一种高产菌体蛋白黑曲霉菌株及其应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于生物技术领域,具体涉及一种高产菌体蛋白黑曲霉菌株,快速高效选育的方法及其应用。
背景技术
单细胞蛋白(Single-cell protein,SCP)又称菌体蛋白,是从微生物中获得的蛋白质。微生物生产的SCP与传统的植物和动物蛋白质相比,单细胞蛋白质的氨基酸成分较为齐全,包含了必需的八种氨基酸,尤其是赖氨酸,还含有多种维生素,碳水化合物、脂肪、矿物质和酶以及生物活性物质。SCP的生产涉及多种微生物,如藻类、细菌、真菌和酵母,黑曲霉与其他微生物相比,具有接受度高、易获取、核酸相对较低等优势,且黑曲霉是公认的食品领域的传统发酵菌株。
诱变筛选作为一种传统的非理性菌种选育技术,主要有物理诱变、化学诱变等,被广泛应用于菌株选育。但具有工作量大,筛选过程复杂等问题。常温常压等离子体(ARTP)诱变育种技术是近年来应用非常广泛的育种手段,同时ARTP诱变育种仪具有对操作者安全、环境友好、操作简便、突变快速、突变率高、获得的突变体性状稳定等特点,目前已成功应用于包括细菌、放线菌、真菌、酵母、微藻等在内的四十余种微生物的诱变育种。
发明内容
基于以上技术问题,本发明提供一株高产菌体蛋白黑曲霉菌株,分类命名为黑曲霉菌株Asperillium niger Q270-C6,保藏于中国典型培养物保藏中心,保藏编号:CCTCCNO:M 20231261,保藏日期:2023年7月10日,保藏地址:湖北省武汉市武昌区八一路珞珈山。
所述的高产菌体蛋白黑曲霉菌株Q270-C6在生产菌体蛋白上的应用。
本发明还提供一种产菌体蛋白的方法,将黑曲霉菌株Q270-C6接种于种子液中进行培养,培养后的产物再接种于发酵培养基中进行培养,得到菌体蛋白。
所述的种子液的组分为;浸母浸粉5-8g/L、蛋白胨2-5g/L、葡萄糖10-30g/L、KH
优选方案中,种子液的组分为;浸母浸粉6g/L、蛋白胨3g/L、葡萄糖20g/L、KH
所述的接种于发酵培养基的接种量为1-5wt%。
所述的发酵培养基组分为葡萄糖20-30g/L、酵母浸粉2.5-4.5g/L、蛋白胨5-7g/L,磷酸氢二钾1.0-2.0g/L,pH为4.0-5.0。
所述的发酵培养基组分为葡萄糖26.65g/L、酵母浸粉3.61g/L、蛋白胨6.65g/L,磷酸氢二钾1.36g/L,pH为5.0。
本发明通过ARTP诱变技术对黑曲霉菌株进行处理,将诱变菌株孢子悬液活化后,接入48孔板进行高通量培养,利用三维样品研磨仪进行破碎,定容后离心取上清液,于96孔板酶标仪进行考马斯亮蓝蛋白含量测定。根据蛋白含量的浓度,筛选出高产菌体蛋白的菌株,为后续的复筛及发酵培养优化提供了优良菌株基础。
本发明的技术方案提供一种高产菌体蛋白菌株,该诱变菌株是以黑曲霉诱变的菌株,该诱变菌株蛋白含量可达41.1%,较出发菌株蛋白含量提高了10.3%,生物量提高了33%。
该诱变菌株包括Asperillium niger Q270C1-C8、Asperillium niger Q300C1-C8。进一步优选耐毒诱变菌株为诱变菌株为Asperillium niger Q270-C6。
本发明的技术方案将ARTP技术结合48孔板高通量培养及三维样品研磨破碎结合酶标仪高通量测定的筛选方法,快速高效的诱变Asperillium niger,诱变菌株蛋白含量可达41.1%,较出发菌株蛋白含量提高了10.3%,生物量提高了33%。通过遗传稳定性实验表明,诱变菌株的生长以及菌体蛋白产量可以保持稳定的遗传特性。由此可见,该诱变方法与高通量筛选简单高效、稳定性好、适用于高产菌体蛋白的菌种改良。
本发明的技术方案将ARTP随机诱变技术结合高通量培养、破碎及检测方法,增大诱变菌株向高产菌体蛋白方向突变的几率,使筛选到优良菌株的概率升高,减少筛选的工作量,为真菌类微生物优势菌株筛选提供了有益的方法。
附图说明
图1为Asperillium niger Q270-C6选育流程图。
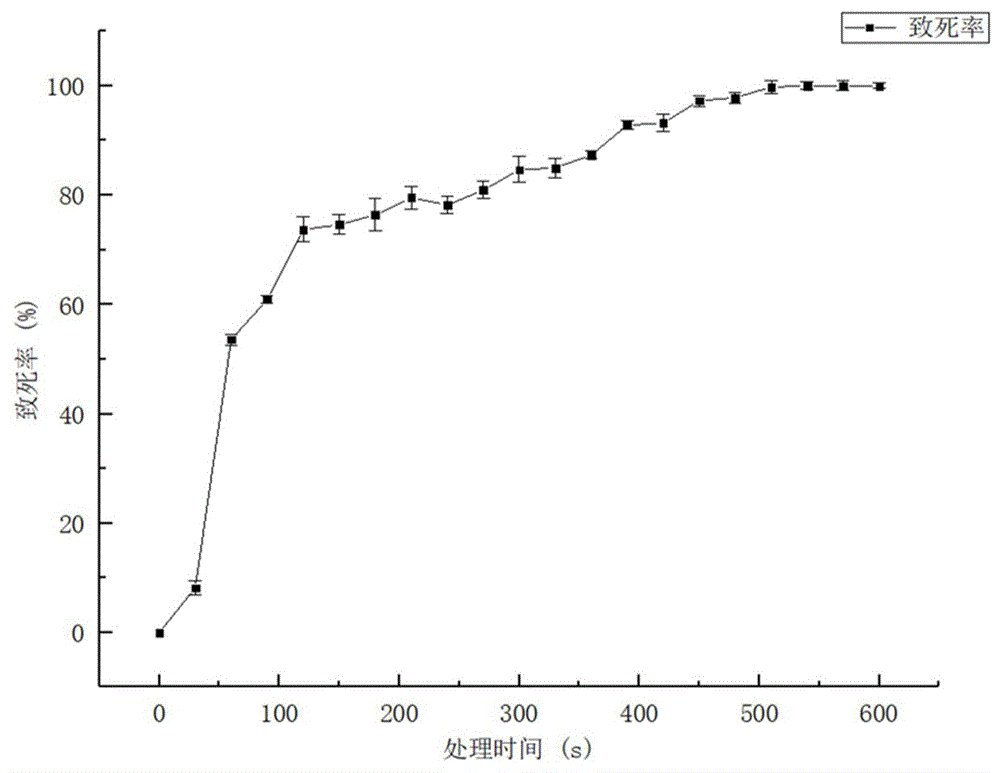
图2为ARTP致死率曲线。
图3为突变菌株的相对蛋白提高率。
图4为菌株Q270-C6的遗传稳定性。
具体实施方式
实施例1
ARTP诱变
将黑曲霉菌种接于PDA斜面培养基上,28℃培养84h,加入10mL灭菌的生理盐水洗脱孢子,过滤菌丝,置于含有玻璃珠的三角瓶中,充分打散,30℃、150r/min培养使孢子萌发,将孢子浓度调整到1×10
加入5%甘油,备用。将ARTP的温度保持在20℃,调节功率为100W,氦气(He)流量为10L/min。吸取10μL孢子悬液均匀涂抹于无菌金属载片上,将载片放入到诱变室内,发射源距离菌液2mm,采用不同的时间(0s、30s、60s、90s、120s、150s、180s、210s、240s、270s、300s,360s)对孢子悬液液进行诱变处理。将经过处理的菌体接入1mL生理盐水中振摇1min,梯度稀释至10
致死率=(未诱变活菌数-诱变活菌数)/未诱变活菌数×100%
诱变功率为100W,氦气(He)流量为10L/min诱变时间分别为0s、30s、60s、90s、120s、150s、180s、210s、240s、270s、300s,360s,在不同诱导时间下,黑曲霉的致死率与时间关系如图2所示。
如图2所示,在诱变功率为100W,氦气(He)流量为10L/min的条件下,诱变时间越长对菌株的致死效应越强,菌体的致死率在前150s急剧上升,150s后致死率相对缓慢上升,当照射时间大于390s之后,黑曲霉致死率大于90%;当照射时间为510-600s,致死率接近100%。
实施例2
高产菌体蛋白黑曲霉菌株的高通量筛选由于诱变产生的突变体多,且仅通过凯氏定氮测定效率很低,所以建立一种高通量的快速筛选方式。利用ARTP在最佳诱变时间下诱变后,将经诱变活化后的种子液在超净台内用4层纱布过滤菌丝,保留发酵液,取10ml发酵液及菌丝球作为种子液,剩余保存于4℃冰箱备用;将种子液按10%接种量接于含有1ml发酵培养基的48深孔板中,同时选择直径较大的菌丝球接种于含有1ml发酵培养基的48深孔板中(接种量1个/孔),其中发酵培养基组分为:葡萄糖26.65g/L、酵母浸粉3.61g/L、蛋白胨6.65g/L,磷酸氢二钾1.36g/L(pH5.0),,28℃培养48h。将菌体转移至2ml研磨管中,用生理盐水洗涤2-3次,弃上清。加入等体积氧化锆珠,再加入1ml去离子水,在M/S:20、研磨次数:4、研磨时间;50s、间隔时间:20s的条件下,进行微量组织研磨破碎,将破碎样品定容至10ml,取5ul样品加入250ulG250染料于96空白中吹打均匀,静置5min后,用酶标仪检测595nm处的吸光值,代入标曲计算蛋白含量。挑取蛋白含量高于对照5%以上的突变菌株复筛,如图3显示了挑取的诱变菌株相对于原始菌株的关系,筛选到的菌株有Q270-C1、Q270-C2、Q270-C3、Q270-C4、Q270-C5、Q270-C6、Q270-C7、Q270-C8、Q300-C1、Q300-C2、Q300-C3、Q300-C4、Q300-C5、Q300-C6、Q300-C7、Q300-C8,上述诱变菌株的蛋白均含量高于原始菌株。选取高产菌株Q270-C6作为复筛的起始菌株,并将其进行生物保藏,即为高产菌体蛋白黑曲霉菌株,分类命名为黑曲霉菌株Asperillium niger Q270-C6,保藏于中国典型培养物保藏中心,保藏编号:CCTCC NO:M 20231261,保藏日期:2023年7月10日,保藏地址:湖北省武汉市武昌区八一路珞珈山,武汉大学。
实施例3
黑曲霉菌株Asperillium niger Q270-C6产蛋白的应用
将原始菌株和筛选诱变菌株(保藏的黑曲霉菌株Asperillium niger Q270-C6,及其他筛选到的菌株)分别接种于种子液(浸母浸粉6g/L、蛋白胨3g/L、葡萄糖20g/L、KH
表1黑曲霉诱变菌株的复筛结果
由表可得,较原始菌株蛋白含量均有一定的提升,其中Q270-C6菌体干重最大可达1.12g/100ml,较原始菌株生物量提高了33%,蛋白含量提高了10.3%由此可见,突变株相比原始菌株具有更高的蛋白产量。
实施例4
遗传稳定性
将诱变菌株黑曲霉菌株Asperillium niger Q270-C6在PDA培养基上连续传代7次,再进行发酵培养48h(发酵培养基组分:葡萄糖26.65g/L、酵母浸粉3.61g/L、蛋白胨6.65g/L,磷酸氢二钾1.36g/L、pH 5.0),烘干至恒重后,通过凯式定氮法测定其蛋白含量,研究其遗传稳定性。
为了检测诱变菌株能否保持稳定的遗传特性,将诱变菌株Q270-C6连续7次传代培养,并同时进行发酵培养,检测菌株的蛋白含量。结果如图4所示,从第1代到第7代菌株的蛋白含量都保持稳定,蛋白含量分别为41.3%、41.0%、40.6%、41.4%、40.5%、40.7%、40.9%。蛋白含量变化幅度均在5%以内,因此Q270-C6菌株产蛋白性能稳定。
- 一种新型黑曲霉菌株及其在普洱茶加工工艺中的应用
- 一种高产菌体蛋白米曲霉菌株及其应用
- 一种低溶氧条件下高产有机酸的黑曲霉基因工程菌株及应用
