基于生姜块茎的组培繁育快繁苗的方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及植物组织培养技术领域,尤其涉及一种基于生姜块茎的组培繁育快繁苗的方法。
背景技术
由于生姜以根状茎作为繁殖材料,繁殖系数低、易通过种姜传播病害而且长期无性繁殖造成种性退化。茎基腐病和姜瘟病是生姜生产中的主要病害,其典型的传播途径是种子传播,严重时导致生姜大范围枯死,可谓是毁灭性的病害。目前针对病原菌进行各种物理以及化学途径防治,效果均不理想,而且对土壤的生态系统及周围环境造成不可弥补的危害,阻碍生态农业的发展。
生姜快繁苗可以解决种姜体内的各种病原菌,为生姜种植提供一种有效的生物防治方法。同时,消除生姜体内的病原菌后,生姜原有的优良性状可以得到恢复,并增强生姜的生长性能,有效提高生姜的生长指标和经济指标。如果移栽后管理得当,生姜快繁苗会具有较好的抗再度感染的能力,进而大大减少各种病害的发生。
现有的生姜组织培养所用的外植体是以茎尖为主,且需要催芽等待生姜芽长到2~3cm的时候才可以取材,大约需要2~3周的时间,该技术需要专业人员借助体视显微镜进行精细取材,操作繁琐、效率低、消毒难彻底、快繁苗污染率高;同时生姜茎尖取材相对较难,茎尖取材过大,容易造成污染,取材过小,成活率降低,不利于大范围推广使用。
发明内容
本发明所要解决的技术问题是提供一种以生姜顶芽周围的块茎为外植体,取材更便捷、不需要借助体视显微镜、省去催芽时间、操作简单、效率高、快繁苗污染率低、繁殖速度快、繁殖量大的基于生姜块茎的组培繁育快繁苗的方法。
为解决上述技术问题,本发明的技术方案是:基于生姜块茎的组培繁育快繁苗的方法,包括如下步骤:
步骤一,选取经过预处理后的生姜顶芽周围的块茎N个,N≥1,块茎的大小为0.2~0.8cm;
步骤二,对经过步骤一处理后的块茎进行清洗消毒处理;
清洗消毒处理包括如下步骤:首先将步骤一中取到的块茎用70%浓度的酒精处理1min,然后用无菌水清洗五遍,再用0.1%的升汞或者5%的次氯酸钠处理10~15 min,然后用无菌水清洗十遍,再去除块茎周围接触消毒剂的部分;
步骤三,将经过步骤二处理后的块茎接种到初代培养基中进行培养,诱导生成愈伤组织;
步骤四,将经过步骤三培养后的愈伤组织转移到丛生芽增殖培养基中继续进行培养,得到丛生芽;
所述丛生芽增殖培养基以Ms为基础培养基,附加0.1~0.2mg/L的KT、0.5~1mg/L的2,4-D、30g/L的蔗糖和4g/L的琼脂;
步骤五,将经过步骤四培养后的丛生芽分割成单株,并转移到生根培养基中,得到快繁苗。
作为优选的技术方案,所述步骤一中,预处理操作是指选取饱满、大块、无虫害的生姜,用自来水冲洗干净,如果是新收获的生姜,需在阴凉处放置15d,再用自来水将表面的泥土冲洗干净,然后装入网袋放在太阳下连晒3~5d,再将生姜进行55℃的恒温处理5min进行催芽,只需确定顶芽的长出位置即可,无需等待姜芽生长到2~3cm,切下顶芽周围0.2~0.8cm以内的生姜块茎N个。
作为优选的技术方案,所述初代培养基以Ms为基础培养基,附加1~2mg/L的6-BA、0.2~0.3 mg/L的NAA、30g/L的蔗糖和4g/L的琼脂,暗培养30d。
作为优选的技术方案,所述步骤四中丛生芽的培养条件为:光照强度4000lx,光照时间16h/d,培养温度25℃,相对湿度保持在60%-80%,培养5~6周。
作为优选的技术方案,所述生根培养基以Ms为基础培养基,附加0.1~0.2mg/L的NAA、30g/L的蔗糖和4g/L的琼脂。
作为优选的技术方案,所述步骤五中快繁苗的培养条件为:培养温度28℃,培养15d。
作为优选的技术方案,将步骤五中得到的快繁苗的根部的培养基清洗干净,移植到体积比蛭石:珍珠岩=1:1的混合基质中,同时添加质量比为氮:磷:钾=1:1:1的缓释肥,适当灌溉,培养一个月后移栽到田地种植。
作为优选的技术方案,快繁苗在混合基质中通过微润的方式进行灌溉,保持混合基质的湿润度。
由于采用了上述技术方案,本发明的有益效果是:本发明从生姜顶芽周围的块茎取材,操作简便,不需要借助体视显微镜,不需要等到姜芽长到2~3cm,只需确定顶芽的位置即可,大大节约了前期催芽的时间,省略了催芽和取芽的繁琐工序,对操作人员的专业技术要求低,与茎尖取材相比,取材过程更简便,节约时间,每斤姜种在相同时间内获得的快繁苗数量至少是茎尖取材的三倍。
附图说明
以下附图仅旨在于对本发明做示意性说明和解释,并不限定本发明的范围。其中:
图1是本发明步骤一的块茎取材图片;
图2是本发明步骤三愈伤组织生成的图片;
图3是本发明步骤四丛生芽生成的图片;
图4是本发明步骤五快繁苗生成的图片;
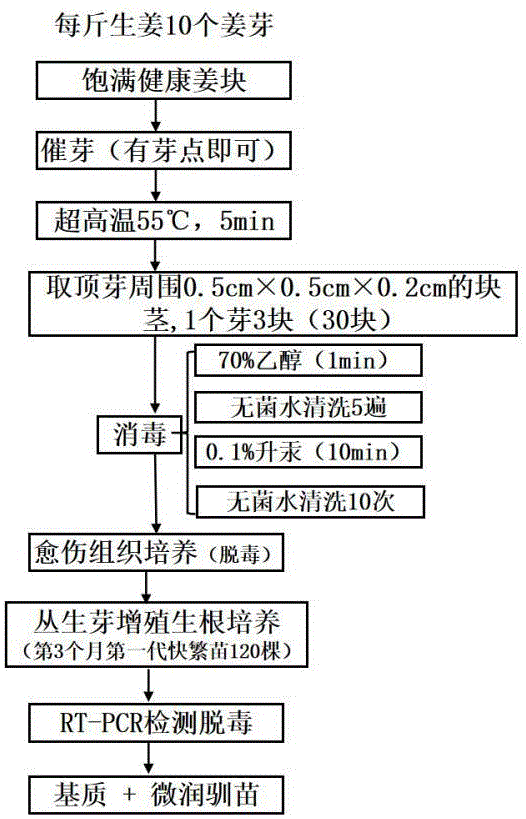
图5是本发明实施例五的培育流程图。
具体实施方式
下面结合附图和实施例,进一步阐述本发明。在下面的详细描述中,只通过说明的方式描述了本发明的某些示范性实施例。毋庸置疑,本领域的普通技术人员可以认识到,在不偏离本发明的精神和范围的情况下,可以用各种不同的方式对所描述的实施例进行修正。因此,附图和描述在本质上是说明性的,而不是用于限制权利要求的保护范围。
实施例一,生姜顶芽周围块茎取材大小的选择:
基于生姜块茎的组培繁育快繁苗的方法,包括如下步骤:
步骤一,选取经过预处理后的生姜顶芽周围的块茎20个,每个顶芽周围优选取3个,可取多个顶芽周围的块茎,共计20个;
步骤二,对经过步骤一处理后的块茎进行清洗消毒处理;
步骤三,将经过步骤二处理后的块茎接种到初代培养基中进行培养,诱导生成愈伤组织;
步骤四,将经过步骤三培养后的愈伤组织转移到丛生芽增殖培养基中继续进行培养,得到丛生芽;
步骤五,将经过步骤四培养后的丛生芽分割成单株,并转移到生根培养基中,得到快繁苗。
所述步骤一中,预处理操作是指选取饱满、大块、无虫害的生姜,用自来水冲洗干净,如果是新收获的生姜,需在阴凉处放置15d,再用自来水将表面的泥土冲洗干净,然后装入网袋放在太阳下连晒3~5d,再将生姜进行55℃的恒温处理5min进行催芽,只需确定顶芽的长出位置即可,无需等待姜芽生长到2~3cm,切下顶芽周围0.5~1.5cm以内的生姜块茎20个。
所述步骤二中,清洗消毒处理包括如下步骤,首先将步骤一中取到的块茎用70%浓度的酒精处理1 min,然后用无菌水清洗五遍,再用0.1%的升汞处理10 min,然后用无菌水清洗十遍,再去除块茎周围接触消毒剂的部分。
所述初代培养基以Ms为基础培养基,附加1mg/L的6-BA、0.2mg/L的NAA 、30g/L的蔗糖和4g/L的琼脂,暗培养30 d。
所述丛生芽增殖培养基以Ms为基础培养基,附加0.2mg/L的KT、1mg/L的2,4-D、30g/L的蔗糖和4g/L的琼脂。
生姜顶芽周围块茎取材大小对愈伤组织诱导率的影响见表1。
表1 生姜顶芽周围块茎大小对愈伤组织诱导率的影响
其中,
取材编号M1的块茎大小(长×宽×高)为:1.5 cm×1.5cm×0.5cm;
取材编号M2的块茎大小(长×宽×高)为:1cm×1cm×0.5cm;
取材编号M3的块茎大小(长×宽×高)为:0.8cm×0.8cm×0.5cm;
取材编号M4的块茎大小(长×宽×高)为:0.5cm×0.5cm×0.2cm;
由表1可知,取材编号为M4的块茎大小在同样的培养条件下,愈伤组织诱导率最高,由此可见,切下顶芽周围0.5cm×0.5cm×0.2cm大小的生姜块茎作为外植体,为最优选的技术方案,愈伤组织诱导率可达70%。
实施例二,消毒方式的选择:
基于生姜块茎的组培繁育快繁苗的方法,包括如下步骤:
步骤一,选取经过预处理后的生姜顶芽周围的块茎20个,每个顶芽周围优选取3个,可取多个顶芽周围的块茎,共计20个;
步骤二,对经过步骤一处理后的块茎进行清洗消毒处理;
步骤三,将经过步骤二处理后的块茎接种到初代培养基中进行培养,诱导生成愈伤组织;
步骤四,将经过步骤三培养后的愈伤组织转移到丛生芽增殖培养基中继续进行培养,得到丛生芽;
步骤五,将经过步骤四培养后的丛生芽分割成单株,并转移到生根培养基中,得到快繁苗。
所述步骤一中,预处理操作是指选取饱满、大块、无虫害的生姜,用自来水冲洗干净,如果是新收获的生姜,需在阴凉处放置15d,再用自来水将表面的泥土冲洗干净,然后装入网袋放在太阳下连晒3~5d,再将生姜进行55 ℃的恒温处理5min进行催芽,只需确定顶芽的长出位置即可,无需等待姜芽生长到2~3cm,切下顶芽周围0.5cm×0.5cm×0.2cm大小的生姜块茎20个。
所述步骤二中,清洗消毒处理包括如下步骤,首先将步骤一中取到的块茎用70%浓度的酒精处理1 min,然后用无菌水清洗五遍,再用0.1%的升汞或5%的次氯酸钠处理10~20min,然后用无菌水清洗十遍,再去除块茎周围接触消毒剂的部分。
所述初代培养基以Ms为基础培养基,附加1mg/L的6-BA 、0.2mg/L的NAA 、30g/L的蔗糖和4g/L的琼脂,暗培养30d。
所述丛生芽增殖培养基以Ms为基础培养基,附加0.2mg/L的KT、1mg/L的2,4-D、30g/L的蔗糖和4g/L的琼脂。
不同消毒方式对愈伤组织的成活率影响见表2。
表2 不同消毒方式对愈伤组织的成活率影响
其中,
消毒编号D1~D4的消毒方式分别为:
D1:70%浓度的酒精处理1 min+0.1%的升汞处理10 min;
D2:70%浓度的酒精处理1 min+0.1%的升汞处理15 min;
D3:70%浓度的酒精处理1 min+0.1%的升汞处理20 min;
D4:70%浓度的酒精处理1 min+5%的次氯酸钠10 min;
由表2可知,消毒编号为D1的消毒方式在同样的培养条件下,愈伤组织成活率最高,由此可见,对块茎用70%浓度的酒精处理1min,然后用无菌水清洗五遍,再用0.1%的升汞处理10 min,然后用无菌水清洗十遍,再去除块茎周围接触消毒剂的部分,这种消毒方式是最优选的技术方案,由此消毒方式处理过后的愈伤组织成活率最高,可达90%。
实施例三,不同激素配比对生姜块茎愈伤组织形成的影响:
基于生姜块茎的组培繁育快繁苗的方法,包括如下步骤:
步骤一,选取经过预处理后的生姜顶芽周围的块茎20个,每个顶芽周围优选取3个,可取多个顶芽周围的块茎,共计20个;
步骤二,对经过步骤一处理后的块茎进行清洗消毒处理;
步骤三,将经过步骤二处理后的块茎接种到初代培养基中进行培养,诱导生成愈伤组织;
步骤四,将经过步骤三培养后的愈伤组织转移到丛生芽增殖培养基中继续进行培养,得到丛生芽;
步骤五,将经过步骤四培养后的丛生芽分割成单株,并转移到生根培养基中,得到快繁苗。
所述步骤一中,预处理操作是指选取饱满、大块、无虫害的生姜,用自来水冲洗干净,如果是新收获的生姜,需在阴凉处放置15d,再用自来水将表面的泥土冲洗干净,然后装入网袋放在太阳下连晒3~5d,再将生姜进行55℃的恒温处理5min进行催芽,只需确定顶芽的长出位置即可,无需等待姜芽生长到2~3cm,切下顶芽周围0.5cm×0.5cm×0.2cm大小的生姜块茎20个。
所述步骤二中,清洗消毒处理包括如下步骤,首先将步骤一中取到的块茎用70%浓度的酒精处理1 min,然后用无菌水清洗五遍,再用0.1%的升汞处理10 min,然后用无菌水清洗十遍,再去除块茎周围接触消毒剂的部分。
所述初代培养基其中一组以Ms为基础培养基,附加1~2mg/L的6-BA、0.2~0.3mg/L的NAA 、30g/L的蔗糖和4g/L的琼脂,暗培养30d。另外几组配比详见下表3。
所述丛生芽增殖培养基以Ms为基础培养基,附加0.2mg/L的KT、1mg/L的2,4-D、30g/L的蔗糖和4g/L的琼脂。
不同激素配比对生姜块茎愈伤组织诱导率的影响见表3。
表3 不同激素配比对生姜块茎愈伤组织诱导率的影响
其中,
初代培养基编号C1~C8的激素配比分别为:
C1:MS+0.2mg/L的KT+1.0 mg/L的2,4-D +30g/L的蔗糖+4g/L的琼脂;
C2:MS+1.0mg/L的6-BA +2.0 mg/L的2,4-D+30g/L的蔗糖+4g/L的琼脂;
C3:1/2MS+1.0mg/L的6-BA+1.0mg/L的2,4-D+30g/L的蔗糖+4g/L的琼脂;
C4:MS+0.2mg/L的2,4-D+30g/L的蔗糖+4g/L的琼脂;
C5:MS+0.2mg/L的6-BA+1.0 mg/L的NAA+30g/L的蔗糖+4g/L的琼脂;
C6:MS+1.0mg/L的6-BA+0.2 mg/L的NAA+30g/L的蔗糖+4g/L的琼脂;
C7:MS+2.0mg/L的6-BA+0.5 mg/L的NAA+30g/L的蔗糖+4g/L的琼脂;
C8:MS+0.5mg/L的NAA+30g/L的蔗糖+4g/L的琼脂;
由表3可知,初代培养基编号为C6的激素配比在同样的培养条件下,愈伤组织诱导率最高,由此可见,初代培养基以Ms为基础培养基,附加1mg/L的6-BA、0.2mg/L的NAA、30g/L的蔗糖和4g/L的琼脂,采用这种初代培养基是最优选的技术方案,愈伤组织诱导率最高,可达70%。
实施例四, 不同激素配比对生姜块茎诱导生成丛生芽的影响:
基于生姜块茎的组培繁育快繁苗的方法,包括如下步骤:
步骤一,选取经过预处理后的生姜顶芽周围的块茎20个,每个顶芽周围优选取3个,可取多个顶芽周围的块茎,共计20个;
步骤二,对经过步骤一处理后的块茎进行清洗消毒处理;
步骤三,将经过步骤二处理后的块茎接种到初代培养基中进行培养,诱导生成愈伤组织;
步骤四,将经过步骤三培养后的愈伤组织转移到丛生芽增殖培养基中继续进行培养,得到丛生芽;
步骤五,将经过步骤四培养后的丛生芽分割成单株,并转移到生根培养基中,得到快繁苗。
所述步骤一中,预处理操作是指选取饱满、大块、无虫害的生姜,用自来水冲洗干净,如果是新收获的生姜,需在阴凉处放置15d,再用自来水将表面的泥土冲洗干净,然后装入网袋放在太阳下连晒3~5d,再将生姜进行55 ℃的恒温处理5min进行催芽,只需确定顶芽的长出位置即可,无需等待姜芽生长到2~3cm,切下顶芽周围0.5cm×0.5cm×0.2cm大小的生姜块茎20个。
所述步骤二中,清洗消毒处理包括如下步骤,首先将步骤一中取到的块茎用70%浓度的酒精处理1 min,然后用无菌水清洗五遍,再用0.1%的升汞处理10 min,然后用无菌水清洗十遍,再去除块茎周围接触消毒剂的部分。
所述初代培养基以Ms为基础培养基,附加1mg/L的6-BA 、0.2mg/L的NAA 、30g/L的蔗糖和4g/L的琼脂,暗培养30 d。
所述丛生芽增殖培养基的其中一组以Ms为基础培养基,附加0.1~0.2mg/L的KT、0.5~1mg/L的2,4-D、30g/L的蔗糖和4g/L的琼脂;另外两个对比组的组份和配比见下表4。
所述步骤四中丛生芽的培养条件为:光照强度4000 lx,光照时间16 h/d,培养温度25℃,相对湿度保持在60%-80%,培养5~6周。不同激素配比对生姜块茎诱导生成丛生芽的影响见表4。
表4 不同激素配比对生姜块茎诱导生成丛生芽的影响
其中,
丛生芽增殖培养基编号S1~S3的激素配比分别为:
S1:MS+2 mg/L的6-BA +0.5 mg/L的NAA+30g/L的蔗糖+4g/L的琼脂;
S2:MS+0.5 mg/L的6-BA+1 mg/L的IAA +30g/L的蔗糖+4g/L的琼脂;
S3:MS+0.2 mg/L的KT+1 mg/L的2,4-D+30g/L的蔗糖+4g/L的琼脂;
由表4可知,丛生芽增殖培养基编号为S3的激素配比在同样的培养条件下,成芽率最高,由此可见,丛生芽增殖培养基以Ms为基础培养基,附加0.2 mg/L的KT、1 mg/L的2,4-D、30g/L的蔗糖和4g/L的琼脂,采用这种丛生芽增殖培养基是最优选的技术方案,成芽率最高,可达75%。
实施例五,如图1至图5所示,最优技术方案:
基于生姜块茎的组培繁育快繁苗的方法,包括如下步骤:
步骤一,选取经过预处理后的生姜顶芽周围的块茎30个,每个顶芽周围优选取3个,可取多个顶芽周围的块茎,共计30个;如图1所示是其中一个顶芽周围选取的3个块茎。
步骤二,对经过步骤一处理后的块茎进行清洗消毒处理;
步骤三,将经过步骤二处理后的块茎接种到初代培养基中进行培养,诱导生成愈伤组织;见图2;
步骤四,将经过步骤三培养后的愈伤组织转移到丛生芽增殖培养基中继续进行培养,得到丛生芽;见图3;
步骤五,将经过步骤四培养后的丛生芽分割成单株,并转移到生根培养基中,得到快繁苗。见图4。
所述步骤一中,预处理操作是指选取饱满、大块、无虫害的生姜,用自来水冲洗干净,如果是新收获的生姜,需在阴凉处放置15d,再用自来水将表面的泥土冲洗干净,然后装入网袋放在太阳下连晒3~5d,再将生姜进行55℃的恒温处理5min进行催芽,只需确定顶芽的长出位置即可,无需等待姜芽生长到2~3cm,切下顶芽周围0.5cm×0.5cm×0.2cm大小的生姜块茎3个,共计取样30个。
所述步骤二中,清洗消毒处理包括如下步骤,首先将步骤一中取到的块茎用70%浓度的酒精处理1 min,然后用无菌水清洗五遍,再用0.1%的升汞处理10 min,然后用无菌水清洗十遍,再去除块茎周围接触消毒剂的部分。
所述初代培养基以Ms为基础培养基,附加1mg/L的6-BA、0.2mg/L的NAA 、30g/L的蔗糖和4g/L的琼脂,暗培养30 d。
所述丛生芽增殖培养基以Ms为基础培养基,附加0.2mg/L的KT、1mg/L的2,4-D、30g/L的蔗糖和4g/L的琼脂。
所述步骤四中丛生芽的培养条件为:光照强度4000lx,光照时间16 h/d,培养温度25℃,相对湿度保持在60%-80%,培养5~6周。
所述生根培养基以Ms为基础培养基,附加0.1~0.2mg/L的NAA、30g/L的蔗糖和4g/L的琼脂。
所述步骤五中快繁苗的培养条件为:培养温度28℃,培养15d。
将步骤五中得到的快繁苗的根部的培养基清洗干净,移植到体积比蛭石:珍珠岩=1:1的混合基质中,同时添加质量比为氮:磷:钾=1:1:1的缓释肥,适当灌溉,培养一个月后移栽到田地种植。
快繁苗在混合基质中通过微润的方式进行灌溉,保持混合基质的湿润度。取代现有技术中针对快繁苗驯苗阶段采用滴灌这种“蓄水于土”的间歇式灌溉方式,本发明采用微润的方式进行灌溉,其用水量约为滴灌的40%~50%,提高了水分的有效利用率,解决了现有技术中喷灌方式因基质蒸发和基质渗漏造成水分损失问题。
本发明具有以下优点:
(1)取材简便快捷,无需等待姜芽长到2~3cm,无需借助体视显微镜,对操作人员的专业技术要求低,与茎尖取材相比,取材过程更简便,更加节约时间。
(2)每斤姜种在相同时间内获得的快繁苗数量至少是茎尖取材的3倍,由于原来每个姜芽仅获得一个愈伤组织,现在每个姜芽处至少可以取三个以上的块茎,每个块茎都会得到一个愈伤组织,因此每斤姜种在相同时间内获得的快繁苗数量至少是茎尖取材的3倍,大大增加了繁殖率。
(3)采用微润灌溉,节约用水,提高水分的有效利用率,其用水量约为滴灌的40%~50%。
如图1所示为本发明实施例五的块茎取材图片;如图2所示为本发明实施例五愈伤组织生成的图片;如图3所示为本发明本实施例五丛生芽生成的图片;如图4所示为本发明本实施例五快繁苗生成的图片;如图5所示为本发明实施例五的培育流程图。
以上只通过说明的方式描述了本发明的某些示范性实施例,毋庸置疑,对于本领域的普通技术人员,在不偏离本发明的精神和范围的情况下,可以用各种不同的方式对所描述的实施例进行修正。因此,上述附图和描述在本质上是说明性的,不应理解为对本发明权利要求保护范围的限制。
- 一种定植用马铃薯组培苗快繁液体培养基和马铃薯脱毒微型薯定植用组培苗快繁方法
- 鹅不食草组培快繁培养基及一次成苗组培快繁方法
