一种免疫细胞及其表达载体、应用和制备方法
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及免疫细胞技术领域,特别涉及一种免疫细胞及其表达载体、应用和制备方法。
背景技术
基于嵌合抗原受体(chimeric antigen receptor,CAR)基因修饰的T细胞(CAR-T)治疗,是通过将外源性人工设计的能识别肿瘤细胞表面抗原的CAR基因导入T细胞进行基因修饰改造,得到表达CAR的T细胞,体外规模化扩增后回输给患者进行治疗的方法。CAR分子主要包括三部分:胞外肿瘤抗原结合区、跨膜区和胞内信号区。胞外抗原结合区通常来源于抗肿瘤细胞表面抗原的单链抗体;胞内信号区以T细胞受体(TCR)的CD3ζ链和共刺激分子CD28、4-1BB的胞内信号转导结构域为主。当CAR-T细胞上的CAR与肿瘤细胞表面的抗原特异性结合后,通过胞内结构域转导活化信号激活T细胞,从而发挥T细胞杀伤作用和抗肿瘤效应。目前在血液肿瘤的临床治疗或绝大多数临床试验中,以包含共刺激分子CD28或4-1BB的胞内信号转导结构域的第二代CAR-T细胞治疗技术为主。
针对目前CAR-T细胞治疗整体有效率不高、以及高复发率等问题,对CAR-T细胞技术进行了大量研究和开发。CAR-T细胞与机体内源性T细胞一样,受抗原刺激后也上调免疫检查点PD-1的表达。CAR-T表面的PD-1与肿瘤细胞或组织表达的PD-L1结合,会抑制CAR-T细胞的抗肿瘤功能。因此,提高CAR-T细胞功能的一个研发策略就是抑制或消除CAR-T细胞内在的PD-1信号。例如:通过表达靶向PD-1的shRNAs抑制CAR-T细胞上PD-1表达。利用CRISPR/Cas9技术制备PD-1缺陷的CD19CAR-T细胞,已进入临床试验阶段。Cherkassky等构建了一个由PD-1胞外区和CD8分子的跨膜区组成的显性负调控受体(DNR,dominant negativereceptor),共转PD-1DNR的CD19CAR-T细胞增加了T细胞的体外和体内抗肿瘤作用。用PD-1胞外区和CD28分子的跨膜区和胞内连接构建成PD-1/CD28嵌合转换受体,转染CAR-T细胞可将PD-1抑制信号变成CD28活化信号。还有在二代CAR-T的结构基础上再加上一段能分泌抗PD-L1、或PD-1单链抗体的基因序列,使CAR-T细胞在与肿瘤细胞接触过程中不仅能杀灭肿瘤细胞,并且局部分泌的单链抗体能阻断PD-1与PD-L1结合,提高CAR-T细胞对肿瘤细胞的杀伤活性。肿瘤微环境是一个由众多免疫抑制信号或机制组成的复杂免疫抑制网络,上述这些策略仅仅是阻断或消除了CAR-T细胞的PD-1抑制信号,不能显著提高CAR-T细胞的效应功能。
还有策略是通过增强机体先天和适应性免疫来提高CAR-T抗肿瘤效应,包括:通过CAR-T细胞表达免疫刺激剂RN7SL1,免疫刺激分子IL-12、IL-18、CD40L和趋化因子等,向肿瘤组织递送这些免疫刺激分子,重塑肿瘤微环境,增强CAR-T细胞的治疗效果。还有为增加CAR-T细胞在体内的增殖和持续性,构建组成性共表达IL-2、IL-7、IL-15或IL-21的CAR-T细胞。这些CAR-T细胞产生的免疫刺激剂、细胞因子或趋化因子,会通过血液循环作用于全身,会导致严重副作用,因此,这些CAR-T细胞均停留在早期研发阶段,未进入临床试验。
以CD19和BCMACAR-T细胞为代表的免疫细胞疗法治疗血液肿瘤目前已有6款产品在美国上市,2款在中国国内上市,分别用于B淋巴细胞白血病和淋巴瘤、以及多发性骨髓瘤的治疗。但是,CAR-T细胞治疗技术目前还存在诸多问题,例如:
(1)CAR-T细胞治疗的整体有效率有待提高
已上市的CD19CAR-T细胞治疗急性B淋巴细胞白血病的完全缓解率达到80%以上,但是治疗B细胞淋巴瘤的完全缓解率在60%左右,而且对大的(直径大于7cm)淋巴瘤治疗效果更差,对其它的CD19阳性B细胞肿瘤治疗效果还不理想。BCMACAR-T细胞治疗多发性骨髓瘤的完全缓解率在60-80%。所有CAR-T细胞治疗对脑部肿瘤治疗效果很差,因此,肿瘤脑部侵犯的患者往往被排除CAR-T细胞治疗。
实体瘤CAR-T细胞治疗均处在早期研发阶段,治疗效果很不理想。一个主要原因是因为肿瘤细胞高度异质性,肿瘤靶点分子在肿瘤细胞上的表达高低不一致,甚至有些肿瘤不表达,CAR-T细胞治疗又会导致肿瘤细胞上靶点分子表达进一步下调或缺失,导致肿瘤细胞逃逸CAR-T细胞的识别。还有就是实体瘤的免疫抑制微环境,抑制了进入瘤体的CAR-T细胞的功能,也不利于CAR-T细胞的有效扩增。
(2)已上市的CAR-T细胞治疗肿瘤复发率高
虽然已上市的CD19和BCMACAR-T细胞治疗急性B淋巴细胞白血病和多发性骨髓瘤均取得很高的缓解率,但是,近一半治疗缓解的患者在1-2年内复发。肿瘤靶抗原丢失或下调、CAR-T细胞本身扩增持续不足或不能在体内长期存在是CAR-T细胞治疗后复发的原因。在CD19CAR-T细胞治疗患者中,儿童和青年B-ALL复发患者,大约50%是由于CD19丢失;淋巴瘤复发患者中,大约30%也是CD19丢失,另有30%患者是CD19表达降低。抗原阴性肿瘤复发的主要机制是抗原丢失,即使抗原未完全丢失,通过免疫调节使抗原表达减少或密度降低也足以使肿瘤细胞逃逸。肿瘤抗原阳性复发的主要原因是CAR-T细胞不能在体内存续存在导致的。
综上,现有技术中缺少成熟的CAR-T细胞治疗技术,肿瘤治疗效果不好,容易导致肿瘤复发。
发明内容
本发明的目的在于提供一种免疫细胞及其表达载体、应用和制备方法,用于解决上述至少一个技术问题,本发明的免疫细胞能够表达和分泌PD-1单链抗体和IL-21融合蛋白,显著增强免疫细胞的抗肿瘤作用和机体内在的抗肿瘤T细胞的反应。
本发明的实施例是这样实现的:
一种免疫细胞,其能够表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21。
在本发明较佳的实施例中,上述免疫细胞的所述免疫细胞特异性识别血液恶性肿瘤、肺癌、乳腺癌、肝癌、胰腺癌、肾癌、前列腺癌、卵巢癌、消化道肿瘤、脑肿瘤、神经内分泌肿瘤、骨肿瘤、软组织肿瘤中的至少一种。
在本发明较佳的实施例中,上述免疫细胞的所述免疫细胞选自CAR-T细胞、TCR-T细胞、CAR-NK细胞、TIL细胞中的至少一种。
在本发明较佳的实施例中,上述免疫细胞的所述免疫细胞除了发挥自身抗肿瘤作用的同时,能增强机体内在的抗肿瘤免疫反应。
一种病毒载体,能够表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21。
在本发明较佳的实施例中,上述病毒载体的所述病毒表达载体感染细胞后,使细胞分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21。
一种免疫细胞表达载体,其包括靶向特定抗原的表达质粒、P2A序列片段、表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的编码序列片段;
可选的,还包括His标签;
所述靶向特定抗原的表达质粒包括胞外域、跨膜域和胞内域;
所述胞外域包括CD8α信号肽片段、特异性抗体片段和CD8α铰链区片段;
所述跨膜域包括CD8α跨膜区片段;
所述胞内域包括4-1BB信号转导结构域片段和CD3ζ信号转导结构域片段。
在本发明较佳的实施例中,上述免疫细胞表达载体中所述表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的编码序列片段的cDNA序列如SEQ ID No.1所示。
在本发明较佳的实施例中,上述免疫细胞表达载体中所述特异性抗体片段包括靶向CD19的特异性单链抗体片段,和/或靶向BCMA的特异性单链抗体片段,和/或靶向Her2/neu肿瘤抗原的特异性抗体片段,和/或靶向其它肿瘤抗原的特异性抗体片段。
一种免疫细胞在治疗B细胞白血病、B细胞淋巴瘤、骨髓瘤瘤、Her2/neu+乳腺癌、晚期B细胞恶性肿瘤中的应用,所述免疫细胞为如前所述的免疫细胞。
一种免疫细胞的制备方法,其包括:
构建PD-1单链抗体和IL-21融合蛋白PD-1Ab21的编码基因;
构建表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的免疫细胞表达载体;
对所述免疫细胞表达载体进行病毒包装,得到病毒颗粒;
通过所述病毒颗粒制备得到免疫细胞。
在本发明较佳的实施例中,上述免疫细胞的制备方法中,所述构建PD-1单链抗体和IL-21的融合蛋白PD-1Ab21的编码基因包括:
选用人源化PD-1抗体,将重链可变区与轻链可变区通过连接子Linker连接在一起后,得到靶向特异性细胞的PD-1单链抗体;
将所述靶向特异性细胞的PD-1单链抗体与IL-21细胞因子融合蛋白的cDNA序列通过连接子Linker连接并进行DNA片段合成,得到PD-1单链抗体和IL-21的融合蛋白PD-1Ab21的编码基因。
在本发明较佳的实施例中,上述免疫细胞的制备方法中,所述构建表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的免疫细胞表达载体包括:
使用慢病毒载体pCDH构建靶向特定抗原的表达质粒,所述靶向特定抗原的表达质粒包括胞外域、跨膜域和胞内域;
所述胞外域包括CD8α信号肽片段、特异性抗体片段和CD8α铰链区片段;
所述特异性抗体片段包括靶向CD19的特异性单链抗体片段,和/或靶向BCMA的特异性单链抗体片段,和/或靶向Her2/neu肿瘤抗原的特异性抗体片段,和/或靶向其它肿瘤抗原的特异性抗体片段;
所述跨膜域包括CD8α跨膜区片段;
所述胞内域包括4-1BB信号转导结构域片段和CD3ζ信号转导结构域片段;将表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的编码序列片段通过P2A序列片段连接到所述靶向特定抗原的表达质粒的编码片段的后面;
在整个序列的C端连接His标签,得到构建表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的免疫细胞表达载体。
在本发明较佳的实施例中,上述免疫细胞的制备方法中,所述对所述免疫细胞表达载体进行病毒包装,得到病毒颗粒包括:
使用磷酸钙转染法进行病毒包装;
转染前16-20小时,选择293T细胞传代,每个细胞培养皿中接种4×10
接种20-24h后,观察293T细胞的传代情况,当293T细胞达到50%覆盖率时,进行转染;
所述转染的方法包括:配制转染试剂,所述转染试剂包括A液和B液,所述A液中包括质粒25μg,2.5molCaCl250μl,ddH2OUpto500μl,所述B液中包括2×HEPES盐缓冲液500μl,所述A液配制后静置3min,将所述A液加入所述B液中,同时用电动移液器向试剂管内打气泡,使所述A液和所述B液混匀,试剂管内溶液产生白色浑浊,制得所述转染试剂,将1ml所述转染试剂加入到293T细胞的培养皿中,轻轻摇匀,放入37℃培养箱中培养,进行转染;
转染12-16h后,进行换液,弃去培养上清,加入15ml含10%FBS的DMEM培养基;
换液后经过48小时,通过0.45μm滤器过滤,收取48h培养上清,补充10ml含10%FBS的DMEM培养基,在4℃下保存;
保存24小时后,通过0.45μm滤器过滤,收取72h培养上清;
将所述48h培养上清和所述72h培养上清均通过浓缩泵浓缩50倍,然后通过0.22μm滤器过滤,收取过滤后的病毒浓缩液,分装到1.5mlEP管中,在-80℃条件下保存,得到病毒颗粒。
在本发明较佳的实施例中,上述免疫细胞的制备方法中,所述通过所述病毒颗粒制备得到免疫细胞包括:
取出所述病毒颗粒,重新得到病毒浓缩液;
取人抗凝外周血,用等体积PBS稀释,用人淋巴细胞分离液分离稀释后的人抗凝外周血,采集外周血单个核细胞PBMC;
将外周血单个核细胞PBMC中的T细胞浓度调整至1x10
T细胞进入激活状态24h后,将T细胞以5x10
感染6小时后,补充加入新鲜的感染培养基1ml;
继续感染48小时,弃去培养上清,更换新鲜的感染培养基;
继续感染使T细胞扩增6-8天后,得到免疫细胞。
本发明实施例的有益效果是:
本发明的免疫细胞,能够表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21,除了发挥普通免疫细胞的抗肿瘤作用外,还可分泌PD-1Ab21融合蛋白。分泌的PD-1Ab21融合蛋白可阻断CAR-T上的PD-1抑制信号,同时将IL-21靶向免疫细胞,促进免疫细胞的增殖,可显著增强免疫细胞的抗肿瘤效应。本发明的免疫细胞在识别和杀伤肿瘤细胞时,分泌PD-1Ab21,除了显著增强免疫细胞抗肿瘤作用外,还能靶向患者体内PD-1+的抗肿瘤CD8
由于细胞因子作用的靶细胞众多,全身应用具有巨大副作用,极大限制了细胞因子在疾病治疗中的应用。PD-1Ab21-CAR-T细胞(PD-1Ab21-TCR-T细胞、PD-1Ab21-CAR-NK细胞、PD-1Ab21-TIL细胞)分泌的PD-1Ab21融合蛋白,可以在体内靶向作用于PD-1+的抗肿瘤T细胞,减少了作用于其它细胞的机会,极大降低了细胞因子IL-21的全身副作用。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明免疫细胞表达载体中PD-1Ab21-CAR-T细胞表达载体的构建结构示意图;
图2为本发明PD-1Ab21-CD19CAR-T细胞的制备及分泌的PD-1Ab21融合蛋白的功能鉴定示意图;
图2a为制备的PD-1Ab21-CD19CAR-T细胞中CAR
图2b为PD-1Ab21-CD19CAR-T细胞培养上清中PD-1Ab21融合蛋白与表达PD-1的CHO(CHO-PD-1)细胞的结合示意图。将2×10
图2c为PD-1Ab21-CD19CAR-T细胞培养上清中PD-1Ab21融合蛋白对CHO-PD1细胞表面PD-1分子的阻断作用示意图。将2×10
图2d为PD-1Ab21-CD19CAR-T细胞培养上清中PD-1Ab21融合蛋白对IL-21R的激活作用示意图。将Baf3细胞以5×10
图3为本发明PD-1Ab21-CD19CAR-T和CD19CAR-T细胞体外培养增殖能力和分化表型的比较示意图;
图3a为将制备的CD19CAR-T或PD-1Ab21-CD19CAR-T细胞分别在体外有100U/ml(左图)或10U/ml(右图)IL-2的条件下培养11天,每天进行计数统计CD19CAR-T,PD-1Ab21-CD19CAR-T细胞的增殖倍数,绘制细胞增殖曲线;
图3b为收集培养到第14天的CD19CAR-T和PD-1Ab21-CD19CART细胞,流式细胞分析CAR-T细胞的表型(CD45RA和CCR7);
图3c为将CD19CAR-T和PD-1Ab21-CD19CART细胞在10U/ml IL-2条件下培养,在一定时间取培养的CAR-T细胞进行染色,流式细胞分析CD4
图3d为取培养14天的CAR-T细胞进行染色,流式细胞分析CD4
图4为本发明PD-1Ab21-CD19CAR-T细胞的体外杀伤功能检测示意图;
图4a为将CD19CAR-T和PD-1Ab21-CD19CAR-T细胞在体外100U/ml IL-2条件下培养到第五天,然后取一定数量的CAR-T细胞,按照如图所示E(CAR-T):M(Daudi-PDL1)比分别与Daudi-PDL1混合共培养24h,用流式细胞检测CAR-T细胞的杀伤能力;
图4b为体外IL-2 100U/ml培养到第五天的CAR-T按照如图所示的E(CAR-T):M(Daudi-PDL1)比,共培养8天,检测CD19CAR-T和PD-1Ab21-CD19CAR-T持续杀伤能力;
图4c为CAR-T细胞持续杀伤过程中T细胞总数和CD8/CD4比例的变化。在上述图4b的杀伤实验中,在不同时间点取细胞计数,并流式细胞分析CD3+,CD4
图5为本发明PD-1Ab21-CD19CAR-T细胞的体外增殖和细胞因子分泌能力检测示意图;
图5a为在体外IL-2 100U/ml培养到第五天的CAR-T按照E(CAR-T):M(Daudi-PDL1)比=1:5,共培养48小时检测CD19CAR-T和PD-1Ab21-CD19CAR-T细胞Ki-67的表达;
图5b为图5a培养条件下通过流式细胞术(B)检测CD19CAR-T和PD-1Ab21-CD19CAR-T细胞IL-2和IFN-γ的分泌表达情况;
图5c为图5a的条件下通过ELISA(C)检测CD19CAR-T和PD-1Ab21-CD19CAR-T细胞培养上清中分泌的IL-2和IFN-γ的水平;
图6为本发明PD-1Ab21-CD19CAR-T细胞的耗竭表型检测示意图;
图6a为在体外IL-2 100U/ml培养到5天的CAR-T按照E(CAR-T):M(Daudi-PDL1)比=1:5,共培养8天检测CD19CAR-T和PD-1Ab21-CD19CAR-T细胞,T细胞和肿瘤细胞比例;
图6b为在体外IL-2 100U/ml培养到5天的CAR-T按照E(CAR-T):M(Daudi-PDL1)比=1:5,共培养8天检测CD19CAR-T和PD-1Ab21-CD19CAR-T细胞,T细胞和肿瘤细胞数目;
图6c为在体外IL-2 100U/ml培养到5天的CAR-T按照E(CAR-T):M(Daudi-PDL1)比=1:5,共培养8天检测CD19CAR-T和PD-1Ab21-CD19CAR-T细胞,CD8 T细胞上耗竭标志物PD-1,TIGIT,TOX,LAG3表达;
图7为本发明免疫细胞中PD-1Ab21-CD19CAR-T细胞在人源化小鼠B细胞白血病模型中具有显著的抗肿瘤治疗效果示意图;
图7a为NSG小鼠尾静脉注射接种Raji-luc细胞7天后回输5x10
图7b为小动物活体成像监测肿瘤进展;
图8为本发明免疫细胞中PD-1Ab21-CD19CAR-T细胞在人源化小鼠淋巴瘤模型中具有显著的抗肿瘤治疗效果示意图;
图8a为NSG小鼠皮下接种Daudi-hPD-L1细胞19天后回输2x10
图8b为NSG小鼠皮下接种Daudi-hPD-L1细胞后的生存曲线,PD-1Ab21-CD19CAR-T细胞治疗组相较于CD19CAR-T具有更高的存活率;
图8c为肿瘤生长曲线,测量肿瘤长度(a)和宽度(b),肿瘤体积计算为(ab
图8d为利用流式细胞术分析在荷瘤的NSG小鼠外周血中回输的CD3+CD45+CAR-T细胞占的百分比;
图9为本发明PD-1Ab21促进免疫细胞中CAR-T细胞的增殖以及向干性分化从而介导更强的抗肿瘤作用示意图;
图9a为NSG小鼠皮下接种Daudi-hPD-L1细胞33天后回输5x10
图9b为NSG小鼠外周血,脾脏,肿瘤组织中CD3
图9c为流式检测脾脏,肿瘤组织中CD3
图9d为流式检测肿瘤部位CD3
图10为本发明免疫细胞中PD-1Ab21-BCMACAR-T细胞在人源化小鼠骨髓瘤模型中具有显著的抗肿瘤治疗效果示意图;
图10a为NSG小鼠尾静脉注射接种U266-luc细胞24天后回输2x10
图10b为小动物活体成像监测肿瘤进展;
图11为本发明免疫细胞中PD-1Ab21-Her2CAR-T细胞在人源化小鼠乳腺癌模型中具有显著的抗肿瘤治疗效果示意图;
图11a为NSG小鼠皮下接种BT474-PD-L1细胞34天后回输3x10
图11b为荷瘤小鼠生存曲线,PD-1Ab21-Her2CAR-T细胞治疗组相较于Her2CAR-T具有更高的存活率;
图11c为肿瘤生长曲线,测量肿瘤长度(a)和宽度(b),肿瘤体积计算为(ab
图12为本发明免疫细胞中PD-1Ab21-CD19CAR-T细胞的IIT临床研究中四例患者回输后外周血T细胞变化趋势示意图;
图12a为第一例患者回输后外周血T细胞变化趋势示意图;
图12b为第二例患者回输后外周血T细胞变化趋势示意图;
图12c为第三例患者回输后外周血T细胞变化趋势示意图;
图12d为第四例患者回输后外周血T细胞变化趋势示意图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本发明实施例的组件能够以各种不同的配置来布置和设计。
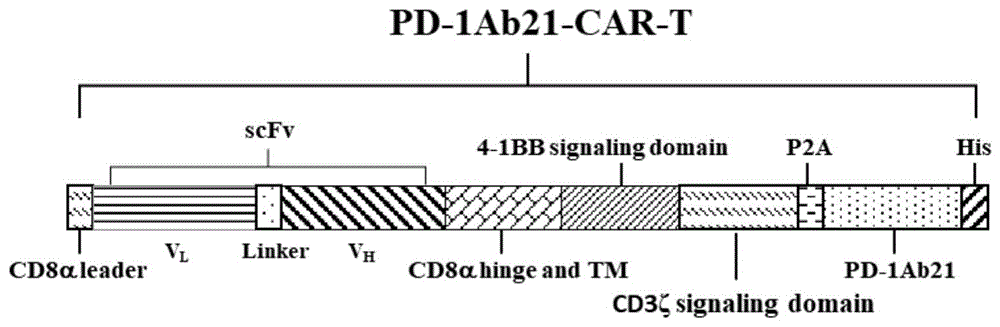
请参照图1,本发明提供一种免疫细胞,其能够表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21。
在本发明较佳的实施例中,上述免疫细胞的所述免疫细胞特异性识别血液恶性肿瘤、肺癌、乳腺癌、肝癌、胰腺癌、肾癌、前列腺癌、卵巢癌、消化道肿瘤、脑肿瘤、神经内分泌肿瘤、骨肿瘤、软组织肿瘤中的至少一种。
在本发明较佳的实施例中,上述免疫细胞的所述免疫细胞选自CAR-T细胞、TCR-T细胞、CAR-NK细胞、TIL细胞中的至少一种。
在本发明较佳的实施例中,上述免疫细胞的所述免疫细胞除了发挥自身抗肿瘤作用的同时,能增强机体内在的抗肿瘤免疫反应。
本发明提供一种病毒载体,能够表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21。
在本发明较佳的实施例中,上述病毒载体的所述病毒表达载体感染细胞后,使细胞分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21。
本发明提供一种免疫细胞表达载体,其包括靶向特定抗原的表达质粒、P2A序列片段、表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的编码序列片段;
优选的,还包括His标签;
所述靶向特定抗原的表达质粒包括胞外域、跨膜域和胞内域;
所述胞外域包括CD8α信号肽片段(图1中CD8αleader所示区域)、特异性抗体片段(图1中scFv所示区域,包括重链可变区VH、轻链可变区VL和一个连接子Linker)和CD8α铰链区片段(图1中CD8αhinge所示区域);
所述跨膜域包括CD8α跨膜区片段(图1中CD8αTM所示区域);
所述胞内域包括4-1BB信号转导结构域片段(图1中4-1BB signaling domain所示区域)和CD3ζ信号转导结构域片段(图1中CD3ζsignaling domain所示区域)。
在本发明较佳的实施例中,上述免疫细胞表达载体中所述表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的编码序列片段的cDNA序列如SEQ ID No.1所示。
在本发明较佳的实施例中,上述免疫细胞表达载体中所述特异性抗体片段包括靶向CD19的特异性单链抗体片段,和/或靶向BCMA的特异性单链抗体片段,和/或靶向Her2/neu肿瘤抗原的特异性抗体片段,和/或靶向其它肿瘤抗原的特异性抗体片段。
本发明提供一种免疫细胞在治疗B细胞白血病、B细胞淋巴瘤、骨髓瘤瘤、Her2/neu+乳腺癌、晚期B细胞恶性肿瘤中的应用,所述免疫细胞为如前所述的免疫细胞。
本发明提供一种免疫细胞的制备方法,其包括:
构建PD-1单链抗体和IL-21融合蛋白PD-1Ab21的编码基因;
构建表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的免疫细胞表达载体;
对所述免疫细胞表达载体进行病毒包装,得到病毒颗粒;
通过所述病毒得到免疫细胞。
在本发明较佳的实施例中,上述免疫细胞的制备方法中,所述构建PD-1单链抗体和IL-21的融合蛋白PD-1Ab21的编码基因包括:
选用人源化PD-1抗体,将重链可变区与轻链可变区通过连接子Linker连接在一起后,得到靶向特异性细胞的PD-1单链抗体;
将所述靶向特异性细胞的PD-1单链抗体与IL-21细胞因子融合蛋白的cDNA序列通过连接子Linker连接并进行DNA片段合成,得到PD-1单链抗体和IL-21的融合蛋白PD-1Ab21的编码基因。
在本发明较佳的实施例中,上述免疫细胞的制备方法中,所述构建表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的免疫细胞表达载体包括:
使用慢病毒载体pCDH构建靶向特定抗原的表达质粒,所述靶向特定抗原的表达质粒包括胞外域、跨膜域和胞内域;
所述胞外域包括CD8α信号肽片段(图1中CD8αleader所示区域)、特异性抗体片段(图1中scFv所示区域,包括重链可变区VH、轻链可变区VL和一个连接子Linker)和CD8α铰链区片段图1中CD8αhinge所示区域);
所述特异性抗体片段包括靶向CD19的特异性单链抗体片段,和/或靶向BCMA的特异性单链抗体片段,和/或靶向Her2/neu肿瘤抗原的特异性抗体片段,和/或靶向其它肿瘤抗原的特异性抗体片段;
所述跨膜域包括CD8α跨膜区片段(图1中CD8αTM所示区域);
所述胞内域包括4-1BB信号转导结构域片段(图1中4-1BB signaling domain所示区域)和CD3ζ信号转导结构域片段(图1中CD3ζsignaling domain所示区域);将表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的编码序列片段通过P2A序列片段连接到所述靶向特定抗原的表达质粒的编码片段的后面;
在整个序列的C端连接His标签,得到构建表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21的免疫细胞表达载体。
在本发明较佳的实施例中,上述免疫细胞的制备方法中,所述对所述免疫细胞表达载体进行病毒包装,得到病毒颗粒包括:
使用磷酸钙转染法进行病毒包装;
转染前16-20小时,选择293T细胞传代,每个细胞培养皿中接种4×10
接种20-24h后,观察293T细胞的传代情况,当293T细胞达到50%覆盖率时,进行转染;
所述转染的方法包括:配制转染试剂,所述转染试剂包括A液和B液,所述A液中包括质粒25μg,2.5molCaCl250μl,ddH2OUpto500μl,所述B液中包括2×HEPES盐缓冲液500μl,所述A液配制后静置3min,将所述A液加入所述B液中,同时用电动移液器向试剂管内打气泡,使所述A液和所述B液混匀,试剂管内溶液产生白色浑浊,制得所述转染试剂,将1ml所述转染试剂加入到293T细胞的培养皿中,轻轻摇匀,放入37℃培养箱中培养,进行转染;
转染12-16h后,进行换液,弃去培养上清,加入15ml含10%FBS的DMEM培养基;
换液后经过48小时,通过0.45μm滤器过滤,收取48h培养上清,补充10ml含10%FBS的DMEM培养基,在4℃下保存;
保存24小时后,通过0.45μm滤器过滤,收取72h培养上清;
将所述48h培养上清和所述72h培养上清均通过浓缩泵浓缩50倍,然后通过0.22μm滤器过滤,收取过滤后的病毒浓缩液,分装到1.5mlEP管中,在-80℃条件下保存,得到病毒颗粒。
在本发明较佳的实施例中,上述免疫细胞的制备方法中,所述通过所述病毒颗粒制备得到免疫细胞包括:
取出所述病毒颗粒,重新得到病毒浓缩液;
取人抗凝外周血,用等体积PBS稀释,用人淋巴细胞分离液分离稀释后的人抗凝外周血,采集外周血单个核细胞PBMC;
将外周血单个核细胞PBMC中的T细胞浓度调整至1x10
T细胞进入激活状态24h后,将T细胞以5x10
感染6小时后,补充加入新鲜的感染培养基1ml;
继续感染48小时,弃去培养上清,更换新鲜的感染培养基(X-VIVO
继续感染使T细胞扩增6-8天后,得到免疫细胞。
本发明提供一种PD-1Ab21-CD19CAR-T细胞培养上清中PD-1Ab21融合蛋白的检测和功能鉴定方法:
将制备的PD-1Ab21-CD19CAR-T和普通CD19CAR-T细胞分别在CAR-T细胞培养基中培养48小时,收上清,用ELISA检测上清中PD-1Ab21融合蛋白浓度。为检测上清中PD-1Ab21融合蛋白结合细胞表面表达的PD-1分子的功能,将稳定表达PD-1的CHO(PD-1
为检测上清中PD-1Ab21融合蛋白IL-21的生物学活性,将表达IL-21R的Baf3细胞以5×10e5/孔接种到24孔板中,然后加入一定量的PD-1Ab21-CD19CAR-T细胞培养上清、或0.3uM重组IL-21(阳性对照)共培养30min,通过胞内流式染色检测细胞内STAT3的磷酸化程度。结果显示:CAR-T细胞培养上清具有和重组IL-21相同刺激IL-21R活化的生物学活性。以上结果说明CAR-T分泌的融合蛋白既有PD-1抗体的结合和阻断作用,又能发挥IL-21正常的生物学活性。
CAR-T细胞培养上清中PD-1Ab21融合蛋白浓度的ELISA检测方法如下:用PD-1蛋白扣板,每孔扣板0.1ug,4℃过夜;洗板3次,每孔100ul的10%FBS封闭30-60min;洗板3次,标准品浓度从200ng/ml成倍梯度稀释,每孔50ul,样品按照原液/10x/100x/1000x测定,室温孵育2h;洗板3次,孵抗体anti-IL-21-HRP(600x),每孔50ul,避光室温孵育1h;洗板5次,每孔加入50ulTMB显色,显色时间根据标曲的显色程度来确定,一般2-3分钟左右(根据标曲显色效果来决定),每孔加入1MH2SO450ul终止,460nmOD读数分析。
本发明提供一种PD-1Ab21-CD19CAR-T细胞的体外增殖和表型鉴定方法:
为了研究表达和分泌PD-1Ab21对CAR-T细胞体外增殖和分化的影响,将制备的PD-1Ab21-CD19CAR-T和普通CD19CAR-T细胞分别在含有100U/ml或10U/mlIL-2的培养基中培养11天,每天进行计数统计CD19CAR-T,PD1Ab21-CD19CAR-T-的增殖倍数变化。结果显示:在含有100U/mlIL-2的培养基中培养,两种CAR-T细胞的增殖没有区别;在含有10U/mlIL-2的培养基中培养时,CD19CAR-T细胞数目没有明显增加,但是可以看到PD-1Ab21-CD19CAR-T细胞明显扩增。流式细胞分析培养CAR-T细胞的表型,结果显示:在100U/mlIL-2的培养条件下,分泌PD-1Ab21的CAR-T细胞中干性记忆T细胞(T
为了检测CAR-T细胞受到肿瘤抗原刺激后的增殖能力,将制备的PD-1Ab21-CD19CAR-T和CD19CAR-T细胞分别在含有100U/mlIL-2的培养条件下与靶细胞(Daudi-PDL1)按1:5比例混合,在96孔细胞培养板中培养2天,流式检测CAR-T细胞表面Ki-67的表达。结果显示:PD-1Ab21-CD19CAR-T表面Ki-67的表达显著高于CD19CAR-T细胞,说明PD-1Ab21-CD19CAR-T细胞受到肿瘤细胞表面抗原刺激后的增殖能力显著高于CD19CAR-T细胞。
本发明提供一种CAR-T细胞的体外杀伤检测方法及细胞因子产生能力检测方法:
在100U/mlIL-2的培养基中培养扩增5天的CD19CAR-T和PD-1Ab21-CD19CAR-T细胞分别与靶细胞(Daudi-PDL1)按不同效靶比(1:1/2:1/5:1/10:1)混合,在96孔板中共培养24小时,用流式分析方法检测CAR-T细胞对靶细胞的杀伤功能。结果显示:CD19CAR-T和PD-1Ab21-CD19CAR-T细胞对CD19+肿瘤细胞的杀伤效应没有显著区别。但是,在低效靶比1:5的条件下与肿瘤细胞共培养8天,PD-1Ab21-CD19CAR-T细胞对肿瘤细胞的持续杀伤能力显著增强高于CD19CAR-T,而且PD-1Ab21-CD19CAR-T细胞的增殖也显著高于CD19CAR-T细胞。第8天用流式细胞检测CAR-T细胞表型,结果显示:PD-1Ab21-CD19CAR-T细胞上免疫检查点分子(PD-1、TOX、TIGIT)的表达显著低于CD19CAR-T细胞。
为了检测CAR-T细胞的细胞因子产生能力,将制备的PD-1Ab21-CD19CAR-T和CD19CAR-T细胞分别在含有100U/mlIL-2的培养条件下与靶细胞(Daudi-PDL1)按1:5比例混合,在24孔细胞培养板中培养2天,收集细胞和培养上清,进行胞内染色,流式检测表达细胞因子的细胞,结果显示:PD-1Ab21-CD19CAR-T细胞中IL-2阳性和IFN-γ阳性细胞的比例显著高于CD19CAR-T细胞。同时,用ELISA试剂盒检测培养上清中细胞因子,结果显示:PD-1Ab21-CD19CAR-T细胞培养上清中IL-2的浓度大约是CD19CAR-T细胞培养上清的2倍,IFN-γ的浓度也显著高于CD19CAR-T细胞培养上清。
以上结果说明:PD-1Ab21-CD19CAR-T细胞在识别杀伤肿瘤细胞的过程中,具有更强的抗肿瘤相应功能和增殖能力,同时,倾向于向记忆细胞分化,能抵抗肿瘤微环境诱导的功能衰竭。
本发明提供关于PD-1Ab21-CD19CAR-T细胞治疗B细胞白血病的临床前实验方法:
重度免疫缺陷(NSG)小鼠尾静脉注射接种2x10
本发明提供关于PD-1Ab21-CD19CAR-T细胞治疗B细胞淋巴瘤的临床前实验方法:
重度免疫缺陷(NSG)小鼠皮下接种5x10
本发明提供关于PD-1Ab21-CD19CAR-T细胞治疗骨髓瘤瘤的临床前实验方法:
给重度免疫缺陷(NSG)小鼠尾静脉注射1x10
本发明提供关于PD-1Ab21-Her2CAR-T细胞治疗Her2/neu+乳腺癌的临床前实验方法:
为研究表达分泌PD-1Ab21的CAR-T细胞对实体瘤的治疗效果,采用人Her2/neu+乳腺癌小鼠模型,进行Her2CAR-T细胞的治疗。给重度免疫缺陷(NSG)小鼠皮下接种1x10
关于PD-1Ab21-CD19CAR-T治疗晚期B细胞恶性肿瘤的IIT临床研究方法:
为研究表达分泌PD-1Ab21的CAR-T细胞对癌症患者的临床治疗效果,我们与北京301血液科合作开展了研究者发起的临床实验(IIT),名为“PD-1Ab21-CD19CAR-T细胞治疗CD19阳性的血液系统恶性肿瘤的单臂临床研究”,研究对象为缺乏其它有效治疗手段的晚期B细胞恶性肿瘤患者。入组的前4例患者,包括2例B细胞白血病,2例B细胞淋巴瘤,经PD-1Ab21-CD19CAR-T细胞治疗后均获得完全缓解出院。其中,第二例白血病患者脑部有直径2cm左右的肿瘤块,CAR-T细胞输入治疗后18天,MRI检查显示脑部肿瘤块明显缩小到不足1cm,3个月增强核磁复查肿瘤完全消失。2例淋巴瘤患者均为高肿瘤负荷,广泛结外病变,包括胸椎等骨骼广泛侵犯、腹腔大于7cm包块等,经PD-1Ab21-CD19CAR-T细胞输入治疗后,完全代谢缓解。对这四例患者在CAR-T细胞输入前后,定期采患者外周血流式检测患者体内CAR-T细胞和其它淋巴细胞的变化。结果显示:四例患者均在CAR-T细胞回输后4~7天开始扩增,CAR-T细胞在外周血单个核细胞中的比例两周内达到峰值,随后快速回落。一个很重要的发现是,当输入的CAR-T细胞开始扩增时,四例患者的外周血CD8+T细胞的比例也随着CAR+T细胞的升高而迅速升高,并同时到达峰值,最高时可达80%以上;但是与CAR-T细胞不同的是,CD8+T细胞在此后依然维持在一个较高水平,尤其是第一和第三例病人。在扩增峰值时,CAR+T细胞的比例在四例患者中分别为~40%、~8%、~60%和45%。
以上结果说明,PD-1Ab21-CD19CAR-T细胞治疗中,分泌的PD-1Ab21融合蛋白既能促进CD19CAR-T细胞自身的抗肿瘤效应,同时还能作用于患者自身内在的CD8+T细胞和NK细胞,激活机体内在的抗肿瘤CD8+T细胞和NK细胞,增强患者内在的抗肿瘤免疫,显著增加CAR-T细胞的治疗效果,防止肿瘤抗原丢失或下调导致的肿瘤复发。
以下提供本发明CAR-T细胞的制备及疗效验证实施例。
实验动物采用6-8周雌性NSG小鼠,购自江苏集萃实验动物有限公司,实验过程中小鼠饲养于中国科学院生物物理所免疫动物缺陷区级动物房。实验流程和小鼠处理过程遵循实验动物管理规范条例,并经过生物物理所动物管理和使用委员会批准。
本发明实施例的细胞系及细胞培养:人胚肾上皮细胞系293T,人乳腺癌癌细胞系BT474-PDL1,人Burkitt’s淋巴瘤细胞系Daudi-PDL1,人PBMC来源于本实验室。小鼠B细胞前体细胞系Baf3购于北纳创联生物技术有限公司。293T细胞培养于含10%的灭活胎牛血清(Hyclone公司),1%青霉素/链霉素(Invitrogen公司)的DMEM培养基(GIBCO)中,BT474-PDL1,Daudi-PDL1和Baf3细胞培养于含10%的灭活胎牛血清(Hyclone公司),1%青霉素/链霉素(Invitrogen公司)的1640培养基(GIBCO)中。均置于5% CO2细胞培养箱内,37℃培养。
本发明实施例的抗体:
表1人淋巴细胞表面检测抗体
表2人淋巴细胞胞内检测抗体
/>
本发明实施例的主要试剂及试剂盒:
表3试剂及试剂盒
实施例1:抗人PD-1单链抗体与人IL-21融合蛋白(PD-1Ab21)的构建
将抗人PD-1抗体(G4)杂交瘤细胞进行外显子测序,根据抗体重链和轻链基因序列设计以下引物,通过RT-PCR克隆抗体重链和轻链可变区编码基因。引物序列如下:
通过RT-PCR技术,分别使用:
抗人PD-1抗体重链(H)上游引物:
ATGACCAGGCTGACAGTGCTG
抗人PD-1抗体重链(H)下游引物:
CGCTAGACACTGTCACCAGGGTG
抗人PD-1抗体轻链(L)上游引物:
GACGTGCTGACCCAGAGCCCATC
抗人PD-1抗体轻链(L)下游引物:
CACTGTCCTCTTGATCTCCAG
克隆获得抗体重链(H)和轻链(L)可变区编码基因后,通过一段链接序列(linker):GAGGAGGAGGATCTGGAGGAGGAGG
AAGCGGAGGAGGAGGATCC,将抗体重链(H)和轻链(L)可变区编码基因相连接,成为一个抗PD-1单链抗体PD-1Ab的编码基因序列。
进一步,通过另一个由36个氨基酸组成的链接序列linker:GGCAGTGGAGAGGGCAGAGGAAGTCTGCTAACATGCGGTGACGTCGAGGAGAATCCTGGCCCA,将获得的序列PD-1单链抗体(mPD-1Ab)与序列人IL-21编码基因序列链接。获得抗PD-1单链抗体与IL-21融合蛋白(PD-1Ab21)。
为了后续蛋白纯化和检测,可选择的,在获得的融合蛋白C端加上一个由22个氨基酸组成标签蛋白6xHis的编码基因序列。
引物序列如下:
IL-21上游引物序列
GGAGGAGGAGGAAGCGG
IL-21下游引物序列
AAGTCGACCTAGTGATGGTGGTGATGATGGTGG
最终,构建获得编码人融合蛋白(PD-1Ab21)的编码基因,核苷酸序列如SEQ IDNo.1所示。将获得的PD-1Ab21核苷酸序列通过P2A序列连接到CD19CAR序列之后。CD19CAR由胞外域,跨膜区,胞内区三部分组成。胞外域段由CD8α信号肽,人CD19单链抗体,CD8α铰链区等三部分构成;跨膜区由CD8α跨膜区构成;胞内域由4-1BB胞内信号结构域,CD3ζ链胞内域序列构成。将CAR的胞外域,跨膜区,胞内域各个部分串联在一起即为CD19CAR序列。具体构建示意图参见图1。
实施例2:PD-1Ab21-CD19CAR-T细胞的制备及分泌的PD-1Ab21融合蛋白的功能鉴定
CAR慢病毒的包装
1)第一天:转染前16-20小时用10cm培养皿进行293T细胞传代,4×106细胞/皿;
2)第二天:观察第一天传代的细胞,当细胞达到50%的覆盖率时可以进行转染,首先将转染试剂(2×HEPES盐缓冲液)和质粒恢复到室温。在50ml离心管中准备转染复合物,一个50ml离心管最多可以配制50皿转染用量,单皿转染体系和试剂用量如下:
A液:质粒25μg
2.5mol CaCl2 50μl
ddH2O Up to 500μl
B液:2×HEPES 500μl
A液配制完静置3min后,加入到B液2×HEPES盐缓冲液中,同时用电动移液器向管内打气泡,使两种溶液快速充分混匀,混匀完成后即可见到管内溶液产生白色浑浊,即为钙转颗粒,应当注意,混匀过快时钙转颗粒形成差,太慢时颗粒会聚集,两种情况都会降低转染效率,
将1ml混合物加入到293T细胞的培养皿中,轻轻摇匀,37℃培养箱培养过夜(12-16h);
3)第三天,弃去培养上清,小心缓慢贴壁加入15ml含10%FBS的DMEM培养基;
4)第五天,收取换液后48小时的病毒培养上清,并补充10ml培养基;过0.45μm滤器,在4℃保存1天;
5)第六天,收取换液后72小时的病毒培养上清,过0.45μm滤器,与48小时的病毒培养上清一起进行浓缩泵浓缩50倍,完成浓缩后再次过0.22μm滤头,分装到1.5ml EP管中,在-80℃保存。
健康人PBMC分离
1)取浓缩后的人外周血,按照比例进行稀释,将50ml浓缩的外周血用70ml的无血清1640培养基稀释,然后混匀;
2)在50ml离心管中加入15ml淋巴细胞分离液,然后用移液管沿着管壁缓缓的加入30ml稀释后的外周血;
3)将离心管缓慢的放入离心机中,调整离心机的升速为3,降速为1,2200rpm离心25min;
4)离心完成后,离心管中的细胞分为四层,用移液管缓慢的去除最上层液体;
5)将第二层的淋巴细胞缓慢的吸出放入新的50ml离心管中,加入无血清1640培养基至50ml,混匀后离心。升速和降速都恢复至9,1800rpm,10min;
6)弃上清,用无血清培养基重悬细胞,1600rpm,6min;重复离心一次;
7)细胞计数,冻存处理。
人外周血中T细胞的活化
1)从液氮中取出冻存的细胞,37℃复苏后,细胞计数,调整细胞密度为1×107/ml,种入24孔板,细胞孵箱静置过夜;
2)第二天,细胞计数,根据1μl磁珠对应4×105细胞,计算出所需磁珠的体积;
3)anti-CD3和anti-CD28磁珠活化细胞:先将1ml Gibco培养基加入到无菌流式管中,然后加入磁珠,把无菌流式管放到磁铁凹槽内上约半分钟,移去管内培养基,加入细胞悬液,与磁珠轻柔混匀,用混匀器处理半小时后转移到24孔板中,细胞孵箱静置过夜;
4)一般活化24小时后进行慢病毒感染。
制备CAR-T细胞
1)取CD3/CD28 beads活化24小时的T细胞,密度调整至1×106/ml,在48孔板中每孔加500μl细胞悬液;
2)将慢病毒从-80℃冰箱取出,恢复到室温,每孔加入500μl;
3)向孔中加聚凝胺(Polybrene)8μg/ml,以及10ng/ml的IL-2,混匀,用保鲜膜把孔板包好;
4)离心感染:2000g,30℃,离心60min,升速9,降速0,离心结束后取出孔板,置于37℃细胞培养孵箱;
5)第二天,从孔中小心取走500μl培养基,再加入500μl逆转录病毒,补充Polybrene和IL-2,离心感染,条件同上;
6)离心完成后放回细胞培养孵箱,6小时后取走500μl,再补充CAR-T培养基,正常培养过夜;
7)第三天,把细胞从孔中取出,加入10ml CAR-T培养基,2000rpm离心10min,弃上清,重悬至5×105/ml,通过流式检测CAR表达(CD19Fc-PE)情况,参见(图2A),后续根据实验需求进行操作。
检测PD-1Ab21生物学功能
为了检测PD-1Ab21蛋白的PD-1单链抗体生物学功能。使用CHO-PD-1细胞系,该细胞表面高表达人的PD-1分子。
PD-1Ab21蛋白与细胞表面PD-1的结合
1)收集PD-1Ab21CD19CAR-T和CD19CAR-T培养至48h的上清,用10KD的超滤管2800rpm浓缩上清100倍(离心时间视浓缩情况而定);
2)取1×105的CHO-PD-1,分别加入50ul的浓缩上清,混匀细胞。4℃,孵育30min,加入1ml 1xPBS,4000rpm,离心3min,弃上清;
3)分别加入50ul FACS(1ml胎牛血清+49ml PBS)重悬细胞,向细胞悬液中加入0.5ul anti-His-PE抗体,4℃孵育30min,加入1ml 1xPBS,4000rpm,离心3min,弃上清;
4)加入100ul PBS重悬细胞,过筛网后上流式分析。
PD-1Ab21蛋白阻断PD-1抗体与细胞表面PD-1的结合
1)收集PD-1Ab21CD19CAR-T和CD19CAR-T培养至48h的上清,用10KD的超滤管2800rpm浓缩上清100倍(离心时间视浓缩情况而定);
2)取1×105的CHO-PD-1,分别加入50ul的浓缩上清,混匀细胞。4℃,孵育30min,加入1ml 1xPBS,4000rpm,离心3min,弃上清;
3)分别加入50ul FACS(1ml胎牛血清+49ml PBS)重悬细胞,向细胞悬液中加入0.5ul anti-PD-1-APC抗体,4℃孵育30min,加入1ml 1xPBS,4000rpm,离心3min,弃上清;
4)加入100ul PBS重悬细胞,过筛网后上流式分析。
制备的PD-1Ab21-CD19CAR-T细胞中CAR
PD-1Ab21蛋白对Baf3细胞STAT3磷酸化
为了检测PD-1Ab21蛋白中的IL-21部分生物学功能。在Baf3培养体系中,分别加入人的IL-21(0.3uM)和PD-1Ab21-CD19CAR-T细胞的48h上清进行刺激,检测人的IL-21和PD-1Ab21蛋白对STAT3在酪氨酸705(Y705)位点的磷酸化的影响。
1)将Baf3细胞放入无血清的1640Resting过夜;
2)将过夜的Baf3细胞收集,1200rpm离心3min,弃上清,将细胞重悬至1x106/ml,24孔板铺板,每孔500ul;
3)每孔分别加入IL-21(0.3uM)和PD-1Ab21-CD19CAR-T细胞的48h浓缩上清进行刺激,37℃,孵育30min;
4)将刺激过后的Baf3细胞收集到提前500ul预冷的4%多聚甲醛中,4℃固定30min,然后4000rpm离心3min,倒上清;
5)加入1ml-20℃预冷的甲醇透膜,4℃透膜30min,然后4000rpm离心3min,弃上清;
6)加入1ml FACS将细胞重悬,4000rpm离心3min,弃上清,重复一次;
7)分别加入50ul FACS重悬细胞,向细胞悬液中加入0.5ul anti-pSTAT3抗体,4℃孵育30min,加入1ml FACS,4000rpm,离心3min,弃上清;
8)加入100ul PBS重悬细胞,过筛网后上流式分析。
结果显示,IL-21与PD-1Ab21都能促进Baf3细胞STAT3在酪氨酸705(Y705)位点的磷酸化(图2d)。
实施例3:PD-1Ab21-CD19CAR-T细胞的体外增殖和表型鉴定
按照实施例2的方法制备CAR-T细胞,在病毒感染48h后,去病毒,将CD19CAR-T和PD-1Ab21-CD19CAR-T分别培养在IL-2:10U或者100U的条件下进行培养
结果显示:在IL-2 100U/ml体外培养条件下,两种CAR-T细胞增殖倍数都没有明显的差异。
当我们在体外培养CAR-T的过程中降低IL-2浓度为10U/ml,在低浓度IL-2体外培养过程中,通过细胞计数监测两种CAR-T细胞增殖倍数的变化。结果显示:在IL-2浓度为10U/ml的体外CAR-T培养体系中,CD19CAR-T基本上为不增殖的状态,而PD-1Ab21-CD19CAR-T细胞在培养过程前7天显示出了持续的增殖能力,相较于CD19CAR-T细胞具有更强的增殖能力(图3a)。
进一步的我们在体外培养过程中通过流式细胞术分析两种CAR-T表型的变化。
表面染色:
1)取分离的细胞悬液5×105细胞/样于1.5ml EP管中,用100μl FACS buffer重悬;
2)取待测的荧光标记抗体及同型对照抗体,4℃避光标记20分钟后,1ml FACSBuffer洗涤,4000rpm离心3min;
3)加入100ul PBS重悬细胞,过筛网后上流式分析。
我们发现在IL-2 10U/ml条件下,统计不同培养天数CD4或CD8 T细胞中Tscm(CD45RA+CCR7+)细胞比例(图3b和图3c),同时在IL-2 10U/ml条件下,统计不同培养天数CD4或CD8 T细胞中CD45RA,CCR7,CD62L,CD45RO,CD28的表达(图3d)。结果显示:PD-1Ab21能够诱导CD19CAR-T向Tscm(CD45RA+CCR7+)细胞分化,并且具备更强的持续增殖能力。
实施例4:PD-1Ab21-CD19CAR-T细胞的体外杀伤功能鉴定
为了检测PD-1Ab21-CD19CAR-T和CD19CAR-T在体外对肿瘤细胞杀伤能力的区别,按照实施例2的方法制备CAR-T细胞,我们选择在体外IL-2100U/ml培养到第五天的CAR-T按照E(CAR-T):M(Daudi-PDL1)比=1:1/2:1/5:1/10:1的条件下,在96孔板共培养24h检测CAR-T细胞的杀伤能力,结果显示:CD19CAR-T和PD-1Ab21-CD19CAR-T短期杀伤肿瘤细胞能力没有区别(图4a)。
而为了研究PD-1Ab21-CD19CAR-T和CD19CAR-T对肿瘤细胞的持续杀伤能力,我们选择体外IL-2 100U/ml培养到第五天的CAR-T按照的E(CAR-T):M(Daudi-PDL1)比=1:5的条件下,共培养8天,检测CD19CAR-T和PD-1Ab21-CD19CAR-T持续杀伤能力;在持续杀伤的过程中通过流式细胞术检测T细胞和肿瘤细胞的比例(图4b)按照实施例3表面染色方法染色,同时通过细胞计数的方式检测T细胞和肿瘤细胞(Daudi-PDL1)数目以及CD8/CD4 Ratio比例变化(图4c),结果显示:PD-1Ab21-CD19CAR-T相较于CD19CAR-T持续杀伤能力显著增强。
实施例5:PD-1Ab21-CD19CAR-T细胞的体外增殖和细胞因子分泌能力检测
为了检测PD-1Ab21-CD19CAR-T和CD19CAR-T在肿瘤细胞共培养之后其增殖和细胞因子分泌的区别,按照实施例2的方法制备CAR-T细胞,我们使用在体外IL-2 100U/ml培养到第五天的CAR-T按照E(CAR-T):M(Daudi-PDL1)比=1:5,共培养2天检测CD19CAR-T和PD-1Ab21-CD19CAR-T细胞Ki-67的表达(图5a)。
细胞核内染色Ki-67
1)取1×106细胞/样于1.5ml EP管中,用100μl FACS Buffer重悬;
2)加入表面标记抗体,4℃避光标记20分钟.;同时设立同型对照管(相同的细胞数目);
3)用1ml FACS Buffer洗涤,洗2次;
4)核内染色Ki-67和TCF-1时,悬于200μlFixation/Permeabilization工作液中,4℃避光孵育,过夜固定;
5)用1ml 1×Permeabilization Buffer洗涤,洗两遍,透膜;
6)将细胞悬于100μl Permeabilization Buffer中;然后加入anti-Ki-67,anti-TCF-1,4℃孵育30分钟;
7)用1ml Permeabilization Buffer洗涤,洗两遍,除去未结合的抗体。
8)加入100ul PBS重悬细胞,过筛网后上流式分析。
结果显示:分泌PD-1Ab21的CD19CAR-T其增殖的标志物Ki-67的表达明显增强,这表明分泌PD-1Ab21的CD19CAR-T具备更强的增殖能力。
在上述条件下通过流式细胞术和ELISA试剂盒方式检测CD19CAR-T和PD-1Ab21-CD19CAR-T细胞IL-2和IFN-γ的分泌表达情况(图5b和图5c),方法参考试剂盒说明书(invitrogen:Catalog Number 88-7025),结果显示:PD-1Ab21-CD19CAR-T相较于CD19CAR-T细胞分泌细胞因子的能力明显增强。这进一步说明了PD-1Ab21-CD19CAR-T相较于CD19CAR-T增殖能力和细胞因子分泌能力显著增强。
实施例6:PD-1Ab21-CD19CAR-T细胞的耗竭表型检测
为了检测PD-1Ab21-CD19CAR-T和CD19CAR-T在体外与肿瘤细胞共培养之后其耗竭标志物的表达,细胞表面染色和细胞核内染色参照实施例5,我们选择在体外IL-2 100U/ml培养到第五天的CAR-T按照E(CAR-T):M(Daudi-PDL1)比=1:10,共培养8天后,我们首先通过流式细胞术和细胞计数检测在与肿瘤细胞共培养8天后CD19CAR-T和PD-1Ab21-CD19CAR-T比例和数目变化(图6a和图6b),结果也再次表明PD-1Ab21-CD19CAR-T相较于CD19CAR-T其增殖和对肿瘤细胞的持续杀伤能力明显更强。
通过流式细胞术检测在与肿瘤细胞共培养8天后CD19CAR-T和PD-1Ab21-CD19CAR-T细胞中CD8 T细胞上耗竭标志物PD-1,TIGIT,TOX,LAG3表达,结果显示:PD-1Ab21-CD19CAR-T相较于CD19CAR-T耗竭标志物的表达明显减弱(图6c)。
实施例7:PD-1Ab21-CD19CAR-T细胞在人源化小鼠B细胞白血病模型中具有显著的抗肿瘤治疗效果
为了探究我们构建的PD-1Ab21-CD19CAR-T细胞是否具有更优的抗肿瘤效果,我们首先在人源化小鼠B细胞白血病模型中开展抗肿瘤治疗效果研究。我们给重度免疫缺陷(NSG)小鼠尾静脉接种2×10
小动物成像
1)每只小鼠腹腔注射2mg Luciferin底物,同时开始计时;
2)将小鼠进行麻醉,三溴乙醇腹腔注射或者采取乙氟醚麻醉;
3)注射荧光素钠约5分钟后,将小鼠置于IVIS Lumina3活体成像仪,设置曝光时间为1分钟,采集图像,进行检测。
小动物活体成像监测肿瘤进展如图7b所示。结果显示:在高肿瘤负荷的情况在,与对照组相比,CD19CAR-T虽然可以在一定程度上抑制白血病的进展,但最终还是无法清除肿瘤,并且小鼠出现死亡;而PD-1Ab21-CD19CAR-T细胞能够显著抑制肿瘤进展,并且完全清除肿瘤,实现肿瘤治愈的效果。这些结果表明,PD-1Ab21-CD19CAR-T细胞在人源化小鼠B细胞白血病模型中具有显著优于CD19CAR-T的抗肿瘤治疗效果。
实施例8:PD-1Ab21-CD19CAR-T细胞在人源化小鼠淋巴瘤模型中具有显著的抗肿瘤治疗效果
为了探究我们所构建的PD-1Ab21-CD19CAR-T细胞相较于CD19CAR-T是否在人源化小鼠淋巴瘤模型中介导一个更强的抗肿瘤作用,我们给重度免疫缺陷(NSG)小鼠皮下接种5×10
实施例9:PD-1Ab21促进CAR-T细胞的增殖以及向干性分化从而介导更强的抗肿瘤作用
以上的结果证明了,我们所构建的PD-1Ab21-CD19CAR-T细胞相较于CD19CAR-T细胞在体内具有更强的抗肿瘤功能。接下来,我们进一步探究我们所构建的PD-1Ab21-CD19CAR-T细胞是通过怎样的机制来介导更强的抗肿瘤功能,PD-1Ab21-CD19CAR-T细胞治疗组小鼠外周血中CD3+CD45+CAR-T细胞比例显著高于CD19CAR-T细胞治疗组(图8d)。这一结果引起了我们的注意,我们假设所构建的PD-1Ab21-CD19CAR-T细胞合成分泌的PD-1Ab21以自分泌或者旁分泌的形式作用于自身,促进了CAR-T细胞在体内增殖,从而诱导了更强的抗肿瘤作用。
为了验证我们的假设,我们利用Daudi-PDL1治疗模型,在回输CAR-T治疗后的第12天,取小鼠的外周血,脾脏,肿瘤等组织进行流式分析(图9a)。
外周血检测CAR-T细胞
1)EP管中预先加入20ul EDTA(50mM),每只取血3滴左右。
2)每管加入1ml ACK裂红,裂解至透明,4000rpm 3min离心。用枪头弃去上清。
3)1ml FACS(1ml血清+49ml 1X PBS),重悬细胞,4000rpm 3min离心,用枪头弃去上清。
4)混流式检测Mix,按照每个样50ul,按照检测的样品数可以多混两个,用FACS配制。流式抗体人的抗体每个样0.5ul,鼠的抗体每个样0.25ul。每个样品加混Mix 50ul,用移液枪将细胞重悬,4度放置30min。
5)每个样品加入1ml FACS洗去抗体,4000rpm 3min离心,弃上清。
6)加入100ul PBS重悬细胞,过筛网后上流式分析。
脾脏单细胞悬液制备
1)脱臼处死小鼠后,取其脾脏于含有1640培养基的培养皿中。
2)用磨砂玻片轻轻将组织磨碎,用培养基重悬后,过40μm筛网;
3)2000rpm离心10min,弃上清;
4)加入1ml ACK红细胞裂解液裂解红细胞,混匀,裂解5min;
5)加入10ml PBS终止裂解反应,2000rpm离心10min;
6)弃上清,用1640完全培养基重悬细胞制成单细胞悬液。
肿瘤单细胞悬液制备
1)脱臼处死小鼠后,用剪刀剪下皮下肿瘤组织;
2)将肿瘤组织至于5ml EP管中,先用剪刀尽量剪碎,然后按照肿瘤重量加入一定量的三酶消化液,于37℃消化20min左右;
3)取出肿瘤组织,加入10倍消化酶体积的PBS溶液终止反应,2000rpm离心10min;
4)用FACS buffer重悬细胞,过40μm筛网,制成单细胞悬液。
首先,通过流式检测这些部位回输的CAR-T细胞所占的比例,在体内主要由CD8+CAR-T细胞来发挥抗肿瘤作用,因此我们检测了PD-1Ab21-CD19CAR-T细胞治疗组和CD19CAR-T细胞治疗组在这些部位CD3+CD8+CAR-T细胞所占的比例,结果显示,CD19CAR-T-hPD-1Ab21细胞治疗组CD3+CD8+CAR-T细胞所占的比例都显著高于CD19CAR-T细胞治疗组(图9b)。
Ki67是细胞增殖的标志,因此我们检测了脾脏和肿瘤部位CD8+CART的Ki67的表达情况,细胞核内染色参照实施例5;结果显示,在肿瘤和脾脏部位PD-1Ab21-CD19CAR-T细胞治疗组Ki67+CD8+细胞比例显著高于CD19CAR-T细胞治疗组(图9c),这些结果再次表明了回输的PD-1Ab21-CD19CAR-T细胞相较于CD19CAR-T细胞具有更强的增殖能力,且增殖的CAR-T细胞主要为CD3+CD8+CAR-T细胞。
为了分析肿瘤部位效应CD8+T细胞发挥对肿瘤杀伤的效应功能,接下来我们检测了两种CAR-T细胞治疗组肿瘤部位浸润的CD3+CD8+CAR-T细胞的表型,细胞表面染色参照实施例4。结果显示,CD45RA+CD62L-的效应CD8+T细胞和CD45RA-CD62L-效应记忆CD8+T细胞在两组CAR-T治疗组之间没有明显的差异(图9d),同时我们发现CD45RA+CD62L+干性记忆CD8+T细胞和CD45RA-CD62L+中央记忆CD8+T细胞比例在PD-1Ab21-CD19CAR-T治疗组显著提高,这进一步表明了我们所构建的PD-1Ab21-CD19CAR-T细胞分泌的PD-1Ab21促进CAR-T细胞的增殖以及向干性分化从而介导更强的抗肿瘤作用。
实施例10:PD-1Ab21-BCMACAR-T细胞在人源化小鼠骨髓瘤模型中具有显著的抗肿瘤治疗效果
为研究表达分泌PD-1Ab21的CAR-T细胞对骨髓瘤的治疗效果,采用人骨髓瘤小鼠模型,进行BCMACAR-T细胞的治疗。我们给重度免疫缺陷(NSG)小鼠尾静脉接种1×10
结果显示:与对照组相比,BCMACAR-T细胞能够在回输后抑制骨髓瘤的进展,但无法清除肿瘤;而PD-1Ab21-BCMACAR-T细胞回输后能够在一周内快速发挥作用抑制骨髓瘤的进展,并且能够完全清除肿瘤负荷,实现肿瘤的治愈。(图10b)。这些结果表明,PD-1Ab21-BCMACAR-T细胞在人源化小鼠骨髓瘤模型中具有显著的抗肿瘤治疗效果。
实施例11:PD-1Ab21-Her2CAR-T细胞在人源化小鼠乳腺癌模型中具有显著的抗肿瘤治疗效果
为研究表达分泌PD-1Ab21的CAR-T细胞对实体瘤的治疗效果,采用人Her2/neu+乳腺癌小鼠模型,进行Her2CAR-T细胞的治疗。给重度免疫缺陷(NSG)小鼠皮下接种1x10
实施例12:PD-1Ab21-CD19CAR-T细胞的IIT临床研究中患者外周血T细胞变化趋势追踪
在与中国人民解放军总医院血液科合作开展的名为“PD-1Ab21-CD19CAR-T细胞治疗CD19阳性的血液系统恶性肿瘤的单臂临床研究”的临床实验中,我们对入组的4例患者PD-1Ab21-CD19CAR-T细胞回输前和回输后不同时间点的外周血进行了采集和分析,通过流式染色的方法追踪不同亚群T细胞的比例变化。结果显示,四例患者均在CAR-T细胞回输后4~7天开始扩增,CAR-T细胞在外周血单个核细胞中的比例两周内达到峰值,随后快速回落。当输入的CAR-T细胞开始扩增时,四例患者的外周血CD8+T细胞的比例也随着CAR+T细胞的升高而迅速升高,并同时到达峰值,最高时可达80%以上;但是与CAR-T细胞不同的是,CD8+T细胞在此后依然维持在一个较高水平,尤其是第一和第三例病人。在扩增峰值时,CAR+T细胞的比例在四例患者中分别为~40%、~8%、~60%和45%(图12a至图12d)。以上结果说明,PD-1Ab21-CD19CAR-T细胞治疗中,分泌的PD-1Ab21融合蛋白既能促进CD19CAR-T细胞自身的抗肿瘤效应,同时还能作用于患者自身内在的CD8+T细胞和NK细胞,激活机体内在的抗肿瘤CD8+T细胞和NK细胞,增强患者内在的抗肿瘤免疫,显著增加CAR-T细胞的治疗效果,防止肿瘤抗原丢失或下调导致的肿瘤复发。
本发明实施例旨在保护一种免疫细胞及其表达载体、应用和制备方法,具备如下效果:
1.本发明的免疫细胞(PD-1Ab21-CAR-T细胞、PD-1Ab21-TCR-T细胞、PD-1Ab21-CAR-NK细胞、PD-1Ab21-TIL细胞),在发挥普通免疫细胞识别和杀伤肿瘤细胞作用的同时,能够表达和分泌PD-1单链抗体和IL-21融合蛋白PD-1Ab21,可阻断CAR-T上的PD-1抑制信号,同时将IL-21靶向免疫细胞,促进免疫细胞的增殖,可显著增强免疫细胞的抗肿瘤效应。
2.本发明的免疫细胞在识别和杀伤肿瘤细胞时,分泌的PD-1Ab21,还能靶向患者体内PD-1+的抗肿瘤CD8
3.由于细胞因子作用的靶细胞众多,全身应用具有巨大副作用,极大限制了细胞因子在疾病治疗中的应用。本发明的免疫细胞分泌的PD-1Ab21融合蛋白,可以在体内靶向作用于PD-1+的抗肿瘤T细胞,减少了作用于其它细胞的机会,极大降低了细胞因子IL-21的全身副作用。
应当理解的是,本发明的上述具体实施方式仅仅用于示例性说明或解释本发明的原理,而不构成对本发明的限制。因此,在不偏离本发明的精神和范围的情况下所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。此外,本发明所附权利要求旨在涵盖落入所附权利要求范围和边界、或者这种范围和边界的等同形式内的全部变化和修改例。
- 一种Nucyep酶的编码基因、重组表达载体、重组工程菌及其制备方法和应用
- 一种运载蛋白、重组表达载体、外泌体及制备方法与应用
- 一种多醣体人体免疫细胞营养素及其制备方法
- 一种石斑鱼重组NNVcp的密码子优化的核酸序列、融合表达载体、制备方法及其本身
- 控制水稻种子萌发的miR1866基因、过表达载体、gRNA表达载体、制备方法及其应用
- 一种免疫细胞培养基、免疫细胞的培养方法及人参皂苷的应用
