包含苯并呋喃基N-酰腙衍生物的抗炎组合物
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及包含苯并呋喃基N-酰腙衍生物的抗炎用组合物,具体地,涉及具有抑制可能与核因子κB(NF-κB)相关的炎症反应调解通路的效果的化合物。
背景技术
炎症为因从外部去进入的有害物质或有机体等多种因素引起细胞或组织受到损伤或遭到破坏时,为了使损伤最小化并使受损伤的部位恢复原样而在局部发生的免疫反应,是保护生物体并清除因组织损伤生成的产物的有用的防御机制。通过上述防御机制,结果会引起疼痛、浮肿、发红或发热等而诱发功能障碍。诱发上述炎症的多种因素中有因外伤、烧伤、冻伤、放射能等引起的物理因素、因酸(acid)等化学物质引起的化学因素及因抗体反应引起的免疫学因素,此外,也会因血管或激素的不均衡而发生。
在正常的情况下,上述炎症起到在生物体内通过炎症反应中和或清除发病因素并通过使受损的组织再生来恢复正常的组织和功能的作用,但若炎症的程度成为规定水平以上或慢性化,则会出现发展为慢性炎症等疾病状态的问题。在临床疾病当中,几乎所有疾病都能够观察到炎症反应。
核因子κB为调节与炎症反应与免疫功能、老化、肿瘤等相关的多种信号传导的转录蛋白,在从果蝇到哺乳动物的广泛的有机体中确认到。迄今已知的核因子κB的靶向基因有60多个,据研究,在多种反应中起到中枢作用。因此,可以通过调节核因子κB的活性选择性地控制多重反应的初期通路及过程,从而可以用作疾病治疗的指标。
核因子κB的激活与灭活的适当协调有助于保持人体的常态,但若因核因子κB的过度激活而开始炎症反应,则非正常地增加炎性前列腺素、类二十烷酸、一氧化氮的生成。这使人体的免疫反应过度地持续,诱发老化和肿瘤的发病和增殖、转移,与包括动脉硬化症、组织移植排斥反应在内的多种病例状态相关。尤其,上述核因子κB与慢性炎症疾病的关联性高。
在过去的研究中,多有报告说核因子κB作为炎性转录因子调节多种炎性基因的表达,通过核因子λB(NF-λB)活性与细胞因子风暴或细胞因子释放综合征的直接关联性高,已知为这些疾病的治疗靶向因子。
“细胞因子风暴”或“细胞因子释放综合征”与包括感染性疾病、非感染性疾病、自身免疫反应及药物副作用在内的多种状态相关。炎症为人体组织对病毒、受损的细胞或刺激剂等有害刺激的复杂的生物学反应的一部分。这是与免疫系统、血管及许多蛋白质相关的保护反应。炎症的目的为去除细胞损伤的初始原因并清除死亡的细胞或行将死亡的细胞来开始组织复原。在正常的状况下,炎症的寿命短,受损的组织恢复在出现症状后的第2天-第3天开始。若释放高水平的炎症诱发性蛋白(细胞因子),则炎症性过度反应使肺及其他组织的血管受损而发生细胞因子风暴或细胞因子释放综合征,通过这时的炎症反应诱导身体各器官的功能下降。
据很多报告,核因子κB具有作为细胞因子风暴或细胞因子释放综合征的主要调节因子的功能,尤其认为核因子κB在感染性疾病中起到重要作用。病毒等引起的感染诱发细胞凋亡及后续的巨噬细胞激活,而后接续为活性氧(ROS)的产生,这引起伴随细胞因子生成的上皮细胞炎症及细胞破坏。前炎性细胞因子还可以通过多种诱导炎症基因的转录的核因子κB的激活以及通过介导细胞因子的生成和分泌的活性氧依赖方式的炎症激活引起二次感染的细胞来生成。同时,上皮细胞屏障的破坏最终延续为增加对感染的敏感性。
因此,最近关于严重急性呼吸系统综合征冠状病毒2型(Sars-Cov2)引起的感染性疾病,已知细胞因子风暴成为因病毒感染死亡的患者的主要死亡原因,发现核因子κB信号传导过程为引起上述细胞因子风暴的重要炎性信号传导过程(TrendsEndocrinolMetab.2020Nov;31(11):802-803,Pabl oGuisado-Vascoetal.;FrontImmunol.2020Dec 10;11:598444.,RalfKircheis etal.)。
因此,需要开发具有通过调节作为炎症反应的主要信号传导物质的核因子κB抑制生物体炎症反应系统的初期通路及过程来预防并治疗因炎症反应发生的多种病理学疾病的效果的新型化合物。
在这样的背景下,本发明确认到作为在体内具有高稳定性及溶解度的新型化合物的苯并呋喃基N-酰腙系列化合物具有通过调节作为炎症反应的主要信号传导物质的核因子κB抑制生物体炎症反应系统的初期通路及过程来预防并治疗因炎症反应发生的多种病理学疾病的效果,从而完成本发明。
发明内容
发明要解决的技术问题
本发明所要解决的技术问题在于,提供包含苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐的用于预防或治疗炎症疾病的药物组合物。
本发明所要解决的再一技术问题在于,提供包含苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐的用于预防或改善炎症疾病的食品组合物、饲料组合物或保健功能食品。
本发明所要解决的另一技术问题在于,提供包含苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的用于缓解皮肤刺激和/或皮肤炎症的化妆品组合物。
解决课题的技术手段
为了解决上述问题,本发明提供包含由下述化学式1表示的化合物、其立体异构体或其药学上可接受的盐的用于预防或治疗炎症疾病的药物组合物。
化学式1:
在上述式中,R
上述C
并且,上述C
并且,上述卤代C
根据一实例,在上述化学式1中,R
根据再一实例,在上述化学式1中,R
根据还有一实例,在上述化学式1中,R
根据另一实例,在上述化学式1中,R
根据又一实例,在上述化学式1中,R
本发明的化学式1的化合物、其立体异构体或其药学上可接受的盐可以通过核因子κB的活性来抑制生物体炎症反应系统的初期通路及过程并调节炎性免疫细胞及炎性细胞因子。尤其,在核因子κB的调解中能够显出调节典型(Canonical)及非典型通路(non-canonicalpathway)的双重抑制(Dualinhibition)的作用。例如,可以通过这种方式通过对重症细胞因子释放综合征(CRS)和/或细胞因子风暴等急性炎症反应的抑制作用来显出疾病的治疗效果。尤其,可以通过选择性地与作为核因子κB炎性信号传导过程的典型及非典型的共同主要因子的IKKα结合来在炎症疾病的治疗中显出优秀效果。
因此,本发明的化学式1的化合物、其立体异构体或其药学上可接受的盐可以有用地用在炎症疾病的预防或治疗中。
在本发明中,上述炎症疾病可以为选自由皮肤炎、细胞因子释放综合征、细胞因子风暴、过敏、鼻腔息肉、鼻炎、慢性鼻窦炎、鼻充血、鼻瘙痒症、哮喘、慢性阻塞性肺疾病、类风湿关节炎、结膜炎、角膜结膜炎、眼炎、眼球干燥症、心衰、心律不齐、动脉粥样硬化症、多发性硬化病、炎性肠疾病、炎性疼痛、神经性疼痛、骨关节炎疼痛、红斑狼疮、败血症、克罗恩病、痛风、干燥综合征、阿尔茨海默病、帕金森病、甲状腺自身免疫疾病、多发性硬化病、吉兰巴雷综合征、自闭症、溶血性止血异常、甲状腺炎、桥本氏病、毒性弥漫性甲状腺肿、强直性脊柱炎、风湿性多肌病、乳糜泻、溃疡性大肠炎、1型糖尿病、末梢神经病变、糖尿病性末梢神经病变、韦格纳肉芽肿、肌萎缩、纤维肌肉疼痛、系统性红斑狼疮、白塞病、葡萄膜炎、肾小球肾炎、肺出血-肾炎综合征、自身免疫性多内分泌腺病综合征、查格-斯特劳斯综合征、亨诺-许兰综合征、结节性动脉周围炎、高安动脉炎、颞动脉炎、复发性多软骨炎、原发性脱发、严重急性呼吸系统综合征冠状病毒2型感染疾病及嗜睡症组成的组中的一种以上。
根据本发明,上述炎症疾病可以为皮肤炎。
皮肤炎可以为例如选自由特异性皮炎、接触性皮炎、过敏性皮炎、痤疮、湿疹、玫瑰痤疮、脂溢性皮肤、银屑病、湿疹、瘙痒症(prurtis)、皮肤瘙痒症、荨麻疹、特发性慢性荨麻疹、硬皮症、白癜风、皮肤硬化症、白塞病及接触传染性脓疱疮组成的组中的一种以上。
在本发明中,细胞因子释放综合征和/或细胞因子风暴为能够因感染或特定药物等多种因素诱发的全身炎症反应综合征的一种。
更具体地,本发明的细胞因子释放综合征和/或细胞因子风暴可以为因病毒感染引起的细胞因子释放综合征和/或细胞因子风暴。
例如,上述病毒可以为选自由流感病毒(influenzavirus)、甲型流感病毒H1N1亚型(InfluenzaAvirussubtypeH1N1)、禽流感病毒(avianinfluenzavirus)、鼻病毒(rhinovirus)、腺病毒(adenovirus)、冠状病毒(coronavirus)、中东呼吸综合症冠状病毒(MERSCoronaVirus)、严重急性呼吸系统综合征冠状病毒2型(Severeacuterespiratorysyndromecoronavirus2)、副流感病毒(parainfluenzavirus)、呼吸道合胞病毒(respiratorysyncytialvirus)、疱疹病毒(Herpesvirus,HSV)、人获得性免疫缺陷病毒(humanimmunodeficiencyvirus,HIV)及肝炎病毒组成的组中的一种以上。
本发明的化学式1的化合物、其立体异构体或其药学上可接受的盐可以在核因子κB的调节中通过均调节典型及非典型通路的双重抑制作用来抑制迅速发病的细胞因子风暴,从而可以在疾病治疗中显出优秀的效果。尤其,对于严重急性呼吸系统综合征冠状病毒2型(Severeacuterespiratorysyndromecoronavirus 2)等急剧的炎症反应,特别是对细胞因子风暴成为问题的病毒感染显出优秀的治疗及改善效果。
根据本发明,上述炎症疾病可以为败血症。
根据本发明,上述炎症疾病可以为严重急性呼吸系统综合征冠状病毒2型感染疾病。
在本发明中,本发明的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以通过抑制核因子κB的活性来抑制细胞因子释放综合征及细胞因子风暴或显出抗炎活性。尤其,本发明的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以在核因子κB的调节中显出均调节典型及非典型通路的双重抑制作用。并且,可以通过选择性地与作为核因子κB炎性信号传导过程的重要因子的IKKα结合抑制活性结构的形成来抑制核因子κB的信号传导过程。
在本发明中,本发明的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以通过抑制p65的磷酸化来显出抗炎活性。
在本发明中,本发明的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以通过减少炎性免疫细胞的数量来显出抗炎活性。
在本发明中,本发明的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以通过抑制炎性细胞因子的表达来显出抗炎活性。
在本发明中,本发明的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以通过抑制炎症反应引起的表皮增生来在皮肤炎中显出尤为优秀的抗炎效果。
在本发明中,本发明的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以在抑制细胞因子释放综合征(CRS)及细胞因子风暴的同时强力抑制肺中的炎症反应,从而可以作为对败血症的治疗剂而显出优秀的效果。
并且本发明的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以通过抑制细胞因子释放综合征及细胞因子风暴的同时具有的优秀的抗炎效果来在以细胞因子风暴以及肺中的强烈炎症反应为问题的严重急性呼吸系统综合征冠状病毒2型感染疾病中显出优秀的治疗效果。
并且,本发明提供包含由上述化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐的用于预防或改善炎症疾病的食品组合物、饲料组合物或保健功能食品。
并且,本发明提供包含由上述化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐的用于预防或改善皮肤炎的化妆品组合物。
并且,本发明提供包含由上述化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐的用于缓解皮肤刺激和/或皮肤炎症的化妆品组合物。
发明效果
本发明的苯并呋喃基N-酰腙化合物通过抑制炎症反应中作为主要信号传导物质的核因子κB的活性来抑制生物体炎症反应系统的初期通路及过程并抑制炎性免疫细胞及炎性细胞因子,从而可以有用地用作能够预防并治疗因炎症反应引起的多种病理学疾病的药物组合物、食品组合物、饲料组合物、保健功能食品或化妆品组合物。
附图说明
图1为通过核因子κB报告基因分析(assay)确认本发明的实施例的化合物的炎症反应抑制功效的结果。
图2为确认本发明的实施例的化合物的核因子κB信号通路抑制效果的结果。
图3为确认本发明的实施例化合物在核因子κB的通路(pathway)中抑制相关因子的表达的结果。
图4示出对皮肤炎诱发模型处理本发明的实施例化合物后通过肉眼确认炎症抑制效果的结果。
图5示出对皮肤炎诱发模型处理本发明的实施例化合物后通过苏木精伊红(H&E)染色确认抑制表皮增生的结果。
图6示出对皮肤炎诱发模型处理本发明的实施例化合物后确认炎性免疫细胞的数量减少的结果。
图7示出对皮肤炎诱发模型处理本发明的实施例化合物后确认炎性细胞因子的表达减少的结果。
图8示出确认本发明的实施例化合物均调节典型及非典型通路的结果。
图9示出确认本发明的实施例化合物选择性地与IKKα结合的结果。
图10示出确认本发明的实施例化合物抑制IKKα的六聚体(Hexamer)形成的结果。
图11示出确认本发明的实施例化合物在细胞因子风暴模型(基于败血症模型)中抑制因败血症的死亡率以及炎性细胞因子与趋化因子的表达抑制效果的结果。
具体实施方式
以下,更为详细地说明本发明。
在本说明书中,除非另行提及,否则术语“卤素”是指F、Cl、Br或I。
除非另有说明,否则术语“烷基”是指直链或支链饱和的烃残基。例如,“C
除非另有说明,否则术语“烷氧基”是指直链或支链烷基-氧基残基。例如,“C
术语“卤代烷基”或“卤代烷氧基”是指被一个以上的卤素取代的烷基或烷氧基。具体地,卤代烷基或卤代烷氧基可以为取代一个以上的同种或异种的卤素的烷基或烷氧基。
术语“取代”是指以在不超出指定的原子上的原子价(valence)的同时通过这种取代成为化学上稳定的化合物的方式由取代基代替分子结构体中的氢原子。例如,“A基团被B取代基取代”是指与组成A基团的骨架的碳等的原子结合的氢原子被B取代基代替而使A基团与B取代基形成共价键。
本发明提供包含由下述化学式1表示的化合物、其立体异构体或其药学上可接受的盐的用于预防或治疗炎症疾病的药物组合物。
化学式1:
在上述式中,R
上述C
并且,上述C
并且,上述卤代C
根据一实例,在上述化学式1中,R
根据再一实例,在上述化学式1中,R
根据另一实例,在上述化学式1中,R
根据还有一实例,在上述化学式1中,R
根据又一实施例,在上述化学式1中,R
上述化学式1的化合物的具体例如下。
1(化合物7).(E)-N'-[(2-氯-1H-吲哚-3-基)亚甲基]-5-甲基苯并呋喃-2-碳酰肼;
2(化合物13).(E)-N'-[(2-氯-1-甲基-1H-吲哚-3-基)亚甲基]-5-甲基苯并呋喃-2-碳酰肼;
3(化合物12).(E)-2-{2-氯-3-[(2-(5-甲基苯并呋喃-2-羰基)亚肼基)甲基]-1H-吲哚-1-基}乙酸乙酯;
4(化合物1).(E)-N'-{[2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼;
5(化合物14).(E)-N'-{[2-溴-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼;
6(化合物15).(E)-N'-{[1-(2-乙氧基乙基)-2-(三氟甲基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼;
7(化合物19).(E)-N'-{[2-氯-1-(2-甲氧基乙基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼;
8(化合物2).(E)-N'-{[2-氯-1-(2-乙氧基乙基)-5-甲氧基-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼;
(化合物6).(E)-N'-{[2-氯-1-(2-乙氧基乙基)-6-甲氧基-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼;
10(化合物5).(E)-N'-{[2-氯-1-(2-乙氧基乙基)-5-氟-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼;
11(化合物9).(E)-N'-{[2,5-二氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼;
12(化合物3).(E)-N'-{[2-氯-1-(2-乙氧基乙基)-5-(三氟甲氧基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼;
13(化合物8).(E)-N'-{[2-氯-1-(2-乙氧基乙基)-5-甲基-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼;
14(化合物16).(E)-N'-{[2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-5-甲氧基苯并呋喃-2-碳酰肼;
15(化合物17).(E)-N'-{[2-氯-1-(2-乙氧基乙基)-5-甲氧基-1H-吲哚-3-基]亚甲基}-5-甲氧基苯并呋喃-2-碳酰肼;
16(化合物20).(E)-5-氯-N'-{[2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}苯并呋喃-2-碳酰肼;
17(化合物21).(E)-N'-{[2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-4,7-二甲基苯并呋喃-2-碳酰肼;
18(化合物22).(E)-N'-{[2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-4,6-二甲氧基苯并呋喃-2-碳酰肼;
19(化合物18).(E)-N'-{2-[2-((2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基)亚甲基]肼-1-羰基}苯并呋喃-5-基)乙酰胺;以及
20(化合物23).(E)-乙基-2-(3-((2-(4,6-二甲氧基苯并呋喃-2-羰基)亚肼基)甲基)-2-甲基-1H-吲哚-1-基)乙酸酯。
21(化合物10).(E)-2-(2-甲基-3-((2-(5-甲基苯并呋喃-2-羰基)亚肼基)甲基)-1H-吲哚-1-基)乙酸乙酯。
22(化合物11).(E)-2-(3-((2-(5-氯苯并呋喃-2-羰基)亚肼基)甲基)-2-甲基-1H-吲哚-1-基-乙酸乙酯。
23(化合物4).(E)-2-(2-氯-3-((2-(5-甲基苯并呋喃-2-羰基)亚肼基)甲基)-1H-吲哚-1-基)乙酸甲酯。
上述化合物(以化合物No.为基准)的结构式如下表所示。
/>
更具体地,本发明的由化学式1表示的化合物可以为由下述化学式2表示的化合物。
化学式2:
在上述式中,R
上述R
在具体例示中,R
本发明包含上述化学式1的化合物的药学上可接受的盐。
上述药学上可接受的盐对人体应具有低毒性,不应对母体化合物的生物活性及物理特性具有任意的不利影响。
例如,上述药学上可接受的盐可以为通过药学上可接受的游离酸(freea cid)形成的酸加成盐。
上述游离酸可使用无机酸或有机酸,此时,无机酸可以为盐酸、硫酸、硝酸、磷酸、高氯酸、溴酸等,有机酸可以为乙酸、甲磺酸、乙磺酸、对甲苯磺酸、富马酸、马来酸、丙二酸、邻苯二甲酸、琥珀酸、乳酸、柠檬酸、葡萄糖酸、酒石酸、水杨酸、苹果酸、草酸、苯甲酸、扑酸、天冬氨酸、谷氨酸等。
上述酸加成盐可通过通常的方法制备,例如,将上述化学式1的化合物溶解在过量的酸水溶液,可通过使用如甲醇、乙醇、丙酮或乙腈的水溶性有机溶剂沉淀上述盐来制备。
并且,上述药学上可接受的盐可以为碱金属盐(钠盐等)或碱土金属盐(钾盐等)。
上述碱金属盐或碱土金属盐可通过如下的方式获得,例如,将上述化学式1的化合物溶解在过量的碱金属氢氧化物或碱土金属氢氧化物溶液中,过滤未溶解的化合物盐后,蒸发及干燥滤液来获得。
上述药学上可接受的盐可以根据一下食品、饲料、化妆品等的用途适当地变更为食品学上可接受的盐、化妆品学上可接受的盐来使用。
并且,本发明的化合物可具有手性碳中心,由此,R或S能够以异构体、外消旋化合物、单独的对映异构体或混合物、单独的非对映异构体或混合物形式存在,这种所有立体异构体及它们的混合物可属于本发明的范畴。立体异构体可以利用公知排列的工学上纯粹的起始物质和/或试剂以立体特异性来合成。
并且,本发明的化合物可包含上述化学式1的化合物的水合物及溶剂化物。上述水合物及溶剂化物可通过公知的方法制备,优选为无毒性及水溶性的。尤其,优选地,上述水合物及溶剂化物分别可以为与水及醇类溶剂(尤其,乙醇等)的1个至5个分子结合的水合物及溶剂化物。
本发明的化合物,即,上述化学式1的化合物、其立体异构体或其药学上可接受的盐显出高的体内稳定性及溶解度,具有生物体利用率优秀的特性。这样的上述化学式1的化合物、其立体异构体或其药学上可接受的盐可以通过调节作为炎症反应的主要信号传导物质的核因子κB抑制生物体炎症反应系统的初期通路及过程来预防并治疗因炎症反应发生的多种病理学疾病。
上述由化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以有用地用在炎症疾病的预防或治疗中。
本申请中使用的术语“炎症疾病”是指以疼痛(因有害物质的生成及神经刺激引起的疼痛)、发热(因血管扩张引起的发热)、发红(因血管扩张及血流增加引起的潮红)、肿胀(因流体的过度流入或受限的流出引起的肿瘤)以及功能丧失(部分或完全、临时或永久的功能丧失)的症候的一个以上为特征的状态。
可以使用本发明的化学式1的化合物的炎症疾病的非限制例包括皮肤炎、细胞因子释放综合征、细胞因子风暴、过敏、鼻腔息肉、鼻炎、慢性鼻窦炎、鼻充血、鼻瘙痒症、哮喘、慢性阻塞性肺疾病、类风湿关节炎、结膜炎、角膜结膜炎、眼炎、眼球干燥症、心衰、心律不齐、动脉粥样硬化症、多发性硬化病、炎性肠疾病、炎性疼痛、神经性疼痛、骨关节炎疼痛、红斑狼疮、败血症、克罗恩病、痛风、干燥综合征、阿尔茨海默病、帕金森病、甲状腺自身免疫疾病、多发性硬化病、吉兰巴雷综合征、自闭症、溶血性止血异常、甲状腺炎、桥本氏病、毒性弥漫性甲状腺肿、强直性脊柱炎、风湿性多肌病、乳糜泻、溃疡性大肠炎、1型糖尿病、末梢神经病变、糖尿病性末梢神经病变、韦格纳肉芽肿、肌萎缩、纤维肌肉疼痛、系统性红斑狼疮、白塞病、葡萄膜炎、肾小球肾炎、肺出血-肾炎综合征、自身免疫性多内分泌腺病综合征、查格-斯特劳斯综合征、亨诺-许兰综合征、结节性动脉周围炎、高安动脉炎、颞动脉炎、复发性多软骨炎、原发性脱发、嗜睡症、严重急性呼吸系统综合征冠状病毒2型感染疾病感染疾病等,但不限定于此。
在本发明的一实施方式中,上述由化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以有用地用在细胞因子释放综合征和/或细胞因子风暴的治疗中。
细胞因子释放综合征和/或细胞因子风暴为能够通过感染或特定药物等多种因素诱发的全身炎症反应综合征的一种。
炎性细胞因子的上升的数值也可以作为上述综合征的症状。例如,以T NF-α、IFN-γ、IL-1β、IL-2、IL-6、IL-8、IL-10、IL-13、GM-CSF、IL-5、Fractalkine或在它们的组合或它们的下游组合中的增加为特征。
更具体地,本发明的细胞因子释放综合征和/或细胞因子风暴可以为因病毒感染引起的细胞因子释放综合征和/或细胞因子风暴。
例如,上述病毒可以为选自由流感病毒、甲型流感病毒H1N1亚型、禽流感病毒、鼻病毒、腺病毒、冠状病毒、中东呼吸综合症冠状病毒、严重急性呼吸系统综合征冠状病毒2型、副流感病毒、呼吸道合胞病毒、疱疹病毒、人获得性免疫缺陷病毒及肝炎病毒组成的组中的一种以上。
本发明的化学式1的化合物、其立体异构体或其药学上可接受的盐可以在核因子κB的调节中通过均调节典型及非典型通路的双重抑制作用来抑制迅速发病的细胞因子风暴,从而可以在疾病治疗中显出优秀的效果。尤其,对于严重急性呼吸系统综合征冠状病毒2型等急剧的炎症反应,特别是对细胞因子风暴成为问题的病毒感染显出优秀的治疗及改善效果。
在本发明的一实施方式中,炎症疾病可以为皮肤炎。在本发明中,上述皮肤炎包括选自由特异性皮炎、接触性皮炎、过敏性皮炎、痤疮、湿疹、玫瑰痤疮、脂溢性皮肤、银屑病、湿疹、瘙痒症、皮肤瘙痒症、荨麻疹、特发性慢性荨麻疹、硬皮症、白癜风、皮肤硬化症、白塞病及接触传染性脓疱疮组成的组中的一种以上,但不限定于此。
在本发明的一实施方式中,皮肤炎可以为特异性皮炎。在本发明中年,术语“特异性皮炎”是指炎症性且复发性的非传染性的瘙痒性慢性皮肤障碍。
根据发生的场所或其外观或诱发其的胁迫因素来赋予名称的特定形态的特异性皮炎也包括在本发明的术语“特异性皮炎”中。特异性皮炎显出干燥的湿疹性皮肤、丘疹、严重的瘙痒感等症状,在特异性皮炎患者的病变样品中确认到表皮增生(epidermalhyperplasia)、表皮增殖以及淋巴细胞与肥大细胞的集聚等。特异性皮炎患者通常患有严重的瘙痒症,由此诱发皮肤病变的炎症而进一步恶化瘙痒症,从而使临床症状进一步恶化。
根据本发明,上述炎症疾病可以为败血症。
对于显出急剧炎症反应的细胞因子风暴和/或重症细胞因子综合征症状的败血症,本发明的上述由化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐抑制炎性细胞因子或趋化因子的表达,显出抗炎作用,从而显出抑制败血症引起的死亡或疾病的发展的效果。
根据本发明,上述炎症疾病可以为严重急性呼吸系统综合征冠状病毒2型感染疾病。严重急性呼吸系统综合征冠状病毒2型感染引起的疾病可以为呼吸道中的炎症疾病。上述严重急性呼吸系统综合征冠状病毒2型感染疾病可以在经过例如感染病毒后2天至14天的潜伏期后显出症状。这些症状包括例如高热、咳嗽、喘息、肺炎、腹泻等胃肠道症状、器官功能衰竭(肾衰、肾脏功能障碍等)、败血性休克,严重时还包括死亡,包括所有因上述病毒感染发生的症状。尤其,上述严重急性呼吸系统综合征冠状病毒2型感染疾病的引起死亡的大多数症状与细胞因子风暴和/或重症细胞因子综合征的症状关联性高。本发明的由上述化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以选择性地与作为核因子κB炎性信号传导过程的重要因子的IKKα结合来抑制活性结构的形成,可以通过均调节典型及非典型通路的双重抑制作用抑制并治疗上述细胞因子风暴和/或重症细胞因子综合征的症状。
本发明的由上述化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以通过抑制核因子κB的活性来抑制细胞因子风暴和/或细胞因子综合征的症状并显出抗炎症活性,但不限定于此。
本发明的上述苯并呋喃基N-酰腙化合物通过基于细胞的报告基因(rep orter)分析确认到对作为炎症反应调节的主要信号传导体系的核因子κB炎症反应通路的抑制效果,确认到通过抑制作为核因子κB信号传导过程的重要因子的p65的磷酸化来显出抗炎症活性。
本发明的上述苯并呋喃基N-酰腙化合物通过选择性地与作为核因子κB炎性信号传导过程的重要因子的IKKα结合来抑制活性结构的形成。
本发明的上述苯并呋喃基N-酰腙化合物可以通过调节核因子κB的典型及非典型通路的双重抑制作用抑制并治疗细胞因子风暴和/或重症细胞因子综合征的症状。
尤其在可能在肺中发生的急剧的炎性细胞因子的增加或因败血症引起的炎症反应数值的增加等中,上述双重抑制作用在相关疾病的治疗中显出相当优秀的效果。
本发明的由上述化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐可以通过减少炎性免疫细胞的数量来显出抗炎症活性,并且,可以通过抑制炎性细胞因子的表达来显出抗炎症活性。
尤其,在皮肤等中可以通过抑制因炎症发生的表皮增生来显出优秀的治疗功效。
本发明的药物组合物还可以包含一种以上显出抗炎症或抗病毒活性的有效成分。
本发明的组合物还可以包含药剂学上可接受的添加剂,在此情况下,药剂学上可接受的添加剂添加剂可以使用淀粉、明胶化淀粉、微晶纤维素、乳糖、聚维酮、胶体二氧化硅、磷酸氢钙、乳糖、甘露醇、麦芽糖、阿拉伯胶、预糊化淀粉、玉米淀粉、粉末纤维素、羟丙基纤维素、欧巴代、淀粉乙醇酸钠、棕榈蜡、合成硅酸铝、硬脂酸、硬脂酸镁、硬脂酸铝、硬脂酸钙、白糖、葡萄糖、山梨糖醇及滑石等。优选地,相对于上述组合物,包含0.1重量份~90重量份的本发明的药剂学上可接受的添加剂,但不限定于此。
即,本发明的组合物在实际临床给药时能够以口服及胃肠外的多种剂型给药,在配制时可以使用通常使用的填充剂、增量剂、结合剂、湿润剂、崩解剂、表面活性剂等稀释剂或者赋形剂来制备。用于口服给药的固体制剂包括片剂、丸剂、散剂、颗粒剂、胶囊剂等,这样的固体制剂在天名精提取物中至少混合一种以上的赋形剂,例如混合淀粉、碳酸钙(Calciumcarbo nate)、蔗糖(Sucrose)、乳糖(Lactose)或明胶等来制备。并且,出单纯的赋形剂以外,还可以使用硬脂酸镁、滑石等润滑剂。用于口服的液体制剂有悬浮剂、内溶液剂、乳剂及糖浆剂等,除作为单纯稀释剂的水、液体石蜡以外,还可以包含多种赋形剂,例如湿润剂、甜味剂、芳香剂、保存剂等。用于胃肠外给药的制剂中可以包括灭菌的水溶液、非水性溶剂、悬浮剂、油剂、冷冻干燥制剂、栓剂。非水性溶剂、悬浮溶剂可以使用丙二醇(Propyleneglycol)、聚乙二醇、橄榄油等植物油、油酸乙酯等可注射的酯类等。栓剂的基剂可以使用witepsol、聚乙二醇、吐温(tween)61、可可脂、月桂酸甘油酯、甘油明胶等。
本发明的组合物可以根据所目标的方法来口服给药或胃肠外给药,胃肠外给药可以选择经皮给药、皮肤外用、腹腔内注射、职场内注射、皮下注射、静脉注射、肌肉内注射或胸部内注射方式,例如,可以经皮给药。给药量的范围根据患者的体重、年龄、性别、健康状态、饮食、给药时间、给药方法、代谢率及疾病的严重程度等的不同而多种多样。
本发明的组合物以药剂学上有效的量来给药。在本发明中,“药剂学上有效的量”是指以能够适用于医学治疗的合理的收益/风险比例来治疗疾病的充分的量,有效剂量的水平可以根据包括患者的种类、疾病严重程度、药物的活性、对药物的敏感度、给药时间、给药途径及代谢比例、治疗期间、同时使用的药物在内的因素及其他医学领域中众所周知的因素来决定。本发明的组合物能够以单独的治疗剂给药或者与其他治疗剂联合给药,可以与现有的治疗剂依次给药或同时给药,可以单次给药或多次给药。重要的在于,在考虑上述所有因素后以能够以无副作用的最小的量获得最大效果的量给药,这可以通过相关从业人员轻易决定。
具体地,本发明的化合物的有销量可以根据患者的年龄、性别、体重的不同而不同,通常能够以每kg体重给药0.1mg至100mg,优选地,能够以每日0.5mg至10mg,隔日或一周1次至5次给药,或者一天分为1次至5次来给药。但可以根据给药途径、疾病的严重程度、性别、体重、年龄的不同来增减,上述给药量无论在任何方面也不是限定本发明的范围。
本发明的化合物或包含其的药物组合物可以用作抗炎剂。
因此,本发明提供将上述化学式1的化合物、其立体异构体或其药学上可接受的盐用于炎症疾病的预防或治疗的用途。
并且,本发明提供将上述化学式1的化合物、其立体异构体或其药学上可接受的盐用于制备用于预防或治疗炎症疾病的药剂的用途。
并且,本发明提供预防或治疗炎症疾病的方法,包括向有需要的对象给药上述化学式1的化合物、其立体异构体或其药学上可接受的盐的步骤。
其中,“预防”是指通过给药上述化合物来抑制或延迟上述疾病的发生、扩散及复发的所有行为,“治疗”是指通过给药上述化合物来改善或有益地改变上述疾病的所有行为。
其中,“需要的对象”是指已患有或可能患有上述疾病的包括人(患者)在内的猴牛、马、羊、猪、鸡、火鸡、鹌鹑、猫、狗、小鼠、大鼠、兔、豚鼠等的所有动物,具体地,是指哺乳动物。并且,上述需要的对象可指生物试样(biologicalsample)。
并且,“给药”是指通过任意适当的方法向需要的对象提供规定物质,本发明的化合物的给药通路可通过能够到达靶组织的任意常规通路给药。
本发明的由化学式1表示的苯并呋喃基N-酰腙化合物通过抑制核因子κB炎症反应的途径,抑制作为核因子κB信号传导过程的重要因子的p65(RelA)的磷酸化来来显出优秀的抗炎症功效。并且,通过减少炎性免疫细胞的数量并抑制炎性细胞因子的表达来显出抗炎活性。
本发明还提供用于预防或治疗炎症疾病的上述化学式1的化合物、其立体异构体或其药学上可接受的盐。
本发明还提供上述化学式1的化合物、其立体异构体或其药学上可接受的盐在制备用于治疗炎症疾病的药剂中的用途。
因此,包含上述学式1的化合物、其立体异构体或其药学上可接受的盐的组合物可以有用地用作用于预防或改善炎症疾病的食品组合物。
在本发明中,上述食品组合物包括保健功能食品。
本发明的上述食品组合物还可以包含其他食品组合物、保健功能食品或饮料中通常所含的添加剂等。
例如,本发明的食品组合物可以包含白糖、结晶果糖、葡萄糖、D-山梨糖醇、甘露醇、低聚异麦芽糖、甜菊糖甙、阿巴斯甜、乙酰磺氨酸钾、蔗糖等甜味剂、无水柠檬酸、DL-苹果酸、琥珀酸及其盐等酸味剂、安息香酸及其衍生物等保存剂、多种营养剂、维生素、矿物质(电解质)、合成风味剂及天然风味剂等风味剂、着色剂及增稠剂(奶酪、巧克力等)、果胶酸及其盐、海藻酸及其盐、有机酸、保护性果胶增稠剂、pH调节剂、稳定剂、防腐剂、甘油、酒精、碳酸饮料中使用的碳酸化剂等。并且本发明的食品组合物可以含有天然果汁及用于制备蔬菜饮料的果肉。上述添加剂的比例可以在每100重量份的食品组合物中约20重量份以下的范围来使用。
在本发明的食品组合物为饮料的情况下,还可以包含饮料中通常包含的香味剂或天然碳水化合物。上述天然碳水化合物可以为葡萄糖、果糖等单糖、麦芽糖、蔗糖等二糖、糊精、环糊精等多糖,或者木糖醇、山梨糖醇、赤藓糖醇等糖醇。并且上述香味剂可以为索马甜、甜叶菊提取物提取物(莱包迪苷A、甘草酸等)的天然香味剂,或者糖精、阿巴斯甜等合成香味剂。在上述食品组合物为饮料的情况下,通常每100mL的组合物包含约1g至20g的天然碳水化合物,优选地,包含约5g至12g。
本发明的上述食品组合物可以制备为粉末、颗粒、片剂、胶囊或者饮料的形态,利用为食品类、饮料、口香糖、茶、维生素复合物、保健辅助食品类。
本发明的由化学式1表示的苯并呋喃基N-酰腙化合物通过抑制核因子κB炎症反应的途径,抑制作为核因子κB信号传导过程的重要因子的p65(R elA)的磷酸化来显出优秀的抗炎症功效。并且,通过减少炎性细胞因子的高表达来改善或预防细胞因子释放综合征、细胞因子风暴等的发病。
因此,包含本发明的由化学式1表示的苯并呋喃基N-酰腙化合物的组合物可以有用地用作用于预防或改善炎症疾病的饲料组合物。
在本发明中,上述饲料可以为昆虫类、鱼类、禽类或哺乳类的饲料,优选地,可以为韩国畜产法第二条第一款及该法实施条例第二条各款中定义的通过驯化野生习性来适于饲养并可以期待增大农业所得的家畜或水产品的饲料。上述家畜可以为牛、马、骡、驴、山羊、绵羊、鹿、猪、兔,家禽类可以为鸡、火鸡、鸭、鸵鸟、鹅、鹌鹑等,优选地,可以为鸡,只要是适于通过饲养来获得畜产品的就不受限制。上述“畜产品”是指韩国畜产法第二条第三款定义的家畜生产的肉、乳、蛋、蜜及它们的加工品、原皮(包括原毛皮)、原毛、其他家畜的生产物,是指农林部法令规定的。并且,还可以包括狗、猫等宠物,但不限定于此。
本发明的术语“饲料”是指用于供动物吃、摄取、消化或者适于其的天然或人造规定式、单次式或上述单次式的成分。作为一实施方式,本发明的包含大麦虫幼虫提取物的饲料用组合物中可以包含精饲料、粗饲料和/或特殊饲料。
精饲料可以为包括小麦、燕麦、玉米等谷类的种子类,包括作为通过精制谷物来获得的副产物的米糠、麦麸、大麦麸等在内的麸皮类,榨取大豆、油菜、芝麻、亚麻籽、椰子等后获得的副产品的油渣类,以及从红薯、马铃薯等中抽取淀粉后剩余的作为淀粉渣滓的主要成分的残余淀粉类等残渣、鱼粉、鱼残渣、作为浓缩从鱼类中获得新鲜液体的鱼汁、肉粉、血粉、羽毛粉、脱脂奶粉、干燥作为从牛奶中制备奶酪、从脱脂乳中制备干酪素时的残液的乳水(whey)的干燥乳清等动物性饲料、酵母、小球藻、海藻类等。
粗饲料有野草、牧草、青刈等生草饲料、饲料用芜菁、饲料用甜菜、作为一种萝卜的芜菁甘蓝等的根茎蔬菜类、作为将青草、青刈作物、谷物等放入筒仓中乳酸发酵的储存饲料的青贮饲料(silage)、将野草、牧草切割干燥的干草、种畜用作物的秸秆、豆科植物的叶等。特殊饲料有牡蛎壳、岩盐等矿物饲料、作为尿素或其衍生物的二脲异丁烷等的尿素饲料、补充仅以天然饲料原料配制时易于缺乏的成分、为提高饲料的储存性而向配合饲料中微量添加的饲料添加物。
本发明的由化学式1表示的苯并呋喃基N-酰腙化合物通过抑制核因子κB炎症反应的途径,抑制作为核因子κB信号传导过程的重要因子的p65(R elA)的磷酸化来显出优秀的抗炎症功效。并且,通过减少炎性细胞因子的高表达来改善或预防细胞因子释放综合征、细胞因子风暴等的发病。
因此,本发明可以提供包含上述由化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐的用于预防或改善皮肤炎的化妆品组合物。并且,本发明可以提供包含上述由化学式1表示的苯并呋喃基N-酰腙化合物、其立体异构体或其药学上可接受的盐的用于缓解皮肤刺激和/或皮肤炎症的化妆品组合物。
在本发明的说明书中,“皮肤损伤”是指可以通过细胞因子表达量的抑制、减少或降低来改善的,或者可以得到预防或促进恢复的任意的皮肤损伤。在本发明的说明书中,“皮肤刺激”是指因任意的刺激引起瘙痒、发热、红斑及皮肤浮肿等任意的可能在皮肤中发生的刺激。
本发明的化妆品组合物可以制备为相关领域中通常制备的任意剂型,例如,可以配制为溶液、悬浮液、乳浊液、化妆膏、凝胶、霜剂、乳液、粉、香皂、含表面活性剂的洗剂、油、粉底霜、乳浊液粉底霜、蜡粉底霜及喷剂等,但不限定于此。更详细地,还可以制备为柔肤化妆水、营养化妆水、营养霜、按摩霜、精华素、眼霜、洁面霜、洁面泡泡、洁面水、面膜、喷剂或粉的剂型。
在本发明的剂型为膏、霜剂或凝胶的情况下,可以利用动物油、植物油、蜡、石蜡、淀粉、黄芪胶、纤维素衍生物、聚乙二醇、硅酮、膨润土、二氧化硅、滑石或氧化锌等作为载体成分。
在本发明的剂型为粉或喷剂的情况下,载体成分可以使用乳糖、滑石、二氧化硅、氢氧化铝、硅酸钙或聚酰胺粉,尤其,在喷剂的情况下,还可以包含氯氟代烃、丙烷/丁烷或二甲基醚等喷射剂。
在本发明的剂型为溶液或乳浊液的情况下,载体成分可以使用溶剂、溶解剂或乳化剂,例如,有水、乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇油、甘油脂肪族酯、聚乙二醇或山梨醇酐的脂肪酸酯。
在本发明的剂型为悬浮液的情况下,载体成分可以利用水、乙醇或丙二醇等液体的稀释剂、乙氧基化的异十八醇、聚氧乙烯山梨醇酯及聚氧乙烯山梨糖醇酐酯等悬浮剂、微晶纤维素、氢氧化铝、苯甲酸盐、琼脂或黄芪胶等。
在本发明的剂型为含表面活性剂的洗剂的情况下,载体成分可以利用脂肪醇硫酸盐、脂肪醇醚硫酸盐、磺基琥珀酸单酯、羟乙磺酸盐、咪唑衍生物、甲基牛磺酸、肌氨酸盐、脂肪酸酰胺醚硫酸盐、椰油酰胺丙基甜菜碱、脂肪醇、甘油脂肪酸酯、脂肪酸二乙醇酰胺、植物油、羊毛脂衍生物或乙氧基化的甘油脂肪酸醚等。
以下,提出优选实施例以助于对本发明的理解,但下述实施例仅用于例示本发明,本发明所属技术领域的普通技术人员应该明白的是,在本发明的范畴及技术思想范围内可以有多种变更及修正,这些变更及修正也当然应该包括在随附的发明要求保护范围中。
在下述实施例中使用的缩写的定义如下。
EA:乙酸乙酯EtOH:乙醇
DMF:二甲基甲酰胺 n-Hex:正己烷
PrOH:丙醇DMSO:二甲基亚砜
Et:乙基
制备芳香族取代的苯并呋喃-2-碳酰肼衍生物
制备例1:5-甲基苯并呋喃-2-羧酸乙酯
将5-甲基水杨醛(1.40g,10.3mmol)溶解在DMF(30mL)后,向其添加Ce
1
制备例2:5-甲基苯并呋喃-2-碳酰肼
/>
将在上述制备例1中获得的5-甲基苯并呋喃-2-羧酸乙酯(2.04g,10.0mm ol)溶解在EtOH(30mL)后,向其添加一水合肼(1.50g,30.0mmol)并回流24小时。利用水洗涤通过对反应溶液进行减压蒸馏来获得的固体后,进行干燥来获得了1.72g的标题化合物(收率为90%,白色固体)。
1
制备例3:5-甲氧基苯并呋喃-2-羧酸乙酯
将2-羟基-5-甲氧基苯甲醛(1.25mL,10.0mmol)溶解在DMF(30mL)后,向其添加K
1
制备例4:5-甲氧基苯并呋喃-2-碳酰肼
将在上述制备例3中获得的5-甲氧基苯并呋喃-2-羧酸乙酯(1.03g,4.68mmol)溶解在EtOH(30mL),向其添加一水合肼(702.8mg,14.04mmol)并回流24小时。利用CH
1
制备例5:5-氯苯并呋喃-2-碳酰肼
在0℃的温度下,向CH
1
制备例6:4,7-二甲基苯并呋喃-2-羧酸乙酯
将3,6-二甲基水杨醛(450.5mg,3.0mmol)溶解在DMF(30mL)后,向其添加Ce
1
制备例7:4,7-二甲基苯并呋喃-2-碳酰肼
将在上述制备例6中获得的4,7-二甲基苯并呋喃-2-羧酸乙酯(290.3mg,1.33mmol)溶解在EtOH(20mL)后,向其添加一水合肼(199.7mg,3.99mmol)并回流24小时。利用水洗涤通过对反应溶液进行减压蒸馏来获得的固体后,进行干燥来获得了236mg的标题化合物(收率为87%,白色固体)。
1
制备例8:4,6-二甲氧基苯并呋喃-2-羧酸乙酯
将4,6-二甲氧基水杨醛(499.2mg,2.74mmol)溶解在DMF(10mL)后,向其添加K
1
制备例9:4,6-二甲氧基苯并呋喃-2-碳酰肼
将在上述制备例8中获得的4,6-二甲氧基苯并呋喃-2-羧酸乙酯(450.5m g,1.80mmol)溶解在EtOH(20mL)后,向其添加一水合肼(450.5mg,9.0mmol)并回流6小时。过滤将反应溶液倒入冷水中来生成的固体后,利用乙醚洗涤并干燥,从而获得了360mg的标题化合物(收率为85%,白色固体)。
1
制备例10:5-乙酰氨基苯并呋喃-2-羧酸乙酯
将5-氨基苯并呋喃-2-羧酸乙酯(205.2mg,1.0mmol)溶解在DMF(3mL)后,向其添加(2-(1H-苯并三唑-1-基)-1,1,3,3-四甲基脲鎓六氟磷酸盐(HBTU,417.2mg,1.1mmol)、羟基苯并三唑(HOBt,148.6mg,1.1mmol)、N,N-二异丙基乙胺(DIEA,209.0μL,1.2mmol)及乙酸(63.0μL,1.1mmol),并在室温条件下反应15小时。利用水稀释反应溶液后,利用EA萃取。利用MgSO
1
制备例11:N-(2-(肼羰基)苯并呋喃-5-基)乙酰胺
将在上述制备例10中获得的5-乙酰氨基苯并呋喃-2-羧酸乙酯(514.3mg,2.08mmol)溶解在1-PrOH(20mL)后,向其添加一水合肼(312.4mg,6.24mmol)并回流24小时。利用n-Hex与CH
1
制备芳香族/N-取代的吲哚-3-甲醛衍生物
制备例12:2-氯-1-甲基-1H-吲哚-3-甲醛
在0℃的温度下,向2-氯-1H-吲哚-3-甲醛(359.2mg,2.0mmol)和NaH(120.0mg,3.0mmol,60%在油中(inoil))添加THF(20mL)并搅拌5分钟后,添加碘甲烷(149.4μL,2.4mmol),并在室温条件下搅拌5小时。利用水稀释反应溶液,并利用EA萃取。利用MgSO
1
制备例13:2-(2-氯-3-甲酰基-1H-吲哚-1-基)乙酸乙酯
在0℃的温度下,向2-氯-1H-吲哚-3-甲醛(200.0mg,1.11mmol)和NaH(66.8mg,1.67mmol,60%在油中)添加THF(10mL)并搅拌5分钟后,添加溴乙酸乙酯(147.5μL,1.33mmol),并在室温条件下搅拌7小时。利用水稀释反应溶液并利用EA萃取。利用MgSO
1
制备例14:2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛
将2-氯-1H-吲哚-3-甲醛(2.69g,15.0mmol)溶解在DMF(50mL)后,添加2-溴乙基乙醚(2.01mL,18.0mmol)和Cs
1
制备例15:2-氯-1-(2-甲氧基乙基)-1H-吲哚-3-甲醛
将2-氯-1H-吲哚-3-甲醛(538.8mg,3.0mmol)溶解在DMF(10mL)后,添加2-溴乙基甲基醚(422.6μL,4.5mmol)和Cs
1
制备例16:5-甲基氧基吲哚
向5-甲基靛红(1.50g,9.31mmol)添加乙二醇(10mL)后,添加KOH(522.4mg,9.31mmol)和一水合肼(1.40g,27.9mmol)并在140℃的温度下加热4小时。冷却反应溶液并利用1N的HCl酸化,之后利用EA萃取。对有机层进行减压蒸馏,通过柱色谱法(n-Hex∶EA=3∶2)分离残留物来获得了1.0g的标题化合物(收率为73%,浅棕色固体)。
1
制备例17:2-氯-5-甲基-1H-吲哚-3-甲醛
在0℃的温度下,向DMF(10mL)添加POCl
1
制备例18:2-氯-1-(2-乙氧基乙基)-5-甲基-1H-吲哚-3-甲醛
向2-氯-5-甲基-1H-吲哚-3-甲醛(440.0mg,2.27mmol)的CH
1
制备例19:2-氯-5-甲氧基-1H-吲哚-3-甲醛
在0℃的温度下,向DMF(10mL)添加POCl
1
制备例20:2-氯-1-(2-乙氧基乙基)-5-甲氧基-1H-吲哚-3-甲醛
将5-甲氧基-2-氯-1H-吲哚-3-甲醛(1.97g,9.40mmol)溶解在DMF(70mL)后,添加2-溴乙基乙醚(1.26mL,11.3mmol)和Cs
1
制备例21:6-甲氧基氧基吲哚
向6-甲氧基靛红(500mg,2.82mmol)添加乙二醇(10mL)后,添加KOH(158.2mg,2.82mmol)和一水合肼(282.3mg,5.64mmol)并在140℃的温度下加热4小时。冷却反应溶液并利用1N的HCl酸化后,利用EA萃取。对有机层进行减压蒸馏,通过柱色谱法(n-Hex∶EA=1∶1)分离残留物来获得了278mg的标题化合物(收率为60%,淡黄色固体)。
1
制备例22:2-氯-6-甲氧基-1H-吲哚-3-甲醛
在0℃的温度下,向DMF(5mL)添加POCl
1
制备例23:2-氯-1-(2-乙氧基乙基)-6-甲氧基-1H-吲哚-3-甲醛
将6-甲氧基-2-氯-1H-吲哚-3-甲醛(765.1mg,3.65mmol)溶解在DMF(15mL)后,添加2-溴乙基乙醚(489.2μL,4.38mmol)和Cs
1
制备例24:2-氯-5-氟-1H-吲哚-3-甲醛
在0℃的温度下,向DMF(5mL)添加POCl
1
制备例25:2-氯-1-(2-乙氧基乙基)-5-氟-1H-吲哚-3-甲醛
将2-氯-5-氟-1H-吲哚-3-甲醛(197.6mg,1.0mmol)溶解在DMF(5mL)后,添加2-溴乙基乙醚(134.0μL,1.2mmol)和Cs
1
制备例26:2,5-二氯-1H-吲哚-3-甲醛
在0℃的温度下,向DMF(5mL)添加POCl
1
制备例27:2,5-二氯-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛
向在上述制备例26中获得的2,5-二氯-1H-吲哚-3-甲醛(350mg,1.64mmo l)的CH
1
制备例28:5-(三氟甲氧基)氧基吲哚
向5-(三氟甲氧基)靛红(1.75g,7.57mmol)添加乙二醇(10mL)后,添加KOH(424.8mg,7.57mmol)和一水合肼(1.14g,22.7mmol)并在140℃的温度下加热4小时。冷却反应溶液,并利用1N的HCl酸化后,利用EA萃取。对有机层进行减压蒸馏,通过柱色谱法(n-Hex∶EA=1∶2)分离残留物来获得了855mg的标题化合物(收率为52%,浅棕色固体)。
1
制备例29:2-氯-5-(三氟甲氧基)-1H-吲哚-3-甲醛
在0℃的温度下,向DMF(1mL)添加POCl
1
制备例30:2-氯-1-(2-乙氧基乙基)-5-(三氟甲氧基)-1H-吲哚-3-甲醛
将2-氯-5-(三氟甲氧基)-1H-吲哚-3-甲醛(100mg,0.38mmol)溶解在DMF(3mL)后,添加2-溴乙基乙醚(51.4μL,0.46mmol)和Cs
1
制备例31:2-溴-1H-吲哚-3-甲醛
在0℃的温度下,向CH
1
制备例32:2-(2-溴-3-甲酰基-1H-吲哚-1-基)乙酸乙酯
在0℃的温度下,向在上述制备例31中获得的2-溴-1H-吲哚-3-甲醛(120.0mg,0.54mmol)和NaH(32.4mg,0.81mmol,60%在油中)添加THF(5mL)和DMF(2mL)并搅拌5分钟后,添加溴乙酸乙酯(72.1μL,0.65mmol)并在室温条件下搅拌15小时。利用水稀释反应溶液并利用EA萃取。利用Mg SO
1
制备例33:2-溴-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛
将在上述制备例31中获得的2-溴-1H-吲哚-3-甲醛(400.0mg,1.79mmol)溶解在DMF(10mL)后,添加2-溴乙基乙醚(240.1μL,2.15mmol)和Cs
1
制备例34:2-(三氟甲基)-1H-吲哚-3-甲醛
在0℃的温度下,向DMF(10mL)添加,POCl
1
制备例35:1-(2-乙氧基乙基)-2-(三氟甲基)-1H-吲哚-3-甲醛
将2-(三氟甲基)-1H-吲哚-3-甲醛(350.0mg,1.64mmol)溶解在DMF(10mL)后,添加2-溴乙基乙醚(220.0μL,1.97mmol)和Cs
1
实施例1:制备(E)-N'-[(2-氯-1H-吲哚-3-基)亚甲基]-5-甲基苯并呋喃-2-碳酰肼(CAP-1052,化合物7)
向5-甲基苯并呋喃-2-碳酰肼(95.1mg,0.50mmol)和2-氯-1H-吲哚-3-甲醛(89.8mg,0.50mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流8小时。对反应溶液进行减压蒸馏,利用n-Hex/CH
1
实施例2:制备(E)-N'-[(2-氯-1-甲基-1H-吲哚-3-基)亚甲基]-5-甲基苯并呋喃-2-碳酰肼(CAP-1041,化合物13)
/>
向5-甲基苯并呋喃-2-碳酰肼(95.1mg,0.50mmol)和2-氯-1-甲基-1H-吲哚-3-甲醛(96.8mg,0.50mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流24小时。冷却反应溶液并过滤固体后,利用EtOH洗涤来获得了100mg的标题化合物(收率为55%,浅棕色固体)。
1
实施例3:制备(E)-2-{2-氯-3-[(2-(5-甲基苯并呋喃-2-羰基)亚肼基)甲基]-1H-吲哚-1-基}乙酸乙酯(CAP-1038,化合物12)
向5-甲基苯并呋喃-2-碳酰肼(60.9mg,0.32mmol)和2-(2-氯-3-甲酰基-1H-吲哚-1-基)乙酸乙酯(85.0mg,0.32mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流30小时。对反应溶液进行减压蒸馏,并利用Et
1
实施例4:制备(E)-N'-{[2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼(CAP-1042,化合物1)
向5-甲基苯并呋喃-2-碳酰肼(98.9mg,0.52mmol)和2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛(130.9mg,0.52mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流24小时。对反应溶液进行减压蒸馏,并通过柱色谱法(n-Hex∶EA=1∶1)分离残留物来获得了179mg的标题化合物(收率为81%,淡黄色固体)。
1
实施例5:制备(E)-N'-{[2-溴-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼(CAP-1044,化合物14)
向5-甲基苯并呋喃-2-碳酰肼(108.4mg,0.57mmol)和2-溴-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛(168.8mg,0.57mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流24小时。对反应溶液进行减压蒸馏并溶解在少量的CH
1
实施例6:制备(E)-N'-{[1-(2-乙氧基乙基)-2-(三氟甲基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼(CAP-1045,化合物15)
向5-甲基苯并呋喃-2-碳酰肼(93.2mg,0.49mmol)和1-(2-乙氧基乙基)-2-三氟甲基-1H-吲哚-3-甲醛(139.8mg,0.49mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流24小时。对反应溶液进行减压蒸馏,并通过柱色谱法(n-Hex∶EA=2∶1)分离残留物来获得了176mg的标题化合物(收率为79%,白色固体)。
1
实施例7:制备(E)-N'-{[2-氯-1-(2-甲氧基乙基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼(CAP-1070,化合物19)
向5-甲基苯并呋喃-2-碳酰肼(319.5mg,1.68mmol)和2-氯-1-(2-甲氧基乙基)-1H-吲哚-3-甲醛(399.3mg,1.68mmol)添加1-PrOH(20mL)和乙酸(1滴~2滴)并回流15小时。冷却反应溶液并过滤固体后,利用n-Hex洗涤来获得了630mg的标题化合物(收率为91%,淡黄色固体)。
1
实施例8:制备(E)-N'-{[2-氯-1-(2-乙氧基乙基)-5-甲氧基-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼(CAP-1046,化合物2)
向5-甲基苯并呋喃-2-碳酰肼(127.4mg,0.67mmol)和2-氯-1-(2-乙氧基乙基)-5-甲氧基-1H-吲哚-3-甲醛(188.8mg,0.67mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流24小时。对反应溶液进行减压蒸馏,通过柱色谱法(n-Hex∶EA=1∶2)分离残留物来获得了213mg的标题化合物(收率为70%,淡黄色固体)。
1
实施例9:制备(E)-N'-{[2-氯-1-(2-乙氧基乙基)-6-甲氧基-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼(CAP-1050,化合物6)
向5-甲基苯并呋喃-2-碳酰肼(95.1mg,0.50mmol)和2-氯-1-(2-乙氧基乙基)-6-甲氧基-1H-吲哚-3-甲醛(140.9mg,0.50mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流16小时。对反应溶液进行减压蒸馏并溶解在少量爱的CH
1
实施例10:制备(E)-N'-{[2-氯-1-(2-乙氧基乙基)-5-氟-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼(CAP-1049,化合物5)
向5-甲基苯并呋喃-2-碳酰肼(66.6mg,0.35mmol)和2-氯-1-(2-乙氧基乙基)-5-氟-1H-吲哚-3-甲醛(94.4mg,0.35mmol)添加1-PrOH(10mL)和乙酸(1滴~2滴)并回流8小时。对反应溶液进行减压蒸馏并溶解在少量的CH
1
实施例11:制备(E)-N'-{[2,5-二氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼(CAP-1060,化合物9)
向5-甲基苯并呋喃-2-碳酰肼(165.5mg,0.87mmol)和2,5-二氯-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛(249.0mg,0.87mmol)添加1-PrOH(30mL)和乙酸(1滴~2滴)并回流3小时。对反应溶液进行减压蒸馏并利用EtOH重结晶。过滤生成的固体并利用冷EtOH洗涤来获得了270mg的标题化合物(收率为68%,白色固体)。
1
实施例12:制备(E)-N'-{[2-氯-1-(2-乙氧基乙基)-5-(三氟甲氧基)-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼(CAP-1047,化合物3)
向5-甲基苯并呋喃-2-碳酰肼(22.8mg,0.12mmol)和2-氯-1-(2-乙氧基乙基)-5-三氟甲氧基-1H-吲哚-3-甲醛(40.3mg,0.12mmol)添加1-PrOH(10mL)和乙酸(1滴~2滴)并回流18小时。对反应溶液进行减压蒸馏,通过柱色谱法(n-Hex∶EA=1∶2)分离残留物来获得了52mg的标题化合物(收率为85%,淡黄色固体)。
1
实施例13:制备(E)-N'-{[2-氯-1-(2-乙氧基乙基)-5-甲基-1H-吲哚-3-基]亚甲基}-5-甲基苯并呋喃-2-碳酰肼(CAP-1059,化合物8)
向5-甲基苯并呋喃-2-碳酰肼(374.7mg,1.97mmol)和2-氯-1-(2-乙氧基乙基)-5-甲基-1H-吲哚-3-甲醛(523.5mg,1.97mmol)添加1-PrOH(30mL)和乙酸(1滴~2滴)并加热回流3小时。对反应溶液进行减压蒸馏并利用EtOH重结晶。过滤生成的固体并利用冷EtOH洗涤来获得了690mg的标题化合物(收率为80%,淡黄色固体)。
1
实施例14:制备(E)-N'-{[2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-5-甲氧基苯并呋喃-2-碳酰肼(CAP-1051,化合物16)
向5-甲氧基苯并呋喃-2-碳酰肼(103.1mg,0.50mmol)和2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛(125.9mg,0.50mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流7小时。对反应溶液进行减压蒸馏,利用n-Hex/CH
1
实施例15:制备(E)-N'-{[2-氯-1-(2-乙氧基乙基)-5-甲氧基-1H-吲哚-3-基]亚甲基}-5-甲氧基苯并呋喃-2-碳酰肼(CAP-1053,化合物17)
向5-甲氧基苯并呋喃-2-碳酰肼(103.1mg,0.50mmol)和2-氯-1-(2-乙氧基乙基)-5-甲氧基-1H-吲哚-3-甲醛(140.9mg,0.50mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流8小时。对反应溶液进行减压蒸馏,通过柱色谱法(n-Hex∶EA=2∶3)分离残留物来获得了222mg的标题化合物(收率为94%,淡黄色固体)。
1
实施例16:制备(E)-5-氯-N'-{[2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}苯并呋喃-2-碳酰肼(CAP-1062,化合物20)
向5-氯苯并呋喃-2-碳酰肼(103.2mg,0.49mmol)和2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛(123.3mg,0.49mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流24小时。对反应溶液进行减压蒸馏,通过柱色谱法(CH
1
实施例17:制备(E)-N'-{[2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-4,7-二甲基苯并呋喃-2-碳酰肼(CAP-1063,化合物21)
向4,7-二甲基苯并呋喃-2-碳酰肼(81.7mg,0.40mmol)和2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛(100.7mg,0.40mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流24小时。对反应溶液进行减压蒸馏,通过柱色谱法(CH
1
实施例18:制备(E)-N'-{[2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基]亚甲基}-4,6-二甲氧基苯并呋喃-2-碳酰肼(CAP-1064,化合物22)
向4,6-二甲氧基苯并呋喃-2-碳酰肼(118.1mg,0.50mmol)和2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛(125.9mg,0.50mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流4小时。冷却反应溶液并过滤固体后,利用EtOH洗涤来获得了210mg的标题化合物(收率为89%,白色固体)。
1
实施例19:制备(E)-N'-{2-[2-((2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-基)亚甲基]肼-1-羰基}苯并呋喃-5-基)乙酰胺(CAP-1056,化合物18)
向N-(2-(肼羰基)苯并呋喃-5-基)乙酰胺(116.6mg,0.50mmol)和2-氯-1-(2-乙氧基乙基)-1H-吲哚-3-甲醛(125.9mg,0.50mmol)添加1-PrO H(20mL)和乙酸(1滴~2滴)并回流12小时。冷却反应溶液并过滤固体后,利用EtOH洗涤来获得了166mg的标题化合物(收率为71%,淡黄色固体)。
1
实施例20:制备(E)-乙基-2-(3-((2-(4,6-二甲氧基苯并呋喃-2-羰基)亚肼基)甲基)-2-甲基-1H-吲哚-1-基)乙酸酯(CAP-1061,化合物23)
向4,6-二甲氧基苯并呋喃-2-碳酰肼(118.1mg,0.50mmol)和2-(3-甲酰基-2-甲基-1H-吲哚-1-基)乙酸乙酯(122.6mg,0.50mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流4小时。冷却反应溶液并过滤固体后,利用EtOH洗涤来获得了197mg的标题化合物(收率为85%,白色固体)。
HRMS(ESI):m/zcalcdforC25H25N3O6Na(M+Na)486.1641,foun d 486.1642
实施例21:制备(E)-2-(2-甲基-3-((2-(5-甲基苯并呋喃-2-羰基)亚肼基)甲基)-1H-吲哚-1-基)乙酸乙酯(CAP-1034,化合物10)
向5-甲基苯并呋喃-2-碳酰肼(82.5mg,0.43mmol)与2-(3-甲酰基-2-甲基-1H-吲哚-1-基)乙酸乙酯(105.5mg,0.43mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流36小时。减压蒸馏反应溶液后,使用Et
1
实施例22:制备(E)-2-(3-((2-(5-氯苯并呋喃-2-羰基)亚肼基)甲基)-2-甲基-1H-吲哚-1-基-乙酸乙酯(CAP-1035,化合物11)
向5-率苯并呋喃-2-碳酰肼(105.3mg,0.50mmol)与2-(3-甲酰基-2-甲基-1H-吲哚-1-基)乙酸乙酯(122.6mg,0.50mmol)添加1-PrOH(15mL)和乙酸(1滴~2滴)并回流24小时。冷却反应溶液并过滤固体后,使用EtOH洗涤来获得107mg的目标化合物(49%,淡黄色固体)。
1
实施例23:制备(E)-2-(2-氯-3-((2-(5-甲基苯并呋喃-2-羰基)亚肼基)甲基)-1H-吲哚-1-基)乙酸甲酯(CAP-1048,化合物4)
向5-甲基苯并呋喃-2-碳酰肼(319.5mg,1.68mmol)与2-(2-氯-3-甲酰基-1H-吲哚-1-基)乙酸甲酯(422.8mg,1.68mmol)添加1-PrOH(20mL)和乙酸(1滴~2滴)并回流15小时。冷却反应溶液并过滤固体后,使用正己烷洗涤来获得648mg的目标化合物(91%,但黄色固体)。
1
对上述制备的实施例化合物进行如下实验。
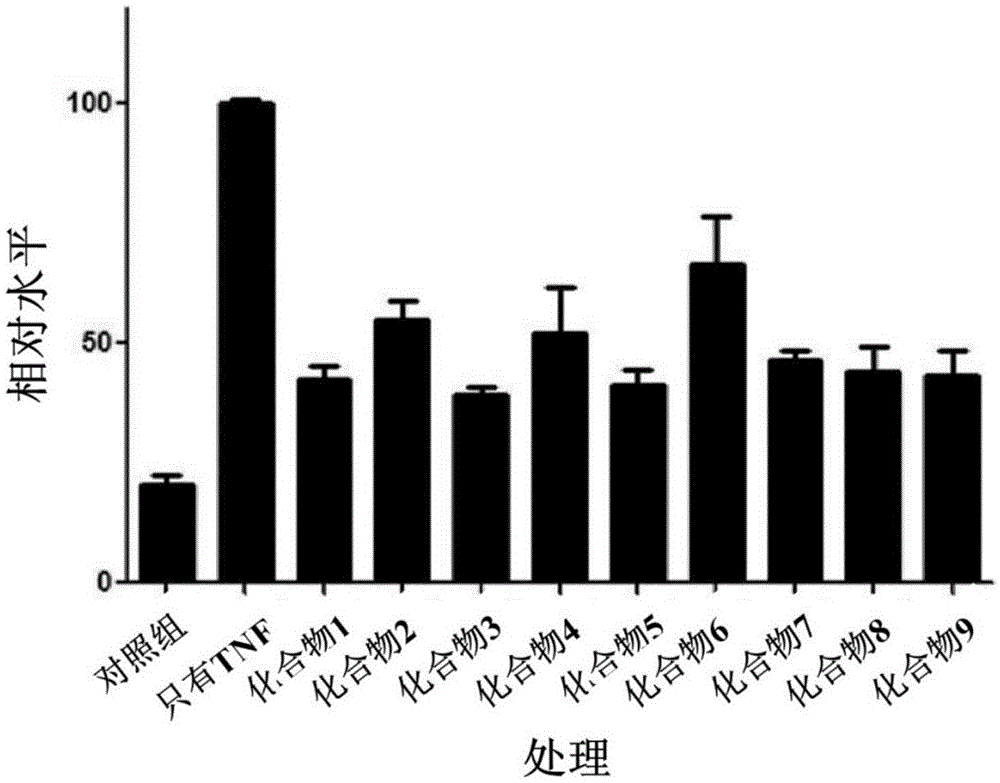
实验例1:通过基于细胞的报告基因分析确认抑制核因子κB炎症反应通路的效果
向培养的人类来源HEK293细胞株转染(transfection)核因子κB荧光素酶(luciferase)(报告基因(reporter))载体(vector)后,处理10ng/ml的TNF-α来诱导核因子κB信号传导通路的激活。并且,在上述过程中分别处理9种化学式1的化合物各1uM来测定抑制以核因子κB为媒介的炎症反应调解通路的效果。具体地,确认核因子κB的相对表达水平。
如图1所示,只处理TNF-α的阳性对照(positivecontrol)组因激活核因子κB炎症反应通路而使报告基因的活性(activity)大幅上升,与之相反,在处理化学式1的化合物(图1中分别表示为化合物1至化合物9)的情况下,观察到核因子κB的活性被抑制50%以上。
实验例2:确认抑制核因子κB炎症反应通路的重要因子p65(RelA)的磷酸化(phosphorylation)的效果
通过现有的与κB炎症反应调节相关的研究知道,为在通路中诱导炎症反应,p65(RelA)的磷酸化过程是非常重要的。这是因为磷酸化的p65实质上向免疫细胞的细胞核内移动来增加引起炎症反应的细胞因子的产生。
培养相同的HEK293细胞株后,处理各化合物来确认是否抑制作为核因子κB信号传导过程中最重要过程的p65(RelA)的磷酸化。
如图2所示,确认到本发明的化学式1的化合物(在图2分别表示为化合物1至化合物9)全都抑制p65的磷酸化过程。
如上所述,确认到本发明的化合物有效抑制核因子κB炎症反应通路,并且抑制核因子κB信号传导过程中的重要因子p65(RelA)的磷酸化,从而确认具有优秀的抗炎症功效。
实验例3:通过基于细胞的报告基因分析确认抑制核因子κB炎症反应通路的效果
培养作为人类(Human)来源胚胎肾(embryonickidney)细胞株的HEK293细胞株(cellline)后,转染核因子κB荧光素酶载体(luciferasevector)并处理1uM的化合物后,处理10ng/ml的TNF-α来诱导核因子κB通路(pathway)。使用光度计(Luminometer)通过荧光素酶报告基因分析(Luciferaseassay)方法以定量的方式测量给核因子κB基因的表达带来的影响。
结果如图3所示。
通过图3可以确认,在只处理TNF-α的阳性对照组中,核因子κB基因大量表达。但当处理本发明的实施例化合物(以CAP-No.(+“No”)的方式表示)时,观察到抑制了核因子κB炎性信号传导过程。
尤其,在分别处理实施例4(CAP-1042)、实施例12(CAP-1047)、实施例10(CAP-1049)、实施例13(CAP-1059)、实施例11(CAP-1060)等五种化合物的样品中,确认到核因子κB基因的表达量显著减少。
实验例4:确认在皮肤中的抗炎效果
在6周龄的小鼠的腹部皮肤涂敷150μl的3%的恶唑酮(Oxazolone)来诱导免疫反应后,以一天的间隔在小鼠的耳部涂敷20μl的稀释为0.5%的恶唑酮共5次来诱导炎症反应。在涂敷恶唑酮30分钟后,以500nM的浓度各涂敷20μl的实施例4(CAP-1042)或实施例12(CAP-1047)共5次。
各实验组的小鼠个体数量保持在10只以上,共重复两次实验。
1.通过肉眼确认炎症抑制效果
作为上述实验的结果,通过肉眼确认的炎症抑制效果和通过苏木精伊红染色确认的抗炎症结果如图4及图5所示。
具体地,图4示出通过肉眼确认的炎症变化的结果。与只涂敷作为溶剂的乙醇的耳部相比,单独涂敷恶唑酮的小鼠的耳部显出发红的状态,可知很好地诱导了炎症反应。与之相反,在处理实施例4的化合物(1042)或实施例12(CAP-1047)的动物组中,观察到与处理乙醇的正常的情况非常相似的皮肤状态。
并且,苏木精伊红染色的结果如图5所示。若诱发皮肤炎症,则通常会观察到皮肤整体与上皮的厚度一同增加的称为表皮增生的病理学现象。观察到与只涂敷作为溶剂的乙醇的皮肤相比,单独涂敷恶唑酮的皮肤的整体的厚度增加2倍左右,上皮的厚度也增加约3倍左右。与之相反,在处理实施例4的化合物(CAP-1042)或实施例12(CAP-1047)的情况下,观察到皮肤整体及上皮的厚度减少到与处理乙醇的正常的情况非常相似的程度,确认到化合物的优秀的抗炎症功效。尤其,在这样的抑制表皮增生的效果方面,确认到比阳性对照组更为优秀的效果。
2.确认炎性免疫细胞数量减少
若诱发皮肤炎症,则通常会观察到皮肤整体的炎症免疫细胞的数量增加的病理学现象。
于是在本发明中,通过测量炎性免疫细胞数量的变化来确认本发明的化合物的治疗效果。
具体地,在苏木精伊红染色(图5)后使用显微镜在各样品的10处以上部位均匀地拍摄照片,进行在拍摄的照片中直接计数染色为暗红色的炎症免疫细胞的数量来求得平均值的方法。
结果如图6所示。
通过图6可以确认,观察到与只涂敷作为溶剂的乙醇的皮肤相比,单独涂敷恶唑酮的皮肤的炎症免疫细胞的数量增加约3倍。与之相反,处理本申请的实施例4(1042)或实施例7(1047)的化合物的免疫细胞的数量减少至与处理乙醇的正常的情况非常相似的程度。
3.确认炎性细胞因子的减少
在核因子κB信号传导过程的上述涂敷实验结束后,从各小鼠中采取皮肤组织,使用组织破碎机粉碎后提取核糖核酸(RNA)。使用互补脱氧核糖核酸(cDNA)逆转录提取的核糖核酸后,使用实时聚合酶链式反应(Real-timeP CR)通过定量聚合酶链式反应(quantitativePCR,qPCR)测量存在于皮肤组织中的IL-4、IL-13的细胞因子的量。
结果如图7所示。
通过图7可以确认,单独处理恶唑酮来诱发炎症的小鼠的耳部的组织内作为炎性细胞因子的白细胞介素4(IL-4)与白细胞介素13(IL-13)的量增加,但在一同处理恶唑酮与本发明的实施例4(1042)或实施例7(1047)化合物的小鼠中,确认到上述细胞因子的表达水平显著减少至20%-25%的水平。
通过上述结果确认本发明的画呢无显出优秀的抗炎效果。
实验例5:确认核因子κB典型及非典型炎性信号传导活性抑制及靶向基因表达减少效果
核因子κB信号传导过程大体具有典型及非典型通路。在典型通路(Canonicalpathway)中,当通过处理TNF-a来诱导炎症反应时,p65蛋白被磷酸化的产物P-p65蛋白的量增加,在向细胞核内移动时诱导炎症反应。在非典型通路中,当通过激活非典型NF-kB通路(Non-canonicalNF-kBpathway)的LIGHT化合物诱导炎症反应时,p100蛋白通过处理过程变为p52蛋白向核内移动来诱导炎症反应。
对于这些各不相同的通路,确认本发明的化合物是否显出通路抑制效果。具体地,为了确认是否调节核因子κB信号传导过程(典型及非典型通路)的活性,利用免疫印迹法确认作为主要信号调节分子的磷酸化p65及p100蛋白的调节。在本实验中,使用实施例4(1042)化合物作为本发明的化合物。
结果如图8所示。
在图8中可以确认,在典型通路中,若处理TNFα来诱导炎症反应,则随着p65蛋白被磷酸化的产物P-p65蛋白的量增加并向核内移动来诱导炎症反应(+)。并且,若通过LIGHT化合物诱导炎症反应,则随着p100蛋白通过处理过程变为p52蛋白并向核内移动来诱导炎症反应(+)。已知为作用于p65蛋白的TPCA1,虽在典型通路中起作用,但在非典型通路中不起作用。
相反,本发明的化合物在核因子κB炎性信号传导过程的典型及非典型通路中,作为均抑制两种信号传导过程的双重抑制剂(dualinhibitor)来起作用,在两种通路中都显出优秀的通路抑制效果。
通过上述结果确认到本发明的化合物显出均抑制核因子κB炎性信号传导过程的典型及非典型通路的双重抑制效果。
实验例6:确认化合物对IKKα的选择性结合以及对结构形成的抑制
为了确认核因子κB活性调节机制,在药物(实施例4)中结合生物素(biotin)来进行是否与核因子κB的主要调节分子结合的实验。具体地,确认是否与有关典型及非典型通路的IKKα、IKKβ、IKKγ、p65、IκBα结合。
结果如图9所示。
通过图9可以确认到在核因子κB主要调节分子中特异性地与IKKα选择性地结合。
在IKKα的情况下,以六聚体(Hexamer)(6mer)形态,即,以6个单体形成合体来介导核因子κB信号传导过程。
于是,通过处理本发明的化合物(实施例4)来确认是否生成六聚体形态的活性形态,结果如图10所示。
通过图10可以确认到处理本发明实施例的化合物抑制六聚体IKKα的形成,从而起到对IKKα的选择性抑制剂的作用。
实验例7:利用败血症模型确认抑制细胞因子风暴及治疗败血症的效果
由于不存在因冠状病毒,尤其是不存在因严重急性呼吸系统综合征冠状病毒2型引起的细胞因子风暴死亡的疾病模型动物,因此在本发明中通过因诱导炎症反应而诱发细胞因子风暴问题的急性败血症模型来确认抑制细胞因子风暴、治疗严重急性呼吸系统综合征冠状病毒2型感染疾病的可能性以及治疗败血症的可能性。
利用因处理脂多糖(LPS)而引起败血症(死亡)的动物模型(细胞因子风暴相似模型)进行实验。实验设计如图11a所示。在通过腹腔给药脂多糖诱导败血症和静脉注射药物(实施例4)后,分别在3小时、6小时、12小时后采取血液,为了观察败血症引起的死亡,在48小时内确认存活率。
确认48小时后的存活率的结果如图11b所示,可以确认给药本发明实施例4的化合物的大幅减少因败血症引起的死亡率。
并且,如图11c所示,可以确认抑制细胞因子及趋化因子的产生方面显出优秀的效果。
通过上述结果确认到本发明实施例的化合物通过抑制体内细胞因子及趋化因子的表达来减少因败血症引起的死亡率,确认到可以抑制急性炎症反应,尤其可以抑制细胞因子风暴现象。
