一种肿瘤T细胞抗原表位肽、pMHC及其制备和应用
文献发布时间:2024-04-18 20:01:23
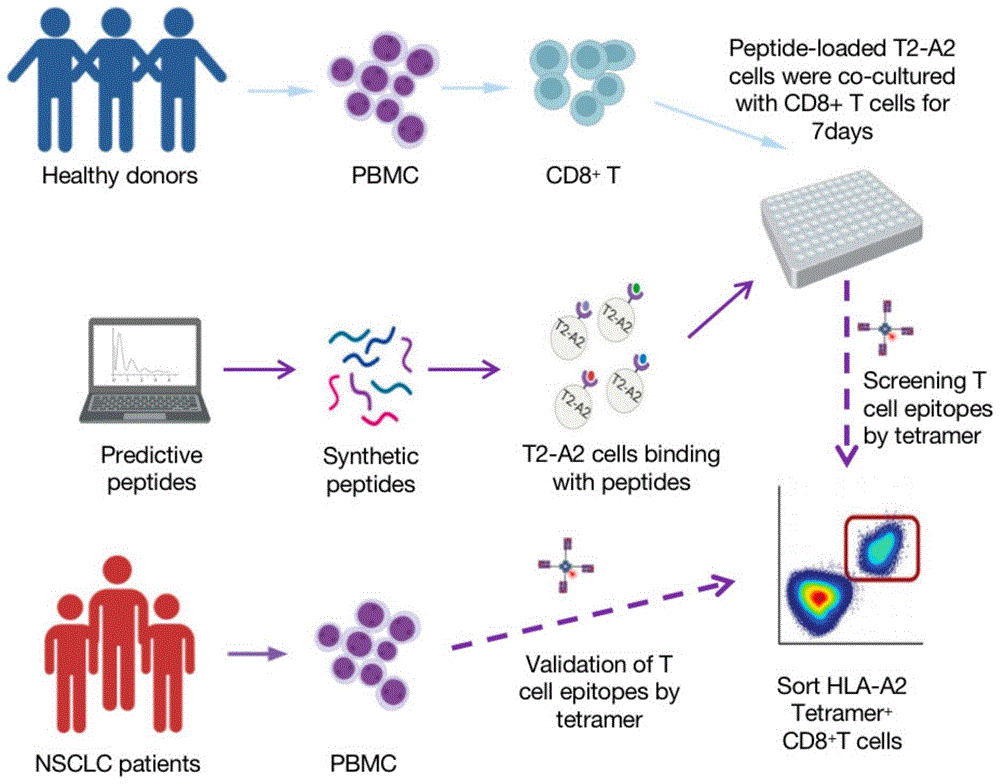
本申请是申请日为2022年8月30日、申请号为202211049861X,发明名称为“一种肿瘤T细胞抗原表位肽、pMHC及其制备和应用”的发明专利申请的分案申请。
技术领域
本发明涉及生物技术领域,具体地,涉及一种肿瘤T细胞抗原表位肽、pMHC及其制备和应用。
背景技术
肿瘤的发生率和死亡率在全球范围内呈现逐年升高的势态,目前存在的最主要问题是缺乏有效的治疗手段。肿瘤免疫治疗是指外源干预机体免疫系统,重新启动并维持“肿瘤-免疫”循环,恢复、提高机体的抗肿瘤免疫反应,加强对肿瘤细胞的识别和杀伤能力,从而达到控制甚至特异性清除肿瘤的治疗效果。与手术、放疗和化疗等传统的治疗手段相比,肿瘤免疫治疗具有特异性强,副作用小的优点,目前,已应用在临床上的肿瘤免疫治疗方法主要包括免疫检查点抑制剂治疗、过继性细胞免疫治疗、癌症疫苗及一些新兴免疫治疗方法等。癌症的免疫疗法被科学杂志评为2013年度十大科学突破之首,也是目前被广泛研究与开发的新型抗肿瘤治疗手段。
癌症免疫循环包括几个步骤:癌细胞产生的抗原在癌细胞死亡后释放并被树突状细胞(DC)捕获。接下来,DC将MHC分子上捕获的抗原呈递给T细胞,从而引发和激活效应T细胞对癌症抗原的反应。在趋化因子的引导下,活化的T细胞进入并浸润肿瘤部位。T细胞通过TCR与抗原-MHC复合物的相互作用特异性识别并结合癌细胞并杀死癌细胞。因此,T细胞免疫应答在抗肿瘤免疫防御中具有重要作用,在疫苗研发中占据重要地位。CD8+T细胞免疫应答的第一步就是T细胞通过其表面的抗原识别受体特异性识别被癌细胞所递呈的抗原表位肽。因此,抗原表位肽是T细胞特异性识别肿瘤细胞、发挥免疫保护作用的重要关键分子,是免疫检测、免疫治疗和疫苗研发的关键靶向分子。
嵌合抗原受体T细胞技术(CAR-T)以及T细胞受体嵌合型T细胞(TCR-T)作为当前最新的两大免疫细胞技术,受到广泛的关注和研究。CAR-T细胞治疗在血液肿瘤中已经取得较好的疗效,但其引起的细胞因子风暴和神经毒性副作用可能会危及生命。而TCR-T细胞治疗是对实体瘤有效的免疫细胞治疗手段之一,将能识别肿瘤特异性抗原的TCRα和β链基因转染到T细胞中,修饰T细胞使其表达肿瘤抗原特异性的TCR抗原结合区,从而能特异性识别相应的肿瘤抗原。然后经体外扩增并回输到人体内,表达肿瘤抗原特异性TCR的T淋巴细胞可识别肿瘤细胞表面的HLA-抗原肽复合物,进而引发T细胞的免疫效应,达到杀伤肿瘤细胞的目的。肿瘤疫苗是利用肿瘤相关抗原(TAAs)、肿瘤多肽或肿瘤细胞裂解产物等诱导机体产生肿瘤特异性免疫应答,保护机体免受肿瘤细胞侵袭,实现对肿瘤的预防和治疗。包括预防性肿瘤疫苗和治疗性肿瘤疫苗两大类。治疗性肿瘤疫苗主要针对肿瘤患者,通过免疫诱导病人体内产生特异性抗体、效应细胞和特异性免疫记忆细胞,达到治疗肿瘤的目的。已有临床试验证实肿瘤全细胞疫苗、肿瘤特异性蛋白或多肽疫苗以及肿瘤核酸疫苗在肿瘤治疗过程中展现了巨大的应用潜力。
MAGE家族是原癌抗原,是癌睾丸(cancer/testis antigen)抗原超家族成员之一。MAGE家族成员超过60个,均存在于同一个MAGE同源结构域。主要分为两个亚类:MAGE-I类抗原和MAGE-II类抗原。MAGE-II类抗原的表达普遍存在于正常细胞中,而MAGE-I类抗原为TAAs,即在人体除睾丸生殖细胞和胎盘滋养组织以外的组织中均不表达,却在肿瘤中高表达,是肿瘤研究中的热点。由于生殖细胞缺乏HLA因而癌睾丸抗原不能被T细胞识别,但在恶性肿瘤中癌睾丸抗原和HLA分子同时表达则可以被T细胞识别。MAGE-I类抗原可划分为三个亚类:MAGE-A、MAGE-B和MAGE-C。MAGE-A亚家族具有严格的表达模式,其中MAGE-A3,MAGE-A4,MAGE-A10及MAGE-A12等是MAGE家族中具有独特特征的一个抗原,在黑色素瘤、肝癌、肺癌和食管癌等患者中存在特异性高表达。近年来,以MAGE-A家族基因为靶点的抗癌作用常用两种方法:(1)接种MAGE表位抗原疫苗;(2)TCR-T免疫细胞治疗。
发明内容
本发明的目的是为了克服现有技术的上述不足,提供一种肿瘤T细胞表位肽、pMHC及其制备和应用。
本发明的第一目的是提供一种肿瘤T细胞抗原表位肽。
本发明的第二目的是提供一种肿瘤T细胞抗原表位肽组合物。
本发明的第三目的是提供一种pMHC复合物。
本发明的第四目的是提供一种抗原肽-抗原递呈细胞复合物。
本发明的第五目的是提供一种编码上述肿瘤T细胞抗原表位肽的基因。
本发明的第六目的是提供上述肿瘤T细胞抗原表位肽、肿瘤T细胞抗原表位肽组合物、pMHC复合物、抗原肽-抗原递呈细胞复合物和/或基因在制备肿瘤疫苗和/或肿瘤药物中的应用。
为了实现上述目的,本发明是通过以下方案予以实现的:
T2-A2是一种通过重组基因工程技术表达人MHC-I类分子HLA-A2的抗原递呈细胞系。只有有效的抗原表位肽才能被其递呈,从而在其细胞表面形成稳定的pMHC复合物,因此可以作为刺激T细胞的人工抗原递呈细胞。
T细胞抗原表位肽单独无法工作,必须以pMHC复合物或抗原肽-抗原递呈细胞复合物的方式进行T细胞活化。本发明利用MHC的单体和鉴定出的新型肿瘤T细胞表位进行联合复性,制备了pMHC复合物。将鉴定出的新型肿瘤T细胞抗原表位肽负荷在抗原递呈细胞表面(T2-A2细胞),制备了抗原肽-抗原递呈细胞复合物,然后用制备好的pMHC复合物去标记T细胞,发现其抗原表位肽可以有效活化健康人外周血中T细胞产生杀伤性细胞因子,也可以有效杀伤携带肿瘤MAGE-A3,MAGE-A10抗原的靶细胞。该T细胞抗原表位肽组装成pMHC复合物,可以在非小细胞肺癌患者外周血中检测到。证明新发现的MAGE-A3和MAGE-A10 T细胞抗原表位肽能有效诱导T细胞免疫,可以应用于肿瘤通用型疫苗和免疫细胞治疗手段,如TCR-T的开发。
因此本发明请求保护一种肿瘤T细胞抗原表位肽,所述肿瘤T细胞抗原表位肽的氨基酸序列如SEQ ID NO:1~SEQ ID NO:3任一所示。
MAGE-A3-Mp4(SEQ ID NO:1):LVFGIELMEV;
MAGE-A10-Mp30(SEQ ID NO:2):VIWEALNMM;
MAGE-A10-Mp32(SEQ ID NO:3):SLLKFLAKV。
本发明还请求保护一种肿瘤T细胞抗原表位肽组合物,所述肿瘤T细胞抗原表位肽含有氨基酸序列如SEQ ID NO:1~SEQ ID NO:3所示的肿瘤T细胞抗原表位肽中的一条或多条。
本发明还请求保护一种pMHC复合物,所述pMHC复合物含有上述肿瘤T细胞抗原表位肽和/或上述肿瘤T细胞抗原表位肽组合物。
优选地,所述pMHC复合物的制备方法为:将HLA-A2重链、HLA-A2轻链β2m和上述肿瘤T细胞抗原表位肽复性得到。
本发明还请求保护一种抗原肽-抗原递呈细胞复合物,所述抗原肽-抗原递呈细胞复合物为表面有上述肿瘤T细胞抗原表位肽和/或上述肿瘤T细胞抗原表位肽组合物的抗原递呈细胞。
优选地,所述抗原递呈细胞为T2-A2细胞。
更优选地,所述T2-A2细胞为过表达HLA-A2的T2细胞。
更优选地,所述抗原肽-抗原递呈细胞复合物的制备方法为:将上述肿瘤T细胞抗原表位肽与抗原递呈细胞混合孵育,得到抗原肽-抗原递呈细胞复合物。
本发明还请求保护一种编码上述肿瘤T细胞抗原表位肽的基因。
本发明还请求保护上述肿瘤T细胞抗原表位肽、肿瘤T细胞抗原表位肽组合物、pMHC复合物、抗原肽-抗原递呈细胞复合物和/或基因在制备肿瘤疫苗和/或肿瘤药物中的应用;所述肿瘤为肺癌。
优选地,所述肿瘤还包括MAGE-A3和/或MAGE-A10高表达的肿瘤。
更优选地,所述MAGE-A3和/或MAGE-A10高表达的肿瘤为黑色素瘤、肝癌和/或食管癌。
与现有技术相比,本发明具有以下有益效果:
本发明发现了3种肿瘤T细胞抗原表位肽,可用于体外的T细胞活化实验。所述肿瘤T细胞抗原表位肽可以应用到针对MAGE-A3和MAGE-A10抗原高表达的肿瘤如黑色素瘤、非小细胞肺癌、肝癌、头颈肿瘤等肿瘤通用疫苗的研发、肿瘤的诊断以及TCR-T疗法的研究中。
本发明所述肿瘤T细胞抗原表位肽制备成pMHC复合物或直接负荷导抗原递呈细胞,从而活化T细胞,可应用于:
(1)肿瘤疫苗的研发和制备:肿瘤细胞死亡后释放肿瘤抗原,DC将MHC分子上捕获的抗原呈递给T细胞,从而引发和激活效应T细胞对癌症抗原的反应,本发明所述肿瘤T细胞抗原表位肽能诱导机体产生免疫应答生成抗原特异性T细胞,故本发明所述肿瘤T细胞抗原表位肽是肿瘤通用疫苗的候选抗原表位肽。
(2)检测机体是否具有抗肿瘤的细胞免疫功能:待检者体内检测到肿瘤抗原特异性T细胞,代表机体已经产生了T细胞免疫功能,根据该抗原表位肽制备成的pMHC复合物标记的抗原特异性CD8T的比例,反应待检者抗肿瘤免疫反应的强弱。
(3)辅助诊断:使用本发明所述肿瘤T细胞抗原表位肽或肿瘤T细胞抗原表位肽组合物可检测出特异性免疫反应成分,从而提高诊断的特异性,并快速筛查出MAGE-A3或MAGE-A10抗原阳性的肿瘤患者。
(4)TCR-T细胞免疫疗法开发。
附图说明
图1为pMHC复合物的组装示例图;
图2为31种候选肿瘤T细胞抗原表位肽的T2-A2抗原提呈的鉴定;A:31种候选肿瘤T细胞抗原表位肽的T2-A2抗原提呈的鉴定试验结果;B:图A的统计图;
图3为31种候选肿瘤T细胞抗原表位肽形成pMHC复合物的检测图;
图4为31种候选肿瘤T细胞抗原表位肽对CD8+T细胞的活化图;A:流式细胞仪检测图;B:MAGE-A3-Mp4、MAGE-A10-Mp30和MAGE-A10-Mp32对应的CD8+T细胞活化柱形图;
图5为CD8+T细胞释放IFN-γ和GZMB的释放检测图;A:流式细胞仪检测CD8+T细胞的释放的GZMB比例图;B:流式细胞仪检测CD8+T细胞的释放的IFN-γ比例图;
图6为Annexin V-APC的检测结果图;
图7为非小细胞癌患者及健康人体内特异性CD8+T细胞比例图;A:流式细胞术检测HLA-A2阳性的NSCLC患者及健康人中MAGE-A3-Mp4、MAGE-A10-Mp30和MAGE-A10-Mp32抗原表位特异性CD8+T细胞的结果图;B:MAGE-A3-Mp4、MAGE-A10-Mp30和MAGE-A10-Mp32制备的pMHC复合物检测NSCLC患者及健康人体内的CD8+T细胞的结果图。
具体实施方式
下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1肿瘤T细胞抗原表位肽的预测及鉴定
pMHC复合物的组装示例图如图1所示。
1、实验方法
(1)肿瘤T细胞抗原表位肽的预测
使用IEDB Recommended 2.22(http://www.iedb.org/)在线网站中的“MHC IBinding”工具对肿瘤抗原MAGE-A3、MAGE-A4、MAGE-A6、MAGE-A10和MAGE-A12蛋白序列进行CD8 T细胞表位预测。
MHC等位基因选择为HLA-A*02:01,得到31种候选肿瘤T细胞抗原表位肽,见表1。
(2)肿瘤T细胞抗原表位肽的鉴定
按照表1的序列,人工合成步骤(1)得到的31种候选肿瘤T细胞抗原表位肽,各自分别用DMSO配置成浓度为10mM的母液。
取对数生长期的T2-A2细胞接种到96孔板中(2×10
空白组为孔中只有T2-A2细胞;
阴性对照组为T2-A2细胞和Negative peptide(EB病毒肽,氨基酸序列:IVTDFSVIK,如SEQ ID NO:4所示)共孵育;
阳性对照组为T2-A2细胞和Positive peptide(甲型流感M1肽,氨基酸序列:GILGFVEFTL,如SEQ ID NO:5所示)共孵育;
设置31个肿瘤T细胞抗原表位肽组,分别用人工合成的31种不同的候选肿瘤T细胞抗原表位肽和T2-A2细胞共孵育。
将96孔板在37℃下孵育4小时后离心去上清液,洗涤两次,细胞沉淀用FITC anti-human HLA-A2(β2m)抗体在4℃避光孵育30min,流式细胞仪对各组细胞分别进行检测。
重复上述操作进行三次平行检测。
2、实验结果
预测得到31种候选肿瘤T细胞抗原表位肽的具体信息如表1所示。
表1:31种候选肿瘤T细胞抗原表位肽
肿瘤T细胞抗原表位肽的鉴定结果如图2所示,结果显示:步骤(1)预测得到的31种肿瘤T细胞抗原表位肽种有29种肿瘤T细胞抗原表位肽(除MAGE-A4-Mp14和MAGE-A6-Mp24)可以被抗原递呈细胞有效提呈给T细胞。
结果说明:这29种肿瘤T细胞抗原表位肽是T细胞抗原表位肽。
实施例2肿瘤T细胞抗原表位肽形成pMHC四聚体复合物的检测
1、实验方法
(1)肿瘤T细胞抗原表位肽的pMHC复合物单体的制备
将实施例1步骤(2)得到的母液(10mM)用PBS稀释至400μM,得到稀释后的母液,置于冰上,备用。
将20μL稀释后的母液和20μL的Flex-T单体(200μg/mL)添加至96孔U形板中,吹打混匀,拿开封板摸;将96孔U形板置于冰上,用UV灯照射30min(UV灯到样本之间的距离保持于2~5cm);盖上封板摸,37℃干暗处孵育30min,即得31种候选肿瘤T细胞抗原表位肽与Flex-T单体分别形成的31个pMHC复合物单体,将其设置为实验组。
将甲型流感M1肽(氨基酸序列:GILGFVEFTL,如SEQ ID NO:5所示)与Flex-T单体形成的pMHC复合物设置为阳性对照组Pos;
将EB病毒肽(氨基酸序列:IVTDFSVIK,如SEQ ID NO:4所示)与Flex-T单体形成的pMHC复合物设置为阴性对照组Neg;
将PBS与Flex-T单体形成的pMHC单体设置为UV对照组;
(2)ELISA检测表位肽形成pMHC四聚体复合物的能力
采用ELISA法检测实施例1步骤(2)人工合成的31种候选肿瘤T细胞抗原表位肽是否可以形成pMHC四聚体,具体方法如下:
室温下,在96孔板中加入100μL的0.5μg/mL的链霉亲和素(Streptavidinsolution)孵育过夜(16~18h),接着用300μL的1×Wash Buffer洗涤3次,并加入1×Dilution Buffer(1M NaCl,0.5M Tris,1%BSA(w/v),0.2% Tween 20(w/v),pH=8.0)在室温下封闭30min。
将步骤(1)的pMHC复合物单体(阳性对照组Pos、阴性对照组Neg、UV对照组和实验组)分别用1×Dilution Buffer进行1200倍稀释。
同时设置Monomer组:将Flex-T单体进行同等稀释;Blank组:仅加入与其他组等量的1×Dilution Buffer。
以阳性对照组Pos为例:
弃掉96孔板内液体,在滤纸上拍干,向96孔板中加入100μL稀释后的pMHC复合物单体。
将阴性对照组Neg、UV对照组、实验组、Monomer组和Blank组进行同等处理加入96孔板中。
盖上封板摸,37℃孵育1h。孵育结束后,使用洗涤缓冲液对96孔板洗涤3次,接着添加100μL稀释HRP-anti-β2M(抗体BioLegend,Cat#280303,US),在37℃下继续孵育1h,孵育结束后进行洗涤。
接着向每孔中添加100μL底物溶液(10.34mL的去离子水、1.2mL的pH 4.0,0.1M的柠檬酸一水合物/柠檬酸三钠二水合物、240μL的40nM的ABTS,120μL的过氧化氢溶液),并在室温(18~25℃)下,干暗处振荡(400~500rpm)显色8min。
使用50μL的Stop Solution(2%草酸二水合物,w/v)终止反应。30min内用酶标仪在414nm波长下测定吸光度值(OD值)。
2、实验结果
以Monomer组OD值为100%,计算UV对照组、阳性对照组Pos、影响对照组Neg和实验组的相对OD值,比值大小代表各肿瘤抗原表位肽形成pMHC四聚体。相对OD值大于UV对照组的,则判断为可形成pMHC四聚体。
结果如图3所示,结果显示:与UV对照组相比,MAGE-A4-Mp14和MAGE-A4-Mp22复合物组相对OD值显著降低,其余各组均显著升高(P<0.001)。结果说明:31种候选肿瘤T细胞抗原表位肽中除MAGE-A4-Mp14和MAGE-A4-Mp22之外,其余29种候选肿瘤T细胞抗原表位肽均可以形成pMHC四聚体复合物,是潜在的可引起特异性免疫应答的候选抗原表位肽。
实施例3肿瘤T细胞抗原表位肽-抗原递呈细胞活化T细胞
APC或靶细胞表面的抗原肽/MHC复合物与TCR结合,提供T细胞活化的第一个信号;APC表面的B7分子与T细胞上的CD28分子结合,提供第二个信号;IL-2等提供共刺激信号。通过将能与HLA分子结合的肿瘤抗原表位肽负载APC细胞T2A2后与CD8T细胞共培养,通过四聚体检测活化CD8T细胞的比例,流式分析产生γ-干扰素(IFN-γ)及颗粒酶(GZMB)的抗原特异T细胞比例,分析接种肿瘤抗原负载的T2A2诱导CD8T细胞的活化的能力。
1、实验方法
分离健康志愿者的外周静脉血的单个核淋巴细胞(PBMCs),并进一步分离CD8+T细胞。将T2-A2细胞用CFSE标记,接着用20μg/mL的丝裂霉素处理30min,分别用实施例1步骤(1)的31种候选肿瘤T细胞抗原表位肽进行孵育。
取30μL实施例2步骤(1)得到的肿瘤T细胞抗原表位肽的pMHC复合物单体到1.5mL的EP管中,加入3.3μL的链霉亲和素(BioLegend Cat#405203,US),枪头吹打混匀,4℃避光孵育30min。
孵育结束后,向EP管中加入2.4μL封闭液(1.6ul,50mM的D-biotin(ThermoFisher,Cat#B20656,US)、6ul的10%(w/v)NaN3和192.4ul PBS),吹打终止反应。4~8℃下孵育过夜,得到pMHC四聚体复合物。
Mixed peps组设置为:将0.5×10
并用1μg/mL的抗人CD28抗体核50IU/mL的IL-2共刺激。培养过程中每隔两天向培养基中补充50IU/mL的IL-2及20μM的候选肿瘤T细胞抗原表位肽。
培养7天后,用pMHC四聚体复合物标记特异性CD8+T细胞,检测特异性CD8+T比例和抗原特异性CD8+T细胞释放IFN-γ和GZMB情况,并同时检测T2-A2细胞凋亡标记物AnnexinV-APC百分比。
同时设置阳性对照组(T2-A2细胞负荷甲型流感M1肽)、阴性对照组(T2-A2细胞负荷EB病毒肽)和UV对照组(PBS与Flex-T单体形成的pMHC复合物),进行同等处理检测。
2、实验结果
不同肿瘤T细胞抗原表位肽活化CD8+T细胞的结果如图4所示;结果显示:31种候选肿瘤T细胞抗原表位肽种有3种肿瘤T细胞抗原表位肽可以活化T细胞,分别为MAGE-A3-Mp4(SEQ ID NO:1)、MAGE-A10-Mp30(SEQ ID NO:2)和MAGE-A10-Mp32(SEQ ID NO:3),活化CD8+T细胞的比例分别为5.20%,0.55%和5.21%。
CD8+T细胞释放IFN-γ和GZMB的情况如图5所示;结果显示:与阴性对照组Negctrl相比,mixed peps组活化CD8+T细胞释放IFN-γ和GZMB的效率极显著升高(P<0.001);结果说明:MAGE-A3-Mp4(SEQ ID NO:1)、MAGE-A10-Mp30(SEQ ID NO:2)和MAGE-A10-Mp32(SEQ ID NO:3)抗原表位活化的特异性CD8+T细胞可以释放IFN-γ和GZMB。
Annexin V-APC的检测结果如图6所示;结果显示:与阴性对照组Neg ctrl相比,mixed peps组Annexin V+CFSE+T2A2细胞比例极显著增加(P<0.001);结果说明:MAGE-A3-Mp4(SEQ ID NO:1)、MAGE-A10-Mp30(SEQ ID NO:2)和MAGE-A10-Mp32(SEQ ID NO:3)抗原表位活化的特异性CD8+T细胞可以杀伤靶细胞T2-A2。
实施例4临床患者外周血抗原表位肽特异性细胞毒性T细胞检测
1、实验方法
分离非小细胞癌症(NSCLC)患者及健康人外周静脉血中的单个核淋巴细胞(PBMCs),并鉴定其HLA亚型。
对于其中HLA-A2阳性的PBMCs样品用实施例3中得到的pMHC四聚体复合物和CD8-APC抗体进行染色,然后进行流式上机观察。
2、实验结果
流式上机观察结果图如图7所示,结果显示,氨基酸序列如SEQ ID NO1~3所示的3中肿瘤T细胞抗原表位肽MAGE-A3-Mp4(SEQ ID NO:1)、MAGE-A10-Mp30(SEQ ID NO:2)和MAGE-A10-Mp32(SEQ ID NO:3)的pMHC复合物可以识别NSCLC患者体内产生的抗原特异性CD8+T细胞,且于健康人相比显著升高;结果说明:NSCLC患者体内存在MAGE-A3-Mp4(SEQ IDNO:1)、MAGE-A10-Mp30(SEQ ID NO:2)和MAGE-A10-Mp32(SEQ ID NO:3)此三种抗原表位肽产生免疫应答的特异性杀伤型CD8+T细胞
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 修饰间充质干细胞的融合基因、质粒、修饰得到干细胞及制备方法
- 修饰间充质干细胞的融合基因、质粒、修饰得到干细胞及制备方法
