三叉神经节组织外囊泡在治疗颌骨损伤中的应用
文献发布时间:2024-04-18 20:02:18
技术领域
本发明属于生物技术领域,尤其涉及一种三叉神经节组织外囊泡在治疗骨缺损中的应用。
背景技术
颌面部骨缺损及骨坏死等严重影响患者的外观和功能。而三叉神经作为穿行于颌骨骨内的脑神经分支,对颌骨的修复起关键作用。三叉神经可分泌多种神经生物活性因子促进颌骨缺损修复,切断下牙槽神经血管束后,颌骨缺损修复受阻。下颌神经损伤会导致该侧通过牵张形成的新骨骨小梁排列紊乱,骨质量显著下降。
外囊泡广泛存在于所有体液和组织中,传递大量生物信息,是细胞间重要而独特的通讯模式。外囊泡根据其来源可分为细胞上清来源的外囊泡、体液分泌的外囊泡和组织分泌的外囊泡三大类。目前研究最多的是前两类,但都有一定的局限性。与从细胞培养上清液或体液中获得的外囊泡相比,直接从组织中分离的外囊泡具有组织特异性、准确反映组织微环境等优点。研究发现,颅脑损伤患者受损的神经元释放外囊泡抑制FOXO4和CBL蛋白的转录,从而促进骨折的愈合。阿尔兹海默症小鼠脑组织来源的外囊泡通过miR-483-5p/lgf2调控轴,诱导骨质疏松发生。以上研究表明,神经组织来源的外囊泡对于骨质代谢起重要作用。
发明内容
本发明的目的在于针对现有技术的不足,提供一种三叉神经节组织外囊泡在治疗骨损伤中的应用。
本发明的目的是通过以下技术方案来实现的:一种三叉神经节组织外囊泡在治疗颌骨损伤中的应用。
进一步地,所述三叉神经节组织外囊泡通过以下方法制备:
将三叉神经节切成碎片后,放置于含有木瓜酶和DNA酶的DMEM-F12培养基中;解离后,经过100μm的滤膜,再通过梯度离心法获得三叉神经节组织外囊泡。
进一步地,所述三叉神经节组织外囊泡为由三叉神经节组织间隙中存在的各种细胞来源的囊泡。
进一步地,所述颌骨损伤包括颌骨坏死和颌骨缺损。
进一步地,所述三叉神经节组织外囊泡作为治疗颌骨损伤的药物,其剂型包括注射剂、片剂、胶囊剂、粉末剂和水凝胶。
进一步地,所述注射剂的溶剂为磷酸缓冲盐溶液。
本发明的有益效果是,本发明通过制备三叉神经节组织来源的外囊泡,在细胞水平通过RT-qPCR、明确TG-EVs能够有效促进骨髓间充质干细胞成骨能力,在动物体内可证实TG-EVs可有效促进颌骨缺损修复。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
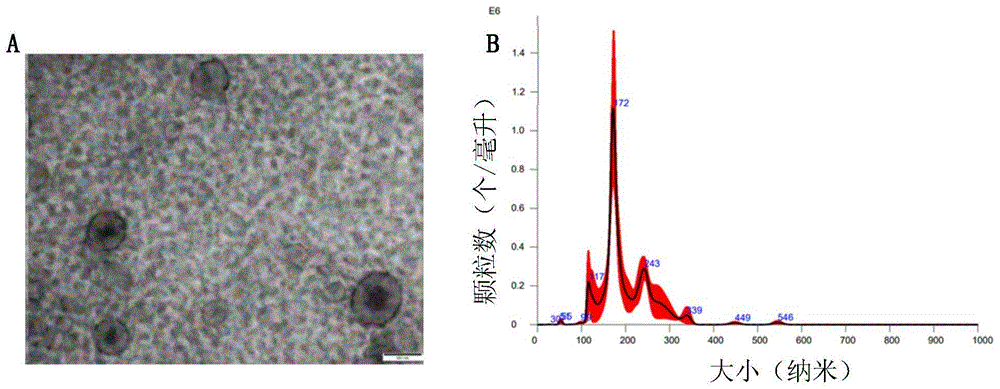
图1为三叉神经节组织外囊泡的鉴定结果图,其中,A为光学显微镜图(比例尺是0.1微米),B为纳米粒子追踪分析的结果图;
图2为TG-EVs刺激BMSC 7天后ALP染色结果图,其中,A为TG-Evs组,B为PBS组;
图3为TG-EVs刺激BMSC 7天后RT-qPCR结果图;
图4为体内实验的CT图,A为颌骨缺损组,B为颌骨缺损+TG-EVs组;
图5为在损伤环境下,TG-EVs出现明显的不同的各种EVs亚群图;
图6为TG-EVs存在的特异标志蛋白,结合EVs亚群及差异蛋白,其携带的JAM3蛋白是其中最重要的传递物质。
具体实施方式
下面结合附图,对本发明进行详细说明。在不冲突的情况下,下述的实施例及实施方式中的特征可以相互组合。
实施例1:三叉神经节组织外囊泡(TG-Evs)的提取及鉴定
S1.TG-EVs的提取
将三叉神经节切成小碎片(1-2mm)后,放置于含有木瓜酶(2mg/ml)和DNA酶(20U/ml)的DMEM-F12培养基中,37℃孵育30分钟。解离完成后,将解离溶液通过100μm的滤膜,除去大的组织碎片。
S2.TG-EVs的分离
将上述收集的上清进行外囊泡提取。具体方法有以下如下:
梯度离心法:离心(4℃,300×g,10分钟),取上清后再次离心(4℃,2000×g,20分钟),再次取上清进行离心(4℃,10000×g,30分钟),弃去沉淀,将上清于4℃中120,000×g离心70分钟,收集沉淀用PBS重悬后,再次离心(4℃,120,000×g,70分钟),取沉淀获得三叉神经节组织外囊泡。
S3.TG-EVs的鉴定
通过NTA法(Nanoparticle Tracking Analysis)分析其粒径,透射电镜观察其表面形态为典型的双凹圆盘状,如图1所示,颗粒的半径在50-200nm之间,符合外囊泡的半径要求。表明提取出的囊泡是外囊泡(TG-EVs)。
实施例2、TG-EVs对BMSC的促成骨作用
S1.小鼠骨髓间充质干细胞(BMSC)的分离
8周C57BL6鼠断颈处死,无菌条件下取出颌骨,去除附着肌肉组织,PBS、α-MEM培养基反复冲洗干净,剪断骨两端,注射器吸取含有10%胎牛血清,青霉素链霉素双抗的α-MEM完全培养基冲出骨髓,直至骨质发白,之后每2~3d换液1次,约10天后细胞可用。
S2.TG-EVs对BMSC的促成骨作用
设置TG-EVs组:将60000个/ml BMSC接种于上述培养基中,隔天加入TG-EVs至终浓度为25ug/ml,隔2天换液的同时加入TG-EVs至终浓度为25ug/ml直至7天收样;
设置PBS组:将600,00个/ml BMSC接种于上述培养基中,隔天加入与TG-EVs组等体积的PBS,隔2天换液直至7天收样。所有组别均通过ALP,RT-qPCR、WB和免疫荧光检测成骨相关基因表达,用碱性磷酸酶染色和茜素红染色法检测BMSC成骨能力。如图2和图3结果显示,加入TG-EVs的BMSC成骨能力明显增强,其中OPG(Osteoprotegerin)为骨保护素,OSX(Osterix)为成骨细胞特异性转录因子。
实施例3、TG-EVs对颌骨缺损小鼠的骨修复作用
选取8周雄性C57BL6小鼠,用1.5mm牙科球钻在小鼠双侧下颌角区域制备下颌骨“临界骨缺损”模型,左侧缺损处放置TG-EVs(100ug/缺损),右侧骨缺损造模后加入等量PBS。7天后取材,观察TG-EVs对骨缺损修复的促进作用。图4结果显示加入TG-EVs可促进骨缺损修复。
实施例4
对于TG-EVs进行单囊泡分析显示,如图5所示,在损伤环境下TG-EVs出现明显的不同的各种EVs亚群;如图6所示,TG-Evs的颌骨修复作用与TG-EV表面携带的特征性的蛋白ITGAM,THY1有关。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动。这里无需也无法把所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明的保护范围。
以上实施例仅用于说明本发明的设计思想和特点,其目的在于使本领域内的技术人员能够了解本发明的内容并据以实施,本发明的保护范围不限于上述实施例。所以,凡依据本发明所揭示的原理、设计思路所作的等同变化或修饰,均在本发明的保护范围之内。
