一种口蹄疫二价mRNA疫苗及其制备方法和应用
文献发布时间:2024-04-18 20:02:18
技术领域
本发明属于口蹄疫疫苗技术领域,涉及一种口蹄疫二价mRNA疫苗及其制备方法和应用。
背景技术
口蹄疫(Foot and Mouth Disease,FMD)是当今国际上最重要的动物传染病之一,侵染对象为猪、牛、羊等主要畜种及其他家养和野生偶蹄动物,易感动物多达70余种。FMD是由FMDV引起的,FMDV基因组和其他小RNA病毒基因组结构相似,属单股正链RNA。病毒粒子的结构为二十面体对称的空间构象,外面为组成病毒衣壳的蛋白,内部为组成内核的RNA,衣壳包裹内核组成一个完整的病毒架构。衣壳由四种结构蛋白1A(VP4)、1B(VP2)、1C(VP3)和1D(VP1)各60个拷贝组成。4种结构蛋白形成一个原聚体,5个原聚体形成一个五聚体,沉降系数为12S。12个五聚体组装成一个病毒粒子,沉降系数为146S。FMDV的血清型有七种,分别为O型、A型、C型、SAT1型、SAT2型、SAT3型和AsiaⅠ型,其流行具有明显的地域性。研究表明,其中最易发生变异的为O型,其次为A型,最为保守的为亚洲Ⅰ型。
疫苗免疫仍是防控口蹄疫的首要选择。由于口蹄疫病毒血清型多且容易发生变异,致使流行毒株和疫苗株之间抗原匹配性不高,影响疫苗免疫效力和疫病预防效果。传统的减毒疫苗和灭活疫苗是利用大量培养动物细胞,然后感染口蹄疫病毒,经过培养、分离病毒,再用化学试剂使病毒灭活或减毒后制备而成。由于FMDV有多种血清型且易发生巨大的抗原变异,所以在防治FMD时,流行株与疫苗毒株的匹配性至关重要。同时,设计的灭活疫苗虽可以诱导强烈的抗体反应,但仅通过抗体水平去评价疫苗的有效性还存在一定的局限性,一般来讲,都是通过病毒直接攻击靶动物进行评价。但这些疫苗仅提供临床意义的保护,并不总能预防原发性感染。病毒载体疫苗是一种借助载体有效将抗原蛋白在动物机体传输的,从而使其在个体内进行合成,以致达到引起全身免疫反应的效果和作用。但是该类疫苗仍然需要一个相对较高的免疫剂量,生产成本较高,严重限制了兽用疫苗的推广和应用。此外,还有VLP疫苗、多肽疫苗、DNA疫苗等新型的FMDV疫苗被研制。相比之下,mRNA疫苗因为它特殊的结构和特点受到了广大科研工作者的青睐,具有开发速度快、易制备、可以体外快速设计合成和大规模生产,且能够诱导高效保护性免疫应答和生物安全风险低等优点。
因此,针对口蹄疫病毒变异造成的免疫逃逸问题,开发其mRNA应急储备疫苗意义重大。
发明内容
针对现有技术的不足和实际需求,本发明提供一种口蹄疫二价mRNA疫苗及其制备方法和应用,可以诱导较强体液免疫与细胞免疫应答,且免疫原性良好。
为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供了一种口蹄疫二价mRNA疫苗,所述口蹄疫二价mRNA疫苗含有mRNA分子和递送载体;所述mRNA分子包括编码O型口蹄疫病毒中VP1结构蛋白的基因序列和/或A型口蹄疫病毒中VP1结构蛋白的基因序列;所述递送载体包括脂质体纳米颗粒;所述脂质纳米颗粒包括可电离的阳离子脂质、中性辅助磷脂、胆固醇和聚乙二醇修饰的脂质。
本发明制备的mRNA疫苗可以诱导较强的体液免疫与细胞免疫应答,免疫原性良好,为研制口蹄疫紧急预防接种疫苗提供了新途径。
SEQ ID NO.1(A型VP1氨基酸序列):
ttatgesadpvtttvenyggetqvqrrhhtdvsfimdrfvqikpvspthvidlmqthqhglvgamlraatyyfsdleivvnhtgrltwvpngapeaaldntsnptayhkapftrlalpytaphrvlatvyngnskysapatrrgdlgslaarlaaqlpasfnygairateiqellvrmkraelycprpllavkvtsqdrhkqkiiapakqll。
SEQ ID NO.2(A型VP1基因序列):
accaccgcgaccggcgaaagcgcggatccggtgaccaccaccgtggaaaactatggcggcgaaacccaggtgcagcgccgccatcataccgatgtgagctttattatggatcgctttgtgcagattaaaccggtgagcccgacccatgtgattgatctgatgcagacccatcagcatggcctggtgggcgcgatgctgcgcgcggcgacctattattttagcgatctggaaattgtggtgaaccataccggccgcctgacctgggtgccgaacggcgcgccggaagcggcgctggataacaccagcaacccgaccgcgtatcataaagcgccgtttacccgcctggcgctgccgtataccgcgccgcatcgcgtgctggcgaccgtgtataacggcaacagcaaatatagcgcgccggcgacccgccgcggcgatctgggcagcctggcggcgcgcctggcggcgcagctgccggcgagctttaactatggcgcgattcgcgcgaccgaaattcaggaactgctggtgcgcatgaaacgcgcggaactgtattgcccgcgcccgctgctggcggtgaaagtgaccagccaggatcgccataaacagaaaattattgcgccggcgaaacagctgctg。
SEQ ID NO.3(O型VP1氨基酸序列):
ttstgesadpvtatvenyggetqvqrrhhtdvsfildrfvkvtprdqinvldlmqtpsytlvgallrtatyyfadlevavkhegdltwvpngapeaaldnttnptayhkapltrlalpytaphrvlatvyngnckyaagsltnvrgdlqvlaqkaarplptsfnygaikatrvtellyrmkraetycprpllavhpsearhkqkivapvkqsl。
SEQ ID NO.4(O型VP1基因序列):
accacttcgacaggcgagtcagccgaccccgtgactgccaccgttgagaactacggcggcgagacacaggtccagagacgccaccacacagacgtctcattcatactggacaggtttgtgaaagttacaccaagagaccaaataaatgtgctggacctgatgcaaaccccctcctacaccctggtaggggcgctccttcgtactgccacttactatttcgctgatctagaagtggcagtgaaacacgagggagacctcacctgggtgccaaatggagcacctgaggcagctttggacaacaccaccaacccaacggcgtaccacaaagcgccacttacccggcttgcactgccctacacggcaccacaccgtgttttggccaccgtttacaacgggaactgcaaatacgccgcgggctcactgaccaacgtgagaggtgatctccaggtgctggctcagaaggcggcgaggccgctgcctacttctttcaactacggtgccatcaaagccactcgggtgacagaactgctgtaccgcatgaagagggccgagacgtactgtcctcggcccctcttggctgtccacccgagtgaggctagacacaaacagaaaatagtggcacctgtgaagcagtccttg。
SEQ ID NO.5(A型VP1GH-loop环氨基酸序列131-163):
ngnskysapatrrgdlgslaarlaaqlpasfny。
SEQ ID NO.6(A型VP1GH-loop环基因序列131-163):
aacggcaacagcaaatatagcgcgccggcgacccgccgcggcgatctgggcagcctggcggcgcgcctggcggcgcagctgccggcgagctttaactat。
SEQ ID NO.7(A型VP1 C末端表位氨基酸序列188-212):
pllavkvtsqdrhkqkiiapakqll。
SEQ ID NO.8(A型VP1 C末端表位基因序列188-212):
ccgctgctggcggtgaaagtgaccagccaggatcgccataaacagaaaattattgcgccggcgaaacagctgctg。
SEQ ID NO.9(O型VP1GH-loop环氨基酸序列131-163):
ngnckyaagsltnvrgdlqvlaqkaarplptsf。
SEQ ID NO.10(O型VP1GH-loop环基因序列131-163):
aacgggaactgcaaatacgccgcgggctcactgaccaacgtgagaggtgatctccaggtgctggctcagaaggcggcgaggccgctgcctacttctttc。
SEQ ID NO.11(O型VP1 C末端表位氨基酸序列188-213):
prpllavhpsearhkqkivapvkqsl。
SEQ ID NO.12(O型VP1 C末端表位基因序列188-213):
tcggcccctcttggctgtccacccgagtgaggctagacacaaacagaaaatagtggcacctgtgaagcagtccttg。
SEQ ID NO.13(3A表位氨基酸序列):
AAIEFFEGMVHDSIK。
SEQ ID NO.14(3A表位基因序列):
gcggcgattgaattttttgaaggcatggtgcatgatagcattaaa。
SEQ ID NO.15(3D表位氨基酸序列):
IFSKHKGDTKMSPED。
SEQ ID NO.16(3D表位基因序列):
atttttagcaaacataaaggcgataccaaaatgagcccggaagat。
SEQ ID NO.17(破伤风类毒素CD4 T表位氨基酸序列):
CD4 T:QYIKANSKFIGITEL。
SEQ ID NO.18(破伤风类毒素CD4 T表位基因序列):
cagtatattaaagcgaacagcaaatttattggcattaccgaactg。
优选地,所述mRNA分子还包括T细胞表位。
优选地,所述O型口蹄疫病毒中VP1结构蛋白的来源包括O/Mya/98毒株;所述A型口蹄疫病毒中VP1结构蛋白的来源于A/WH/CHA/09毒株。
优选地,所述编码O型口蹄疫病毒中VP1结构蛋白的基因序列和/或A型口蹄疫病毒中VP1结构蛋白的基因序列包括编码完整VP1的基因序列和/或编码VP1结构蛋白中免疫细胞识别表位的基因序列。
优选地,所述编码VP1结构蛋白中免疫细胞识别表位的基因序列包括GH-loop环和/或C末端表位。
优选地,所述T细胞表位包括FMDV结构蛋白3A的T细胞表位、FMDV 3D的T细胞表位或破伤风类毒素CD4 T细胞表位中的任意一种或至少两种的组合。
优选地,所述T细胞表位为FMDV结构蛋白3A的T细胞表位和破伤风类毒素CD4 T细胞表位的组合。
优选地,所述口蹄疫二价mRNA疫苗在mRNA编码区的N端含有分泌信号肽,所述口蹄疫二价mRNA疫苗在mRNA编码区的C端含有标签蛋白。
优选地,所述分泌信号肽的氨基酸序列包括SEQ ID NO.19所示的序列。
SEQ ID NO.19:GVKVLFALICIAVAEA。
优选地,所述标签蛋白包括Flag蛋白序列。
优选地,所述mRNA的编码区的核苷酸序列经过密码子优化。
优选地,所述密码子优化包括GC含量优化、密码子偏好性优化、mRNA二级结构优化、mRNA不稳定序列优化、核糖体结合位点优化、相邻密码子关联性优化、提高mRNA的翻译效率或提高蛋白折叠正确率中的任意一种或至少两种的组合。
优选地,所述mRNA分子还含有linker,所述linker包括(GGGGS)
优选地,所述mRNA分子的5’端含有帽子结构、5’UTR和Kozak序列,所述mRNA分子的3’端含有3’UTR和聚腺苷酸PolyA序列。
优选地,所述帽子结构的添加方式包括酶法加帽或共转录加帽。
优选地,所述mRNA分子的核苷酸序列中含有经过化学修饰的碱基。
优选地,聚腺苷酸PolyA长度为50-200nt。
上述50-200nt中的具体点值可以选择50nt、60nt、80nt、100nt、120nt、140nt、160nt、180nt、200nt等。
第二方面,本发明提供了一种制备第一方面所述的口蹄疫二价mRNA疫苗的方法,所述方法包括以下步骤:
(1)将脂质体纳米颗粒溶于无水乙醇中,构成有机相,所述脂质体纳米颗粒包括可电离的阳离子脂质、中性辅助磷脂DSPC、胆固醇和聚乙二醇修饰的磷脂;
(2)将mRNA分子溶于柠檬酸钠缓冲液中,构成水相;
(3)将有机相与水相混合,使用微流控设备混匀得到LNP-mRNA混合液,透析、超滤浓缩,得到所述口蹄疫二价mRNA疫苗。
优选地,所述可电离的阳离子脂质、中性辅助磷脂DSPC、胆固醇和聚乙二醇修饰的磷脂的摩尔比为50:10:(30-40):(1-2)。
上述30-40中的具体点值可以选择30、31、32、33、34、35、36、37、38、39、40等。
优选地,所述脂质体纳米颗粒与mRNA分子的N/P摩尔比为(5-10):1。
上述5-10中的具体点值可以选择5、6、7、8、9、10等。
第三方面,本发明提供了第一方面所述的口蹄疫二价mRNA疫苗在抗口蹄疫病毒感染中的应用。
具体地,包括在豚鼠模型中诱导产生体液免疫应答的应用,在诱导产生细胞免疫应答的应用,在保护动物模型小鼠免受多种口蹄疫病毒的侵害的应用。
与现有技术相比,本发明具有如下有益效果:
本发明制备的mRNA疫苗可以诱导较强的体液免疫与细胞免疫应答,免疫原性良好,为研制口蹄疫紧急预防接种疫苗提供了新途径。
附图说明
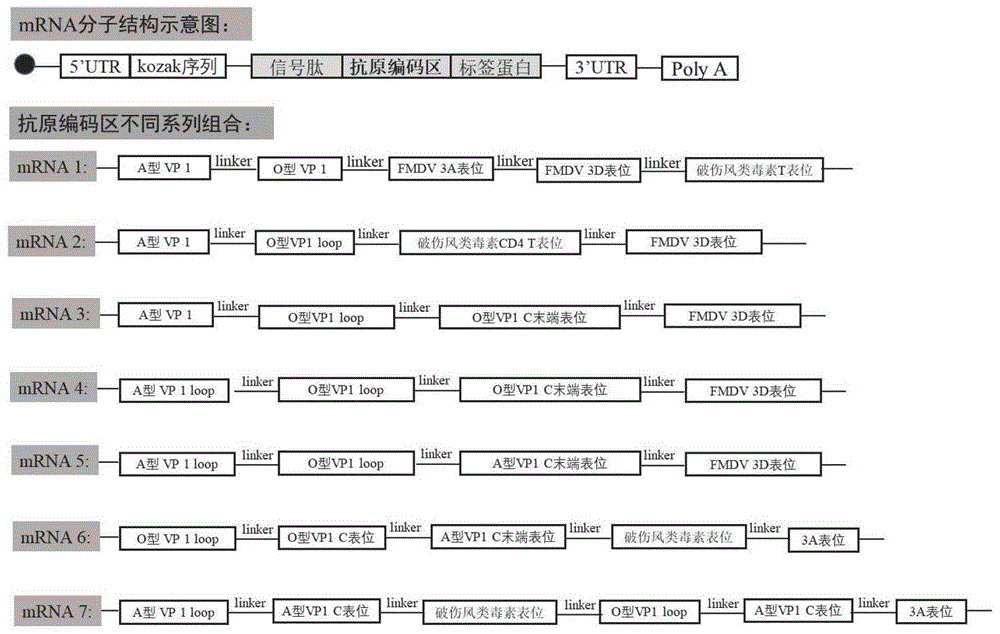
图1为二价mRNA疫苗的结构设计示意图;
图2为Dot-blot检测抗原蛋白的表达和分泌结果图;
图3为豚鼠免疫血清抗体水平结果图;
图4为免疫后豚鼠后脾细胞IL-4与IFN-γ的ELISA检测结果图。
具体实施方式
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
实施例1
口蹄疫病毒mRNA疫苗的设计。
口蹄疫病毒mRNA疫苗序列包含以下元件:T7启动子、帽子结构、5’端非翻译区(5’UTR)、信号肽序列、编码抗原的mRNA序列、标签肽、3’端非翻译区(3’UTR)和多聚腺苷酸(polyA)。
其中编码抗原的mRNA序列具有多种组合,图1为二价mRNA疫苗的结构设计示意图。
实施例2
mRNA分子的制备与检测。
实施例1中设计的mRNA序列交由上海生工公司合成,质粒载体为pUC57,经转化测序验证,序列与设计的序列一致。将合成质粒加入至感受态DH5α感受态细胞中进行转化构建工程菌,利用LB培养基进行工程菌的克隆培养,收获菌体后采用碱裂解法提取质粒,并进一步采用凝胶过滤色谱层析进行质粒的纯化,以获得高纯度的超螺旋质粒。
将超螺旋质粒用限制性核酸内切酶BbSI线性化。用T7体外转录试剂盒进行转录,用DNaseI消化转录模板,并用沉淀法纯化mRNA。进一步采用Cap1加帽试剂盒给mRNA加帽,并用Thermo公司的dT亲和填料对mRNA进行纯化。
采用琼脂糖电泳、尿素电泳分别分析mRNA的纯度以及加帽比例,结果如表1所示。表明本发明制备得到的mRNA纯度高,加帽率高。
表1
实施例3
mRNA的细胞表达评价。
将纯化后的体外转录RNA通过Mirus公司TransIT
实施例4
LNP-mRNA疫苗的的制备。
第一种制备:将脂质以阳离子脂质(SM102):二硬酯酰磷脂酰胆碱(DSPC):胆固醇:DMG-2000=50:10:38.5:1.5(摩尔比)比例溶解在无水乙醇中;pH4.0的柠檬酸缓冲液(50mM)作为溶解mRNA的溶质;根据N/P=6,水油比=3,通过微流控设备以醇相:水相(体积比为1:3)进行mRNA的包装。接着以无RNase的PBS缓冲液进行透析,使用30KDa超滤管对其进行浓缩换液。加入等体积蔗糖浓度为20%的PBS溶液,使用0.22μm滤膜对其过滤,即为制备好的LNP-mRNA疫苗,分装后置于-20℃储存。对制备的LNP-mRNA颗粒进行表征分析,包括纳米颗粒的大小、分散指数、包封率测定。采用动态光散射法(DLS法)对制备纳米颗粒的大小和分散指数(PDI)情况进行分析,采用Quant-iT
表2
第一种制备:将脂质以阳离子脂质(SM102):二硬酯酰磷脂酰胆碱(DSPC):胆固醇:DMG-2000=50:10:40:2(摩尔比)比例溶解在无水乙醇中;pH4.0的柠檬酸缓冲液(50mM)作为溶解mRNA的溶质;根据N/P=5,水油比=3,通过微流控设备以醇相:水相(体积比为1:3)进行mRNA的包装。接着以无RNase的PBS缓冲液进行透析,使用30KDa超滤管对其进行浓缩换液。加入等体积蔗糖浓度为20%的PBS溶液,使用0.22μm滤膜对其过滤,即为制备好的LNP-mRNA疫苗,分装后置于-20℃储存。对制备的LNP-mRNA颗粒进行表征分析,包括纳米颗粒的大小、分散指数、包封率测定。采用动态光散射法(DLS法)对制备纳米颗粒的大小和分散指数(PDI)情况进行分析,采用Quant-iT
第三种制备:将脂质以阳离子脂质(SM102):二硬酯酰磷脂酰胆碱(DSPC):胆固醇:DMG-2000=50:10:30:1(摩尔比)比例溶解在无水乙醇中;pH4.0的柠檬酸缓冲液(50mM)作为溶解mRNA的溶质;根据N/P=10,水油比=3,通过微流控设备以醇相:水相(体积比为1:3)进行mRNA的包装。接着以无RNase的PBS缓冲液进行透析,使用30KDa超滤管对其进行浓缩换液。加入等体积蔗糖浓度为20%的PBS溶液,使用0.22μm滤膜对其过滤,即为制备好的LNP-mRNA疫苗,分装后置于-20℃储存。对制备的LNP-mRNA颗粒进行表征分析,包括纳米颗粒的大小、分散指数、包封率测定。采用动态光散射法(DLS法)对制备纳米颗粒的大小和分散指数(PDI)情况进行分析,采用Quant-iT
实施例5
mRNA口蹄疫疫苗的免疫原性。
用实施例4第一种制备得到的mRNA二价口蹄疫疫苗为抗原,采用300~500g重的豚鼠为动物模型,后大腿内侧肌肉注射(抗原含量约5μg/mL疫苗),初次免疫后14d加强一次免疫,28d采血。每组处死3只分离培养脾细胞,利用ELISA方法检测脾细胞分泌的IL-4和IFN-γ水平。同时使用流式细胞仪测定T淋巴细胞亚群变化情况。
分别利用O型口蹄疫病毒灭活颗粒、A型口蹄疫病毒灭活颗粒包板,利用酶联免疫吸附法检测免疫小鼠血清ELISA抗体效价。结果如图3所示,使用本发明所制备的mRNA二价口蹄疫疫苗以5μg/只的剂量经肌肉免疫接种豚鼠后产生了高滴度的IgG抗体。说明本发明所制备的mRNA二价口蹄疫疫苗能够刺激机体产生较强的免疫原性。免疫原在不同的二价口蹄疫疫苗之间均能产生高的抗体滴度,表明多血清型抗原制备成联合疫苗后,各血清型之间无免疫抑制效果。取免疫28d的血清进行细胞因子检测,试验结果如图4所示,mRNA疫苗能刺激机体产生IFN-γ和IL-4,其水平显著高于对照组。试验结果表明mRNA疫苗能够刺激强大的细胞免疫。
实施例6
口蹄疫毒株感染保护实验。
用实施例5制备得到的mRNA疫苗和LNP、PBS对照样品分别免疫300~500g重的豚鼠,每组12只,后大腿内侧肌肉注射,豚鼠均在首免后第14天加强免疫1次。免疫豚鼠饲养至35dpv时,将每组的12只随机平均分成2组,分别用0.2mL的50倍GPID50(50%豚鼠感染剂量)的口蹄疫病毒(FMDV/A/WH/09株、FMDV/O/Mya/98株)注射免疫豚鼠左后腿的脚趾中。连续观察14d并记录豚鼠发病情况,计算攻毒保护率:豚鼠攻毒保护率=(未发病数/总数)×100%。其中,保护程度分3个等级:“不保护”代表2只后脚掌都发病;“部分保护”代表穿刺接种的后脚掌发病;“完全保护”代表2只后脚掌都未发病。结果如表3所示,表明PBS组和LNP组的所有豚鼠均出现明显的FMD发病症状。与对照组相比,mRNA疫苗免疫动物中以50倍GPID50病毒攻击时,仅有1只发病症状,提供了3/4的保护,表明本发明mRNA疫苗能够对FMDV/Re-A/WH/09株攻击动物提供一定的保护作用。
表3
综上所述,本发明获得了以FMDV VP1基因为核心的二价mRNA分子,转染细胞后,验证了mRNA转染细胞的蛋白表达,制备了FMDV结构蛋白VP1基因mRNA疫苗。通过检测实验动物抗体、IL-4、IFN-γ和攻毒保护试验,表明mRNA二价口蹄疫疫苗可以诱导机体产生体液免疫和细胞免疫,用50倍的GPID50攻毒时对实验组豚鼠提供了83%以上的保护,该发明为研制新型候选FMDV二价疫苗提供了新思路,为FMD的有效防控提供了参考。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
