一种小鼠嵌合脑-电极复合体模型及其构建方法
文献发布时间:2024-04-18 20:02:18
技术领域
本发明涉及生物技术领域,具体来说涉及一种小鼠嵌合脑-电极复合体模型及其构建方法。
背景技术
人脑类器官的细胞发育轨迹和基因表达模式与人脑发育相近,并且由于其自组织特性,细胞类型丰富度以及神经网络复杂度更加接近人类正常大脑,因此是体外模拟人类大脑的先进模型。但由于长期培养过程中体积的增大以及缺乏脉管系统,脑类器官中心部分缺乏营养物质交换,导致脑类器官发育不良,仅仅能模拟发育初期的胎儿大脑。将脑类器官植入到小鼠皮层,构建脑类器官-小鼠嵌合脑模型,使得脑类器官获得小鼠的血管支持以及适宜的微环境,对脑类器官发育成熟至关重要。但是,作为外源性组织移植物,脑类器官于宿主体内发育的长时程稳定电生理检测仍有很大的技术难点。
发明内容
为了解决上述技术方案的不足,本发明的目的在于提供一种小鼠嵌合脑-电极复合体模型的构建方法。
本发明的另一目的在于提供一种上述构建方法构建的小鼠嵌合脑-电极复合体模型。
本发明的目的是通过下述技术方案予以实现的。
一种小鼠嵌合脑-电极复合体模型的构建方法,包括以下步骤:
步骤1,体外构建表达绿色荧光蛋白(GFP)的自主装皮质脑类器官。
步骤2,在小鼠颅骨上构建自由开合的自体颅骨窗,再移除小鼠部分大脑皮层,形成空腔,向所述空腔中植入自主装皮质脑类器官,还纳颅骨盖并饲养小鼠至设定时间后,剃除小鼠头顶毛发,将小鼠固定,并保持颅骨面水平,对小鼠头皮消毒,再充分暴露出移植部位颅窗及其他部位的硬性骨质层。
步骤3,打开并移除移植部位的颅窗,扩大暴露的皮层面积,以适配柔性电极,在非移植部位均匀安装多个颅钉,在安装过程中滴加生理盐水防止产热和颅骨飞屑,用紫外光照射移植部位,自主装皮质脑类器官在紫外光的照射下发出绿色荧光,用以确认柔性电极的植入位置。
步骤4,避开毛细血管,将小鼠的硬脑膜移除,再将与信号采集系统连接的柔性电极与颅骨面垂直植入移植部位中心,并将柔性电极上的地线缠绕在多个所述颅钉上,在植入过程中,当柔性电极丝触碰到皮层表面时,记为深度值的0点,直至到达目标深度。
步骤5,颅骨面清洁并保持干燥,将组织胶均匀滴在颅窗内,以对裸露出来的脑组织形成保护作用,并使用牙科水泥封装柔性电极,得到小鼠嵌合脑-电极复合体模型。
在所述步骤1中,体外构建表达绿色荧光蛋白(GFP)的自主装皮质脑类器官,包括以下步骤:将H9-GFP人胚胎干细胞于多能干细胞培养基(mTesR Plus)中进行培养,至拥有合适的细胞融合度,形成克隆形态后,使用Accutase将形成的克隆形态消化成单细胞悬液,将所述单细胞悬液中的单细胞接种在孔板中,置于神经诱导培养基培养,得到拟胚体,将拟胚体转移至另一种孔板中,置于神经分化培养基中,在水平摇床中培养至设定时间后,更换至成熟培养基中,继续旋转培养38~42天,得到自主装皮质脑类器官。
在上述技术方案中,步骤2包括以下步骤:
步骤2.1,使用颅钻以Nod-SCID小鼠颅骨的骨缝为“铰链”构建自由开合的自体颅骨窗,用真空抽吸系统移除小鼠部分大脑皮层,形成空腔,其中,所述骨缝为冠状缝、矢状缝或人字缝,所述自由开合的方式为向上开合、向下开合、向左开合或向右开合。
步骤2.2,向所述空腔中植入切割好的所述自主装皮质脑类器官,形成移植部位,还纳颅骨盖并饲养小鼠一个月。
步骤2.3,逆着小鼠的毛发剃除小鼠头顶毛发,剃毛范围为两耳之间,前至两眼间,后至颈部始端,将小鼠固定,并保持颅骨面水平,小鼠的头部不能移动,给小鼠的眼部涂抹眼膏,以防手术灯的长时间照射造成眼部损伤以及保持眼睛的湿润。
步骤2.4,对小鼠头皮消毒,去除颅骨上的粘膜,摩擦颅骨表面,充分暴露出移植部位的颅窗及其他部位的硬性骨质层,再刮涂颅骨表面,以使颅骨表面粗糙,便于后续牙科水泥的粘连固定。
在所述步骤2中,所述小鼠部分大脑皮层为初级运动皮层、初级体感皮层或初级视觉皮层。
在所述步骤3中,所述紫外光的波长为365nm,用该波长的紫外光照射自主装皮质脑类器官可发出绿色荧光,以提高柔性电极的植入准确率,且无需借助其他影像学定位。
在所述步骤4中,所述柔性电极为单针柔性电极、双针柔性电极或多针柔性电极。
上述构建方法得到的小鼠嵌合脑-电极复合体模型。
本发明的优点和有益效果为:
1、本发明构建的小鼠嵌合脑-电极复合体模型在自主装皮质脑类器官上植入柔性电极,该柔性电极与信号采集系统连接,使得单个个体长时程拥有稳定的电生理信号记录。
2、本发明可以长期稳定地监测移植到小鼠皮层内的脑类器官神经电生理活动,为研究脑类器官神经网络发育提供技术支撑。
3、本发明的构建方法,柔性电极可以长期稳定地监测移植入小鼠皮层的脑类器官电生理活动长达120天,构建完成后120天后,对小鼠脑进行切片观察,植入的脑类器官在宿主皮层内整合良好。
附图说明
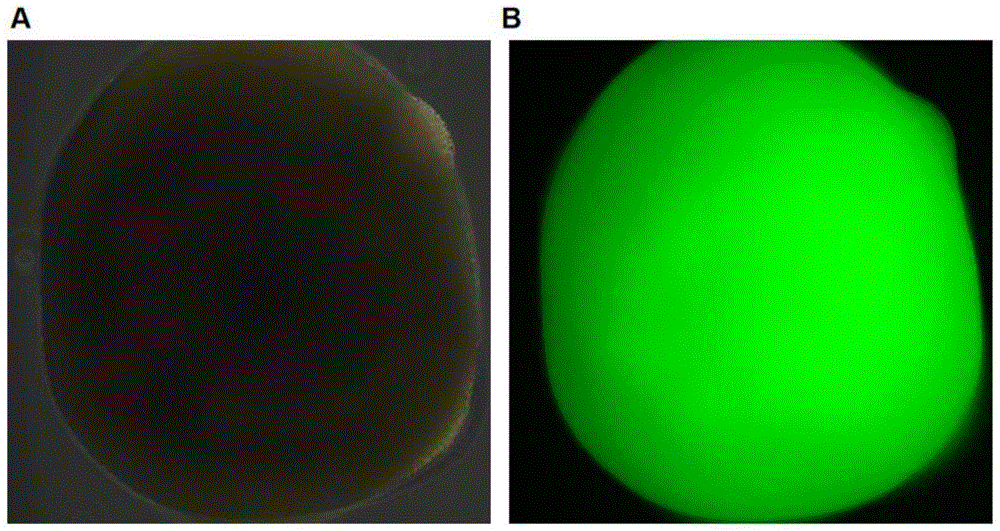
图1为培养第40天的自主装皮质脑类器官的整体形态,其中,A:培养第40天,自主装皮质脑类器官显微镜明场图像;B培养第40天,自主装皮质脑类器官显微镜荧光图像。
图2为自主装皮质脑类器官植入小鼠皮层的过程图,其中,A:自体颅骨开窗;B:真空抽吸构建空腔;C:切割后的自主装皮质脑类器官;D:左:皮质类器官植入到空腔中;右:闭合颅骨窗。
图3为柔性电极植入到自主装皮质脑类器官的过程图,其中,A:钻入颅钉并打开颅窗;B:紫光灯下定位移植部位的位置;C:缓慢植入电极;D:迅速抽出钨丝;E:牙科水泥封装;F:小鼠嵌合脑-电极复合体模型构建完成。
图4为自主装皮质脑类器官于小鼠皮层内整合图。
图5为柔性电极于自主装皮质脑类器官内插痕检测,其中虚线框内的痕迹为电极植入时留下的插痕,证明电极采集的信号源自皮质类器官而不是宿主皮层。
图6为自主装皮质脑类器官的场电位时频图。
图7为自主装皮质脑类器官的峰电位波形图。
图8为自主装皮质类器官的所有通道的放电栅格图。
图9为植入120天自主装皮质脑类器官与小鼠皮层整合的光镜图。
图10为紫光灯下自主装皮质脑类器官与小鼠皮层整合的荧光图像。
具体实施方式
下面结合具体实施例进一步说明本发明的技术方案。
实施例1
一种小鼠嵌合脑-电极复合体模型的构建方法,包括以下步骤:
步骤1,体外构建表达绿色荧光蛋白(GFP)的自主装皮质脑类器官,其中,外构建表达绿色荧光蛋白(GFP)的自主装皮质脑类器官,包括以下步骤:将H9-GFP人胚胎干细胞于多能干细胞培养基(mTesR Plus)中进行培养,至拥有合适的细胞融合度,形成克隆形态后,使用Accutase将形成的克隆形态消化成单细胞悬液,按照12000个细胞/孔的密度将所述单细胞悬液中的单细胞接种在低黏附96孔板中,置于神经诱导培养基培养,得到拟胚体,将拟胚体转移至6孔板中,置于神经分化培养基中,在水平摇床进行中培养第18天后,更换至成熟培养基中,继续旋转培养38~42天,得到自主装皮质脑类器官。
如图2所示,步骤2,将小鼠麻醉,在小鼠颅骨上构建自由开合的自体颅骨窗,再移除小鼠部分大脑皮层,形成空腔,向所述空腔中植入自主装皮质脑类器官,还纳颅骨盖并饲养小鼠一段时间后,剃除小鼠头顶毛发,将小鼠固定,并保持颅骨面水平,对小鼠头皮消毒,再充分暴露出移植部位颅窗及其他部位的硬性骨质层,其中,所述小鼠部分大脑皮层为初级运动皮层、初级体感皮层或初级视觉皮层,包括以下步骤:
步骤2.1,使用颅钻以Nod-SCID小鼠颅骨的冠状缝为“铰链”构建自由开合的自体颅骨窗,用真空抽吸系统移除小鼠部分大脑皮层,形成空腔。
步骤2.2,向所述空腔中植入切割好的所述自主装皮质脑类器官,形成移植部位,还纳颅骨盖并饲养小鼠一个月。
步骤2.3,将小鼠重新麻醉,用小动物剃毛器逆着小鼠的毛发剃除小鼠头顶毛发,剃毛范围为两耳之间,前至两眼间,后至颈部始端,将小鼠固定(首先将一侧耳杆固定,找到小鼠耳道稍向前上方的骨性凹陷处,将其中一侧的凹陷处贴在固定的耳杆上,同时将另一侧耳杆也插入对应的位置,调节两侧耳杆长度,使之对称,固定紧耳杆,向各个方向轻轻移动小鼠的头部,避免出现松动及偏斜),适当调整各固定点,保持颅骨面水平,从各个方向均不能移动小鼠的头部,给小鼠的眼部涂抹红霉素眼膏,以防手术灯的长时间照射造成眼部损伤以及保持眼睛的湿润。
步骤2.4,对小鼠头皮消毒,使用手术剪刀将皮肤剪开,使用眼科剪去除颅骨上的粘膜,用棉签摩擦颅骨表面,充分暴露出移植部位的颅窗及其他部位的硬性骨质层,再使用眼科剪轻轻刮涂颅骨表面,以使颅骨表面粗糙,便于后续牙科水泥的粘连固定。
如图3所示,步骤3,使用颅钻打开并移除移植部位的颅窗,扩大暴露的皮层面积,以适配柔性电极(在颅钻使用过程中,不能立即钻透颅骨,需留下较薄的一层(按压开口处的颅骨松动无较大阻力),将打磨后的颅骨从一侧钩起,利用细镊子从钩起的位置将其夹去),在非移植部位均匀安装3个颅钉,颅钉安装深度为0.6~1mm,以防挤压到颅内脑膜,在安装过程中滴加生理盐水防止产热和颅骨飞屑,用紫外光照射移植部位,自主装皮质脑类器官在365nm的紫外光的照射下发出绿色荧光(用该波长的紫外光照射自主装皮质脑类器官可发出绿色荧光,以提高柔性电极的植入准确率,且无需借助其他影像学定位),用以确认柔性电极的植入位置。
步骤4,利用尖端折弯的注射器针头在无血管的地方将硬脑膜小心挑破,钩起一侧,利用镊子将硬脑膜轻轻移除,在此过程中避开毛细血管(因为血管的破坏会在一定程度上影响到此区域神经元的活性,而且出血过多会影响手术植入),将柔性电极基座小心地固定在定位仪上的夹持器上,并将柔性电极与信号采集系统连接,调整角度使柔性电极与颅骨面垂直植入移植部位中心,将柔性电极上的地线缠绕在多个所述颅钉上,在植入过程中,当柔性电极丝触碰到皮层表面时,记为深度值的0点,直至到达目标深度(达到目标深度后,需要用无菌生理盐水缓慢冲洗电极顶端用于固定支撑体钨丝的水溶性胶水,将其取出后快速抽出钨丝,将柔性电极留在脑类器官移植部位),且可以实时观察信号采集系统显示的信号,在电极丝进入到脑组织后,噪音信号会迅速地减弱,此时的噪音基线单向不应超过30μV,其中,所述柔性电极为单针柔性电极。
步骤5,颅骨面清洁并保持干燥,将组织胶均匀滴在颅窗内,以对裸露出来的脑组织形成保护作用,并使用牙科水泥封装柔性电极(使用浓度较低的牙科水泥,使其自然流进电极阵列的缝隙中,外围涂上浓度较高的牙科水泥进行固定,在封装过程中,小心地去掉电极的连线及夹持器,且颅骨连同颅钉和地线都使用牙科水泥封住),在这个过程中尽量避免牙科水泥与小鼠皮肤开口及粘膜的接触,因为牙科水的刺激性可能会导致小鼠状态变差,得到小鼠嵌合脑-电极复合体模型。
本实施例的信号采集系统包括Blackrock多通道神经信号采集器和Intan神经信号采集器,将用于连接的Headstage插入小鼠头部的柔性电极接口,在信号采集器软件端设置好对于工频噪声的滤除,以及采集数据的采样率,即可对信号进行采集与记录,在手术过后妥善安置小鼠,饲养1周后可进行电信号的正常采集。
图1为培养第40天的自主装皮质脑类器官的整体形态,由图1中的A可知,自主装皮质脑类器官整体圆润,由图1中的B可知,图中的绿色为自主装皮质脑类器官自发荧光。
由图4可知,绿色的部分为植入的自主装皮质脑类器官,可见移植物与小鼠皮层整合良好。
由图5可知,其中虚线框内的痕迹为电极植入时留下的插痕,证明电极采集的信号源自自主装皮质脑类器官而不是宿主皮层。
图6通过Intan神经信号采集器检测到的植入到小鼠脑皮层的自主装皮质脑类器官的场电位时频图,可见自主装皮质脑类器官神经元集群的放电模式,在横坐标所示10秒时间内,自主装皮质脑类器官神经集群的放电集中在中低频段。
图7为通过Intan神经信号采集器检测到的植入到小鼠脑皮层的自主装皮质脑类器官的峰电位波形图,可见其幅值集中在几十微伏范围,波形各异,说明其来源包括不同类型的神经元。
图8为通过Intan神经信号采集器检测到的植入到小鼠脑皮层的自主装皮质类器官的所有通道的放电栅格图,自主装皮质脑类器官神经元放电分布较为分散,纵轴所示不同通道之间尚未发现较高的同步性。
图9为植入120天自主装皮质脑类器官与小鼠皮层整合的光镜图,黑色虚线内为整合的皮质类器官。
图10为紫光灯下自主装皮质脑类器官与小鼠皮层整合的荧光图像,黑色虚线内绿色的部分为皮质类器官。
以上对本发明做了示例性的描述,应该说明的是,在不脱离本发明的核心的情况下,任何简单的变形、修改或者其他本领域技术人员能够不花费创造性劳动的等同替换均落入本发明的保护范围。
