用于荧光成像和早期诊断的多荧光团纳米报道物
文献发布时间:2024-04-18 20:02:18
技术领域
本发明涉及多荧光团纳米报道物(nanoporter)及其在荧光成像和早期诊断中的应用。
背景技术
在本说明书中对先前公开的文献的列表或讨论不一定应被视为承认该文献是现有技术的一部分或者是公知常识。
纳米技术的进步使得纳米颗粒传感剂得到了广泛的发展,对生物学的基本理解、治疗响应的密切监测和疾病的灵敏诊断产生了影响。由于光学检测的优点,包括高时空分辨率、高灵敏度和安全的非电离辐射,已经致力于开发用于传感应用的光学纳米颗粒的巨大努力。由于信号放大和复用能力,光学纳米颗粒在体外诊断中发现了其独特的地位。尽管用于药物递送的纳米颗粒的优异的靶向能力、有效的积累和延长的血液循环时间,但它们的体内传感应用主要限制于临床前环境,因为它们的大尺寸和光学活性组成往往导致全身给药后从活体清除缓慢,引起长期毒性问题。此外,光散射和组织重吸收的问题使得光学纳米颗粒仅对浅成像有效,进一步阻碍了它们的临床转化。因此,非常期望非常规传感策略来增强光学纳米颗粒的体内检测能力以进行早期诊断。
小分子和纳米颗粒之间的体内相互转化提供了一种精确的方法,以发挥它们各自的优点以相互补偿,用于先进的成像和治疗应用。响应于疾病生物标志物(诸如pH、水解酶、碱性磷酸酶、弗林蛋白酶和胱天蛋白酶-3/7)的小分子荧光探针的体内自组装已被证明在癌症成像中具有比小分子对应物更高的信号背景比。这归因于小分子和纳米颗粒两者的组合药代动力学优点:荧光探针的小尺寸确保了深层组织的渗透和对主要器官的广泛生物分布,而生物标志物活化的纳米颗粒形成延长了在疾病部位的滞留。类似地,纳米颗粒在体内分解成超小纳米颗粒或小分子片段已被示出增强成像组分对靶向组织的渗透,同时促进在缩短的时间范围内清除。例如,按需将卟啉微泡转化为纳米颗粒,避开微型颗粒的差增强的渗透性和滞留,导致改善的肿瘤的光学成像。此外,针对生物标志物从无机纳米颗粒的染料-肽缀合物的原位裂解和分解应用于灵敏的癌症诊断和增强靶向的肿瘤治疗。尽管残留的无机纳米颗粒停留在疾病部位,但裂解的染料-肽缀合物可以经肾清除,提供了一种经由荧光尿检测来检测癌症的便利方法。因此,这些研究强调了分子-纳米颗粒相互转化的前途,以解决光学纳米颗粒用于体内检测的内在挑战。然而,尚未报道用于体内传感的能够将纳米颗粒完全原位转化为小分子的合成方法。
因此,存在需要以发现新的纳米报道物(nanoreporter)用于荧光成像和早期诊断。
附图说明
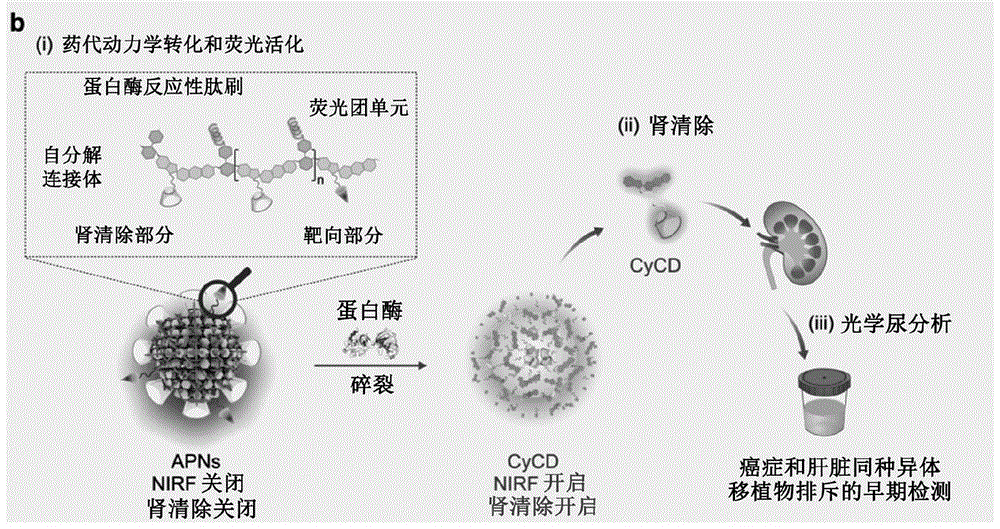
图1描绘了用于癌症和急性肝脏同种异体移植物排斥的实时成像和非侵入性纵向尿分析的原位纳米颗粒至分子药代动力学转化传感方法的设计。(a)经由基于APN的光学尿分析的早期检测癌症和急性肝脏同种异体移植物排斥的示意图;(b)用于成像和尿分析的APN的纳米颗粒至分子的药代动力学转化和荧光开启的分子机制;(c)蛋白酶-反应性肽刷(brush)(肽序列:Ac-FK和Ac-IEFD)、肾清除部分(HPβCD)和各自APN的靶向部分(cRGD)的化学结构;以及(d)APN及其荧光片段CyCD或CyRGD在响应于其各自蛋白酶的化学结构(对于APN
图2描绘了APN的体外传感评价。(a,e)APN(10μM)与其各自的蛋白酶(0.5μg,CatB或GzmB)在37℃下温育之前和之后的荧光光谱。荧光在650nm处激发。插图:在675nm处激发时在720nm处获得的相应荧光图像。a.u.,任意单位;(b,f)APN(10μM)在37℃下与在PBS(10mM,pH7.4)中的指示的活性氧(90μM)、酶和其他分析物(90μM,过量)温育后,在720nm处的近红外荧光(NIRF)变化。·OH,羟基自由基;H
图3描绘了APN
图4描绘了(a&d)CT26细胞、LM3细胞和AML-12细胞在与不同浓度的PBS、APN
图5描绘了APN及其活化片段的生物分布和清除途径。(a)活小鼠中肾和肝胆清除途径的示意图;(b)CyCD(R=H或CH
图6描绘了(a&c)在37℃下PBS缓冲液(10mM,pH 7.4)中CyCD和CyRGD(30μM)的吸收(暗)和荧光(红)光谱;(b&d)活小鼠中注射CyCD和CyRGD(2.5μmol kg
图7描绘了APN
图8描绘了(a-c)分别静脉内注射PBS(0.2mL)、CyCD(2.5μmol kg-1体重)和CyRGD(2.5μmol kg
图9描绘了使用组织学分析的体内生物相容性研究。静脉内注射CyCD(2.5μmolkg
图10描绘了使用光学表征和MALDI-TOF质谱法对CyCD和CyRGD的体内稳定性研究。静脉内注射(a)PBS、(b)CyCD和(c)CyRGD后活小鼠尿样品的吸收和荧光光谱。在静脉内注射后通过对尿样品的MALDI-TOF质量分析来进行CyCD和CyRGD的体内稳定性研究;以及(d-e)PBS中纯化合物(CyCD和CyRGD)的MALDI-TOF质量分析也指示用于比较。与PBS中的纯化合物的质量范围相比,尿中排泄的CyCD和CyRGD具有相同的质量范围。请注意,CyCD和CyRGD的MALDI-TOF质谱是在反射模式(reflector mode)下进行的。
图11描绘了原位肝癌的实时成像和尿分析。(a)APN
图12描绘了APN
图13描绘了在活小鼠中使用APN
图14描绘了荷瘤小鼠中的离体NIRF成像和尿分析。(a)肿瘤植入15天后,在静脉内注射APN
图15描绘了活小鼠中癌症的实时体内NIRF成像。(a)活小鼠在不同的肿瘤植入后时间点(2、5、10或15天)注射APN
图16描绘了荷瘤小鼠在不同肿瘤植入时间点的离体NIRF成像。(a)CT26荷瘤小鼠的发展和不同肿瘤植入时间点的NIRF成像的示意图。静脉内注射APN
图17描绘了活小鼠中原位肝癌的实时体内NIRF成像。(a)HCC LM-3荷瘤小鼠的发展和静脉内注射APN
图18描绘了癌症的实时成像和尿分析。(a)APN
图19描绘了原位肝脏肿瘤小鼠中的离体NIRF成像和组织学研究。(a&b)在不同肿瘤植入后时间点(3、8或14天)静脉内注射APN
图20描绘了急性免疫介导的肝炎的实时成像和纵向尿分析。(a)伴刀豆球蛋白A(Con-A)诱导的急性免疫介导的肝炎中APN
图21描绘了活小鼠中免疫介导的肝炎的实时体内NIRF成像。(a)免疫介导的肝炎小鼠模型的发展和不同处理后时间点的成像的示意图。将Con-A以12.5mg kg
图22描绘了(a)各种处理后小鼠的石蜡包埋肝脏和肾脏切片中H&E染色的代表性显微照片。组织学研究示出,Con-A或LPS攻击后肾脏没有组织学变化。然而,Con-A处理后12h仅观察到肝脏中大量肝坏死(比例尺:200μm)。实验独立重复三次,结果相似;(b)各种处理后小鼠肝脏切片的共聚焦荧光显微术图像。蓝色和绿色信号分别来自DAPI和GzmB抗体染色;以及红色通道表示来自活化的APN
图23描绘了肝脏、肾脏和膀胱中APN
图24描绘了免疫介导的肝炎的小鼠模型中APN
图25描绘了免疫介导的肝炎的小鼠模型中活化的APN
图26描绘了Con-A处理后白细胞中GzmB表达的流式细胞术分析。定量图示出小鼠在不同处理之后(a)肝脏、(b)脾、(c)淋巴结和(d)血液中白细胞中的GzmB
图27描绘了在各种处理后的小鼠的肝脏、脾、淋巴结和血液中的GzmB
图28描绘了免疫介导的肝炎的小鼠模型中肝脏功能和细胞因子水平的测量。(a)各种处理后小鼠的ALT和AST的水平。双尾学生t检验;健康组相比于移植组或LPS处理组。NS:无统计学显著差异;以及(b)各种处理后血清中肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)、白介素-2(IL-2)和白介素-6(IL-6)的细胞因子水平(n=6,平均值±s.d.)。双尾学生t检验;健康组相比于移植组或LPS处理组。NS:无统计学显著差异。
图29描绘了活大鼠中急性肝脏同种异体移植物排斥的纵向光学尿分析。(a)肝脏移植的外科手术过程、肝脏同种异体移植物排斥的机制以及移植肝脏中APN
图30描绘了急性肝脏同种异体移植物排斥的大鼠模型的发展以及肝脏功能和肾脏功能的测量。(a)急性肝脏同种异体移植物排斥的大鼠模型的发展的示意图。通过使用Dark Agouti(DA)大鼠和Lewis大鼠分别作为供体和受体来进行原位肝脏移植。对照组为健康大鼠或外科手术后用免疫抑制剂药物他克莫司(Tacrolimus)(Tac)处理的大鼠。还对同系移植物、假手术和皮内注射LPS进行比较;(b)肝脏移植后大鼠的ALT、AST和ALP的水平(n=4,平均值±s.d.);以及(c)肝脏移植后大鼠的血清肌酐、BUN和尿酸的水平(n=4,平均值±s.d.)。双尾学生t检验。健康组相比于移植组。NS:无统计学显著差异。
图31描绘了(a)区域肝脏切片的代表性共聚焦荧光显微术图像,和(b)来自肝移植后的大鼠的石蜡包埋的肾脏和肝脏切片中的H&E染色的显微照片。组织学研究示出肝脏移植后肾脏没有组织学变化,但仅在同种异体移植后6天观察到肝脏的血窦扩张和肝细胞碎片(比例尺:200μm)。a和b中的实验独立重复三次,结果相似;以及(c)图片a中抗GzmB和活化的APN
图32描绘了健康大鼠中CyCD和APN
图33描绘了肝脏移植后的离体NIRF成像。不同大鼠组的切除器官的代表性离体NIRF图像。使用IVIS Lumina III系统在675nm处激发时在720nm处获得NIRF图像。
图34描绘了(a)来自不同组的活大鼠的尿中活化的APN
图35描绘了肝脏移植后CD8
图36描绘了在肝脏移植后的大鼠的肝脏、脾、淋巴结和血液中CD8
图37描绘了移植后细胞因子水平的测量。肝脏移植后血清中(a)TNF-α、(b)IFN-γ、(c)IL-2、(d)IL-4和(e)IL-6的细胞因子水平(n=7,平均值±s.d.)。双尾学生t检验。健康组相比于移植组。NS:无统计学显著差异。
具体实施方式
令人惊讶地发现可以制造克服上述认定的一些或所有问题的分子。因此,在本发明的第一方面,提供了一种根据式I的聚合物纳米报道物化合物:
其中:
n为1至20(例如1至5);
m表示0或1,由X或X'确定;
X表示选自由以下组成的组的笼状荧光部分:
/>
/>
/>
其中,波浪形线分别表示X与部分R和Y附连的点;
R
R
X'表示选自由以下组成的组的笼状荧光部分:
/>
/>
/>
其中,波浪形线分别表示X与部分R和Y或Y'附连的点,其中,如果X'基团是末端X'基团,则部分Y/Y'是Y',以及如果X'基团不是末端X'基团,则部分Y/Y'是Y;
每个o独立地表示1至3;
Y表示选自以下的自分解连接体:
其中,波浪形线表示Y与部分A、X和X'附连的点,其中,如果Y基团附连至所述聚合物纳米报道物化合物链的第一个X基团并且还附连至X'基团,则部分X/X'是X';
Y'表示选自以下的自分解连接体:
其中,波浪形线表示Y与部分A和X'附连的点;
其中,每个R
A表示生物标志物响应部分,选自:
/>
其中,波浪形线表示与分子的其余部分附连的点;R表示选自以下中的一项或多项的溶解度增强部分:
/>
其中,每个R
或者其药学上可接受的盐或溶剂化物。
在本文的实施方式中,词语“包括”可以被解释为需要所提及的特征,但不限制其他特征的存在。替代地,词语“包括”也可以涉及其中旨在仅所列举的组分/特征存在的情况(例如,词语“包括”可以被短语“由……组成”或“基本上由……组成”替换)。明确设想了无论是广义的解释还是狭义的解释两者都可以适用于本发明的所有方面和实施方式。换句话说,词语“包括”及其同义词可被短语“由……组成”或短语“基本上由……组成”或其同义词所替换,并且反之亦然。
短语“基本上由……组成”及其假名在本文中可以解释为是指可存在少量杂质的材料。例如,该材料可以大于或等于90%纯度、诸如大于95%纯度、诸如大于97%纯度、诸如大于99%纯度、诸如大于99.9%纯度、诸如大于99.99%纯度、诸如大于99.999%纯度、诸如100%纯度。
如本文所用,除上下文另外明确规定,否则单数形式“一个/种(a)”、“一个/种(an)”和“所述/该(the)”包括复数指示物。因此,例如,提及“组合物”包括两种或更多种这样的组合物的混合物等。
本文(在本发明的任何方面或实施方式中)对式I的化合物的提及包括对这样的化合物本身、这样的化合物的互变异构体以及这样的化合物的药学上可接受的盐或溶剂化物或药学上功能衍生物的提及。
可以被提到的药学上可接受的盐包括酸加成盐和碱加成盐。这样的盐可以通过常规的手段来形成,例如通过使式I的化合物的游离酸或游离碱形式与一当量或多当量的适当的酸或碱任选地在其中该盐是不可溶的溶剂或介质中反应,紧接着使用标准技术(例如,在真空中通过冻干或过滤)去除所述溶剂或所述介质。盐也可以通过以下制备:将呈盐的形式的式I的化合物的反荷离子与另一反荷离子交换,例如使用合适的离子交换树脂。
药学上可接受的盐的实例包括来源于矿物酸和有机酸的酸加成盐,以及来源于金属,诸如钠、镁,或优选地钾和钙的盐。
酸加成盐的实例包括用以下形成的酸加成盐:乙酸、2,2-二氯乙酸、己二酸、海藻酸、芳基磺酸(例如苯磺酸、萘-2-磺酸、萘-1,5-二磺酸以及对甲苯磺酸)、抗坏血酸(例如,L-抗坏血酸)、L-天冬氨酸、苯甲酸、4-乙酰胺基苯甲酸、丁酸、(+)樟脑酸、樟脑-磺酸、(+)-(1S)-樟脑-10-磺酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环己氨磺酸、十二烷基硫酸、乙烷-1,2-二磺酸、乙烷磺酸、2-羟基乙烷磺酸、甲酸、富马酸、半乳糖二酸、龙胆酸、葡庚糖酸、葡糖酸(例如,D-葡糖酸)、葡糖醛酸(例如,D-葡糖醛酸)、谷氨酸(例如,L-谷氨酸)、α-氧亚基戊二酸、乙醇酸、马尿酸、氢溴酸、盐酸、氢碘酸、羟乙磺酸、乳酸(例如(+)-L-乳酸和(±)-DL-乳酸)、乳糖酸、马来酸、苹果酸(例如(-)-L-苹果酸)、丙二酸、(±)-DL-苦杏仁酸、偏磷酸、甲烷磺酸、1-羟基-2-萘甲酸、烟酸、硝酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、磷酸、丙酸、L-焦谷氨酸、水杨酸、4-氨基-水杨酸、癸二酸、硬脂酸、琥珀酸、硫酸、单宁酸、酒石酸(例如(+)-L-酒石酸)、硫氰酸、十一烯酸以及戊酸。
盐的具体实例是来源于以下的盐:矿物酸,诸如盐酸、氢溴酸、磷酸、偏磷酸、硝酸和硫酸;有机酸,诸如酒石酸、乙酸、柠檬酸、苹果酸、乳酸、富马酸、苯甲酸、乙醇酸、葡糖酸、琥珀酸、芳基磺酸;以及金属,诸如钠、镁,或优选地钾和钙。
如上提及,还被式I涵盖的是化合物的任何溶剂化物及其盐。优选的溶剂化物是通过将无毒的药学上可接受的溶剂(以下被称为溶剂化溶剂)的分子掺入到本发明的化合物的固态结构(例如晶体结构)而形成的溶剂化物。这样的溶剂的实例包括水、醇(诸如乙醇、异丙醇和丁醇)以及二甲基亚砜。可以通过用溶剂或包含溶剂化溶剂的溶剂的混合物使本发明的化合物重结晶来制备溶剂化物。在任何给定的情况下,是否已经形成溶剂化物可以通过使用众所周知且标准的技术,诸如热重分析(TGA)、差示扫描量热法(DSC)和X射线晶体学使化合物的晶体经受分析来确定。
溶剂化物可以是化学计量的或非化学计量的溶剂化物。特别优选的溶剂化物是水合物,并且水合物的实例包括半水合物、一水合物和二水合物。
对于溶剂化物以及用于制造和表征它们的方法的更详细的讨论,参见Bryn etal.,Solid-State Chemistry of Drugs,Second Edition,published by SSCI,Inc ofWest Lafayette,IN,USA,1999,ISBN 0-967-06710-3。
为简便起见,式I的化合物以及这样的化合物的药学上可接受的盐、溶剂化物和药学上功能衍生物在下文中统称为“式I的化合物”。
式I的化合物可以包含双键,并且因此关于每个单独的双键可以作为E(异侧)和Z(同侧)几何异构体存在。所有的这样的异构体及其混合物都包括在本发明的范围内。
式I化合物可以作为区域异构体存在并且还可以表现出互变异构。所有互变异构形式及其混合物都包括在本发明的范围内。
式I的化合物可以包含一个或多个不对称碳原子,并且因此可以表现出光学和/或非对映异构。非对映异构体可以使用常规技术分离,例如,色谱法或分级结晶。各种立体异构体可以通过使用常规例如分级结晶或HPLC技术分离化合物的外消旋或其他混合物来分离。替代地,所需的光学异构体可以通过以下制造:在不引起外消旋化或差向异构化的条件下适当的光学活性起始材料的反应(即‘手性池’方法);适当的起始材料与‘手性助剂’的反应,该手性助剂随后可以在合适的阶段被去除;衍生化(即拆分,包括动态拆分),例如用同手性的酸,然后通过常规手段诸如色谱法分离非对映异构体衍生物;或在技术人员已知的条件下与所有适当的手性试剂或手性催化剂反应。所有的立体异构体和其混合物都包括在本发明的范围内。
除非另有说明,否则术语“烷基”是指非支链或支链、非环状或环状、饱和或不饱和(如此形成,例如,烯基或炔基)烃基基团,其可以是取代的或未取代的(具有例如,一种或多种卤素原子)。当术语“烷基”是指非环状基团时,其优选地为C
可以提及的本发明的另外的实施方式包括其中式I的化合物被同位素标记的那些。然而,可以提及的本发明的其他具体实施方式包括其中式I的化合物没有被同位素标记的那些。
当在本文中使用时,术语“同位素标记的”包括对其中在化合物中的一个或多个位置存在非天然同位素(或同位素的非天然分布)的式I的化合物的提及。本文对“化合物中的一个或多个位置”的提及将被本领域技术人员理解为是指式I的化合物的原子中的一个或多个。因此,术语“同位素标记的”包括对在化合物中的一个或多个位置被同位素地富集的式I的化合物的提及。
式I的化合物的同位素标记或富集可以具有氢、碳、氮、氧、硫、氟、氯、溴和/或碘的任何放射性或非放射性同位素。在这个方面可以被提到的具体同位素包括
当式I的化合物用放射性或非放射性同位素所标记或富集时,可以被提到的式I的化合物包括其中化合物中至少一个原子显示同位素分布的那些,在同位素分布中所讨论的原子的放射性或非放射性同位素以超过该放射性或非放射性同位素的天然水平至少10%(例如10%至5000%,特别是50%至1000%,以及更特别是100%至500%)的水平存在。
在本文可提及的本发明的实施方式中,可以应用以下一项或多项:
n可以是2;
A可以表示:
或者/>
其中,波浪形线表示与分子的其余部分附连的点;
X可以选自:
其中,波浪形线分别表示X与部分R和Y附连的点;R
其中,波浪形线分别表示X与部分R和Y或Y'附连的点,其中,如果X'基团是末端X'基团,则部分Y/Y'是Y',以及如果X'基团不是末端X'基团,则部分Y/Y'是Y;
Y可以是:
其中,波浪形线表示Y与部分A、X和X'附连的点,其中,如果Y基团附连至所述聚合物纳米报道物化合物链的第一个X基团并且还附连至X'基团,则部分X/X'是X';
Y'可以是:
其中,波浪形线表示Y与部分A和X'附连的点;
每个R
每个R表示选自以下之一或两者的溶解度增强部分:
在本文可提及的本发明的实施方式中,可以应用以下一项或多项:n可以是2;
A可以表示:
或者/>
X可以是:
其中,波浪形线分别表示X与部分R和Y附连的点;
R
X'可以是:
其中,波浪形线分别表示X与部分R和Y或Y'附连的点,其中,如果X'基团是末端X'基团,则部分Y/Y'是Y',以及如果X'基团不是末端X'基团,则部分Y/Y'是Y;
Y可以是:
其中,波浪形线表示Y与部分A、X和X'附连的点,其中,如果Y基团附连至所述聚合物纳米报道物化合物链的第一个X基团并且还附连至X'基团,则部分X/X'是X';
Y'可以是:
其中,波浪形线表示Y与部分A和X'附连的点;
每个R
每个R表示选自以下之一或两者的溶解度增强部分:
在本文可提及的本发明的具体实施方式中,聚合物纳米报道物化合物或者其盐或溶剂化物可以选自:
其中,(i)中的R选自以下的两者:
其中,Ia与Ib的比率为1:9;以及
其中,(ii)中的R为:
本文公开的分子可以特别用于检测受试者的病理病症。因此,在本发明的另外方面中,提供了:
(A)一种检测受试者的病理病症的方法,所述方法包括以下步骤:
(a)向受试者给药靶向所选择的病理病症的如上文所述的根据式I的聚合物纳米报道物化合物或者其药学上可接受的盐或溶剂化物;以及
(b)检测来自所述受试者的尿和由所述根据式I的聚合物纳米报道物化合物所靶向的所述受试者的器官或组织之一或两者中的任何荧光,其中,所述受试者中病理病症的存在由以下中的荧光指示:所述尿、所述组织或器官、或者所述尿和所述组织或器官两者;
(B)如上文所述的根据式I的聚合物纳米报道物化合物或者其药学上可接受的盐或溶剂化物在制造用于诊断病理病症的药物中的用途;
(C)如上文所述的根据式I的聚合物纳米报道物化合物或者其药学上可接受的盐或溶剂化物,用于在诊断病理病症中的用途。
术语“患者(patient)”和“患者(patients)”包括对哺乳动物(例如人)患者的提及。如本文所用,术语“受试者”或“患者”是本领域所公认的,并且本文中可互换使用以来指哺乳动物,包括狗、猫、大鼠、小鼠、猴、奶牛、马、山羊、绵羊、猪、骆驼以及最优选地人。在一些实施方式中,受试者是需要治疗的受试者或具有疾病或疾患的受试者。然而,在其他实施方式中,受试者可以是正常的受试者。该术语没有指示具体的年龄或性别。因此,旨在涵盖成年和新生的受试者,无论雄性或雌性。
在上述方面的实施方式中,病理病症可以是癌症、器官同种异体移植物排斥和免疫介导的肝炎。
如应当理解,如果发现潜在的病理病症,则然后可以通过给药药学上有效量的可用于治疗所述病症的一种或多种治疗剂来治疗受试者的这种病症。替代地或另外,可以通过放射疗法和外科手术中的一种或多种来治疗受试者。
术语“有效量”是指化合物的量,其对被治疗患者赋予治疗效果(例如,足以治疗或预防疾病)。效果可以是客观的(即,通过一些测试或标志物可测量的)或主观的(即,受试者给出效果的迹象或感觉到效果)。
式I的化合物可以通过任何合适的途径给药,但是特别地可以口服地、静脉内地、肌内地、皮地、皮下地、经粘膜地(例如舌下地或颊地)、直肠地、经皮地、鼻地、经肺地(例如经气管地或经支气管地)、局部地、通过任何其他肠胃外途径,以呈药学上可接受的剂型的包括化合物的药物制剂的形式给药。可以被提到的具体的给药的模式包括口服、静脉内、皮、皮下、鼻、肌内或腹腔给药。
式I的化合物将通常作为与在适当考虑预期给药途径和标准药学实践下可以选择的药学上可接受的佐剂、稀释剂或载体的混合物的药物制剂来给药。这样的药学上可接受的载体对活性化合物可以是化学惰性的,并且在使用的条件下可以没有有害的副作用或毒性。合适的药物制剂可以在例如,Remington The Science and Practice of Pharmacy,19th ed.,Mack Printing Company,Easton,Pennsylvania(1995)中找到。对于肠胃外给药,可以使用肠胃外可接受的水性溶液,其不含致热原并且具有必要的pH、等渗压和稳定性。合适的溶液将是技术人员所众所周知的,其中在文献中描述了众多的方法。药物递送的方法的简要综述也可以在例如Langer,Science(1990)249,1527中找到。
否则,合适的制剂的制备可以由技术人员使用常规技术和/或按照标准和/或公认的药学实践来常规地实现。
在根据本发明所使用的任何药物制剂中的式I的化合物的量将取决于各种因素,诸如待治疗的病症的严重性、待治疗的具体患者以及使用的一种或多种化合物。在任何情况下,制剂中式I的化合物的量可由技术人员常规确定。
例如,固体口服组合物诸如片剂或胶囊可以包含1至99%(w/w)的活性成分;0至99%(w/w)的稀释剂或填料;0至20%(w/w)的崩解剂;0至5%(w/w)的润滑剂;0至5%(w/w)的助流剂;0至50%(w/w)的造粒剂或粘结剂;0至5%(w/w)的抗氧化剂以及0至5%(w/w)的色素。控释片剂可以另外包含0至90%(w/w)的释放-控制聚合物。
肠胃外制剂(诸如用于注射的溶液或混悬剂或用于输注的溶液)可以包含1至50%(w/w)的活性成分;以及50%(w/w)至99%(w/w)的液体或半固体载体(carrier)或负载体(例如溶剂,诸如水);以及0-20%(w/w)的一种或多种其他赋形剂诸如缓冲剂、抗氧化剂、混悬剂稳定剂、张力调节剂以及防腐剂。
取决于待治疗的疾患和患者以及给药途径,可以向有此需要的患者以不同诊断有效剂量给药式I的化合物。
然而,在本发明的上下文中,向哺乳动物,特别是人给药的剂量,应当足以在合理的时间范围内在哺乳动物中产生治疗反应。本领域技术人员将认识到,确切剂量和组成以及最合适的递送方案的选择也将尤其受到以下影响:制剂的药理学特性,被治疗的病症的性质和严重性以及受体的身体状况和精神敏度以及特定化合物的潜能,待治疗的患者的年龄、状况、体重、性别和反应,以及疾病的阶段/严重性。
给药可以是连续的或间歇的(例如,通过弹丸注射)。剂量也可以通过定时和给药频率来确定。在口服或肠胃外给药的情况下,式I的化合物的剂量可以从约0.01mg至约1000mg/天变化。
在任何情况下,执业医师或其他技术人员将能够常规地确定对个体患者将最合适的实际的剂量。以上提到的剂量是平均情况的示例;当然,可以是其中更高或更低的剂量范围是理所当然的个别情况,并且这样的在本发明的范围内。
本文所述的本发明的方面(例如,以上提及的化合物、组合、方法和用途)可以具有以下优点,即,在治疗本文所述的病症时,与用于治疗这些病症或其他方面的现有技术中已知的类似化合物、组合、方法(治疗)或用途相比,它们对医生和/或患者来说可更方便,更有效,毒性更小,具有更好的选择性,具有更广的活性范围,更强有力,产生更少的副作用,或者可具有其他有用的药理学特性。
如应当理解,本文描述的本发明的方面(例如以上提及的化合物、组合、方法和用途)可以具有以患者友好但灵敏、特异且动态的方式密切监测移植物状况的潜能。此外,本文描述的本发明的方面(例如以上提及的化合物、组合、方法和用途)可以优于现有的血液和尿测试,从而允许超灵敏检测癌症和早期诊断肝脏同种异体移植物排斥,具有现有非侵入性方法所无法达到的同种异体移植物特异性。因此,本文描述的本发明的方面(例如以上提及的化合物、组合、方法和用途)不仅可以转化为体内传感的光学纳米颗粒,而且还提供超灵敏的尿测试以用于受试者中病理病症的早期诊断。
如应当理解的,生物标志物响应部分对于特定病症可以是选择性的。与具体生物标志物响应部分相关的病症列于下表中。
表AA
现将通过参考以下非限制性实施例来讨论本发明的另外方面和实施方式。
实施例
材料
除非另有说明,否则所有化学品均购自Sigma-Aldrich或Tokyo ChemicalIndustry(TCI)。Con-A、CsA、CA-074、Tac、LPS、γ-谷氨酰转移酶、羧酸酯酶、二辛可宁酸(bicinchoninic acid)蛋白测定试剂盒、ALT活性测定、AST活性测定试剂盒、ALP活性测定试剂盒、肌酐测定试剂盒和脲测定试剂盒购自Sigma-Aldrich。丙氨酸氨肽酶和重组胱天蛋白酶-3购自R&D Systems。颗粒酶B(GzmB)购自Novoprotein Scientific Inc.。小鼠TNF-ɑ(430904)、IFN-γ(430804)和IL-6(431304)酶联免疫吸附测定(ELISA)试剂盒购自BioLegend。小鼠IL-2(ab223588)购自Abcam。大鼠TNF-ɑ(ab236712)、IFN-γ(ab46107)、IL-2(ab100769)、IL-4(ab100770)和IL-6(ab234570)ELISA试剂盒购自Abcam。FITC(异硫氰酸荧光素)抗小鼠CD3(目录编号100204,稀释度1:50)、藻红蛋白(PE)抗小鼠CD8(目录编号100708,稀释度1:80)、纯化抗小鼠CD16/32(目录编号156604),稀释度1:200)、Alexa Fluor700抗小鼠CD45(目录编号103128,稀释度1:200)、多甲藻素-叶绿素-蛋白抗小鼠CD4(目录编号100538,稀释度1:80)、别藻蓝蛋白(APC)抗-人/小鼠GzmB(目录编号372204,稀释度1:20)和BV510抗小鼠/人CD44(目录编号103043,稀释度1:40)购自BioLegend。Live/Dead可固定蓝色死细胞染色剂购自Thermo Fisher Scientific(目录编号L23105,稀释度1:1000)。小鼠GzmB单克隆抗体(目录编号sc-8022,稀释度1:200)购自Santa Cruz Biotechnology。第二抗体Alexa Fluor 488缀合的山羊抗小鼠IgG购自Thermo Fisher Scientific(目录编号A28175,稀释度1:1000)。抗大鼠CD16/32(目录编号550270,稀释度1:200)、BV510可固定生存力染色剂(目录编号564406,稀释度1:1000)、BV786抗大鼠CD45(目录编号740914,稀释度1:100)、FITC抗大鼠CD3(目录编号559975,稀释度1:200)、APC抗大鼠CD8a(目录编号200610,稀释度1:200)、BV421抗大鼠CD4(目录编号100563,稀释度1:400)和BV650抗大鼠CD44(目录编号740455,稀释度1:100)
购自BD Biosciences。PE抗大鼠GzmB(目录编号130-116-486,稀释度1:50)购自Miltenyi Biotec。大鼠GzmB单克隆抗体(目录编号Sc-8022)购自Santa CruzBiotechnology。第二抗体Alexa Fluor 488缀合的山羊抗大鼠IgG购自Thermo FisherScientific(目录编号A11006,稀释度1:1000)。超纯水由Milli-Q Plus系统(Millipore)供应。杜尔贝科氏改良伊格尔培养基(Dulbecco’smodifed Eagle medium)(DMEM)和FBS购自GIBCO。RBC裂解缓冲液购自Invitrogen。
小鼠结肠癌细胞系CT26、小鼠巨噬细胞系RAW 264.7细胞和小鼠肝细胞细胞系AML-12购自美国典型培养物保藏中心(American Type Culture Collection)(ATCC)。
分析技术
柱色谱法
使用硅胶(Silicycle,230-400目)用于柱色谱法。
薄层色谱法(TLC)
在Merck硅胶60F-254玻璃板上进行薄层色谱法(TLC)。
紫外-可见(UV-vis)光谱法
在使用石英比色皿(1cm程长)的Shimadzu UV-2450分光光度计或ThermoScientific NanoDrop 2000上记录UV-vis光谱。
荧光光谱法
采用使用石英比色皿(1cm程长)的Fluorolog 3时间相关单光子计数荧光分光光度计(Horiba Jobin Yvon)或Thermo Scientific NanoDrop 2000来获得荧光光谱。
荧光成像
在IVIS spectrumCT(PerkinElmer,Inc,USA)上进行小鼠的荧光成像,并且在IVISLumina III(PerkinElmer,Inc,USA)上进行大鼠的荧光成像。
高效液相色谱法(HPLC)
使用具有0.1%三氟乙酸(TFA)的乙腈(CH
核磁共振(NMR)波谱法
使用Bruker 300MHz NMR仪器进行质子核磁共振(
电喷雾电离质谱法(ESI-MS)
ESI-MS谱是在配备有标准ESI源的Thermo Finnigan Polaris Q四极离子阱质谱仪(ThermoFisher Corporation)上获得的。
基质辅助激光解吸/电离飞行时间(MALDI-TOF)质谱法
在Bruker ultraflex TOF/TOF仪器上进行MALDI-TOF分析。
pH测量
使用数字pH计(SevenCompact S220,苏黎世(Zurich),瑞士)测试pH值。
凝胶渗透色谱法(GPC)
使用四氢呋喃作为洗脱液在Agilent 1260系统上进行GPC分析。
DLS
在Malvern Nano-ZS粒度仪上测量DLS和ζ电位。
TEM
使用JEM 1400透射电子显微镜(JEOL,东京,日本)捕获TEM图像。
细胞因子检测的通用程序
在指示时间点从活小鼠或大鼠的肝素化毛细管中采样血液,并通过离心分离血清用于分析。根据制造商的方案,通过ELISA试剂盒测量TNF-α、IFN-γ、IL-2、IL-4和IL-6的水平。
组织成像的通用程序
使用低温恒温器(Leica,德国)将组织切成切片。使用Nikon ECLIPSE 80i显微镜(Nikon Instruments Inc,USA)检查组织切片。在LSM800共聚焦激光扫描显微镜(CarlZeiss,德国)上获得组织切片的共聚焦荧光显微术图像。
采集血液样品的通用程序
使用肝素化毛细管(Paul Marienfeld,德国)采集血液样品。
尿样品采集的通用程序
用代谢笼(Lab Products Inc,USA)采集尿样品。
组织学研究的通用程序
将所有组织用4%多聚甲醛(PFA)固定,在一系列乙醇溶液中脱水,包埋在石蜡中,并切成具有10μm厚度的切片以进行H&E染色。将切片用二甲苯和乙醇洗涤,并且然后浸入苏木精工作溶液5min和伊红工作溶液3min,随后用蒸馏水洗涤。使用Nikon ECLIPSE 80i显微镜检查染色切片。对于免疫荧光染色,将肝脏和肾脏组织用4% PFA固定,使用30%蔗糖溶液脱水,包埋于冷冻最佳切割温度(O.C.T.)培养基中,并且然后切成具有10μm厚度的切片。将切片在室温下干燥60min,使用包含0.1% Triton X-100的PBS洗涤三次,并用3%牛血清白蛋白(BSA)溶液在室温下温育额外的60min,随后用PBS洗涤。然后在37℃下将切片与抗GzmB抗体温育60min。用PBS洗涤三次以去除未结合的抗体后,在室温下用各自的第二抗体复染切片60min。接下来,用DAPI对细胞核进行染色。使用LSM800共聚焦激光扫描显微镜对染色切片进行成像。
流式细胞术分析的通用程序
为了分析小鼠白细胞中的GzmB水平,在用con-A处理后的不同时间从小鼠中收获肝脏、脾、血液和淋巴结,并制备成单细胞悬浮液。简而言之,将肝脏切碎,在冰冷的1×PBS中轻轻研磨,并通过70μm粗滤器过滤。使用eBioscience 1×RBC裂解缓冲液去除采集的细胞悬浮液中的红细胞。然后通过密度梯度离心40%和70% Percoll的单细胞悬浮液(850g,20min)来分离肝脏中的免疫细胞,随后用冰冷的1×PBS洗涤。用注射器柱塞在冰冷的1×PBS中轻轻研磨脾和淋巴结,并通过70μm细胞粗滤器过滤,以得到单细胞悬浮液。使用eBioscience 1×RBC裂解缓冲液去除脾的单细胞悬浮液中的红细胞。使用Histopaque1077(400g,30min)通过密度梯度离心来分离血液中的免疫细胞。单细胞悬浮后,将从肝脏、脾、血液和淋巴结采集的细胞用抗小鼠CD16/32封闭,并根据供应商的方案用以下染色:Alexa Fluor700抗小鼠CD45、Live/Dead可固定蓝色死细胞染色剂、FITC抗小鼠CD3、PE抗小鼠CD8、多甲藻素-叶绿素-蛋白抗小鼠CD4、APC抗人/小鼠GzmB和BV510抗小鼠/人CD44。为了分析大鼠CD8
统计分析的通用程序
使用Living Image 4.3软件利用目的区域分析对体外、体内和离体荧光信号进行定量。除非另有说明,否则将结果表示为平均值±s.d.。研究人员在实验期间对组分配不知情。两组之间的统计比较通过t检验确定,并且三组或更多组之间的统计比较通过单向方差分析确定。对于所有检验,P值小于0.05被认为统计学显著(*P<0.05、**P<0.01和***P<0.001)。包括所使用检验的假设的所有统计计算均使用GraphPad Prism 8.0(GraphPad软件)进行。
实施例1.开发具有生物标志物触发的肾清除和荧光响应的可活化的聚合物纳米报道物(APN),用于疾病的非侵入性近红外荧光(NIRF)体内成像和尿分析
APN包括三个关键构建单元(图1b):蛋白酶-反应性肽刷、级联自分解(self-immolative)连接体、具有肾清除部分和/或靶向部分的笼状荧光团单元。荧光团单元与自分解连接体连接以形成聚合物主链,该聚合物主链也经由自分解连接体由肽刷接枝。因此,APN是两亲性的,并且在水性溶液中自发组装成纳米颗粒。在固有状态下,APN是非荧光的,因为荧光团单元的酚基团被笼化(成笼,caged)以抑制其给电子能力。在活化状态下,疾病过表达的蛋白酶切割肽刷并诱导级联自消除,以解聚APN的主链,释放肾可清除的荧光团片段(图1b,d)用于实时NIRF成像和尿分析(图1a,b)。这样的蛋白酶引发的碎裂不仅将APN从纳米颗粒转化为小分子片段,而且还从笼中放出了肾可清除荧光团的酚基团,导致灵敏的荧光开启响应。因此,APN避开了纳米颗粒的缓慢清除和光的浅层组织穿透,实现了非侵入性体内光学检测以用于早期诊断。此外,由于酶促解聚的催化信号放大和荧光开启检测的高信号背景比,APN对于早期诊断灵敏。
实施例2.APN的合成
APN是经由具有烷基链上的叠氮化物基团的荧光团单元(NH
荧光团单元(NH
化合物2
将N-(4-氨基苯基)乙酰胺(化合物1,3000mg,20mmol)和HCl(12M,10mL)的混合物在冰浴中搅拌。滴加溶解在HCl(10mL)中的亚硝酸钠(1380mg,20mmol)并搅拌1h。然后,将HCl(10mL)中的氯化锡(14460mg,80mmol)添加至上述混合物中并在冰浴中搅拌另外的2h。过滤沉淀的黄色固体,并干燥以得到化合物2(3200mg,80%产率),其无需进一步纯化用于下一步骤。
1
化合物3
将化合物2(3200mg,16mmol)、3-甲基丁-2-酮(1720mg,20mmol)、冰乙酸(30mL)和乙酸钠(1600g,19mmol)的混合物在100℃下回流6h。然后,将热溶液冷却至室温并浓缩。通过硅胶柱色谱法纯化残余物,以得到化合物3(2940mg,85%产率)。
1
化合物4
将化合物3(2940mg,13.6mmol)和1-叠氮基-6-溴己烷(3090mg,15mmol)的混合物在在90℃下于50ml圆底烧瓶中的乙腈中搅拌。48h后,通过HPLC纯化残余物,得到化合物4(3256g,70%)。
1
化合物5
将化合物4(3078mg,9.0mmol)、(E)-2-氯-3-(羟基亚甲基)环己-1-烯-1-甲醛(765mg,4.5mmol)和无水乙酸钠(1170mg,13.5mmol)在乙酸酐(30ml)中的混合物在80℃下回流5h。将反应混合物冷却并减压浓缩。使用硅胶柱色谱法来纯化残余物,以得到呈绿色固体的化合物5(4800mg,65%产率)。
1
化合物6
将碳酸钾(840mg,6.0mmol)和间苯二酚(330mg,3.0mmol)在乙腈(15ml)中的混合物在55℃搅拌30min。然后,将化合物5(1640mg,2mmol)在乙腈(15ml)中的溶液滴加至上述混合物中。将反应混合物在55℃下搅拌额外的5h。在减压下蒸发溶剂后,将粗产物通过硅胶柱色谱法纯化,以得到化合物6(773mg,70%产率)。
1
化合物7
将化合物6(773mg,1.4mmol)和三氟化硼甲醇(4400μL,28mmol)的混合物在80℃下在氮气气氛下搅拌8h。在减压下蒸发溶剂后,使用HPLC纯化粗产物,以得到化合物7(510mg,71%)。
1
肽缀合的级联自分解连接体(化合物14和19)的合成
化合物9
将2,6-双(羟甲基)-对甲酚(化合物8,2000mg,12mmol)和咪唑(1620mg,24mmol)的混合物溶解于二甲基甲酰胺(DMF,15mL)中并在冰浴中搅拌。30min后,将叔丁基二甲基氯硅烷(3650mg,24mmol)添加至反应混合物中并在室温下搅拌12h。将混合物用二乙醚稀释并用饱和氯化铵溶液洗涤。然后,将有机相经无水硫酸钠干燥并在减压下浓缩。通过硅胶柱色谱法纯化粗产物,以得到化合物9(3960mg,83%)。
1
化合物10
通过固相肽合成来制备肽10(Ac-FK,2176mg,5.0mmol)。
1H NMR(300MHz,CDCl
化合物11
向化合物10(435mg,1.0mmol)在四氢呋喃(THF,20mL)中的溶液中添加(4-氨基苯基)甲醇(490mg,4.0mmol)和N-乙氧基羰基-2-乙氧基-1,2-二氢喹啉(960mg,4.0mmol)。将反应混合物在室温下搅拌12h,之后将其在减压下浓缩。将残余物用蒸馏水洗涤并用二氯甲烷(DCM)萃取。将有机层进一步用盐水洗涤,经无水硫酸镁干燥并在减压下浓缩。使用HPLC纯化残余物以得到化合物11(405mg,75%产率)。
1
化合物14
向化合物11(405mg,0.75mmol)在干燥THF(10mL)中的溶液中添加三溴化磷(540mg,2.0mmol)。将反应混合物在冰浴中搅拌6h,并且然后将其用蒸馏水淬灭,随后用DCM萃取。将有机层用盐水洗涤,经无水硫酸镁干燥并在减压下浓缩,以得到化合物12(360mg,80%产率),其不经进一步纯化即用于下一步骤。向化合物12(360mg,0.6mmol)在乙腈(8ml)中的溶液中添加化合物9(396mg,1.0mmol)和N,N-二异丙基乙胺(160μl,1.22mmol)。将反应混合物在55℃下搅拌12h后,将其倒入蒸馏水中,通过DCM萃取并在真空下浓缩,以得到化合物13,其无需进一步纯化即用于下一步骤。将化合物13(459mg,0.5mmol)和四丁基氟化铵(1.0M,在THF中,1.5ml,1.5mmol)溶解在无水THF(6ml)中并在室温下搅拌3h。将反应混合物倒入稀释的氯化氢(HCl)水性溶液中,用乙酸乙酯萃取并在真空下浓缩。通过硅胶柱色谱法纯化残余物得到化合物14(138mg,40%产率)。
1
化合物15
通过根据发明人先前的研究(Kwon,E.J.,Dudani,J.S.&Bhatia,S.N.,Nat.Biomed.Eng.2017,1,0054)的固相肽合成来制备肽15(Ac-IEFD,3382mg,5.0mmol)。
1
化合物16
向化合物15(676mg,1.0mmol)在THF(20mL)中的溶液中添加(4-氨基苯基)甲醇(490mg,4.0mmol)和N-乙氧基羰基-2-乙氧基-1,2-二氢喹啉(960mg,4.0mmol)。将反应混合物在室温下搅拌12h,之后将其在减压下浓缩。将残余物用蒸馏水洗涤并用DCM萃取。将有机层进一步用盐水洗涤,经无水硫酸镁干燥并在减压下浓缩。使用HPLC纯化残余物以得到化合物16(473mg,70%产率)。
1
化合物19
向化合物16(390mg,0.5mmol)在干燥THF(10mL)中的溶液中添加三溴化磷(540mg,2.0mmol)。将反应混合物在冰浴中搅拌6h,并且然后将其用蒸馏水淬灭,随后用DCM萃取。将有机层用盐水洗涤,经无水硫酸镁干燥并在减压下浓缩,以得到化合物17(590mg,70%产率),其不经进一步纯化即用于下一步骤。向化合物17(422mg,0.5mmol)在乙腈(8ml)中的溶液中添加化合物9(396mg,1.0mmol)和N,N-二异丙基乙胺(160μl,1.22mmol)。将反应混合物在55℃下搅拌12h后,将其倒入蒸馏水中,通过DCM萃取并在真空下浓缩,以得到化合物18,其无需进一步纯化即用于下一步骤。将化合物18(580mg,0.5mmol)和四丁基氟化铵(1.0M,在THF中,1.5ml,1.5mmol)溶解在无水THF(6ml)中并在室温下搅拌3h。将反应混合物倒入稀释的HCl水性溶液中,用乙酸乙酯萃取并在真空下浓缩。将在DCM(5mL)中的残余物和三氟乙酸(5mL)在冰浴中在氮气气氛下搅拌3h。在减压下蒸发溶剂后,使用HPLC纯化粗产物,以得到化合物19(123mg,30%产率)。
1
肾清除部分丙炔基-HPβCD和肿瘤靶向部分丙炔基-cRGD的合成
丙炔基-HPβCD
丙炔基-HPβCD是根据发明人先前的研究合成的(Huang,J.et al.,Nat.Mater.2019,18,1133-1143)。
丙炔基-cRGD
将戊-4-炔酸(98mg,1.0mmol)、N-羟基琥珀酰亚胺(138mg,1.2mmol)和1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(186mg,1.2mmol)溶解在无水DCM中(6mL)中并在室温下搅拌6h。将反应混合物倒入水中,用乙酸乙酯萃取并在真空下浓缩。通过硅胶柱色谱法纯化残余物得到化合物20。将化合物20(24mg,0.12mmol)和cRGD(60mg,0.1mmol)溶解在无水THF(6mL)中并在室温下搅拌6h。使用HPLC纯化反应混合物,得到化合物丙炔基-cRGD(55mg,80%产率)。
1
合成聚合物APN
在冰浴中在氩气气氛下,将化合物7(16mg,0.03mmol)和三乙胺(25mg,0.25mmol)滴加至三光气(75mg,0.25mmol)在无水DCM中的溶液中。30min后,将反应混合物在真空下浓缩以除去残余的三光气,随后滴加4-二甲基氨基吡啶(61mg,0.5mmol)和化合物14或19(0.05mmol)的溶液。10min后,添加二甲胺(2μL,在100μL无水DCM中),并将反应混合物搅拌额外的10min,然后倒入H
APN
在Ac-FK配体中引入胺保护的赖氨酸的考虑是双重的。首先,它可以减少合成挑战。为了制备APN
APN
APN
APN
中间体和APN的结构通过NMR波谱法、凝胶渗透色谱法(GPC)和MALDI-TOF质谱法确认。
实施例3.APN的表征、稳定性和选择性
对实施例2中制备的APN进行表征并用于稳定性和选择性研究。
体外稳定性和选择性研究
将APN
结果与讨论
APN的疏水性荧光团主链和亲水性刷使它们为两亲性,并且从而在水性溶液中自发组装成具有球形形态的纳米颗粒(如TEM所示,图2d,h),APN
实施例4.CyCD和CyRGD的合成
还合成了实施例2中的APN的解聚荧光片段,包括HPβCD取代的NH
CyCD和CyRGD合成的通用程序
将化合物7(10mg,0.02mmol)和丙炔基底物(丙炔基-HPβCD或丙炔基-cRGD,0.024mmol)的混合物溶解在二甲亚砜(DMSO)/水(3mL/3mL)中,随后添加抗坏血酸钠(2.0mg,0.01mmol)和硫酸铜(2.5mg,0.01mmol)在蒸馏水(0.1mL)中的溶液。将混合物在室温下在氮气气氛下在黑暗中搅拌6h后。通过HPLC纯化反应混合物,以得到相应的化合物,为蓝色固体。
CyCD:
CyRGD:
实施例5.APN、CyCD和CyRGD的光学测量
确定APN(实施例2中制备)以及CyCD和CyRGD(实施例4中制备)的光学谱。
储备溶液的制备
将APN、CyCD和CyRGD溶解在超纯水中以获得储备溶液。H
光学测量
将APN
酶动力学测定
将不同浓度的APN
V=V
其中V是初始速度,并且[S]是底物浓度。
荧光量子产率的测量
将ICG用作标准品,在DMSO中已知的荧光量子产率(Φ)值为13%(Benson,R.C.&Kues,H.A.,J.Chem.Eng.Data 1977,22,379-383)。使用以下方程式计算荧光量子产率:Φ
分配系数的计算
使用Marvin和JChem计算器插件(ChemAxon,匈牙利)进行分配系数(pH 7.4下的Log D)的计算机计算。
结果与讨论
相同的荧光团主链赋予APN
表1.APN及其活化片段(CyCD和CyRGD)的光物理特性。
注释:λ
因此,虽然赖氨酸的胺被叔丁氧基羰基基团保护,但APN
实施例6.APN
取实施例2中制备的APN用于细胞毒性研究。此外,研究了它们在检测细胞中CatB和GzmB的能力。
体外细胞毒性和细胞成像研究
将鼠大肠癌细胞(CT26)、鼠巨噬细胞(RAW 264.7)和鼠肝细胞(AML-12)在具有10% FBS的DMEM中在37℃下在包含5% CO
对于细胞毒性研究,将细胞以每孔8,000个细胞的密度接种在96孔板中并培养24h。然后,将细胞培养基更换为包含不同浓度APN的200μL新鲜DMEM细胞培养基,随后温育24h。之后,去除细胞培养基,并用PBS小心地洗涤细胞。然后,向每孔中添加包含20μL 5-(3-羧基甲氧基苯基)-2-(4,5-二甲基噻唑基)-3-(4-磺苯基)四唑鎓内盐(MTS)的120μL新鲜DMEM细胞培养基并将细胞温育另外的4h。使用SpectraMax M5微孔板读数仪测量每个孔在490nm处的吸光度,以计算细胞生存力。
对于细胞荧光成像,将CT26、人肝细胞癌细胞(LM3)、CD8
结果与讨论
在确认其最小的细胞毒性(图4a,d)后,分别在鼠大肠癌CT26细胞系(人肝细胞癌LM3细胞)和颗粒酶B阳性细胞毒性T细胞(CD8
实施例7.APN、CyCD和CyRGD的药代动力学研究
取APN(实施例2中制备)和CyCD和CyRGD(实施例4中制备)用于药代动力学研究。
药代动力学研究
在整个实验期间,通过腹腔注射氯胺酮/赛拉嗪(xylazine)(每kg体重50mg氯胺酮和每kg体重5mg赛拉嗪)来麻醉雌性Balb/c小鼠。切开尾巴末端以抽取血液。在注射前在肝素化毛细管中采样血液作为参考。小鼠静脉内注射CyCD和CyRGD(每kg体重2.5μmol),并在注射后1、4、9、16、25、35、55、75、95、120、240、720和1,440min采样血液。对于APN的药代动力学研究,在注射APN(每kg体重10μmol)后1、9、35、95、120、240、720和1,440min从活小鼠中采样血液。将采集的血液样品储存在冰箱中以防止凝固,之后以1,096g离心20min。使用HPLC直接定量CyCD和CyRGD。将APN萃取并降解为片段以进行HPLC定量。定量结果呈现为双指数衰减曲线,以估计血液t
体内稳定性和生物相容性研究
使用UV-vis、荧光分光光度计和MALDI-TOF质谱法来测量PBS缓冲液(10mM,pH7.4)中采集的尿。从注射APN(每kg体重10μmol)、CyCD或CyRGD(每kg体重2.5μmol)后14天的Balb/c小鼠中,或从注射APN
肾清除效率和粪便排泄效率研究
对于小鼠中的清除研究,将雌性Balb/c小鼠静脉内注射APN(每kg体重10μmol)、CyCD或CyRGD(每kg体重2.5μmol)并置于代谢笼中。注射后15天采集尿和粪便。将采集的尿以1,585g离心8min,并使用0.22μm注射器式过滤器过滤。将尿中CyCD和CyRGD的排泄使用IVIS SpectrumCT系统进行成像,并使用HPLC进行定量。将排泄的APN与各自的蛋白酶温育,并降解为片段,以使用IVIS SpectrumCT系统进行成像和HPLC定量。采集尿和粪便后,杀死小鼠以对切除器官进行成像。使用Living Image 4.3软件利用目的区域分析来分析切除器官的荧光强度。采集主要器官,在PBS缓冲液中匀浆化,并以1,585g离心15min以去除不溶性组分。将最终的上清液与各自的蛋白酶温育并在荧光分光光度计上测量。对于大鼠中的清除研究,将SD大鼠静脉内注射APN
结果与讨论
通过HPLC追踪其血液浓度,研究了静脉内注射的APN及其片段(包括CyCD和CyRGD)的药代动力学(图5f)。CyCD和CyRGD的血液浓度分别在注射后2h和4h下降至接近0% ID g
表2.APN及其活化片段(CyCD和CyRGD)在活小鼠中的消除半衰期、肾清除效率和粪便排泄效率。
注释:t
实施例8.APN、CyCD和CyRGD的生物分布
取APN(实施例2中制备)以及CyCD和CyRGD(实施例4中制备)用于生物分布研究。
体内生物分布研究
所有小鼠研究均按照机构动物护理和使用委员会(Institutional Animal Careand Use Committee),Sing Health设置的指南进行。雌性NCr小鼠、雌性Balb/c小鼠和雄性Balb/c小鼠(6周龄)以及具有SCID表型的NSG小鼠(6周龄)获自InVivos。所有大鼠研究均按照国家研究所实验动物护理和使用指南(National Institute Guide for the Care andUse of Laboratory Animals)进行。购买分别来自浙江省医学科学院(Zhejiang Academyof Medical Sciences)和Beijing Vital River的无特定病原体的雄性Sprague Dawley(SD)大鼠、Lewis大鼠、Dark Agouti(DA)大鼠(12-15周龄并且体重为250-300g)和Balb/c裸小鼠(4-5周龄)。实验方案经浙江大学医学院第一附属医院(First Affiliated Hospital,Zhejiang University School of Medicine)动物伦理审查委员会(animal ethicsreview committees)批准。这些伦理委员会允许的最大肿瘤大小/负荷为1,100mm
结果与讨论
研究了APN的生物分布,并与CyCD和CyRGD的生物分布进行了比较(图5b)。注射后1h,在肾脏中检测到CyCD的荧光信号,但在其他器官中极少(图5d和8b,d)。相比之下,CyRGD主要积累在肝脏、胆囊和肠中(图5d和8c,d),因为它具有更高的分配系数(Log D=-2.40),并且因此比CyCD(Log D=-10.90)更高的疏水性。APN的大尺寸(~170nm>肾过滤阈值~5nm)导致它们在肝脏中积累,示出最小的荧光,因为它们本质上是非荧光的(图5c,d)。HPLC定量(图5e)显示,注射后1h,CyRGD、APN
实施例9.CyCD的体内稳定性
为了确定CyCD(实施例4中制备)的体内稳定性,通过遵循实施例5中的方案测量从活小鼠肾排泄的CyCD的光学和化学谱,并与纯化合物进行比较。
LOD测量
将一系列稀释的CyCD(0.00625、0.0125、0.025、0.05和0.1μmol kg
LOD=3σ/k (2)
其中σ是空白的标准偏差,并且k是发射强度针对CyCD的ID的图的斜率。
结果与讨论
在活小鼠中循环后CyCD在其光学光谱(图10b,c)或化学结构(MALDI,图10d,e)没有变化,证实了CyCD在小鼠中的最小体内代谢。为了评估CyCD对尿分析的灵敏度,将不同浓度的CyCD注射到活小鼠中,随后对采集的尿样品进行荧光读数。注射的CyCD的LOD被计算为每只小鼠4nmol(图6e)。这些数据证实了CyCD在活小鼠中的高肾清除效率和极低的体内代谢,使其成为光学尿分析中稳定且灵敏的示踪剂。
实施例10.癌症的实时成像和纵向尿分析
癌症的早期诊断对于有疗效的治疗和提高生存率至关重要。然而,由于当前方法的灵敏度和特异性低,检测超小肿瘤(<2mm微转移水平)仍然具有挑战性(Pashayan,N.&Pharoah,P.D.,Science 2020,368,589-590)。首先通过在皮下CT26荷瘤小鼠模型中与对照纳米传感器APN
CT26结直肠癌的小鼠模型
随机选择小鼠,并以1×10
癌症小鼠模型中的尿分析
对于原位肝脏肿瘤模型,从以下中采集尿:在肿瘤植入后注射APN
活小鼠癌症的实时体内NIRF成像
对于原位肝脏肿瘤模型,肿瘤植入后14天,静脉内注射APN
肝脏功能和肾脏功能的确定
为了研究小鼠的肝脏功能和肾脏功能,在用Con-A处理或静脉内注射CsA然后Con-A给药之后的t=2、5、8或12h在异氟醚麻醉下的小鼠尾静脉采集血液,SCID小鼠、LPS处理的小鼠或患有原位肝脏肿瘤的小鼠。将采集的血液样品以1,096g离心20min。使用商业试剂盒测定血清ALT、AST、肌酐和BUN。为了研究大鼠的肝脏功能和肾脏功能,从移植之后的、肝脏移植后每日静脉内注射Tac之后的或在腹部上仅具有创伤的假手术之后的2、3、4和6天从腹主动脉采集血液样品,或者从同系移植物大鼠或LPS处理的大鼠采集血液样品。将血液样品以1,096g离心20min。根据制造商的方案,使用商业试剂盒测定血清ALT、AST、ALP、肌酐、BUN和尿酸。
皮下肿瘤和原位肝脏肿瘤小鼠模型
随机选择Balb/c小鼠,并以每只小鼠1×10
结果与讨论
注射APN
在原位肝脏肿瘤模型中进一步评价了APN
CT26细胞植入15天后,静脉内注射APN
通过APN
为了揭示APN
凭借CyCD的高肾清除效率,通过NIRF测量荷瘤活小鼠注射APN
因此,这些结果示出基于APN
实施例11.急性免疫介导的肝炎的实时成像和尿分析
实时非侵入性监测T淋巴细胞的存在和活化对于诊断免疫介导的疾病和实体器官同种异体移植物排斥至关重要,但这仍然具有挑战性。在凝集素(Con-A)诱导的急性免疫介导的肝炎的鼠模型中测试了APN
急性免疫介导的肝炎的小鼠模型
随机选择雄性Balb/c小鼠并用Con-A(12.5mg kg
免疫介导的肝炎的小鼠模型的尿分析
从以下采集尿:在用Con-A处理或静脉内注射CsA然后Con-A给药之后在注射APN
活小鼠中急性免疫介导的肝炎的实时体内NIRF成像
在用Con-A处理或静脉内注射CsA(每kg体重10或50mg)然后Con-A给药之后静脉内注射APN
具有LPS诱导的局部皮肤水肿的活小鼠的特异性研究
雄性Balb/c小鼠在右大腿皮内注射LPS(0.2mg kg
结果与讨论
Con-A以12.5mg/kg的剂量静脉内给药至活Blab/c小鼠中(Yamashita,J.et al.,J.Immunol.2011,186,3410-3420),随后在用Con-A处理后的不同时间点(1、4、7和11h,图21a)静脉内注射APN
将APN
将临床和临床前测定用于测试小鼠血清中的肝脏功能(ALT和AST)以及促炎细胞因子(包括TNF-α、IFN-γ、IL-2和IL-6)的水平(图28)。处理后12h,ALT和AST具有统计学显著增加(10.6倍和16.9倍)。相比之下,细胞因子在con-A处理后2h较早增加(TNF-α、IFN-γ、IL-2和IL-6分别为13.1、2.5、3.0和4.2倍),因为它们是用于淋巴细胞活化的上游激活因子(图20g)。尽管细胞因子的检测时间点(2h)早于基于APN
实施例12.急性肝脏同种异体移植物排斥的光学尿分析
原位肝脏移植是患有末期肝脏疾病患者唯一选项;然而,同种异体移植物排斥仍然是移植后的主要并发症(Lechler,R.I.et al.,Nat.Med.2005,11,605-613)。侵入性活检是常规用于诊断同种异体移植物排斥和监测免疫抑制药物疗法功效的金标准(Jones,K.D.&Ferrell,L.D.,Semin.Diagn.Pathol.1998,15,306-317)。然而,此手术可引起继发性损伤,并且仅提供静态和病灶病理状态(Portmann,B.et al.,Verh.DtschGes.Pathol.1995,79,277-290)。因此,早期检测同种异体移植物排斥对于保留移植物的功能至关重要。受到APN
急性肝脏同种异体移植物排斥的大鼠模型
Dark Agouti(DA)大鼠和Lewis大鼠分别用作原位肝脏移植的供体和受体。外科手术根据“二袖套技术(two cuff technique)”进行(Kamada,N.&Calne,R.Y.,Transplantation 1979,28,47-50)。简而言之,对供体DA大鼠进行麻醉并随后进行全身肝素化。将DA大鼠的供体肝脏分离,浸入4℃林格氏平衡溶液中,并立即原位移植至受体Lewis大鼠的腹部。连续缝合肝上腔静脉吻合。应用袖套技术连接门静脉和肝下腔静脉。之后然后,通过留置支架进行端端吻合来重建胆管。原位肝脏移植后,自由可获得标准啮齿动物食物和无菌水。对于处理组,受体Lewis大鼠在肝脏移植后每日用他克莫司(tacrolimus)(0.3或1.5mg kg
急性肝脏同种异体移植物排斥的大鼠模型中的尿分析
从以下采集尿:在移植或在肝脏移植后每日静脉内注射Tac之后静脉内注射APN
大鼠急性肝脏同种异体移植物排斥的离体NIRF成像
在移植后的或在肝脏移植之后每日静脉内注射Tac(0.3或1.5mg kg
具有LPS诱导的局部皮肤水肿的活小鼠的特异性研究
雄性Balb/c小鼠在右大腿皮内注射LPS(0.2mg kg
结果与讨论
通过分别使用DA和Lewis大鼠作为供体和受体来进行同种异体原位肝脏移植(称为同种异体移植物)(图29a)。对照组包括健康的大鼠或外科手术后用免疫抑制药物Tac处理的大鼠(图30a)。首先在不同手术后时间点评价肝脏和肾脏功能。移植后4天,ALT、AST和ALP具有统计学显著增加(5.6、3.7和3.2倍)(图30b),然而,任何组中的血清肌酐、BUN和尿酸均没有增量(图30c)。此外,组织学研究示出同种异体移植后3天组织形态正常,但同种异体移植后6天观察到肝脏血窦扩张和肝细胞碎片(图29h和31b),而在任何大鼠的肾脏中均未检测到组织学变化(图31b)。大鼠中这样的完整的肾脏功能确保了移植后6天内CyCD的相同肾清除功效。
在不同的移植后时间点(2、3、4和6天,图30a)将APN
为了评价APN
为了验证APN
对大鼠血清中促炎细胞因子的分析的ELISA测定显示,包括TNF-α、IFN-γ、IL-2、IL-4和IL-6的细胞因子在手术后2天示出统计学显著增加(1.3倍、2.0倍、1.7倍、1.4倍和1.8倍)(图37)。然而,在同系移植物的大鼠、假手术大鼠和皮肤水肿大鼠中也观察到细胞因子的统计学显著增加(图37),这意味着血清细胞因子具有低疾病特异性。
在免疫介导的肝炎和急性肝脏同种异体移植物排斥模型两者中,基于APN
因此,我们证明了原位纳米颗粒到分子的药代动力学转化为一种有效的体内传感方法。这通过开发作为通用聚合物支架的APN来例证,该支架经历生物标志物引发的催化解聚并随后释放肾可清除的荧光片段,用于癌症的光学尿分析(参见实施例10)或啮齿动物模型中的同种异体移植物排斥。APN的设计与染料-肽缀合的无机纳米传感器的设计不同。首先,APN在与蛋白酶相互作用时经历了从纳米颗粒到小分子片段的完全转化,而报道的无机纳米传感器将无机核留在组织中(Kwong,G.A.et al.,Nat.Biotechnol.2013,31,63-70)。第二,APN的荧光响应仅由蛋白酶催化反应时荧光团单元的结构演变决定,而常规的电子转移诱导的荧光猝灭是报道的无机纳米传感器的信号传导机制,该机制是距离依赖的并且容易受到生物分子相互作用的干扰(Kwon,E.J.,Dudani,J.S.&Bhatia,S.N.,Nat.Biomed.Eng.2017,1,0054;以及Dudani,J.S.et al.,Adv.Funct.Mater.2016,26,2919-2928)。第三,释放的荧光团片段(CyCD)是为高肾清除而特异性设计的(24h时~91%ID,参见实施例7),而染料-肽缀合物具有高度依赖于肽序列的中至低肾清除(Kwon,E.J.,Dudani,J.S.&Bhatia,S.N.,Nat.Biomed.Eng.2017,1,0054)。因此,APN表示了一类无与伦比的光学纳米传感器,具有成像和诊断的高临床转化潜能。
为了评估所有测试测定的灵敏度和特异性,进行了ROC分析(图29e,f)。与细胞因子对早期检测的有限预测能力相比(0.69 比较例1 配备有被癌症过表达的CatB和癌症靶向部分(cRGDfK)可裂解的肽刷的APN 表3.APN 缓慢体内清除和光的浅层组织穿透是光学纳米颗粒作为早期诊断成像剂的临床转化的主要障碍。为了解决这些挑战,这里报道了第一种光学纳米颗粒,它可以特异性活化疾病部位的纳米颗粒至分子的药代动力学转化,灵敏地触发荧光信号来报道生物标志物的水平,并经由安全的肾清除途径快速地从活体中排泄以用于非侵入性尿分析。超高的肾清除功效和生物标志物特异性释放荧光片段(CyCD),连同催化碎裂的原位扩增,使得基于APN的荧光开启了优于传统的血液和尿测试的尿分析,其允许癌症的超灵敏检测和急性肝脏同种异体移植物排斥的早期诊断,其具有由其他非侵入性方法无法获得的长期期望的同种异体移植物特异性。APN的模块化化学提供了结构和功能多样性两者,用于灵敏地检测涵盖癌症和同种异体移植物排斥的潜在疾病。因此,本发明不仅提供了将光学纳米颗粒转化用于体内传感的新机会,而且还强调了通用纳米平台来填补缺乏用于早期诊断的超灵敏尿测试的空白。
