包括马鞭草烯酮衍生物的用于治疗或预防肥胖或肥胖相关肝病的组合物
文献发布时间:2024-04-29 00:47:01
技术领域
本发明涉及包含马鞭草烯酮衍生物的用于治疗或预防肥胖或肥胖相关肝病的药物组合物,并且更特别地,涉及包含马鞭草烯酮衍生物的用于治疗或预防肥胖或肥胖相关肝病的药物组合物,该药物组合物能够通过抑制高脂饮食诱导的小鼠中的TGF-β/Smad3信号传导来治疗或预防肥胖或肥胖相关肝病。
背景技术
肥胖相关非酒精性脂肪性肝病(NAFLD)是从非酒精性脂肪肝到非酒精性脂肪性肝炎(NASH)的连续的慢性肝病,是肝脏相关发病率和死亡率的主要原因。此外,估计NALFD的患病率为约全球总人口的25%,并且其患病率持续上升,从而给公共卫生带来了显著负担[2,3]。
越来越多的证据表明,肝脏与内脏脂肪组织(VAT)密切相互作用,并且肥胖诱导的发炎的VAT在NAFLD的发展中起着关键作用[1,4-6]。肥胖,尤其是内脏型肥胖,促进代谢健康的VAT转化为失调和发炎的VAT[5]。失调的VAT(作为内分泌和旁分泌器官)分泌促炎症细胞因子诸如白介素-6(IL-6)和肿瘤坏死因子-α(TNF-α),从而增加炎症细胞诸如巨噬细胞的浸润,这导致VAT中的炎症进一步加重[4-6]。随后发炎的VAT增强促炎症细胞因子的分泌,从而促进全身炎症和胰岛素抵抗,这进一步导致NAFLD进展加速[1,4-6]。因此,发生在VAT中的炎症反应促进了NAFLD的进展,并将为肥胖相关NAFLD的适当的治疗靶点[6,7]。
先前的几项研究报道了,转化生长因子(TGF)-β/Smad3信号传导在VAT炎症的病理过程中起着至关重要的作用[8-10]。已知,在TGF-β1与TGF-β1型和2型受体的复合物(TGF-βR1和TGF-βR2)之间的相互作用激活了Smad2/3的磷酸化,从而上调了VAT炎症(图1A)[10]。此外,先前报道的动物研究结果发现,Smad3的遗传切除和用TGF-β功能性封闭抗体的治疗减少肥胖造成的VAT炎症[11,12]。因此,TGF-β/Smad3信号传导通路可以是发炎的VAT的治疗靶点。
因此,本发明人付出努力来利用TGF-β/Smad3信号传导通路作为用于由上述发炎的VAT引起的NAFLD的治疗靶点,并且结果是,马鞭草烯酮衍生物化合物能够通过抑制高脂饮食诱导的(HFD)小鼠中的TGF-β/Smad3信号传导通路来治疗和预防肥胖诱导的内脏脂肪组织(VAT)炎症以及后续的肥胖或非酒精性脂肪性肝病(NAFLD),从而完成了本发明。
[现有技术文件]
[非专利文件]
[1]Byrne CD,Targher G.NAFLD:a multisystem disease.Journal ofhepatology.2015;62:S47-S64.
[2]Younossi ZM,Blissett D,Blissett R,Henry L,Stepanova M,Younossi Y,et al.The economic and clinical burden of nonalcoholic fatty liver disease inthe United States and Europe.Hepatology.2016;64:1577-86.
[3]Younossi ZM,Koenig AB,Abdelatif D,Fazel Y,Henry L,Wymer M.Globalepidemiology of nonalcoholic fatty liver disease—meta-analytic assessment ofprevalence,incidence,and outcomes.Hepatology.2016;64:73-84.
[4]Khan RS,Bril F,Cusi K,Newsome PN.Modulation of insulin resistancein nonalcoholic fatty liver disease.Hepatology.2019;70:711-24.
[5]Azzu V,Vacca M,Virtue S,Allison M,Vidal-Puig A.Adipose tissue-liver cross talk in the control of whole-body metabolism:implications in non-alcoholic fatty liver disease.Gastroenterology.2020.
[6]Friedman SL,Neuschwander-Tetri BA,Rinella M,Sanyal AJ.Mechanismsof NAFLD development and therapeutic strategies.Nature medicine.2018;24:908-22.
[7]Wang Y,Tang B,Long L,Luo P,Xiang W,Li X,et al.Improvement ofobesity-associated disorders by a small-moleculedrug targeting mitochondriaof adipose tissue macrophages.Nature communications.2021;12:1-16.
[8]Lee M-J.Transforming growth factor beta superfamily regulationofadipose tissue biology in obesity.Biochimica et Biophysica Acta(BBA)-Molecular Basis of Disease.2018;1864:1160-71.
[9]Sousa-Pinto B,
[10]Tan C,Chong H,Tan E,Tan N.Getting‘Smad’about obesityanddiabetes.Nutrition&diabetes.2012;2:e29-e.
[11]Tan CK,Leuenberger N,Tan MJ,Yan YW,Chen Y,Kambadur R,et al.Smad3deficiency in mice protects against insulin resistance and obesity inducedbya high-fat diet.Diabetes.2011;60:464-76.
[12]Yadav H,Quijano C,Kamaraju AK,Gavrilova O,Malek R,Chen W,etal.Protection from obesity and diabetes by blockade of TGF-β/Smad3signaling.Cell metabolism.2011;14:67-79.
[13]Ju C,Song S,Hwang S,Kim C,Kim M,Gu J,et al.Discovery of novel(1S)-(-)-verbenone derivatives with anti-oxidant and anti-ischemiceffects.Bioorganic&medicinal chemistry letters.2013;23:5421-5.
[14]Nguyen HT,Reyes-Alcaraz A,Yong HJ,Nguyen LP,Park H-K,InoueA,etal.CXCR7:aβ-arrestin-biased receptor that potentiates cell migrationandrecruitsβ-arrestin2 exclusively through Gβγsubunits and GRK2.Cell&bioscience.2020;10:1-19.
[15]Bachmanov AA,Reed DR,Beauchamp GK,Tordoff MG.Food intake,waterintake,and drinking spout side preference of 28 mousestrains.Behaviorgenetics.2002;32:435-43.
[16]Pahk K,Kim EJ,Joung C,Seo HS,Kim S.Exercise trainingreducesinflammatory metabolic activity of visceral fat assessed by 18F-FDGPET/CTin obese women.Clinical Endocrinology.2020.
[17]Pahk K,Kim EJ,Joung C,Seo HS,Kim S.Association of glucoseuptakeof visceral fat and acute myocardial infarction:a pilot 18 F-FDG PET/CTstudy.Cardiovascular Diabetology.2020;19:1-11.
[18]Jimenez-Gomez Y,Mattison JA,Pearson KJ,Martin-Montalvo A,PalaciosHH,Sossong AM,et al.Resveratrol improves adipose insulin signalingand reducesthe inflammatory response in adipose tissue of rhesus monkeys onhigh-fat,high-sugar diet.Cell metabolism.2013;18:533-45.
[19]Lee ES,Kwon M-H,Kim HM,Woo HB,Ahn CM,Chung CH.Curcumin analogCUR5–8 ameliorates nonalcoholic fatty liver disease in micewith high-fatdiet-induced obesity.Metabolism.2020;103:154015.
[20]Livak KJ,Schmittgen TD.Analysis of relative gene expressiondatausing real-time quantitative PCR and the 2-ΔΔCT method.methods.2001;25:402-8.
[21]Elsegood CL,Chang M,Jessup W,Scholz GM,HamiltonJA.GlucoseMetabolism Is Required for Oxidized LDL–Induced MacrophageSurvival:Roleof PI3K and Bcl-2 Family Proteins.Arteriosclerosis,thrombosis,and vascularbiology.2009;29:1283-9.
[22]Moraes-Vieira PM,Saghatelian A,Kahn BB.GLUT4 expressioninadipocytes regulates de novo lipogenesis and levels of a novel class oflipids withantidiabetic and anti-inflammatory effects.Diabetes.2016;65:1808-15.
[23]Viglino D,Martin M,Almeras N,Després J-P,Coxson HO,Pépin J-L,etal.Low Liver Density Is Linked to Cardiovascular Comorbidity in COPD:AnECLIPSE Cohort Analysis.International Journal of ChronicObstructivePulmonary Disease.2019;14:3053.
[24]Um MY,Moon MK,Ahn J,Ha TY.Coumarin attenuates hepaticsteatosis bydown-regulating lipogenic gene expression in mice fed a high-fat diet.Britishjournal of nutrition.2013;109:1590-7.
[25]Feng D,Zou J,Su D,Mai H,Zhang S,Li P,et al.Curcumin preventshigh-fat diet-induced hepatic steatosis in ApoE-/-mice by improvingintestinalbarrier function and reducing endotoxin and liver TLR4/NF-κBinflammation.Nutrition&metabolism.2019;16:1-11.
[26]Cildir G,Akincilar SC,Tergaonkar V.Chronic adiposetissueinflammation:all immune cells on the stage.Trends in molecularmedicine.2013;19:487-500.
[27]Xie L,Ortega MT,Mora S,Chapes SK.Interactive changesbetweenmacrophages and adipocytes.Clinical and Vaccine Immunology.2010;17:651-9.
[28]Lumeng CN,Deyoung SM,Saltiel AR.Macrophages block insulinactionin adipocytes by altering expression of signaling and glucosetransportproteins.American Journal of Physiology-Endocrinology andMetabolism.2007;292:E166-E74.
[29]Chalasani N,Younossi Z,Lavine JE,Charlton M,Cusi K,Rinella M,etal.The diagnosis and management of nonalcoholic fatty liver disease:practiceguidance from the American Association for the Study of LiverDiseases.Hepatology.2018;67:328-57.
[30]Adams LA,Lymp JF,Sauver JS,Sanderson SO,Lindor KD,FeldsteinA,etal.The natural history of nonalcoholic fatty liver disease:a population-basedcohort study.Gastroenterology.2005;129:113-21.
[31]Musolino V,Gliozzi M,Scarano F,Bosco F,Scicchitano M,Nucera S,etal.Bergamot polyphenols improve dyslipidemia and pathophysiologicalfeaturesin a mouse model of non-alcoholic fatty liver disease.Scientificreports.2020;10:1-14.
[32]Nam J-S,Terabe M,Mamura M,Kang M-J,Chae H,Stuelten C,et al.Ananti–transforming growth factorβantibody suppresses metastasis viacooperativeeffects on multiple cell compartments.Cancer research.2008;68:3835-43.
[33]Takahashi K,Akatsu Y,Podyma-Inoue KA,Matsumoto T,Takahashi H,Yoshimatsu Y,et al.Targeting all transforming growth factor-βisoforms withanFc chimeric receptor impairs tumor growth and angiogenesis of oralsquamouscell cancer.Journal of Biological Chemistry.2020;295:12559-72.
[34]Chames P,Van Regenmortel M,Weiss E,Baty D.Therapeuticantibodies:successes,limitations and hopes for the future.British journalofpharmacology.2009;157:220-33.
[35]Bell MR,Engleka MJ,Malik A,Strickler JE.To fuse or not to fuse:what is your purpose?Protein Science.2013;22:1466-77.
[36]Santiago B,
[37]Gallo-Oller G,Vollmann-Zwerenz A,Meléndez B,Rey JA,Hau P,Dotor J,et al.P144,a Transforming Growth Factor beta inhibitor peptide,generatesantitumoral effects and modifies SMAD7 and SKI levels in human glioblastomacell lines.Cancer letters.2016;381:67-75.
[38]Huang C-Y,Chung C-L,Hu T-H,Chen J-J,Liu P-F,Chen C-L.Recentprogress in TGF-βinhibitors for cancer therapy.Biomedicine&Pharmacotherapy.2021;134:111046.
发明内容
本发明的目的是提供马鞭草烯酮衍生物用于通过抑制高脂饮食(HFD)诱导的肥胖小鼠中的TGF-β/Smad3信号传导通路来治疗和预防肥胖诱导的VAT炎症和后续的NAFLD的新用途。
为了实现上述目的,本发明提供了一种用于治疗肥胖的药物组合物,所述药物组合物包括由下式1表示的马鞭草烯酮衍生物或其药学上可接受的盐作为活性成分:
[式1]
其中,R
指示双键或单键。
本发明还提供了一种用于治疗或预防肥胖相关肝病并且包含活性成分由式1表示的马鞭草烯酮衍生物或其药学上可接受的盐的药物组合物。
本发明还提供了一种用于预防或改善肥胖的健康功能性食品,所述健康功能性食品包括由下式1表示的马鞭草烯酮衍生物或其药学上可接受的盐作为活性成分。
本发明还提供了一种用于预防或改善肥胖相关肝病的健康功能性食品,所述健康功能性食品包括由下式1表示的马鞭草烯酮衍生物或其药学上可接受的盐作为活性成分。
附图说明
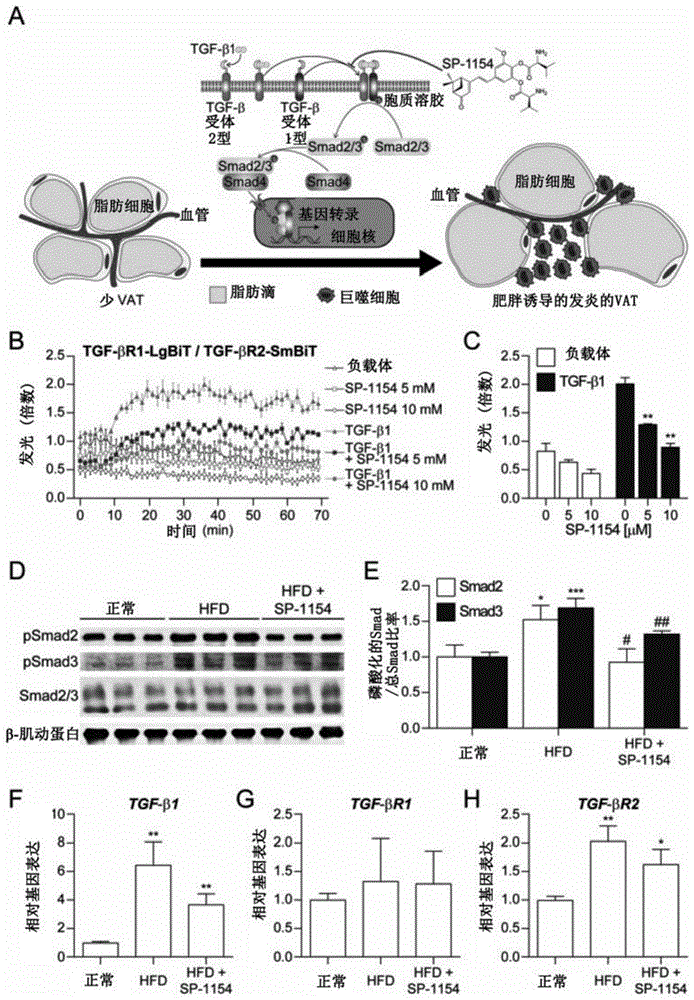
图1(A)示出了根据本发明的一种实施方式的SP-1154对TGF-β/Smad3信号传导通路的影响的示意图。TGF,转化生长因子;VAT,内脏脂肪组织。(B和C)SP-1154抑制HEK293细胞中TGF-β1刺激的TGF-βR1和TGF-βR2的复合物形成。TGF-βR1,TGF-β1型受体;TGF-βR2,TGF-β2型受体。数据呈现为三个独立实验的平均值±标准偏差(SD)。统计显著性通过单向方差分析(ANOVA),随后Tukey事后检验进行评估。**p<0.01对比于没有SP-1154处理的TGF-β1刺激组。(D和E)SP-1154抑制高脂饮食(HFD)诱导的小鼠的VAT中的Smad2/3的磷酸化。pSmad2,磷酸化的Smad2;pSmad3,磷酸化的Smad3。数据呈现为三个独立实验的平均值±SD。统计显著性通过单向ANOVA,随后Tukey事后检验进行评估。*p<0.05对比于正常。***p<0.001对比于正常。
图2示出了在20周研究期过程中体重(A)和食物摄入量(B和C)的变化(对于正常,n=5,对于HFD,n=10,对于HFD+SP-1154,n=8)。数据呈现为平均值±SD。统计显著性通过单向ANOVA,随后Tukey事后检验进行评估。*p<0.05对比于正常。**p<0.01对比于正常。***p<0.001对比于正常。
图3示出SP-1154降低HFD诱导的小鼠中的VAT SUVmax(A和B)和CRP水平(C)。(A和B)CT,计算机体层成像;PET,正电子发射体层显像;ROI,感兴趣区;R,右;L,左;SUVmax,最大标准摄取值。对于正常,n=6,对于HFD,n=6,以及对于HFD+SP-1154,n=6。数据呈现为平均值±SD。统计显著性通过单向ANOVA,随后Tukey事后检验进行评估。***p<0.001对比于正常。
图4示出SP-1154防止巨噬细胞浸润到HFD诱导的小鼠的VAT中。(A)截面VAT的代表性CD68
图5示出SP-1154改进了胰岛素抵抗和葡萄糖稳态。(A)截面VAT的代表性GLUT1
图6示出SP-1154抑制HFD诱导的肝脂肪变性。(A)肝脏CT和截面肝脏组织的代表性图像(比例尺,100μm;放大率,×100)。冠状CT图像上的黄色箭头表示相应横向CT图像的水平。(B)从CT图像对肝脏密度进行定量。对于正常,n=6,对于HFD,n=6,以及对于HFD+SP-1154,n=6。数据呈现为平均值±SD。统计显著性通过单向ANOVA,随后Tukey事后检验进行评估。***p<0.001对比于正常。
本发明的详细描述和优选实施方式
除非另有定义,否则本说明书中使用的所有技术和科学术语具有与本发明所属领域的技术人员通常理解的相同的含义。通常,本说明书中使用的命名法是公知的,并且在本领域中常用。
在本发明中,已经发现在高脂饮食诱导的小鼠中,SP-1154抑制TGF-β/Smad3信号传导通路,显著抑制了高脂饮食诱导的内脏脂肪组织(VAT)炎症及其相关的全身炎症,显著改进了胰岛素敏感性以及葡萄糖稳态,并降低了肝脏脂肪变性,从而显著改善了VAT炎症和肥胖相关NAFLD。这支持了SP-1154通过靶向发炎的VAT而作为用于肥胖及其相关NAFLD的治疗药物的潜在用途。
因此,本发明涉及一种用于治疗肥胖的药物组合物,该药物组合物包括由下式1表示的马鞭草烯酮衍生物或其药学上可接受的盐作为活性成分:
[式1]
其中,R
指示双键或单键。
肥胖诱导的发炎的内脏脂肪组织(VAT)分泌促炎症细胞因子,从而促进全身炎症和胰岛素抵抗,这进一步加剧了肥胖相关非酒精性脂肪性肝病(NAFLD),并且TGF-β/Smad3信号传导在VAT中的炎症事件中发挥重要作用。SP-1154通过抑制高脂饮食诱导的小鼠中的TGF-β/Smad3信号传导,表现出对肥胖诱导的发炎的VAT和后续的NAFLD的治疗作用。
在本发明中,使用雄性C57BL/6小鼠通过20周的高脂饮食(60%脂肪)来诱导NAFLD。每天口服给药SP-1154(50mg/kg),持续20周。通过使用
结果发现,SP-1154抑制了TGF-β/Smad3信号传导通路,并显著抑制了高脂饮食诱导的VAT炎症及其相关的全身炎症。此外,SP-1154显著改进了胰岛素敏感性和葡萄糖稳态,并降低了肝脏脂肪变性。SP-1154显著抑制了VAT炎症和肥胖相关NAFLD。总之,可以说SP-1154显著改善了VAT炎症和肥胖相关NAFLD。这支持了SP-1154通过靶向发炎的VAT而作为用于肥胖及其相关NAFLD的治疗药物的潜在用途。
为了更好地溶解于水中,将SP-1154合成为抗炎/抗氧化的马鞭草烯酮衍生物SP-8356的前药[13]。由于TGF-β/Smad3信号传导通路参与炎症和氧化应激两者[10],因此假设TGF-β/Smad3信号传导可能受SP-1154影响。
在本发明中中,R
在本发明中,R
在本发明中,马鞭草烯酮衍生物可以是选自由以下组成的组中的至少一种:
(1S,5R)-4-(4-羟基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(3a);
(1S,5R)-4-(4-羟基-2-甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(3b);
(1S,5R)-4-(3,4-二羟基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(3c);
(1S,5R)-4-(3-溴-4-羟基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(3d);
(1S,5R)-4-(4-羟基-2,6-二甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(3e);
(1S,5R)-4-(3,4-二羟基-5-甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(3f);
(1S,5R)-4-(3-羟基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(3g);
(1S,5R)-4-(2-羟基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(3h);
(1S,5R)-4-(2-羟基-4-甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(3i);
(1S,5R)-6,6-二甲基-4-苯乙烯基双环[3.1.1]庚-3-烯-2-酮(4a);
(1S,5R)-4-(4-氟苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(4b);
(1S,5R)-4-(4-甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(4c);
(1S,5R)-4-(2-(联苯-4-基)乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(4d);
(1S,5R)-4-(4-(1H-吡咯-1-基)苯乙烯基)-二甲基双环[3.1.1]庚-3-烯-2-酮(4e);
(1S,5R)-4-(3,4-二甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(4f);
(1S,5R)-4-(3,5-二甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(4g);
(1S,5R)-4-(2,5-二甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(4h);
(1S,5R)-4-(5-溴-2-甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(4i);
(1S,5R)-6,6-二甲基-4-((E)-2-(吡啶-2-基)乙烯基)双环[3.1.1]庚-3-烯-2-酮(5a);
(1S,5R)-6,6-二甲基-4-((E)-2-(吡啶-3-基)乙烯基)双环[3.1.1]庚-3-烯-2-酮(5b);
(1S,5R)-6,6-二甲基-4-((E)-2-(吡啶-4-基)乙烯基)双环[3.1.1]庚-3-烯-2-酮(5c);以及
(2S,2'S)-5-((E)-2-((1R,5S)-6,6-二甲基-4-氧亚基双环[3.1.1]庚-2-烯-2-基)乙烯基)-3-甲氧基-1,2-亚苯基双(2-氨基-3-甲基丁酸酯)-二盐酸盐(6)。优选地,马鞭草烯酮衍生物可以是(1S,5R)-4-(3,4-二羟基-5-甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(3f),或(2S,2'S)-5-((E)-2-((1R,5S)-6,6-二甲基-4-氧亚基双环[3.1.1]庚-2-烯-2-基)乙烯基)-3-甲氧基-1,2-亚苯基双(2-氨基-3-甲基丁酸酯)-二盐酸盐(6)。
[式2]
(化合物3f)
[式3]
(化合物6)
在本发明中,肥胖相关肝病可以是非酒精性脂肪性肝病(NAFLD),其中脂肪性肝病可以是脂肪变性、脂肪性肝炎、非酒精性脂肪性肝炎(NASH)、肝纤维化或肝硬化。
在本发明中,该组合物能够通过抑制TGF-β/Smad3信号传导通路来降低肥胖诱导的内脏脂肪组织炎症。
在本发明中,SP-8356没有很好地溶解在盐水中,并且因此当它作为悬浮液使用时,其功效弱但显著。此外,SP-8356的缬氨酸酯(SP-1154)(SP-8356的前药形式)非常快速地转化为SP-8356,并且具有高溶水度,并且因此将其在溶解于粘性透明质酸中后使用。可溶性SP-8356(SP-1154)比作为悬浮液给药的SP-8356更有效。
如本文所用,术语“治疗”是指通过给药根据本发明的包括由下式1表示的马鞭草烯酮衍生物或其药学上可接受的盐作为活性成分的组合物来减轻或有益地改变肥胖或肥胖相关肝病的症状的任何动作。
如本文所用,术语“预防”是指通过给药根据本发明的包括由下式1表示的马鞭草烯酮衍生物或其药学上可接受的盐作为活性成分的组合物来抑制或延缓肥胖或肥胖相关肝病的症状的任何动作。
如本文所用,术语“前药”是指需要通过酶或水解转化为母体药物以在体内和体外释放活性药物的药物分子的衍生物。前药通常(尽管不是必要的)在转化为母体药物之前不具备药理学活性。当母体药物被转化时,前药通常(但不是必要的)不具备药物活性。
如本文所用,术语“非酒精性脂肪性肝病(NAFLD)”是指由于酒精以外的原因引起的脂肪性肝病。术语“非酒精性脂肪性肝病”涵盖了“非酒精性脂肪变性”和“非酒精性脂肪性肝炎”(这些是由于酒精以外的原因导致的肝细胞中脂肪积累的病症)、“非酒精性脂肪肝相关的纤维化”和“非酒精性脂肪肝相关的肝硬化”。
如本文所用,术语“脂肪肝”是指肝脏内有脂肪沉积但没有肝细胞损伤(气球样变性)和纤维化的情况。“脂肪性肝炎”是指伴有肝细胞损伤(气球样变性)的炎症发现,同时示出肝脏内脂肪沉积的情况。脂肪性肝炎也可以伴有肝纤维化。“肝硬化”是指伴有脂肪肝或脂肪性肝炎的组织学发现的肝硬化,或发生在先前具有组织学证明的脂肪肝或脂肪性肝炎患者中的肝硬化。在本说明书中,与脂肪性肝病相关的术语的定义仅旨在包括与脂肪肝相关的各种病症,并且根据这些术语定义的患者的病症并不总是能够明显地区分。
如本文所用,术语“血脂异常”是指高脂血症和高胆固醇血症。高脂血症和高胆固醇血症各自是指血浆甘油三酯水平高于正常人血浆中的甘油三酯水平且血浆总胆固醇和/或LDL-胆固醇水平较高的病症。
根据本领域已知的常规方法,可以将根据本发明的由式1表示的化合物制备成药学上可接受的盐或溶剂化物。药学上可接受的盐有利地是用药学上可接受的游离酸形成的酸加成盐。可使用常规方法制备酸加成盐,例如通过将化合物溶解在过量的水性酸溶液中,并使用与水混溶的有机溶剂诸如甲醇、乙醇、丙酮或乙腈沉淀所得盐。替代地,酸加成盐可以通过在水或醇(例如,二醇单甲醚)中加热等摩尔量的化合物和酸,以及然后通过蒸发干燥混合物或通过抽吸来过滤沉淀的盐来制备。
在这种情况下,无机酸或有机酸可以用作游离酸。无机酸的实例包括盐酸、磷酸、硫酸、硝酸、锡酸等,并且有机酸的实例包括甲磺酸、对甲苯磺酸、乙酸、三氟乙酸、柠檬酸、马来酸、琥珀酸、草酸、苯甲酸、酒石酸、富马酸、扁桃酸、丙酸、乳酸、乙醇酸、葡糖酸、半乳糖醛酸、谷氨酸、戊二酸、葡糖醛酸、天冬氨酸、抗坏血酸、碳酸、香草酸、氢碘酸等。
此外,可以使用碱来制备药学上可接受的金属盐。碱金属或碱土金属盐可以例如通过将化合物溶解在过量的碱金属氢氧化物或碱土金属氢氧化物溶液中,过滤未溶解的盐,以及然后通过蒸发来干燥滤液而获得。在这种情况下,作为金属盐,特别是钠、钾或钙盐是药学上合适的。此外,相应的银盐可以通过使碱金属或碱土金属盐与适当的银盐(例如,硝酸银)反应获得。
除非另有说明,具有式1的结构的化合物的药学上可接受的盐包括酸性或碱性基团的盐,其可以存在于具有式1的结构的化合物中。例如,药学上可接受的盐包括羟基基团的钠、钙和钾盐,以及氨基基团的其他药学上可接受的盐,包括氢溴酸盐、硫酸盐、硫酸氢盐、磷酸盐、磷酸氢盐、磷酸二氢盐、乙酸盐、琥珀酸盐、柠檬酸盐、酒石酸盐、乳酸盐、扁桃酸盐、甲烷磺酸盐(甲磺酸盐)和对甲苯磺酸盐(甲苯磺酸盐)。可以使用本领域已知的盐制备方法或制备工艺来制备盐。
如本文所用,术语“药物组合物”是指为了预防或治疗疾病目的而制备的药物组合物,并且每种组合物可以根据常规方法配制成各种形式并使用。例如,药物组合物可以配制成剂型,诸如散剂、颗粒剂、片剂、胶囊、混悬剂、乳剂和糖浆,并且可以配制成剂型,诸如外用制剂、栓剂和无菌可注射溶液。特别地,药物组合物可以配制成适合于通过滴注给药的形式并且使用,例如,滴眼剂、乳膏、软膏、凝胶剂或洗剂。
根据本发明的药物组合物的给药途径包括但不限于口服、静脉内、肌内、动脉内、髓内、鞘内、心内、经皮、皮下、腹腔内、鼻内、胃肠道、局部、舌下、滴注或直肠途径。如本文所用,术语“肠胃外”包括皮下、皮内、静脉内、肌内、关节内、滑膜内、胸骨内、鞘内、病灶内和颅内注射或输注技术。本发明的药物组合物也可以以用于直肠给药的栓剂形式给药。本发明的药物组合物可以以任何口服可接受的剂型口服给药,包括但不限于胶囊、片剂和水性混悬剂和溶液。在用于口服用途的片剂的情况下,常用的载体包括乳糖和玉米淀粉。通常还加入润滑剂,诸如硬脂酸镁。对于胶囊形式的口服给药,有用的稀释剂包括乳糖和干玉米淀粉。当口服给药水性混悬剂时,活性成分与乳化剂和助悬剂组合。如果需要,可以加入甜味剂、调味剂和/或着色剂。
本发明的药物组合物可以根据多种因素而变化,这些因素包括使用的特定化合物的活性、年龄、体重、一般健康状况、性别、饮食、给药时间、给药途径、排泄速率、药物组合以及待预防或治疗的特定疾病的严重程度。
在本发明中,药物组合物可以与选自由以下组成的组中的一种或多种剂一起配制或组合使用:钙通道阻滞剂、抗氧化剂、谷氨酸拮抗剂、抗凝剂、抗高血压剂、抗血栓形成剂、抗组胺剂、抗炎镇痛剂、抗癌剂和抗生素。
在另一方面,本发明涉及一种用于预防或改善肥胖或肥胖相关肝病的健康功能性食品,该健康功能性食品包括由下式1表示的马鞭草烯酮衍生物或其药学上可接受的盐作为活性成分。
本发明的功能性食品可用于各种应用,包括用于预防炎症的药物、食品或饮料。本发明的功能性食品的实例包括各种食品、糖果、巧克力、饮料、口香糖、茶、复合维生素、健康补充食品等,并且功能性食品可以以散剂、颗粒剂、片剂、胶囊或饮料的形式使用。
可以根据各自的常规方法将包含根据本发明的化合物的组合物配制成口服制剂诸如散剂、颗粒剂、胶囊、片剂和水性混悬剂、外用制剂、栓剂和无菌可注射溶液的形式,并使用。组合物中可以包含的载体、赋形剂和稀释剂包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、硬脂酸镁和矿物油。使用稀释剂或赋形剂来配制组合物,诸如填料、填充剂、粘结剂、湿润剂、崩解剂、表面活性剂等,这些都是常用的。用于口服给药的固体制剂包括片剂、丸剂、散剂、颗粒剂、胶囊等。这样的固体制剂通过将化合物与至少一种赋形剂诸如棉、淀粉、碳酸钙、蔗糖、乳糖、明胶混合来制备。除了简单的赋形剂之外,也可以使用润滑剂诸如硬脂酸镁、滑石等。用于口服给药的液体制剂包括混悬剂、口服溶液、乳剂、糖浆等,其可以包括常用的简单稀释剂,例如,水和液体石蜡,以及各种赋形剂,例如,湿润剂、甜味剂、调味剂、防腐剂等。用于肠胃外给药的制剂包括无菌水性溶液、非水性溶剂、混悬剂、乳剂、冻干制剂、栓剂等。作为非水性溶剂和助悬剂,可以用丙二醇、聚乙二醇、植物油诸如橄榄油、可注射的酯诸如油酸乙酯等。作为栓剂的基质,可以使用Witepsol、Macrogol、Tween 61、可可脂、月桂脂、甘油明胶等。
尽管本发明的化合物的优选剂量根据患者的病症和体重、疾病的严重程度、药物的类型以及给药的途径和持续时间而变化,但它可以由本领域技术人员适当进行选择。然而,为了达到期望的效果,化合物可以以0.01mg/kg至10g/kg、优选1mg/kg至1g/kg的每日剂量给药。化合物可以一天一次或多次给药。因此,剂量不旨在以任何方式限制本发明的范围。
在另一方面,本发明涉及一种用于治疗或预防肥胖或肥胖相关肝病的方法,该方法包括向受试者给药用于治疗或预防肥胖或肥胖相关肝病的药物组合物的步骤,该药物组合物包含作为活性成分的由式1表示的马鞭草烯酮或其药学上可接受的盐。(USA)
在另一方面,本发明涉及药物组合物用于治疗或预防肥胖或肥胖相关肝病的新用途,该药物组合物包含作为活性成分的由式1表示的马鞭草烯酮或其药学上可接受的盐。(欧洲/中国)
在下文中,将参考实施例更详细地描述本发明。然而,这些实施例仅用于说明本发明,并且对于本领域技术人员来说将是显而易见的是,本发明的范围不受这些实施例的限制。
[实施例]
[实施例]
生产实施例1:生产马鞭草烯酮衍生物
商业购买试剂级(1S)-(-)-马鞭草烯酮、3,4-二羟基-5-甲氧基苯甲醛、氯甲基甲醚(MOM-Cl)、二异丙基乙胺(DIPEA)、氢氧化钾(KOH)和甲醇钠(NaOCH
使用仪器(Varian)在500MHz下测量
根据以下反应方案1生产式3f的化合物:
[反应方案1]
生产(1S,5R)-4-(3-甲氧基-4,5-双(甲氧基甲氧基)苯乙烯基)-6,6-二甲基双环
将400mg的3,4-二羟基-5-甲氧基苯甲醛加入到4mL的二氯甲烷中,以及然后向其中加入920mg的二异丙基乙胺,随后冷却。向其中加入570mg的甲基氯甲醚并在室温下搅拌。向其中加入少量水并分离成层后,将有机层脱水并减压浓缩。
为了通过醇醛缩合从(1S)-(-)-马鞭草烯酮获得二烯,将380mg的(1S)-(-)-马鞭草烯酮1和620mg的3-甲氧基-4,5-双(甲氧基甲氧基)苯甲醛加入到6.2mL的MeOH中,并向其中加入270mg的KOH,随后在60℃下搅拌并冷却至室温。向其中加入少量水后,将有机层分离,脱水,并且减压浓缩得到黄色产物,然后通过硅胶柱色谱法纯化该产物,以获得(1S,5R)-4-(3-甲氧基-4,5-双(甲氧基甲氧基)苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮(2f)(90%产率)。
1
d6.94(d,J=1.96Hz,1H),6.84(s,2H),6.78(d,J=1.71Hz,1H),5.92(s,1H),5.22(s,2H),5.15(s,2H),3.89(s,3H),3.60(s,3H),3.52(s,3H),3.09(t,J=5.75Hz,1H),2.90(dt,J=9.48,5.53Hz,1H),2.72(td,J=5.75,1.47Hz,1H),2.10(d,J=9.29Hz,1H),1.57(s,3H),1.00(s,3H);
13
生产(1S,5R)-4-(3,4-二羟基-5-甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-
将960mg的化合物2f加入到5mL的MeOH中,并向其中滴加630mg的浓盐酸,然后搅拌。将反应溶液通过加入饱和的NaHCO
mp 168-170℃;
[a]
1
13
50,121.62,108.63,58.08,56.25,53.12,43.75,40.18,26.78,22.16;
HRMS:C
HPLC分析结果:(方法1)100%(t
前药SP-1154根据以下反应方案2生产:
[反应方案2]
(2S,2'S)-5-((E)-2-((1R,5S)-6,6-二甲基-4-氧亚基双环[3.1.1]庚-2-烯-2-
向化合物3f(SP-8356,(1S,5R)-4-(3,4-二羟基-5-甲氧基苯乙烯基)-6,6-二甲基双环[3.1.1]庚-3-烯-2-酮,600mg,2.0mmol)在二氯甲烷(5mL)的搅拌溶液中加入N-(叔丁氧基羰基)-L-缬氨酸(Boc-Val-OH(1.3g 6.0mmol))、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸(EDCI,1.15g,6.0mmol)和4-二甲基氨基吡啶(DMAP,120mg,1.0mmol),随后在室温下搅拌1小时。反应完成后,加入6mL的水,并将有机层分离并且然后用6mL的20% NaCl水性溶液洗涤。将有机层用无水硫酸钠脱水并减压浓缩。从6mL的二乙醚中重结晶得到(2S,2'S)-5-((E)-2-((1R,5S)-6,6-二甲基-4-氧亚基双环[3.1.1]庚-2-烯-2-基)乙烯基)-3-甲氧基-1,2-亚苯基双(2-((叔丁氧基羰基)氨基)-3-甲基丁酸酯)(产率为67%)。
1
13
生产(2S,2'S)-5-((E)-2-((1R,5S)-6,6-二甲基-4-氧亚基双环[3.1.1]庚-2-烯-
将9.2mL的乙腈和9.2mL的2N HCl二乙醚溶液加入到(2S,2'S)-5-((E)-2-((1R,5S)-6,6-二甲基-4-氧亚基双环[3.1.1]庚-2-烯-2-基)乙烯基)-3-甲氧基-1,2-亚苯基双(2-((叔丁氧基羰基)氨基)-3-甲基丁酸酯)(920mg,1.32mmol)中。在室温下搅拌3小时后,过滤固体,并向其中加入18.4mL的乙酸乙酯,然后搅拌24小时。将固体过滤并干燥,以获得(2S,2'S)-5-((E)-2-((1R,5S)-6,6-二甲基-4-氧亚基双环[3.1.1]庚-2-烯-2-基)乙烯基)-3-甲氧基-1,2-亚苯基双(2-氨基-3-甲基丁酸酯)二盐酸盐(89%产率)。
1
13
实施例1:马鞭草烯酮衍生物针对NAFLD的作用
1.1.SP-1154的合成:结构互补测定
如之前的研究所述[14],使用由Promega(Madison,威斯康星州(WI),USA)建立的NanoBiT技术研究了在TGF-βR1和TGF-βR2之间的分子相互作用。简而言之,将HEK293细胞以2.0×10
1.2.NAFLD的诱导
雄性C57BL/6小鼠(6周龄,体重20g)购自Orient-Bio(城南(Seongnam),韩国)。所有小鼠都保持在12-hr的光/暗循环中,并随意地喂食。为了使环境差异最小化,在实验开始前,允许小鼠适应2周。对于饮食诱导的NAFLD实验,向小鼠喂食HFD(60%千卡的脂肪,D12492,Research Diets,新泽西州(NJ),USA)或正常食物饮食(ND)20周。所有实验方案和程序均经高丽大学医学院的伦理委员会和机构动物护理和使用委员会(Ethics Committeeand the Institutional Animal Care and Use Committee of Korea UniversityCollege of Medicine)批准(批准号KOREA-2019-0026)。
1.3.药物处理
将小鼠细分为负载体组和SP-1154(50mg/kg,作为SP-8356)组。通过自来水向小鼠给药SP-1154,并且药物的剂量由每日饮水量(6mL/天)[15]和体重决定,每周测量体重。
1.4.
使用专用的小动物PET/CT扫描仪(eXplore Vista DR PET/CT,GE Healthcare,密尔沃基(Milwaukee),威斯康星州,USA)进行
图像由两位有经验的核医学医师(KP和HWK)使用商业可获得的软件(Syngo.via,Siemens Healthcare,埃朗根(Erlangen),德国)进行分析。通过
SUV=示踪物的放射性(ROI)(MBq/mL)/
注射剂量(MBq)/总体重(g)
SUV=示踪物的放射性(ROI)(MBq/mL)/
注射剂量(MBq)/总体重(g)
接下来,为了测量肝脏的豪斯费尔德(Hounsfield)单位(HU),在每个切片的肝脏上绘制ROI,并获取相应的HU值。将来自这些ROI的平均HU值用作代表性HU值。目标ROI上的VAT SUV max和肝脏HU的观察者内和观察者间相关系数值>0.9。
1.5.酶联免疫吸附测定(ELISA)
根据制造商的说明,使用商业可获得的ELISA试剂盒(ab157712,Abcam,剑桥(Cambridge),马萨诸塞州(MA),USA)确定C-反应蛋白(CRP)的血清浓度。
1.6.胰岛素耐量试验(ITT)和葡萄糖耐量试验(GTT)
对于GTT,禁食过夜后向小鼠口服给药葡萄糖(2g/kg体重),并且然后在指定时间采血以测量葡萄糖浓度。对于ITT,在禁食4小时后将胰岛素(1.5胰岛素单位/kg体重)腹腔注射到小鼠体内,并在指定时间采血以测量血糖。在每个指定时间测量从经受GTT的小鼠收集的血清中的胰岛素浓度。
1.7.血液分析
处死前立即采集血样。使用FUJIDRI-Chemiclinical Chemistry分析仪(FUJIDRI-CHEM 4000i,Fuji Film,东京,日本)测量血清中AST(谷草转氨酶)、ALT(谷丙转氨酶)、总胆固醇和甘油三酯的水平。
1.8.流式细胞术分析
将细胞悬浮在0.1mL的荧光激活细胞分选(FACS)缓冲液(磷酸盐缓冲盐水;具有5%胎牛血清的PBS;FBS)并在室温下与Fc阻断剂(BD Bioscience,圣何塞(San Jose),加利福尼亚州,USA)一起温育10min,然后根据制造商的建议与抗CD45 APC-Cy7、抗F4/80PE和抗CD11b-PerCP-Cy5.5(Biolegend,圣地亚哥(San Diego),加利福尼亚州,USA)抗体一起额外温育30min。染色后,使用FACS Canto II(BD Bioscience,圣何塞,加利福尼亚州,USA)进行流式细胞术。使用FACSDiva软件(BD Bioscience,圣何塞,加利福尼亚州,USA)收集数据,并使用FlowJo软件(FlowJo LLC,阿什兰(Ashland),俄勒冈(OR),USA)进行分析。
1.9.组织病理学
通过使用CO
1.10.免疫组织化学
将组织与抗CD68(ab125212,Abcam,剑桥,马萨诸塞州,USA)、抗葡萄糖转运体1(GLUT1)(ab652,Abcam,剑桥,马萨诸塞州,USA)和抗GLUT4(ab654,Abcam,马萨诸塞州,USA)一起温育。Alexa Fluor 594(Invitrogen,卡尔斯巴德,加利福尼亚州,USA)用作第二抗体。所有荧光图像均用Zeiss Axio Scan.Z1(Carl Zeiss,耶拿(Jena),德国)获取。
1.11.定量实时RT-PCR(qRT-PCR)
使用Trizol试剂(Invitrogen,卡尔斯巴德,加利福尼亚州,USA)从VAT样品中提取总RNA,并使用逆转录反应试剂盒(iScript cDNA合成试剂盒,Bio-Rad,赫拉克勒斯(Hercules),加利福尼亚州,USA)来进行cDNA的生成。使用SYBR Green混合物(iQTM SYBRGreen Supermix,Bio-Rad,赫拉克勒斯,加利福尼亚州,USA)和iCycler PCR热循环仪(Bio-Rad,赫拉克勒斯,加利福尼亚州,USA)来评估基因表达。靶基因mRNA模板特异性引物组由GenScript(皮斯卡塔韦(Piscataway),新泽西州(NJ),USA)设计,并用甘油醛3-磷酸脱氢酶(GAPDH)的mRNA水平归一化mRNA的水平[20]。qRT-PCR中使用的引物序列如下:GAPDH(5'-ATGTGTCCGTCGTGGATCTG-3'和5'-AAGTCGCAGGACAACCTG-3')、GLUT1(5'-AGTATTGGAGCAACTGTGC-3'和5'-GCCTTTGGTCTCAGGGACTT-3')、GLUT4(5'-GCCATCGTCATTGGCATTCT-3'和5'-GGAGAGCAGGGAGTACTGTG-3')、TGF-β1(5'-CACTCCCGTGGCTTCTAGTG-3'和5'-GGACTGGCGAGCCTTAGTTT-3')、TGF-βR1(5'-TTGCACTTG)'和5'-AGCTGCCAGCTCCACAGGAC-3')以及TGF-βR2(5'-CACAGTGTGTGGCAGAGC-3'和5'-GTTCAGCGAGCCATCTTCTG-3')。
1.12.蛋白质印迹分析
在具有蛋白酶抑制剂(GeneDepot,Barker,德克萨斯州(TX),USA)的RIPA缓冲液(Thermo Fisher Scientific,沃尔瑟姆(Waltham),马萨诸塞州,USA)中裂解VAT。使用BCA蛋白质测定试剂盒(Thermo Fisher Scientific,沃尔瑟姆,马萨诸塞州,USA)对蛋白质浓度进行定量。接下来,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳凝胶分离蛋白质并将其转移到聚偏二氟乙烯膜(PVDF,Merck Millipore,比勒利卡(Billerica),马萨诸塞州,USA)。将膜与Smad2/3(sc-133098,Santa Cruz Biotechnology,圣克鲁兹(Santa Cruz),加利福尼亚州,USA)、磷酸-Smad2(3108S,Cell Signaling Technology,丹佛斯(Danvers),马萨诸塞州,USA)和磷酸-Smad3(9520S,Cell Signaling Technology,丹佛斯,马萨诸塞州,USA)一起温育。使用ECL测定试剂盒(GE Healthcare,芝加哥(Chicago),伊利诺伊州(IL),USA)检测蛋白质带。
1.13.统计学分析
所有数据均表示为平均值±标准偏差。进行夏皮罗-威尔克(Shapiro-Wilk)检验以确定正态分布。使用单向方差分析(ANOVA),随后Tukey事后检验用于参数分析,并且使用克鲁斯卡尔-沃利斯检验和Conover事后检验用于非参数分析。使用MedCalc版本18.5(MedCalc,Mariakerke,比利时)和SPSS版本17.0(SPSS Inc.,芝加哥,伊利诺伊州,USA)分析数据。p-值<0.05被认为具有统计学显著性。
SP-1154对TGF-β/Smad3信号传导通路的抑制作用
为了确定SP-1154对TGF-βR1与TGF-βR2相互作用的作用,本发明人使用NanoBiT技术进行了结构互补测定,其中载体(vectors)包含与纳米荧光素酶片段缀合的两种受体的基因。纳米荧光素酶的大片段(LgBiT)和小片段(SmBit)的复合物生成明亮的发光信号,从而可以研究蛋白质-蛋白质相互作用[14]。如图1B和1C所示,TGF-β1增加了TGF-βR1和TGF-βR2的复合物的荧光素酶活性,并且用SP-1154处理以剂量依赖性方式显著降低了TGF-β1刺激的活性。接下来,本发明人检查了SP-1154对HFD诱导的小鼠的VAT中的TGF-β的下游效应物Smad2/3的磷酸化的作用。值得注意的是,HFD组中Smad2/3的磷酸化上调,而通过SP-1154处理抑制了该磷酸化(图1D和1E)。关于VAT中的TGF-β1、TGF-βR1和TGF-βR2的mRNA表达水平,HFD组和具有SP-1154的HFD组之间没有显著差异(图1F至1H)。因此,SP-1154抑制TGF-βR1与TGF-βR2的相互作用,从而抑制Smad2/3的磷酸化。
SP-1154对HFD诱导的体重增加的抑制作用
如从图2A中可以看出,SP-1154显著减弱了HFD诱导的体重增加。此外,HFD组和具有SP-1154的HFD组在食物消耗方面没有显著差异(图2B和2C)。因此,SP-1154抑制HFD诱导的体重增加,但不影响食欲。
SP-1154对VAT炎症及其相关全身炎症的减轻作用
本发明人首先通过使用
接下来,为了证实来自体内PET/CT的结果,本发明人对收获的VAT进行了IHC和流式细胞术分析。如图4A所示,巨噬细胞标志物CD68的表达在HFD小鼠中被上调,并由SP-1154处理抑制。此外,流式细胞术分析显示,与正常小鼠相比来自HFD小鼠的VAT示出增加的巨噬细胞浸润,并且SP-1154处理显著防止了巨噬细胞浸润到VAT中(图4B至4E)。这些结果表明SP-1154抑制了肥胖诱导的VAT炎症及其相关的全身炎症。
SP-1154对胰岛素抵抗和葡萄糖稳态的改进作用
由于VAT炎症有助于胰岛素抵抗的发展[1,4,6],本发明人进一步评估了SP-1154对胰岛素抵抗的治疗效果。本发明人首先评估了胰岛素依赖性GLUT4和胰岛素非依赖性GLUT1的表达,该GLUT4和GLUT1是VAT中的胰岛素抵抗的标志。在VAT中的胰岛素抵抗期间,增大的脂肪细胞示出胰岛素依赖性GLUT4表达降低,而炎症细胞诸如巨噬细胞示出胰岛素非依赖性GLUT1表达增加[21,22]。与先前的研究一致,发现20周的HFD增加了脂肪细胞的大小,以及增加了GLUT1表达且降低了GLUT4表达。值得注意的是,SP-1154诱导了脂肪细胞大小的显著减小,以及GLUT1表达的降低,以及GLUT4表达的增加(图5A、5E、5F和5G)。此外,一致地,SP-1154显著改进了HFD诱导的小鼠中的胰岛素抵抗和葡萄糖稳态(图5B和5C)。这些结果表明SP-1154改进了肥胖诱导的胰岛素抵抗和葡萄糖稳态。
SP-1154对HFD诱导的肝脂肪变性的减轻作用
为了研究SP-1154对HFD诱导的肝脂肪变性的作用,本发明人首先进行CT扫描以测量肝脏密度。肝脏密度(以HU计测量)是脂肪浸润的替代标志物,HU越低反映脂肪浸润越多[23]。在本发明中,发现HFD组的肝脏密度降低,而SP-1154组的肝脏密度显著提高(图6A和B)。类似地,HFD组的肝脏重量和肝脂肪变性分数两者均增加,而通过SP-1154处理显著降低(图6A、6C和6D)。SP-1154还改进了AST和ALT的水平,这两者在HFD诱导的小鼠中均升高(图6E和6F)。就血清总胆固醇而言,HFD组和具有SP-1154的HFD组之间没有显著差异(图6G)。总之,这些结果表明SP-1154抑制在HFD诱导的小鼠中的肥胖相关NAFLD。
内脏型肥胖已经被认为是一种低度慢性的全身炎症,其有助于NAFLD的发展[1,4-6]。发现减少肥胖相关的VAT炎症从而防止NAFLD进展的方法可具有重大临床影响。在这个意义上,本发明人清楚地确定了SP-1154,一种新的合成药物,有效地抑制了VAT炎症,从而减轻了肥胖相关的NAFLD。
使用HFD诱导的小鼠模型来评估SP-1154的治疗功效。众所周知,用HFD喂食小鼠诱导肥胖、胰岛素抵抗和肝脏脂肪变性,从而近似模仿人类代谢不健康的肥胖表型[24,25],这也与本发明的实施例的结果一致。因此,本发明还强调了SP-1154用于将数据外推至临床领域的潜在适用性。
巨噬细胞在肥胖相关的VAT炎症的发展中起着关键作用[7]。在正常的VAT中,巨噬细胞约占整个细胞群的少于15%[26]。然而,在肥胖中,巨噬细胞浸润到VAT中,并在促炎症细胞因子分泌增加的VAT中占细胞群的最高达50%[26]。发现SP-1154显著抑制HFD诱导的巨噬细胞向VAT的浸润及其相关的全身炎症两者。此外,这是第一项使用
有趣的是,VAT中浸润的巨噬细胞还通过下调脂肪细胞膜中的GLUT4来阻断脂肪细胞中的胰岛素作用,从而有助于胰岛素抵抗的发展[27,28],这与本发明的实施例的结果一致。本发明人表征了一种新型药物SP-1154,其有效改进胰岛素抵抗并恢复发炎的VAT中的GLUT4表达。因此,共同发现支持SP-1154的有益代谢作用可归因于其对VAT炎症的治疗作用,主要是对巨噬细胞的治疗作用。
目前,大多数针对NAFLD的新药开发的努力都集中在NAFLD的晚期,诸如非酒精性脂肪性肝炎和2-3期肝纤维化或肝硬化[29]。然而,早期NAFLD的治疗策略在临床上也有益于NAFLD患者[30]。早期NAFLD患者潜在地更容易发生可逆肝损伤,而他们患末期肝病的机会更高,心脏代谢风险更大[30,31]。因此,SP-1154可以通过减轻肝脏脂肪变性和防止NAFLD的进展而成为早期NAFLD的有前景的治疗药物。
本发明的实施例的结果示出SP-1154抑制TGF-βR1和TGF-βR2的复合物的形成,从而抑制Smad3磷酸化。由于TGF-β1与TGF-βR1和TGF-βR2的复合物之间的相互作用是TGF-β/Smad3信号传导通路中的关键起始因素[10],靶向TGF-β的单克隆中和抗体在临床前研究中示出对TGF-β/Smad3信号传导的抑制作用[12,32]。此外,与单克隆抗体类似,靶向TGF-β受体的Fc-融合蛋白也在细胞和动物模型两者中抑制TGF-β/Smad3信号传导[33]。然而,这些基于蛋白质工程的方法具有若干限制,这继续阻碍它们的临床应用,诸如不利的药代动力学、不明确的作用方式、高生产成本、不正确的蛋白质构象和低蛋白质产率[34,35]。相比之下,SP-1154像其他小分子药物一样,易于制造,便宜,并提供口服生物利用度的巨大优势。
与SP-1154类似,源自人β蛋白聚糖的合成肽P144,也已知抑制TGF-βR1和TGF-βR2的复合物的形成,从而在临床前研究中表现出抗纤维化和抗肿瘤作用[36,37]。然而,由于其毒性,P144仅被批准在患有皮肤纤维化的系统性硬化病患者的临床试验中局部使用(NCT00574613和NCT 00781053)[38]。据本发明人所知,SP-1154是第一种被开发通过防止TGF-βR1和TGF-βR2的复合物形成来治疗肥胖相关的代谢性疾病的新合成药物。然而,需要进一步的研究来充分阐明SP-1154对TGF-βR1和TGF-βR2之间的相互作用的详细潜在作用机制,包括实际的结合位点。
总之,本发明人提供了SP-1154在HFD喂养小鼠中显著降低肥胖诱导的VAT炎症并减轻随后的肝脂肪变性的证据。SP-1154通过减少巨噬细胞向VAT的募集来改进VAT炎症。SP-1154在VAT中的抗炎作用似乎是通过抑制TGF-β/Smad3信号传导通路介导的。总之,这些发现表明SP-1154可以是用于治疗肥胖及其相关NAFLD的一种有前景的药物。
工业实用性
根据本发明的式1的化合物能够显著减少HFD喂养的小鼠中的肥胖诱导的VAT炎症并减轻随后的肝脏脂肪变性,并且能够通过减少巨噬细胞向VAT的募集来缓解VAT炎症。
在本发明中,VAT中的抗炎作用似乎是通过抑制TGF-β/Smad3信号传导通路介导的,并且该作用表明根据本发明的式1的化合物可以是用于治疗肥胖或肥胖相关肝病诸如NAFLD的有前景的药物。
尽管已经参照特定特征详细描述了本发明,但是对于本领域技术人员来说将是显而易见的是该描述仅仅是其优选实施方式,并不限制本发明的范围。因此,本发明的实质范围将由所附权利要求及其等同物来限定。
