促进或激活F7基因表达的试剂在制备治疗和预防NAFLD的药物中的应用
文献发布时间:2024-04-29 00:47:01
技术领域
本发明涉及生物医药技术领域,具体涉及促进或激活F7基因表达的试剂在制备治疗和预防NAFLD的药物中的应用。
背景技术
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的全球患病率超过25%,已成为首要的慢性肝病,但仍未有药物获批于该病的治疗。NAFLD是以肝细胞脂肪过度贮积和脂肪变性为主要特征的临床综合征,包括非酒精性脂肪肝(nonalcoholicfatty liver,NAFL)及其演变的非酒精性脂肪肝炎(non-alcoholic steatohepatitis,NASH)、肝纤维化、肝硬化和肝细胞癌。预计到2030年,中国将有3.146亿NAFLD患者,而NAFLD相关肝硬化病例数将增长112.8%,NAFLD相关肝癌将增加86%。NAFLD除了增加肝病并发症和肝病死亡风险外,还显著增加心血管疾病的发病风险。NAFLD患者中有冠心病者占比40.9%,高血压患者占比47.1%,颈动脉硬化者为55.5%。因此,急需开发针对NAFLD的有效防治策略。
多名学者已确认凝血因子与代谢性疾病的发生和发展密切相关。凝血因子前激肽释放酶(prekallikrein,PK)通过与低密度脂蛋白受体(low-density lipoproteinreceptor,LDLR)结合并诱导其溶酶体依赖性降解,抑制PK可以提高肝脏中LDLR蛋白水平,降低血液中低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平,减缓动脉粥样硬化进展。该成果为治疗和预防代谢性疾病提供了新的靶点。此外,凝血酶(thrombin)通过Par1介导的G12-Pyk2-Gab1-PKCθ依赖性ATF2激活诱导CD36表达和泡沫细胞形成,参与饮食诱导的动脉粥样硬化。同时,多名学者关注并确认了凝血因子VII(F7)基因与代谢性疾病密切相关。但目前未有F7基于在NAFLD发生发展中的作用的相关报道。
从人体应用角度看,腺病毒作为基因治疗载体虽然具有较高的基因转导效率、病毒基因组DNA不整合入宿主细胞染色体中、对不同靶组织具有广泛的亲和性和可以被大规模工业化生产等优势。但是,由于人群中广泛存在的抗腺病毒免疫机制,对病毒衣壳蛋白强大的固有免疫反应,以及新合成的病毒和转基因产物引起的获得性免疫反应,限制了腺病毒作为基因治疗的应用。现如今,重组AAV(rAAV)已经成为体内基因治疗递送的主要平台。第一种rAAV基因治疗产品是uniQure公司的alipogene tiparvovec(Glybera),于2012年被欧洲药品管理局(EMA)批准用于治疗脂蛋白脂肪酶缺乏症;2018年,FDA批准了voretigeneneparvovec-rzyl(Luxturna),这是第一个获得美国许可的rAAV基因疗法。因此重组腺相关病毒作为基因治疗的载体得到对其有效性和安全性的长期验证。几乎所有天然AAV衣壳都可以在全身给药后有效地转导肝脏,所以rAAV很适合应用于靶向肝脏疾病的治疗。
发明内容
为了克服现有技术中的缺陷,本发明提供了促进或激活F7基因表达的试剂在制备治疗和/或预防NAFLD的药物中的应用。
为实现上述目的,本发明采用如下技术方案:
本发明的第一方面是提供促进或激活F7基因表达的试剂在制备治疗和/或预防NAFLD的药物中的应用。
进一步地,上述F7基因为非分泌型F7基因。
进一步地,上述促进或激活F7基因表达的试剂为含有非分泌型F7编码基因的腺相关病毒载体、慢病毒载体、腺病毒载体或重组表达质粒。
本发明的第二方面是提供一种非分泌型F7基因的重组腺相关病毒载体的构建方法,将含有突变型F7基因的转基因载体质粒、pHelper质粒和pAAVRC质粒共同转染受体细胞,培养若干代后,裂解细胞纯化获得重组AAV8-F7mut病毒。
进一步地,上述含有F7基因的转基因载体质粒是以pAAV-TBG-MCS-3FLAG-WPRE载体系统作为载体,以分泌肽缺失的F7基因作为目的基因转化而成。
进一步地,上述目的基因的序列为SEQ ID No.4。
进一步地,上述含有F7基因的转基因载体质粒的构建方法如下:
将pAAV-TBG-MCS-3FLAG-WPRE载体系统用限制性内切酶BamHI和Nhel进行酶切,得到酶切产物后琼脂糖凝胶电泳胶回收酶切产物,得到线性化表达载体;
将上述目的基因与上述线性化表达载体按照一定的摩尔比加到离心管中进行连接反应,得到重组质粒;
将上述重组质粒转入感受态细胞中,然后涂布在氨苄霉素抗性固体培养基平板,培养得到第一菌落;
利用鉴定后的阳性第一菌落提取转基因载体质粒。
进一步地,上述目的基因与线性化表达载体的摩尔比为1~3:1,优选为2:1。
进一步地,鉴定阳性第一菌落所采用的引物序列为SEQ ID No.5和SEQ ID No.6。
本发明的第三方面是提供上述构建方法构建的非分泌型F7基因的重组腺相关病毒载体。
本发明的第四方面是提供一种治疗和/或预防NAFLD的生物制剂,其包括上述重组腺相关病毒载体。
本发明的第五方面是提供上述非分泌型F7基因的重组腺相关病毒载体在制备治疗和/或预防NAFLD药物中的应用。
本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
本发明通过腺病毒载体实现内源性过表达非分泌型F7基因,可有效减轻肝脏脂肪贮积程度、炎症水平及纤维化程度,为有效预防和治疗NAFLD提供了新的策略。
附图说明
图1是本发明一实施例中pAAV-TBG-MCS-3FLAG-WPRE载体系统以及以该载体系统转入非分泌型F7基因后的转基因载体质粒的质粒图谱;其中,图a为pAAV-TBG-MCS-3FLAG-WPRE载体系统,图b为AAV-F7 mut转基因载体质粒;
图2显示了本发明一实施例中阳性克隆的测序结果;
图3显示了本发明一实施例中AAV8-F7 mut转基因载体质粒能增加肝原代细胞中F7基因的转录(图a)和蛋白的表达(图b);
图4显示了本发明一实施例中重组AAV8-F7 mut病毒在小鼠中能够靶向感染肝脏并增加肝脏组织F7基因的转录(图a)和蛋白的表达(图b);
图5显示了本发明一实施例中重组AAV8-F7 mut病毒和对照病毒感染的小鼠的每日摄食量(图a)和体重(图b);
图6显示了本发明一实施例中感染重组AAV8-F7 mut病毒或AAV8-ctrl病毒的小鼠的凝血四项、出血时间和凝血时间的检测结果;其中图a-图f分别为血浆凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB),以及出血时间(Bleeding Time)和凝血时间(Clotting Time)的评估结果;
图7显示了本发明一实施例中感染重组AAV8-F7 mut病毒或AAV8-ctrl病毒的小鼠的肝脏组织图片;
图8显示了本发明一实施例中重组AAV8-F7 mut或AAV8-ctrl病毒感染的小鼠肝脏/体重比值;
图9显示了本发明一实施例中通过H&E染色法(图a)和油红染色法(图b)观察重组AAV8-F7 mut或AAV8-ctrl病毒感染的小鼠肝脏组织切片的结果;
图10显示了本发明一实施例中分别通过F4/80免疫组织化学染色法和天狼新红染色法观察重组AAV8-F7 mut或AAV8-ctrl病毒感染的小鼠肝脏组织中炎症细胞的浸润情况(图a)和胶原纤维沉积情况(图b);
图11显示了本发明一实施例中重组AAV8-F7 mut或AAV8-ctrl病毒感染的小鼠的肝功能指标ALT水平(图a)和AST水平(图b);
图12显示了本发明一实施例中重组AAV8-F7 mut或AAV8-ctrl病毒感染的小鼠肝脏组织中甘油三酯水平(图a)和总胆固醇含量(图b);
图13显示了本发明一实施例中重组AAV8-F7 mut或AAV8-ctrl病毒感染的小鼠肝脏组织促炎相关基因(图a)和促纤维化相关基因(图b)的转录水平。
具体实施方式
下面通过具体实施例和附图对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
实施例中方法如无特殊说明的采用常规方法,使用的试剂如无特殊说明的使用常规市售试剂或按常规方法配制的试剂。
实施例1
本实施例提供了一种转基因载体质粒,该转基因载体质粒以pAAV-TBG-MCS-3FLAG-WPRE载体系统作为载体,以非分泌型F7基因作为目的基因转化而成。其中,pAAV-TBG-MCS-3FLAG-WPRE载体系统为市售的质粒(图1a),该载体质粒具有氨苄霉素抗性,以TBG启动子。该转基因载体质粒的构建方法如下:
1.线性化表达载体的构建
以pAAV-TBG-MCS-3FLAG-WPRE载体系统为模板,用限制性内切酶BamHI(BioLabs,Cat#R3136S)和Nhel(BioLabs,Cat#R3131S)对载体质粒进行酶切,酶切反应体系为:载体质粒2μg,10×反应缓冲液5μl(BioLabs,Cat#B7204S),限制性内切酶各1μl,用双蒸水补足50μl,于37℃水浴锅中孵育2h以上。酶切产物进行琼脂糖凝胶电泳检测酶切效果,并将目的载体条带从琼脂糖凝胶电泳后的胶中切割下来,用TaKaRa MiniBESTAgarose Gel DNAExtraction KitVer.3.0做胶回收,得到线性化表达载体。
2.F7基因的获取
由于F7基因序列带有编码分泌肽的核苷酸序列,过表达F7可能会影响机体的凝血系统。为保留F7对NAFLD的治疗效果,减少其对凝血途径的影响,考虑到今后开展临床应用,选择使用F7基因并去除编码分泌肽的核苷酸序列。本实施例选F7基因转录本NM_010172.5的第一核苷酸序列作为目的基因片段,第一核苷酸序列如SEQ ID No.1所示。
SEQ ID No.1(5’→3’):
ATGGTTCCACAGGCGCATGGGCTGCTGCTTCTCTGCTTTCTGCTCCAGCTCCAGGGACCTCTAGGGACTGCAGTTTTCATAACCCAGGAGGAAGCACATGGTGTCCTACACAGGCAAAGGCGTGCCAACTCACTCCTGGAGGAGCTTTGGCCCGGCTCTCTGGAGAGAGAGTGCAATGAGGAACAGTGCTCCTTTGAGGAGGCCCGGGAGATCTTCAAGAGCCCTGAGAGGACCAAGCAGTTCTGGATTGTTTACAGTGATGGGGACCAGTGTGCCTCGAATCCATGTCAGAACGGAGGTACCTGCCAGGATCATCTCAAGTCTTACGTCTGCTTCTGCCTCCTAGACTTTGAGGGTCGGAACTGTGAGAAAAGCAAGAATGAGCAGCTGATCTGTGCAAATGAAAATGGTGACTGTGACCAGTACTGCAGGGACCATGTAGGGACCAAGCGTACCTGTAGCTGTCATGAGGACTACACGCTACAGCCAGATGAGGTGTCCTGCAAACCAAAAGTTGAGTACCCGTGTGGGAGAATACCTGTTGTAGAAAAAAGAAACTCCAGCAGCCGCCAAGGCCGCATTGTGGGAGGCAACGTGTGCCCCAAAGGGGAGTGTCCATGGCAGGCTGTGCTGAAAATCAATGGGTTATTGCTGTGTGGGGCCGTCCTGCTGGACGCCAGATGGATAGTGACCGCAGCCCACTGCTTCGATAATATCCGCTACTGGGGAAACATCACAGTGGTGATGGGTGAACATGACTTCAGTGAGAAGGATGGGGATGAGCAAGTACGACGGGTGACACAGGTCATCATGCCCGACAAGTACATCCGCGGCAAGATCAACCACGACATTGCCCTGCTCCGCCTTCACCGGCCTGTGACCTTCACTGACTACGTGGTGCCCCTGTGTCTGCCTGAAAAGTCCTTCTCCGAGAACACCCTAGCCAGAATCCGCTTCTCAAGGGTCAGTGGCTGGGGCCAGCTACTGGACCGTGGTGCCACAGCCCTGGAACTCATGTCCATCGAGGTGCCCCGGCTGATGACCCAGGACTGTCTGGAGCACGCCAAGCACAGCTCTAACACCCCCAAAATCACAGAGAACATGTTCTGCGCTGGCTACATGGATGGTACCAAGGACGCCTGCAAGGGTGACAGCGGTGGCCCACATGCCACGCACTACCATGGCACATGGTATCTGACAGGTGTGGTCAGCTGGGGGGAGGGCTGTGCAGCTATTGGTCACATTGGGGTGTACACCAGGGTCTCCCAGTACATAGACTGGCTGGTCAGACACATGGACTCCAAGCTCCAGGTTGGGGTTTTCCGACTCCCACTACTGTAG
在第一核苷酸序列的N端去除编码分泌肽的核苷酸序列,并在C端携带3×Flag标签序列以便于检测表达,最终获得目的基因的核苷酸序列如SEQ ID No.2所示。本实施例所需的目的基因直接通过高通量DNA合成仪进行人工合成。SEQ ID No.2(5’→3’):
ATGGTTTTCATAACCCAGGAGGAAGCACATGGTGTCCTACACAGGCAAAGGCGTGCCAACTCACTCCTGGAGGAGCTTTGGCCCGGCTCTCTGGAGAGAGAGTGCAATGAGGAACAGTGCTCCTTTGAGGAGGCCCGGGAGATCTTCAAGAGCCCTGAGAGGACCAAGCAGTTCTGGATTGTTTACAGTGATGGGGACCAGTGTGCCTCGAATCCATGTCAGAACGGAGGTACCTGCCAGGATCATCTCAAGTCTTACGTCTGCTTCTGCCTCCTAGACTTTGAGGGTCGGAACTGTGAGAAAAGCAAGAATGAGCAGCTGATCTGTGCAAATGAAAATGGTGACTGTGACCAGTACTGCAGGGACCATGTAGGGACCAAGCGTACCTGTAGCTGTCATGAGGACTACACGCTACAGCCAGATGAGGTGTCCTGCAAACCAAAAGTTGAGTACCCGTGTGGGAGAATACCTGTTGTAGAAAAAAGAAACTCCAGCAGCCGCCAAGGCCGCATTGTGGGAGGCAACGTGTGCCCCAAAGGGGAGTGTCCATGGCAGGCTGTGCTGAAAATCAATGGGTTATTGCTGTGTGGGGCCGTCCTGCTGGACGCCAGATGGATAGTGACCGCAGCCCACTGCTTCGATAATATCCGCTACTGGGGAAACATCACAGTGGTGATGGGTGAACATGACTTCAGTGAGAAGGATGGGGATGAGCAAGTACGACGGGTGACACAGGTCATCATGCCCGACAAGTACATCCGCGGCAAGATCAACCACGACATTGCCCTGCTCCGCCTTCACCGGCCTGTGACCTTCACTGACTACGTGGTGCCCCTGTGTCTGCCTGAAAAGTCCTTCTCCGAGAACACCCTAGCCAGAATCCGCTTCTCAAGGGTCAGTGGCTGGGGCCAGCTACTGGACCGTGGTGCCACAGCCCTGGAACTCATGTCCATCGAGGTGCCCCGGCTGATGACCCAGGACTGTCTGGAGCACGCCAAGCACAGCTCTAACACCCCCAAAATCACAGAGAACATGTTCTGCGCTGGCTACATGGATGGTACCAAGGACGCCTGCAAGGGTGACAGCGGTGGCCCACATGCCACGCACTACCATGGCACATGGTATCTGACAGGTGTGGTCAGCTGGGGGGAGGGCTGTGCAGCTATTGGTCACATTGGGGTGTACACCAGGGTCTCCCAGTACATAGACTGGCTGGTCAGACACATGGACTCCAAGCTCCAGGTTGGGGTTTTCCGACTCCCACTACTGGGATCCGGCGGATCTGGCGACTACAAGGATGACGATGACAAGGATTACAAAGACGACGATGATAAGGACTATAAGGATGATGACGACAAATAA
后续临床应用选用人F7基因转录本NM_019616.4的第一核苷酸序列作为目的基因片段,第一核苷酸序列如SEQ ID No.3所示。SEQ ID No.3(5’→3’):
ATGGTCTCCCAGGCCCTCAGGCTCCTCTGCCTTCTGCTTGGGCTTCAGGGCTGCCTGGCTGCAGTCTTCGTAACCCAGGAGGAAGCCCACGGCGTCCTGCACCGGCGCCGGCGCGCCAACGCGTTCCTGGAGGAGCTGCGGCCGGGCTCCCTGGAGAGGGAGTGCAAGGAGGAGCAGTGCTCCTTCGAGGAGGCCCGGGAGATCTTCAAGGACGCGGAGAGGACGAAGCTGTTCTGGATTTCTTACAGTGATGGGGACCAGTGTGCCTCAAGTCCATGCCAGAATGGGGGCTCCTGCAAGGACCAGCTCCAGTCCTATATCTGCTTCTGCCTCCCTGCCTTCGAGGGCCGGAACTGTGAGACGCACAAGGATGACCAGCTGATCTGTGTGAACGAGAACGGCGGCTGTGAGCAGTACTGCAGTGACCACACGGGCACCAAGCGCTCCTGTCGGTGCCACGAGGGGTACTCTCTGCTGGCAGACGGGGTGTCCTGCACACCCACAGTTGAATATCCATGTGGAAAAATACCTATTCTAGAAAAAAGAAATGCCAGCAAACCCCAAGGCCGAATTGTGGGGGGCAAGGTGTGCCCCAAAGGGGAGTGTCCATGGCAGGTCCTGTTGTTGGTGAATGGAGCTCAGTTGTGTGGGGGGACCCTGATCAACACCATCTGGGTGGTCTCCGCGGCCCACTGTTTCGACAAAATCAAGAACTGGAGGAACCTGATCGCGGTGCTGGGCGAGCACGACCTCAGCGAGCACGACGGGGATGAGCAGAGCCGGCGGGTGGCGCAGGTCATCATCCCCAGCACGTACGTCCCGGGCACCACCAACCACGACATCGCGCTGCTCCGCCTGCACCAGCCCGTGGTCCTCACTGACCATGTGGTGCCCCTCTGCCTGCCCGAACGGACGTTCTCTGAGAGGACGCTGGCCTTCGTGCGCTTCTCATTGGTCAGCGGCTGGGGCCAGCTGCTGGACCGTGGCGCCACGGCCCTGGAGCTCATGGTCCTCAACGTGCCCCGGCTGATGACCCAGGACTGCCTGCAGCAGTCACGGAAGGTGGGAGACTCCCCAAATATCACGGAGTACATGTTCTGTGCCGGCTACTCGGATGGCAGCAAGGACTCCTGCAAGGGGGACAGTGGAGGCCCACATGCCACCCACTACCGGGGCACGTGGTACCTGACGGGCATCGTCAGCTGGGGCCAGGGCTGCGCAACCGTGGGCCACTTTGGGGTGTACACCAGGGTCTCCCAGTACATCGAGTGGCTGCAAAAGCTCATGCGCTCAGAGCCACGCCCAGGAGTCCTCCTGCGAGCCCCATTTCCCTAG
在人第一核苷酸序列的N端去除编码分泌肽的核苷酸序列,最终获得治疗效果的目的基因的核苷酸序列如SEQ ID No.4所示。
SEQ ID No.4(5’→3’):
ATGGCAGTCTTCGTAACCCAGGAGGAAGCCCACGGCGTCCTGCACCGGCGCCGGCGCGCCAACGCGTTCCTGGAGGAGCTGCGGCCGGGCTCCCTGGAGAGGGAGTGCAAGGAGGAGCAGTGCTCCTTCGAGGAGGCCCGGGAGATCTTCAAGGACGCGGAGAGGACGAAGCTGTTCTGGATTTCTTACAGTGATGGGGACCAGTGTGCCTCAAGTCCATGCCAGAATGGGGGCTCCTGCAAGGACCAGCTCCAGTCCTATATCTGCTTCTGCCTCCCTGCCTTCGAGGGCCGGAACTGTGAGACGCACAAGGATGACCAGCTGATCTGTGTGAACGAGAACGGCGGCTGTGAGCAGTACTGCAGTGACCACACGGGCACCAAGCGCTCCTGTCGGTGCCACGAGGGGTACTCTCTGCTGGCAGACGGGGTGTCCTGCACACCCACAGTTGAATATCCATGTGGAAAAATACCTATTCTAGAAAAAAGAAATGCCAGCAAACCCCAAGGCCGAATTGTGGGGGGCAAGGTGTGCCCCAAAGGGGAGTGTCCATGGCAGGTCCTGTTGTTGGTGAATGGAGCTCAGTTGTGTGGGGGGACCCTGATCAACACCATCTGGGTGGTCTCCGCGGCCCACTGTTTCGACAAAATCAAGAACTGGAGGAACCTGATCGCGGTGCTGGGCGAGCACGACCTCAGCGAGCACGACGGGGATGAGCAGAGCCGGCGGGTGGCGCAGGTCATCATCCCCAGCACGTACGTCCCGGGCACCACCAACCACGACATCGCGCTGCTCCGCCTGCACCAGCCCGTGGTCCTCACTGACCATGTGGTGCCCCTCTGCCTGCCCGAACGGACGTTCTCTGAGAGGACGCTGGCCTTCGTGCGCTTCTCATTGGTCAGCGGCTGGGGCCAGCTGCTGGACCGTGGCGCCACGGCCCTGGAGCTCATGGTCCTCAACGTGCCCCGGCTGATGACCCAGGACTGCCTGCAGCAGTCACGGAAGGTGGGAGACTCCCCAAATATCACGGAGTACATGTTCTGTGCCGGCTACTCGGATGGCAGCAAGGACTCCTGCAAGGGGGACAGTGGAGGCCCACATGCCACCCACTACCGGGGCACGTGGTACCTGACGGGCATCGTCAGCTGGGGCCAGGGCTGCGCAACCGTGGGCCACTTTGGGGTGTACACCAGGGTCTCCCAGTACATCGAGTGGCTGCAAAAGCTCATGCGCTCAGAGCCACGCCCAGGAGTCCTCCTGCGAGCCCCATTTCCCTAG
3.将目的基因构建入线性化表达载体中:
将目的基因片段和线性化载体以摩尔比2:1加到离心管中,其中载体按浓度加入总计100ng的量,再加入1ul T4连接酶(BioLabs,Cat#M0202S),2ul T4ligase buffer(BioLabs,Cat#B0202S),双蒸水补足至20ul,混匀后在16℃孵育1小时,然后转移到冰上放置5分钟进行转化,得到连接产物(重组质粒)。
4.感受态细胞的制备和转化:
(1)感受态细胞的制备:
取大肠杆菌DH5α菌划线,过夜培养。用灭菌枪头挑圆形菌落于LB液体培养基中,37℃,200rpm,振荡培养12h左右,直至对数生长期。
将菌种接种在锥形瓶LB液体培养基中(1ml/100ml),37℃、200r/min,振荡培养2~3h,至OD
(2)转化
准备氨苄霉素抗性固体培养基平板,平板中的培养基为含有100μg/ml氨苄霉素的LB固体培养基;用移液枪取1μl重组产物(重组质粒)放入100μl大肠杆菌DH5α感受态细胞中,冰上30min;42℃热激90s,立即放在冰上,冰上1~2分钟;加入1ml LB液体培养基至管中,37℃,200rpm,30min-60min,活化细菌;取50μl菌液涂布在氨苄霉素抗性固体培养基平板上,待菌液干燥后倒置放于37℃培养箱中培养过夜。
5.菌落PCR鉴定阳性转化子:
挑取氨苄霉素抗性固体培养基平板上长出的转化子(第一菌落)重悬于10μlLB培养液中,取1μl作为模板进行菌落PCR鉴定。菌落PCR鉴定所使用的正向测序引物的核苷酸序列为CCGgctagcatggttttcataacccaggagg(SEQ ID No.5),反向测序引物的核苷酸序列为CGGggatcccagtagtgggagtcggaaa(SEQ ID No.6)。
反应体系为:10ul 2X PCR mix(Vazyme,Cat#P112-03-AA),0.5ul正向和反向测序引物(10uM),1ul菌落,双蒸水补足至20ul。
PCR循环条件为:94℃2min
6.阳性克隆送测序验证及表达检测:
(1)测序结果如图2所示。
(2)检测转基因载体质粒在小鼠原代肝细胞中的表达
在小鼠原代肝细胞中检测到F7基因的转录本(如图3a所示);预测非分泌型F7蛋白约为49KDa,在Marker 40-55kDa之间检测到蛋白条带(如图3b所示)。
7.转基因载体质粒的提取
将经过测序验证及表达检测验证的第一菌落进行扩大培养后,利用AxyPrep质粒DNA小量试剂盒提质粒,得到转基因载体质粒。
实施例2
本实施例提供了一种携带非分泌型F7基因的重组腺相关病毒载体,其构建方法包括如下步骤:
将实施例1得到的转基因载体质粒、pHelper质粒以及pAAVRC质粒(为能够合成衣壳蛋白上特定酪氨酸残基被定点诱导突变为苯丙氨酸的8血清型衣壳蛋白的质粒)共同转染293细胞,细胞培养若干代后,裂解细胞并通过超速离心或其他纯化方式得到所述重组AAV8-F7mut病毒。这种三质粒包装系统属于腺相关病毒合成的通用方法,在此不再详细描述。
实施例二构建的重组AAV8-F7mut病毒具有AAV2型的稳定表达和基因整合能力,同时具有8血清型的肝脏组织感染嗜亲性。
实施例3
本实施验证实施例2提供的携带非分泌型F7基因的重组腺相关病毒载体(重组AAV8-F7mut病毒)体内感染效率、安全性和有效性,具体的实验步骤和结果如下:
1.实验动物分组:
将喂食12周高脂饲料诱导肥胖(diet-induced obesity,DIO)的野生型C57BL/6小鼠随机分为:
(1)重组AAV8-F7mut载体感染组:尾静脉注射法给予重组AAV8-F7mut病毒。
(2)重组AAV8-ctrl感染组:尾静脉注射法给予重组AAV8-ctrl病毒。其中,重组AAV8-ctrl载体为无F7基因的重组AAV8载体。
2.重组AAV8-F7mut病毒表达检测
为探寻重组AAV8-F7mut病毒效果,每组小鼠各7只,根据组别尾静脉注射对应病毒,将小鼠分别放置动物房不同笼位中继续饲养。由于AAV8介导的目的基因在注射后第7天开始表达,14天后长期稳定表达,因此在注射病毒后第28天处死小鼠,取出小鼠肝脏进行实时荧光定量PCR(RT-PCR,qPCR)和蛋白免疫印迹(Western Blot,WB)检测重组AAV8-F7mut病毒过表达非分泌型F7基因的效果,发现感染AAV8-F7mut病毒组小鼠的肝脏组织的F7基因的mRNA水平和蛋白水平与对照组相比显著增加(如图4所示)。这些结果表明重组AAV8-F7mut病毒能够靶向感染肝脏并增加肝脏组织F7基因的转录和蛋白的表达。
3.重组AAV8-F7mut病毒感染的安全性检测
测定小鼠每日摄食量和体重,两组小鼠的每日摄食量和体重均基本持平,属于正常范围之内,两组组间无统计学差异(图5)。
由于F7是凝血因子,构建的F7基因载体表达的是不含分泌肽的非分泌型的F7蛋白,理论上不分泌入血,不会影响凝血系统,为进一步验证是否存在影响凝血功能的作用,采用凝血四项,包括血浆凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(TT)、纤维蛋白原(Fibrinogen,FIB),以及出血时间(bleeding time,BT)和凝血时间(clotting time,CT)评估。检测结果发现(参见图6),感染重组AAV8-F7mut病毒或AAV8-ctrl病毒的小鼠,其凝血四项、出血时间和凝血时间均基本持平,属于正常范围之内,两组组间无统计学差异。
4.重组AAV8-F7mut病毒对防治小鼠NAFLD发生的有效性实验
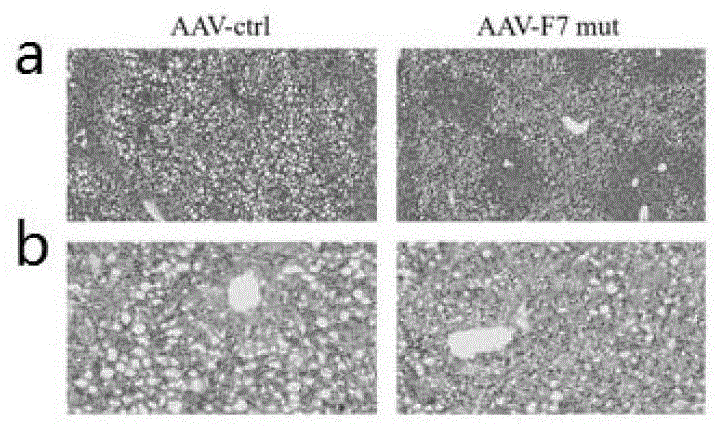
为探求重组AAV8-F7mut病毒对高脂饮食构建小鼠NAFLD模型的作用及影响,采用眼球取血法取血并制备血清,用颈椎脱臼法处死小鼠,解剖其腹部取出肝脏组织,注射AAV8-ctrl病毒转染组的小鼠肝脏组织体积增大,包膜紧张光滑,边缘变钝,浅黄色,质地柔软,有油腻感。而注射重组AAV8-F7mut组小鼠肝脏形态学改变在肉眼观察下较轻(如图7所示)。
迅速将新鲜的肝脏组织放于称量纸上,称取肝脏湿重(mg为单位),计算肝脏湿重/小鼠体重(mg/g)的比值,发现重组AAV8-F7mut载体感染的小鼠肝重/体重比值为3.648±0.09mg/g,显著低于注射AAV8-ctrl组(4.108±0.19mg/g)(如图8所示)。
将小鼠肝脏组织石蜡切片通过H&E染色法观察发现对照组小鼠肝细胞脂肪变性,并散布全肝,肝细胞肿胀,细胞质易见脂肪空泡,肝细胞有炎性改变,而在重组AAV8-F7mut病毒感染组小鼠中,小鼠肝细胞组织学改变在显微镜观察下较轻(如图9a所示)。将小鼠肝脏组织新鲜冰冻切片通过油红染色法观察脂肪的分布情况,结果显示在重组AAV8-ctrl载体感染组小鼠中,油红标记的红色脂滴明显多于重组AAV8-F7 mut感染组(如图9b所示)。
通过F4/80免疫组织化学染色法观察肝脏组织中炎症细胞浸润情况,结果显示在重组AAV8-ctrl病毒感染组小鼠中,标记的褐色F4/80蛋白显著多于重组AAV8-F7 mut感染组小鼠,重组AAV8-F7mut感染组小鼠炎症细胞浸润程度较重组AAV8-ctrl组更轻(如图10a所示)。通过天狼猩红染色(Sirius red)法观察肝脏组织中胶原纤维沉积情况,结果显示在重组AAV8-ctrl病毒感染组小鼠中,标记的红色胶原显著多于重组AAV8-F7mut感染组小鼠,重组AAV8-F7mut感染组小鼠纤维化程度较重组AAV8-ctrl组更轻(如图10b所示)。
小鼠取血清用试剂盒检测感染重组AAV8-F7mut后小鼠肝功能指标(谷丙转氨酶ALT、谷草转氨酶AST)水平。检测结果发现,感染重组AAV8-F7mut组肝功能受损程度较AAV8-ctrl组更轻(如图11所示)。
取新鲜肝脏组织,通过甘油三脂试剂盒检测肝脏组织甘油三酯水平,通过总胆固醇测试盒检测肝脏组织总胆固醇含量,发现重组AAV8-F7mut感染组小鼠肝脏组织的甘油三脂和总胆固醇含量较AAV8-ctrl组更低,显著改善NAFLD小鼠的肝脏脂质累积程度(如图12所示)。
取新鲜肝脏组织,采用qPCR检测肝脏组织促炎相关基因:interleukin 1 Beta(IL-1β)、c-cmotif chemokine ligand 2(CCL2)、interleukin 6(IL6)、cd68 molecule(CD68)和促纤维化相关基因:collagen type III alpha 1(Col3a1)、collagen type Ialpha 1(Col1a1)、cellular communication network factor 2(Ctgf)、transforminggrowth factor beta 1(Tgfβ)、fibronectin 1(Fn)的转录水平,结果显示在重组AAV8-F7mut感染组小鼠中,促炎和纤维化相关基因的转录水平的显著低于AAV8-ctrl组感染小鼠,重组AAV8-F7mut感染组小鼠纤维化程度比AAV8-ctrl组更轻(如图13所示)。
以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
