一种抗原捕获纳米颗粒及其制备方法在肿瘤免疫治疗中的应用
文献发布时间:2024-04-29 00:47:01
技术领域
本发明属于纳米颗粒捕获抗原技术领域,具体涉及一种具有抗原捕获功能以及增强免疫反应的纳米颗粒的制备方法,通过该方法制备的纳米颗粒,及其抗原捕获策略在基于放射治疗(Radiotherapy,RT)的抗肿瘤免疫治疗中的应用。
背景技术
肿瘤免疫治疗被证明是一种强有力的癌症治疗方法。在免疫治疗中,促使抗原提呈细胞(APCs)激活naïve T细胞并进一步增强细胞毒性T淋巴细胞(CTL)免疫应答的癌症疫苗受到越来越多的关注。然而,这些个性化疫苗的体外加工的复杂性和要求,以及必须为每位患者量身定制,限制了它们的大规模工业生产。原位疫苗(ISV)被认为是一种更有效的替代癌症疫苗接种策略,它不需要鉴定和分离患者特异性肿瘤相关抗原(TAA),激活肿瘤微环境从免疫抑制到免疫刺激,刺激肿瘤抗原通过APC向T细胞呈递,促进效应T细胞攻击原发性和远处转移性肿瘤。这种方法成功的避免了识别独特的个体TAA和合成定制药物策略的挑战,从而显示出临床应用的巨大潜力。
现有技术中,马来酰亚胺(Maleimide, Mal)因易与蛋白的巯基发生反应,具有较强的抗原吸附能力,在肿瘤免疫治疗中得到广泛应用。然而,由于它对大多数蛋白质高度敏感这一性质,导致可能会结合许多非抗原蛋白,从而影响抗原呈递效果。充分的抗原呈递对于刺激肿瘤特异性免疫应答至关重要。因此,促进抗原的识别和递呈,以优化对效应免疫细胞的刺激至关重要。鉴于此,为了弥补上述不足,寻找并开发一种新的特异性捕获抗原的纳米颗粒并且激活肿瘤微环境,促进抗原呈递,诱导免疫反应,抑制肿瘤生长的纳米平台策略,应用于肿瘤免疫的治疗具有重要的意义。
发明内容
为了克服上述现有技术中存在的问题,本发明公开了一种新的修饰纳米颗粒及其制备方法,通过特异性捕获放疗后肿瘤源性的次磺酸化蛋白抗原,促进抗原呈递,激活肿瘤特异性T细胞,诱导体外效应,从而促进肿瘤免疫。
本发明采用如下技术方案:
一种抗原捕获纳米颗粒,包括纳米粒及其表面修饰物;所述修饰物包括聚乙二醇-3,5-二氧环己烷羧酸复合物。
本发明公开了上述抗原捕获纳米颗粒在制备肿瘤源性蛋白抗原捕获试剂中的应用;进一步的,本发明公开了上述抗原捕获纳米颗粒在制备肿瘤源性蛋白抗原捕获及抗原呈递试剂中的应用;进一步的,本发明公开了上述抗原捕获纳米颗粒在制备免疫细胞激活试剂中的应用。其中,肿瘤源性蛋白抗原包括次磺酸化蛋白抗原;免疫细胞包括T细胞。具体的,本发明公开了上述抗原捕获纳米颗粒作为肿瘤源性蛋白抗原捕获及抗原呈递试剂在制备免疫细胞激活试剂中的应用。因此,本发明公开了上述抗原捕获纳米颗粒在制备治疗肿瘤的药物中的应用。
本发明公开了上述抗原捕获纳米颗粒在制备免疫细胞激活协同药物中的应用,所述协同药物的活性成分除了上述抗原捕获纳米颗粒,还有免疫佐剂。本发明将上述抗原捕获纳米颗粒与免疫佐剂联用,发挥了更好的免疫激活效果,因此,本发明公开了上述抗原捕获纳米颗粒在制备提高免疫佐剂免疫激活效果的药物中的应用。
本发明公开了一种抗原捕获免疫激活纳米颗粒,包括纳米粒及其表面修饰物;所述修饰物包括聚乙二醇-3,5-二氧环己烷羧酸复合物、免疫佐剂。优选的,免疫佐剂为CpG。
本发明公开了上述抗原捕获免疫激活纳米颗粒在制备免疫细胞激活试剂中的应用。进一步的,本发明公开了上述抗原捕获免疫激活纳米颗粒在制备治疗肿瘤的药物中的应用。
本发明公开了一种治疗肿瘤的联合药物,包括上述抗原捕获纳米颗粒、上述抗原捕获免疫激活纳米颗粒、抗体药物中的一种或几种;优选的,治疗肿瘤的联合药物为上述抗原捕获免疫激活纳米颗粒、抗体药物的组合。其中,抗体药物优选抗αPD -1抗体。
本发明公开了上述抗原捕获纳米颗粒或者上述抗原捕获免疫激活纳米颗粒在制备抗体药物抗肿瘤增效药物中的应用。
本发明公开了上述治疗肿瘤的联合药物在制备治疗肿瘤的药物中的应用。
本发明中,治疗肿瘤指基于放射治疗(Radiotherapy,RT)的抗肿瘤免疫治疗。
本发明中,聚乙二醇-3,5-二氧环己烷羧酸复合物为氨基聚乙二醇与3,5-二氧环己烷羧酸的反应产物。纳米粒为金纳米颗粒。
本发明公开了上述抗原捕获纳米颗粒的制备方法,包括以下步骤,在纳米粒表面依次修饰聚乙二醇与3,5-二氧环己烷羧酸,得到抗原捕获纳米颗粒。具体的,以纳米粒为载体,甲氧基聚乙二醇硫醇和氨基聚乙二醇硫醇为原料,制备PEG修饰的氨基功能化纳米颗粒;然后在PEG修饰的氨基功能化纳米颗粒的PEG末端氨基上修饰3,5-二氧环己烷羧酸,制备抗原捕获纳米颗粒,具有抗原捕获功能,能够抗原呈递,激活免疫细胞,进而攻击癌细胞。
本发明公开了上述抗原捕获免疫激活纳米颗粒的制备方法,包括以下步骤,在纳米粒表面依次修饰聚乙二醇、3,5-二氧环己烷羧酸、免疫佐剂,得到抗原捕获免疫激活纳米颗粒。具体的,以纳米粒为载体,甲氧基聚乙二醇硫醇和氨基聚乙二醇硫醇为原料,制备PEG修饰的氨基功能化纳米颗粒;然后在PEG修饰的氨基功能化纳米颗粒的PEG末端氨基上修饰3,5-二氧环己烷羧酸;然后在纳米颗粒的表面修饰免疫佐剂,制备抗原捕获免疫激活纳米颗粒,具有抗原捕获功能,能够抗原呈递,更好的激活免疫细胞,进而攻击癌细胞。
本发明中,所述甲氧基聚乙二醇硫醇为两个末端分别由甲氧基和巯基修饰的聚乙二醇,其选自M-PEG
本发明中,所述氨基聚乙二醇硫醇为两个末端分别由氨基和巯基修饰的聚乙二醇,其选自NH
本发明中,纳米粒、甲氧基聚乙二醇硫醇、氨基聚乙二醇硫醇的质量比为1∶(1~3)∶(3~5)。PEG修饰的氨基功能化纳米颗粒、3,5-二氧环己烷羧酸的质量比为1∶(2~4);进一步的,PEG修饰的氨基功能化纳米颗粒、免疫佐剂的质量比为1∶(0.1~0.15)。
由于上述技术方案的运用,本发明与现有技术相比具有如下优点:
(1)本发明中纳米颗粒利用放疗触发肿瘤微环境中高水平的ROS和氧化应激,生成的次磺酸蛋白作为肿瘤相关抗原被金纳米颗粒捕获并由抗原递呈细胞呈递,并激活肿瘤特异性T细胞,作为原位疫苗可以有效地清除残留和转移的癌细胞,并展现出强大而持久的体外效应。
(2)本发明可以有效的识别肿瘤源性抗原蛋白,促进了抗原呈递效率,优化对效应免疫细胞的刺激。
(3)本发明有望为次磺酸化修饰的蛋白介导的肿瘤免疫治疗提供一个新的视角。
(4)本发明的制备方法具有高抗原利用性,高生产效率,高生物安全性和普遍适用性等特点,极大地节约了制备时间,具有广阔的应用空间。
附图说明
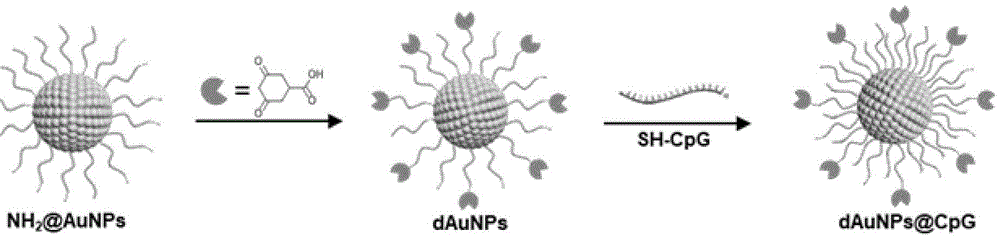
图1为金纳米颗粒表面PEG末端修饰3,5-二氧环己烷羧酸和修饰带有巯基的CpG寡脱氧核苷酸过程的示意图。
图2为金纳米颗粒的粒径、电势、TEM图像和元素能谱分析表征。
图3为B16F10和DC2.4细胞与不同浓度的NH
图4分析NH
图5为NH
图6为质谱分析dAuNPs与已报道具有抗原捕获功能的Maleimide 组成的金纳米颗粒复合物Mal@AuNPs进行比较。
图7为金纳米颗粒与肿瘤上清液孵育后促进DC细胞成熟情况。
图8为金纳米颗粒对小鼠原发和远端肿瘤的治疗效果评估。
具体实施方式
现有技术中,马来酰亚胺(Maleimide, Mal)因易与蛋白的巯基发生反应,具有较强的抗原吸附能力,在肿瘤免疫治疗中得到广泛应用。然而,由于它对大多数蛋白质高度敏感这一性质,导致可能会结合许多非抗原蛋白,从而影响抗原呈递效果。充分的抗原呈递对于刺激肿瘤特异性免疫应答至关重要。因此,促进抗原的识别和递呈,以优化对效应免疫细胞的刺激至关重要。鉴于此,为了弥补上述不足,寻找并开发一种新的特异性捕获抗原的纳米颗粒并且激活肿瘤微环境,促进抗原呈递,诱导免疫反应,抑制肿瘤生长的纳米平台策略,应用于肿瘤免疫的治疗具有重要的意义。本发明纳米疫苗通过提高靶向递送效率、促进抗原呈递、刺激先天免疫和诱导强大的T细胞应答而发挥高效作用,尤其是纳米颗粒与免疫检查点阻断剂联合用于放射诱导免疫治疗取得很好的技术效果。本发明中,纳米颗粒具有优异的生物相容性和尺寸可控性,易于调整大小和表面修饰,经过表面化学性质修饰的纳米颗粒可以通过捕获释放的肿瘤源性蛋白抗原(tumor-derived protein antigens,TDPAs)并将其呈递给APCs,从而提高免疫治疗的抗肿瘤效果,促进肿瘤免疫。
本发明公开的一种能特异性识别放疗后释放的肿瘤源性次磺酸化蛋白抗原的纳米颗粒,以金纳米颗粒为载体,其表面修饰物包括甲氧基聚乙二醇硫醇、氨基聚乙二醇硫醇、聚乙二醇-3,5-二氧环己烷羧酸复合物以及巯基-CpG寡脱氧核苷酸;具体的,在金纳米颗粒表面修饰甲氧基聚乙二醇硫醇、聚乙二醇-3,5-二氧环己烷羧酸复合物,得到抗原捕获纳米颗粒;在金纳米颗粒表面修饰甲氧基聚乙二醇硫醇、聚乙二醇-3,5-二氧环己烷羧酸复合物以及CpG,得到抗原捕获免疫激活纳米颗粒。聚乙二醇-3,5-二氧环己烷羧酸复合物为氨基聚乙二醇与3,5-二氧环己烷羧酸的反应产物。以金纳米颗粒为载体,3,5-二氧环己烷羧酸为抗原捕获剂,CpG作为免疫佐剂。放疗触发肿瘤细胞的免疫原性细胞死亡(ICD)后,生成的次磺酸蛋白作为肿瘤相关抗原被金纳米颗粒捕获并由抗原呈递细胞呈递并激活肿瘤特异性T细胞,进而攻击癌细胞。
本发明公开了上述抗原捕获纳米颗粒的制备方法,包括以下步骤,在纳米粒表面依次修饰聚乙二醇与3,5-二氧环己烷羧酸,得到抗原捕获纳米颗粒。具体的,以纳米粒为载体,甲氧基聚乙二醇硫醇和氨基聚乙二醇硫醇为原料,制备PEG修饰的氨基功能化纳米颗粒;然后在PEG末端氨基上修饰3,5-二氧环己烷羧酸,制备抗原捕获纳米颗粒,具有抗原捕获功能,能够抗原呈递,激活免疫细胞,进而攻击癌细胞。
本发明公开了上述抗原捕获免疫激活纳米颗粒的制备方法,包括以下步骤,在纳米粒表面依次修饰聚乙二醇、3,5-二氧环己烷羧酸、免疫佐剂,得到抗原捕获免疫激活纳米颗粒。具体的,以纳米粒为载体,甲氧基聚乙二醇硫醇和氨基聚乙二醇硫醇为原料,制备PEG修饰的氨基功能化纳米颗粒;然后在PEG末端氨基上修饰3,5-二氧环己烷羧酸;然后在纳米颗粒的表面修饰免疫佐剂,制备抗原捕获免疫激活纳米颗粒,具有抗原捕获功能,能够抗原呈递,更好的激活免疫细胞,进而攻击癌细胞。
作为示例,3,5-二氧环己烷羧酸和CpG修饰的金纳米颗粒的制备方法,包括如下步骤:
(1)以金纳米颗粒为载体,甲氧基聚乙二醇硫醇和氨基聚乙二醇硫醇为原料,制备PEG修饰的氨基功能化金纳米颗粒。具体步骤如下:
以柠檬酸钠为还原剂合成了裸金纳米颗粒。首先,将氯金酸溶液放入超纯水中,在热板上搅拌至剧烈沸腾,加入柠檬酸钠水溶液,在沸腾条件下保持反应,直到颜色变为酒红色,得到金纳米颗粒原液。待上述溶液冷却到室温后将合成的金纳米颗粒离心,弃上清;分别将甲氧基聚乙二醇硫醇和氨基聚乙二醇硫醇混合在超纯水中,再加入上述金纳米颗粒原液中,室温搅拌,使反应混合物能够实现颗粒表面聚乙二醇化,然后将得到的聚乙二醇化的金纳米颗粒离心,弃上清,并用超纯水清洗以去除未结合的PEG,最后得到经PEG修饰的氨基功能化金纳米颗粒的母液。
(2)在PEG末端氨基上修饰3,5-二氧环己烷羧酸,制备具有抗原捕获功能的金纳米颗粒。具体步骤如下:
首先,3,5-二氧环己烷羧酸在含有N-羟基琥珀酰亚胺和碳二胺的溶液中混合,室温活化,然后将混合物悬滴加入上述步骤(1)制备好的经PEG修饰的氨基功能化金纳米颗粒的母液中,室温下搅拌,得到的纳米颗粒离心,弃上清,超纯水清洗以去除多余未结合的反应产物,最后得到具有捕获次磺酸化蛋白抗原功能的金纳米颗粒。
本发明中,3,5-二氧环己烷羧酸的化学结构式如下:
(3)在金纳米颗粒的表面修饰带有巯基的CpG寡脱氧核苷酸,制备具有进一步增强免疫反应功能的金纳米颗粒。
将带有巯基修饰的CpG加入到上述步骤(2)的溶液中。室温搅拌,将产物离心处理,用PBS清洗去除未结合的DNA。最终溶液溶解在PBS中,得到负载了免疫佐剂的金纳米颗粒。
CpG寡脱氧核苷酸序列:5′-tccatgacgttcctgacgtt-3′。
作为阳性对照,也同样合成了在PEG末端氨基上修饰马来酰亚胺(Maleimide,Mal),制备具有抗原捕获功能的金纳米颗粒Mal@AuNPs。具体步骤如下:首先, 将3-马来酰亚胺基丙酸羟基琥珀酰亚胺酯溶解于DMSO,然后悬滴加入上述步骤(1)制备好的经PEG修饰的氨基功能化金纳米颗粒的母液中,室温下搅拌之后,将悬浮液离心,并用超纯水冲洗两次以去除游离共轭物。其中,3-马来酰亚胺基丙酸羟基琥珀酰亚胺酯与氨基聚乙二醇硫醇反应效率为68%。
本发明中,3-马来酰亚胺基丙酸羟基琥珀酰亚胺酯的化学结构式如下:
本发明中,所述甲氧基聚乙二醇硫醇为两个末端分别由甲氧基和巯基修饰的聚乙二醇,其选自M-PEG
本发明中,所述氨基聚乙二醇硫醇为两个末端分别由氨基和巯基修饰的聚乙二醇,其选自NH
下文将结合附图和具体实施例来进一步阐述本发明。应当理解的是,这些实施例仅用于解释和说明本发明中的技术方案,而并非旨在限制本发明的范围。此外,除非另有说明,下列实施例中所使用的材料、试剂、仪器等均可通过商业手段获得,本发明具体制备操作以及测试方法为常规技术。
组间差异性由ANOVA单因素方差分析评估,*p<0.05视为具有显著性差异,将**p<0.01,***p<0.001和∗∗∗∗p<0.0001视为高显著性差异。
实施例1
金纳米颗粒的制备及其表面的PEG修饰
首先,将1wt%的氯金酸溶液(1.2 mL)放入200 mL超纯水中,在热板上以600 rpm的转速搅拌至剧烈沸腾,30分钟后,加入1wt%柠檬酸钠水溶液(6 mL),在沸腾条件下保持反应,直到颜色变为酒红色,得到金纳米颗粒原液。待上述溶液冷却到室温后将合成的金纳米颗粒在13000 rpm下离心15 分钟,然后分别将20 mg 的甲氧基聚乙二醇硫醇和40 mg的氨基聚乙二醇硫醇混合在超纯水中,加入上述已制备好的金纳米颗粒原液,室温搅拌反应12小时,使反应混合物能够实现颗粒表面聚乙二醇化;然后将得到的聚乙二醇化的金纳米颗粒以13000 rpm离心15 min,并用超纯水清洗以去除未结合的PEG,最后得到经PEG修饰的氨基功能化金纳米颗粒NH
实施例2
在PEG末端氨基上修饰3,5-二氧环己烷羧酸
按照3,5-二氧环己烷羧酸(3.73 mg) ∶N-羟基琥珀酰亚胺∶碳二胺= 1:1.2:1.5的摩尔比在DMSO溶液中混合,室温活化6小时,然后将混合物悬滴加入上述已制备好的8 mg经PEG修饰的氨基功能化金纳米颗粒的母液中,室温下搅拌反应12小时,得到的纳米颗粒离心13000 rpm,15 min,超纯水清洗以去除多余未结合的反应产物,最后得到具有捕获次磺酸化蛋白抗原功能的金纳米颗粒dAuNPs。其中,3,5-二氧环己烷羧酸与氨基聚乙二醇硫醇反应效率为75%。
实施例3
在金纳米颗粒的表面修饰带有巯基的CpG寡脱氧核苷酸
将带有巯基修饰的CpG (0.5 mg)加入到上述方法制备的已经修饰3,5-二氧环己烷羧酸的金纳米颗粒溶液中;室温搅拌12 小时,将产物在4℃条件下13000 rpm离心15min,用PBS清洗2次,去除未结合的DNA,最终溶液溶解在PBS中,最后得到负载了免疫佐剂的金纳米颗粒,称为抗原捕获免疫激活纳米颗粒dAuNPs@CpG。
实施例1至实施例3的反应示意如图1所示。
作为阳性对照,也同样合成了在PEG末端氨基上修饰马来酰亚胺(Maleimide,Mal),制备具有抗原捕获功能的金纳米颗粒Mal@AuNPs。具体步骤如下:首先, 将3-马来酰亚胺基丙酸羟基琥珀酰亚胺酯(6.39 mg)溶解于0.5 mL 的DMSO,然后悬滴加入上述方法制备好的NH
实施例4
金纳米颗粒的粒径、电势、TEM图像和元素能谱分析表征
将上述所得5mg的金纳米颗粒溶液离心浓缩,1mL超纯水重悬,取10μL用超纯水稀释至1mL,利用动态光散射仪(DLS)检测金纳米颗粒的水合粒径和电势变化,并将相应样品各取10μL分别滴于铜网,自然风干后,利用透射电子显微镜进行拍摄。
如图2a所示,金纳米颗粒的水合粒径分布较为均匀(约为60 nm)。图2b是各金纳米颗粒的电势变化情况,其中金纳米颗粒表面修饰了3,5-二氧环己烷羧酸(dAuNPs)和CpG寡核苷酸(dAuNPs@CpG)后的电势为负值。图2c是金纳米颗粒在透射电镜下的形貌,可以看到金纳米颗粒粒径在20nm左右。图2d是 dAuNPs和dAuNPs@CpG的 EDS元素能谱分析,可以明显看到负载了巯基修饰的CpG寡核苷酸后,dAuNPs@CpG的P元素显著高于dAuNPs,证明CpG成功偶联到了dAuNPs金纳米颗粒上。
实施例5
金纳米颗粒的细胞毒性实验
小鼠黑色素瘤细胞(B16F10)和小鼠树突状细胞(DC2.4)分别接种于96孔板中(密度5 × 10
如图3a为B16F10细胞与NH
实施例6
分析金纳米颗粒的蛋白捕获能力,以及捕获前后粒径和电势的变化情况
首先,从辐照的B16-F10细胞上清液中提取肿瘤源性抗原蛋白。待B16-F10细胞密度生长至80%左右,预冷PBS轻轻洗涤细胞,更换不含FBS的DMEM培养液。然后,在峰值电压为160 kV和电流为25 mA的情况下,以20 Gy的剂量辐照B16-F10细胞,继续将细胞置于37℃、5% CO
如图4a所示,与NH
实施例7
Western blot 检测各金纳米颗粒上吸附次磺酸化蛋白的情况
首先,从辐照的B16-F10细胞上清液中提取肿瘤源性抗原蛋白。待B16-F10细胞密度生长至80%左右,预冷PBS轻轻洗涤细胞,更换不含FBS的DMEM培养液。然后,在峰值电压为160 kV和电流为25 mA的情况下,以20 Gy的剂量辐照B16-F10细胞,继续将细胞置于37℃、5% CO
为了进一步检测金纳米颗粒表面的抗原蛋白是否次磺酸化,将上述金纳米颗粒中加入SDS上样缓冲溶液,并在100°C下恒温金属浴中变性10分钟,此时金纳米颗粒上吸附的抗原蛋白已变性并溶解在SDS溶液中。13000rpm 离心10分钟,取上清液。然后,将上清液依次加入6-15% SDS- PAGE梯度凝胶上进行跑胶。待跑胶结束,将蛋白转移到PVDF膜上。5%牛奶与PVDF膜在室温下封闭2小时后,加入抗小鼠GAPDH (1:2000)抗体和抗兔半胱氨酸次磺酸(1:5000)抗体并在4℃下孵育过夜。第二天,PBST清洗PVDF膜3次,每次5-10分钟。加入二抗(1:5000)在室温下孵育1小时。曝光显影,观察条带的亮度来判断金纳米颗粒捕获抗原蛋白的次磺酸化情况。
如图5结果所示,金纳米颗粒与肿瘤细胞上清液孵育后,与NH
实施例8
质谱分析金纳米颗粒上所捕获的蛋白
金纳米颗粒与肿瘤细胞上清液孵育后,将负载了肿瘤抗原的金纳米颗粒用PBS洗涤,然后用8 M尿素裂解30 min。待蛋白变性后,在恒温振荡器上加入50 mM二硫苏糖醇, 60℃,30 min,使二硫键断裂。然后室温加入50 mM氯乙酰胺进行烷基化反应。加入25mm碳酸氢铵,使其分离溶解。最后,用200 ng胰蛋白酶在37℃恒温振荡器中消化16小时。第二天,纯化蛋白并质谱分析检测。
如图6a所示,质谱检测分析发现dAuNPs捕获了1394个蛋白,已报道的具有蛋白捕获功能的Mal@AuNPs材料也同样捕获了1364个蛋白,并且他们有1133个相同的蛋白。说明dAuNPs与Mal@AuNPs一样都具有蛋白捕获功能。接下来进一步分析他们捕获蛋白具体的功能,如图6b所示,对他们各自捕获不同的200多个蛋白进行了KEGG功能富集分析,进一步表征他们分别捕获的不同蛋白的生物学功能。结果表明,与Mal@AuNPs相比,dAuNPs捕获的特异性蛋白具有更有用的生物学功能,如免疫和代谢相关功能。
由此看来,与传统的纳米疫苗捕获技术相比,本发明的策略dAuNPs可以特异性和准确地捕获肿瘤来源的次磺酸化蛋白抗原,从而促进有效的抗原识别和交叉呈递。
实施例9
负载了肿瘤特异性抗原的金纳米颗粒诱导DC细胞成熟分析
首先,从辐照的B16-F10细胞上清液中提取肿瘤源性抗原蛋白。待B16-F10细胞密度生长至80%左右,预冷PBS轻轻洗涤细胞,更换不含FBS的DMEM培养液。然后,在峰值电压为160 kV和电流为25 mA的情况下,以20 Gy的剂量辐照B16-F10细胞,继续将细胞置于37℃、5% CO
提取C57BL/6小鼠的原代骨髓源性树突状细胞(DCs)。取老鼠的后肢,并用镊子和剪刀将肌肉、血管和皮肤完全分离。PBS冲洗骨髓,70 μm滤网进行过滤,1500 rpm离心5分钟,弃上清。细胞沉淀用1mL的红细胞裂解液进行室温裂解2分钟,然后用RPMI-1640培养液终止裂解。1500 rpm离心5分钟,弃上清。最后用含有GM-CSF (20ng/ml) 和IL-4 (5ng/ml)细胞因子的RPMI-1640培养液在37℃,5%培养箱中培养细胞。于第3、5天补充含GM-CSF和IL-4细胞因子的新鲜培养液继续培养细胞。第7天骨髓巨噬细胞可诱导转化为树突状细胞。
将上述已经负载了肿瘤抗原的金纳米颗粒与树突状细胞在培养箱中共孵育24小时。用PBS清洗细胞3次,0.25%胰蛋白酶消化细胞,并用RPMI-1640培养液终止消化。经过各种处理后,将DC细胞收集于1.5mL的EP管中。然后用PE-CY7标记的CD80抗体、PE标记的CD86抗体、FITC标记的MHCII抗体、APC标记的CD11c抗体与细胞在冰上孵育30分钟,避光操作。流式细胞仪分析金纳米颗粒刺激树突状细胞的成熟程度。
如图7a和7b所示,与肿瘤上清液孵育后,抗原呈递细胞表面的CD80、CD86和MHC II分子的表达增加,表明它们通过捕获大量肿瘤源性蛋白,促进DC细胞激活并促进抗原呈递。此外,值得注意的是,不含CpG的金纳米颗粒在刺激DC细胞成熟方面的效率低于含CpG的金纳米颗粒,这表明CpG的引入在增强纳米疫苗的免疫原性方面发挥了关键作用。
实施例10
金纳米颗粒对小鼠原发和远端肿瘤的治疗效果评估
将5 × 10
取小鼠的脾脏,用注射器橡胶端将其磨碎,收集脾脏细胞并用1mL的红细胞裂解液在室温下裂解1分钟,PBS终止裂红。脾脏组织的单细胞悬液与含PMA (20 ng ml
如图8a和8b所示,dAuNPs和dAuNPs@CpG金纳米颗粒注射入经放射治疗后的肿瘤中,并协同αPD-1抗体联合治疗后,可以显著抑制远端肿瘤的生长,并显著延长小鼠的生存期。此外,含有CpG的金纳米颗粒可以作为一种有效的免疫佐剂,能够增强肿瘤放疗后的免疫反应。另外考虑到CD8
综上所述,本发明公开了一种新的纳米疫苗,可以改善肿瘤免疫治疗并诱导体外效应。本发明的制备方法包括以下步骤:1)在金纳米颗粒表面修饰3,5-二氧环己烷羧酸,制备具有抗原捕获功能的金纳米颗粒。2)在金纳米颗粒的表面修饰带有巯基的CpG寡脱氧核苷酸,制备具有进一步增强免疫反应功能的金纳米颗粒。与以往的方法相比,本发明首次利用放疗诱导产生的高水平ROS和高氧化应激环境,进而引起次磺酸化蛋白形成这一现象,在金纳米颗粒表面修饰3,5-二氧环己烷羧酸,特异性的捕获肿瘤源性次磺酸化蛋白,增强抗原对抗原呈递细胞的交叉呈递,从而引发T细胞介导的深刻的抗肿瘤免疫。本发明提出了一种基于放射治疗诱导的原位疫苗的特殊抗原捕获剂,可以有效地识别并促进抗原呈递效率,从而诱导肿瘤免疫反应,可能为改善肿瘤治疗效果和抑制转移性肿瘤复发提供一种新的有效策略。
