用于抗衰老的静脉给药制剂
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及用于抗衰老的静脉给药制剂。
背景技术
衰老是机体从构成物质、组织结构到生理功能的丧失和退化过程。人体衰老过程中的生理变化主要体现在机体组织细胞和构成物质的丧失,机体代谢率的减缓,机体和器官功能减退。
科学研究表明,衰老与过量自由基的产生有关联。衰老的自由基学说认为衰老过程中的退行性变化是由于细胞正常代谢过程中产生的自由基的有害作用造成的。一些体内和体外实验表明,自由基抑制剂及抗氧化剂可以延长细胞和动物的寿命;体内自由基防御能力随年龄的增长而减弱;脊椎动物寿命长的,体内的氧自由基产率低。因此,通过抑制体内自由基的生成,可预防衰老或抗衰老。
发明内容
本发明第一方面提供羊水或含有所述羊水的药物组合物在制备抗衰老的静脉给药制剂中的用途;其中,所述羊水来自胚龄为5-10天的鸡蛋,或者来自发育时期与所述胚龄的鸡蛋所处的发育时期相对应的鸡以外的其它禽类的蛋;或来自胎龄为8-12天的啮齿类动物的胚胎,或来自发育时期与胎龄为8-12天的啮齿类动物的发育时期相对应的啮齿类动物以外的其它非人哺乳动物的胚胎。
本发明第二方面提供羊水或含有所述羊水的药物组合物在制备用于减少对象体内自由基的静脉给药制剂中的用途,或在制备用于提高对象体内超氧化物歧化酶和/或谷胱甘肽过氧化物酶水平的静脉给药制剂中的用途;其中,所述羊水来自胚龄为5-10天的鸡蛋,或者来自发育时期与所述胚龄的鸡蛋所处的发育时期相对应的鸡以外的其它禽类的蛋;或来自胎龄为8-12天的啮齿类动物的胚胎,或来自发育时期与胎龄为8-12天的啮齿类动物的发育时期相对应的啮齿类动物以外的其它非人哺乳动物的胚胎。
本发明第三方面提供羊水或含有所述羊水的药物组合物在制备用于提高对象体内超氧化物歧化酶和/或谷胱甘肽过氧化物酶水平、从而减少对象体内自由基、抗衰老的静脉给药制剂中的用途;其中,所述羊水来自胚龄为5-10天的鸡蛋,或者来自发育时期与所述胚龄的鸡蛋所处的发育时期相对应的鸡以外的其它禽类的蛋;或来自胎龄为8-12天的啮齿类动物的胚胎,或来自发育时期与胎龄为8-12天的啮齿类动物的发育时期相对应的啮齿类动物以外的其它非人哺乳动物的胚胎。
在一个或多个实施方案中,所述羊水来自胚龄为6-9天的鸡蛋或胚龄为8-9天的鸭蛋,优选胚龄为7-8天的鸡蛋,更优选胚龄为约7天的鸡蛋。
在一个或多个实施方案中,所述静脉给药制剂含有所述羊水以及注射用生理盐水、注射用水和/或葡萄糖注射液。
在一个或多个实施方案中,所述静脉给药制剂为静脉注射剂或静脉输注液。
在一个或多个实施方案中,所述静脉给药制剂中含有5-100%(v/v)或10-35%(v/v)的羊水,优选含有50-100%(v/v)的羊水。
在一个或多个实施方案中,所述静脉给药制剂的给药频次为每天多次、每天二次、每二天、每三天、每四天、每五天或每六天给药一次,每半个月给药一次,或每月、几个月给药一次,或者每年给药一次。
在一个或多个实施方案中,所述静脉给药制剂为冻干制剂。
附图说明
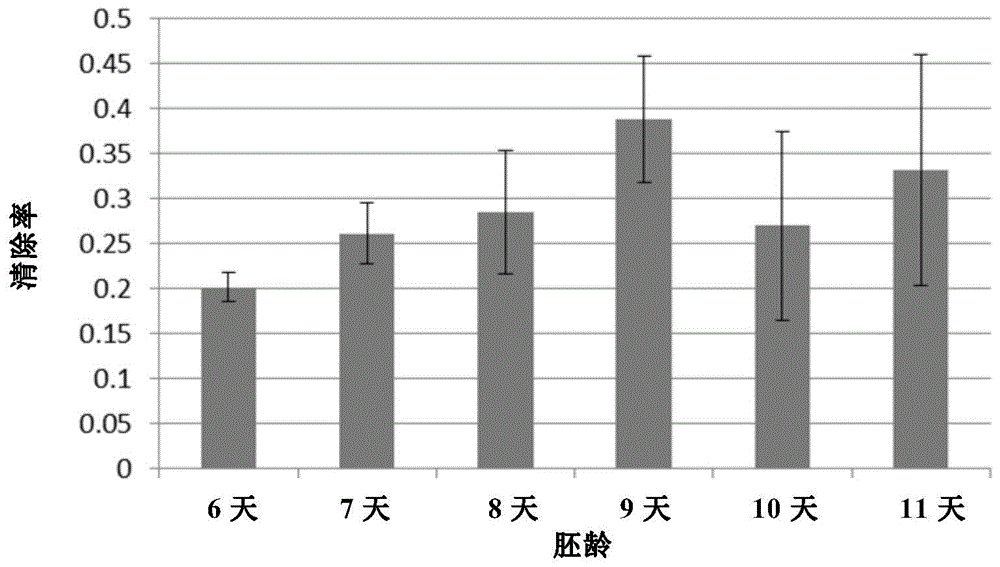
图1:不同胚龄的鸡蛋羊水(EE)的抗自由基能力。其中,横坐标表示胚龄,纵坐标表示清除率。
图2:来自鸡蛋的羊水对对人脐静脉内皮细胞(HUVEC)的生长活力和迁移能力的影响。其中,横坐标表示培养基,纵坐标表示OD
图3:来自鸭蛋的羊水对鸡胚胎成纤维细胞的生长活力和迁移能力的影响。其中,横坐标表示培养基,纵坐标表示OD
图4:注射期间至解剖前D7 EE-1组和空白对照-1组存活率,n=7。
图5:注射期间至解剖前D7 EE-1组和空白对照-1组平均体重,n=7。
图6:D7 EE-1组和空白对照-1组血常规检查:A)白细胞系计数,B)红细胞系计数,C)血小板计数,n=7。
图7:D7 EE-1组和空白对照-1组血清生化检查:A)血清总超氧化物歧化酶(SOD),B)血清总谷胱甘肽过氧化物酶(GSH-PX),n=7。
图8:解剖D7 EE-1组和空白对照-1组小鼠,称取心(Heart)、肝(Liver)、脾(Spleen)、肺(Lung)、肾(Kidney)、胰(Pancreas)、脑(Brain)重量并计算脏器体重比。
图9:注射D8 EE、D9 EE、D10 EE和空白对照组的平均体重(A)以及存活率(B)。
图10:注射D8 EE、D9 EE、D10 EE和空白对照组的平均体重。
图11:D11 EE和D14 EE对小鼠具有显著生物毒性。
具体实施方式
应理解,在本发明范围中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成优选的技术方案。
本发明人发现,胚龄为11天和14天的非人动物羊水的静脉给药制剂,在进行静脉注射时对受试者具有显著生物毒性,表现为注射后急性免疫反应导致的死亡率升高。而胚龄为5-10天的非人动物羊水的静脉注射剂,在进行静脉注射时,未观察到对受试者的存活率有显著影响。同时,通过静脉注射,可显著延缓受试者的衰老,由此完成本发明。
因此,本发明提供一种静脉给药制剂,其含有羊水;其中,所述羊水来自胚龄为5-10天的鸡蛋,优选胚龄为6-8天的鸡蛋,更优选胚龄为约7天的鸡蛋,或者来自发育时期与所述胚龄的鸡蛋所处的发育时期相对应的鸡以外的其它禽类的蛋;或来自胎龄为8-12天的啮齿类动物的胚胎,或来自发育时期与胎龄为8-12天的啮齿类动物的发育时期相对应的啮齿类动物以外的其它非人哺乳动物的胚胎。
本发明中,羊水可来自禽蛋和非人哺乳动物。禽蛋指禽类的蛋。优选的禽类为家禽,如鸡、鸭和鹅。优选的是,本发明使用胚龄在5-10天、优选6-9天的禽蛋。应理解,不同禽蛋,合适的胚龄未必相同。例如,当使用鸡蛋时,优选使用胚龄为5-10天的鸡蛋,更优选使用胚龄为6-9天的鸡蛋,更优选使用胚龄为7-8天的鸡蛋、更优选使用胚龄为约7天的鸡蛋。当使用其它禽类的蛋时,可使用其发育时期与上述胚龄的鸡蛋所处的发育时期相对应的蛋。例如,当使用鸭蛋时,胚龄为8-10天、尤其是8-9天的鸭蛋可能是最好的。
可采用常规的方法获得禽蛋羊水。例如,可敲击相应胚龄的蛋的钝端,使蛋壳碎裂,将蛋壳剥开形成一个直径约为2厘米的口子。然后用镊子小心撕开壳膜和卵黄膜,注意不要破坏羊膜。将包裹着胚胎的羊膜和相连组织从壳中倾倒至培养皿中,用注射器刺入羊膜抽取羊水,直至羊膜紧贴胚胎,由此即可获得用于本发明的羊水。
本文中,羊水还可来自非人哺乳动物,尤其是啮齿类动物,如来自小鼠。其它非人哺乳动物可以是常见的家畜,例如牛、羊、狗、猫、猪等。在某些实施方案中,羊水来自胎龄为8-12天的啮齿类动物的胚胎,或来自其发育时期与胎龄为8-12天的啮齿类动物所处的发育时期相对应的非人哺乳动物的胚胎。可采用常规的方法获得羊水。例如,用手术剪剪开怀孕8-12天的小鼠腹腔,小心取出并剪开子宫,用注射器刺入羊膜抽取羊水,直至羊膜紧贴胚胎,由此即可获得用于本发明的羊水。
应理解,必要时,可对羊水进行离心,以分离出可能含有的杂质,例如卵黄等,尽可能获得纯的羊水。离心后获得的上清液即为用于本发明的羊水。应理解的是,获取羊水的所有步骤都需在无菌条件下进行;另外,本文所示的“羊水”应指“纯”的羊水,即分离自禽蛋或非人哺乳动物胚胎的不含有禽蛋内或非人哺乳动物胚胎内其它成分、且也未被外源物质污染的羊水。纯的羊水可储存于-60℃以下的冰箱中,解冻后再使用。
本文所述的羊水可作为药物的活性成分,用于体内给予需要的对象。例如,可给予需要的对象有效量的本文所述的羊水,或含有所述羊水的药物组合物。
本文中,受试者可以是动物,如哺乳动物,尤其是人。
本发明特别优选的实施方案中,使用羊水,尤其是本文所述的禽蛋羊水,更优选是鸡蛋羊水制成静脉给药制剂,用于给予需要的对象进行抗衰老。
本文中,衰老指机体对环境的生理和心理适应能力进行性降低、逐渐趋向死亡的现象。衰老的自由基学说认为,衰老过程中的退行性变化是由于细胞正常代谢过程中产生的自由基的有害作用造成的。自由基是正常代谢的中间产物,其反应能力很强,可使细胞中的多种物质发生氧化,损害生物膜。还能够使蛋白质、核酸等大分子交联,影响其正常功能。一些体内和体外实验显示,自由基抑制剂及抗氧化剂可以延长细胞和动物的寿命;体内自由基防御能力随年龄的增长而减弱;脊椎动物寿命长的,体内的氧自由基产率低。本文的制剂能显著提高超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-PX)的血清水平,因而能显著降低动物体内自由基,从而能实现抗衰老的效果。
含有本文所述羊水的药物组合物通常还含有药学上可接受的辅料。本文中,“药学上可接受的辅料”是指在药理学和/或生理学上与受试者和活性成分相容的载体、稀释剂和/或赋形剂,包括但不限于:抗生素,保湿剂,pH调节剂,表面活性剂,碳水化合物,佐剂,抗氧化剂,螯合剂,离子强度增强剂、防腐剂、载剂、助流剂、甜味剂、染料/着色剂、增味剂、润湿剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂或乳化剂。在一些实施方案中,药学上可接受的辅料可以包括一种或多种非活性成分,包括但不限于:稳定剂、防腐剂、添加剂、佐剂,或其它适宜的与药效化合物合用的非活性成分。在一些实施方案中,所述药物组合物是适合静脉给药的药物制剂,其含有适合静脉给药的药学上可接受的辅料。
在一些实施方案中,可将治疗有效量的羊水与适量的注射用生理盐水、注射用水或葡萄糖注射液混匀,然后通过例如静脉注射或静脉内输注给药,用于抗衰老。在一些实施方案中,所述静脉给药制剂可含有5-100%(v/v)或10-100%的本文所述的羊水,优选50-100%。在一些实施方案中,所述静脉给药制剂可以是冻干制剂形式,使用时,可用药学上可接受的辅料,如注射用生理盐水、注射用水和/或葡萄糖注射液等溶解,制备成静脉给药的制剂,如注射剂或输注液。
本案中,给药的剂量和频次可根据具体的病情,给予对象的年龄和性别等情况由本领域技术人员确定。可每天或每周注射给予。在某些实施方案中,给药频次可以是每天多次、每天二次、每二天、每三天、每四天、每五天或每六天给药一次,每半个月给药一次,或每月、几个月给药一次,或者每年给药一次。通常,给予人时,每次的剂量可在0.1mL/kg体重到2mL/kg体重的范围内。
在一些实施方案中,本发明提供本文所述的羊水或含有所述羊水的药物组合物在制备抗衰老用的静脉给药制剂中的用途。在另外一些实施方案中,本发明提供本文所述的羊水或含有所述羊水的药物组合物在制备用于减少对象体内自由基的静脉给药制剂中的用途。在另外一些实施方案中,本发明提供本文所述的羊水或含有所述羊水的药物组合物在制备用于提高对象体内超氧化物歧化酶(SOD)和/或谷胱甘肽过氧化物酶(GSH-PX)水平的静脉给药制剂中的用途。在一些实施方案中,本发明提供本文所述的羊水或含有所述羊水的药物组合物在制备提高对象体内超氧化物歧化酶(SOD)和/或谷胱甘肽过氧化物酶(GSH-PX)水平、减少对象体内自由基、从而抗衰老的静脉给药制剂中的应用。在一些实施方案中,所述静脉给药制剂含有所述羊水以及注射用生理盐水、注射用水和/或葡萄糖注射液。在一些实施方式中,所述静脉给药制剂为静脉注射剂或静脉输注液。
本发明还提供一种抗衰老方法,所述方法包括静脉给予需要的对象本文所述的羊水、含有所述羊水的药物组合物、或本文所述的静脉给药制剂。
在本发明所述药物组合物、静脉给药制剂、方法以及用途的特别优选的实施方案中,所述羊水优选来自胚龄为约7天的鸡蛋。
下文将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并不意图限制本发明的范围。实施例中所用到的方法、试剂和仪器,除非另有说明,否则为本领域常规的方法、试剂和仪器。
实施例1:不同胚龄鸡蛋羊水(EE)的获取
1、材料
a)仪器和工具
微电脑全自动孵化器(正大
b)试剂和生物材料
不同胚龄的鸡蛋。
2、实验流程
取鸡蛋,敲击朝上放置的、较为扁平的钝端,使蛋壳碎裂,将蛋壳剥开形成一个直径约为2厘米的口子,边缘应尽量平整。用镊子小心撕开壳膜和卵黄膜,注意不要破坏羊膜。观察胚胎发育状况,只有发育良好且符合对应阶段标准的胚胎可用于抽提羊水。
将包裹着胚胎的羊膜和相连组织从壳中倾倒至培养皿中,用注射器刺入羊膜抽取羊水,针口斜面应背对胚胎,直至羊膜紧贴胚胎,然后将澄清、无色、无异物的羊水注入冰盒内的离心管中。
用镊子取出羊膜中的胚胎,收集于放置在冰上的不锈钢筛子中,每隔一小时将收集的胚胎用搅拌机匀质化,封装在无菌的塑料储物罐中,倾斜放置于-80℃冰箱中。冷冻后可竖直放置。
通过美谱达
将收集羊水抽提液的离心管配平后用中佳
所有步骤都在无菌条件下进行。
实施例2:EE抗自由基能力的测试
DPPH即1,1-二苯基-2-苦基肼基自由基,其结构如下所示:
DPPH的分子中,由于存在多个吸电子的-NO
当DPPH自由基被清除,其最大吸收波长519nm处的吸光度A值随之减小。DPPH这种稳定的自由基为清除自由基活性的检测提供了一个理想而又简单的药理模型。本实施例利用DPPH来检测来自EE的抗自由基能力。
取0.8mg的DPPH,溶于20mL溶剂甲醇中,超声5min,充分振摇,使上下各部分均匀。取1mL该DPPH溶液,在519nm处测A
采用实施例一所述的方法分别获得胚龄为6天、7天、8天、9天、10天和11天的鸡蛋的羊水,离心后保存在4℃冰箱中待用。
以维生素C作为正对照,测定标准曲线。取不同体积的0.04mg/mL Vc样品加入0.6mL的DPPH,加入无水乙醇补足至1mL,混匀,以甲醇为对照调零,测定519nm波长下的吸光值。重复三次数据后作图。
取不同胚龄的羊水400μL至试管中,加入600μL中配制好的DPPH的甲醇溶液,混匀,反应10min,使气泡不再产生(测定前要混匀)。以甲醇为对照调零,测定519nm的吸光度。
各组的加样信息如下表1所示:
表1:各组组分
采用以下公式计算清除率(抑制率):
清除率(%)=(A
结果如图1所示。
实施例3:鸡蛋羊水和鸭蛋羊水的划痕实验
采用与实施例1相同的方法获得胚龄为8天的鸭蛋的羊水。采用划痕实验测试鸡蛋羊水对人脐静脉内皮细胞(HUVEC)和鸭蛋羊水对鸡胚胎成纤维细胞的生长活力和迁移能力的影响。人脐静脉内皮细胞从市售途径获得。
本实施例使用的DMEM培养基的组成如下:
实验前第一天,准备6孔板,用马克笔在6孔板背后用直尺画出5-6条分布均匀的横线,横穿过孔;再在中线位置画一条垂直的竖线以指示划痕的位置。在每个孔中加入约5×10
实验当天,用枪头比着直尺,沿马克笔竖线,垂直于6孔板底面划线。尽量不要倾斜、弯曲,不同孔之间最好用同一支枪头,宽度在1000-2000um为宜。每个孔用2mL PBS清洗3次,洗去划痕处的细胞。各个孔中分别加入2mL含不同含量的EE的培养基,常规培养,每48h换液。从划痕计时为0h,每24h定点拍照,测量划痕两侧细胞间距。观察每个孔中细胞生长状况;以时间(天)为横轴,每个孔中划痕距离为纵轴绘制图表;计算每个孔中划痕愈合的速度。
结果如图2和3所示。图2显示来自鸡蛋的羊水对人脐静脉内皮细胞(HUVEC)的生长活力和迁移能力的影响,添加5%(体积比)的羊水明显对HUVEC的愈合具有非常明显的促进作用。图3显示来自鸭蛋的羊水对鸡胚胎成纤维细胞的生长活力和迁移能力的影响,羊水的添加对鸡胚胎成纤维细胞的愈合也显示出非常明显的促进作用。
结果显示,不同来源的羊水都具有相同或相似的生物学活性。
实施例4:短期静脉注射鸡胚羊水对KM小鼠的影响
本实施例测试短期静脉注射EE对KM小鼠的影响。
实验动物为6-8周龄雄性KM小鼠(浙江维通利华),每组n=7。
采用实施例1的方法获得不同胚龄的羊水,用于本实施例。
实验方法包括:尾静脉注射,0.15mL/只/次,10天内注射7次,注射天数范围内持续观察状态。实验期间称重和观察。实验结束后取样、解剖,观察并称重心、肝、脾、肺、肾、胰、脑等器官。
对照品为0.9%氯化钠注射液(
实验组设置如下表2所示:
表2
实验流程如下表3所示:
表3
注:①-⑦表示第1-7次注射,每次注射前需称重;Blank-1组注射时间和D7 EE-1组注射时间相同;D7 EE指从胚龄为7天的鸡蛋获得的羊水。
采样和检测如下表4所示:
表4
结果:
1、存活率
10天内尾静脉注射7次至解剖前,D7 EE-1组和空白对照-1组(Blank-1)存活率均为100%,存活率曲线重合。结果如图4所示。
2、状态观察
各实验组动物的体重结果如图5所示。D7 EE-1组和空白对照-1组平均体重初始值均为44.4g,10天内尾静脉注射7次后,D7 EE-1组和空白对照-1组平均体重分别为45.7g、46.6g,增长率分别为2.86%、4.99%,组间无显著性差异(图5)。
3、血常规
血常规检查结果见图6。对比D7 EE-1组和空白对照-1组三系血细胞:白细胞系(图6,A)、红细胞系(图6,B)和血小板(图6,C)。D7 EE-1组白细胞计数均值为0.36×10
其中各类白细胞计数比值和参考值为(D7 EE-1组/空白对照-1组,参考范围):中性粒细胞计数(0.10/0.26,0.1-1.8)、淋巴细胞计数(0.20/5.29,0.7-5.7)和单核细胞计数(0.06/0.31,0-0.3)。D7 EE-1组白细胞显著低于正常水平,主要表现在淋巴细胞浓度低于正常水平。两组红细胞系和血小板计数均在正常范围,组间无显著性差异。
4、抗衰老能力(SOD、GSH-PX)
将血清作生化检查,检测项为超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-PX)。结果如图7所示。
作为机体关键抗过氧化能力指标,SOD和GSH-PX的水平能够反映机体抗衰老能力和其衰老程度[Yang,G.Y.等,2013,Effects of cigarette smoke extracts on thegrowth and senescence of skin fibroblasts in vitro,International journal ofbiological sciences,9(6),613–623;Wang,F.等,2016,Senescence-specific change inROS scavenging enzyme activities and regulation of various SOD isozymes toROS levels in psf mutant rice leaves,Plant physiology and biochemistry:PPB,109,248–261]。由图7可见,D7 EE-1组血清SOD和GSH-PX水平均高于空白对照-1组,GSH-PX水平具有显著差异,指示D7 EE-1组小鼠具有更强的抗衰老能力。
5、解剖和病理观察
取血后,颈椎脱臼法处死小鼠,解剖以下器官:心、肝、脾、肺、肾、胰、脑。观察D7EE-1组和空白对照-1组小鼠各脏器形态,未发现显著异常。
各脏器称重并计算脏器体重比如图8所示。D7 EE-1组和Blank-1组小鼠各重要器官脏器体重比均在正常水平,组间无显著差异。
实施例5:中期静脉注射鸡胚羊水对KM小鼠的影响
本实施例测试中期静脉注射EE对KM小鼠的影响。
实验动物为6-8周龄雄性KM小鼠(浙江维通利华),每组n=6。
采用实施例1的方法获得胚龄8天、9天和10天的羊水(D8 EE、D9 EE和D10 EE),用于本实施例。
实验方法包括:尾静脉注射,0.15mL/只/次,151天内,前7次注射如表3进行,然后每周注射1次,共计26次。注射天数范围内持续观察状态。实验期间称重和观察。
对照品为0.9%氯化钠注射液(
实验结果如图9所示。观察到D8 EE和D9 EE有促进KM小鼠体重增长的作用(图9,A),未观察到D8 EE、D9 EE和D10 EE对KM小鼠存活率的显著影响(图9,B;注:除D8 EE组有1例于实验初期死亡,其余各组存活率均为100%)。
实施例6:长期静脉注射鸡胚羊水对KM小鼠的影响
本实施例测试长期静脉注射EE对KM小鼠的影响。
实验动物为6-8周龄雄性KM小鼠(浙江维通利华),每组n=6。
采用实施例1的方法获得胚龄8天、9天和10天的羊水(D8 EE、D9 EE和D10 EE),用于本实施例。
实验方法包括:尾静脉注射,0.15mL/只/次,48天内注射7次,然后每周注射1次,注射天数范围内持续观察状态。实验期间称重和观察。
对照品为0.9%氯化钠注射液(
实验结果如图10所示。观察到长期注射D7 EE组KM小鼠体重增长缓于D8、D9 EE组,毛色较其余各组有光泽。
实施例7:D11 EE和D14 EE对小鼠具有显著生物毒性
实验动物为6-8周龄雄性KM小鼠(浙江维通利华),每组n=6。
采用实施例1的方法获得胚龄7天、11天和17天的羊水(D7 EE、D11EE和D14 EE),用于本实施例。
实验方法包括:尾静脉注射,0.15mL/只/次,注射40次以上。实验期间称重和观察。
对照品为0.9%氯化钠注射液(
实验结果如图11所示。D11 EE和D14 EE于30天内进行10次静脉注射在KM小鼠中具有显著生物毒性,主要表现在注射后急性免疫反应导致的死亡率升高。较长周期内(大于40天)D11 EE、D14 EE组存活率为0。
- 一种用于静脉抽血引起的静脉炎的中药制剂及制备方法
- 用于抗衰老的中药制剂及其制备方法
