一种磁珠法提取血浆游离DNA的试剂盒及其使用方法
文献发布时间:2023-06-19 11:40:48
技术领域
本发明涉及DNA检测领域,尤其涉及一种磁珠法提取血浆游离DNA的试剂盒及其使用方法。
背景技术
血浆是血液除去血细胞、白细胞和血小板外的液体组分,约占全血体积的50%。研究表明血浆中含有水、血浆蛋白、糖类外,还有游离在细胞外的脱氧核糖核酸分子,即为血浆游离DNA。血浆游离DNA大部分都是双链DNA分子,其片段长度远小于基因组DNA,主要集中在0.1~0.3kb之间。在癌症发展、诊断和治疗的整个自然过程中,血浆游离DNA分析有潜在的应用价值。近年来,血浆游离DNA在医学诊断中的应用不断拓展,其广泛应用于无创产前、肿瘤液体活检和肿瘤个体化用药指导等领域。
由于血浆游离DNA片段小,含量低,其提取的难度远高于基因组DNA。目前市场上的游离DNA提取试剂盒存在提取过程中血浆游离DNA的损失,蛋白残留等问题,从而影响血浆游离DNA纯度。因此需要研究一种可以降低游离DNA损失和蛋白残留,从而提高血浆游离DNA检测结果准确性的试剂盒。
发明内容
有鉴于此,本发明提出了可以降低游离DNA损失和蛋白残留,提高血浆游离DNA检测结果准确性的一种磁珠法提取血浆游离DNA的试剂盒及其使用方法。
本发明的技术方案是这样实现的:本发明提供了一种磁珠法提取血浆游离DNA的试剂盒及其使用方法。
一种磁珠法提取血浆游离DNA的试剂盒,包括:裂解液、蛋白酶K、结合液、磁珠溶液、第一清洗液、第二清洗液和洗脱液,上述溶液的溶剂均为去离子水。
在以上技术方案的基础上,优选的,所述裂解液浓缩制成裂解液冻干粉。
在以上技术方案的基础上,优选的,所述裂解液冻干粉由pH值为8.0、浓度为0.45-1mol/L的EDTA溶液、浓度为0.5-3mol/L的柠檬酸钠溶液、浓度为0.1-1.3mol/L的海藻酸钠溶液,浓度为0.25-0.8mol/L的十六烷基三甲基溴化胺溶液和体积分数为0.1%-2%的吐温20制备而成。
在以上技术方案的基础上,优选的,所述结合液浓缩制成结合液冻干粉。
在以上技术方案的基础上,优选的,所述结合液冻干粉由浓度为4-8mol/L的异硫氰酸胍溶液、浓度为0.1-2mol/L的乙酸钠溶液和体积分数为0.1%-1%的曲拉通x-100溶液制备而成。
在以上技术方案的基础上,优选的,所述结合液和裂解液冻干粉的制作方法为:在配置好的裂解液和结合液中分别加入0.3%-0.5%的稳定剂,转入1.5ml离心管内,然后置于真空冷冻浓缩仪内,液体经低温冻结、脱水至干粉状,浓缩条件是:冷凝器温度-40~-30℃,加热器转速为10000-13000r,温度为45-56℃,浓缩时间为60-90min。
在以上技术方案的基础上,优选的,所述真空冷冻浓缩仪包括冷凝器、加热干燥器和真空泵。
在以上技术方案的基础上,优选的,所述结合液和裂解液经完全冻结,并在真空条件下使冰晶升华,制备得到冻干粉。
在以上技术方案的基础上,优选的,所述稳定剂为黄原胶和三聚磷酸钠,黄原胶和三聚磷酸钠的质量比为(1-3):(2-5)。
在以上技术方案的基础上,优选的,所述磁珠溶液的浓度为30-55mg/mL,磁珠的表面包覆二氧化硅纳米层,内核为四氧化三铁。
在以上技术方案的基础上,优选的,所述第一清洗液的pH值为8.0,包括:浓度为5-25mmol/L的Tris-HCl溶液、浓度为8-17mmol/L的氯化钠溶液、浓度为3-5mol/L盐酸胍溶液和体积分数为30%-80%的乙醇溶液。
在以上技术方案的基础上,优选的,所述第二清洗液包括:浓度为10-20mmol/L的Tris-HCl溶液和体积分数为75%-95%的乙醇溶液。
在以上技术方案的基础上,优选的,所述洗脱液包括:浓度为8-10mmol/L的Tris-HCl溶液,浓度为0.5-1mmol/L的SDS溶液和浓度为0.1%-1%吐温20。
更进一步优选的,还包括一种磁珠法提取血浆游离DNA的试剂盒的使用方法,其特征在于,步骤如下:
S1:在血浆样本置于20-37℃条件下解冻,然后取800-1000μl解冻的血浆,加入裂解液冻干粉0.1-0.12g,震荡混匀,使其沉淀消失;
S2:向1.5ml离心管中加入80-100μl蛋白酶K溶液,涡旋振荡30s使其充分混匀,置于恒温金属浴中,在56℃条件下温浴20-30min,温浴期间震荡1-2次;
S3:取出温浴后的离心管置于20-25℃条件下,并将0.54-0.58g混合液冻干粉加入离心管中,震荡混匀,使沉淀消失;
S4:向步骤S3离心管中依次加入2-3mg磁珠溶液和600-800μl异丙醇,并将离心管置于涡旋混合仪上结合5min,离心3s,然后将离心管置于磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S5:将步骤S4离心管从磁力架上取下,加入500-700μl第一清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S6:将步骤S5离心管从磁力架上取下,加入500-700μl第二清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S7:将步骤S6离心管置于56℃的恒温金属浴内干燥3-5min,取出离心管,加入15-20μl洗脱液,涡旋振荡30s后放置56℃的恒温金属浴内温浴3-5min;
S8:从恒温金属浴中取出步骤S7离心管,并将其放置于磁力架上30s,保持离心管于磁力架上,将离心管中的洗脱液转移至一个新的1.5ml离心管中,即为提取后的血浆游离DNA产物。
本发明的一种磁珠法提取血浆游离DNA的试剂盒及其使用方法相对于现有技术具有以下有益效果:
(1)本专利采用真空浓缩方法制备的结合液和裂解液冻干粉,减少实验过程中血浆游离DNA的损失,同时也利于结合液和裂解液的长时间保存,不变质。
(2)在制备裂解液和结合液冻干粉过程中加入黄原胶和三聚磷酸钠使得裂解液和结合液在冻干和脱水过程中保持稳定,同时冻干粉在使用时分散性好,溶解性高,防止沉淀的作用。
(3)本发明试剂盒中裂解液特定的试剂组合,具有促进蛋白质变性,裂解细胞,释放核酸的作用。
(4)应用本专利试剂盒在提取血浆游离DNA时,仅需要短暂离心3秒,不需要多次重复的离心,在保证血浆游离DNA总量的同时,还避免了离心过程中可能带来的交叉污染,提高了DNA纯度。
(5)本专利的方法可以简单快速、有效提取高质量的游离DNA,直接满足PCR扩增、二代测序、定量与定性分析等分子实验。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
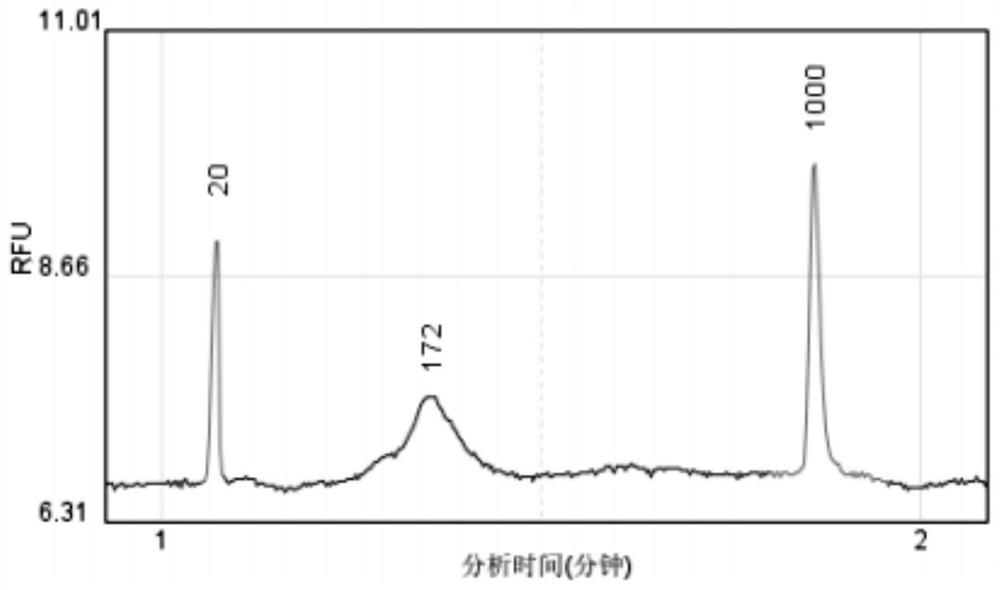
图1为本发明实施例一提取的游离DNA产物的Qsep质检结果图;
图2为本发明实施例二提取的游离DNA产物的Qsep质检结果图;
图3为本发明实施例三提取的游离DNA产物的Qsep质检结果图;
图4为本发明对比例一提取的游离DNA产物的Qsep质检结果图;
图5为本发明对比例二提取的游离DNA产物的Qsep质检结果图;
图6为本发明对比例三提取的游离DNA产物的Qsep质检结果图。
具体实施方式
下面将结合本发明实施方式,对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式仅仅是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
实施例一
一种磁珠法提取血浆游离DNA的试剂盒,包括如下组分:裂解液冻干粉、蛋白酶K、结合液、磁珠溶液、第一清洗液、第二清洗液和洗脱液,上述溶液的溶剂均为去离子水。
裂解液冻干粉:由pH值为8.0、浓度为0.45mol/L的EDTA溶液、浓度为0.5mol/L的柠檬酸钠溶液、浓度为0.1mol/L的海藻酸钠溶液,浓度为0.25mol/L的十六烷基三甲基溴化胺溶液和体积分数为0.1%的吐温20制备而成。
结合液:由浓度为4mol/L的异硫氰酸胍溶液、浓度为0.1mol/L的乙酸钠溶液和体积分数为0.1%的曲拉通x-100溶液制备而成。
裂解液冻干粉的制作方法为:在配置好的裂解液和结合液中分别加入0.3%的黄原胶和三聚磷酸钠,黄原胶和三聚磷酸钠的质量比为1:2,将混合液转入1.5ml离心管内,然后置于真空冷冻浓缩仪内,液体经低温冻结、脱水至干粉状,浓缩条件是:冷凝器温度-40℃,加热器转速为10000r,温度为45℃,浓缩时间为60min。
磁珠溶液:磁珠溶液的浓度为30mg/mL,磁珠的表面包覆二氧化硅纳米层,内核为四氧化三铁。
第一清洗液:pH值为8.0,包括:浓度为5mmol/L的Tris-HCl溶液、浓度为8mmol/L的氯化钠溶液、浓度为3mol/L盐酸胍溶液和体积分数为30%的乙醇溶液;
第二清洗液:浓度为10mmol/L的Tris-HCl溶液和体积分数为75%的乙醇溶液。
洗脱液:浓度为8mmol/L的Tris-HCl溶液,浓度为0.5mmol/L的SDS溶液和浓度为0.1%吐温20。
上述溶液的溶剂均为去离子水。
使用方法:
S1:在血浆样本置于20℃条件下解冻,然后取800μl解冻的血浆,加入裂解液冻干粉0.1g,震荡混匀,使其沉淀消失;
S2:向1.5ml离心管中加入80μl蛋白酶K溶液,涡旋振荡30s使其充分混匀,置于恒温金属浴中,在56℃条件下温浴20min,温浴期间震荡1次;
S3:取出温浴后的离心管置于20℃条件下,并将200μl混合液冻干粉加入离心管中,震荡混匀,使沉淀消失;
S4:向步骤S3离心管中依次加入2mg磁珠溶液和600μl异丙醇,并将离心管置于涡旋混合仪上结合5min,离心3s,然后将离心管置于磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S5:将步骤S4离心管从磁力架上取下,加入500μl第一清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S6:将步骤S5离心管从磁力架上取下,加入500μl第二清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S7:将步骤S6离心管置于56℃的恒温金属浴内干燥3min,取出离心管,加入15μl洗脱液,涡旋振荡30s后放置56℃的恒温金属浴内温浴3min;
S8:从恒温金属浴中取出步骤S7离心管,并将其放置于磁力架上30s,保持离心管于磁力架上,将离心管中的洗脱液转移至一个新的1.5ml离心管中,即为提取后的血浆游离DNA产物。
实施例二
一种磁珠法提取血浆游离DNA的试剂盒,包括如下组分:裂解液冻干粉、蛋白酶K、结合液冻干粉、磁珠溶液、第一清洗液、第二清洗液和洗脱液,上述溶液的溶剂均为去离子水。
裂解液冻干粉:由pH值为8.0、浓度为1mol/L的EDTA溶液、浓度为3mol/L的柠檬酸钠溶液、浓度为1.3mol/L的海藻酸钠溶液,浓度为0.8mol/L的十六烷基三甲基溴化胺溶液和体积分数为2%的吐温20制备而成。
结合液冻干粉:由浓度为8mol/L的异硫氰酸胍溶液、浓度为2mol/L的乙酸钠溶液和体积分数为1%的曲拉通x-100溶液制备而成。
结合液和裂解液冻干粉的制作方法为:在配置好的裂解液和结合液中分别加入0.5%的黄原胶和三聚磷酸钠,黄原胶和三聚磷酸钠的质量比为3:5,将混合液转入1.5ml离心管内,然后置于真空冷冻浓缩仪内,液体经低温冻结、脱水至干粉状,浓缩条件是:冷凝器温度-30℃,加热器转速为13000r,温度为56℃,浓缩时间为90min。
磁珠溶液:磁珠溶液的浓度为55mg/mL,磁珠的表面包覆二氧化硅纳米层,内核为四氧化三铁。
第一清洗液:pH值为8.0,包括:浓度为25mmol/L的Tris-HCl溶液、浓度为17mmol/L的氯化钠溶液、浓度为5mol/L盐酸胍溶液和体积分数为80%的乙醇溶液;
第二清洗液:浓度为20mmol/L的Tris-HCl溶液和体积分数为95%的乙醇溶液。
洗脱液:浓度为10mmol/L的Tris-HCl溶液,浓度为1mmol/L的SDS溶液和浓度为1%吐温20。
使用方法:
S1:在血浆样本置于37℃条件下解冻,然后取1000μl解冻的血浆,加入裂解液冻干粉0.12g,震荡混匀,使其沉淀消失;
S2:向1.5ml离心管中加入100μl蛋白酶K溶液,涡旋振荡30s使其充分混匀,置于恒温金属浴中,在56℃条件下温浴30min,温浴期间震荡2次;
S3:取出温浴后的离心管置于25℃条件下,并将0.58g混合液冻干粉加入离心管中,震荡混匀,使沉淀消失;
S4:向步骤S3离心管中依次加入3mg磁珠溶液和800μl异丙醇,并将离心管置于涡旋混合仪上结合5min,离心3s,然后将离心管置于磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S5:将步骤S4离心管从磁力架上取下,加入700μl第一清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S6:将步骤S5离心管从磁力架上取下,加入700μl第二清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S7:将步骤S6离心管置于56℃的恒温金属浴内干燥5min,取出离心管,加入20μl洗脱液,涡旋振荡30s后放置56℃的恒温金属浴内温浴5min;
S8:从恒温金属浴中取出步骤S7离心管,并将其放置于磁力架上30s,保持离心管于磁力架上,将离心管中的洗脱液转移至一个新的1.5ml离心管中,即为提取后的血浆游离DNA产物。
实施例三
一种磁珠法提取血浆游离DNA的试剂盒,包括如下组分:裂解液冻干粉、蛋白酶K、结合液冻干粉、磁珠溶液、第一清洗液、第二清洗液和洗脱液,上述溶液的溶剂均为去离子水。
裂解液冻干粉:由pH值为8.0、浓度为0.5mol/L的EDTA溶液、浓度为1mol/L的柠檬酸钠溶液、浓度为1mol/L的海藻酸钠溶液,浓度为0.5mol/L的十六烷基三甲基溴化胺溶液和体积分数为0.5%的吐温20制备而成。
结合液冻干粉:由浓度为5mol/L的异硫氰酸胍溶液、浓度为0.5mol/L的乙酸钠溶液和体积分数为0.5%的曲拉通x-100溶液制备而成。
结合液和裂解液冻干粉的制作方法为:在配置好的裂解液和结合液中分别加入0.4%的黄原胶和三聚磷酸钠,黄原胶和三聚磷酸钠的质量比为2:5,将混合液转入1.5ml离心管内,然后置于真空冷冻浓缩仪内,液体经低温冻结、脱水至干粉状,浓缩条件是:冷凝器温度-45℃,加热器转速为12000r,温度为50℃,浓缩时间为70min。
磁珠溶液:磁珠溶液的浓度为40mg/mL,磁珠的表面包覆二氧化硅纳米层,内核为四氧化三铁。
第一清洗液:pH值为8.0,包括:浓度为20mmol/L的Tris-HCl溶液、浓度为15mmol/L的氯化钠溶液、浓度为4mol/L盐酸胍溶液和体积分数为50%的乙醇溶液;
第二清洗液:浓度为15mmol/L的Tris-HCl溶液和体积分数为80%的乙醇溶液。
洗脱液:浓度为8-10mmol/L的Tris-HCl溶液,浓度为0.5-1mmol/L的SDS溶液和浓度为0.1%-1%吐温20。
使用方法:
S1:在血浆样本置于25℃条件下解冻,然后取900μl解冻的血浆,加入裂解液冻干粉0.11g,震荡混匀,使其沉淀消失;
S2:向1.5ml离心管中加入90μl蛋白酶K溶液,涡旋振荡30s使其充分混匀,置于恒温金属浴中,在56℃条件下温浴25min,温浴期间震荡1次;
S3:取出温浴后的离心管置于23℃条件下,并将0.55g混合液冻干粉加入离心管中,震荡混匀,使沉淀消失;
S4:向步骤S3离心管中依次加入2.5mg磁珠溶液和700μl异丙醇,并将离心管置于涡旋混合仪上结合5min,离心3s,然后将离心管置于磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S5:将步骤S4离心管从磁力架上取下,加入600μl第一清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S6:将步骤S5离心管从磁力架上取下,加入600μl第二清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S7:将步骤S6离心管置于56℃的恒温金属浴内干燥4min,取出离心管,加入17μl洗脱液,涡旋振荡30s后放置56℃的恒温金属浴内温浴4min;
S8:从恒温金属浴中取出步骤S7离心管,并将其放置于磁力架上30s,保持离心管于磁力架上,将离心管中的洗脱液转移至一个新的1.5ml离心管中,即为提取后的血浆游离DNA产物。
实施例四
一种磁珠法提取血浆游离DNA的试剂盒,包括如下组分:裂解液冻干粉、蛋白酶K、结合液冻干粉、磁珠溶液、第一清洗液、第二清洗液和洗脱液,上述溶液的溶剂均为去离子水。
裂解液冻干粉:由pH值为8.0、浓度为0.7mol/L的EDTA溶液、浓度为2mol/L的柠檬酸钠溶液、浓度为0.8mol/L的海藻酸钠溶液,浓度为0.6mol/L的十六烷基三甲基溴化胺溶液和体积分数为0.8%的吐温20制备而成。
结合液冻干粉:由浓度为6mol/L的异硫氰酸胍溶液、浓度为0.9mol/L的乙酸钠溶液和体积分数为0.6%的曲拉通x-100溶液制备而成。
结合液和裂解液冻干粉的制作方法为:在配置好的裂解液和结合液中分别加入0.3%的黄原胶和三聚磷酸钠,黄原胶和三聚磷酸钠的质量比为1:5,将混合液转入1.5ml离心管内,然后置于真空冷冻浓缩仪内,液体经低温冻结、脱水至干粉状,浓缩条件是:冷凝器温度-42℃,加热器转速为11000r,温度为47℃,浓缩时间为65min。
磁珠溶液:磁珠溶液的浓度为35mg/mL,磁珠的表面包覆二氧化硅纳米层,内核为四氧化三铁。
第一清洗液:pH值为8.0,包括:浓度为19mmol/L的Tris-HCl溶液、浓度为12mmol/L的氯化钠溶液、浓度为3mol/L盐酸胍溶液和体积分数为40%的乙醇溶液;
第二清洗液:浓度为13mmol/L的Tris-HCl溶液和体积分数为85%的乙醇溶液。
洗脱液:浓度为9mmol/L的Tris-HCl溶液,浓度为0.8mmol/L的SDS溶液和浓度为0.4%吐温20。
使用方法:
S1:在血浆样本置于21℃条件下解冻,然后取850μl解冻的血浆,加入裂解液冻干粉0.1g,震荡混匀,使其沉淀消失;
S2:向1.5ml离心管中加入85μl蛋白酶K溶液,涡旋振荡30s使其充分混匀,置于恒温金属浴中,在56℃条件下温浴21min,温浴期间震荡1次;
S3:取出温浴后的离心管置于21℃条件下,并将0.55g混合液冻干粉加入离心管中,震荡混匀,使沉淀消失;
S4:向步骤S3离心管中依次加入2mg磁珠溶液和660μl异丙醇,并将离心管置于涡旋混合仪上结合5min,离心3s,然后将离心管置于磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S5:将步骤S4离心管从磁力架上取下,加入550μl第一清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S6:将步骤S5离心管从磁力架上取下,加入560μl第二清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S7:将步骤S6离心管置于56℃的恒温金属浴内干燥5min,取出离心管,加入16μl洗脱液,涡旋振荡30s后放置56℃的恒温金属浴内温浴5min;
S8:从恒温金属浴中取出步骤S7离心管,并将其放置于磁力架上30s,保持离心管于磁力架上,将离心管中的洗脱液转移至一个新的1.5ml离心管中,即为提取后的血浆游离DNA产物。
对比例一
一种磁珠法提取血浆游离DNA的试剂盒,包括如下组分:裂解液、蛋白酶K、结合液、磁珠溶液、第一清洗液、第二清洗液和洗脱液,上述溶液的溶剂均为去离子水。
裂解液:由pH值为8.0、浓度为0.5mol/L的EDTA溶液、浓度为0.5mol/L的柠檬酸钠溶液、浓度为0.1mol/L的海藻酸钠溶液,浓度为0.25mol/L的十六烷基三甲基溴化胺溶液和体积分数为0.1%的吐温20制备而成。
结合液:由浓度为4mol/L的异硫氰酸胍溶液、浓度为2mol/L的乙酸钠溶液和体积分数为1%的曲拉通x-100溶液制备而成。
磁珠溶液:磁珠溶液的浓度为55mg/mL,磁珠的表面包覆二氧化硅纳米层,内核为四氧化三铁。
第一清洗液:pH值为8.0,包括:浓度为5mmol/L的Tris-HCl溶液、浓度为8mmol/L的氯化钠溶液、浓度为3mol/L盐酸胍溶液和体积分数为30%的乙醇溶液;
第二清洗液:浓度为10mmol/L的Tris-HCl溶液和体积分数为75%的乙醇溶液。
洗脱液:浓度为8mmol/L的Tris-HCl溶液,浓度为0.5mmol/L的SDS溶液和浓度为0.1%吐温20。
使用方法:
S1:在血浆样本置于20℃条件下解冻,然后取500μl解冻的血浆,加入裂解液200μl,震荡混匀,使其沉淀消失;
S2:向1.5ml离心管中加入80μl蛋白酶K溶液,涡旋振荡30s使其充分混匀,置于恒温金属浴中,在56℃条件下温浴20min,温浴期间震荡1次;
S3:取出温浴后的离心管置于20℃条件下,并将200μl混合液加入离心管中,震荡混匀,使沉淀消失;
S4:向步骤S3离心管中依次加入2mg磁珠溶液和200μl异丙醇,并将离心管置于涡旋混合仪上结合5min,离心3s,然后将离心管置于磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S5:将步骤S4离心管从磁力架上取下,加入500μl第一清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S6:将步骤S5离心管从磁力架上取下,加入500μl第二清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S7:将步骤S6离心管置于56℃的恒温金属浴内干燥3min,取出离心管,加入15μl洗脱液,涡旋振荡30s后放置56℃的恒温金属浴内温浴3min;
S8:从恒温金属浴中取出步骤S7离心管,并将其放置于磁力架上30s,保持离心管于磁力架上,将离心管中的洗脱液转移至一个新的1.5ml离心管中,即为提取后的血浆游离DNA产物。
对比例二
一种磁珠法提取血浆游离DNA的试剂盒,包括如下组分:裂解液、蛋白酶K、结合液、磁珠溶液、第一清洗液、第二清洗液和洗脱液,上述溶液的溶剂均为去离子水。
裂解液:由pH值为8.0、浓度为1mol/L的EDTA溶液、浓度为3mol/L的柠檬酸钠溶液和体积分数为2%的吐温20制备而成。
结合液:由浓度为5mol/L的异硫氰酸胍溶液、浓度为0.5mol/L的乙酸钠溶液和体积分数为0.1%的曲拉通x-100溶液制备而成。
磁珠溶液:磁珠溶液的浓度为40mg/mL,磁珠的表面包覆二氧化硅纳米层,内核为四氧化三铁。
第一清洗液:pH值为8.0,包括:浓度为13mmol/L的Tris-HCl溶液、浓度为10mmol/L的氯化钠溶液、浓度为4mol/L盐酸胍溶液和体积分数为50%的乙醇溶液;
第二清洗液:浓度为12mmol/L的Tris-HCl溶液和体积分数为80%的乙醇溶液。
洗脱液:浓度为9mmol/L的Tris-HCl溶液,浓度为1mmol/L的SDS溶液和浓度为1%吐温20。
使用方法:
S1:在血浆样本置于37℃条件下解冻,然后取500μl解冻的血浆,加入裂解液200μl,震荡混匀,使其沉淀消失;
S2:向1.5ml离心管中加入80μl蛋白酶K溶液,涡旋振荡30s使其充分混匀,置于恒温金属浴中,在56℃条件下温浴30min,温浴期间震荡1次;
S3:取出温浴后的离心管置于20℃条件下,并将200μl混合液加入离心管中,震荡混匀,使沉淀消失;
S4:向步骤S3离心管中依次加入2mg磁珠溶液和200μl异丙醇,并将离心管置于涡旋混合仪上结合5min,离心3s,然后将离心管置于磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S5:将步骤S4离心管从磁力架上取下,加入500μl第一清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S6:将步骤S5离心管从磁力架上取下,加入500μl第二清洗液后,涡旋振荡30s,然后将离心管放置磁力架上静置30s,待混合液澄清,保持离心管于磁力架上,用移液枪去除上清液;
S7:将步骤S6离心管置于56℃的恒温金属浴内干燥3min,取出离心管,加入15-20μl洗脱液,涡旋振荡30s后放置56℃的恒温金属浴内温浴3min;
S8:从恒温金属浴中取出步骤S7离心管,并将其放置于磁力架上30s,保持离心管于磁力架上,将离心管中的洗脱液转移至一个新的1.5ml离心管中,即为提取后的血浆游离DNA产物。
对比例三
以市场上常用的游离DNA提取试剂盒:HiPure Circulating DNA Mini Kit为对照,按照该试剂盒的说明书进行提取。
分别以实施例1-4和对比例1-3的试剂盒提取血浆游离DNA,血浆样本选自申请人公司员工志愿者。
OD值检测:使用超微量紫外-可见光分光光度计对7份血浆游离DNA回收产物进行了OD值检测(见表1)。
表1游离血浆DNA的提取
实施例1-4为本发明试剂盒;对比例1为裂解液和结合液为液体,未制成冻干粉;对比例2的裂解液为常规试剂,且裂解液和结合液未制成冻干粉;对比例3为HiPureCirculating DNA Mini Kit试剂盒。表1所示:实施例1-4的A260/A280值和A260/A230值均高于对比例,表现出较高的纯度,其中A260/A280值为1.79-1.84,表示本发明试剂盒提取的游离DNA蛋白残留很低,纯度较高。
图1-6为血浆中提取的游离DNA产物的Qsep质检结果图,代表实施例和对比例试剂盒提取游离DNA的片段长度。
以上所述仅为本发明的较佳实施方式而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种磁珠法提取血浆游离DNA的试剂盒及其使用方法
- 一种磁珠法提取血浆游离DNA的试剂盒和方法
