S-抗原转运抑制寡核苷酸聚合物和方法
文献发布时间:2023-06-19 12:16:29
相关申请信息
本申请要求2018年11月8日提交的美国序列号62/757,632;2019年5月31日提交的美国序列号62/855,323;以及2019年9月30日提交的美国序列号62/907,845的优先权。上述每一个通过引用以其整体并入本文。
背景
本申请涉及作为S-抗原转运抑制寡核苷酸聚合物的STOPS
本文所述的STOPS
概述
现在已经发现,与本领域关于抗病毒化合物的所需结构特征的最佳组合的教导相反,可通过将其修饰以提供如本文所述的STOPS
本文所述的一些实施方案涉及修饰的寡核苷酸或其复合物,其具有针对乙型肝炎的序列非依赖性抗病毒活性,可以包含交替的A单元和C单元的至少部分硫代磷酸化的序列,其中:
所述A单元包含选自以下的一种或多种:
所述C单元包含选自以下的一种或多种:
每个末端
每个内部
如通过HBsAg分泌测定所确定的,针对乙型肝炎的序列非依赖性抗病毒活性大于参考化合物针对乙型肝炎的序列非依赖性抗病毒活性;
条件是,当交替的A单元和C单元的序列包含Ribo-A单元时,所述序列还包含至少一个不是Ribo-A单元的A单元;以及
条件是,当交替的A单元和C单元的序列包含Ribo-C单元时,所述序列还包含至少一个不是Ribo-C单元的C单元。
本文所述的一些实施方案涉及治疗HBV和/或HDV感染的方法,其可以包括向被鉴定为患有HBV和/或HDV感染的对象施用有效量的如本文所述的修饰的寡核苷酸,或者包含有效量的如本文所述的修饰的寡核苷酸的药物组合物。
本文公开的一些实施方案涉及抑制HBV和/或HDV复制的方法,其可以包括使感染有HBV和/或HDV的细胞与有效量的本文所述的修饰的寡核苷酸,或者包含有效量的本文所述的修饰的寡核苷酸的药物组合物接触。
下面将更详细地描述这些和其它实施方案。
附图简述
图1说明了包含C
图2说明了包含环氧丙烷连键的修饰的寡核苷酸的实施方案。
图3A说明了具有通过5’-四甘醇(TEG)连键连接的胆固醇的修饰的寡核苷酸的实施方案。
图3B说明了具有通过3’TEG连键连接的胆固醇的修饰的寡核苷酸的实施方案。
图3C说明了具有通过5’TEG键连接的生育酚(维生素E)的修饰的寡核苷酸的实施方案。
图3D说明了具有通过3’TEG键连接的生育酚(维生素E)的修饰的寡核苷酸的实施方案。
图4A和4B说明了具有通过连接基团连接的GalNac的修饰的寡核苷酸的实施方案。
图5说明了用于制备5’-EP结构单元的反应方案的实施方案。
图6A说明了修饰的寡核苷酸的实施方案以及针对乙型肝炎的序列非依赖性抗病毒活性(如通过HBsAg分泌测定所确定的)和细胞毒性的相应值。
图6B说明了修饰的寡核苷酸的实施方案以及针对乙型肝炎的序列非依赖性抗病毒活性(如通过HBsAg分泌测定所确定的)和细胞毒性的相应值。
图7说明了用于制备化合物5’-VP的反应方案的实施方案。
图8说明了用于制备化合物8-5和8-6的反应方案的实施方案。
图9A说明了用于制备化合物9R的反应方案的实施方案。
图9B说明了用于制备化合物9S的反应方案的实施方案。
图10说明了用于制备化合物10-5和10-6的反应方案的实施方案。
图11A说明了用于制备化合物11R的反应方案的实施方案。
图11B说明了用于制备化合物11S的反应方案的实施方案。
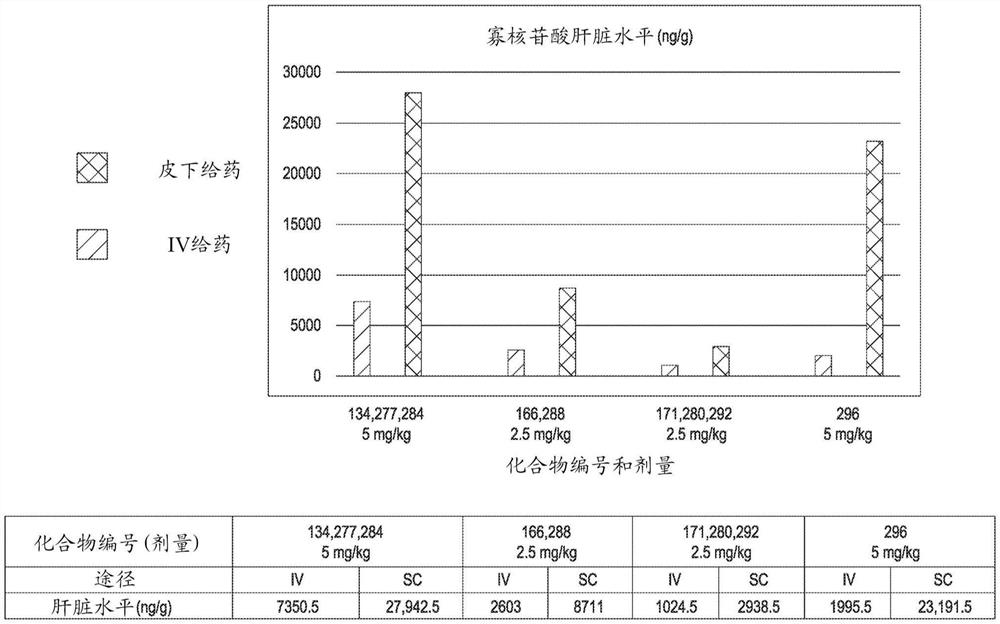
图12说明了向非人灵长类动物皮下施用修饰的寡核苷酸化合物的实施方案后的肝脏暴露结果。
图13说明了PBMC测定结果,说明了修饰的寡核苷酸化合物的实施方案的免疫反应。
图14说明了PBMC测定结果,说明了修饰的寡核苷酸化合物的实施方案的免疫反应。
图15说明了PBMC测定结果,说明了修饰的寡核苷酸化合物的实施方案的免疫反应。
图16说明了PBMC测定结果,说明了修饰的寡核苷酸化合物的实施方案的免疫反应。
图17说明了PBMC测定结果,说明了修饰的寡核苷酸化合物的实施方案的免疫反应。
图18说明了PBMC测定结果,说明了修饰的寡核苷酸化合物的实施方案的免疫反应。
图19说明了PBMC测定结果,说明了修饰的寡核苷酸化合物的实施方案的免疫反应。
图20说明了PBMC测定结果,说明了修饰的寡核苷酸化合物的实施方案的免疫反应。
图21说明了PBMC测定结果,说明了修饰的寡核苷酸化合物的实施方案的免疫反应。
图22说明了PBMC测定结果,说明了修饰的寡核苷酸化合物的实施方案的免疫反应。
图23说明了与实施例B3和B4中描述的HBsAg分泌测定结合使用的图。
详述
除非另有定义,本文使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同含义。除非另有说明,本文引用的所有专利、申请、公开的申请和其它出版物都通过引用以其整体并入。在本文中对于术语存在多个定义的情况下,除非另有说明,以本节中的那些定义为准。
乙型肝炎病毒(HBV)是DNA病毒和肝脱氧核糖核酸病毒科的成员。HBV在世界范围内感染超过3亿人,并且是肝癌和肝病(如慢性肝炎、肝硬化和肝细胞癌)的病原体。HBV可以是急性的和/或慢性的。急性HBV感染可以是无症状的或与有症状的急性肝炎一起存在。HBV分为A至H的8种基因型。
HBV是约3.2千碱基(kb)对的部分双链环状DNA。已经对HBV复制途径进行了详细的研究。T.J.Liang,Heptaology(2009)49(5Suppl):S13-S21。复制的一部分包括共价闭合环状(cccDNA)形式的形成。cccDNA的存在在整个宿主有机体的生命中导致病毒再度出现的风险。HBV携带者可以传播疾病多年。估计有2.57亿人患有乙型肝炎病毒感染,估计全世界每年有超过750,000人死于乙型肝炎。此外,免疫抑制个体或正在进行化疗的个体尤其处于HBV感染再活化的风险中。
HBV可通过血液、精液和/或另一种体液传播。这可以通过直接的血液对血液(blood-to-blood)接触、非保护性性行为、合用针头以及在分娩过程中从受感染的母亲传给婴儿而发生。HBV表面抗原(HBsAg)最常用于筛选这种感染的存在。目前可用的药物不能治愈HBV和/或HDV感染。而是,药物抑制病毒的复制。
丁型肝炎病毒(HDV)是也在病毒的肝脱氧核糖核酸病毒科中的DNA病毒。HDV只能在HBV存在下繁殖。HDV的传播途径与HBV的传播途径相似。HDV的传播可通过同时感染HBV(共感染)或者除了慢性乙型肝炎或乙型肝炎携带者状态(双重感染)之外发生。与感染单独的HBV相比,HDV的双重感染和共感染都导致更严重的并发症。这些并发症包括在急性感染中经历肝衰竭的更大可能性和快速发展为肝硬化,在慢性感染中发展肝癌的风险增加。与乙型肝炎组合,丁型肝炎在所有肝炎感染中具有最高的病死率,为20%。目前对丁型肝炎没有疗法或疫苗。
如本文在寡核苷酸或其它材料的上下文中所用的,术语“抗病毒”具有本领域技术人员所理解的通常含义,因此包括通常通过减少在另外适于形成至少一种病毒的感染性病毒颗粒的系统中形成的感染性病毒颗粒的数量,抑制病毒颗粒产生的寡核苷酸或其它材料的存在的影响。在某些实施方案中,抗病毒寡核苷酸对多种不同的病毒,例如HBV和HDV具有抗病毒活性。
本文所用的术语“寡核苷酸”(或“oligo”)具有本领域技术人员所理解的通常含义,因此是指包括寡脱氧核苷酸、寡脱氧核糖核苷酸和寡核糖核苷酸的一类化合物。因此,“寡核苷酸”是指核糖核酸(RNA)或脱氧核糖核酸(DNA)或其模拟物的寡聚物或聚合物,包括提及由天然存在的核碱基、糖和磷酸二酯(PO)核苷间(主链)连键组成的寡核苷酸,以及具有类似功能的非天然存在部分的“修饰的”或取代的寡核苷酸。因此,术语“修饰的”(或“取代的”)寡核苷酸具有本领域技术人员所理解的通常含义,并且包括具有一个或多个不同修饰,例如稳定化修饰的寡核苷酸,因此可以包括在核苷间连键和/或在核糖上和/或在碱基上的至少一个修饰。例如,修饰的寡核苷酸可以包括在核糖的2'-位的修饰、无环核苷酸类似物、碱基的甲基化、硫代磷酸化(PS)连键、二硫代磷酸酯连键、甲基膦酸酯连键、通过硫或氮连接到糖环的连键和/或如本文别处所述的其它修饰。因此,修饰的寡核苷酸可以包括一个或多个硫代磷酸化(PS)连键而不是PO连键,或者除了PO连键之外还可以包括一个或多个硫代磷酸化(PS)连键。与未修饰的寡核苷酸一样,包含此类PS连键的修饰的寡核苷酸被认为是在同一类化合物中,因为即使PS连键含有磷-硫双键而不是PO连键的磷-氧双键,PS和PO连键都通过氧原子连接到糖环。
如本文在修饰的寡核苷酸的上下文中所用的,术语“硫代磷酸化的”寡核苷酸具有本领域技术人员所理解的通常含义,因此是指其中所有的磷酸二酯核苷间连键均已经被硫代磷酸酯连键替代的修饰的寡核苷酸。因此,本领域技术人员理解术语“硫代磷酸化的”寡核苷酸与“完全硫代磷酸化的”寡核苷酸同义。硫代磷酸化的寡核苷酸(或部分硫代磷酸化的寡核苷酸内的硫代磷酸化的寡核苷酸的序列)可以类似地修饰,包括(例如)通过磷酸二酯连键替代一个或多个硫代磷酸化的核苷间连键。因此,术语“修饰的硫代磷酸化的”寡核苷酸是指已以与本文关于寡核苷酸所述类似的方式修饰的硫代磷酸化的寡核苷酸,例如通过用修饰的连键(如磷酸二酯、二硫代磷酸酯、甲基膦酸酯、硫代二磷酸酯(diphosphorothioate)、5’-氨基磷酸酯、3’,5’-磷二酰胺酯、5’-硫代磷酰胺酯、3’,5’-硫代磷二酰胺酯或二磷酸二酯)替代硫代磷酸化的连键。修饰的寡核苷酸的至少部分硫代磷酸化的序列可以被类似地修饰,因此,例如,可以被修饰以包含非硫代磷酸化的连键,如磷酸二酯、二硫代磷酸酯、甲基膦酸酯、硫代二磷酸酯、5’-氨基磷酸酯、3’,5’-磷二酰胺酯、5’-硫代磷酰胺酯、3’,5’-硫代磷二酰胺酯或二磷酸二酯。在描述对硫代磷酸化的寡核苷酸或者对修饰的寡核苷酸的至少部分硫代磷酸化的序列的修饰的上下文中,通过包含磷酸二酯连键的修饰可以被认为分别导致修饰的硫代磷酸化的寡核苷酸或修饰的硫代磷酸化的序列。类似地,在描述对寡核苷酸或对修饰的寡核苷酸的至少部分磷酸二酯化的序列的修饰的上下文中,包含硫代磷酸化的连键可以被认为分别导致修饰的寡核苷酸或修饰的磷酸二酯化的序列。
如本文在二核苷酸或寡核苷酸的上下文中所用的,术语“立体化学限定的硫代磷酸酯连键”具有本领域技术人员所理解的通常含义,因此是指具有选定手性(R或S构型)的磷立构中心的硫代磷酸酯连键。含有此类二核苷酸或寡核苷酸的组合物可以富含具有选定手性的分子。此类组合物的立体纯度可以在宽范围内变化,例如约51%至约100%的立体纯度。在各种实施方案中,立体纯度大于55%、65%、75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%;或在定义为具有前述立体纯度值中的任两个作为端点的范围内。
术语“序列非依赖性”抗病毒活性具有本领域技术人员所理解的通常含义,因此是指与寡核苷酸的序列无关的寡核苷酸(例如修饰的寡核苷酸)的抗病毒活性。用于确定寡核苷酸的抗病毒活性是否是序列非依赖性的方法是本领域技术人员已知的,并且包括用于确定寡核苷酸是否主要通过非序列互补作用模式起作用的测试,如美国专利第7,358,068号的实施例10;美国专利第8,008,269号;美国专利第8,008,270号;和美国专利第8,067,385号中所公开的,将其在此通过引用并且特别出于描述此类测试的目的并入本文。
在描述具有序列非依赖性抗病毒活性并包含A单元和C单元(例如交替的A单元和C单元或AC单元)的序列(例如至少部分硫代磷酸化的序列)的修饰的寡核苷酸的上下文中,术语“A”和“C”是指下表1和2中分别列出的修饰的含腺苷(A)的单元和修饰的含胞嘧啶(C)的单元。
表1-“A”单元
表2-“C”单元
实施方案提供了具有针对乙型肝炎的序列非依赖性抗病毒活性的STOPS
表3-AC单元的实例
如本文所述的修饰的寡核苷酸的长度可以在宽范围内变化。在各种实施方案中,如本文所述的修饰的寡核苷酸包含交替的A单元和C单元的至少部分硫代磷酸化的序列,其具有约8个单元、约10个单元、约12个单元、约14个单元、约16个单元、约18个单元、约20个单元、约24个单元、约30个单元、约34个单元、约36个单元、约38个单元、约40个单元、约44个单元、约50个单元、约60个单元、约76个单元、约100个单元、约122个单元、约124个单元、约150个单元、约172个单元、约200个单元的序列长度或者范围在上述值的任何两个之间的序列长度。例如,在实施方案中,交替的A单元和C单元的至少部分硫代磷酸化的序列具有范围为8个单元至200个单元的序列长度。在另一个实施方案中,交替的A单元和C单元的至少部分硫代磷酸化的序列具有在以下范围中的任何一个或多个(适用时)的序列长度:约8个单元至约36个单元;约16个单元至约36个单元;20个单元至36个单元;16个单元至30个单元;18个单元至60个单元;20个单元至30个单元;30个单元至50个单元;34个单元至46个单元,36个单元至44个单元;44个单元至200个单元;44个单元至150个单元;44个单元至120个单元;50个单元至200个单元;50个单元至150个单元;50个单元至120个单元;60个单元至200个单元;60个单元至150个单元;和/或60个单元至120个单元。
如本文别处所述,在一些实施方案中,修饰的寡核苷酸可以包含单个交替的A单元和C单元的至少部分硫代磷酸化的序列,或者在其它实施方案中,修饰的寡核苷酸可以包含连接在一起的多个交替的A单元和C单元的至少部分硫代磷酸化的序列。因此,含有单个交替的A单元和C单元的至少部分硫代磷酸化的序列的修饰的寡核苷酸可以具有与该序列相同的序列长度。此种序列长度的实例在本文别处描述。类似地,含有多个交替的A单元和C单元的至少部分硫代磷酸化的序列的修饰的寡核苷酸可以具有这样的序列长度,其是连接本文别处所述的那些序列的结果。含有多个交替的A单元和C单元的至少部分硫代磷酸化的序列的修饰的寡核苷酸的序列长度的实例在本文别处以各个序列的长度表示,并且也考虑了连接基团的长度。
如本文所述的修饰的寡核苷酸可以包含多个交替的A单元和C单元的至少部分硫代磷酸化的序列。在实施方案中,当交替的A单元和C单元的序列包含Ribo-A单元时,该序列还包含至少一个不是Ribo-A单元的A单元。类似地,在实施方案中,当交替的A单元和C单元的序列包含Ribo-C单元时,该序列还包含至少一个不是Ribo-C单元的C单元。在实施方案中,修饰的寡核苷酸可以含有不是A单元或C单元的多种核苷酸单元(本领域技术人员已知的,例如,胸腺嘧啶、胞嘧啶、腺嘌呤、鸟嘌呤及其修饰形式)中的一种或多种,例如,作为末端基团和/或作为两个或更多个交替的A单元和C单元的至少部分硫代磷酸化的序列之间的连接基团。例如,在实施方案中,修饰的寡核苷酸包含一个或多个胞嘧啶单元,其将两个或更多个交替的A单元和C单元的至少部分硫代磷酸化的序列连接在一起。在实施方案中,通过非A/非C连接基团连接在一起的两个或更多个交替的A单元和C单元的至少部分硫代磷酸化的序列彼此相同。这种修饰的寡核苷酸的实例是(AC)
修饰的寡核苷酸可以含有两个或更多个不同的A基团和/或两个或更多个不同的C基团。当A或C基团被不同的A或C基团替代时,这种替代通常不被认为中断A单元和C单元的交替序列。例如,在实施方案中,至少一些A单元在核糖环上不是2’-O甲基化的和/或至少一些C单元在核糖环上不是2’-O甲基化的。然而,在一些实施方案中,连接两个交替的A单元和C单元的至少部分硫代磷酸化的序列的基团本身是中断A单元和C单元的交替序列的A单元或C单元。例如,交替的A单元和C单元的至少部分硫代磷酸化的16-mer可以通过A单元与另一个此类16-mer连接以形成(AC)
在实施方案中,修饰的寡核苷酸包含5’封端。在各种实施方案中,5’封端选自
在其它实施方案中,修饰的寡核苷酸包含3’和/或5’连接基团。例如,对于包含如本文所述的A单元和C单元,如分别是表1和2的A单元和C单元的修饰的寡核苷酸化合物,至少一个末端
在各种实施方案中,修饰的寡核苷酸中的两个、三个、四个或更多个可以以各种方式彼此连接。例如,修饰的寡核苷酸可以通过3’和/或5’连接基团首尾相连,和/或连接基团可以连接到多个修饰的寡核苷酸的一个3’或5’末端,例如,如图1和2所示。
在各种实施方案中,修饰的寡核苷酸还包含通过连接基团与修饰的寡核苷酸连接的靶向配体。例如,在各种实施方案中,靶向配体是或包含N-乙酰半乳糖胺(GalNac)(例如,三触角-GalNAc)、生育酚或胆固醇。图3A和3B说明了具有分别通过5’TEG连接基团和3’TEG连接基团连接的胆固醇的修饰的寡核苷酸的实施方案。图3C和3D说明了具有分别通过5’TEG连接基团和3’TEG连接基团连接的生育酚(维生素E)的修饰的寡核苷酸的实施方案。图4A和4B说明了具有通过连接基团连接的GalNac的修饰的寡核苷酸的实施方案。在实施方案中,GalNac是三触角GalNac。
在各种实施方案中,交替的A单元和C单元的至少部分硫代磷酸化的序列可以包括对一个或多个硫代磷酸化的连键的修饰。包含这种修饰的连键通常不被认为中断A单元和C单元的交替序列,因为本领域技术人员理解这种序列可以是仅部分地硫代磷酸化的,因此可以包括对硫代磷酸酯连键的一个或多个修饰。在各种实施方案中,对硫代磷酸酯连键的修饰是修饰的连键,其选自磷酸二酯、二硫代磷酸酯、甲基膦酸酯、硫代二磷酸酯和二磷酸二酯。例如,在实施方案中,修饰的连键是磷酸二酯连键。
在各种实施方案中,交替的A单元和C单元的至少部分硫代磷酸化的序列可以具有不同程度的硫代磷酸化。例如,在实施方案中,交替的A单元和C单元的至少部分硫代磷酸化的序列是至少50%、55%、60%、65%、70%、75%、80%、85%、90%或95%硫代磷酸化的。在实施方案中,交替的A单元和C单元的至少部分硫代磷酸化的序列是至少85%硫代磷酸化的。在实施方案中,交替的A单元和C单元的至少部分硫代磷酸化的序列是完全硫代磷酸化的。
在各种实施方案中,交替的A单元和C单元的至少部分硫代磷酸化的序列可以包含对一个或多个硫代磷酸化的连键的立体化学修饰。在实施方案中,本文所述的修饰的寡核苷酸可以包含至少一个立体化学限定的硫代磷酸酯连键。在各种实施方案中,立体化学限定的硫代磷酸酯连键具有R构型。在各种实施方案中,立体化学限定的硫代磷酸酯连键具有S构型。
本领域技术人员将认识到,包含如本文所述的A单元和C单元,分别如表1和2的A单元和C单元,的修饰的寡核苷酸化合物含有A单元和C单元之间的内部连键以及3’和5’末端的端基。因此,对于本文所述的A单元和C单元,分别如表1和2的A单元和C单元,每个
如上所述,本文所述的STOPS
在各种实施方案中,如本文所述的包含交替的A单元和C单元的至少部分硫代磷酸化的序列的修饰的寡核苷酸具有如通过HBsAg分泌测定所确定的针对乙型肝炎的序列非依赖性抗病毒活性,其在小于30纳摩尔(nM)的“A”活性范围内;在30nM至小于100nM的“B”活性范围内;在100nM至小于300nM的“C”活性范围内;或者在大于300nM的“D”活性范围内。在一些实施方案中,如本文所述的包含交替的A单元和C单元的至少部分硫代磷酸化的序列的修饰的寡核苷酸具有如通过HBsAg分泌测定所确定的小于50nM的针对乙型肝炎的序列非依赖性抗病毒活性。
本文所述的修饰的寡核苷酸可以以各种复合物的形式制备。因此,实施方案提供了如本文所述的修饰的寡核苷酸的螯合物。例如,在实施方案中,此类螯合物包括修饰的寡核苷酸的钙、镁或锌螯合物。本文所述的修饰的寡核苷酸也可以以各种单价抗衡离子复合物的形式制备。例如,在实施方案中,此类抗衡离子复合物包括修饰的寡核苷酸的锂、钠或钾复合物。
实施方案提供了具有针对乙型肝炎的序列非依赖性抗病毒活性的修饰的寡核苷酸或其复合物,其包含如本文所述的交替的A单元和C单元的至少部分硫代磷酸化的序列,其中:
交替的A单元和C单元的至少部分硫代磷酸化的序列是至少85%硫代磷酸化的;
交替的A单元和C单元的至少部分硫代磷酸化的序列具有范围为36个单元至44个单元的序列长度;
A单元包含至少12个2’-OMe-A单元(例如,至少15个2’-OMe-A单元)和至少1个Ribo-A单元(例如,至少2个Ribo-A单元);
C单元包含至少15个LNA-5mC单元;以及
修饰的寡核苷酸具有如通过HBsAg分泌测定所确定的小于100nM(例如,小于50nM或小于30nM)的EC
实施方案提供了具有针对乙型肝炎的序列非依赖性抗病毒活性的修饰的寡核苷酸或其复合物,其包含如本文所述的交替的A单元和C单元的至少部分硫代磷酸化的序列,其中:
交替的A单元和C单元的至少部分硫代磷酸化的序列是至少85%硫代磷酸化的;
交替的A单元和C单元的至少部分硫代磷酸化的序列具有范围为36个单元至44个单元的序列长度;
A单元包含至少15个2’-OMe-A单元;
C单元包含至少7个LNA-5mC单元;以及
修饰的寡核苷酸具有如通过HBsAg分泌测定所确定的小于100nM(例如,小于50nM或小于30nM)的EC
实施方案提供了具有针对乙型肝炎的序列非依赖性抗病毒活性的修饰的寡核苷酸或其复合物,其包含如本文所述的交替的A单元和C单元的至少部分硫代磷酸化的序列,其中:
交替的A单元和C单元的至少部分硫代磷酸化的序列是至少85%硫代磷酸化的;
交替的A单元和C单元的至少部分硫代磷酸化的序列具有范围为36个单元至44个单元的序列长度;
A单元包含至少15个2’-OMe-A单元;
C单元包含至少3个LNA-5mC单元;以及
修饰的寡核苷酸具有如通过HBsAg分泌测定所确定的小于100nM(例如,小于50nM或小于30nM)的EC
实施方案提供了具有针对乙型肝炎的序列非依赖性抗病毒活性的修饰的寡核苷酸或其复合物,其包含如本文所述的交替的A单元和C单元的至少部分硫代磷酸化的序列,其中:
交替的A单元和C单元的至少部分硫代磷酸化的序列是至少85%硫代磷酸化的;
交替的A单元和C单元的至少部分硫代磷酸化的序列具有范围为36个单元至44个单元的序列长度;
A单元包含至少18个2’-OMe-A单元;
C单元包含至少15个LNA-5mC单元;以及
修饰的寡核苷酸具有如通过HBsAg分泌测定所确定的小于100nM(例如,小于50nM或小于30nM)的EC
本文所述的修饰的寡核苷酸可以以各种方式制备。在实施方案中,通过应用标准亚磷酰胺化学,使用表4和5中所述的结构单元单体来制备本文所述的修饰的寡核苷酸。表4和5中所述的结构单元和其它结构单元亚磷酰胺单体可以通过已知的方法制备或从商业来源(Thermo Fischer Scientific US,Hongene Biotechnology USA Inc.,ChemgenesCorporation)获得。在下面的实施例中阐述了用于制备修饰的寡核苷酸的示例性程序。
表4-“A”单元的结构单元
表5-“C”单元的结构单元
在各种实施方案中,本文所述的STOPS
实施方案提供了二核苷酸,其包含通过立体化学限定的硫代磷酸化的连键连接的A单元和C单元或者由其组成,其中所述A单元选自表4中所述的任何结构单元单体,所述C单元选自表5中所述的任何结构单元单体,并且其中每个
在各种实施方案中,式(A)的R
在另一个实施方案中,
在各种实施方案中,式(B1)和(B2)的R
各种实施方案提供了制备如本文所述的修饰的寡核苷酸的方法,其包括偶联如本文所述的一个或多个二核苷酸。在以下实施例中说明了进行此类偶联的示例性方法。
本文所述的一些实施方案涉及药物组合物,其可包含有效量的本文所述的化合物(例如如本文所述的STOPS
如本文所用,“载体”是指促进化合物掺入细胞或组织中的化合物。例如,但不限于,二甲亚砜(DMSO)是通常使用的载体,其促进许多有机化合物摄取到对象的细胞或组织中。
如本文所用,“稀释剂”是指药物组合物中缺乏药理学活性但可能是药学上必需的或期望的成分。例如,稀释剂可用于增加有效药物的体积,所述有效药物的质量对于制造和/或施用而言太小。它也可以是用于通过注射、摄取或吸入施用的药物的溶解的液体。本领域中稀释剂的常见形式是缓冲水溶液,如但不限于模拟人血液组成的磷酸盐缓冲盐水。
如本文所用,“赋形剂”是指添加到药物组合物中以向组合物提供(但不限于)体积、稠度、稳定性、结合能力、润滑性、崩解能力等的惰性物质。“稀释剂”是一种类型的赋形剂。
适当的制剂取决于所选的施用途径。用于配制和施用本文所述的化合物的技术是本领域技术人员已知的。本领域存在多种施用化合物的技术,包括但不限于口服、直肠、局部、气溶胶、注射和肠胃外递送,包括肌内、皮下、静脉内、髓内注射、鞘内、直接心室内、腹膜内、鼻内和眼内注射。药物组合物通常根据具体的预期施用途径进行调整。
还可以以局部方式而不是全身方式施用化合物,例如,通过将化合物直接注射到感染区域中,任选地在贮库或持续释放制剂中。此外,可以在靶向药物递送系统中,例如在用组织特异性抗体包被的脂质体中施用化合物。脂质体可以靶向器官并被器官选择性地吸收。
本文公开的药物组合物可以以本身已知的方式,例如通过常规的混合、溶解、制粒、制糖衣丸、研磨、乳化、封装、包埋或压片过程制备。如本文所述,用于药物组合物中的化合物可以作为与药学上相容的抗衡离子的盐提供。
本文所述的一些实施方案涉及治疗HBV和/或HDV感染的方法,其可以包括向被鉴定为患有HBV和/或HDV感染的对象施用有效量的如本文所述的修饰的寡核苷酸或其复合物,或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物。本文所述的其它实施方案涉及在制备用于治疗HBV和/或HDV感染的药物中使用如本文所述的修饰的寡核苷酸或其复合物。本文所述的其它实施方案涉及如本文所述的修饰的寡核苷酸或其复合物或者包含如本文所述的修饰的寡核苷酸的药物组合物用于治疗HBV和/或HDV感染的用途。
可使用各种途径将修饰的寡核苷酸或其复合物施用至有需要的对象,如本文别处所示。在实施方案中,将修饰的寡核苷酸或其复合物通过肠胃外途径施用至所述对象。例如,在实施方案中,将修饰的寡核苷酸或其复合物静脉内施用至所述对象。在另一个实施方案中,将修饰的寡核苷酸或其复合物皮下施用至所述对象。令人惊奇的是,现在已经发现,如本文所述的修饰的寡核苷酸或其复合物的实施方案可以以对治疗安全和有效的量皮下施用至灵长类动物。先前,因为认为获得功效所需的相对高的剂量和伴随的安全问题(如不希望的注射部位反应)的潜在风险增加,所以将修饰的寡核苷酸或其复合物皮下施用(如REP 2139、REP 2055或美国专利第7,358,068号;第8,008,269号;第8,008,270号和第8,067,385号中描述的那些)至灵长类动物被认为未必是安全的和有效的。因此,例如,涉及向人类施用REP 2139的先前临床研究被认为仅利用静脉内途径。在被认为是功效所必需的剂量水平下,认为安全问题如不希望的注射部位反应将阻止皮下施用。
出乎意料地,如图12和下面的实施例B5所示,现在已经发现,在皮下施用至非人灵长类动物后的肝脏暴露远高于基于由在其它方面相当的静脉内给药产生的肝脏暴露水平所预期的。该发现意味着如本文所述的修饰的寡核苷酸或其复合物的实施方案,特别是如本文所述的高效的STOPS
本文公开的一些实施方案涉及治疗HBV和/或HDV感染的方法,其可以包括使感染HBV和/或HDV的细胞与有效量的如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物接触。在实施方案中,此类治疗HBV和/或HDV感染的方法包括以低于基于在其它方面相当的静脉内施用后观察到的肝脏水平而另外预期的剂量向人类安全且有效地皮下施用修饰的寡核苷酸或其复合物。例如,在实施方案中,修饰的寡核苷酸或其复合物是REP-2139或其复合物。在另一个实施方案中,修饰的寡核苷酸或其复合物包含如本文所述的高效的STOPS
本文所述的其它实施方案涉及在制备用于治疗HBV和/或HDV感染的药物中使用如本文所述的修饰的寡核苷酸或其复合物。本文所述的其它实施方案涉及如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物用于治疗HBV和/或HDV感染的用途。在实施方案中,此类用途包括以低于基于在其它方面相当的静脉内施用后观察到的肝脏水平而另外预期的剂量向人类安全且有效地皮下施用修饰的寡核苷酸或其复合物。例如,在实施方案中,修饰的寡核苷酸或其复合物是REP-2139或其复合物。在另一个实施方案中,修饰的寡核苷酸或其复合物包含如本文所述的高效的STOPS
本文公开的一些实施方案涉及抑制HBV和/或HDV复制的方法,其可以包括使感染HBV和/或HDV的细胞与有效量的如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物接触。在实施方案中,此类抑制HBV和/或HDV复制的方法包括以低于基于在其它方面相当的静脉内施用后观察到的肝脏水平而另外预期的剂量向人类安全且有效地皮下施用修饰的寡核苷酸或其复合物。例如,在实施方案中,修饰的寡核苷酸或其复合物是REP-2139或其复合物。在另一个实施方案中,修饰的寡核苷酸或其复合物包含如本文所述的高效的STOPS
本文所述的其它实施方案涉及在制备用于抑制HBV和/或HDV复制的药物中使用如本文所述的修饰的寡核苷酸或其复合物。本文所述的其它实施方案涉及如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物用于抑制HBV和/或HDV的复制的用途。在实施方案中,此类用于抑制HBV和/或HDV复制的用途包括以低于基于在其它方面相当的静脉内施用后观察到的肝脏水平而另外预期的剂量向人类安全且有效地皮下施用修饰的寡核苷酸或其复合物。例如,在实施方案中,修饰的寡核苷酸或其复合物是REP-2139或其复合物。在另一个实施方案中,修饰的寡核苷酸或其复合物包含如本文所述的高效的STOPS
在一些实施方案中,HBV感染可以是急性HBV感染。在一些实施方案中,HBV感染可以是慢性HBV感染。
本文公开的一些实施方案涉及治疗由于HBV和/或HDV感染而发展的肝硬化的方法,其可以包括向患有肝硬化的对象施用有效量的如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物和/或使患有肝硬化的对象中的HBV和/或HDV感染的细胞与有效量的如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物接触。在实施方案中,此类治疗由于HBV和/或HDV感染而发展的肝硬化的方法包括以低于基于在其它方面相当的静脉内施用后观察到的肝脏水平而另外预期的剂量向人类安全且有效地皮下施用修饰的寡核苷酸或其复合物。例如,在实施方案中,修饰的寡核苷酸或其复合物是REP-2139或其复合物。在另一个实施方案中,修饰的寡核苷酸或其复合物包含如本文所述的高效的STOPS
本文所述的其它实施方案涉及在制备用于治疗由于HBV和/或HDV感染而发展的肝硬化的药物中使用如本文所述的修饰的寡核苷酸或其复合物,所述药物具有有效量的修饰的寡核苷酸。本文所述的其它实施方案涉及如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物用于治疗由于HBV和/或HDV感染而发展的肝硬化的用途。在实施方案中,此类用于治疗肝硬化的用途包括以低于基于在其它方面相当的静脉内施用后观察到的肝脏水平而另外预期的剂量向人类安全且有效地皮下施用修饰的寡核苷酸或其复合物。例如,在实施方案中,修饰的寡核苷酸或其复合物是REP-2139或其复合物。在另一个实施方案中,修饰的寡核苷酸或其复合物包含如本文所述的高效的STOPS
本文公开的一些实施方案涉及治疗由于HBV和/或HDV感染而发展的肝癌(如肝细胞癌)的方法,其可以包括向患有肝癌的对象施用有效量的如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物和/或使患有肝癌的对象中的HBV和/或HDV感染的细胞与有效量的如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物接触。在实施方案中,此类治疗由于HBV和/或HDV感染而发展的肝癌(如肝细胞癌)的方法包括以低于基于在其它方面相当的静脉内施用后观察到的肝脏水平而另外预期的剂量向人类安全且有效地皮下施用修饰的寡核苷酸或其复合物。例如,在实施方案中,修饰的寡核苷酸或其复合物是REP-2139或其复合物。在另一个实施方案中,修饰的寡核苷酸或其复合物包含如本文所述的高效的STOPS
本文所述的其它实施方案涉及在制备用于治疗由于HBV和/或HDV感染而发展的肝癌(如肝细胞癌)的药物中使用如本文所述的修饰的寡核苷酸或其复合物。本文所述的其它实施方案涉及如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物用于治疗由于HBV和/或HDV感染而发展的肝癌(如肝细胞癌)的用途。在实施方案中,此类用于治疗肝癌(如肝细胞癌)的用途包括以低于基于在其它方面相当的静脉内施用后观察到的肝脏水平而另外预期的剂量向人类安全且有效地皮下施用修饰的寡核苷酸或其复合物。例如,在实施方案中,修饰的寡核苷酸或其复合物是REP-2139或其复合物。在另一个实施方案中,修饰的寡核苷酸或其复合物包含如本文所述的高效的STOPS
本文公开的一些实施方案涉及治疗由于HBV和/或HDV感染而发展的肝衰竭的方法,其可以包括向患有肝衰竭的对象施用有效量的如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物和/或使患有肝衰竭的对象中的HBV和/或HDV感染的细胞与有效量的如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物接触。在实施方案中,此类治疗由于HBV和/或HDV感染而发展的肝衰竭的方法包括以低于基于在其它方面相当的静脉内施用后观察到的肝脏水平而另外预期的剂量向人类安全且有效地皮下施用修饰的寡核苷酸或其复合物。例如,在实施方案中,修饰的寡核苷酸或其复合物是REP-2139或其复合物。在另一个实施方案中,修饰的寡核苷酸或其复合物包含如本文所述的高效的STOPS
本文所述的其它实施方案涉及在制备用于治疗由于HBV和/或HDV感染而发展的肝衰竭的药物中使用如本文所述的修饰的寡核苷酸或其复合物。本文所述的其它实施方案涉及如本文所述的修饰的寡核苷酸或其复合物或者包含有效量的如本文所述的修饰的寡核苷酸或其复合物的药物组合物用于治疗由于HBV和/或HDV感染而发展的肝衰竭的用途。在实施方案中,此类用于治疗肝衰竭的用途包括以低于基于在其它方面相当的静脉内施用后观察到的肝脏水平而另外预期的剂量向人类安全且有效地皮下施用修饰的寡核苷酸或其复合物。例如,在实施方案中,修饰的寡核苷酸或其复合物是REP-2139或其复合物。在另一个实施方案中,修饰的寡核苷酸或其复合物包含如本文所述的高效的STOPS
用于确定治疗HBV和/或HDV感染的方法的有效性的各种指标也是本领域技术人员已知的。合适的指标的实例包括但不限于通过HBV DNA(或载量)、HBV表面抗原(HBsAg)和HBV e-抗原(HBeAg)的减少指示的病毒载量的减少,血浆病毒载量的减少,病毒复制的减少,血清转化时间的减少(在患者血清中检测不到病毒),对治疗的持续病毒应答的速率的增加,肝功能的改善和/或临床结果中的发病率或死亡率的降低。
在一些实施方案中,如本文所述的修饰的寡核苷酸或其复合物的有效量是在治疗完成之后12个月有效实现持续的病毒学应答,例如持续的病毒应答的量。
临床上诊断具有HBV和/或HDV感染的对象包括“初始”对象(例如,先前未治疗HBV和/或HDV的对象)和先前治疗HBV和/或HDV失败的对象(“治疗失败”的对象)。治疗失败的对象包括“无应答者”(ALT水平未达到足够降低的对象,例如,在开始抗HBV和/或抗HDV治疗的6个月内未达到从基线的超过1log10降低的对象)和“复发者”(先前针对ALT水平增加的HBV和/或HDV治疗的对象,例如,ALT>正常上限的两倍,并且通过杂交测定可检测到的血清HBVDNA)。对象的其它实例包括具有无症状的HBV和/或HDV感染的对象。
在一些实施方案中,可以将如本文所述的修饰的寡核苷酸或其复合物提供给患有HBV和/或HDV的治疗失败的对象。在一些实施方案中,可以将如本文所述的修饰的寡核苷酸或其复合物提供给患有HBV和/或HDV的无应答对象。在一些实施方案中,可以将如本文所述的修饰的寡核苷酸或其复合物提供给患有HBV和/或HDV的复发者对象。在一些实施方案中,对象可以患有HBeAg阳性的慢性乙型肝炎。在一些实施方案中,对象可以患有HBeAg阴性的慢性乙型肝炎。在一些实施方案中,对象可以患有肝硬化。在一些实施方案中,对象可以是无症状的,例如,对象可以感染HBV和/或HDV,但不表现出病毒感染的任何症状。在一些实施方案中,对象可以是免疫受损的。在一些实施方案中,对象可以进行化疗。
已经用于治疗HBV和/或HDV的药剂的实例包括干扰素(如IFN-α和包含PEG-IFN-α-2a的聚乙二醇化的干扰素)和核苷/核苷酸(如拉米夫定、替比夫定、阿德福韦酯、克立夫定、恩替卡韦、替诺福韦艾拉酚胺和替诺福韦酯)。然而,与干扰素治疗相关的一些缺点是不利的副作用,需要皮下施用和高成本。核苷/核苷酸治疗的缺点可能是抗性的发展。
抗性可能是治疗失败的一种原因。本文所用的术语“抗性”是指对抗病毒剂显示延迟、减弱和/或无效应答的病毒毒株。在一些实施方案中,可以将如本文所述的修饰的寡核苷酸或其复合物提供给感染HBV和/或HDV毒株的对象,所述HBV和/或HDV毒株对一种或多种抗HBV和/或抗HDV剂具有抗性。其中可发展抗性的抗病毒剂的实例包括拉米夫定、替比夫定、阿德福韦酯、克立夫定、恩替卡韦、替诺福韦艾拉酚胺和替诺福韦酯。在一些实施方案中,与对其它HBV和/或HDV抗病毒剂(如所述的那些)具有抗性的HBV和/或HDV毒株的发展相比,当用如本文所述的修饰的寡核苷酸治疗对象时,延迟了抗性HBV和/或HDV毒株的发展。
在一些实施方案中,如本文所述的修饰的寡核苷酸或其复合物可以与一种或多种另外的药剂组合用于治疗和/或抑制HBV和/或HDV的复制。另外的药剂包括但不限于干扰素、核苷/核苷酸类似物、衣壳组装调节剂、序列特异性寡核苷酸(如反义寡核苷酸和/或siRNA)、进入抑制剂和/或小分子免疫调节剂。例如,在实施方案中,如本文所述的修饰的寡核苷酸或其复合物可以用作与一种或多种用于HBV的第二治疗组合的第一治疗,其中第二治疗包含具有针对乙型肝炎的序列非依赖性抗病毒活性的第二寡核苷酸、siRNA寡核苷酸(或核苷酸)、反义寡核苷酸、核苷、干扰素、免疫调节剂、衣壳组装调节剂或其组合。另外的药剂的实例包括重组干扰素α2b、IFN-α、PEG-IFN-α-2a、拉米夫定、替比夫定、阿德福韦酯、克立夫定、恩替卡韦、替诺福韦艾拉酚胺、替诺福韦酯、JNJ-3989(ARO-HBV)、RG6004、GSK3228836、AB-729、VIR-2218、DCR-HBVS、JNJ-6379、GLS4、ABI-HO731、JNJ-440、NZ-4、RG7907、AB-423、AB-506和ABI-H2158。在实施方案中,另外的药剂是衣壳组装调节剂(CAM)。在实施方案中,另外的药剂是反义寡核苷酸(ASO)。
在一些实施方案中,如本文所述的修饰的寡核苷酸或其复合物可以与一种或多种另外的药剂一起在单一药物组合物中施用。在一些实施方案中,如本文所述的修饰的寡核苷酸或其复合物可以与一种或多种另外的药剂作为两种或更多种单独的药物组合物施用。此外,如本文所述的修饰的寡核苷酸或其复合物与一种或多种另外的药剂的施用顺序可以变化。
实施例
在下面的实施例中更详细地公开了另外的实施方案,这些实施方案不以任何方式意图限制权利要求的范围。
实施例1-116
在ABI 394合成仪上使用标准亚磷酰胺化学合成了一系列含有交替的A单元和C单元的硫代磷酸化的序列的修饰的寡核苷酸。固体支持物是可控孔度玻璃(CPG,1000A,GlenResearch,Sterling VA),并且结构单元单体描述在表4和5中。将试剂(二甲基氨基-亚甲基)氨基)-3H-1,2,4-二噻唑啉-3-硫酮(DDTT)用作硫转移剂来合成寡核糖核苷酸硫代磷酸酯(PS连键)。在5-(乙硫基)-1H-四唑活化剂的存在下,将0.1M亚磷酰胺在CH
在合成完成之后,将可控孔度玻璃(CPG)转移到螺帽小瓶或螺帽无RNA酶的微量离心管中。在55℃下,用1.0mL乙醇氨(氨:乙醇(3:1))的混合物处理5-15小时,将寡核苷酸从支持物上裂解,同时去保护碱基和磷酸基团。将小瓶在冰上短暂冷却,然后将乙醇氨的混合物转移到新的微量离心管中。用2×0.1mL部分的去离子水洗涤CPG,放入干冰中10分钟,然后在速度真空中干燥。
将样品溶解在去离子水(1.0mL)中并如下定量:首先仅以水(1mL)进行空白测量(blanking)。将20μl样品和980μL水在微量离心管中充分混合,转移到比色皿中,在260nm处获得吸光度读数。将粗材料干燥并储存在-20℃。
通过HPLC(Dionex PA 100)分析和纯化粗寡聚物。缓冲体系是A=水B=0.25MTris-HCl pH8,C:0.375M钠/氯酸盐,流速5.0mL/min,波长260nm。首先上样少量材料(~5OD)并通过LC-MS分析。一旦确认了这种材料的特性,则可以使用较大量的材料,例如60OD/运行,5mL/min的流速来纯化粗寡聚物。然后将含有全长寡核苷酸的级分汇集在一起,蒸发并最终如下所述脱盐。
然后使用Sephadex G-25M(Amersham Biosciences)将纯化的干燥寡聚物脱盐。用10mL水调节小柱(cartridge)。将完全溶解在2.5mL无RNA酶的水中的纯化的寡聚物以非常缓慢的逐滴洗脱施加到小柱上。将无盐的寡聚物用3.5ml水直接洗脱到螺帽小瓶中。
首先将大约0.2OD的寡聚物干燥,重新溶解在水(50μl)中,然后用移液器吸取到特殊小瓶中用于HPLC和LC-MS分析。
表6总结了所得的示例性修饰的寡核苷酸的序列长度,交替的A单元和C单元以及主链是硫代磷酸酯(PS)还是磷酸二酯(PO)。
表6
实施例117-130
通过按照以上实施例1-116中所述的方法制备一系列硫代磷酸化的寡核苷酸来评价5’修饰的影响。通过使用5’-乙烯基膦酸酯结构单元掺入5’-乙烯基膦酸酯封端来制备封端的寡核苷酸:
参考图7,如下制备5’-乙烯基膦酸酯结构单元(5’-VP)。
化合物7-2的制备:向7-1(15.0g,53.3mmol)在无水吡啶(150mL)中的溶液中加入TBSCl(20.0g,133.3mmol)和咪唑(10.8g,159.9mmol)。将混合物在室温下搅拌15h。TLC显示7-1被完全消耗。将反应混合物真空浓缩,得到残余物。将残余物用DCM(500mL)猝灭。将DCM层用H
化合物7-3的制备:在5℃下,向7-2(26.2g,51.3mmol)在吡啶(183mL)中的溶液中滴加苯甲酰氯(15.8g,113.0mmol)。将反应混合物在室温下搅拌2小时。TLC显示7-2被完全消耗。将反应混合物用H
化合物7-4的制备:在0℃下,向7-3(44.0g,粗品)在THF(440mL)中的混合物溶液中加入H
化合物7-5的制备:在室温下向500mL圆底烧瓶中依次加入DMSO(132mL)和7-4(13.2g,26.4mmol)、EDCI(15.19g,79.2mmol)。然后将吡啶(2.09g,26.4mmol,2.1mL)加入到反应混合物中。在搅拌5分钟之后,向反应混合物中加入TFA(1.51g,13.2mmol)。然后将反应混合物在室温下搅拌3小时。LC-MS显示7-4被完全消耗。将反应混合物加入到冰水(500mL)中并用EA(300mL*3)萃取3次。将合并的EA层用H
化合物7-6的制备:在0℃下,将5A(24.4g,38.5mmol)加入到NaH(2.5g,64.3mmol,60%纯度)在THF(50mL)中的混合物溶液中。在搅拌15分钟之后,将THF(60mL)中的7-5(16.0g,32.1mmol)加入到反应混合物中。然后将反应混合物在室温下搅拌1小时。LC-MS显示7-5被完全消耗。然后将反应混合物用饱和NH
化合物7-7的制备:向500mL圆底烧瓶中依次加入7-6(9.0g,11.2mmol)和H
化合物5’-VP的制备:向7-7(5.5g,7.9mmol)在DCM(55mL)中的溶液中加入DCI(750mg,6.3mmol),然后加入CEP[N(iPr)
表7总结了所得的示例性修饰的硫代磷酸化的寡核苷酸的序列长度、交替的A单元和C单元和5’修饰。
表7
实施例131-174
通过根据以上实施例1-116中所述的方法制备一系列的硫代磷酸化的寡核苷酸来评价序列长度、LNA掺入和5’-修饰的影响。表8总结了所得的示例性修饰的硫代磷酸化的寡核苷酸的序列长度、交替的A单元和C单元、5’修饰以及LNA单元的长度和位置。
表8
实施例175-216
通过根据以上实施例1-116中所述的方法制备一系列的硫代磷酸化的寡核苷酸来评价序列长度、LNA掺入、立体化学修饰和5’修饰的影响,不同之处在于通过使用由A单元和C单元组成的二核苷酸结构单元的改进的方法来制备寡核苷酸,所述A单元和C单元通过如下立体化学限定的硫代磷酸酯连键连接:
参考图8、9A和9B,二核苷酸结构单元9R和9S如下制备。
化合物8-2的制备:在室温下,在氮气惰性气氛下,向8-1(300.0g,445.1mmol)在3000mL无水二噁烷中的溶液中滴加乙酰丙酸(309.3g,2.67mol)。然后在室温下依次加入二环己基碳二亚胺(274.6g,1.33mol)和4-二甲基氨基吡啶(27.1g,222.0mmol)。将所得溶液在室温下搅拌5小时,用5000mL二氯甲烷稀释并过滤。分别用2×3000mL 2%碳酸氢钠水溶液和1×3000mL水洗涤有机相。将有机相经无水硫酸钠干燥,过滤并且在减压下浓缩。获得呈白色固体的345.0g(粗品)8-2,不经进一步纯化用于下一步骤。ESI-LCMS:m/z 774[M+H]+。
化合物8-3的制备:在0℃下,在氮气惰性气氛下,向8-2(345g,445.1mmol)溶解在3000mL二氯甲烷的溶液中滴加对甲苯磺酸(84.6g,445.1mmol)。将所得溶液在0℃下搅拌0.5h,用3000mL二氯甲烷稀释,并且分别用2×2000mL饱和碳酸氢钠水溶液和1×2000mL饱和氯化钠水溶液洗涤。将有机相经无水硫酸钠干燥,在减压下浓缩,并且将残余物通过硅胶柱色谱法(SiO
化合物8-4的制备:在0℃下,在氮气惰性气氛下,向8-3(210.0g,444.9mmol)在2000mL乙腈中的溶液中加入8-3a(360.0g,405.4mmol)和ETT(58.0g,445.9mmol)。将所得溶液在室温下搅拌2h。然后将混合物过滤,并且不经进一步纯化用于下一步骤。ESI-LCMS:m/z1258[M+H]
化合物8-5和8-6的制备:在室温下,在氮气惰性气氛下,向8-4(509.9g,405.4mmol)在2000mL乙腈中的溶液中依次加入吡啶(128.0g,1.62mol)和5-氨基-3H-1,2,4-二噻唑-3-硫酮(121.8g,810.9mmol)。将反应溶液在室温下搅拌30分钟。将所得溶液过滤并且在减压下浓缩。将残余物通过快速制备型HPLC在以下条件下(IntelFlash-1)纯化:柱,C18硅胶;在20分钟内,流动相CH
化合物9-1的制备:在0℃下,在氮气惰性气氛下,向8-5(100.0g,77.4mmol)在700mL乙腈中的溶液中加入在吡啶/乙酸(3:2)中的0.5M水合肼(20.0g,0.4mol)。将所得溶液在0℃下搅拌0.5h。然后立即向反应中加入2,4-戊二酮,使混合物升温至室温并且再搅拌15分钟。将溶液用DCM(2000mL)稀释,用饱和NH
化合物9R的制备:在室温下,在氮气惰性气氛下,向9-1(58.0g,48.6mmol)在600mL二氯甲烷中的溶液中依次加入CEP[N(iPr)
化合物9-2的制备:在0℃下,在氮气惰性气氛下,向8-6(110.0g,85.1mmol)在700mL乙腈中的溶液中加入在吡啶/乙酸(3:2)中的0.5M水合肼(21.1g,423.6mol)。将所得溶液在0℃下搅拌0.5h。然后立即向反应中加入2,4-戊二酮,使混合物升温至室温并且再搅拌15分钟。将溶液用DCM(2000mL)稀释,用饱和NH
化合物9S的制备:在室温下,在氮气惰性气氛下,向9-2(62.0g,51.9mmol)在600mL二氯甲烷中的溶液中依次加入CEP[N(iPr)
改进的方法还使用更长的偶联时间(8分钟)和更多当量的酰胺化物(8当量)。表9总结了所得的示例性修饰的硫代磷酸化的寡核苷酸的序列长度、交替的A单元和C单元、立体化学限定的硫代磷酸酯(PS)连键的数量和类型(R或S)、以及5’-修饰。
表9
实施例217-234
通过根据以上实施例175-216中所述的方法制备一系列的硫代磷酸化的寡核苷酸来评价序列长度、LNA掺入、立体化学修饰和5’修饰的影响,不同之处在于通过使用由A单元和C单元组成的二核苷酸结构单元的改进的方法来制备寡核苷酸,所述A单元和C单元通过如下立体化学限定的硫代磷酸酯连键连接:
参考图10、11A和11B,如下制备二核苷酸结构单元11R和11S:
化合物10-2的制备:在室温下,在氮气惰性气氛下,向10-1(50.0g,74.0mmol)在500mL无水二噁烷中的溶液中滴加乙酰丙酸(51.5g,44.4mol)。然后在室温下依次加入二环己基碳二亚胺(45.7g,0.2mol)和4-二甲基氨基吡啶(4.6g,37.0mmol)。将所得溶液在室温下搅拌5h,用3000mL二氯甲烷稀释并过滤。分别用2×1000mL 2%碳酸氢钠水溶液和1×1000mL水洗涤有机相。将有机相经无水硫酸钠干燥,过滤并且在减压下浓缩。获得52.0g(粗品)呈白色固体的10-2,并且不经进一步纯化用于下一步骤。ESI-LCMS:m/z 774[M+H]
化合物10-3的制备:在0℃下,在氮气惰性气氛下,向10-2(52.0g,67.0mmol)溶解在400mL二氯甲烷中的溶液中滴加对甲苯磺酸(51.5g,0.4mol)。将所得溶液在0℃下搅拌0.5h,用2000mL二氯甲烷稀释,并且分别用2×1000mL饱和碳酸氢钠水溶液和1×1000mL饱和氯化钠水溶液洗涤。将有机相用无水硫酸钠干燥,在减压下浓缩,并且将残余物通过硅胶柱色谱法(SiO
化合物10-4的制备:在0℃下,在氮气惰性气氛下,向10-3(28.0g,59.4mmol)在300mL乙腈中的溶液中加入8-3a(50.0g,56.3mmol)和ETT(7.9g,59.4mmol)。将所得溶液在室温下搅拌2h。然后将混合物过滤,并且不经进一步纯化用于下一步骤。ESI-LCMS:m/z1258[M+H]
化合物10-5和10-6的制备:在室温下,在氮气惰性气氛下,向10-4(70.9g,56.3mmol)在300mL乙腈中的溶液中依次加入吡啶(17.8g,225.2mmol)和5-氨基-3H-1,2,4-二噻唑-3-硫酮(16.9g,112.6mmol)。将反应溶液在室温下搅拌30分钟。将所得溶液过滤并且在减压下浓缩。将残余物通过快速制备型HPLC在以下条件下(IntelFlash-1)纯化:柱,C18硅胶;在20分钟内,流动相CH
化合物11-1的制备:在0℃下,在氮气惰性气氛下,向10-5(10.0g,7.7mmol)在100mL乙腈中的溶液中加入在吡啶/乙酸(3:2)中的0.5M水合肼(1.8g,37.5mmol)。将所得溶液在0℃下搅拌0.5h。然后立即向反应中加入2,4-戊二酮,使混合物升温至室温并且再搅拌15分钟。将溶液用DCM(500mL)稀释,用饱和NH
化合物11R的制备:在室温下,在氮气惰性气氛下,向11-1(6.0g,5.0mmol)在60mL二氯甲烷中的溶液中依次加入CEP[N(iPr)
化合物II-2的制备:在0℃下,在氮气惰性气氛下,向10-6(10.0g,7.7mmol)在100mL乙腈中的溶液中加入在吡啶/乙酸(3:2)中的0.5M水合肼(1.8g,37.5mmol)。将所得溶液在0℃下搅拌0.5h。然后立即向反应中加入2,4-戊二酮,使混合物升温至室温并且再搅拌15分钟。将溶液用DCM(500mL)稀释,用饱和NH
化合物11S的制备:在室温下,在氮气惰性气氛下,向11-2(7.0g,5.0mmol)在70mL二氯甲烷中的溶液中依次加入CEP[N(iPr)
如在实施例175-216中一样,改进的方法还使用更长的偶联时间(8分钟)和更多当量的酰胺化物(8当量)。表10总结了所得的示例性修饰的硫代磷酸化的寡核苷酸的序列长度、交替的A单元和C单元、立体化学限定的硫代磷酸酯(PS)连键的数量和类型(R或S)、以及5’-修饰。
表10
实施例235-240
通过制备一系列的具有分支双倍体(doubler)设计的硫代磷酸化的寡核苷酸来评价分支的影响,其中两个寡核苷酸通过连接基团彼此连接。具有双倍体设计的硫代磷酸化的寡核苷酸的实例示于图1中。表11总结了所得的示例性硫代磷酸化的寡核苷酸的序列长度、交替的A单元和C单元以及5’修饰。
表11
实施例241-246
通过制备一系列的具有分支三倍体(trebler)设计的硫代磷酸化的寡核苷酸来评价分支的影响,其中三个硫代磷酸化的寡核苷酸通过连接基团彼此连接。具有三倍体设计的硫代磷酸化的寡核苷酸的实例示于图2中。表12总结了所得的示例性硫代磷酸化的寡核苷酸的序列长度、交替的A单元和C单元以及5’修饰。
表12
实施例247-252
通过制备一系列修饰的硫代磷酸化的寡核苷酸来评价酰氨基-桥核酸(AmNA-(N-Me))修饰和螺环丙烯桥接的核酸(scp-BNA)修饰的影响。AmNA-N-Me 6-N-苯甲酰基腺苷(A
表13
实施例253-256
通过制备一系列修饰的硫代磷酸化的寡核苷酸来评价连接靶向配体的影响。按照以上实施例1-116中所述的方法,靶向配体,即胆固醇和生育酚(维生素E)通过环氧烷烃连接基团(四甘醇,TEG)连接到硫代磷酸化的寡核苷酸上,不同之处在于在胆固醇和生育酚支持物上进行固相合成,通过TEG连接子连接用于3’-缀合,而亚磷酰胺的最终偶联提供了5’-缀合的寡核苷酸。图3A-D和表14说明了所得的示例性修饰的硫代磷酸化的寡核苷酸的序列长度、交替的A单元和C单元以及靶向配体。
表14
实施例257-268
通过制备一系列修饰的硫代磷酸化的寡核苷酸来评价连接靶向配体的影响。N-乙酰半乳糖胺(GalNac)通过与如图4A示出的GalNAc结构单元反应经由各种连接基团与硫代磷酸化的寡核苷酸连接。GalNAc-3和GalNAc-5酰胺化物分别购自AM Chemicals LLC和GlenResearch。GalNAc-4和GalNAc-6获自AM Chemicals LLC。表15说明了所得的示例性修饰的硫代磷酸化的寡核苷酸的结构并且总结了所得的示例性修饰的硫代磷酸化的寡核苷酸的序列长度、交替的A单元和C单元以及靶向配体。
表15
实施例269-272
通过制备一系列修饰的硫代磷酸化的寡核苷酸来评价连接靶向配体的影响。通过制备起始寡核苷酸,通过在5’-末端连接C
在IEX纯化和脱盐之后,将前体溶解在0.2M碳酸氢钠缓冲液,pH 8.5(0.015mM)中,并加入溶解在DMSO中的5-7mol当量的GalNAc酯中。GalNAc酯的结构示于图4B中。将反应混合物在室温下搅拌4小时。分析样品以确认不存在前体。向此,加入氨水(28重量%)(5×反应体积),并在室温下搅拌2-3h。将反应混合物在减压下浓缩,将所得残余物溶解在水中,并且在强的阴离子交换柱上通过HPLC纯化。
表16说明了所得的示例性修饰的硫代磷酸化的寡核苷酸的结构并且总结了所得的示例性修饰的硫代磷酸化的寡核苷酸的序列长度、交替的A单元和C单元以及靶向配体。分别按照J.Med.Chem.201659(6)2718-2733和WO 2017/021385A1中所述的程序制备GalNAc-1和GalNAc-2。
表16
实施例273-281
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价5’修饰的影响,不同之处在于使用以下5’-乙基膦酸酯(EP)结构单元来掺入5’-乙基膦酸酯封端:
参考图5,如下制备5’-乙基膦酸酯结构单元。
在N
向5-2(2.3g,3.33mmol,1当量)在DCM(30mL)中的溶液中加入1H-咪唑-4,5-二甲腈(589.06mg,4.99mmol,1.5当量),然后加入3-双(二异丙基氨基)膦酰基氧基丙腈(2.00g,6.65mmol,2.11mL,2.0当量),并将混合物在25℃下搅拌2小时。TLC显示大部分5-2被消耗并且形成一个主要的新斑点。将反应混合物用H
表17总结了所得的示例性5’-EP封端的修饰的硫代磷酸化的寡核苷酸的序列长度、交替的A单元和C单元、立体化学限定的硫代磷酸酯(PS)连键的数量和类型(R或S)以及LNA修饰。
表17
实施例282-298
图6A描述了化合物编号282-295,其按照上述方法制备。
实施例296-304
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价序列长度、LNA掺入和RNA掺入的影响。结果总结在表18中。
表18
实施例305-313
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价序列长度、LNA掺入和主链的影响。结果总结在表19中。
表19
实施例314-322
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价序列长度、LNA掺入和膦酸乙酯封端的影响。结果总结在表20中。
表20
实施例323-324
通过按照上述方法制备硫代磷酸化的寡核苷酸来评价LNA掺入和磷酸封端的影响。结果总结在表21中。
表21
实施例325-338
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价LNA掺入水平的影响。结果总结在表22中。
表22
实施例339-340
通过按照上述方法制备硫代磷酸化的寡核苷酸来评价ScpA和AmNA掺入的影响。结果总结在表23中。
表23
实施例341-346
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价GNA和UNA掺入的影响。结果总结在表24中。
表24
实施例347-350
通过按照上述方法制备一系列修饰的硫代磷酸化的寡核苷酸来评价连接靶向配体的影响。结果总结在表25中。
表25
实施例351-355
通过按照上述方法制备一系列修饰的硫代磷酸化的寡核苷酸来评价连接胆固醇或生育酚靶向配体的影响。结果总结在表26中。
表26
实施例356-358
通过按照上述方法制备硫代磷酸化的寡核苷酸来评价封端结构(甲基、烯丙基、胞嘧啶)的影响。结果总结在表27中。
表27
实施例359-362
通过按照上述方法制备硫代磷酸化的寡核苷酸来评价包括G和U碱基的影响。化合物总结在表28中。
表28
实施例363-376
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价序列长度的影响。化合物总结在表29中。
表29
实施例377-380和384
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价RNA掺入的影响。结果总结在表30中。
表30
实施例381-383
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价4etl(4-乙基-LNA)掺入的影响。根据已知的方法(Seth,P.P.,J.Org.Chem.2010,75,(5),1569–1581)制备4etl单体。结果总结在表31中。
表31
实施例385-389
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价nmLNA(N-甲基LNA)A和C掺入的影响。nmLNA单体获自商业来源(Bio-Synthesis Inc.,Lewisville,TX)。结果总结在表32中。
表32
实施例390-392
通过按照上述方法制备一系列硫代磷酸化的寡核苷酸来评价AmNA和Scp-BNA A和C掺入的影响。结果总结在表33中(也参见表23)。
表33
实施例B1
HBsAg分泌测定和细胞毒性测定
针对乙型肝炎的序列非依赖性抗病毒活性(如通过HBsAg分泌测定所确定的)和许多示例性修饰的寡核苷酸化合物的细胞毒性如下所述测定并总结在表34-35和图6A和6B中。
将HepG2.2.15细胞维持在含有10%胎牛血清(FBS)和1%青霉素/链霉素、1%谷氨酰胺、1%非必需氨基酸、1%丙酮酸钠和380μg/mL G418的DMEM培养基中。将细胞在37℃下在5%CO
HBsAg分泌测定
使HepG2.2.15细胞在如上所述的DMEM培养基中生长。将细胞以45,000个细胞/孔的浓度铺板在胶原蛋白-I包被的96孔板中。在加入细胞之后立即加入测试化合物。
也可以在
通过溶解在1×PBS中至100×所需的最终测试浓度来评估50%的抑制浓度(EC
在化合物加入/转染后3天,用含有RNAiMax的新鲜培养基/化合物代替培养基和化合物,并再孵育3天,总孵育时间为6天。收集细胞上清液和细胞裂解物(见下文)以定量HBsAg。
使用HBsAg ELISA试剂盒(Autobio-CL0310)定量测量分泌的HBsAg。
使用Microsoft Excel(forecast函数)从HBsAg水平降低百分比相对于药物浓度的图计算EC
设置一组平行的平板,其用于测试化合物诱导的细胞毒性(见下文)。
按上述培养和处理HepG2.2.15细胞。在第6天,使用细胞增殖测定(CellTiter-Glo发光细胞活力测定;Promega)根据制造商的说明或使用合适的替代方案来评估细胞毒性。
使用Microsoft Excel(forecast函数)从活细胞减少百分比相对于药物浓度的图来计算CC
表34-效力和细胞毒性
效力:A:比(2’-OMe-A;2’-OMe-C)高>5倍;B:比(2’-OMe-A;2’-OMe-C)高>2倍且比(2’-OMe-A;2’-OMe-C)高<5倍;C:高于或等于(2’-OMe-A;2’-OMe-C)且比(2’-OMe-A;2’-OMe-C)高<2倍;D:低于(2’-OMe-A;2’-OMe-C)。
细胞毒性:A:>2μM;B:<2μM
表35:效力和细胞毒性
效力:A:EC
细胞毒性:A:CC
实施例B2
活的感染测定
将HepG2-NTCP细胞维持在含有10%胎牛血清(FBS)和1%青霉素/链霉素、1%谷氨酰胺、1%非必需氨基酸、1%丙酮酸钠的DMEM/F12培养基中。将细胞在37℃下在5%CO
用上述培养基重悬HepG2-NTCP细胞,并以15,000个细胞/孔的浓度铺板在胶原蛋白-I包被的96孔板中。在第二天(第0天),在4%PEG8000和2%DMSO存在下,用200moi(ge)的HBV(来自HepAD38细胞的纯化的HBV)感染细胞,并在37℃孵育过夜。将接种物抽真空,用含2%FBS的DMEM/F12洗涤细胞三次,然后更换为HepG2-NTCP培养基。
在第5天处理细胞。在第5天,将测试化合物用Opti-MEM I培养基稀释3倍,并根据制造商的说明与
使用Microsoft Excel forecast函数或GraphPad Prism从HBsAg水平降低百分比相对于药物浓度的图计算EC
表36-效力和细胞毒性
效力:A:EC
细胞毒性:A:CC
实施例B3
用于组合的HBsAg分泌测定
如下所述测定示例性修饰的寡核苷酸化合物与反义寡核苷酸(ASO)的组合针对乙型肝炎的序列非依赖性抗病毒活性(如通过HBsAg分泌测定所确定的),并将其总结在表37中。
将HepG2.2.15细胞维持在含有10%胎牛血清(FBS)和1%青霉素/链霉素、1%谷氨酰胺、1%非必需氨基酸、1%丙酮酸钠的DMEM/F12培养基中。将细胞在37℃下在5%CO
如上所述,使HepG2.2.15细胞在DMEM/F12培养基中生长。将细胞以35,000个细胞/孔的浓度接种在胶原蛋白-I包被的96孔板中。在加入细胞之后立即加入测试化合物。在第0天和第3天进行双重转染(double transfection)。
A:将RNAiMAX(对于96孔板为0.3uL/孔)与Opti-MEM I(多加20%)混合,在室温下孵育5分钟。
B:在Opti-MEM I中稀释ASO和修饰的寡核苷酸的组合以使最终浓度为40x(8点,3倍稀释,包括浓度0nM)。最高浓度是EC
以等体积(多加20%的体积)混合A和B,再孵育5-10分钟。然后将A和B的混合物以最终培养体积的1/10加入每个孔中,用手将板旋转10秒。板应该至少一式三份。在37℃下孵育3天,更新培养基,重复转染过程。在处理后的第6天,收集上清液用于ELISA测定,用CellTiter-Glo(Promega)测量细胞活力。
为了分析协同作用,计算每个孔的HBsAg(或DNA)减少的百分比。降低的百分比=(1孔/无药物对照的平均值)*100。将这些数值输入MacSynergy II软件中,并根据软件的指令获得协同/拮抗量。
协同量<25表明没有协同作用/拮抗作用。
协同量25-50表明较小的协同作用/拮抗作用。
协同量50-100表明中等的协同作用/拮抗作用。
协同量>100表明强的协同作用/拮抗作用。
协同量>1,000表示可能错误,检查数据。
细胞活力的百分比=(孔/无药物对照的平均值)*100。如前所述监测细胞毒性。
使用HBsAg ELISA试剂盒(Autobio-CL0310)定量测量分泌的HBsAg。表37中提供了修饰的寡核苷酸与ASO的组合的协同值。
表37-组合的协同作用
实施例B4
用于组合的HBsAg分泌测定
如下所述测定示例性修饰的寡核苷酸化合物与ASO、衣壳组装调节剂(CAM化合物1或CAM化合物2)或核苷类似物(恩替卡韦,ETV)的组合对乙型肝炎的序列非依赖性抗病毒活性(如通过HBsAg分泌测定所确定的),并将其总结在表38中。
以下测定程序描述了HBV抗病毒测定。该测定使用已经用HBV基因组转染的HepG2.2.15细胞,并且使用细胞外HBV DNA定量作为终点。通过使用来自Promega的
如上所述,使HepG2.2.15细胞在DMEM/F12培养基中生长。将细胞以35,000个细胞/孔的浓度接种在胶原蛋白-I包被的96孔板中。在加入细胞之后立即加入测试化合物。在第0天和第3天进行双重转染。
用QIAamp 96DNA血液试剂盒,按照制造商的手册,分离细胞外DNA。然后,在ABI-7900HT上,使用来自Roche的FastStart Universal MasterMix,用如下指定的HBV特异性引物和探针,通过qPCR定量HBV DNA。PCR循环程序由95℃,10分钟,然后在95℃,15秒和60℃,1分钟的40个循环组成。
A:将RNAiMAX(对于96孔板为0.3uL/孔)与Opti-MEM I(多加20%)混合,在室温下孵育5分钟。
B:在Opti-MEM I中稀释CAM、ASO或ETV和修饰的寡核苷酸的组合以使最终浓度为40x(8点,3倍稀释,包括浓度0nM)。最高浓度是EC
以等体积(多加20%的体积)混合A和B,再孵育5-10分钟。然后将A和B的混合物以最终培养体积的1/10加入每个孔中,用手将板旋转10秒。板应该至少一式三份。在37℃下孵育4小时,然后加入ASO、ETV或CAM以使细胞从转染中恢复。在处理后的第3天,收集上清液用于ELISA测定,用CellTiter-Glo(Promega)测量细胞活力。
如以上实施例B3中所述分析协同数据。
使用HBsAg ELISA试剂盒(Autobio-CL0310)定量测量分泌的HBsAg。表38中提供了修饰的寡核苷酸与ASO的组合的协同值。
表38-组合的协同作用
实施例B5
非人灵长类动物的肝脏暴露
通过静脉内(IV)或皮下(SC)途径向雌性食蟹猴给药示例性修饰的寡核苷酸化合物来评价非人灵长类动物的末端肝脏暴露。对于IV途径,将化合物在无菌磷酸盐缓冲盐水(PBS)媒介物中施用,并在2小时内以1mL/kg输注。对于皮下给药,媒介物也是无菌PBS,并且以1mL/kg作为单次推注(single bolus)施用化合物。每个剂量组有两只动物,所示数据是两只动物的平均值。在24小时时间点测定肝脏水平。用于该研究的剂量和获得的数据显示在图12中。出乎意料的是,皮下施用至非人灵长类动物后的肝脏暴露远高于基于由其它方面相当的静脉内给药产生的肝脏暴露水平所预期的。
实施例B6
PBMC测定
如下所述进行评价示例性修饰的寡核苷酸化合物对从外周血单核细胞(PBMC)释放细胞因子的影响,并将其总结在表39和图13-22中。
从斯坦福血液中心(Stanford Blood Center)获得血沉棕黄层(N=3),并按照Aragen的标准方案使用Ficoll密度梯度离心处理以分离PBMC。将PBMC(1百万/mL)悬浮于完全培养基(补充有10%热灭活的低IgG FBS和PSG的RPMI)中,并以100μL/孔铺板于96孔圆底板中。用测试物品(在下一个载玻片(slide)上列出)(浓度范围:10μM至0μM-3倍稀释)和PHA及Poly IC(浓度范围:10μg/mL至0μg/mL-3倍稀释)处理PBMC。全部以一式三份设置。在37℃/5%CO
表39
- S-抗原转运抑制寡核苷酸聚合物和方法
- 用于根据谷胱甘肽-S-转移酶π表达确定化疗方案的方法的寡核苷酸引物
