一种非茂稀土金属碳氢官能团化反应催化剂及其制备方法和应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于催化剂领域,具体涉及一种非茂稀土金属碳氢官能团化反应催化剂及其制备方法和应用。
背景技术
碳氢(C-H)键活化作为有机合成中重要的一个分支,广泛应用于药物、天然产物、农药、聚合物和原料等化合物的合成。在过去的20年间,C-H键活化及官能团化取得了显著的发展。碳氢官能化反应已经成为当代有机合成化学的热点和前沿领域之一。过渡金属催化的碳氢键活化反应,由于其具有步骤经济性和原子经济性等特点,已经发展成为一种高效构筑碳碳键、碳杂键的方法。
苯甲醚、甲基苯甲醚等物质是重要的染料和医药中间体。含氮化合物是一类非常重要的有机化合物,广泛存在于药物,天然产物和功能材料中。吡啶类化合物是一类重要的含氮化合物,在许多天然产物、功能材料、电化学、农药、药物、有机催化以及多种配体中,吡啶骨架是多类重要生物活性分子的核心结构,如治疗糖尿病的罗格列酮、常用的抗组胺扑尔敏、治疗胃溃疡的奥美拉唑。因此发展苯甲醚或其衍生物、含氮化合物参与的碳氢键活化反应具有重要的意义。
在过渡金属催化的碳氢活化反应中,目前报道较多的催化剂为后过渡金属,如钌、铑、钯、铱等贵金属,这些后过渡金属可以通过氧化加成、亲电取代以及碱协助金属化去质子化等活化机理来活化碳氢键。但是,这些后过渡金属价格昂贵,增加了反应成本,不适合大规模推广。近期研究发现,除了后过渡金属,前过渡金属(例如稀土金属钪、钇)能够形成强极性的金属元素键,也能实现碳氢键的活化。
日本理化学研究所的侯召民(J.Am.Chem.Soc.2020,142,5531–5537)报道了一种单茂稀土催化剂,通过对半夹心型稀土催化剂的空间位阻调控,实现了首例芳基醛亚胺与烯烃的非对映多样性的[3+2]环化反应(合成路线如下所示)。但是,该单茂稀土催化剂属于茂系稀土金属催化剂,存在以下问题:(1)该单茂稀土催化剂合成方法比较复杂,并且不易修饰;(2)这种单茂稀土催化剂适用的底物有限,例如在催化2-甲基苯甲醚与苯乙烯的碳氢活化反应中,会生成聚合物副产物,目标产物收率低;(3)手性的单茂稀土催化剂虽能催化不对称碳氢官能化反应,但催化剂合成相对困难,阻碍了其应用。
为了解决上述问题,亟需开发出一种合成方法简便,容易修饰,底物适用范围广,甚至适用于不对称碳氢官能化反应的新型碳氢官能团化反应催化剂。
发明内容
本发明的目的在于提供一种非茂稀土金属碳氢官能团化反应催化剂及其制备方法和应用。
本发明提供了一种非茂稀土金属催化剂,它的结构如式I所示:
其中,R
R
L
进一步地,所述非茂稀土金属催化剂的结构如式II所示:
/>
其中,R
L
进一步地,所述非茂稀土金属催化剂的结构如式III所示:
其中,---表示无或共价键;
R
R
R
L
进一步地,所述非茂稀土金属催化剂的结构如式IV-1或式IV-2所示:
其中,---表示无或共价键;
R
n1选自0、1、2或3;
n2选自0、1、2或3;
R
L
进一步地,所述非茂稀土金属催化剂的结构如下所示:
/>
其中,
本发明还提供了一种制备上述非茂稀土金属催化剂的方法,所述方法包括以下步骤:亚胺类化合物与稀土金属烷基配合物反应,得到非茂稀土金属催化剂
其中,亚胺类化合物的结构为
稀土金属烷基配合物的结构为
R
R
进一步地,所述亚胺类化合物与稀土金属烷基配合物的摩尔比为1:(0.5-2),优选为1:1;
和/或,所述反应的溶剂为有机溶剂,优选为四氢呋喃;
和/或,所述反应的温度为10-80℃,优选为室温-70℃,反应的时间为12-48小时,优选为24-36小时。
本发明还提供了一种制备官能团化的化合物的方法,所述方法包括以下步骤:化合物底物与烯烃类化合物在上述非茂稀土金属催化剂的作用下反应,得到官能团化的化合物,所述化合物底物中含C-H键。
进一步地,所述化合物底物选自含氮化合物、苯甲醚或其衍生物;所述含氮化合物优选为含氮杂环化合物,更优选为吡啶或其衍生物、哌啶或其衍生物;所述吡啶衍生物优选为2-苯基吡啶、均三甲基吡啶、2-苯基吡啶,所述哌啶衍生物优选为N-甲基哌啶,所述苯甲醚衍生物优选为2-甲基苯甲醚。
进一步地,所述反应是在路易斯酸的存在下进行的;所述路易斯酸优选为硼酸盐、硼烷的一种或两种的混合物,更优选为三苯碳四(五氟苯基)硼酸盐、三(五氟苯基)硼烷、N,N-二甲基苯铵四(五氟苯基)硼酸盐中的一种或两种以上的混合物;
和/或,所述烯烃类化合物选自C
和/或,所述化合物底物、烯烃类化合物、非茂稀土金属催化剂、路易斯酸的摩尔比为1:(0.1-10):(0.001-1):(0.001-1),优选为1:(0.7-5):(0.01-0.1):(0.01-0.1);
和/或,所述反应的溶剂为有机溶剂,优选为甲苯;
和/或,所述反应的温度为0-140℃,优选为35-120℃,反应的时间为0.5-48小时,优选为6-36小时。
本发明还提供了上述非茂稀土金属催化剂在碳氢官能团化反应中作为催化剂的用途。
关于本发明的使用术语的定义:除非另有说明,本文中基团或者术语提供的初始定义适用于整篇说明书的该基团或者术语;对于本文没有具体定义的术语,应该根据公开内容和上下文,给出本领域技术人员能够给予它们的含义。
碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀C
“芳基”指具有共轭的π电子体系的全碳单环基团,例如苯基。所述芳基不含杂原子,如氮,氧,或硫,同时连接母体的点必须在具有共轭的π电子体系的环上的碳原子上。
“杂芳基”指包含一个到多个杂原子的杂芳族基团。这里所指的杂原子包括但不限于氧、硫、氮。例如呋喃基、噻吩基、吡啶基、吡唑基、吡咯基、N-烷基吡咯基、嘧啶基、吡嗪基、咪唑基、四唑基等。
“桥环烷基”指多环的环烷基,且该多环的环烷基中有两个环共用两个不相邻的碳原子。
“杂桥环基”指多环的杂环基,且该多环的杂环基中有两个环共用两个不相邻的碳原子或杂原子。
三甲基吡啶即2,4,6-三甲基吡啶。
卤素为氟、氯、溴或碘。
Sc表示金属钪,Y表示金属钇,Gd表示金属钆,Lu表示金属镥。
室温指25±5℃。
前过渡金属指元素周期表中第3副族至第7副族中的所有过渡金属元素。包括镧系和锕系元素。是一些d轨道(或f轨道)没有填满电子或其轨道能级接近于外层价电子轨道能级因而可以利用d轨道(或f轨道)成键的一些金属元素。
后过渡金属指元素周期表中第8副族至第2副族中的过渡金属元素。
茂系稀土金属催化剂指稀土金属元素和至少一个环戊二烯或环戊二烯衍生物作为配体组成的稀土有机金属配合物。
非茂稀土金属催化剂指不含环戊二烯基配体和环戊二烯衍生物配体的稀土金属配合物。
本发明提供了一种结构新颖的非茂稀土金属催化剂,与现有技术中的碳氢官能团化反应催化剂相比,取得了以下有益效果:
1.本发明的催化剂是一种非茂稀土金属催化剂,其合成方法简单,容易修饰,结构变化丰富。
2.本发明的非茂稀土金属催化剂能够用于催化碳氢官能团化反应,其用量少,适用的底物范围广,例如苯甲醚或其衍生物、吡啶或其衍生物、哌啶或其衍生物等。
3.以本发明的非茂稀土金属催化剂催化的碳氢官能团化反应,所得官能团化的产物收率高,纯度高。
4.本发明的非茂稀土金属应催化剂能够用于不对称碳氢官能化反应,并且具有较好的对映选择性。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
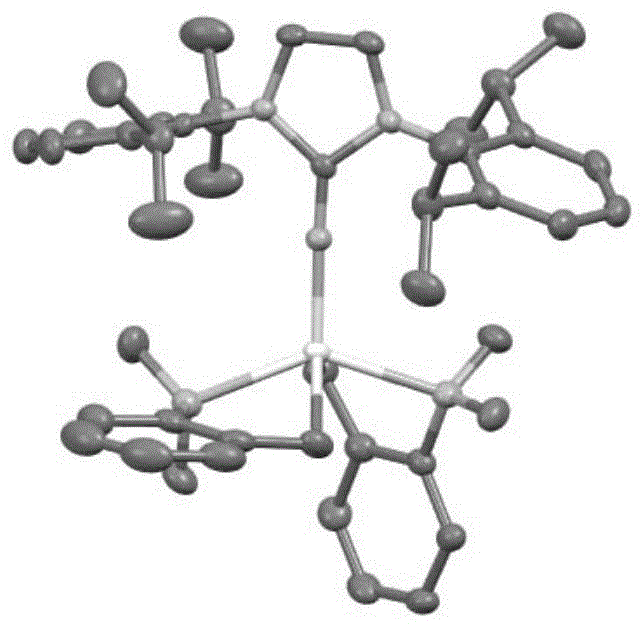
图1:配合物1的单晶结构。
图2:配合物3的单晶结构。
图3:配合物4的单晶结构。
图4:配合物5的单晶结构。
图5:配合物8的单晶结构。
图6:配合物9的单晶结构。
图7:配合物10的单晶结构。
具体实施方式
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
实施例中涉及的反应操作和产物处理都是在无水无氧的Schlenk管技术和氩气手套箱中进行操作。所用溶剂和试剂都是经过无水无氧处理的。
实施例1-14为制备本发明非茂稀土金属碳氢官能团化反应催化剂1-14(简称配合物1-14)的方法。
实施例1:制备咪唑啉-2-亚胺(双(邻N,N-二甲基氨基苄基))钪(配合物1)
Sc(CH
1,3-双(2,6-二异丙基苯基)咪唑啉-2-亚胺(0.5mmol),Sc(CH
结构表征如下:
配合物1的单晶结构如图1所示。
实施例2:制备咪唑啉-2-亚胺(双(邻N,N-二甲基氨基苄基))钇(配合物2)
1,3-双(2,6-二异丙基苯基)咪唑啉-2-亚胺(0.5mmol),Y(CH
结构表征如下:
实施例3:制备咪唑烷-2-亚胺(双(邻N,N-二甲基氨基苄基))钪(配合物3)
1,3-双(2,6-二异丙基苯基)咪唑烷-2-亚胺(0.5mmol),Sc(CH
配合物3的单晶结构如图2所示。
实施例4:制备咪唑啉-2-亚胺(双(邻N,N-二甲基氨基苄基))钪(配合物4)
1,3-双(2,6-二异丙基苯基)-4,5-二甲基咪唑啉-2-亚胺(0.5mmol),Sc(CH
结构表征如下:
配合物4的单晶结构如图3所示。
实施例5:制备咪唑啉-2-亚胺(双(邻N,N-二甲基氨基苄基))钪(配合物5)
4,5-二氯-1,3-双(2,6-二异丙基苯基)咪唑啉-2-亚胺(0.5mmol),Sc(CH
结构表征如下:
配合物5的单晶结构如图4所示。
实施例6:制备咪唑啉-2-亚胺(双(邻N,N-二甲基氨基苄基))钪(配合物6)
1,3-双(2,4,6-三甲基苯基)咪唑啉-2-亚胺(0.5mmol),Sc(CH
结构表征如下:
实施例7:制备咪唑啉-2-亚胺(双(邻N,N-二甲基氨基苄基))钪(配合物7)
1,3-双(1-金刚烷基)咪唑烷-2-亚啉(0.5mmol),Sc(CH
结构表征如下:
实施例8:制备咪唑啉-2-亚胺(双(邻N,N-二甲基氨基苄基))钆(配合物8)
1,3-双(2,6-二异丙基苯基)-4,5-二甲基咪唑烷-2-亚胺(0.5mmol),Gd(CH
配合物8的单晶结构如图5所示。
实施例9:制备咪唑啉-2-亚胺(双(邻N,N-二甲基氨基苄基))钇(配合物9)
1,3-双(2,6-二异丙基苯基)-4,5-二甲基咪唑啉-2-亚胺(0.5mmol),Y(CH
结构表征如下:
配合物9的单晶结构如图6所示。
实施例10:制备手性1,3-双(4-甲基-2,6-双(1-苯乙基)苯基)-1,3-二氢-2H-咪唑-2-亚胺(双(邻N,N-二甲基氨基苄基))钪(配合物10)
1.制备手性1,3-双(4-甲基-2,6-双(1-苯乙基)苯基)-1,3-二氢-2H-咪唑-2-亚胺
称手性1,3-双(4-甲基-2,6-双((R)-1-苯乙基)苯基)-1H-咪唑-3-氯化鎓(2.58mmol),叔丁醇钾(3.87mmol),在12mL四氢呋喃中室温搅拌过夜后,减压移除溶剂,加入14mL甲苯和5mL正己烷,过滤不溶物,减压抽干滤液,收集固体。
将所得固体用4.5mL甲苯溶解,加入1.1mL TMSN
2.制备手性1,3-双(4-甲基-2,6-双(1-苯乙基)苯基)-1,3-二氢-2H-咪唑-2-亚胺(双(邻N,N-二甲基氨基苄基))钪
手性1,3-双(4-甲基-2,6-双(1-苯乙基)苯基)-1,3-二氢-2H-咪唑-2-亚胺(0.5mmol),Sc(CH
结构表征如下:
配合物10的单晶结构如图7所示。
实施例11:制备手性7,9-双(4-甲基-2,6-双(1-苯乙基)苯基)-7,9-二氢-8H-苊并[1,2-d]咪唑-8-亚胺(双(邻N,N-二甲基氨基苄基))钪(配合物11)
1.制备手性7,9-双(4-甲基-2,6-双(1-苯乙基)苯基)-7,9-二氢-8H-苊并[1,2-d]咪唑-8-亚胺
称手性7,9-双(4-甲基-2,6-双(1-苯乙基)苯基)-7H-苊并[1,2-d]咪唑-9-氯化鎓(0.7mmol),叔丁醇钾(1.05mmol),在3mL四氢呋喃中室温搅拌过夜后,减压移除溶剂,加入4mL甲苯和2mL正己烷,过滤不溶物,减压抽干滤液,收集固体。
将所得固体用5mL甲苯溶解,加入0.3mL TMSN
2.制备手性7,9-双(4-甲基-2,6-双(1-苯乙基)苯基)-7,9-二氢-8H-苊并[1,2-d]咪唑-8-亚胺(双(邻N,N-二甲基氨基苄基))钪
手性7,9-双(4-甲基-2,6-双(1-苯乙基)苯基)-7,9-二氢-8H-苊并[1,2-d]咪唑-8-亚胺(0.43mmol),Sc(CH
实施例12:制备1,3-双(2,6-双((R)-1-(3,5-二叔丁基苯基)乙基)-4-甲基苯基)-1,3-二氢-2H-咪唑-2-亚胺(双(邻N,N-二甲基氨基苄基))钪(配合物12)
1.制备1,3-双(2,6-双((R)-1-(3,5-二叔丁基苯基)乙基)-4-甲基苯基)-1,3-二氢-2H-咪唑-2-亚胺
称1,3-双(2,6-双((R)-1-(3,5-二叔丁基苯基)乙基)-4-甲基苯基)-1H-咪唑-3-氯化鎓(0.72mmol),叔丁醇钾(3当量,2.16mmol),在3mL四氢呋喃中室温搅拌过夜后,减压移除溶剂,加入4mL甲苯和2mL正己烷,过滤不溶物,减压抽干滤液,收集固体。
将所得固体用5mL甲苯溶解,加入0.3mL TMSN
2.制备1,3-双(2,6-双((R)-1-(3,5-二叔丁基苯基)乙基)-4-甲基苯基)-1,3-二氢-2H-咪唑-2-亚胺(双(邻N,N-二甲基氨基苄基))钪
手性1,3-双(2,6-双((R)-1-(3,5-二叔丁基苯基)乙基)-4-甲基苯基)-1,3-二氢-2H-咪唑-2-亚胺(0.28mmol),Sc(CH
实施例13:制备1,3-双(4-(叔丁基)-2,6-双((R)-1-苯乙基)苯基)-1,3-二氢-2H-咪唑-2-亚胺(双(邻N,N-二甲基氨基苄基))钪(配合物13)
1.制备1,3-双(4-(叔丁基)-2,6-双((R)-1-苯乙基)苯基)-1,3-二氢-2H-咪唑-2-亚胺
称1,3-双(4-(叔丁基)-2,6-双(1-苯乙基)苯基)-1H-咪唑-3-氯化鎓(1mmol),叔丁醇钾(3mmol),在4mL四氢呋喃中室温搅拌过夜后,减压移除溶剂,加入5mL甲苯和3mL正己烷,过滤不溶物,减压抽干滤液,收集固体。
将所得固体用10mL甲苯溶解,加入0.39mL TMSN
2.制备1,3-双(4-(叔丁基)-2,6-双((R)-1-苯乙基)苯基)-1,3-二氢-2H-咪唑-2-亚胺(双(邻N,N-二甲基氨基苄基))钪
手性1,3-双(4-(叔丁基)-2,6-双((R)-1-苯乙基)苯基)-1,3-二氢-2H-咪唑-2-亚胺(0.5mmol),Sc(CH
实施例14:制备咪唑啉-2-亚胺(双(邻N,N-二甲基氨基苄基))镥(配合物14)
1,3-双(2,6-二异丙基苯基)-4,5-二甲基咪唑啉-2-亚胺(0.5mmol),Lu(CH
结构表征如下:
实施例15-21为本发明配合物1-14作为催化剂制备官能团化吡啶衍生物、官能团化苯甲醚衍生物的方法。
实施例15:官能团化2-苯基吡啶衍生物的制备
称取0.01mmol的按照实施例1制备的配合物1于试管中,加入0.01mmol三苯碳四(五氟苯基)硼酸盐,加入2mL的甲苯,室温搅拌十分钟后,加入0.2mmol的2-苯基吡啶和0.4mmol苯乙烯,120℃反应6小时,经石油醚/乙醚(其中石油醚与乙醚的体积比为20:1)柱层析分离纯化,得到吡啶碳氢烷基化产物,收率93%,纯度95%。
结构表征如下:
实施例16:官能团化均三甲基吡啶衍生物的制备
称取0.005mmol的按照实施例1制备的配合物2于试管中,加入0.005mmol三苯碳四(五氟苯基)硼酸盐,加入1mL的甲苯,室温搅拌十分钟后,加入0.15mmol的均三甲基吡啶和0.1mmol苯乙烯,90℃反应24小时,经石油醚/乙醚(其中石油醚与乙醚的体积比为10:1)柱层析分离纯化,得到吡啶甲基碳氢烷基化产物,收率88%,纯度95%。
结构表征如下:
实施例17:官能团化苯甲醚衍生物的制备
称取0.005mmol的按照实施例4制备的配合物4于试管中,加入0.005mmol三苯碳四(五氟苯基)硼酸盐,加入0.5mL的甲苯,室温搅拌十分钟后,加入0.2mmol的苯甲醚和0.3mmol降冰片烯,50℃反应12小时,得到苯甲醚碳氢烷基化产物,收率96%,纯度95%。
结构表征如下:
实施例18:官能团化2-甲基苯甲醚衍生物的制备
称取0.002mmol的按照实施例4制备的配合物4于试管中,加入0.002mmol三苯碳四(五氟苯基)硼酸盐,加入0.5mL的甲苯,室温搅拌十分钟后,加入0.2mmol的2-甲基苯甲醚和0.3mmol降冰片烯,70℃反应12小时,得到苯甲醚碳氢烷基化产物,收率99%,纯度95%。
结构表征如下:
实施例19:官能团化N-甲基哌啶衍生物的制备
称取0.02mmol的按照实施例4制备的配合物4于试管中,加入0.02mmol三苯碳四(五氟苯基)硼酸盐,加入0.5mL的甲苯,室温搅拌十分钟后,加入0.2mmol的N-甲基哌啶和0.3mmol降冰片烯,120℃反应12小时,得到N-甲基哌啶碳氢烷基化产物,收率99%,纯度95%。
结构表征如下:
实施例20:官能团化2-苯基吡啶衍生物的制备
/>
称取0.005mmol的配合物10、配合物12或配合物13中的一种于试管中,加入0.005mmol三苯碳四(五氟苯基)硼酸盐,加入1mL的甲苯,室温搅拌十分钟后,加入0.1mmol的2-苯基吡啶和0.5mmol 1-辛烯,100℃反应24小时,经石油醚/乙醚(其中石油醚与乙醚的体积比为20:1)柱层析分离纯化得到手性吡啶碳氢烷基化产物。
产物的对映体过量用高效液相色谱(Daicel chiralcel OJH,V
结构表征如下:
实施例21:官能团化2,4,6-三甲基吡啶衍生物的制备
称取0.02mmol的配合物10或配合物11中的一种于试管中,加入0.02mmol三苯碳四(五氟苯基)硼酸盐,加入2mL的甲苯,室温搅拌十分钟后,加入0.2mmol的2,4,6-三甲基吡啶和0.2mmol烯丙基苯,35℃反应36小时,经石油醚/乙醚(其中石油醚与乙醚的体积比为20:1)柱层析分离纯化得到手性吡啶碳氢烷基化产物。
产物的对映体过量用高效液相色谱(Daicel chiralcel ODH,V正己烷:V异丙醇=100:0,流速0.5mL/min)测定。结果显示,采用配合物10作为催化剂时,产物收率为78%,对映选择性为60%ee;采用配合物11作为催化剂时,产物收率为8%,对映选择性为59%ee。
结构表征如下:
综上,本发明提供了一种非茂稀土金属碳氢官能团化反应催化剂及其制备方法和应用。本发明的催化剂是一种非茂稀土金属催化剂,其合成方法简单,容易修饰,结构变化丰富。该非茂稀土金属催化剂能够用于催化碳氢官能团化反应,其用量少,适用的底物范围广,例如苯甲醚或其衍生物、吡啶或其衍生物、哌啶或其衍生物等。以本发明的非茂稀土金属催化剂催化的碳氢官能团化反应,所得官能团化的产物收率高,纯度高,应用前景广阔。
- 负载型非茂金属催化剂、其制备方法及其应用
- 负载型非茂金属催化剂、其制备方法及其应用
- 负载型非茂金属催化剂、其制备方法及其应用
- 负载型非茂金属催化剂、其制备方法及其应用
- 一种非茂稀土金属烯烃聚合催化剂及其制备方法和应用
- 一种非茂稀土金属烯烃聚合催化剂及其制备方法和应用
