一种用于细菌中快速响应法尼基焦磷酸FPP的报告系统、构建方法及其应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及一种用于细菌中快速响应法尼基焦磷酸FPP的报告系统、构建方法及其应用,并公开了其基因的核苷酸序列、氨基酸序列、蛋白结构,报告系统在不同FPP水平以及不同发酵时间下的响应效果,属于生物工程技术领域。
背景技术
异戊二烯类化合物存在于所有生物体中,是最多样化的天然物质之一。目前已知至少有50,000种结构,其中许多结构在医疗和技术应用方面具有巨大潜力。在异戊二烯形成的一类最为重要的代谢物:萜烯类化合物中存在一个中心代谢物质:法尼基焦磷酸FPP,FPP作为合成倍半萜烯的关键性前体,参与包括胡萝卜素、番茄红素、罗汉果苷等多种高附加值产品。
随着生物技术的发展,合成生物学受到越来越多的关注。通过在微生物底盘细胞中重组天然化合物的生物合成途径,来快速、大量的获取天然产物及其中间体,为植物天然活性产物的开发与应用提供了新的方法。微生物具有生长速度快、发酵周期短、发酵成本低的优点,且相对于植物其遗传背景更清楚有利于遗传改造。基于这些优点,多种萜烯类化合物已成功在微生物底盘中生产,而想要在微生物底盘中更加高效地进行生产,精准的调控和检测细胞内的FPP含量就至关重要,基于这一需求,我们开发了一种使用分裂式荧光蛋白检测FPP的方法。
发明内容
本发明的目的是构建一种能够在细菌中快速响应法尼基焦磷酸FPP的报告系统并将其工业化应用。该报告系统由两个独立表达的蛋白FPPR1和FPPR2构成。将两个蛋白以基因簇的形式转化至E.coli BL21(DE3)感受态细胞中构建获得。
为实现上述目的,本发明采取的技术方案如下:
该报告系统通过如下步骤构建获得:
构建组成性表达FPPR的重组质粒:
(1)分别合成插入了FPP结合序列的麦芽糖结合蛋白及其锚定蛋白,其核苷酸序列如SEQ ID NO.1、SEQ ID NO.2所示,其氨基酸序列如SEQ ID NO.3、SEQ ID NO.4所示。
(2)分别合成β-桶蛋白的N端以及C端序列,其核苷酸序列如SEQ ID NO.5、SEQ IDNO.6所示,其氨基酸序列如SEQ ID NO.7、SEQ ID NO.8所示。
(3)将步骤(1)及(2)扩增得到的麦芽糖结合蛋白与β-桶蛋白的N端连接,获得FPPR1;将步骤(1)及(2)扩增得到的锚定蛋白与β-桶蛋白的C端连接,获得FPPR2;FPPR1、FPPR2的序列如SEQ ID NO.9、SEQ ID NO.10所示。
(4)根据具体使用环境,选择具有合适强度的组成性启动子,将FPPR1、FPPR2串联表达,并转入用于生产的底盘菌株使用。
本发明的有益效果是:本发明构建的传感器在野生型大肠杆菌BL21以及过表达FPP生产途径的大肠杆菌BL21-MVA中分别验证了可用性,该方法适于工业化生产中FPP的实时检测。
附图说明
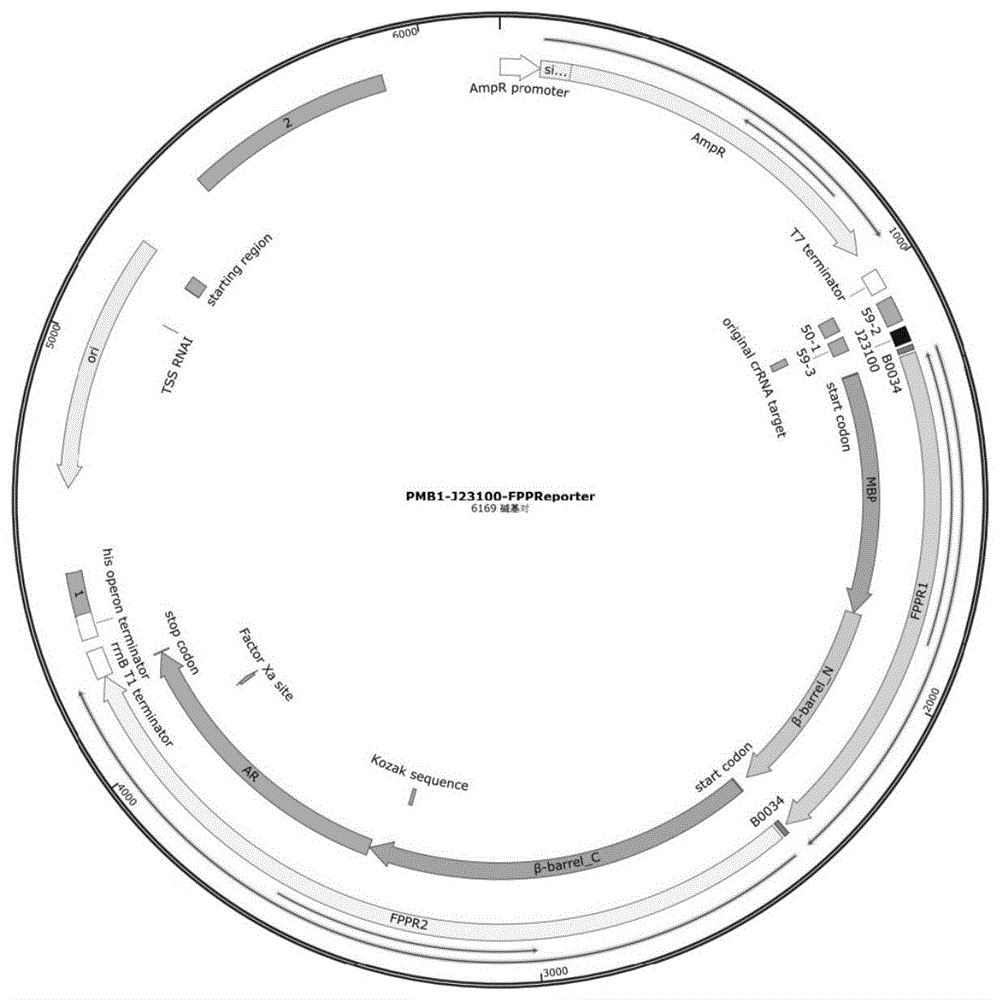
图1FPPR重组载体谱图;
图2FPPR结合FPP时的结构示意图;
图3FPPR用于检测不同FPP水平的菌株;
图4FPPR荧光强度随发酵时间的变化情况。
具体实施方式
在以下的实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
一般性说明:实施例所涉及材料包括RNA提取试剂盒、反转录试剂盒、快切酶、无缝连接酶、质粒试剂盒、胶回收试剂盒,但不限于此。操作完全按照相应说明书进行。
E.coli JM109感受态细胞、E.coli BL21(DE3)感受态细胞按Competent CellPreparation Kit说明书制备,具体步骤如下:
1.使用无抗性LB平板培养基,用接种针挑取大肠杆菌(-80℃甘油保存菌),平板培养基上分级划线,上述划线的平板培养基倒置于恒温培养箱中37℃过夜培养。
2.在划线平板培养基上挑取单菌落,接种到20mL无抗性的LB培养基中,37℃振荡(约120rpm)培养。测定OD
3.取步骤(2)菌体培养液1ml于1.5mL离心管中,6000rpm 4℃离心6分钟,弃上清
4.在每个离心管中加入100μL冰中预冷的Solution A,轻弹动离心管使沉淀悬浮,避免剧烈振荡。
5.6000rpm 4℃离心6分钟。
6.在每个离心管中加入100μL冰中预冷的Solution B,轻轻弹动离心管使沉淀悬浮,避免剧烈振荡。
7.感受态细胞制作完成。本感受态细胞可以直接用于DNA的转化实验,也可以于-80℃中保存,以备以后使用。
实施例1FPPR重组质粒的构建
本实施例为本发明所述FPPR重组质粒的构建
1)引物的设计
根据质粒进行FPPR1、FPPR2片段的扩增,具体引物设计为:
FPPR1-F:tagagaaagaggagaaatactagATGTCAAAGATAGAGGAAGGAAAACTAGT
FPPR1-R:ctttcgactgagcctttcgtttcaTTTGTAACGTTCATCCATACCCA
FPPR2-F:gaaagaggagaaatactagATGGTATCAAAAGGAGAAGAGAC
FPPR2-R:gtatttctcctctttctctagtattaCGCTGCTTTTTGCAGA
2)PCR扩增
扩增反应体系为:PCR反应组成液(50ul)
PCR反应的条件:98℃30s,58℃30s,72℃1.5min,35个循环,得到PCR产物最后保存于4℃中。
PCR产物经过胶回收试剂盒回收后测序,测序所得序列如SEQ ID NO.9、SEQ IDNO.10所示
3)双酶切和连接
将pSB1C3质粒进行双酶切,酶切体系为
上述反应在37℃反应3h后进行核酸胶回收,然后与PCR回收产物进行连接。
连接体系为:
上述反应在37℃反应30min,然后冰浴5min,准备转化。
4)转化
1.取1管上述制得的JM109感受态置于冰上融化。
2.将连接反应液全部转入JM109感受态中,并吹打均匀。
3.冰浴30min。
4.在42℃水浴中热激90s,然后冰浴2min。
5.加入1mL LB培养基,在37℃条件下培养1h复壁。
6.5000r/min离心5min,弃900ul上清,剩余菌体和培养液吹打均匀,涂布含有Amp抗性的平板。
7.37℃过夜倒置培养。
8.挑选6个单克隆重组质粒进行菌落PCR阳性鉴定,并将阳性克隆进行测序。测序引物为pSB1C3上抗性启动子序列TTTGTTTATTTTTCTAAATA。
9.比对测序结果,得到阳性重组质粒,其图谱如图1所示。
10.将阳性重组质粒转入BL21(DE3)感受态得到重组菌株备用。
实施例2将实施例1构建的质粒在工程菌株E.coli BL21(DE3)中组成性表达,FPPR结合FPP时的结构示意图如图2所示,并于6h发酵后使用酶标仪/流式细胞仪进行荧光检测。具体参数为Ex 492nm,Em 510nm。
实施例3本实施例为本发明所述的报告系统随着菌株FPP水平的变化进行FPP进行实时检测。分别测定不同的FPP水平(MVA,MVA+FPPR,FPPR)条件下的荧光强度。如图3所示,FPPR用于检测不同FPP水平的菌株,FPPR报告系统可以对菌株中FPP进行实时检测。
实施例4本实施例为本发明所述的报告系统随着菌株OD变化的进行FPP进行实时检测。分别测定不同的发酵时间值(0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5h)条件下的荧光强度。如图4所示,FPPR荧光强度随发酵时间的变化情况,FPPR报告系统可以对菌株中FPP进行实时检测。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干优化改进和补充,这些改进和补充也应视为本发明的保护范围。
- 一种人的法呢基焦磷酸合酶突变蛋白及其应用
- 一种法尼基焦磷酸合酶FPPS抑制剂的筛选方法及应用
- 一种法尼基焦磷酸合酶FPPS抑制剂的筛选方法及应用
