包含基于靶向亲和域的膜蛋白的胞外囊泡
文献发布时间:2023-06-19 09:30:39
本发明是在美国国立卫生研究院授予的P30AI117943的政府支持下完成的。政府对本发明享有一定的权利。
本申请根据35U.S.C.§119(e)要求2018年4月10日提交的申请号为62/655,521的美国临时申请的优先权权益,该申请的内容通过整体引用并入本文。
背景技术
本发明的领域涉及脂质颗粒用于将药剂递送至靶细胞的使用。特别地,本发明的领域涉及分泌的胞外囊泡(EV),其包含基于靶向亲和域的膜蛋白,例如单链抗体域。分泌的胞外囊泡可用于将试剂(例如治疗试剂)递送至靶细胞。
分泌的胞外囊泡(例如外泌体和微囊泡)是由许多细胞类型产生的纳米级脂质囊泡,并在人体细胞以及其他动物细胞之间转移蛋白质、核酸和其他分子。靶向外泌体尤其具有广泛的潜在治疗用途,并且已经显示出可有效地将RNA递送至小鼠的神经细胞和肿瘤细胞。
在此,我们描述了用于通过外泌体和微粒体生源论分别在外泌体和微囊泡的表面上显示基于靶向亲和域的膜蛋白的方法。所公开的技术利用亲和剂(例如抗体或抗体的抗原结合域)为靶向膜蛋白提供亲和域。特别地,所描述的技术提供了一种鲁棒方法,用于通过对定位于EV并展示外部亲和域的改造蛋白质的表达来在EV的表面上显示靶向蛋白。所公开的靶向系统可以用于改造EV,以用于体内靶向基因治疗或靶向药物递送载具。这样,所公开的技术可以用于改造可应用于各种细胞类型和疾病的靶向EV。
发明内容
公开了包含改造的靶向蛋白的胞外囊泡,所述改造的靶向蛋白将胞外囊泡靶向到靶细胞、组织或路径。改造的靶向蛋白可以通过经由特定途径靶向靶细胞内吞作用的表面蛋白,从而将胞外囊泡靶向到靶细胞。靶向蛋白是一种融合蛋白,其最少包含以下作为结构域:(i)亲和剂,例如抗体的单链可变片段(scFv),其中,scFv在胞外囊泡的表面被表达;和(ii)跨膜域,其使融合蛋白在胞外囊泡的膜中定向。示例性胞外囊泡可以包括但不限于外泌体和微囊泡。
胞外囊泡的改造的靶向蛋白或“融合蛋白”还可以包括另外的结构域。另外的结构域可以包括改造的糖基化位点,其例如使得融合蛋白能够在细胞中被糖基化。优选地,当改造的糖基化位点被糖基化时,融合蛋白和/或融合蛋白的组分域免受融合蛋白的裂解和/或溶酶体中的降解。例如,当改造的糖基化位点被糖基化时,优选地,scFv免受从融合蛋白的其余部分上裂解。
融合蛋白的另外的结构域可以包括靶向外泌体的结构域。优选地,靶向外泌体的结构域将融合蛋白靶向到胞内囊泡,例如溶酶体,其中,融合蛋白可以掺入到溶酶体的膜中并分泌在胞外囊泡(例如外泌体)中。
融合蛋白的另外的结构域可以包括靶向微囊泡的结构域。优选地,靶向微囊泡的结构域将融合蛋白靶向到细胞表面,其中,融合蛋白可以掺入到细胞膜中并分泌在胞外囊泡(例如微囊泡)中。
胞外囊泡还可以包含试剂,例如治疗剂,并且胞外囊泡可以用于将所包含的试剂递送至靶细胞。胞外囊泡所包含的试剂可以包括但不限于生物分子,例如货物RNA,以及其他小分子治疗分子或蛋白质。例如,融合蛋白还可以包含RNA结合域,其与货物RNA上存在的一个或多个RNA基序结合,使得融合蛋白起到包装蛋白的作用,以便在胞外囊泡从细胞被分泌之前将货物RNA包装到胞外囊泡中。在一些实施方式中,包装蛋白可以被称为胞外囊泡装载蛋白或“EV装载蛋白”。
附图说明
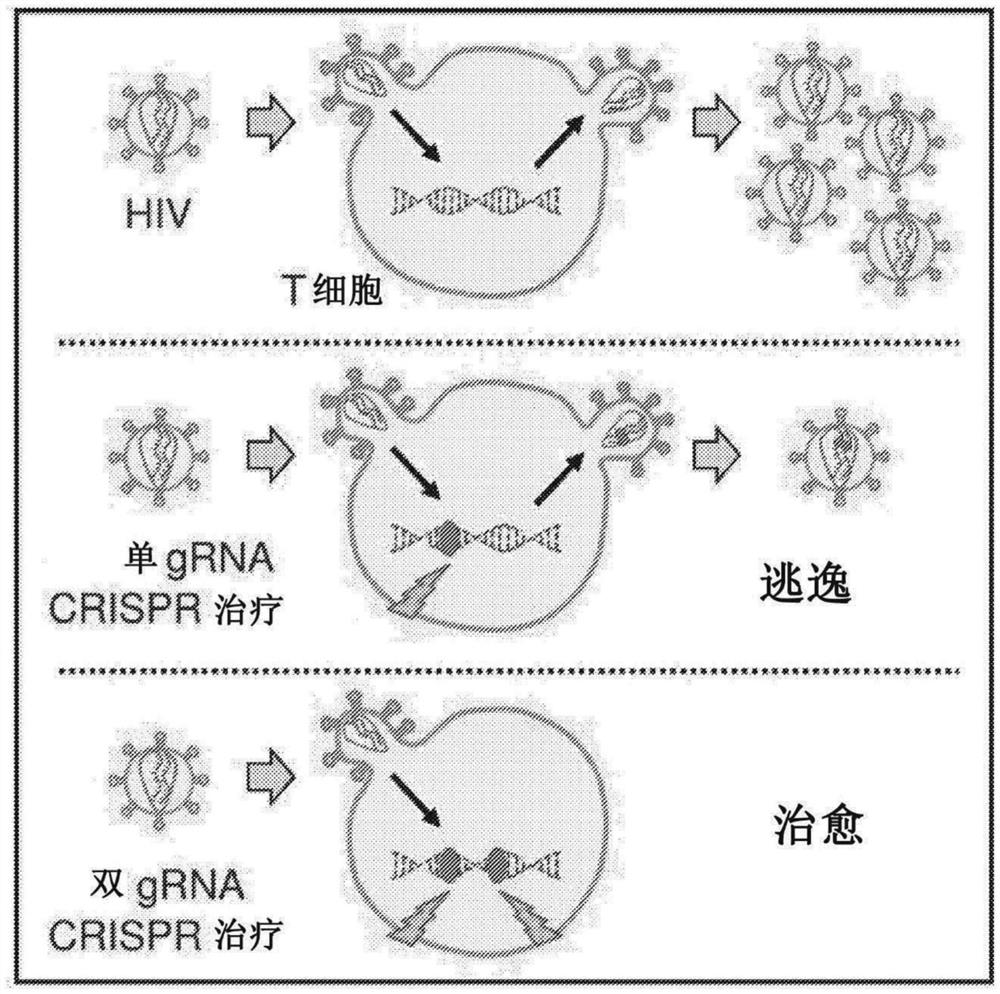
图1。组合式sgRNA疗法治疗HIV感染的概况。
图2。接受组合式sgRNA的表达Cas9的SupT1细胞中病毒复制的抑制。(参见Wang等人的“A Combinatorial CRISPR-Cas9 Attack on HIV-1 DNA Extinguishes AllInfectious Provirus in Infected T Cell Cultures(对HIV-1DNA的组合式CRISPR-Cas9攻击可消除感染的T细胞培养物中的所有感染性原病毒)”,细胞报告,第17卷,第11期,第2819-2826页,2016年12月13日”;其内容通过整体引用并入本文)。
图3。EV产生和EV介导的生物分子递送的概况。(参见Stranford和Leonard,“通过胞外囊泡输送生物分子:出芽治疗策略,遗传学进展,98:155-175,2017年9月11日;其内容通过整体引用并入本文)。产生:外泌体是通过内吞体膜内陷形成多囊泡体(MVB)而形成的,而MVB与质膜的反向融合使得从细胞释放外泌体。通过从质膜直接出芽形成微囊泡。两种类型的囊泡均包含来自生产细胞的RNA和蛋白质,但外泌体富含内吞体膜蛋白。摄取:EV可以由受体细胞通过多种内吞途径被吸收或通过在细胞表面直接融合被吸收。货物递送:将EV货物释放到受体细胞的细胞质中需要EV与内吞体区室中或质膜处的细胞膜之间的融合。无法融合会导致电动车EV及其货物通过内吞体-溶酶体途径降解。
图4。EV介导的Cas9和组合式sgRNA递送至T细胞以及HIV原病毒在潜伏感染的T细胞中的Cas9介导的裂解的示意图。
图5。展示抗CD2 scFv的EV示意图,其将EV靶向到带有CD2的细胞,例如潜伏感染的T细胞。
图6。展示麻疹病毒糖蛋白变体H和F的EV示意图,这些变体将EV靶向到带有CD46的细胞和带有信号淋巴细胞激活分子(SLAM)(带有SLAM)的细胞。
图7。展示细胞间粘附分子1(ICAM-1)的EV示意图,该分子将EV靶向到带有淋巴细胞功能相关抗原1(LFA-1)的细胞,例如激活的T细胞。
图8。用Cas9和sgRNA装载EV的方法。
图9。将抗CD2 scFv定位到EV(N端检测)。用对融合至PDGFR跨膜域的标记FLAG的CD2 scFv或融合至PDGFR跨膜域的FLAG标签进行编码的构建体来转染HEK293FT细胞作为EV展示对照。加载细胞裂解物(2μg)或EV(每泳道8.9x 10
图10。将抗CD2 scFv定位到EV(C末端检测)。用对融合至PDGFR跨膜域的标记FLAG的CD2 scFv或融合至PDGFR跨膜域的FLAG标签进行编码的构建体来转染HEK293FT细胞作为EV展示对照。装载细胞裂解物(2μg)或EV(每泳道8.9x10
图11。装载有Cas9的EV和装载sgRNA的EV以及向受体T细胞的功能递送的示意图。
具体实施方式
本文使用在下文以及在整个申请中阐述的若干定义来描述本发明。
除非上下文另外指定或指示,否则术语“一(a)”、“一(an)”和“该”表示“一个或多个”。例如,“融合蛋白”、“RNA”和“环”应分别解释为表示“一个或多个融合蛋白”、“一个或多个RNA”以及“一个或多个环”。“改造的糖基化位点”应解释为表示“一个或多个改造的糖基化位点”。
如本文中所使用的,“约”、“大约”、“基本上”和“显著”将被本领域普通技术人员理解,并且将在使用它们的上下文中在一定程度上变化。如果这些术语在其被使用的给定上下文中存在对于本领域技术人员而言不清楚的使用,则“约”和“大约”将表示特定术语的正或负≤10%,而“基本上”和“显著”将表示特定术语的正或负>10%。
如本文中所使用的,术语“包括(include)”和“包括(including)”具有与术语“包含(comprise)”和“包含(comprising)”相同的含义,因为后面的这些术语是“开放式”过渡术语,其不将权利要求仅限制于在这些过渡术语之后叙述的要素。术语“由......组成”虽然被术语“包括”所涵盖,但应被解释为“封闭式”过渡术语,其将权利要求仅限制于在该过渡术语之后叙述的要素。术语“本质上由......组成”虽然被术语“包含”所涵盖,但应被解释为“部分封闭式”过渡术语,其容许在该过渡术语之后有另外的要素,但前提是这些另外的要素不会实质上影响权利要求的基本的和新颖的特征。
公开了包含靶向蛋白的胞外囊泡,所述靶向蛋白将胞外囊泡靶向到靶细胞。示例性胞外囊泡可以包括但不限于外泌体。然而,术语“胞外囊泡”应被解释为包括由细胞分泌的所有纳米级脂质囊泡,例如由溶酶体形成的分泌囊泡或通过从质膜出芽或通过其他细胞膜出芽过程分泌的囊泡。
所公开的胞外囊泡包含“靶向蛋白”。靶蛋白可以被描述为“融合蛋白”,并且术语“靶向蛋白”和“融合蛋白”可以根据上下文在本文中互换使用。融合蛋白通常包括:(i)亲和剂,例如抗体的单链可变片段(scFv),其在胞外囊泡的表面被表达,并且优选地将胞外囊泡靶向到靶细胞;和(ii)跨膜域,其优选地定向胞外囊泡的膜中的融合蛋白。在一些实施方式中,融合蛋白具有腔的或胞外的N末端和胞质的C末端。
“亲和剂”是指包括有助于EV与靶细胞的特异性结合的部分。优选的部分是蛋白质域(优选为折叠的蛋白质域)而不是未折叠的肽。样本亲和剂包括(但不限于)scFv、骆驼科动物纳米体、纤连蛋白域衍生的单体和DARPins(参见Koide A,Koide S,2007;纳米体:基于纤连蛋白III型域的支架的抗体模拟物,方法分子生物学352:95-109;纳米体:天然单域抗体,生物化学年度评论,第82卷:775-797,2013;设计的锚蛋白重复蛋白(DARPins):用于研究、诊断和治疗的结合蛋白,Pharm Tox的Ann Rev,第55卷:489-511,2015)。
公开的胞外囊泡的融合蛋白通常包括单链抗体,例如scFv。可以通过经由氨基酸接头链接重链可变域片段和轻链可变域片段(Fv区)来形成单链抗体,从而产生单条多肽链。这样的单链Fv或“scFv”是通过融合对编码两个可变域多肽(V
通过组合和链接不同的V
融合蛋白的亲和剂(例如scFv)通常结合至靶细胞表面上存在的表位。融合蛋白的scFv通常存在于融合蛋白的腔端,其可选地可以是融合蛋白的N-末端。例如,融合蛋白可以包含如下结构:N
所公开的胞外囊泡的融合蛋白通常包括跨膜域。跨膜域是本领域已知的。跨膜域(TMD)主要由非极性氨基酸残基组成,并且可以穿过双层一次(一次通过)或若干次。TMD通常由α螺旋组成。肽键是极性的,并且可以包括在羰基氧原子和酰胺氮原子之间形成的内部氢键,其可以被水合。在基本上不含水的脂质双层中,肽通常采用α-螺旋构型以便最大化其内部氢键。18-21个氨基酸残基的螺旋长度通常足以跨越脂质双层的通常宽度。以胞质外N-末端和胞质C-末端定向的TMD被归类为I型TMD,而以胞质外C-末端和胞质N-末端定向的TMD被归类为II型TMD。在所公开的胞质外的一些实施方式中,它们被归类为I型,或者如果是胞质则被归类为II型。在一些实施方式中,所公开的胞外囊泡的融合蛋白是单通I型跨膜域,其包含18-21个氨基酸,其中,至少约90%的氨基酸是非极性的。用于所公开的融合蛋白的合适的TMD可以包括细胞受体的跨膜域,例如血小板衍生的生长因子受体(PDGFR),其序列提供为SEQ ID NO:40。TMD可以直接链接到亲和剂(例如ascFv),或者TMD可以通过在本文中被称为L
所公开的胞外囊泡的融合蛋白可以可选地包括改造的标签,所述改造的标签可以用于检测或分离融合蛋白。例如,融合蛋白可以在其N-末端、C-末端或两者处包括人工表位,例如FLAG表位(SEQ ID NO:39)。其他合适的改造的标签可以包括:包含4-10个组氨酸残基的组氨酸标签;或包含9个氨基酸的血凝素(HA)标签。
所公开的胞外囊泡的融合蛋白可以可选地包括改造的糖基化位点(EGS)(例如,在融合蛋白的结构域的任何氨基酸序列中都不是天然存在的异源糖基化位点)。融合蛋白的改造的糖基化位点可以被定义为当融合蛋白在细胞中被表达时作为酶促的N链接的糖基化的靶标的氨基酸序列。改造的糖基化位点可以与融合蛋白的scFv相邻存在(例如,N
所公开的胞外囊泡的融合蛋白可以可选地包括靶向外泌体的结构域(ETD)。融合蛋白的外泌体靶向域可以包括但不限于外泌体相关蛋白质和/或溶酶体相关蛋白质的结构域。ExoCarta在其网站上提供了外泌体蛋白质、RNA和脂质的数据库。(还参见Mathivanan等人,核酸研究.2012,第40卷,数据库D1241-1244期,2011年10月11日在线发布,其内容通过整体引用并入本文。)已经描述了合适的外泌体相关蛋白质,其也可以被描述为外泌体囊泡富集蛋白质或(EEP)。(参见Hung和Leonard,“用于主动装载货物RNA以阐明EV介导递送的限制性步骤的平台”,J.Extracellular Vesicles,2016,5:31027,2016年5月13日公布,其内容通过整体引用并入本文)。在一些实施方式中,溶酶体相关蛋白质的合适的结构域可以包括来自具有腔N-末端和胞质C-末端的溶酶体膜蛋白的结构域,然而具有不同定向的膜蛋白也可能是合适的(例如,具有腔C-末端和胞质N-末端的膜蛋白)。
所公开的胞外囊泡的融合蛋白可以可选地包括微囊泡靶向域。微囊靶向域可以将融合蛋白靶向到细胞表面,其中,融合蛋白可以掺入到细胞膜中并作为胞外囊泡(例如微囊泡)被分泌。微囊泡靶向域可以包括细胞表面蛋白的结构域,包括细胞表面受体的结构域,例如包括血小板衍生的生长因子受体(PDGFR)的G-蛋白偶联受体(GCR)。在一些实施方式中,本文考虑的“微囊泡靶向域”是“细胞表面靶向域”。细胞表面靶向域是本领域已知的。
在本文公开的融合蛋白的一些实施方式中,融合蛋白包括靶向外泌体的结构域,并且靶向外泌体的结构域是LAMP的靶向外泌体的结构域。合适的LAMP可以包括但不限于LAMP-1和LAMP-2及其同种型。(参见Fukuda等人,“编码人类溶酶体膜糖蛋白h-lamp-1和h-lamp-2的cDNA的克隆”,J.生物化学,第263卷,第35号,1988年12月,第18920-18928页;以及Fukuda,“溶酶体膜糖蛋白”,J.生物化学,第266卷,第32号,1991年11月,第21327、21330页。)LAMP是具有腔(即,胞质外)N-末端和胞质C-末端的溶酶体膜蛋白。(参见id.)。可以用不同的方式处理用于表达LAMP的mRNA以提供同种型。例如,对于LAMP-2有三种同种型,分别被命名为LAMP-2a、LAMP-2b和LAMP-2c。(参见UniProt数据库,条目号P13473-LAMP2_HUMAN,其内容通过整体引用并入本文)。LAMP-1具有单个同种型。(参见UniProt数据库,条目号P11279-LAMP1_HUMAN,其内容通过整体引用并入本文)。LAMP-2a、LAMP-2b和LAMP-2c的全长氨基酸序列在本文中分别被提供为SEQ ID NO:20、21和22。LAMP-1的全长氨基酸序列在本文中被提供为SEQ ID NO:26。本文公开的融合蛋白可以包括本文考虑的LAMP或其变体的全长氨基酸序列,其具有与野生型LAMP的氨基酸序列相比的一定百分比的序列同一性,或其包含野生型LAMP的一部分的片段(例如,分别包含LAMP-2a、LAMP-2b、LAMP-2c和LAMP-1的C-末端的一部分的SEQ ID NO:23、24、25和27)。
对于LAMP,已经表明C-末端(例如,包含10-11个C-末端氨基酸)对于将LAMP靶向到溶酶体是很重要的。(参见id.和Fukuda 1991)。在所公开的胞外囊泡的一些实施方式中,融合蛋白包含与SEQ ID NO:23、24、25和27中的一个的C-末端融合的RNA结合域,其分别包含LAMP-2a、LAMP-2b、LAMP-2c和LAMP-1的C-末端的一部分)。融合蛋白可以包括LAMP的胞质域,并且可以可选地包括另外的氨基酸序列(例如,跨膜域的至少一部分和/或腔域的至少一部分)。
在一些实施方式中,靶向外泌体的结构域是LIMP的靶向外泌体的结构域。合适的LIMP可以包括但不限于LIMP-1(CD63)和LAMP-2及其同种型。LIMP是具有一个或多个腔域、多个跨膜域和胞质C-末端的溶酶体膜蛋白。(参见Ogata等人,“Limp II膜糖蛋白的溶酶体靶向需要在其细胞质尾部的特定位置的新型Leu-Ile基序”,J.生物化学,第269卷,第7号,1994年2月,第5210-5217页)。可以用不同的方式处理用于表达LIMP的mRNA以提供同种型。例如,对于LIMP-1有三种同种型,分别被命名为LIMP-1a、LIMP-1b和LIMP-1c,而对于LIMP-2有两种同种型,被命名为LIMP-2a和LIMP-2b。(参见UniProt数据库,条目号Q10148-SCRB2_HUMAN,和UniProt数据库,条目号P08962-CD63_HUMAN,其内容通过整体引用并入本文)。LIMP-1a、LIMP-1b和LIMP-1c的全长氨基酸序列在本文中分别被提供为SEQ ID NO:28、29和30。LIMP-2A和LIMP-2b的全长氨基酸序列在本文中分别被提供为SEQ ID NO:32和33。本文公开的融合蛋白可以包括本文考虑的LIMP或其变体的全长氨基酸序列,其具有与野生型LIMP的氨基酸序列相比的一定百分比的序列同一性,或其包含野生型LIMP的一部分的片段(例如,包含LIMP-1a、LIMP-1b、LIMP-1C的C-末端的一部分的SEQ ID NO:31,和包含LIMP-2a和LIMP-2b的C-末端的一部分的SEQ ID NO:34)。
对于LIMP,已经表明C-末端(例如,包含14-19个C-末端氨基酸)对于将LAMP靶向到溶酶体是很重要的。(参见Ogata等人)。在所公开的胞外囊泡的一些实施方式中,融合蛋白包含与SEQ ID NO:31和34中的一个的C-末端融合的RNA结合域,其包含LIMP-1a、LIMP-1b、LIMP-1c以及LIMP-2a和LIMP-2b的C-末端的一部分)。融合蛋白可以包括LIMP的胞质域,并且可以可选地包括另外的氨基酸序列(例如,跨膜域的至少一部分和/或腔域的至少一部分)。
在本文公开的融合蛋白的一些实施方式中,靶向外泌体的结构域是CD63或其同种型的靶向外泌体的结构域。可以用别名交替地指代CD63蛋白,包括溶酶体整合膜蛋白1(LIMP-1)、MLA1、溶酶体相关膜蛋白3、眼黑素瘤相关抗原、黑素瘤1抗原、黑素瘤相关抗原ME491、四跨膜蛋白-30、肉芽肿和Tspan-30。CD63的同种型可以包括CD63同种型A(即,LIMP-1a(SEQ ID NO:28))、CD63同种型C(即,LIMP-1b(SEQ ID NO:29))和CD63同种型D前体(在本文中被提供为SEQ ID NO:35)。
在本文公开的融合蛋白的一些实施方式中,靶向外泌体的结构域是病毒跨膜蛋白的靶向外泌体的结构域。病毒跨膜蛋白是本领域已知的。(参见例如,领域病毒学,第六版,2013.还参见White等人,Crit.Rev.Biochem.分子生物学.2008;43(3):189-219)。具体地,靶向外泌体的结构域可以是水泡性口炎病毒的G糖蛋白(VSV G-蛋白)的靶向外泌体的结构域。VSV G-蛋白的氨基酸序列在本文中被提供为SEQ ID NO:36。
所公开的胞外囊泡还可以包含试剂,例如治疗剂,其中,胞外囊泡将试剂递送至靶细胞。胞外囊泡所包含的药剂可以包括但不限于治疗性药物(例如,小分子药物)、治疗性蛋白质和治疗性核酸(例如,治疗性RNA)。在一些实施方式中,所公开的胞外囊泡包含治疗性RNA作为所谓的“货物RNA”。例如,在一些实施方式中,融合蛋白还可以包含RNA-结构域(例如,在融合蛋白的胞质C-末端),其与货物RNA中存在的一种或多种RNA基序结合,以便在从细胞分泌到胞外囊泡之前将货物RNA包装到胞外囊泡中。这样,融合蛋白可以充当“靶向蛋白”和“包装蛋白”两者。在一些实施方式中,包装蛋白可以被称为胞外囊泡装载蛋白或“EV装载蛋白”。(参见Hung和Leonard,“用于主动装载货物RNA以阐明EV介导递送的限制性步骤的平台”,J.Extracellular Vesicles,2016,5:31027,2016年5月13日公布,其内容通过整体引用并入本文。)
总之,在一些实施方式中,所公开的胞外囊泡的融合蛋白可以具有被如下表征的结构:N
所公开的胞外囊泡可以包含货物核酸,例如货物RNA。在胞外囊泡包含货物RNA的实施方式中,货物RNA可以被描述为融合RNA,其包含:(1)结合融合蛋白RNA-结合域的RNA基序,以及进一步的(2)用于治疗目的的另外的功能性RNA序列(例如,miRNA、shRNA、mRNA、ncRNA、sgRNA或任意这些RNA的组合)。RNA也可以被动地被装载。
所公开的胞外囊泡的货物RNA可以具有任何合适的长度。例如,在一些实施方式中,货物RNA可以具有至少约10nt、20nt、30nt、40nt、50nt、100nt、200nt、500nt、1000nt、2000nt、5000nt或更长的核苷酸长度。在其他实施方式中,货物RNA可以具有不超过约5000nt、2000nt、1000nt、500nt、200nt、100nt、50nt、40nt、30nt、20nt或10nt的核苷酸长度。在更进一步的实施方式中,货物RNA的核苷酸长度可以在所考虑这些的核苷酸长度中的任何一个所限制的范围内,例如,在约10nt-5000nt的范围内的核苷酸长度或其他范围。所公开的胞外囊泡的货物RNA可以相对较长,例如,其中,货物RNA包含mRNA或另一相对较长的RNA。
用于本发明公开的胞外囊泡的组分的合适的RNA结合域和RNA基序可以包括但不限于噬菌体的RNA结合域和RNA基序。(参见,例如,KerVer-Bibens等人,“通过噬菌体蛋白将蛋白质束缚到RNA”,生物细胞(2008)100,125-138,其内容通过整体引用并入本文。
在所公开的胞外囊泡的一些实施方式中,融合蛋白的RNA结合域是MS2噬菌体或R17噬菌体的外壳蛋白的RNA结合域,其可以被认为是可互换的。(参见,例如,Keryer-Bibens等人;和Stockley等人,“通过噬菌体MS2外壳蛋白探测序列特异性RNA识别”,核酸.Res.,1995,第23卷,第13号,第2512-2518页,其内容通过整体引用并入本文)。MS2噬菌体的外壳蛋白的全长氨基酸序列在本文中被提供为SEQ ID NO:1。本文公开的融合蛋白可以包括本文考虑的MS2噬菌体或其变体的外壳蛋白的全长氨基酸序列,其具有与MS2噬菌体的外壳蛋白的氨基酸序列相比的一定百分比的序列同一性,或其包含MS2噬菌体的外壳蛋白的一部分的片段(例如,MS2或SEQ ID NO:2的RNA结合域,包含MS2噬菌体的外壳蛋白的氨基酸序列(2-22))。
在融合蛋白包含MS2噬菌体的外壳蛋白的RNA结合域的实施方式中,货物RNA通常包含MS2噬菌体RNA的RNA基序,其可以形成结合至融合蛋白的RNA结合域的高亲和力结合环。(参见PeabodV等人,“噬菌体MS2外壳蛋白的RNA结合位点”,The EMBO J.,第12卷,第2号,第595-600页,1993;Keryer-Bibens等人;和Stockley等人,其内容通过整体引用并入本文)。已经表征了MS2噬菌体和R17噬菌体的RNA基序。(参见id.)。已确定RNA基序最少包含21-nt茎-环结构,其中,形成茎的核苷酸的同一性似乎并不影响外壳蛋白对RNA基序的亲和力,但是其中,环的序列包含4-nt序列(AUUA(SEQ ID NO:3)),其实际上影响外壳蛋白对RNA基序的亲和力。同样重要的是在环上游的两个核苷酸的未配对腺苷酸。在所公开的胞外囊泡的一些实施方式中,RNA基序包含一个或多个野生型和/或高亲和力结合环,其包含选自由以下组成的组的序列和结构:
SEQ ID NO:4
其中,N-N是任何两个碱基配对的RNA核苷酸(例如,其中,每次出现的N-N独立地选自A-U、C-G、G-C、G-U、U-A或U-G中的任何一个,并且每次出现的N-N可以相同或不同)。具体地,高亲和力结合环可以包含选自由以下组成的组的序列:SEQ ID NO:7(5’-ACAUGAGGAUUACCCAUGU-3’)、SEQ ID NO:8(5’-ACAUGAGGACUACCCAUGU-3’)和SEQ ID NO:9(5’-ACAUGAGGAUCACCCAUGU-3’)、或其具有一定百分比的序列同一性的变体。
优选地,融合蛋白的RNA结合域以至少约1x 10
除了用于结合至融合蛋白的RNA结合域的RNA基序之外,货物RNA还可以包括用于治疗目的的另外的功能性RNA序列(例如,miRNA、shRNA、mRNA、ncRNA、sgRNA、或任意这些RNA的组合)。(参见Marcus等人,“FedExosomes:真实递送的工程治疗性生物纳米颗粒”,医药品2013,6,659-680;
在所公开的胞外囊泡的其他实施方式中,融合蛋白的RNA结合域是λ噬菌体(其可以包括但不限于λ噬菌体、P22噬菌体和phi21噬菌体)的N-蛋白的RNA结合域。(参见,例如,Keryer-Bibens等人;Bahadur等人,“通过分子动力学模拟研究的噬菌体P22 N-肽与boxBRNA基序的结合”,生物物理学J.,第97卷,2009年12月,3139-3149;Cilley等人,“噬菌体phi21 N肽-boxB RNA复合物中的结构拟态”,RNA(2003),9:663-376,其全部内容通过整体医用并入本文)。λ噬菌体、P22噬菌体和phi21噬菌体的N-蛋白的全长氨基酸序列在本文中分别被提供为SEQ ID NO:10、11和12。本文公开的融合蛋白可以包括本文考虑的λ噬菌体或其变体的N-蛋白的全长氨基酸序列,其具有与λ噬菌体的N-蛋白的氨基酸序列相比的一定百分比的序列同一性,或其包含λ噬菌体的N-蛋白的一部分的片段(例如,λ噬菌体、P22噬菌体和phi21噬菌体中的任何一个的N-蛋白的RNA结合域,或SEQ ID NO:13、14和15,其分别包含λ噬菌体、P22噬菌体和phi21噬菌体的N-蛋白的部分)。
在融合蛋白包含λ噬菌体的外壳蛋白的RNA结合域的实施方式中,货物RNA通常包含λ噬菌体RNA的RNA基序,其可以形成结合至融合蛋白的RNA结合域的被称为“boxB”的高亲和力结合环。(参见Keryer-Bibens等人)。λ噬菌体的BoxB已被表征。(参见id.;Bahadur等人;和Cilley等人)。对于λ噬菌体,已确定boxB最少包含15-nt茎-环结构,其中,形成茎和环的核苷酸的同一性会影响外壳蛋白对RNA基序的亲和力。(参见Keryer-Bibens等人)。在所公开的胞外囊泡的一些实施方式中,RNA基序包含一个或多个高亲和力结合环,其包含选自由以下组成的组的序列和结构:
SEQ ID NO:16
对于P22噬菌体,已确定boxB最少包含15-nt茎-环结构,其中,形成茎和环的核苷酸的同一性会影响外壳蛋白对RNA基序的亲和力。(参见Bahadur等人)。在所公开的胞外囊泡的一些实施方式中,RNA基序包含一个或多个高亲和力结合环,其包含以下序列和结构:
SEQ ID NO:18
对于phi21噬菌体,已确定boxB最少包含20-nt茎-环结构,其中,形成茎和环的核苷酸的同一性会影响外壳蛋白对RNA-基序的亲和力。(参见Cilley等人)。在所公开的胞外囊泡的一些实施方式中,RNA基序包含一个或多个高亲和力结合环,其包含以下序列和结构:
SEQ ID NO:19
在一些实施方式中,所公开的胞外囊泡的融合蛋白包含Cas9蛋白的RNA结合域。在这样的实施方式中,所公开的胞外囊泡可以包含货物RNA,其包含这样的序列:所述序列被RNA结合域识别和结合,并且被主动地包装到胞外囊泡中。
所公开的胞外囊泡可以通过本领域已知的方法制备。例如,所公开的胞外囊泡可以通过以下方式制备:(a)在真核细胞中表达编码包装/融合蛋白的mRNA;和(b)在真核细胞中表达货物RNA或货物蛋白(用在硅胶中制备的货物RNA转导真核细胞)。包装/融合蛋白的mRNA和货物RNA可以从载体被表达,所述载体被转染到合适的生产细胞中以产生所公开的胞外囊泡。注意,载体也可以被稳定地转染。包装/融合蛋白的mRNA和货物RNA可以从同一载体被表达(例如,其中,载体表达包装/融合蛋白的mRNA和来自单独的启动子的货物RNA),或者包装/融合蛋白的mRNA和货物RNA可以从单独的载体被表达。用于表达包装/融合蛋白的mRNA和货物RNA的一种或多种载体可以被包装在设计用于制备所公开的胞外囊泡的试剂盒中。
本文还考虑了用于使用所公开的胞外囊泡的方法。例如,所公开的胞外囊泡可以用于将治疗剂(例如货物RNA或货物蛋白或货物RNA-蛋白复合物)递送至靶细胞,其中,所述方法包括使靶细胞与所公开的胞外囊泡接触。可以将所公开的胞外囊泡配制成用于治疗疾病或病症的药物组合物的一部分,并且可以将该药物组合物给药于需要该药物组合物的患者以将货物分子递送至靶细胞以便治疗疾病或病症。
所公开的胞外囊泡可以包括货物蛋白(例如,治疗性蛋白质或蛋白质/RNA复合物)。在一些实施方式中,治疗性蛋白质被主动地包装在胞外囊泡中(例如,通过治疗性蛋白质与融合蛋白之间的相互作用)。
所公开的胞外囊泡可以包含新型的蛋白质、多肽或肽。如本文中所使用的,术语“蛋白质”或“多肽”或“肽”可互换使用,以指代氨基酸的聚合物。通常,“多肽”或“蛋白质”被定义为较长的氨基酸聚合物,其长度通常大于50、60、70、80、90或100个氨基酸。“肽”被定义为短的氨基酸聚合物,其长度通常为50、40、30、20个或更少的氨基酸。
本文考虑的“蛋白质”通常包含天然或非天然存在的氨基酸(例如,丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸)。本文考虑的蛋白质可以在体外或体内被进一步改性以包括非氨基酸部分。这些改性可以包括但不限于酰化(例如,O-酰化(酯)、N-酰化(酰胺)、S-酰化(硫酯))、乙酰化(例如,在蛋白质的N-末端处或在赖氨酸残基处添加乙酰基)、甲酰化脂化(例如,脂酸、C8官能团的附接)、肉豆蔻酰化(例如,肉豆蔻酸盐、C14饱和酸的附接)、棕榈酰化(例如,棕榈酸盐、C16饱和酸的附接)、烷化(例如,在赖氨酸或精氨酸残基处添加烷基,如甲基)、异戊二烯化或异戊烯化(例如,添加类异戊二烯基,如金合欢醇或香叶基香叶醇)、在C-末端处酰胺化、糖基化(例如,向天冬酰胺、羟赖氨酸、丝氨酸或苏氨酸中添加糖基,产生糖蛋白)。与糖化(其被认为是糖的非酶附接)不同,多唾液酸化(例如,添加多唾液酸)、糖基磷脂酰肌醇化(例如,糖基磷脂酰肌醇(GPI))锚定(例如,甲状腺激素的)形成、羟基化、碘化,以及磷酸化(例如,通常向丝氨酸、酪氨酸、苏氨酸或组氨酸中添加磷酸基)。
术语“氨基酸残基”还可以包括由以下组成的组中包含的氨基酸残基:同型半胱氨酸、2-氨基己二酸、N-乙基天冬酰胺、3-氨基己二酸、羟赖氨酸、β-丙氨酸、β-氨基丙酸、别羟赖氨酸、2-氨基丁酸、3-羟脯氨酸、4-氨基丁酸、4-羟脯氨酸、哌啶酸、6-氨基己酸、异锁链素、2-氨基庚酸、别异亮氨酸、2-氨基异丁酸、N-甲基甘氨酸、肌氨酸、3-氨基异丁酸、N-甲基异亮氨酸、2-氨基庚二酸、6-N-甲基赖氨酸、2,4-二氨基丁酸、N-甲基缬氨酸、锁链素、戊氨酸、2,2′-二氨基庚二酸、正亮氨酸、2,3-二氨基丙酸、鸟氨酸和N-乙基甘氨酸。
本文公开的蛋白质可以包括“野生型”蛋白质及其变体、突变体和衍生物。如本文中所使用的,术语“野生型”是本领域技术人员能够理解的术语,并且是指与突变体或变体形式不同的自然存在的有机体、菌株、基因或特征的典型形式。如本文中所使用的,“变体”、“突变体”或“衍生物”是指具有不同于参考蛋白或多肽分子的氨基酸序列的蛋白分子。变体或突变体可以相对于参考分子具有一个或多个氨基酸残基的插入、缺失或取代。变体或突变体可以包括参考分子的片段。例如,突变体或变体分子可以相对于参考多肽对至少一个氨基酸残基(例如,SEQ ID NO:1-40中的任何一个)进行插入、缺失或取代中的一种或多种。MS2噬菌体的全长外壳蛋白序列、λ噬菌体的全长N-蛋白序列、P22噬菌体的全长N-蛋白序列、phi21噬菌体的全长N-蛋白的序列、全长LAMP-2a的序列、全长LAMP-2b的序列以及全长LAMP-2c的序列分别被表示为SEQ ID NO:1、10、11、12、20、21和22,并且可以在这方面用作参考。
关于蛋白质,“缺失”是指氨基酸序列的改变,其引起一个或多个氨基酸残基不存在。缺失移除至少1、2、3、4、5、10、20、50、100或200个氨基酸残基或由这些值中的任意值定界的范围的氨基酸残基(例如,缺失5-10个氨基酸)。缺失可以包括内部缺失或末端缺失(例如,参考多肽的N-末端截断或C-末端截断)。参考多肽序列的“变体”、“突变体”或“衍生物”可以包括相对于参考多肽序列的缺失。
关于蛋白质,“片段”是氨基酸序列的一部分,其序列与参考序列相同,但长度短于参考序列。片段可以包含达参考序列的整个长度减去至少一个氨基酸残基。例如,片段可以分别包含参考多肽的5至1000个连续氨基酸残基。在一些实施方式中,片段可以包含参考多肽的至少5、10、15、20、25、30、40、50、60、70、80、90、100、150、250或500个连续氨基酸残基;在其他实施方式中,片段可以包含参考多肽的少于约5、10、15、20、25、30、40、50、60、70、80、90、100、150、250或500个连续氨基酸残基;或者在其他实施方式中,片段的长度在这些值中的任意值定界的范围内(例如,参考多肽的50-100个连续氨基酸的范围)。片段可以优先选自分子的某些区域。术语“至少一个片段”涵盖了全长多肽。例如,蛋白质的片段可以包含SEQ ID NO:1-40中的任何一个的全长蛋白质的氨基酸序列的连续部分或者本质上由其组成。相对于全长蛋白质,片段可以包括N-末端截断、C末端-截断或这两种截断。参考多肽序列的“变体”、“突变体”或“衍生物”可以包括参考多肽序列的片段。
关于蛋白质,词语“插入”和“添加”是指氨基酸序列的改变,其引起一个或多个氨基酸残基的添加。插入或添加可以指1、2、3、4、5、10、20、30、40、50、60、70、80、90、100、150、200或更多个氨基酸残基,或者由这些值中的任意值定界的氨基酸残基的范围(例如,5-10个氨基酸的插入或添加)。参考多肽序列的“变体”、“突变体”或“衍生物”可以包括相对于参考多肽序列的插入或添加。蛋白质的变体可以具有N-末端插入、C-末端插入、内部插入,或者N-末端插入、C-末端插入和内部插入的任何组合。
“融合多肽”是指这样的多肽:该多肽在其氨基酸序列的N-末端、C-末端或在这两个末端包含异源氨基酸序列。参考多肽序列的“变体”可以包括包含参考多肽的融合多肽。
关于蛋白质,短语“同一性百分比”和“%同一性”是指使用标准化算法比对的至少两个氨基酸序列之间的残基匹配的百分比。氨基酸序列比对的方法是众所周知的。一些比对方法考虑了保守性氨基酸取代。下文更详细解释的这样的保守性取代通常在取代位点保留电荷和疏水性,从而保留多肽的结构(并因此保留功能)。氨基酸序列的百分比同一性可以如本领域中已知的那样来确定。(参见,例如,专利号为7,396,664的美国专利,其通过整体引用并入本文)。美国国家生物技术信息中心(NCBI)基本本地比对搜索工具(BLAST)提供了一套常用且可免费获得的序列比较算法,其可从多种渠道获得,包括马里兰州贝塞斯达市的NCBI,可在其网站上获得。BLAST软件套件包括各种序列分析程序,包括“blastp”,其用于将已知的氨基酸序列与来自各种数据库的其他氨基酸序列进行比对。如本文所述,变体、突变体或片段(例如,蛋白质变体、突变体或其片段)可以具有相对于参考分子的99%、98%、97%、96%、95%、94%、93%、92%、91%、90%、80%、70%、60%、50%、40%、30%或20%的氨基酸序列同一性(例如,相对于SEQ ID NO:1-40中的任何一个)。
关于蛋白质,百分比同一性可以在整个定义的(例如,如由特定的SEQ ID号所定义的)多肽序列的长度上测量,或者可以在较短的长度上(例如,在从较大的定义的多肽序列取得的片段(例如,至少15、至少20、至少30、至少40、至少50、至少70或至少150个连续残基的片段)的长度上)测量。这样的长度仅是示例性的,并且应当理解,在表、附图或序列表中由本文所示的序列支持的任何片段长度都可以用于描述可以测量百分比同一性的长度。
关于蛋白质,本文考虑的变体、突变体或衍生物的氨基酸序列可以包括相对于参考氨基酸序列的保守性氨基酸取代。例如,变体、突变体或衍生蛋白可以包括相对于参考分子的保守性氨基酸取代。“保守性氨基酸取代”是指氨基酸被不同的氨基酸取代的那些取代,其中,预测取代对参考多肽的性质的干扰最小。换句话说,保守性氨基酸取代基本上保留了参考多肽的结构和功能。下表提供了本文考虑的示例性保守性氨基酸取代的列表:
保守性氨基酸取代通常维持:(a)取代区域中多肽骨架的结构,例如,呈β片层或α螺旋构象,(b)取代位点上分子的电荷或疏水性,和/或(c)大部分侧链。
所公开的或本文所述的蛋白质、突变体、变体可以具有由参考多肽展示出的一种或多种功能或生物学活性(例如,由野生型蛋白质展示出的一种或多种功能或生物学活性)。例如,所公开的蛋白质、突变体、变体或其衍生物可以具有一种或多种生物学活性,其包括:与单链RNA结合、与双链RNA结合、与靶多核苷酸序列结合以及将蛋白质靶向到囊泡(例如溶酶体或外泌体)。
所公开的蛋白质可以是基本上分离的或纯化的。术语“基本上分离的或纯化的”是指这样的蛋白质:所述蛋白质从其天然环境中被移除,并且其至少60%不含、优选为至少75%不含、更优选为至少90%不含、甚至更优选为至少95%不含与其自然相关的其他组分。
本文还公开了多核苷酸,例如编码蛋白质的多核苷酸序列(例如,对以下进行编码的DNA:多肽,所述多肽具有SEQ ID NO:1-40中的任一个的氨基酸序列;或多肽变体,所述多肽变体具有与SEQ ID NO:1-40中的任一个的至少约20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%或99%的序列同一性的氨基酸序列;对以下进行编码的DNA:SEQ ID NO:1-40中的任一个的多核苷酸序列;或多核苷酸变体,所述多核苷酸变体具有与SEQ ID NO:1-40中的任一个的至少约20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%或99%的序列同一性的核苷酸序列;包括以下的RNA:SEQ ID NO:1-40中的任一个的多核苷酸序列;或多核苷酸变体,所述多核苷酸变体具有与SEQ ID No:1-40中的任一个的至少约20%,30%,40%,50%,60%,70%,80%,90%,95%,96%,97%,98%或99%的序列同一性的核苷酸序列)。
术语“多核苷酸”、“多核苷酸序列”、“核酸”和“核酸序列”是指核苷酸、寡核苷酸、多核苷酸(这些术语可以互换使用)或其任何片段。这些短语也指基因组的、天然的或合成的来源的DNA或RNA(可以是单链或双链,并且可以代表有义链或反义链)。
关于多核苷酸序列,术语“百分比同一性”和“%同一性”是指使用标准化算法比对的至少两个多核苷酸序列之间残基匹配的百分比。这样的算法可以以标准化且可再现的方式在被比较的序列中插入缺口,以便优化两个序列之间的比对,从而实现两个序列的更有意义的比较。如本领域所理解的,可以确定核酸序列的百分比同一性。(参见,例如,专利号为7,396,664的美国专利,其通过整体引用并入本文)。美国国家生物技术信息中心(NCBI)基本本地比对搜索工具(BLAST)提供了一套常用且可免费获得的序列比较算法,其可从多种渠道获得,包括马里兰州贝塞斯达市的NCBI,可在其网站上获得。BLAST软件套件包括各种序列分析程序,包括“blastn”,用于将已知的多核苷酸序列与来自各种数据库的其他多核苷酸序列进行比对。还可以使用一种被称为“BLAST 2序列”的工具,该工具用于直接成对比较两个核苷酸序列。可以在NCBI网站上交互访问和使用“BLAST 2序列”。“BLAST 2序列”工具可以用于blastn和blastp(如上文所讨论的)。
关于多核苷酸序列,百分比同一性可以在整个定义的(例如,如由特定的SEQ ID号所定义的)多核苷酸序列的长度上测量,或者可以在较短的长度上(例如,在从较大的定义的序列获取的片段(例如,至少20、至少30、至少40、至少50、至少70、至少100、或至少200个连续核苷酸的片段)的长度上)测量。这样的长度仅是示例性的,并且应理解,本文、表格、附图或序列表中所示的序列所支持的任何片段长度可以用于描述可以测量百分比同一性的长度。
关于多核苷酸序列,可以使用以美国国家生物技术信息中心网站上可用的“BLAST2序列”工具获得的blastn将“变体”、“突变体”或“衍生物”定义为这样的核酸序列:该核酸序列具有与一个核酸序列的某一长度上的特定核酸序列的至少50%的序列同一性。(参见Tatiana A.Tatusova,Thomas L.Madden(1999),“Blast 2序列-一种用于比较蛋白质和核苷酸序列的新工具”,FEMS Microbiol Lett.174:247-250)。在一定的定义的长度上,这样的核酸对可以显示例如至少60%、至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%、或更大的序列同一性。
然而,由于遗传密码的简并性(其中多个密码子可以编码单个氨基酸),不显示高度同一性的核酸序列可以编码相似的氨基酸序列。应当理解,可以使用这种简并性使核酸序列发生改变,以产生全部编码基本上相同的蛋白质的多个核酸序列。例如,本文考虑的多核苷酸序列可以编码蛋白质并且可以被密码子优化以在特定宿主中表达。在本领域中,已经为许多宿主有机体(包括人类、小鼠、大鼠、猪、大肠杆菌、植物和其他宿主细胞)制备了密码子使用频率表。
“重组核酸”是非天然存在的序列或具有通过两个或更多个在其他情况下分离的序列片段的人工组合制成的序列。这种人工组合通常通过化学合成、或更普遍地通过人工操纵分离的核酸片段(例如通过本领域已知的基因工程技术)来完成。术语重组体包括仅通过添加、取代或缺失一部分核酸而改变的核酸。通常,重组核酸可以包括可操作地链接至启动子序列的核酸序列。这样的重组核酸可以是用于例如转化细胞的载体的一部分。
本文公开的核酸可以是“基本上分离的或纯化的”。术语“基本上分离的或纯化的”是指这样的核酸:所述核酸从其天然环境中被移除,并且其至少60%不含、优选为至少75%不含、并且更优选为至少90%不含、甚至更优选为至少95%不含与其自然相关的其他组分。
“转化”或“转染”描述了将外源核酸(例如,DNA或RNA)引入受体细胞的过程。根据本领域众所周知的各种方法,转化或转染可以在天然或人工条件下进行,并且可以依赖于将外来核酸序列插入原核或真核宿主细胞中的任何已知方法。基于转化的宿主细胞的类型选择转化或转染的方法,并且所述方法可以包括但不限于噬菌体或病毒感染或非病毒递送。核酸的非病毒递送的方法包括脂质转染、核转染、显微注射、电穿孔、热休克、粒子轰击、基因枪、病毒体、脂质体、免疫脂质体、聚阳离子或脂质核酸缀合物、裸露的DNA、人工病毒体、以及DNA的试剂增强的摄取。脂质转染在例如专利号为5,049,386、4,946,787和4,897,355)的美国专利中进行了描述,并且脂质转染试剂在市场上有销售(例如,Transfectam
本文考虑的多核苷酸序列可以存在于表达载体中。例如,载体可以包括:(a)编码蛋白质的ORF的多核苷酸;(b)对引导靶DNA序列的RNA介导的结合、切口和/或裂解的RNA进行表达的多核苷酸;以及(a)和(b)两者。载体中存在的多核苷酸可以与原核或真核启动子可操作地链接。“可操作地链接”是指第一核酸序列与第二核酸序列处于功能关系的情况。例如,如果启动子影响编码序列的转录或表达,则将该启动子与编码序列可操作地链接。可操作地链接的DNA序列可以在同一阅读框中紧邻或连续,并且在需要时连接两个蛋白质编码区。本文考虑的载体可以包含与编码蛋白质的多核苷酸可操作地链接的异源启动子(例如,真核或原核启动子)。“异源启动子”是指这样的启动子:该启动子不是正在表达的蛋白质或RNA的天然性或内源性启动子。例如,用于LAMP的异源启动子可以包括不是LAMP的天然性、内源性启动子的真核启动子或原核启动子。
如本文中所使用的,“表达”是指从DNA模板转录多核苷酸的过程(例如转录成mRNA或其他RNA转录物)和/或随后将转录的mRNA转译成肽、多肽或蛋白质的过程。转录物和编码的多肽可以统称为“基因产物”。如果多核苷酸衍生自基因组DNA,则表达可以包括在真核细胞中剪接mRNA。
术语“载体”是指可以将核酸(例如,DNA)引入宿主有机体或宿主组织中的某些方式。存在各种类型的载体,包括质粒载体、噬菌体载体、粘粒载体、细菌载体和病毒载体。如本文中所使用的,“载体”可以指已经被改造以表达异源多肽(例如,本文公开的融合蛋白)的重组核酸。重组核酸通常包括用于表达异源多肽的c/.s作用元件。
用于在真核细胞中表达的任何常规载体都可以用于将DNA直接引入对象。含有来自真核病毒的调节元件的表达载体可以用于真核表达载体(例如,含有SV40、CMV或逆转录病毒启动子或增强子的载体)。示例性载体包括在启动子的引导下表达蛋白质的那些载体,所述启动子诸如:SV40早期启动子、SV40晚期启动子、金属硫蛋白启动子、人类巨细胞病毒启动子、鼠类乳腺肿瘤病毒启动子和劳斯肉瘤病毒启动子。本文所考虑的表达载体可以包括调节异源蛋白(例如本文公开的融合蛋白)的表达的真核或原核控制序列。原核表达控制序列可以包括组成型或诱导型启动子(例如,T3、T7、Lac、trp或pho A)、核糖体结合位点或转录终止子。
本文所考虑的载体可以在原核生物中被引入和繁殖,其可以用于扩增将被引入真核细胞中的载体的拷贝,或者作为将被引入真核生物中的载体的产生中的中间载体(例如,扩增质粒作为病毒载体包装系统的一部分)。原核生物可以用于扩增载体的拷贝并表达一种或多种核酸,从而提供一种或多种蛋白质的来源以递送至宿主细胞或宿主有机体。可以利用含有组成型或诱导型启动子(其引导蛋白质或包含蛋白质或蛋白质片段的融合蛋白的表达)的载体使用大肠杆菌来执行蛋白质在原核生物中的表达。融合载体将许多氨基酸添加到其中编码的蛋白质上,例如添加到重组蛋白的氨基末端上。这样的融合载体可用于一个或多个目的,例如:(i)增加重组蛋白的表达;(ii)增加重组蛋白的溶解度;(iii)通过在亲和纯化中作为配体(例如,His标签)来辅助重组蛋白的纯化;(iv)标记重组蛋白以进行标识(例如,诸如绿色荧光蛋白(GFP)或可以被标记的抗体识别的抗原(例如,HA));(v)促进重组蛋白定位到细胞的特定区域(例如,其中,蛋白融合(例如,在其N-末端或C-末端)到核定位信号(NLS),其可以包括SV40的NLS、核质蛋白、C-myc、hnRNP A1的M9域、或合成的NLS)。已经研究了NLS中的中性和酸性氨基酸的重要性。(参见Makkerh等人(1996)Curr Biol 6(8):1025-1027)。通常,在融合表达载体中,在融合部分和重组蛋白的连接处引入蛋白水解裂解位点,以使得在纯化融合蛋白之后能够从融合部分分离重组蛋白。这样的酶及其同源识别序列包括因子Xa、凝血酶和肠激酶。
本发明公开的方法可以包括将一种或多种多核苷酸(例如本文所述的一种或多种载体)、其一种或多种转录物和/或从其转录的一种或多种蛋白质递送至宿主细胞。还考虑了通过这样的方法产生的宿主细胞、以及包含这样的细胞或由这样的细胞产生的有机体(例如动物、植物或真菌)。可以通过引入对本文所公开的编码融合蛋白和货物RNA的mRNA进行表达的载体来制备所公开的胞外囊泡。常规的基于病毒和非病毒的基因转移方法可以用于将核酸引入哺乳动物细胞或靶组织中。非病毒载体递送系统包括DNA质粒、RNA(例如本文所述的载体的转录物)、裸露的核酸、以及与递送载具(诸如脂质体)复合的核酸。病毒载体递送系统包括DNA和RNA病毒,它们在递送至细胞后具有游离基因组或整合基因组。
在本文所考虑的方法中,可以用本文所述的一种或多种载体瞬时地或非瞬时地转染(即,稳定地转导)宿主细胞。在一些实施方式中,当细胞天然存在于对象中(即,原位)时转染该细胞。在一些实施方式中,转染的细胞取自对象(即,被外植)。在一些实施方式中,细胞衍生自取自对象的细胞,例如细胞系。合适的细胞可以包括干细胞(例如,胚胎干细胞和多能干细胞)。用本文所述的一种或多种载体转染的细胞可以用于建立包含一个或多个载体衍生的序列的新细胞系。在本文所考虑的方法中,可以用本文所述的系统的组分瞬时转染细胞(例如通过一种或多种载体的瞬时转染,或用RNA转染),并通过复合物的活性进行改性,以便建立新的细胞系,所述新的细胞系包含含有改性但缺乏任何其他外源序列的细胞。
以下实施方式是例示性的,并不旨在限制要求保护的发明的范围。
实施方式1。包含靶向蛋白的胞外囊泡,其中,所述靶向蛋白是融合蛋白,所述融合蛋白包含:(i)抗体的单链可变片段(scFv),其中,所述scFv在所述胞外囊泡的表面被表达;和(ii)跨膜域(TMD),其中,所述scFv和TMD直接链接或通过接头间接链接。
实施方式2。根据实施方式1所述的胞外囊泡,其中,所述胞外囊泡是外来体或微囊泡。
实施方式3。根据实施方式1或实施方式2所述的胞外囊泡,其中,所述融合蛋白具有以下结构:N
实施方式4。根据前述实施方式中任一项所述的胞外囊泡,还包含N-末端蛋白标签、C-末端蛋白标签或者N-末端蛋白标签和C-末端蛋白标签两者。
实施方式5。根据前述实施方式中任一项所述的胞外囊泡,其中,所述跨膜将所述融合蛋白靶向到所述胞外囊泡的膜。
实施方式6。根据前述实施方式中任一项所述的胞外囊泡,其中,所述跨膜域是细胞受体蛋白的跨膜域。
实施方式7。根据实施方式6所述的胞外囊泡,其中,所述细胞受体蛋白是血小板衍生的生长因子受体。
实施方式8。根据前述实施方式中任一项所述的胞外囊泡,其中,所述跨膜域是溶酶体相关的膜蛋白的跨膜域。
实施方式9。根据前述实施方式中任一项所述的胞外囊泡,其中,所述溶酶体膜蛋白包含腔N-末端和胞质C-末端。
实施方式10。根据前述实施方式中任一项所述的胞外囊泡,其中,所述跨膜域包含LAMP-1或LAMP-2的跨膜域。
实施方式11。根据前述实施方式中任一项所述的胞外囊泡,其中,所述融合蛋白还包含:(iii)改造的糖基化位点。
实施方式12。根据实施方式11所述的胞外囊泡,其中,所述融合蛋白具有选自以下的结构:(i)N
实施方式13。根据实施方式11或12所述的胞外囊泡,其中,所述糖基化位点包含选自SEQ ID NO:37和SEQ ID NO:38的序列。
实施方式14。根据前述实施方式中任一项所述的胞外囊泡,其中,所述融合蛋白还包含:(iv)靶向外泌体的结构域。
实施方式15。根据实施方式14所述的胞外囊泡,其中,所述融合蛋白具有以下结构:(i)N
实施方式16。根据实施方式14或15所述的胞外囊泡,其中,所述外泌体靶向域包含:序列,所述序列选自由以下组成的组:SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、SEQID NO:27、SEQ ID NO:28、SEQ ID NO:29、SEQ ID NO:31、以及SEQ ID NO:34、SEQ ID NO:35和SEQ ID NO:36;或所述序列的变体,所述序列的变体分别具有与SEQ ID NO:23、SEQ IDNO:24、SEQ ID NO:25、SEQ ID NO:27、SEQ ID NO:28、SEQ ID NO:29、SEQ ID NO:31、以及SEQ ID NO:34、SEQ ID NO:35和SEQ ID NO:36的至少80%的氨基酸序列同一性。
实施方式17。根据前述实施方式中任一项所述的胞外囊泡,其中,所述胞外囊泡还包含选自由以下组成的组的治疗剂:小分子治疗性、治疗性RNA和治疗性蛋白质。
实施方式18。根据前述实施方式中任一项所述的胞外囊泡,其中,所述胞外囊泡还包含治疗性RNA作为货物RNA,并且所述融合蛋白还包含所述货物RNA的RNA结合域,和/或所述胞外囊泡还包含治疗性蛋白质作为货物蛋白,并且所述融合蛋白还包含与所述治疗性蛋白质上的同源域结合的结构域。
实施方式19。根据实施方式18所述的胞外囊泡,其中,所述融合蛋白具有以下结构:N
实施方式20。根据实施方式18所述的胞外囊泡,其中,所述货物RNA包含RNA基序,并且所述融合蛋白的RNA结合域与所述货物RNA的RNA基序特异性结合。
实施方式21。根据实施方式18所述的胞外囊泡,其中,所述RNA结合域是噬菌体的RNA结合域,并且其中,所述RNA基序包含所述噬菌体的RNA的一个或多个高亲和力结合环。
实施方式22。根据实施方式21所述的胞外囊泡,其中,所述RNA结合域是MS2噬菌体的RNA结合域,其包含SEQ ID NO:2或其具有与SEQ ID NO:2的至少80%的氨基酸序列同一性的变体,并且其中,所述RNA基序包含一个或多个高亲和力结合环,其包含选自由以下组成的组的序列和结构:
SEQ ID NO:4
其中,N-N是任意两个碱基配对的RNA核苷酸。
实施方式23。根据实施方式21所述的胞外囊泡,其中,所述高亲和力结合环包含:选自由SEQ ID NO:7、SEQ ID NO:8和SEQ ID NO:9组成的组的序列,或其分别具有与SEQ IDNO:7、SEQ ID NO:8和SEQ ID NO:9的至少80%的氨基酸序列同一性的变体。
实施方式24。根据实施方式23所述的胞外囊泡,其中,所述RNA结合域是λ噬菌体的N-蛋白的RNA结合域,其包含SEQ ID NO:13或其具有与SEQ ID NO:13的至少80%的氨基酸序列同一性的变体,并且其中,所述RNA基序包含一个或多个高亲和力结合环,其包含选自由以下组成的组的序列和结构:
SEQIDNO:16
实施方式25。根据实施方式21所述的胞外囊泡,其中,所述RNA结合域是P22噬菌体的N-蛋白的RNA结合域,其包含SEQ ID NO:14或其具有与SEQ ID NO:14的至少80%的氨基酸序列同一性的变体,并且其中,所述RNA基序包含一个或多个高亲和力结合环,其包含以下序列和结构:
SEQ ID NO;18
实施方式26。根据实施方式25所述的胞外囊泡,其中,所述RNA结合域是phi22噬菌体的N-蛋白的RNA结合域,其包含SEQ ID NO:15或其具有与SEQ ID NO:15的至少80%的氨基酸序列同一性的变体,并且其中,所述RNA基序包含一个或多个高亲和力结合环,其包含以下序列和结构:
SEQ ID NO:19
实施方式27。根据实施方式18所述的胞外囊泡,其中,所述货物RNA是杂合RNA,其包含所述RNA基序,并且还包含miRNA、shRNA、mRNA、ncRNA、sgRNA或任意这些RNA的组合。
实施方式28。一种用于制备根据前述实施方式中任一项所述的胞外囊泡的方法,所述方法包括在真核细胞中表达编码融合蛋白的mRNA。
实施方式29。一种用于制备根据实施方式18所述的胞外囊泡的方法,所述方法包括:(a)在真核细胞中表达编码融合蛋白的mRNA,以及(b)在真核细胞中表达货物RNA或用所述货物RNA转导所述真核细胞,或者表达所述货物蛋白。
实施方式30。一种用于制备根据实施方式18所述的胞外囊泡的试剂盒,所述试剂盒包括:(a)用于表达融合蛋白的载体,和(b)用于表达货物RNA或货物蛋白或RNA/蛋白质复合物的载体。
实施方式31。根据实施方式30所述的试剂盒,其中,所述载体是分开的载体。
以下实施例是例示性的,并不旨在限制要求保护的主题的范围。
参考Devin M.Stranford和Joshua N.Leonard于2017年10月2日在艾滋病研究第三海岸中心(CFAR)研讨会发表的题为“用于灭活HIV原病毒DNA的靶向核酸酶的改造胞外囊泡介导递送”的壁报论文,其内容通过整体引用并入本文。
治愈HIV感染的主要障碍是细胞中潜伏病毒库的持久性。最近已经证明,使用Cas9和组合式指导RNA可以破坏潜伏原病毒并防止病毒逃逸。该试点项目将研究使用胞外囊泡以临床上可转译的方式将Cas9治疗递送给T细胞
当治疗中断或失败时,潜伏的HIV原病毒会增加病毒载量,并且消除这样的储库是尚未满足的临床需求。一种有前途的策略是使用改造的核酸酶,例如Cas9,靶向T细胞中的HIV基因组以破坏原病毒DNA。尽管这种方法在体外损害了病毒的复制,但转译这种方法需要克服一些挑战。
HIV迅速从靶向蛋白质编码或非必需序列的核酸酶中逃逸。(参见图1)。然而,最近的一份报告表明,同时靶向某些对带有Cas9的HIV基因座可抑制病毒复制和逃逸。(参见图2,来自Wang等人“对HIV-1 DNA的组合式CRISPR-Cas9攻击可消除感染的T细胞培养物中的所有传染性Pro病毒”,细胞报告,第17卷,第11期,第2819-2826页,2016年12月13日;其内容通过整体引用并入本文)。在实践中,消除病毒可能需要多重且可能相继的靶向核酸酶处理以抑制出现的病毒。
此外,还没有标识用于将核酸酶递送至T细胞的易于转译的策略,特别是如果需要多种轮次/类型的治疗时。因此,需要用于将靶向治疗剂递送至体内T细胞的新方法。
EV是在许多类型的细胞之间转移RNA和蛋白质的纳米级颗粒。(参见图3)。EV越来越被认为是可行的治疗性递送载具,因为其与合成递送载具相比展示出良好的稳定性、无毒性和递送性。对EV进行改造以装载所需货物并靶向某些细胞的能力使其成为有望将核酸酶递送至T细胞的载具。
我们旨在通过利用分泌的EV介导的转移来开发用于将治疗性生物分子递送至T细胞的新策略。具体地,我们将探索通过在EV表面显示各种蛋白质将EV靶向到T细胞的不同方法,并结合多种引导RNA研究Cas9蛋白质或mRNA的装载和递送。(参见图4)。
EV生产细胞中的感兴趣的货物的过量生产导致EV中积累的增加。将利用各种T细胞转染生产者HEK293FT细胞,其将构建体靶向到产生的显示这样的构建体的EV。图5例示了显示抗CD2 scFV的EV,其将这些EV靶向到潜在感染了HIV的带有CD2的细胞,例如T细胞。图6例示了显示麻疹病毒糖蛋白变体H和F的EV,其将这些EV靶向到带有CD46的细胞和带有信号淋巴细胞激活分子(SLAM)的细胞。这些EV可以用于转导静止的T细胞。图7例示了显示细胞间粘附分子1(ICAM-1)的EV,其将这些EV靶向到带有淋巴细胞功能相关抗原1(LFA-1)的细胞。这些EV可以用于增加树突细胞衍生EV的摄取。
将用Cas9和sgRNA转染生产细胞以研究向受体细胞的装载和功能性递送。(参见图8)。如果需要,将探索Cas9蛋白质或mRNA与富含EV的蛋白质之间的改造的相互作用,以增加装载。
需要:因为T细胞展示出较低的内吞率,所以需要增加受体细胞摄取EV的方法。目前尚未探索的一种方法是在EV表面显示scFv,以增加EV与靶细胞之间的结合。在这里,我们研究了抗CD2 scFv对EV的显示,以特异性靶向T细胞。(参见图9和10)。
抗CD2 scFv与血小板衍生的生长因子受体跨膜域的融合引起scFv定位于EV的两个子集:微囊泡(其直接从细胞表面出芽)和外泌体(其起源于内吞途径)。
装载细胞裂解物(2μg)或EV(每泳道8.9x 10
作为正在进行的工作的一部分,我们正在探索增加scFv在EV上的显示的方法。我们也正在研究显示scFv的EV与细胞系和初始T细胞的结合和摄取。此外,我们还在EV表面显示了麻疹病毒糖蛋白变体H和F,并正在研究其对EV摄取的影响。最后,我们计划评估将Cas9和sgRNA装载到EV中以及向受体细胞的功能递送。(参见图11)。
在前面的描述中,对于本领域技术人员而言将显而易见的是,在不脱离本发明的范围和精神的情况下,可以对本文公开的发明进行各种替换和修改。可以在不存在本文未具体公开的任何一个或多个元素、一个或多个限制的情况下适当地实践本文例示性地描述的本发明。已经采用的术语和表述用作描述性而非限制性的术语,并且不旨在当使用这样的术语和表述时排除所示出和描述的特征或其部分的任何等同形式,而应认识到在本发明的范围内可以进行各种修改。因此,应当理解,尽管已经通过特定的实施方式和可选的特征例示了本发明,但是本领域技术人员可以对本文公开的概念进行修改和/或改变,并且这样的修改和改变被认为处于本发明的范围内。
本文引用了许多专利和非专利参考文献。所引用的参考文献通过整体引用并入本文。如果说明书中术语的定义与所引用的参考文献中的术语的定义之间存在不一致,则应基于说明书中的定义来解释该术语。
序列表
<110> 西北大学
Leonard, Joshua N
Stranford, Devin M.
<120> 包含基于靶向亲和域的膜蛋白的胞外囊泡
<130> 702581.00304
<150> US 62/655,521
<151> 2018-04-10
<160> 52
<170> PatentIn 版本 3.5
<210> 1
<211> 130
<212> PRT
<213> 轻小病毒噬菌体 MS2
<400> 1
Met Ala Ser Asn Phe Thr Gln Phe Val Leu Val Asp Asn Gly Gly Thr
1 5 10 15
Gly Asp Val Thr Val Ala Pro Ser Asn Phe Ala Asn Gly Val Ala Glu
20 25 30
Trp Ile Ser Ser Asn Ser Arg Ser Gln Ala Tyr Lys Val Thr Cys Ser
35 40 45
Val Arg Gln Ser Ser Ala Gln Asn Arg Lys Tyr Thr Ile Lys Val Glu
50 55 60
Val Pro Lys Val Ala Thr Gln Thr Val Gly Gly Val Glu Leu Pro Val
65 70 75 80
Ala Ala Trp Arg Ser Tyr Leu Asn Met Glu Leu Thr Ile Pro Ile Phe
85 90 95
Ala Thr Asn Ser Asp Cys Glu Leu Ile Val Lys Ala Met Gln Gly Leu
100 105 110
Leu Lys Asp Gly Asn Pro Ile Pro Ser Ala Ile Ala Ala Asn Ser Gly
115 120 125
Ile Tyr
130
<210> 2
<211> 53
<212> PRT
<213> 轻小病毒噬菌体 MS2
<400> 2
Tyr Lys Val Thr Cys Ser Val Arg Gln Ser Ser Ala Gln Asn Arg Lys
1 5 10 15
Tyr Thr Ile Lys Val Glu Val Pro Lys Val Ala Thr Gln Thr Val Gly
20 25 30
Gly Val Glu Leu Pro Val Ala Ala Trp Arg Ser Tyr Leu Asn Met Glu
35 40 45
Leu Thr Ile Pro Ile
50
<210> 3
<211> 10
<212> RNA
<213> 轻小病毒噬菌体 MS2
<220>
<221> misc_特征
<222> (1)..(3)
<223> n is a, c, g, or u
<220>
<221> misc_特征
<222> (8)..(10)
<223> n is a, c, g, or u
<400> 3
nnnauuannn 10
<210> 4
<211> 23
<212> RNA
<213> 轻小病毒噬菌体 MS2
<220>
<221> misc_特征
<222> (1)..(7)
<223> n is a, c, g, or u
<220>
<221> misc_特征
<222> (9)..(10)
<223> n is a, c, g, or u
<220>
<221> misc_特征
<222> (15)..(23)
<223> n is a, c, g, or u
<400> 4
nnnnnnnann auuannnnnn nnn 23
<210> 5
<211> 23
<212> RNA
<213> 轻小病毒噬菌体 MS2
<220>
<221> misc_特征
<222> (1)..(7)
<223> n is a, c, g, or u
<220>
<221> misc_特征
<222> (9)..(10)
<223> n is a, c, g, or u
<220>
<221> misc_特征
<222> (15)..(23)
<223> n is a, c, g, or u
<400> 5
nnnnnnnann aucannnnnn nnn 23
<210> 6
<211> 23
<212> RNA
<213> 轻小病毒噬菌体 MS2
<220>
<221> misc_特征
<222> (1)..(7)
<223> n is a, c, g, or u
<220>
<221> misc_特征
<222> (9)..(10)
<223> n is a, c, g, or u
<220>
<221> misc_特征
<222> (15)..(23)
<223> n is a, c, g, or u
<400> 6
nnnnnnnann acuannnnnn nnn 23
<210> 7
<211> 23
<212> RNA
<213> 轻小病毒噬菌体 MS2
<400> 7
aaacaugagg auuacccaug ucg 23
<210> 8
<211> 23
<212> RNA
<213> 轻小病毒噬菌体 MS2
<400> 8
aaacaugagg aucacccaug ucg 23
<210> 9
<211> 23
<212> RNA
<213> 轻小病毒噬菌体 MS2
<400> 9
aaacaugagg acuacccaug ucg 23
<210> 10
<211> 107
<212> PRT
<213> 肠道菌噬菌体λ
<400> 10
Met Asp Ala Gln Thr Arg Arg Arg Glu Arg Arg Ala Glu Lys Gln Ala
1 5 10 15
Gln Trp Lys Ala Ala Asn Pro Leu Leu Val Gly Val Ser Ala Lys Pro
20 25 30
Val Asn Arg Pro Ile Leu Ser Leu Asn Arg Lys Pro Lys Ser Arg Val
35 40 45
Glu Ser Ala Leu Asn Pro Ile Asp Leu Thr Val Leu Ala Glu Tyr His
50 55 60
Lys Gln Ile Glu Ser Asn Leu Gln Arg Ile Glu Arg Lys Asn Gln Arg
65 70 75 80
Thr Trp Tyr Ser Lys Pro Gly Glu Arg Gly Ile Thr Cys Ser Gly Arg
85 90 95
Gln Lys Ile Lys Gly Lys Ser Ile Pro Leu Ile
100 105
<210> 11
<211> 100
<212> PRT
<213> 肠道菌噬菌体P22
<400> 11
Met Thr Val Ile Thr Tyr Gly Lys Ser Thr Phe Ala Gly Asn Ala Lys
1 5 10 15
Thr Arg Arg His Glu Arg Arg Arg Lys Leu Ala Ile Glu Arg Asp Thr
20 25 30
Ile Cys Asn Ile Ile Asp Ser Ile Phe Gly Cys Asp Ala Pro Asp Ala
35 40 45
Ser Gln Glu Val Lys Ala Lys Arg Ile Asp Arg Val Thr Lys Ala Ile
50 55 60
Ser Leu Ala Gly Thr Arg Gln Lys Glu Val Glu Gly Gly Ser Val Leu
65 70 75 80
Leu Pro Gly Val Ala Leu Tyr Ala Ala Gly His Arg Lys Ser Lys Gln
85 90 95
Ile Thr Ala Arg
100
<210> 12
<211> 99
<212> PRT
<213> 肠道菌噬菌体Phi21
<400> 12
Met Val Thr Ile Val Trp Lys Glu Ser Lys Gly Thr Ala Lys Ser Arg
1 5 10 15
Tyr Lys Ala Arg Arg Ala Glu Leu Ile Ala Glu Arg Arg Ser Asn Glu
20 25 30
Ala Leu Ala Arg Lys Ile Ala Leu Lys Leu Ser Gly Cys Val Arg Ala
35 40 45
Asp Lys Ala Ala Ser Leu Gly Ser Leu Arg Cys Lys Lys Ala Glu Glu
50 55 60
Val Glu Arg Lys Gln Asn Arg Ile Tyr Tyr Ser Lys Pro Arg Ser Glu
65 70 75 80
Met Gly Val Thr Cys Val Gly Arg Gln Lys Ile Lys Leu Gly Ser Lys
85 90 95
Pro Leu Ile
<210> 13
<211> 21
<212> PRT
<213> 肠道菌噬菌体λ
<400> 13
Asp Ala Gln Thr Arg Arg Arg Glu Arg Arg Ala Glu Lys Gln Ala Gln
1 5 10 15
Trp Lys Ala Ala Asn
20
<210> 14
<211> 25
<212> PRT
<213> 肠道菌噬菌体P22
<400> 14
Lys Ser Thr Phe Ala Gly Asn Ala Lys Thr Arg Arg His Glu Arg Arg
1 5 10 15
Arg Lys Leu Ala Ile Glu Arg Asp Thr
20 25
<210> 15
<211> 22
<212> PRT
<213> 肠道菌噬菌体Phi21
<400> 15
Glu Ser Lys Gly Thr Ala Lys Ser Arg Tyr Lys Ala Arg Arg Ala Glu
1 5 10 15
Leu Ile Ala Glu Arg Arg
20
<210> 16
<211> 15
<212> RNA
<213> 肠道菌噬菌体λ
<400> 16
gcccugaaga agggc 15
<210> 17
<211> 15
<212> RNA
<213> 肠道菌噬菌体λ
<400> 17
gcccugaaaa agggc 15
<210> 18
<211> 15
<212> RNA
<213> 肠道菌噬菌体P22
<400> 18
gcgcugacaa agcgc 15
<210> 19
<211> 20
<212> RNA
<213> 肠道菌噬菌体Phi21
<400> 19
uucaccucua accgggugag 20
<210> 20
<211> 410
<212> PRT
<213> 智人
<400> 20
Met Val Cys Phe Arg Leu Phe Pro Val Pro Gly Ser Gly Leu Val Leu
1 5 10 15
Val Cys Leu Val Leu Gly Ala Val Arg Ser Tyr Ala Leu Glu Leu Asn
20 25 30
Leu Thr Asp Ser Glu Asn Ala Thr Cys Leu Tyr Ala Lys Trp Gln Met
35 40 45
Asn Phe Thr Val Arg Tyr Glu Thr Thr Asn Lys Thr Tyr Lys Thr Val
50 55 60
Thr Ile Ser Asp His Gly Thr Val Thr Tyr Asn Gly Ser Ile Cys Gly
65 70 75 80
Asp Asp Gln Asn Gly Pro Lys Ile Ala Val Gln Phe Gly Pro Gly Phe
85 90 95
Ser Trp Ile Ala Asn Phe Thr Lys Ala Ala Ser Thr Tyr Ser Ile Asp
100 105 110
Ser Val Ser Phe Ser Tyr Asn Thr Gly Asp Asn Thr Thr Phe Pro Asp
115 120 125
Ala Glu Asp Lys Gly Ile Leu Thr Val Asp Glu Leu Leu Ala Ile Arg
130 135 140
Ile Pro Leu Asn Asp Leu Phe Arg Cys Asn Ser Leu Ser Thr Leu Glu
145 150 155 160
Lys Asn Asp Val Val Gln His Tyr Trp Asp Val Leu Val Gln Ala Phe
165 170 175
Val Gln Asn Gly Thr Val Ser Thr Asn Glu Phe Leu Cys Asp Lys Asp
180 185 190
Lys Thr Ser Thr Val Ala Pro Thr Ile His Thr Thr Val Pro Ser Pro
195 200 205
Thr Thr Thr Pro Thr Pro Lys Glu Lys Pro Glu Ala Gly Thr Tyr Ser
210 215 220
Val Asn Asn Gly Asn Asp Thr Cys Leu Leu Ala Thr Met Gly Leu Gln
225 230 235 240
Leu Asn Ile Thr Gln Asp Lys Val Ala Ser Val Ile Asn Ile Asn Pro
245 250 255
Asn Thr Thr His Ser Thr Gly Ser Cys Arg Ser His Thr Ala Leu Leu
260 265 270
Arg Leu Asn Ser Ser Thr Ile Lys Tyr Leu Asp Phe Val Phe Ala Val
275 280 285
Lys Asn Glu Asn Arg Phe Tyr Leu Lys Glu Val Asn Ile Ser Met Tyr
290 295 300
Leu Val Asn Gly Ser Val Phe Ser Ile Ala Asn Asn Asn Leu Ser Tyr
305 310 315 320
Trp Asp Ala Pro Leu Gly Ser Ser Tyr Met Cys Asn Lys Glu Gln Thr
325 330 335
Val Ser Val Ser Gly Ala Phe Gln Ile Asn Thr Phe Asp Leu Arg Val
340 345 350
Gln Pro Phe Asn Val Thr Gln Gly Lys Tyr Ser Thr Ala Gln Asp Cys
355 360 365
Ser Ala Asp Asp Asp Asn Phe Leu Val Pro Ile Ala Val Gly Ala Ala
370 375 380
Leu Ala Gly Val Leu Ile Leu Val Leu Leu Ala Tyr Phe Ile Gly Leu
385 390 395 400
Lys His His His Ala Gly Tyr Glu Gln Phe
405 410
<210> 21
<211> 410
<212> PRT
<213> 智人
<400> 21
Met Val Cys Phe Arg Leu Phe Pro Val Pro Gly Ser Gly Leu Val Leu
1 5 10 15
Val Cys Leu Val Leu Gly Ala Val Arg Ser Tyr Ala Leu Glu Leu Asn
20 25 30
Leu Thr Asp Ser Glu Asn Ala Thr Cys Leu Tyr Ala Lys Trp Gln Met
35 40 45
Asn Phe Thr Val Arg Tyr Glu Thr Thr Asn Lys Thr Tyr Lys Thr Val
50 55 60
Thr Ile Ser Asp His Gly Thr Val Thr Tyr Asn Gly Ser Ile Cys Gly
65 70 75 80
Asp Asp Gln Asn Gly Pro Lys Ile Ala Val Gln Phe Gly Pro Gly Phe
85 90 95
Ser Trp Ile Ala Asn Phe Thr Lys Ala Ala Ser Thr Tyr Ser Ile Asp
100 105 110
Ser Val Ser Phe Ser Tyr Asn Thr Gly Asp Asn Thr Thr Phe Pro Asp
115 120 125
Ala Glu Asp Lys Gly Ile Leu Thr Val Asp Glu Leu Leu Ala Ile Arg
130 135 140
Ile Pro Leu Asn Asp Leu Phe Arg Cys Asn Ser Leu Ser Thr Leu Glu
145 150 155 160
Lys Asn Asp Val Val Gln His Tyr Trp Asp Val Leu Val Gln Ala Phe
165 170 175
Val Gln Asn Gly Thr Val Ser Thr Asn Glu Phe Leu Cys Asp Lys Asp
180 185 190
Lys Thr Ser Thr Val Ala Pro Thr Ile His Thr Thr Val Pro Ser Pro
195 200 205
Thr Thr Thr Pro Thr Pro Lys Glu Lys Pro Glu Ala Gly Thr Tyr Ser
210 215 220
Val Asn Asn Gly Asn Asp Thr Cys Leu Leu Ala Thr Met Gly Leu Gln
225 230 235 240
Leu Asn Ile Thr Gln Asp Lys Val Ala Ser Val Ile Asn Ile Asn Pro
245 250 255
Asn Thr Thr His Ser Thr Gly Ser Cys Arg Ser His Thr Ala Leu Leu
260 265 270
Arg Leu Asn Ser Ser Thr Ile Lys Tyr Leu Asp Phe Val Phe Ala Val
275 280 285
Lys Asn Glu Asn Arg Phe Tyr Leu Lys Glu Val Asn Ile Ser Met Tyr
290 295 300
Leu Val Asn Gly Ser Val Phe Ser Ile Ala Asn Asn Asn Leu Ser Tyr
305 310 315 320
Trp Asp Ala Pro Leu Gly Ser Ser Tyr Met Cys Asn Lys Glu Gln Thr
325 330 335
Val Ser Val Ser Gly Ala Phe Gln Ile Asn Thr Phe Asp Leu Arg Val
340 345 350
Gln Pro Phe Asn Val Thr Gln Gly Lys Tyr Ser Thr Ala Gln Glu Cys
355 360 365
Ser Leu Asp Asp Asp Thr Ile Leu Ile Pro Ile Ile Val Gly Ala Gly
370 375 380
Leu Ser Gly Leu Ile Ile Val Ile Val Ile Ala Tyr Val Ile Gly Arg
385 390 395 400
Arg Lys Ser Tyr Ala Gly Tyr Gln Thr Leu
405 410
<210> 22
<211> 411
<212> PRT
<213> 智人
<400> 22
Met Val Cys Phe Arg Leu Phe Pro Val Pro Gly Ser Gly Leu Val Leu
1 5 10 15
Val Cys Leu Val Leu Gly Ala Val Arg Ser Tyr Ala Leu Glu Leu Asn
20 25 30
Leu Thr Asp Ser Glu Asn Ala Thr Cys Leu Tyr Ala Lys Trp Gln Met
35 40 45
Asn Phe Thr Val Arg Tyr Glu Thr Thr Asn Lys Thr Tyr Lys Thr Val
50 55 60
Thr Ile Ser Asp His Gly Thr Val Thr Tyr Asn Gly Ser Ile Cys Gly
65 70 75 80
Asp Asp Gln Asn Gly Pro Lys Ile Ala Val Gln Phe Gly Pro Gly Phe
85 90 95
Ser Trp Ile Ala Asn Phe Thr Lys Ala Ala Ser Thr Tyr Ser Ile Asp
100 105 110
Ser Val Ser Phe Ser Tyr Asn Thr Gly Asp Asn Thr Thr Phe Pro Asp
115 120 125
Ala Glu Asp Lys Gly Ile Leu Thr Val Asp Glu Leu Leu Ala Ile Arg
130 135 140
Ile Pro Leu Asn Asp Leu Phe Arg Cys Asn Ser Leu Ser Thr Leu Glu
145 150 155 160
Lys Asn Asp Val Val Gln His Tyr Trp Asp Val Leu Val Gln Ala Phe
165 170 175
Val Gln Asn Gly Thr Val Ser Thr Asn Glu Phe Leu Cys Asp Lys Asp
180 185 190
Lys Thr Ser Thr Val Ala Pro Thr Ile His Thr Thr Val Pro Ser Pro
195 200 205
Thr Thr Thr Pro Thr Pro Lys Glu Lys Pro Glu Ala Gly Thr Tyr Ser
210 215 220
Val Asn Asn Gly Asn Asp Thr Cys Leu Leu Ala Thr Met Gly Leu Gln
225 230 235 240
Leu Asn Ile Thr Gln Asp Lys Val Ala Ser Val Ile Asn Ile Asn Pro
245 250 255
Asn Thr Thr His Ser Thr Gly Ser Cys Arg Ser His Thr Ala Leu Leu
260 265 270
Arg Leu Asn Ser Ser Thr Ile Lys Tyr Leu Asp Phe Val Phe Ala Val
275 280 285
Lys Asn Glu Asn Arg Phe Tyr Leu Lys Glu Val Asn Ile Ser Met Tyr
290 295 300
Leu Val Asn Gly Ser Val Phe Ser Ile Ala Asn Asn Asn Leu Ser Tyr
305 310 315 320
Trp Asp Ala Pro Leu Gly Ser Ser Tyr Met Cys Asn Lys Glu Gln Thr
325 330 335
Val Ser Val Ser Gly Ala Phe Gln Ile Asn Thr Phe Asp Leu Arg Val
340 345 350
Gln Pro Phe Asn Val Thr Gln Gly Lys Tyr Ser Thr Ala Glu Glu Cys
355 360 365
Ser Ala Asp Ser Asp Leu Asn Phe Leu Ile Pro Val Ala Val Gly Val
370 375 380
Ala Leu Gly Phe Leu Ile Ile Val Val Phe Ile Ser Tyr Met Ile Gly
385 390 395 400
Arg Arg Lys Ser Arg Thr Gly Tyr Gln Ser Val
405 410
<210> 23
<211> 10
<212> PRT
<213> 智人
<400> 23
Lys His His His Ala Gly Tyr Glu Gln Phe
1 5 10
<210> 24
<211> 11
<212> PRT
<213> 智人
<400> 24
Arg Arg Lys Ser Tyr Ala Gly Tyr Gln Thr Leu
1 5 10
<210> 25
<211> 11
<212> PRT
<213> 智人
<400> 25
Arg Arg Lys Ser Arg Thr Gly Tyr Gln Ser Val
1 5 10
<210> 26
<211> 417
<212> PRT
<213> 智人
<400> 26
Met Ala Ala Pro Gly Ser Ala Arg Arg Pro Leu Leu Leu Leu Leu Leu
1 5 10 15
Leu Leu Leu Leu Gly Leu Met His Cys Ala Ser Ala Ala Met Phe Met
20 25 30
Val Lys Asn Gly Asn Gly Thr Ala Cys Ile Met Ala Asn Phe Ser Ala
35 40 45
Ala Phe Ser Val Asn Tyr Asp Thr Lys Ser Gly Pro Lys Asn Met Thr
50 55 60
Phe Asp Leu Pro Ser Asp Ala Thr Val Val Leu Asn Arg Ser Ser Cys
65 70 75 80
Gly Lys Glu Asn Thr Ser Asp Pro Ser Leu Val Ile Ala Phe Gly Arg
85 90 95
Gly His Thr Leu Thr Leu Asn Phe Thr Arg Asn Ala Thr Arg Tyr Ser
100 105 110
Val Gln Leu Met Ser Phe Val Tyr Asn Leu Ser Asp Thr His Leu Phe
115 120 125
Pro Asn Ala Ser Ser Lys Glu Ile Lys Thr Val Glu Ser Ile Thr Asp
130 135 140
Ile Arg Ala Asp Ile Asp Lys Lys Tyr Arg Cys Val Ser Gly Thr Gln
145 150 155 160
Val His Met Asn Asn Val Thr Val Thr Leu His Asp Ala Thr Ile Gln
165 170 175
Ala Tyr Leu Ser Asn Ser Ser Phe Ser Arg Gly Glu Thr Arg Cys Glu
180 185 190
Gln Asp Arg Pro Ser Pro Thr Thr Ala Pro Pro Ala Pro Pro Ser Pro
195 200 205
Ser Pro Ser Pro Val Pro Lys Ser Pro Ser Val Asp Lys Tyr Asn Val
210 215 220
Ser Gly Thr Asn Gly Thr Cys Leu Leu Ala Ser Met Gly Leu Gln Leu
225 230 235 240
Asn Leu Thr Tyr Glu Arg Lys Asp Asn Thr Thr Val Thr Arg Leu Leu
245 250 255
Asn Ile Asn Pro Asn Lys Thr Ser Ala Ser Gly Ser Cys Gly Ala His
260 265 270
Leu Val Thr Leu Glu Leu His Ser Glu Gly Thr Thr Val Leu Leu Phe
275 280 285
Gln Phe Gly Met Asn Ala Ser Ser Ser Arg Phe Phe Leu Gln Gly Ile
290 295 300
Gln Leu Asn Thr Ile Leu Pro Asp Ala Arg Asp Pro Ala Phe Lys Ala
305 310 315 320
Ala Asn Gly Ser Leu Arg Ala Leu Gln Ala Thr Val Gly Asn Ser Tyr
325 330 335
Lys Cys Asn Ala Glu Glu His Val Arg Val Thr Lys Ala Phe Ser Val
340 345 350
Asn Ile Phe Lys Val Trp Val Gln Ala Phe Lys Val Glu Gly Gly Gln
355 360 365
Phe Gly Ser Val Glu Glu Cys Leu Leu Asp Glu Asn Ser Met Leu Ile
370 375 380
Pro Ile Ala Val Gly Gly Ala Leu Ala Gly Leu Val Leu Ile Val Leu
385 390 395 400
Ile Ala Tyr Leu Val Gly Arg Lys Arg Ser His Ala Gly Tyr Gln Thr
405 410 415
Ile
<210> 27
<211> 11
<212> PRT
<213> 智人
<400> 27
Arg Lys Arg Ser His Ala Gly Tyr Gln Thr Ile
1 5 10
<210> 28
<211> 238
<212> PRT
<213> 智人
<400> 28
Met Ala Val Glu Gly Gly Met Lys Cys Val Lys Phe Leu Leu Tyr Val
1 5 10 15
Leu Leu Leu Ala Phe Cys Ala Cys Ala Val Gly Leu Ile Ala Val Gly
20 25 30
Val Gly Ala Gln Leu Val Leu Ser Gln Thr Ile Ile Gln Gly Ala Thr
35 40 45
Pro Gly Ser Leu Leu Pro Val Val Ile Ile Ala Val Gly Val Phe Leu
50 55 60
Phe Leu Val Ala Phe Val Gly Cys Cys Gly Ala Cys Lys Glu Asn Tyr
65 70 75 80
Cys Leu Met Ile Thr Phe Ala Ile Phe Leu Ser Leu Ile Met Leu Val
85 90 95
Glu Val Ala Ala Ala Ile Ala Gly Tyr Val Phe Arg Asp Lys Val Met
100 105 110
Ser Glu Phe Asn Asn Asn Phe Arg Gln Gln Met Glu Asn Tyr Pro Lys
115 120 125
Asn Asn His Thr Ala Ser Ile Leu Asp Arg Met Gln Ala Asp Phe Lys
130 135 140
Cys Cys Gly Ala Ala Asn Tyr Thr Asp Trp Glu Lys Ile Pro Ser Met
145 150 155 160
Ser Lys Asn Arg Val Pro Asp Ser Cys Cys Ile Asn Val Thr Val Gly
165 170 175
Cys Gly Ile Asn Phe Asn Glu Lys Ala Ile His Lys Glu Gly Cys Val
180 185 190
Glu Lys Ile Gly Gly Trp Leu Arg Lys Asn Val Leu Val Val Ala Ala
195 200 205
Ala Ala Leu Gly Ile Ala Phe Val Glu Val Leu Gly Ile Val Phe Ala
210 215 220
Cys Cys Leu Val Lys Ser Ile Arg Ser Gly Tyr Glu Val Met
225 230 235
<210> 29
<211> 215
<212> PRT
<213> 智人
<400> 29
Met Ala Val Glu Gly Gly Met Lys Cys Val Lys Phe Leu Leu Tyr Val
1 5 10 15
Leu Leu Leu Ala Phe Cys Gly Ala Thr Pro Gly Ser Leu Leu Pro Val
20 25 30
Val Ile Ile Ala Val Gly Val Phe Leu Phe Leu Val Ala Phe Val Gly
35 40 45
Cys Cys Gly Ala Cys Lys Glu Asn Tyr Cys Leu Met Ile Thr Phe Ala
50 55 60
Ile Phe Leu Ser Leu Ile Met Leu Val Glu Val Ala Ala Ala Ile Ala
65 70 75 80
Gly Tyr Val Phe Arg Asp Lys Val Met Ser Glu Phe Asn Asn Asn Phe
85 90 95
Arg Gln Gln Met Glu Asn Tyr Pro Lys Asn Asn His Thr Ala Ser Ile
100 105 110
Leu Asp Arg Met Gln Ala Asp Phe Lys Cys Cys Gly Ala Ala Asn Tyr
115 120 125
Thr Asp Trp Glu Lys Ile Pro Ser Met Ser Lys Asn Arg Val Pro Asp
130 135 140
Ser Cys Cys Ile Asn Val Thr Val Gly Cys Gly Ile Asn Phe Asn Glu
145 150 155 160
Lys Ala Ile His Lys Glu Gly Cys Val Glu Lys Ile Gly Gly Trp Leu
165 170 175
Arg Lys Asn Val Leu Val Val Ala Ala Ala Ala Leu Gly Ile Ala Phe
180 185 190
Val Glu Val Leu Gly Ile Val Phe Ala Cys Cys Leu Val Lys Ser Ile
195 200 205
Arg Ser Gly Tyr Glu Val Met
210 215
<210> 30
<211> 166
<212> PRT
<213> 智人
<400> 30
Cys Gly Ala Cys Lys Glu Asn Tyr Cys Leu Met Ile Thr Phe Ala Ile
1 5 10 15
Phe Leu Ser Leu Ile Met Leu Val Glu Val Ala Ala Ala Ile Ala Gly
20 25 30
Tyr Val Phe Arg Asp Lys Val Met Ser Glu Phe Asn Asn Asn Phe Arg
35 40 45
Gln Gln Met Glu Asn Tyr Pro Lys Asn Asn His Thr Ala Ser Ile Leu
50 55 60
Asp Arg Met Gln Ala Asp Phe Lys Cys Cys Gly Ala Ala Asn Tyr Thr
65 70 75 80
Asp Trp Glu Lys Ile Pro Ser Met Ser Lys Asn Arg Val Pro Asp Ser
85 90 95
Cys Cys Ile Asn Val Thr Val Gly Cys Gly Ile Asn Phe Asn Glu Lys
100 105 110
Ala Ile His Lys Glu Gly Cys Val Glu Lys Ile Gly Gly Trp Leu Arg
115 120 125
Lys Asn Val Leu Val Val Ala Ala Ala Ala Leu Gly Ile Ala Phe Val
130 135 140
Glu Val Leu Gly Ile Val Phe Ala Cys Cys Leu Val Lys Ser Ile Arg
145 150 155 160
Ser Gly Tyr Glu Val Met
165
<210> 31
<211> 14
<212> PRT
<213> 智人
<400> 31
Cys Cys Leu Val Lys Ser Ile Arg Ser Gly Tyr Glu Val Met
1 5 10
<210> 32
<211> 478
<212> PRT
<213> 智人
<400> 32
Met Gly Arg Cys Cys Phe Tyr Thr Ala Gly Thr Leu Ser Leu Leu Leu
1 5 10 15
Leu Val Thr Ser Val Thr Leu Leu Val Ala Arg Val Phe Gln Lys Ala
20 25 30
Val Asp Gln Ser Ile Glu Lys Lys Ile Val Leu Arg Asn Gly Thr Glu
35 40 45
Ala Phe Asp Ser Trp Glu Lys Pro Pro Leu Pro Val Tyr Thr Gln Phe
50 55 60
Tyr Phe Phe Asn Val Thr Asn Pro Glu Glu Ile Leu Arg Gly Glu Thr
65 70 75 80
Pro Arg Val Glu Glu Val Gly Pro Tyr Thr Tyr Arg Glu Leu Arg Asn
85 90 95
Lys Ala Asn Ile Gln Phe Gly Asp Asn Gly Thr Thr Ile Ser Ala Val
100 105 110
Ser Asn Lys Ala Tyr Val Phe Glu Arg Asp Gln Ser Val Gly Asp Pro
115 120 125
Lys Ile Asp Leu Ile Arg Thr Leu Asn Ile Pro Val Leu Thr Val Ile
130 135 140
Glu Trp Ser Gln Val His Phe Leu Arg Glu Ile Ile Glu Ala Met Leu
145 150 155 160
Lys Ala Tyr Gln Gln Lys Leu Phe Val Thr His Thr Val Asp Glu Leu
165 170 175
Leu Trp Gly Tyr Lys Asp Glu Ile Leu Ser Leu Ile His Val Phe Arg
180 185 190
Pro Asp Ile Ser Pro Tyr Phe Gly Leu Phe Tyr Glu Lys Asn Gly Thr
195 200 205
Asn Asp Gly Asp Tyr Val Phe Leu Thr Gly Glu Asp Ser Tyr Leu Asn
210 215 220
Phe Thr Lys Ile Val Glu Trp Asn Gly Lys Thr Ser Leu Asp Trp Trp
225 230 235 240
Ile Thr Asp Lys Cys Asn Met Ile Asn Gly Thr Asp Gly Asp Ser Phe
245 250 255
His Pro Leu Ile Thr Lys Asp Glu Val Leu Tyr Val Phe Pro Ser Asp
260 265 270
Phe Cys Arg Ser Val Tyr Ile Thr Phe Ser Asp Tyr Glu Ser Val Gln
275 280 285
Gly Leu Pro Ala Phe Arg Tyr Lys Val Pro Ala Glu Ile Leu Ala Asn
290 295 300
Thr Ser Asp Asn Ala Gly Phe Cys Ile Pro Glu Gly Asn Cys Leu Gly
305 310 315 320
Ser Gly Val Leu Asn Val Ser Ile Cys Lys Asn Gly Ala Pro Ile Ile
325 330 335
Met Ser Phe Pro His Phe Tyr Gln Ala Asp Glu Arg Phe Val Ser Ala
340 345 350
Ile Glu Gly Met His Pro Asn Gln Glu Asp His Glu Thr Phe Val Asp
355 360 365
Ile Asn Pro Leu Thr Gly Ile Ile Leu Lys Ala Ala Lys Arg Phe Gln
370 375 380
Ile Asn Ile Tyr Val Lys Lys Leu Asp Asp Phe Val Glu Thr Gly Asp
385 390 395 400
Ile Arg Thr Met Val Phe Pro Val Met Tyr Leu Asn Glu Ser Val His
405 410 415
Ile Asp Lys Glu Thr Ala Ser Arg Leu Lys Ser Met Ile Asn Thr Thr
420 425 430
Leu Ile Ile Thr Asn Ile Pro Tyr Ile Ile Met Ala Leu Gly Val Phe
435 440 445
Phe Gly Leu Val Phe Thr Trp Leu Ala Cys Lys Gly Gln Gly Ser Met
450 455 460
Asp Glu Gly Thr Ala Asp Glu Arg Ala Pro Leu Ile Arg Thr
465 470 475
<210> 33
<211> 335
<212> PRT
<213> 智人
<400> 33
Met Gly Arg Cys Cys Phe Tyr Thr Ala Gly Thr Leu Ser Leu Leu Leu
1 5 10 15
Leu Val Thr Ser Val Thr Leu Leu Val Ala Arg Val Phe Gln Lys Ala
20 25 30
Val Asp Gln Ser Ile Glu Lys Lys Ile Val Leu Arg Asn Gly Thr Glu
35 40 45
Ala Phe Asp Ser Trp Glu Lys Pro Pro Leu Pro Val Tyr Thr Gln Phe
50 55 60
Tyr Phe Phe Asn Val Thr Asn Pro Glu Glu Ile Leu Arg Gly Glu Thr
65 70 75 80
Pro Arg Val Glu Glu Val Gly Pro Tyr Thr Tyr Arg Ser Leu Asp Trp
85 90 95
Trp Ile Thr Asp Lys Cys Asn Met Ile Asn Gly Thr Asp Gly Asp Ser
100 105 110
Phe His Pro Leu Ile Thr Lys Asp Glu Val Leu Tyr Val Phe Pro Ser
115 120 125
Asp Phe Cys Arg Ser Val Tyr Ile Thr Phe Ser Asp Tyr Glu Ser Val
130 135 140
Gln Gly Leu Pro Ala Phe Arg Tyr Lys Val Pro Ala Glu Ile Leu Ala
145 150 155 160
Asn Thr Ser Asp Asn Ala Gly Phe Cys Ile Pro Glu Gly Asn Cys Leu
165 170 175
Gly Ser Gly Val Leu Asn Val Ser Ile Cys Lys Asn Gly Ala Pro Ile
180 185 190
Ile Met Ser Phe Pro His Phe Tyr Gln Ala Asp Glu Arg Phe Val Ser
195 200 205
Ala Ile Glu Gly Met His Pro Asn Gln Glu Asp His Glu Thr Phe Val
210 215 220
Asp Ile Asn Pro Leu Thr Gly Ile Ile Leu Lys Ala Ala Lys Arg Phe
225 230 235 240
Gln Ile Asn Ile Tyr Val Lys Lys Leu Asp Asp Phe Val Glu Thr Gly
245 250 255
Asp Ile Arg Thr Met Val Phe Pro Val Met Tyr Leu Asn Glu Ser Val
260 265 270
His Ile Asp Lys Glu Thr Ala Ser Arg Leu Lys Ser Met Ile Asn Thr
275 280 285
Thr Leu Ile Ile Thr Asn Ile Pro Tyr Ile Ile Met Ala Leu Gly Val
290 295 300
Phe Phe Gly Leu Val Phe Thr Trp Leu Ala Cys Lys Gly Gln Gly Ser
305 310 315 320
Met Asp Glu Gly Thr Ala Asp Glu Arg Ala Pro Leu Ile Arg Thr
325 330 335
<210> 34
<211> 19
<212> PRT
<213> 智人
<400> 34
Gly Gln Gly Ser Met Asp Glu Gly Thr Ala Asp Glu Arg Ala Pro Leu
1 5 10 15
Ile Arg Thr
<210> 35
<211> 156
<212> PRT
<213> 智人
<400> 35
Met Ile Thr Phe Ala Ile Phe Leu Ser Leu Ile Met Leu Val Glu Val
1 5 10 15
Ala Ala Ala Ile Ala Gly Tyr Val Phe Arg Asp Lys Val Met Ser Glu
20 25 30
Phe Asn Asn Asn Phe Arg Gln Gln Met Glu Asn Tyr Pro Lys Asn Asn
35 40 45
His Thr Ala Ser Ile Leu Asp Arg Met Gln Ala Asp Phe Lys Cys Cys
50 55 60
Gly Ala Ala Asn Tyr Thr Asp Trp Glu Lys Ile Pro Ser Met Ser Lys
65 70 75 80
Asn Arg Val Pro Asp Ser Cys Cys Ile Asn Val Thr Val Gly Cys Gly
85 90 95
Ile Asn Phe Asn Glu Lys Ala Ile His Lys Glu Gly Cys Val Glu Lys
100 105 110
Ile Gly Gly Trp Leu Arg Lys Asn Val Leu Val Val Ala Ala Ala Ala
115 120 125
Leu Gly Ile Ala Phe Val Glu Val Leu Gly Ile Val Phe Ala Cys Cys
130 135 140
Leu Val Lys Ser Ile Arg Ser Gly Tyr Glu Val Met
145 150 155
<210> 36
<211> 511
<212> PRT
<213> 水泡性口炎病毒
<400> 36
Met Lys Cys Leu Leu Tyr Leu Ala Phe Leu Phe Ile Gly Val Asn Cys
1 5 10 15
Lys Phe Thr Ile Val Phe Pro His Asn Gln Lys Gly Asn Trp Lys Asn
20 25 30
Val Pro Ser Asn Tyr His Tyr Cys Pro Ser Ser Ser Asp Leu Asn Trp
35 40 45
His Asn Asp Leu Val Gly Thr Ala Leu Gln Val Lys Met Pro Lys Ser
50 55 60
His Lys Ala Ile Gln Ala Asp Gly Trp Met Cys His Ala Ser Lys Trp
65 70 75 80
Val Thr Thr Cys Asp Phe Arg Trp Tyr Gly Pro Lys Tyr Ile Thr His
85 90 95
Ser Ile Arg Ser Phe Thr Pro Ser Val Glu Gln Cys Lys Glu Ser Ile
100 105 110
Glu Gln Thr Lys Gln Gly Thr Trp Leu Asn Pro Gly Phe Pro Pro Gln
115 120 125
Ser Cys Gly Tyr Ala Thr Val Thr Asp Ala Glu Ala Ala Ile Val Gln
130 135 140
Val Thr Pro His His Val Leu Val Asp Glu Tyr Thr Gly Glu Trp Val
145 150 155 160
Asp Ser Gln Phe Ile Asn Gly Lys Cys Ser Asn Asp Ile Cys Pro Thr
165 170 175
Val His Asn Ser Thr Thr Trp His Ser Asp Tyr Lys Val Lys Gly Leu
180 185 190
Cys Asp Ser Asn Leu Ile Ser Met Asp Ile Thr Phe Phe Ser Glu Asp
195 200 205
Gly Glu Leu Ser Ser Leu Gly Lys Lys Gly Thr Gly Phe Arg Ser Asn
210 215 220
Tyr Phe Ala Tyr Glu Thr Gly Asp Lys Ala Cys Lys Met Gln Tyr Cys
225 230 235 240
Lys His Trp Gly Val Arg Leu Pro Ser Gly Val Trp Phe Glu Met Ala
245 250 255
Asn Lys Asp Leu Phe Ala Ala Ala Arg Phe Pro Glu Cys Pro Glu Gly
260 265 270
Ser Ser Ile Ser Ala Pro Ser Gln Thr Ser Val Asp Val Ser Leu Ile
275 280 285
Gln Asp Val Glu Arg Ile Leu Asp Tyr Ser Leu Cys Gln Glu Thr Trp
290 295 300
Ser Lys Ile Arg Ala Gly Leu Pro Ile Ser Pro Val Asp Leu Ser Tyr
305 310 315 320
Leu Ala Pro Lys Asn Pro Gly Thr Gly Pro Val Phe Thr Ile Ile Asn
325 330 335
Gly Thr Leu Lys Tyr Phe Glu Thr Arg Tyr Ile Arg Val Asp Ile Ala
340 345 350
Ala Pro Ile Leu Ser Arg Met Val Gly Met Ile Ser Gly Thr Thr Lys
355 360 365
Glu Arg Val Leu Trp Asp Asp Trp Ala Pro Tyr Glu Asp Val Glu Ile
370 375 380
Gly Pro Asn Gly Val Leu Arg Thr Ser Ser Gly Tyr Lys Phe Pro Leu
385 390 395 400
Tyr Met Ile Gly His Gly Met Leu Asp Ser Asp Leu His Leu Ser Ser
405 410 415
Lys Ala Gln Val Phe Glu His Pro His Ile Gln Asp Ala Ala Ser Gln
420 425 430
Leu Pro Asp Gly Glu Thr Leu Phe Phe Gly Asp Thr Gly Leu Ser Lys
435 440 445
Asn Pro Ile Glu Phe Val Glu Gly Trp Phe Ser Ser Trp Lys Ser Ser
450 455 460
Ile Ala Ser Phe Phe Phe Thr Ile Gly Leu Ile Ile Gly Leu Phe Leu
465 470 475 480
Val Leu Arg Val Gly Ile Tyr Leu Cys Ile Lys Leu Lys His Thr Lys
485 490 495
Lys Arg Gln Ile Tyr Thr Asp Ile Glu Met Asn Arg Leu Gly Lys
500 505 510
<210> 37
<211> 3
<212> PRT
<213> 人工
<220>
<223> N-链接的糖基化的子序列的共有氨基酸序列
<400> 37
Asn Ser Thr
1
<210> 38
<211> 5
<212> PRT
<213> 人工
<220>
<223> N-链接的糖基化的子序列的共有序列
<400> 38
Gly Asn Ser Thr Met
1 5
<210> 39
<211> 8
<212> PRT
<213> 人工
<220>
<223> 用于标记蛋白质的FLAG表位
<400> 39
Asp Tyr Lys Asp Asp Asp Asp Lys
1 5
<210> 40
<211> 21
<212> PRT
<213> 智人
<400> 40
Ala Ala Val Leu Val Leu Leu Val Ile Val Ile Ile Ser Leu Ile Val
1 5 10 15
Leu Val Val Ile Trp
20
<210> 41
<211> 10
<212> PRT
<213> 人工
<220>
<223> scFv中VL和VH结构域的富含甘氨酸-丝氨酸的链接序列
<400> 41
Gly Leu Gly Ser Gly Ser Gly Gly Ser Ser
1 5 10
<210> 42
<211> 10
<212> PRT
<213> 人工
<220>
<223> scFv的VL和VH结构域之间富含甘氨酸-丝氨酸的链接序列
<400> 42
Gly Ser Gly Ser Gly Ser Gly Gly Ser Ser
1 5 10
<210> 43
<211> 15
<212> PRT
<213> 人工
<220>
<223> scFv的VL和VH结构域之间富含甘氨酸-丝氨酸的链接序列
<400> 43
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 44
<211> 40
<212> PRT
<213> 人工
<220>
<223> scFv的VL和VH结构域之间富含甘氨酸-丝氨酸的链接序列
<400> 44
Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser
1 5 10 15
Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Gly
20 25 30
Ser Gly Gly Gly Ser Gly Gly Gly
35 40
<210> 45
<211> 23
<212> PRT
<213> 人工
<220>
<223> 用于链接融合蛋白结构域的螺旋链接序列
<400> 45
Asp Gln Ser Asn Ser Glu Glu Ala Lys Lys Glu Glu Ala Lys Lys Glu
1 5 10 15
Glu Ala Lys Lys Ser Asn Ser
20
<210> 46
<211> 12
<212> PRT
<213> 人工
<220>
<223> 用于链接融合蛋白结构域的IgG4铰链序列
<400> 46
Glu Ser Lys Tyr Gly Pro Pro Ala Pro Pro Ala Pro
1 5 10
<210> 47
<211> 27
<212> PRT
<213> 人工序列
<220>
<223> 合成
<400> 47
Thr Gly Asp Gln Ser Asn Ser Glu Glu Ala Lys Lys Glu Glu Ala Lys
1 5 10 15
Lys Glu Glu Ala Lys Lys Ser Asn Ser Ile Asp
20 25
<210> 48
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成
<400> 48
Thr Gly Glu Ser Lys Tyr Gly Pro Pro Ala Pro Pro Ala Pro Ile Asp
1 5 10 15
<210> 49
<211> 44
<212> PRT
<213> 人工序列
<220>
<223> 合成
<400> 49
Thr Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly
1 5 10 15
Gly Ser Gly Gly Ser Gly Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
20 25 30
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ile Asp
35 40
<210> 50
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成
<400> 50
Thr Gly Gly Leu Gly Ser Gly Ser Gly Gly Ser Ser Ile Asp
1 5 10
<210> 51
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成
<400> 51
Thr Gly Gly Ser Gly Ser Gly Ser Gly Gly Ser Ser Ile Asp
1 5 10
<210> 52
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成
<400> 52
Thr Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser Ile Asp
- 包含基于靶向亲和域的膜蛋白的胞外囊泡
- 包含胞外囊泡的制剂、用以制备该制剂的方法及其用途
