一种诱导脂肪来源间充质干细胞肌源性分化的方法
文献发布时间:2023-06-19 09:52:39
技术领域
本发明属于干细胞肌源性分化技术领域,具体涉及一种诱导脂肪来源的间充质干细胞肌源性分化的方法。
背景技术
创伤,神经损伤,肿瘤切除术或变性肌肉疾病(例如肩袖撕裂后的脂肪浸润)引起的骨骼肌功能丧失是一个严重的临床问题,显然会影响人们的日常生活和工作,但解决方案很少。干细胞移植是一种在1990年代开发的有前途的技术,为骨骼肌疾病的治疗提供了希望。
近年来,对人类MSC的研究受到了广泛关注,其中大多数是骨髓来源的间充质干细胞(BMSC)和脂肪来源的间充质干细胞(ADSC)。如体外,离体和体内证据所示,这些多能细胞可以分化为成熟的脂肪细胞,软骨细胞,成骨细胞,心肌细胞,肝细胞,神经元样和内皮细胞,以及其他谱系。然而,骨髓提取是痛苦的,并且骨髓细胞的数量极少,因此需要体外扩增以获得足够的细胞。当前,漫长的扩增过程限制了BMSC的临床应用。通过微创吸脂从脂肪组织中获得的ADSC具有丰富的优势,并且易于从可再生细胞来源获得。与BMSC相比,ADSC具有很大的优势,因为它们易于收获,具有多分化潜能并且易于扩增,并且具有基因组稳定性和低免疫原性。ADSCs还可以用于生产许多具有良好存活能力的多能干细胞,并且是干细胞生物工程研究的种子细胞。由于脂肪组织和骨髓从中胚层发育并包含易于分离的基质成分,因此ADSCs和BMSCs具有许多相似的生物学特性,并且可以在多次传代后保持干细胞的特性,并且衰老程度相对较低,这使得它们组织工程中理想的种子细胞。
2001年,Zuk首次通过脂肪消化和分离以及干细胞提取从人体脂肪组织中获得了ADSC,并且脂肪干细胞的研究也在继续发展。ADSC具有多向分化潜力和自我更新功能;此外,可以在一定条件下诱导这些细胞分化为成肌细胞,成脂细胞,成骨细胞和成软骨细胞。在这项研究中,通过手术从新西兰白兔的腹股沟获得脂肪组织,并通过酶消化获得ADSC。
目前,5-氮杂胞苷(5-Aza)是诱导MSCs分化的最常用化学试剂。但是,这种方法具有一定程度的细胞毒性,在某种程度上,细胞增殖受到影响,导致细胞分化时形态发生改变。最重要的是,成肌细胞分化的机制仍不清楚。氢是一种无色,无味,具有生物活性的还原性小分子气体,可与体内的活性氧发生反应。同时,氢的抗氧化,抗炎和抗凋亡作用已在多种动物疾病模型和人体研究中得到证实。由于含氢培养箱的发明,现在可以评估氢对体外细胞增殖和分化的影响。但在现有技术中并没有关于氢用于干细胞领域,其对ADSCs诱导的成肌细胞分化的作用尚未见报道。
发明内容
针对现有技术中的缺陷,本发明旨在通过比较不同培养条件下ADSC诱导和分化为肌细胞的两种方法,研究氢是否对ADSC的肌源性分化具有有益作用。
第一方面,本发明提供了一种诱导脂肪来源的间充质干细胞(ADSC)肌源性分化的方法,所述方法包括将待诱导细胞置于含有诱导剂的培养环境中诱导肌源性分化,所述诱导剂包括氢气。
采用上述技术方案的效果:在含有氢气的培养条件下,可以成功诱导脂肪来源的间充质干细胞(ADSC)肌源性分化,氢是一种无色,无味,无毒,具有生物活性的还原性小分子气体,可与体内的活性氧发生反应,且本方法能够避免采用诱导剂5-氮杂胞苷(5-Aza)产生的细胞形态变化。
上述技术方案可进一步改为以下技术方案:
在某些实施例中,所述培养环境中氢气H
采用上述浓度的氢气,可以高效的诱导脂肪来源的间充质干细胞(ADSC)肌源性分化。
在某些实施例中,所述诱导的温度为35-38℃。
在某些实施例中,所述诱导的温度为37℃。
在某些实施例中,所述氢气H
采用上述培养条件,可以为待诱导细胞提供最适宜的肌源分化温度及时间,有效提高待诱导细胞的分化率及有效避免分化细胞产生的畸形分化。
在某些实施例中,所述诱导剂还包括5-氮杂胞苷(5-Aza)。
在某些实施例中,所述诱导剂5-氮杂胞苷(5-Aza)的浓度为10μmol/L。
在某些实施例中,所述诱导剂5-氮杂胞苷(5-Aza)的处理时间为24h。
在诱导分化环境中同时添加诱导剂5-氮杂胞苷(5-Aza),其与氢气之间产生协同作用,氢气可以有效的促进5-氮杂胞苷对脂肪来源的间充质干细胞(ADSC)的肌源性分化。
在某些实施例中,所述培养环境中还包括氧气O
在某些实施例中,所述培养环境中氧气O
在某些实施例中,所述培养环境中二氧化碳CO
在某些实施例中,所述培养环境中氮气N
在某些实施例中,所述培养环境中湿度保持90%以上。
采用上述技术方案,培养环境中含有一定浓度的氧气O
在某些实施例中,所述待诱导细胞可以为经过传代培养的细胞,所述细胞的培养采用本领域常用的ADSCs细胞培养基,例如高葡萄糖DMEM、低葡萄糖DMEM等,优选为含15%FBS的高葡萄糖DMEM。
第二方面,本发明提供了氢气作为诱导剂在诱导脂肪来源的间充质干细胞(ADSC)肌源性分化中的应用。
氢的抗氧化,抗炎和抗凋亡作用已在多种动物疾病模型和人体研究中得到证实。由于含氢培养箱的发明,现在可以评估氢对体外细胞增殖和分化的影响。本发明实现了采用氢气作为单独诱导剂诱导脂肪来源的间充质干细胞(ADSC)的肌源性分化,提供了氢气作为肌源性分化诱导剂的用途。
与现有技术相比,本发明的有益效果为:
1)采用本发明的方法,在ADSCs肌源性分化后9天,MyoD表达的R T-PCR结果表明,诱导组中调控成肌细胞分化的上游基因的表达水平高于对照组,肌节α-肌动蛋白和肌钙蛋白,肌球蛋白,MyoD和MHC基因的表达证明了这一结果。氢基团和5-氮杂基团之间的MyoD表达没有显着差异,这些结果表明氢和5-Aza诱导成肌细胞分化的机制是相似的,与5-氮杂施用相比,氢暴露是一种更简单,无毒且便宜的分化方法。
2)本发明通过实验证明,两种诱导剂氢气H
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式描述中所需要使用的附图作简单地介绍。
图1第1-4组第三代ADSC在诱导前、诱导后第1天、诱导后第9天的细胞形态图。
图2流式细胞术分析结果和第3代ADSC的细胞表面CD标志物的表达。x轴是荧光强度,y轴是细胞数。
图3诱导后ADSCs的茜素红,油红O和甲苯胺蓝染色及差异化。
图4MTT分析结果。在暴露1、3、5、7和9天后,第3代,不同培养条件对ADSCs活力的影响。x轴是时间(天),y轴是平均吸光度(A)值。
图5ADSC的免疫荧光分析。
图6成肌发生分化率用(通过免疫组织化学测量的肌动蛋白表达百分数表示)。
图7肌钙蛋白,肌球蛋白,MyoD和肌球蛋白重链(MHC)表达结果。
具体实施方式
下面将结合附图对本发明技术方案的实施例进行详细的描述。以下实施例仅用于更加清楚地说明本发明的技术方案,因此只是作为示例,而不能以此来限制本发明的保护范围。需要注意的是,除非另有说明,本申请使用的技术术语或者科学术语应当为本发明所属领域技术人员所理解的通常意义。
本发明从兔获得的ADSC被分配到两个不同的诱导分化的培养箱:含5%CO
氢和5-Aza诱导9天后,细胞表达肌钙蛋白,肌球蛋白,MyoD和MHC,但第3组和第2组之间无显着差异。肌节α-肌动蛋白表达和成肌细胞分化率显着高于对照组但低于第4组则更低。氢不仅可以增加5-Aza对ADSC成肌细胞分化的作用,而且单独施用时还可以诱导成肌细胞分化,具有广阔的应用前景。
实施例1
采用一只体重为2.0kg的八周大的雄性新西兰白兔(江苏大学动物实验中心),在单笼饲养条件下饲养和喂养兔子。控制房屋的温度(25℃),湿度(40-60%)和光照(12h,明暗循环)。在手术前观察动物一周,以确认它们健康无病。
为了获得ADSC,将动物通过被动吸入异氟烷在麻醉室中安乐死,直到发生过量。通过监测心脏-呼吸停止来评估兔子的死亡。从腹部区域剪下毛,切开一个切口以暴露腹膜,并除去腹股沟脂肪。然后,将脂肪组织置于细胞层流室中。用磷酸盐缓冲盐水(PBS)洗涤脂肪组织3次以去除红细胞。将收集的脂肪组织切成小块,并转移到一个20mL离心管中,并加入等体积的0.25%胰蛋白酶(Gibco,美国)和0.1%I型胶原酶(Sigma,美国)的混合物。将该组织在37℃的摇床上在恒定搅拌下孵育约15分钟。然后,将液体分成三层:上层包含黄色油性脂肪细胞,中间层包含脂肪组织,而底层包含单核细胞。提取底层并将其转移到含有15%胎牛血清(FBS,G ibco,美国)和高葡萄糖DMEM(Sigma,美国)的离心管中。剩余的基质部分在室温下用3mL红细胞裂解缓冲液(Sigma,美国)处理10分钟,通过100mm尼龙网过滤,并在1200×g下离心10分钟;然后,除去上清液。然后将细胞沉淀物悬浮在含有15%FBS,100U/mL青霉素和100mg/mL链霉素(Gibco Company,St.Louis,MO,美国)的高葡萄糖DME M培养基中。将细胞在37℃和5.0%CO
实施例2分离细胞的评估
MSC中没有特异性抗原。因此,需要同时分析多种表面抗原和细胞形态来确定间充质细胞的特征。通过流式细胞术检查ADSC表面标记。用0.25%胰蛋白酶(Gibco,美国)处理第3代粘附细胞,并用PBS洗涤两次。将细胞与兔抗CD31,抗CD44,抗CD45和抗CD90抗体(美国Invitrogen和美国Gibco)一起在4℃孵育过夜。通过用PBS洗涤三遍来去除未结合的抗体。洗涤后,将细胞与Cy3标记的抗山羊/抗兔第二抗体在室温下于黑暗中孵育45分钟,然后重悬于PBS中进行FACS分析。用流式细胞仪(B D FACSVerse,美国)分析每个样品至少1×10
在本研究中,从脂肪组织分离出的细胞具有以下特征:(1)呈纺锤形粘附生长并在菌落形成中生长(2)CD44,CD90和CD105的表达较高(>95%),而CD31和CD45的表达较低(<5%)和(3)具有多谱系分化潜能。这些特性符合ISCT对MSC规定的标准。结合分离的方法,免疫表型表征和细胞形态,分离的细胞确实是ADSC。我们检查了第3代ADSC中C D31,CD44,CD45和CD90的表达,95.2%的细胞表达CD44、97.4%的C D90、1.6%的细胞表达了CD31和1.1%的的细胞表达了CD45(如图1所示)。
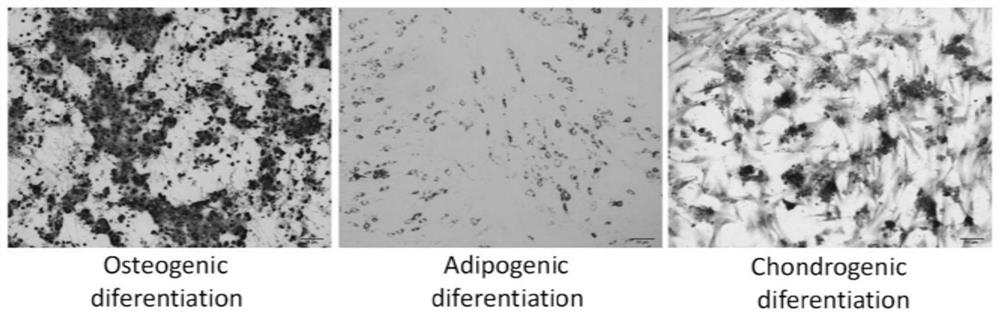
ADSCs的多系分化潜能以成骨,成脂和成软骨分化为特征。简而言之,将ADSC以5×10
实施例3
第三代细胞用胰蛋白酶和EDTA的混合物消化,制成10
如图3所示,诱导之前的第三代ADSC通常呈纺锤形,具有均匀的毛发分布和良好的细胞生长。诱导后的第一天,对照组和氢组中的增殖细胞在细胞形态上均未显示明显变化。然而,在第2组和第4组中,发生部分细胞死亡,细胞形状比诱导前稍大,并且细胞生长不如诱导前。诱导后第9天,各组细胞密度均达到80%以上,细胞呈梭形螺旋状分布。与第1组相比,三个处理组的细胞更大且数量更少。
实施例4细胞活力
使用3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2-四溴化铵(MTT)方法定量测定细胞活力。MTT是一种对代谢活性有响应的黄色四唑鎓染料,活细胞中的还原酶将MTT从浅黄色化合物还原为深蓝色的甲maz晶体。将细胞以1×10
MTT结果表明,与第1、3组相比,第2、4组的生长速度明显降低。值得注意的是,第2组和第4组的生长率尚未达到稳定期,并且两组均显示出持续的增殖趋势。但是,趋势相对平稳。如MTT增殖曲线所示,在不同的培养条件下,培养的前5天,第3组的生长速率小于第1组的生长速率。然而,在第5天之后,第3组的生长速率增加并超过了第1组。第2组从第二天起的生长速度快于第3组(如图4所示)。
实施例5细胞内平滑肌肌节α-肌动蛋白表达和百分比表达
诱导细胞分化后,将板用PBS溶液洗涤,并用PBS中的4%多聚甲醛固定细胞15分钟。然后,将细胞用PBS洗涤两次,每次10分钟,并用0.25%Triton X-100(Roche,德国)透化,然后仅用PBS洗涤3次。用含1%牛血清白蛋白(BSA)和5%山羊血清的PBS封闭含有处理过的细胞的盖玻片。然后,将细胞与一抗在4℃的潮湿箱中孵育2小时。然后,将细胞在兔抗肌节蛋白-α-肌动蛋白抗体(1:200)(Proteintech,USA),兔抗连接蛋白43抗体,单克隆GJA1抗体(1:400稀释度)下于4℃孵育过夜)(CX-43,AbCam),以及山羊抗兔和山羊抗大鼠AlexaFluor 555偶联的二抗。将Hoechst 33258(Beyotime Biotechnology,中国)添加到每个载玻片中,并将载玻片在室温下在黑暗中孵育30分钟。洗涤后,将载玻片密封,并使用荧光显微镜(Leica,德国)拍摄显微照片。
激光扫描共聚焦显微镜可用于定量标记的组织标本的荧光,并可显示Z轴方向的荧光变化。使用420至460nm(蓝色),510至560nm(绿色)和560至660nm(红色)滤光片查看并分别捕获图像。使用ImageJ软件(Rawak Software,德国)对照片进行分析,并使用PrismDemo软件(Gr aphPad Software,美国)对数据进行统计分析。
所有诱导分化的ADSC组均表达肌节α-肌动蛋白。但是,对照组细胞几乎没有分化。通常在骨骼肌细胞中表达的肌节蛋白-α-肌动蛋白在所有三种分化方案中均在细胞的外骨骼中表达。在第3组和第2组之间,肌动蛋白的表达没有显着差异,但是在第4组中,表达水平最高。可以通过观察染成蓝色的细胞核的密度来近似细胞密度。第3组的细胞密度与第1组相似,高于5-氮杂诱导的两组。然而,第1组的核体积比其他组更大(如图5所示)。
肌源性分化率由通过免疫组织化学的肌动蛋白表达百分数表示。诱导9天后,1、2、3、4组的表达率分别为3.2%±0.3%,48.5%±5%,41.1%±3.4%,62.8%±3.5%。第2组和第3组中发生肌原性分化的细胞比例显着高于第1组(均p<0.01),第2组低于第4组(P<0.05)。与第3组相比,第2组中发生肌原性分化的细胞比例有所增加,但差异不显着(P>0.05)(如图6所示)。这些结果表明,氢不仅可以促进单独的ADSC的肌源性分化,而且可以改善5-Aza诱导的细胞的肌源性分化。
实施例6肌钙蛋白,肌球蛋白,MyoD和肌球蛋白重链(MHC)表达(RT-PCR)
使用RNeasy Mini试剂盒(美国Invitrogen)分离未处理的和诱导分化的ADSCS的总RNA,包括用DNase I消化。根据说明使用逆转录试剂盒制备逆转录反应系统。使用PrimerPremier 5.0软件设计和合成用于逆转录PCR的引物,管家基因GAPDH作为内部参考。根据说明使用SYBR Gree n PCR试剂盒(Thermo Scientific,USA),将反应系统放入实时检测器(Applied Biosystems,USA)中进行检测。每组有两个重复的孔,并使用以下温度程序:94℃10分钟和94℃20秒,55℃20秒和72℃20秒的40个循环。
定量RT-PCR结果显示,第2组和第3组肌钙蛋白,肌球蛋白和Myo D的mRNA表达水平明显高于第1组(均p<0.01)。此外,与第1组相比,第2组和第3组的MHC mRNA表达增加(P<0.05)。此外,第4组中所有测试mRNA的表达水平均显着高于第2组(均P<0.05)。第2组中这些mRNA的表达水平高于第3组,但两组之间无显着差异(均P>0.05)(如图7所示)。
ADSCs肌源性分化后9天,MyoD表达的RT-PCR结果表明,诱导组中调控成肌细胞分化的上游基因的表达水平高于对照组。氢基团和5-氮杂基团之间的MyoD表达没有显着差异,但是两种诱导剂的协同作用可以增加MyoD表达。RT-PCR分析显示二级调节基因肌钙蛋白和肌球蛋白以及终末分化基因MHC的结果相似。这些结果表明氢和5-Aza诱导成肌细胞分化的机制是相似的。
因此,氢和5-Aza可以诱导脂肪组织来源的MSC进行肌原性分化。肌节α-肌动蛋白和肌钙蛋白,肌球蛋白,MyoD和MHC基因的表达证明了这一结果。类似于5-氮杂,氢有效地促进了肌原性分化。此外,与5-氮杂施用相比,氢暴露是一种更简单,无毒且便宜的分化方法。因此,氢是实现MSC分化为肌纤维的推荐诱导剂。
除非另外具体说明,否则在这些实施例中阐述的数值并不限制本发明的范围。在这里示出和描述的所有示例中,除非另有规定,任何具体值应被解释为仅仅是示例性的,而不是作为限制,因此,示例性实施例的其他示例可以具有不同的值。
- 一种诱导脂肪来源间充质干细胞肌源性分化的方法
- 一种诱导脂肪来源间充质干细胞肌源性分化的方法
