基于影像组学的胃癌多维特征提取与分析系统
文献发布时间:2023-06-19 11:22:42
技术领域
本发明属于计算机技术与医学图像处理交叉领域,具体涉及一种基于影像组学的胃癌多维特征提取与分析系统、方法、设备。
背景技术
胃癌(Gastric cancer,GC)是世界上最常见的恶性肿瘤之一,也是癌症相关死亡的第三大原因。胃癌患者预后与肿瘤浸润深度、淋巴结转移程度(LNM)及有无淋巴血管浸润密切相关。准确的术前评估这些预后因素对胃癌患者选择适当的医疗方案至关重要。CT(Computed tomography,CT)由于具有稳定的图像质量、高空间分辨率和快速的采集速度,是术前评估中最常用的检查手段。而CT对肿瘤浸润及淋巴结深度的评估主要依赖于肿瘤的大小、形态及强化模式,其准确性一般。
近年来,影像组学作为一种从影像数据转换中提取大量定量特征并进行进一步数据分析以支持决策的方法,越来越受到人们的关注。影像组学通过并行结合多种特征,实现了对肿瘤异质性的无创分析。许多基于影像组学的研究已经在肿瘤学实践中提供了一些与癌症鉴别、淋巴结转移、生存评估相关的参考。
影像组学包括几个步骤,包括肿瘤勾画、特征提取、特征选择和数据挖掘。在这些步骤中,选择更具重复性和有效性的特征对于进一步的数据挖掘至关重要。然而,在提取特征时,不可避免地会出现两难境地——肿瘤在CT图像中是多层表达的,因此可以用所有涉及的层(3D特征)或仅使用覆盖病变最大区域的单个横断面(2D特征)来计算特征。其中2D勾画易于执行,手工勾画的工作量和特征计算复杂度都较低;而3D特征可能携带更多的肿瘤信息,但其多层勾画的方式往往引入更多噪声。因此,在基于GC影像组学的研究中是使用2D还是3D勾画仍存在长期分歧。针对上述问题,本发明提出了一种基于影像组学的胃癌多维特征提取与分析方法。
发明内容
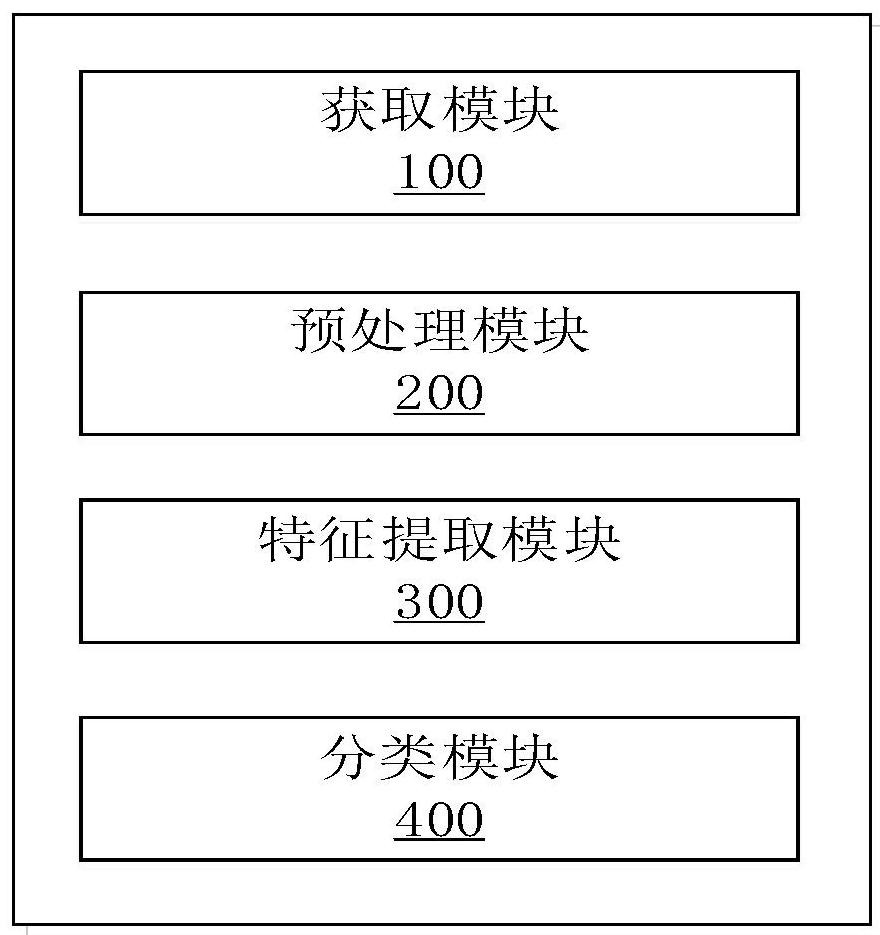
为了解决现有技术中的上述问题,即为了解决现有的基于影像组学的胃癌分析系统无法提取更具重复性和有效性的特征,从而导致分类准确度较低的问题,本发明提出了一种基于影像组学的胃癌多维特征提取与分析系统,该系统包括:获取模块、预处理模块、特征提取模块、分类模块;
所述获取模块,配置为获取待分类的胃癌CT图像,作为输入图像;
所述预处理模块,配置为通过差值法对所述输入图像进行重采样,使得所述输入图像的体素保持各向同性;并对重采样后的输入图像进行滤波处理;
所述特征提取模块,配置为提取重采样后的输入图像、滤波处理后的输入图像的2D和3D影像组学特征;
所述分类模块,配置为基于提取的2D和3D影像组学特征,通过预训练的分类模型获取所述输入图像的分类结果;
所述分类模型基于支持向量机构建,其训练方法为;
A10,获取胃癌CT图像及其对应的分类真值标签,构建训练样本集;
A20,对训练样本集中的胃癌CT图像的病灶区域进行勾画,并在设定时间间隔后的进行重复勾画;
A30,通过所述预处理模块、所述特征提取模块的方法提取训练样本集中已勾画的各胃癌CT图像的病灶区域的2D和3D影像组学特征;对重复勾画的病灶区域再次提取2D和3D影像组学特征;
A40,通过预设的筛选方法对步骤A30提取的2D和3D影像组学特征进行筛选;所述筛选方法包括一致性检验、Mann–Whitney U检验、线性相关分析、最小冗余最大相关性分析、最小绝对收缩和选择算子LASSO;
A50,将筛选后的2D和3D影像组学特征进行融合并输入分类模型,获取胃癌CT图像对应的分类预测结果,作为预测标签;基于所述预测标签、所述分类真值标签,计算损失值,更新所述分类模型的模型参数;
A60,循环执行步骤A10-步骤A50,直至得到训练好的分类模型。
在一些优选的实施方式中,“通过差值法对所述输入图像进行重采样,使得所述输入图像的体素保持各向同性”,其方法为:
采用B样条插值法对所述输入图像重采样到预设尺寸,使得所述输入图像的体素保持各向同性。
在一些优选的实施方式中,提取重采样后的输入图像的2D和3D影像组学特征包括:一阶统计直方图特征、形状特征、灰度共生矩阵特征、灰度游程矩阵特征、灰度区域大小矩阵特征、灰度空间依赖矩阵特征和临近灰度差矩阵特征;
提取滤波处理后的输入图像的2D和3D影像组学特征包括:一阶统计直方图特征、灰度共生矩阵特征、灰度游程矩阵特征、灰度区域大小矩阵特征、灰度空间依赖矩阵特征和临近灰度差矩阵特征。
在一些优选的实施方式中,分类模型的超参数使用交叉验证方法和Grid Search方法进行选取。
在一些优选的实施方式中,“通过预设的筛选方法对步骤A30提取的2D和3D影像组学特征进行筛选”,其方法包括:
对第一次提取的2D和3D影像组学特征和重复提取的2D和3D影像组学特征进行类间一致性检验和类内一致性检验,并将类间一致性和类内一致性系数均大于设定第一阈值的2D和3D影像组学特征,作为第一特征;
对各第一特征进行Mann–Whitney U检验,并将在正样本组和负样本组内分布差异较小的第一特征比对预设的有效表,推导出假设检验的P值,并将P值小于等于设定第二阈值的第一特征作为第二特征;所述正样本组为分类真值标签为正的样本组,所述负样本组为分类真值标签为负的样本组;
计算两两第二特征之间的Pearson线性相关系数,并将Pearson线性相关系数大于设定第三阈值的特征对中P值较小的一个保留,作为第三特征;
结合所述分类真值标签,利用最小冗余最大相关性方法对各第三特征进行筛选,筛选后的第三特征作为第四特征;
通过LASSO模型对各第四特征进行稀疏化处理,并将稀疏化处理后对应回归系数为非零的第四特征作为最终筛选得到的2D和3D影像组学特征。
在一些优选的实施方式中,所述LASSO模型的优化目标函数为:
其中,x
本发明的第二方面,提出了一种基于影像组学的胃癌多维特征提取与分析方法,该方法包括:
S10,获取待分类的胃癌CT图像,作为输入图像;
S20,通过差值法对所述输入图像进行重采样,使得所述输入图像的体素保持各向同性;并对重采样后的输入图像进行滤波处理;
S30,提取重采样后的输入图像、滤波处理后的输入图像的2D和3D影像组学特征;
S40,基于提取的2D和3D影像组学特征,通过预训练的分类模型获取所述输入图像的分类结果;
所述分类模型基于支持向量机构建,其训练方法为;
A10,获取胃癌CT图像及其对应的分类真值标签,构建训练样本集;
A20,对训练样本集中的胃癌CT图像的病灶区域进行勾画,并在设定时间间隔后的进行重复勾画;
A30,通过所述预处理模块、所述特征提取模块的方法提取训练样本集中已勾画的各胃癌CT图像的病灶区域的2D和3D影像组学特征;对重复勾画的病灶区域再次提取2D和3D影像组学特征;
A40,通过预设的筛选方法对步骤A30提取的2D和3D影像组学特征进行筛选;所述筛选方法包括一致性检验、Mann–Whitney U检验、线性相关分析、最小冗余最大相关性分析、最小绝对收缩和选择算子LASSO;
A50,将筛选后的2D和3D影像组学特征进行融合并输入分类模型,获取胃癌CT图像对应的分类预测结果,作为预测标签;基于所述预测标签、所述分类真值标签,计算损失值,更新所述分类模型的模型参数;
A60,循环执行步骤A10-步骤A50,直至得到训练好的分类模型。
本发明的第三方面,提出了一种设备,至少一个处理器;以及与至少一个所述处理器通信连接的存储器;其中,所述存储器存储有可被所述处理器执行的指令,所述指令用于被所述处理器执行以实现权利要求上述的基于影像组学的胃癌多维特征提取与分析方法。
本发明的第四方面,提出了一种计算机可读存储介质,所述计算机可读存储介质存储有计算机指令,所述计算机指令用于被所述计算机执行以实现权利要求上述的基于影像组学的胃癌多维特征提取与分析方法。
本发明的有益效果:
本发明结合了2D影像组学特征和3D影像组学特征的优势,提取更具重复性和有效性的多维特征,提高了胃癌CT图像的分类准确度。
本发明基于2D影像组学特征和3D影像组学特征的优势,并结合一致性检验、Mann–Whitney U检验、线性相关分析、最小冗余最大相关性分析、最小绝对收缩和选择算子LASSO筛选出稳定且显著的特征,对分类模型进行训练,提高了分类模型的分类精度,降低了图像类型变化对分类结果的影响。
另外,本发明提供的方法步骤简单,鲁棒性好,相比于以往的方法不需要额外的人工劳作。
附图说明
通过阅读参照以下附图所做的对非限制性实施例所做的详细描述,本申请的其他特征、目的和优点将会变得更明显。
图1是本发明一种实施例的基于影像组学的胃癌多维特征提取与分析系统的框架示意图;
图2为本发明一种实施例的基于影像组学的胃癌多维特征提取与分析方法的流程示意图;
图3是本发明一种实施例的分类模型的训练流程示意图;
图4是本发明一种实施例的适于用来实现本申请实施例的电子设备的计算机系统的结构示意图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
下面结合附图和实施例对本申请作进一步的详细说明。可以理解的是,此处所描述的具体实施例仅仅用于解释相关发明,而非对该发明的限定。需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。
本发明第一实施例的一种基于影像组学的胃癌多维特征提取与分析系统,如图1、图3所示,该系统包括以下模块:获取模块100、预处理模块200、特征提取模块300、分类模块400;
所述获取模块100,配置为获取待分类的胃癌CT图像,作为输入图像;
所述预处理模块200,配置为通过差值法对所述输入图像进行重采样,使得所述输入图像的体素保持各向同性;并对重采样后的输入图像进行滤波处理;
所述特征提取模块300,配置为提取重采样后的输入图像、滤波处理后的输入图像的2D和3D影像组学特征;
所述分类模块400,配置为基于提取的2D和3D影像组学特征,通过预训练的分类模型获取所述输入图像的分类结果;
所述分类模型基于支持向量机构建,其训练方法为;
A10,获取胃癌CT图像及其对应的分类真值标签,构建训练样本集;
A20,对训练样本集中的胃癌CT图像的病灶区域进行勾画,并在设定时间间隔后的进行重复勾画;
A30,通过所述预处理模块、所述特征提取模块的方法提取训练样本集中已勾画的各胃癌CT图像的病灶区域的2D和3D影像组学特征;对重复勾画的病灶区域再次提取2D和3D影像组学特征;
A40,通过预设的筛选方法对步骤A30提取的2D和3D影像组学特征进行筛选;所述筛选方法包括一致性检验、Mann–Whitney U检验、线性相关分析、最小冗余最大相关性分析、最小绝对收缩和选择算子LASSO;
A50,将筛选后的2D和3D影像组学特征进行融合并输入分类模型,获取胃癌CT图像对应的分类预测结果,作为预测标签;基于所述预测标签、所述分类真值标签,计算损失值,更新所述分类模型的模型参数;
A60,循环执行步骤A10-步骤A50,直至得到训练好的分类模型。
为了更清晰地对本发明基于影像组学的胃癌多维特征提取与分析系统进行说明,下面对本发明系统一种实施例中各步骤进行展开详述。
在下述实施例中先对分类模型的训练过程进行详述,再对基于影像组学的胃癌多维特征提取与分析系统获取胃癌CT图像的分类结果的过程进行详述。
1、分类模型的训练过程
A10,获取胃癌CT图像及其对应的分类真值标签,构建训练样本集;
在本实施例中,获取胃癌CT图像,所有入组的胃癌CT图像被按照CT扫描时间顺序,按照7:3的比例被划分为训练集和测试集。并基于获取的胃癌CT图像及其对应的分类真值标签构建训练样本集。
A20,对训练样本集中的胃癌CT图像的病灶区域进行勾画,并在设定时间间隔后的进行重复勾画;
在本实施例中,采用的是手动勾画的方法,由一名影像学专家勾画病灶区域作为感兴趣区域(ROI),ROI由影像学专家根据具体的需要预测的感兴趣事件进行定义。由该影像学专家勾画完所有胃癌CT图像一个月后,随机选取其中30%的病例,再由该影像学专家重新进行勾画;随机选取其中30%的病例,由另一名影像学专家重新勾画。这是为了在步骤A60中利用一致性检验的方法,淘汰不稳定的特征。
A30,通过差值法对训练样本集中已勾画的各胃癌CT图像进行重采样,使得胃癌CT图像的体素保持各向同性;并对重采样后的胃癌CT图像进行滤波处理;提取重采样后、滤波处理后的各胃癌CT图像的病灶区域的2D和3D影像组学特征;对重复勾画的病灶区域再次提取2D和3D影像组学特征;
在本实施例中,通过插值法对训练样本集中已勾画的各胃癌CT图像进行重采样处理到预设尺寸,使得各胃癌CT图的体素保持各向同性。其中,插值法在本发明中优选为B样条差值法,预设尺寸优选设置为1mm×1mm×1mm,在其他实施例中可以根据实际需求设置。
对重采样后的胃癌CT图像进行小波滤波处理,通过x,y,z三个轴分别进行高通或低通滤波,一共得到8幅小波滤波后的胃癌CT图像。
针对重采样后的胃癌CT图像、滤波处理后的胃癌CT图像,提取2D和3D影像组学特征。影像组学特征是按照《影像生物学标志物标准化倡议》(Imaging BiomarkerStandardization Initiative)中的定义提取的。针对重采样后的胃癌CT图像提取以下7类特征:18个一阶统计直方图特征、14个形状特征、24个灰度共生矩阵(Gray Level Co-occurrence Matrix)特征,16个灰度游程矩阵(Gray Level Run Length Matrix)特征,16个灰度区域大小矩阵(Gray Level Size Zone Matrix)特征,14个灰度空间依赖矩阵(GrayLevel Dependence Matrix)特征和5个临近灰度差矩阵特征(Neighboring Gray ToneDifference Matrix)。
由于小波滤波不会对ROI的形状产生变化,对于小波滤波后的图像,提取除了形状特征之外的其他六类特征。即包括灰度共生矩阵特征、灰度游程矩阵特征、灰度区域大小矩阵特征、灰度空间依赖矩阵特征、临近灰度差矩阵特征,临近灰度差矩阵特征是ROI纹理的描述子。
另外,对步骤A20中重复勾画的病灶区域再次提取2D和3D影像组学特征。
A40,通过预设的筛选方法对步骤A30提取的2D和3D影像组学特征进行筛选;所述筛选方法包括一致性检验、Mann–Whitney U检验、线性相关分析、最小冗余最大相关性分析、最小绝对收缩和选择算子LASSO;
在本实施例中,为了选出稳定且显著的特征,对2D和3D影像组学特征进行筛选,具体包括以下步骤:
A41,一致性检验:首先,为了评估影像组学特征在存在勾画偏差下的可重复性和鲁棒性,使用30%的重新分割的训练图像进行类间一致性检验和类内一致性检验,即对第一次提取的2D和3D影像组学特征和重复提取的2D和3D影像组学特征进行类间一致性检验和类内一致性检验,只有类间和类内一致性系数(ICC)均大于设定第一阈值时(本发明中优选设置为0.75)的特征被认为是可重复的,其他特征被淘汰。将保留的2D和3D影像组学特征作为第一特征。
A42,分布分析:使用Mann–Whitney U检验衡量各第一特征在正样本组和负样本组内分布的差异,如公式(1)所示:
其中,i是正样本组或负样本组,正样本组为分类真值标签为正的样本组,负样本组为分类真值标签为负的样本组,分类真值标签的正、负根据实际需要设置,n
A43,相关性分析:针对A42筛选后的第二特征,计算两两第二特征间的Pearson线性相关系数:Pearson线性相关系数计算方法如公式(2)所示:
其中,x
A44,最小冗余最大相关性(3)Minimum Redundancy Maximum Relevance)分析:利用最小冗余最大相关性方法,可以选择了彼此之间相关性较小、但与预测标签仍高度相关的特征组。该方法基于互信息,特征x和特征y间的互信息定义为:
其中,p(x,y)表示两个特征的联合分布,p(x)、p(y)分别表示两个特征的边缘分布。
假设经过A43筛选后,共有X个特征,使用者可以选择其中的m-1个特征,组成特征集S
其中,y为分类真值标签,x
将经过最小冗余最大相关性分析筛选后的第三特征作为第四特征。
A45,最小绝对收缩和选择算子(LASSO):它是一个线性模型,添加了L
其中,x
A50,将筛选后的2D和3D影像组学特征进行融合并输入分类模型,获取胃癌CT图像对应的分类预测结果,作为预测标签;基于所述预测标签、所述分类真值标签,计算损失值,更新所述分类模型的模型参数;
在本实施例中,将经过步骤A40筛选后的2D和3D影像组学特征进行融合并输入预构建的分类模型,对分类模型进行训练。分类模型基于支持向量机构建。
基于分类模型输出的胃癌CT图像的分类预测结果,作为预测标签。基于预测标签。分类真值标签,计算损失值,更新分类模型的模型参数。
另外,分类模型在训练时使用交叉验证结合Grid Search的方法选择超参数。
A60,循环执行步骤A10-步骤A50,直至得到训练好的分类模型。
在本实施例中,循环对分类模型进行训练,直至分类模型达到设定的精度或达到设定的训练次数,则将训练好的分类模型进行输出。
2、基于影像组学的胃癌多维特征提取与分析系统
所述获取模块100,配置为获取待分类的胃癌CT图像,作为输入图像;
在本实施例中,获取待分类的胃癌CT图像。
所述预处理模块200,配置为通过差值法对所述输入图像进行重采样,使得所述输入图像的体素保持各向同性;并对重采样后的输入图像进行滤波处理;
在本实施例中,通过B样条差值法对胃癌CT图像进行重采样至设定尺寸,使得胃癌CT图像的体素保持各向同性。并对重采样后的输入图像进行滤波处理。重采样和滤波处理过程可以参考步骤A30的处理过程。
所述特征提取模块300,配置为提取重采样后的输入图像、滤波处理后的输入图像的2D和3D影像组学特征;
在本实施例中,提取采样后的输入图像、滤波处理后的输入图像的2D和3D影像组学特征;
提取重采样后的输入图像的2D和3D影像组学特征包括:一阶统计直方图特征、形状特征、灰度共生矩阵特征、灰度游程矩阵特征、灰度区域大小矩阵特征、灰度空间依赖矩阵特征和临近灰度差矩阵特征;
提取滤波处理后的输入图像的2D和3D影像组学特征包括:一阶统计直方图特征、灰度共生矩阵特征、灰度游程矩阵特征、灰度区域大小矩阵特征、灰度空间依赖矩阵特征和临近灰度差矩阵特征。
所述分类模块400,配置为基于提取的2D和3D影像组学特征,通过预训练的分类模型获取所述输入图像的分类结果。
在本实施例中,将提取的2D和3D影像组学特征输入上述训练的分类模型,得到胃癌CT图像的分类结果。
需要说明的是,上述实施例提供的基于影像组学的胃癌多维特征提取与分析系统,仅以上述各功能模块的划分进行举例说明,在实际应用中,可以根据需要而将上述功能分配由不同的功能模块来完成,即将本发明实施例中的模块或者步骤再分解或者组合,例如,上述实施例的模块可以合并为一个模块,也可以进一步拆分成多个子模块,以完成以上描述的全部或者部分功能。对于本发明实施例中涉及的模块、步骤的名称,仅仅是为了区分各个模块或者步骤,不视为对本发明的不当限定。
本发明第二实施例的一种基于影像组学的胃癌多维特征提取与分析方法,如图2所示,包括:
S10,获取待分类的胃癌CT图像,作为输入图像;
S20,通过差值法对所述输入图像进行重采样,使得所述输入图像的体素保持各向同性;并对重采样后的输入图像进行滤波处理;
S30,提取重采样后的输入图像、滤波处理后的输入图像的2D和3D影像组学特征;
S40,基于提取的2D和3D影像组学特征,通过预训练的分类模型获取所述输入图像的分类结果;
所述分类模型基于支持向量机构建,其训练方法为;
A10,获取胃癌CT图像及其对应的分类真值标签,构建训练样本集;
A20,对训练样本集中的胃癌CT图像的病灶区域进行勾画,并在设定时间间隔后的进行重复勾画;
A30,通过所述预处理模块、所述特征提取模块的方法提取训练样本集中已勾画的各胃癌CT图像的病灶区域的2D和3D影像组学特征;对重复勾画的病灶区域再次提取2D和3D影像组学特征;
A40,通过预设的筛选方法对步骤A30提取的2D和3D影像组学特征进行筛选;所述筛选方法包括一致性检验、Mann–Whitney U检验、线性相关分析、最小冗余最大相关性分析、最小绝对收缩和选择算子LASSO;
A50,将筛选后的2D和3D影像组学特征进行融合并输入分类模型,获取胃癌CT图像对应的分类预测结果,作为预测标签;基于所述预测标签、所述分类真值标签,计算损失值,更新所述分类模型的模型参数;
A60,循环执行步骤A10-步骤A50,直至得到训练好的分类模型。
所述技术领域的技术人员可以清楚的了解到,为描述的方便和简洁,上述描述的方法的具体的工作过程及有关说明,可以参考前述系统实施例中的对应过程,在此不再赘述。
本发明第三实施例的一种设备,至少一个处理器;以及与至少一个所述处理器通信连接的存储器;其中,所述存储器存储有可被所述处理器执行的指令,所述指令用于被所述处理器执行以实现权利要求上述的基于影像组学的胃癌多维特征提取与分析方法。
本发明第四实施例的一种计算机可读存储介质,所述计算机可读存储介质存储有计算机指令,所述计算机指令用于被所述计算机执行以实现权利要求上述的基于影像组学的胃癌多维特征提取与分析方法。
所述技术领域的技术人员可以清楚的了解到,为描述的方便和简洁,上述描述的存储装置、处理装置的具体工作过程及有关说明,可以参考前述方法实例中的对应过程,在此不再赘述。
下面参考图4,其示出了适于用来实现本申请方法、系统、装置实施例的服务器的计算机系统的结构示意图。图4示出的服务器仅仅是一个示例,不应对本申请实施例的功能和使用范围带来任何限制。
如图4所示,计算机系统包括中央处理单元(CPU,Central Processing Unit)401,其可以根据存储在只读存储器(ROM,Read Only Memory)402中的程序或者从存储部分408加载到随机访问存储器(RAM,Random Access Memory)403中的程序而执行各种适当的动作和处理。在RAM 403中,还存储有系统操作所需的各种程序和数据。CPU 401、ROM 402以及RAM 403通过总线404彼此相连。输入/输出(I/O,Input/Output)接口405也连接至总线404。
以下部件连接至I/O接口405:包括键盘、鼠标等的输入部分306;包括诸如阴极射线管(CRT,Cathode Ray Tube)、液晶显示器(LCD,Liquid Crystal Display)等以及扬声器等的输出部分407;包括硬盘等的存储部分408;以及包括诸如LAN(局域网,Local AreaNetwork)卡、调制解调器等的网络接口卡的通信部分409。通信部分409经由诸如因特网的网络执行通信处理。驱动器410也根据需要连接至I/O接口405。可拆卸介质411,诸如磁盘、光盘、磁光盘、半导体存储器等等,根据需要安装在驱动器410上,以便于从其上读出的计算机程序根据需要被安装入存储部分408。
特别地,根据本公开的实施例,上文参考流程图描述的过程可以被实现为计算机软件程序。例如,本公开的实施例包括一种计算机程序产品,其包括承载在计算机可读介质上的计算机程序,该计算机程序包含用于执行流程图所示的方法的程序代码。在这样的实施例中,该计算机程序可以通过通信部分409从网络上被下载和安装,和/或从可拆卸介质411被安装。在该计算机程序被中央处理单元(CPU)401执行时,执行本申请的方法中限定的上述功能。需要说明的是,本申请上述的计算机可读介质可以是计算机可读信号介质或者计算机可读存储介质或者是上述两者的任意组合。计算机可读存储介质例如可以是——但不限于——电、磁、光、电磁、红外线、或半导体的系统、装置或器件,或者任意以上的组合。计算机可读存储介质的更具体的例子可以包括但不限于:具有一个或多个导线的电连接、便携式计算机磁盘、硬盘、随机访问存储器(RAM)、只读存储器(ROM)、可擦式可编程只读存储器(EPROM或闪存)、光纤、便携式紧凑磁盘只读存储器(CD-ROM)、光存储器件、磁存储器件、或者上述的任意合适的组合。在本申请中,计算机可读存储介质可以是任何包含或存储程序的有形介质,该程序可以被指令执行系统、装置或者器件使用或者与其结合使用。而在本申请中,计算机可读的信号介质可以包括在基带中或者作为载波一部分传播的数据信号,其中承载了计算机可读的程序代码。这种传播的数据信号可以采用多种形式,包括但不限于电磁信号、光信号或上述的任意合适的组合。计算机可读的信号介质还可以是计算机可读存储介质以外的任何计算机可读介质,该计算机可读介质可以发送、传播或者传输用于由指令执行系统、装置或者器件使用或者与其结合使用的程序。计算机可读介质上包含的程序代码可以用任何适当的介质传输,包括但不限于:无线、电线、光缆、RF等等,或者上述的任意合适的组合。
可以以一种或多种程序设计语言或其组合来编写用于执行本申请的操作的计算机程序代码,上述程序设计语言包括面向对象的程序设计语言—诸如Java、Smalltalk、C++,还包括常规的过程式程序设计语言—诸如“C”语言或类似的程序设计语言。程序代码可以完全地在用户计算机上执行、部分地在用户计算机上执行、作为一个独立的软件包执行、部分在用户计算机上部分在远程计算机上执行、或者完全在远程计算机或服务器上执行。在涉及远程计算机的情形中,远程计算机可以通过任意种类的网络——包括局域网(LAN)或广域网(WAN)—连接到用户计算机,或者,可以连接到外部计算机(例如利用因特网服务提供商来通过因特网连接)。
附图中的流程图和框图,图示了按照本申请各种实施例的系统、方法和计算机程序产品的可能实现的体系架构、功能和操作。在这点上,流程图或框图中的每个方框可以代表一个模块、程序段、或代码的一部分,该模块、程序段、或代码的一部分包含一个或多个用于实现规定的逻辑功能的可执行指令。也应当注意,在有些作为替换的实现中,方框中所标注的功能也可以以不同于附图中所标注的顺序发生。例如,两个接连地表示的方框实际上可以基本并行地执行,它们有时也可以按相反的顺序执行,这依所涉及的功能而定。也要注意的是,框图和/或流程图中的每个方框、以及框图和/或流程图中的方框的组合,可以用执行规定的功能或操作的专用的基于硬件的系统来实现,或者可以用专用硬件与计算机指令的组合来实现。
术语“第一”、“第二”等是用于区别类似的对象,而不是用于描述或表示特定的顺序或先后次序。
术语“包括”或者任何其它类似用语旨在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备/装置不仅包括那些要素,而且还包括没有明确列出的其它要素,或者还包括这些过程、方法、物品或者设备/装置所固有的要素。
至此,已经结合附图所示的优选实施方式描述了本发明的技术方案,但是,本领域技术人员容易理解的是,本发明的保护范围显然不局限于这些具体实施方式。在不偏离本发明的原理的前提下,本领域技术人员可以对相关技术特征作出等同的更改或替换,这些更改或替换之后的技术方案都将落入本发明的保护范围之内。
- 基于影像组学的胃癌多维特征提取与分析系统
- 基于增强CT影像组学的胃癌腹膜转移的预测系统及方法
