用于标测支配动脉壁功能性神经的系统和方法以及可实现相同功能的3D标测法和导管
文献发布时间:2023-06-19 11:57:35
在本申请中,引用了各种公开文献。本申请结合了相关领域内发表的公开文献,用以更充分地表述本发明在相关领域内的先进水平。
技术领域
本发明涉及用于在动脉壁上准确和精确定位并识别在能量传递过程期间和之后,由交感和副交感相关神经支配区域的系统和方法。本发明还涉及特定用于肾神经标测和消融的导管系统。
背景技术
充血性心力衰竭、高血压、糖尿病和慢性肾衰竭具有许多不同的初始病因;然而,这些疾病在发展为末期疾病的进程中都遵循一个共同过程。这种共同过程为肾交感神经过度兴奋。肾交感神经充当信号输入通路,将肾神经活动传入信号传送到位于脊髓和大脑中更高级的交感神经中枢,来增加系统性交感神经紧张度;同时,通过活动传出信号,由于肾神经和动脉响应于来自大脑的信号,参与了交感神经过度兴奋作用,进一步增加系统性交感神经紧张度(Dibona和Kopp,1977)。交感神经激活最初可为有益的,但最终会变得适应不良。在交感神经过度兴奋的状态下,会发生大量病理学现象:激素分泌异常,如儿茶酚胺、肾素(renine)和血管紧张素II水平升高;外周血管收缩和/或水钠潴留从而引起的血压升高;肾小球过滤受损和肾单位损失从而导致的肾衰竭;左心室肥大和肌细胞损失从而导致的心肌功能不全和心力衰竭;中风,甚至糖尿病。因此,对交感神经活性进行调节(减少/去除)可减慢或阻止这些疾病的发展。最近,使用高射频切除肾神经已成为治疗耐药性高血压(Esler等人,2010和Krum等人,2009)和葡萄糖代谢异常(Mahfoud,2011)的公认方法。然而,执行肾神经消融术或去肾神经的某些方法或者比较简陋,或者以医学专业人员在对疾病通路中关键的肾神经位置不确定的情况下进行操作的方式来实施。本发明试图矫正某些这类问题。
关于肾交感神经过度兴奋对高血压的发展和延续作用已有系统的研究。已根据大量事实探索出了这种关系,不管各种医药产品和组合医药产品的可获得性以及帮助改变病患生活方式的资源如何,高血压的治疗率仍出人意料的低。具体来说,约1/3的高血压患者即使采用优化后的药物疗法,仍没有充分反应,且这个群体当中所测量的血压范围仍然异常。这个现象称为耐药性高血压。在约一半高血压患者中,血压仍然高于可接受的治疗目标水平。患有“原发性”高血压(即,未能找到具体病因的持续性和病理学高血压)的这些患者当中,据说存在对于当前治疗方案没有反应的基础病理生理学。另外,已注意到,在这类患者中,传出交感肾神经的输出流会刺激肾素释放,增加肾小管钠再吸收,且减小肾血流量,而来自肾的传入神经信号可以调节中枢交感神经的输出流,且由此有助于调节钠和水的代谢、血管张力/阻力和血压。
各种数据已确认肾神经阻断对降低高血压有积极影响;有数据已进一步确认交感神经系统活性增加与高血压之间的关系。具体来说,研究已展示,肾功能不全作为交感神经系统活性增加而导致高血压的一种机制(Campese,2002;Ye,2002),可以阻断肾神经活性,控制患有慢性肾功能不足的动物的高血压(Campese,1995),以及为消除患有多囊性肾病患者的难治病疼痛而执行的去肾神经术也可消除高血压(Valente 2001)。额外研究表明,溢出到肾静脉中增加的去甲肾上腺素被鉴定为原发性高血压的罪魁祸首(Esler等人,1990),且已显示通过肾切除术实现的神经可以消除接受透析治疗、患有多药物疗法顽固性重度高血压患者的高血压(Converse 1992)。去肾神经术也被认为可以延迟或阻止患有各种实验性高血压的动物(例如,自发性高血压大鼠(SHR)、易中风SHR、新西兰SHR、临界高血压大鼠(BHR)、戈德布拉特氏IK、1C(大鼠)、戈德布拉特氏2K、2C(大鼠)、主动脉狭窄(犬)、主动脉神经切断(大鼠)、DQCA-NaCL(大鼠、猪)血管紧张素II(大鼠、兔)、脂肪喂食造成的肥胖症(犬)、肾包裹(大鼠))中病情的发展(DiBona和Kopp,1997)。
某些先前降低顽固性高血压的努力集中在使用治疗性药物的方法上,且具体来说,在神经位点处局部使用神经阻断剂,如局部麻醉剂、氯胺酮、三环类抗抑郁剂或神经毒素。
在犬科动物中进行的研究证实了关于这类治疗性药物方法的概念验证。在一个研究中,从已执行了微栓塞诱导急性心力衰竭的总共十一(11)只犬中收集数据;其中八(8)只犬用通过在Gerota筋膜内部注入10ml布比卡因
肾神经过度兴奋也被认为在胰岛素敏感性和葡萄糖代谢中起一定作用。确切地说,伴随肾神经过度兴奋的去甲肾上腺素释放增加导致了血流量减小,这转而与葡萄糖摄入减少相关。这表示细胞跨细胞膜输送葡萄糖的能力受损。肾神经过度兴奋与神经介导的开口毛细管数量减少相关,使得胰岛素从血管内室移动到达细胞膜必须经过的距离增加。胰岛素介导的肌肉渗透增加在抗胰岛素状态下减小约30%。因此肌肉交感神经活性与胰岛素抗性之间存在正比关系,且胰岛素抗性与开口毛细管数量之间存在反比关系。(Mahfoud等人,2011)。由此,肾交感神经过度兴奋与糖尿病和/或代谢综合症的某些方面相关;交感神经过度兴奋诱导胰岛素抗性和高胰岛素血症,这转而产生额外交感神经刺激。已有研究评估去肾神经对糖尿病指标的影响的研究。
Mahfoud等人(2011)的研究测试了去肾神经对患有2型糖尿病以及≥160mm Hg的高血压的患者(或≥150mm Hg的患有2型糖尿病的患者)的影响,尽管这些患者使用了至少3种抗高血压药物(包含1种利尿剂)进行治疗。在最初和在手术之后一(1)个月和三(3)个月进行的后续访问时,对血液化学和空腹葡萄糖、胰岛素、C肽和HbAic进行测量,同时在最初和3个月之后执行口服葡萄糖耐受性测试(OGTT)。血浆葡萄糖浓度用葡萄糖氧化酶方法评定,而血浆胰岛素和C肽浓度可通过化学发光分析测量。在去神经之后三个月,糖尿病指标已明显改善。在测验最初,治疗组中的13个患者的胰岛素水平为≥20μIU/mL。该治疗方法可将此参数减小77%(n=10),同时保持对照组中无变化。胰岛素敏感性也在去肾神经之后显著增加。在34个患者(测试组,n=25;对照组,n=9)中,在最初,OGTT表示8个患者患有空腹血糖异常,18个患者患有葡萄糖耐受性异常,且8个患者患有糖尿病。在手术之后,25名患者中有7位的OGTT表示有所改善。基于OGTT诊断患有糖尿病的患者的数量减小12%(n=3);并患有普通葡萄糖耐受性的患者的数量增加16%(n=4)。对照组的患者在后续复查期间葡萄糖或胰岛素代谢无显著变化。
由此,Mahfoud等人的研究确凿地证明肾交感神经系统是胰岛素抗性的重要调节因子,且展示肾神经消融可以明显改善胰岛素敏感性和葡萄糖代谢。
在1950年代期间,在抗高血压剂药物问世之前,手术去交感神经术用于治疗人类重度高血压(Smithwick和Thompson,1953)。然而,这类去肾神经手术极其具有创伤性且涉及大量手术过程;因此,这在临床实践中具有很大限制(DiBoma,2003)。
最近,更倾向于利用血管内导管技术在人体肾中选择性去神经。肾神经主要排布在血管中膜外、肾动脉外膜间隙内。因此,射频能量、激光能量、高强度聚焦超声和乙醇可传递到肾动脉壁,且冷冻消融技术经由肾动脉内腔可同样作用于肾动脉壁上,以消融交感肾神经。
通过导管方法进行肾神经消融的首个人类研究在2009年于高血压患者测试受试者上进行。参加的患者测试受试者的站立血压(SBP)大于或等于160mm Hg,尽管患者服用多于三种抗高血压药剂(包含利尿剂),或受试者对抗高血压药剂具有确定的不耐受性(Krum等人,2009)。在本研究的四十五(45)个患者中,患者总体初始基线血压为177/101±20/15(mm Hg)。在参加的患者中,去肾神经疗法对89%的患者有反应,且观测到了血压降低。
为了评定去肾神经是否有效执行,在肾神经消融之后,测量去甲肾上腺素溢出值以确定去交感神经的成果。在最初和在手术之后1个月、3个月、6个月、9个月以及12个月测量血压。在每个时间点,收缩压和舒张压两者的减小都有记录,并且随时间继续减小。手术后,在45个受试者当中,自身去甲肾上腺素溢出量总体降低28%(p=0.043),其中约三分之一可归因于去肾交感神经术。45个患者中有43名接受了治疗并无并发症发生,且没有慢性血管并发症。
在Krum等人的研究之后,有一些公认的通过运用导管的方式来执行肾神经消融的某些方法,但所述方法包括一些其它形式。通常,肾神经消融包括基于导管的方法,其中,向患者每个肾动脉执行四(4)个到六(6)个两分钟的射频(RF)治疗,其中射频由自动、低功率且具有内置安全算法的射频(RF)产生器产生。射频通常为5-8瓦,通过肾动脉中的导管,在应用射频的情况下将导管从主动脉远端移动到主动脉的近端来执行,间隔增量为5mm或更多。
在前述Mahfoud等人的糖尿病研究中,后续具体消融方法如下:通过使用肾双曲面或左侧内部乳腺动脉导引导管,将治疗导管引入到每一肾动脉中;对各个持续至多2分钟的射频消融施加8瓦的低功率,在每一肾动脉内纵向地和可旋转地进行至多6次独立消融。治疗从主要肾动脉的远端分支开始一直进行到到肾动脉开口。连续监测导管尖端阻抗和温度,且根据预定算法调节射频能量传递。
如上文所列举的那些的血管内导管治疗过程旨在保持血流量且将内皮损伤最小化,同时沿肾血管施加的病灶性消融可实现快速愈合。这种神经消融效果可以同时减小来自肾作用的系统性交感神经活性和肾的交感神经刺激的传出影响,同时可提供临床上持久的作用结果。
在功能上,消融肾动脉的最优目标是在不损害交感神经传导信号到其它器官的情况下选择性使肾交感神经(传入和传出两种)失效,且将能量精确传递到分布肾交感神经的位置以便切除所述神经。目前,肾神经消融是在“盲目”方式下完成的——也就是说,在进行消融射频之前,执行手术的医生并不知道肾交感神经分布在何处,从而在肾动脉全长进行消融;此外,肾神经是否已被消融仅可通过在完成手术之后测量的继发作用——即去甲肾上腺素溢出量来确认。目前,约89%患者对去肾神经治疗有反应(Krum等人,2009;和Esler等人,2010)。然而,这些数据是通过在手术之后至少一个月后,测量病人的血压来确定去肾神经的疗效。在一些情况下,治疗失败的原因可能是肾神经的再生(Esler等人,Lancet2010),而在其它情况下,可能是由于未能恰当地定位肾神经且未能充分完全地消融所述肾神经而致使治疗失败。因此,迫切需要以下方法:精确检测肾神经沿肾动脉如何分布,以将消融结果回馈给医生,通过监测临床相关指数(如血压、心率和肌肉交感神经活性等)来评定是否施行了有效的消融。如上文所论述,肾传入和传出神经系统是交感神经过度兴奋的共同通路,肾神经刺激可经交感神经使血压升高,并使心率变化。心率上升可以是由于直接刺激交感神经所致,或由于经由压力感受器反射间接反射调节而降低血压的原因。
一种改进方法将涉及肾神经标测方法,通过所述肾神经标测方法,可通过低功率电流刺激肾动脉的单独区段,同时测量血压、心率和肌肉交感神经活性。如果检测到血压、心率和肌肉交感神经活动中的可测量的变化,如血压升高或心率变化或肌肉交感神经活性减弱,那么可期望,那个位点处的消融应已经执行,以便可以更精确的方式破坏神经纤维,且因此可以改进所需临床测量的结果。这些改进的肾神经标测和导管插入技术将力求将所描述的去神经手术的类型中的不必要消融最小化,导引操作员来执行肾消融手术,并优化治疗高血压、心力衰竭、肾衰竭和糖尿病的肾神经消融的临床结果。
在解剖学上,运载纤维往返肾的神经发源于腹腔神经丛(a/k/a太阳神经丛)及其分支、腰椎内脏神经和肠系膜间神经丛(DiBona和Kopp,1997,第79页)。腹腔神经丛由肾上腺神经节(即主动脉肾神经节)、腹腔神经节和内脏大神经构成。腹腔神经节接收由胸交感神经干(胸内脏神经)和迷走神经而来的神经冲动(DiBona和Kopp,1997,第79页)。近来的研究揭示了人体肾动脉周围神经分布的解剖结构和神经成分。Mompeo团队在研究了平均年龄在73到94岁的12具人体标本(6男6女),共24只肾后发现,大部分的神经网络分布于肾动脉的上表面(95.83%)与下表面(91.66%),并且由斜角分布的神经纤维所松散连接。在24只肾中的15个肾(62.5%),主动脉肾神经节与内脏神经节融合为一个整体结构。主动脉肾神经节通过1到3根粗大的、跨过肾动脉三分之一的前表面的神经链条与肾下神经节相连接.肾下神经节位于肾动脉下侧,并与肾后神经节相连.在3只肾(12.5%),肾下神经节与肾后神经节相连形成一独立的块状神经结构.肾下神经节接受来自于腰交感链、肠系膜间神经、和肠系膜上神经的神经纤维.在全部24只肾,在肾门主动脉中段三分之一处都发现有由神经纤维-神经节形成的整体结构所包裹.这一结构中包含有内脏神经节(100%的肾脏),主动脉肾神经节(100%),肾下神经节(95.83%)和肾后神经节(70.83%).这一结构是由短粗的神经纤维带将不同的神经节连在一起所形成的.在7只肾脏,观察到在肾动脉上环绕有神经组织所形成的完整环状结构(Mompeo et al.,2016)..重要的发现是,van Amsterdam(等研究者基于从7具人体标本所获取的8条肾动脉制作得来的共3372神经组织节段.运用免疫组化特异标志物染色的方法证明,交感神经、付交感神经和传入神经分别是神经横截总面积的73.5%、17.9%和8.7%(van Amsterdam et al.,2016)。这些解剖与组织学数据为肾神经标测策略和选择性消融治疗奠定了坚实的基础。
肾上腺神经节朝向肾上腺发出许多分支,这些分支中的一些沿肾上腺动脉行进到围绕肾动脉的血管周围神经束并进入肾门;其它分支进入肾门区域外的肾。内脏主神经在通往腹腔神经节的途中,在除肾上腺神经节以外的点向肾发出分支。腹腔神经节向肾发出分支,所述分支围绕肾动脉的血管周围神经束并进入肾门(DiBona和Kopp,1997,第79页)。
腰椎和胸内脏神经分别发源于胸和腰椎椎旁交感神经干。这些神经通过通达腹腔神经节的分支和通达围绕肾动脉的血管周围神经束而进入肾门的分支神经来支配肾神经(DiBona和Kopp,1997,第79页)。
含有上肠系膜神经节的肠系膜间神经丛可接收由腰椎内脏神经传来的神经冲动,并在到达肾之前分叉,这种分叉常常附有卵巢或睾丸动脉的分支(DiBona和Kopp,1997,第79页)。肾神经与肾动脉和静脉结合进入肾门(DiBona和Kopp,1997,第81页)。这些神经随后沿肾皮质和外部髓质中的肾动脉血管区段分布,所述肾动脉血管区段包含叶间动脉、弓形动脉和小叶间动脉以及传入和传出肾小球微动脉(DiBona和Kopp,1997,第81页)。
尽管在进行消融之前要考虑肾神经结构,在执行为去神经的导管插入术之前必须仔细考虑个别肾结构。如关于Krum等人/Esler等人的研究中所提及,部分地通过评估肾动脉解剖结构、肾动脉狭窄、先前的肾支架术或血管成形术和双侧肾动脉的情况来确定导管插入术的适用性。异常或反常的肾结构不仅是导管插入术过程中或自身的障碍,而且肾结构中的普通变化形式也有可能具有挑战性,尤其在使用没被临床试验认可的导管系统(即,不是为肾动脉消融本身专门设计的导管)时。使用次优导管系统的肾导管插入术的风险可包含:在通过脆弱组织时,由于这类导管尖端的粗糙形态或是尖突状造成肾动脉断裂,由于应用过度消融能量而造成动脉壁或肾动脉内皮断裂和/或损伤,以及动脉剥离。因此,需要有专门为肾结构和肾结构中的常见变化设计的导管系统,以便适于治疗大量符合条件的顽固性患者群体。
为冠状动脉系统设计的某些导管系统类似于可用于肾神经消融的导管系统;具体来说,设计用于冠状动脉的被调适成弥补心动过速的消融导管系统可用于肾神经消融手术。因而,这些系统通常含有用于评定可在导管电极中传递并在心肌组织中的预先存在电流的电极。相反,用于去肾神经的理想导管系统应当优化改造有双重功能:标测肾神经分布和通过提供电刺激来刺激肾神经活性,以使得医务操作员可实时评定患者由于所述电刺激和去肾神经而出现的生理变化。然而,这类导管之前并没有被研发出来。
已知导管系统常常具有用于心脏的多种功能。市场上的一些著名导管系统包含以下:
这种导管通常用于评定治疗阵发性心房颤动时的肺静脉隔离情况。它与Medtronic的Arctic Front冷冻消融系统一起结合使用。Achieve
i. 3.3Fr,1.1mm(0.043")导管轴尺寸
ii. 总长165cm;可使用长度146cm
iii. 两种环尺寸:15mm和20mm
iv. 两种电极间隔:4mm和6mm
v. 八个1mm电极
vi. 导管兼容的最小ID为3.8Fr,1.3mm(0.049")
这种导管是用于执行心脏电生理标测和消融的组合导管。这种气囊导管包含温度、压力和EKG传感器,以及可消融心脏组织的LED。导管是基于互连件的“弹出”设计和可拉伸电子件的概念。在这个设计中,所有必需医疗装置集中于一种标准心内膜气囊导管(薄柔管)的区段上,该区段的壁比其它部分的壁更薄,而且这个区段从导管表面的剩余部分略微凹入。在这个凹陷部分中,敏感装置和激活器在导管通过身体到心脏的行程期间受到保护。一旦导管到达心脏,就对导管充气,且薄壁区段将显著扩张以使得电子件暴露出并与心脏接触。
当导管在适当位置时,个别装置可按需要执行其具体任务。压力传感器确定心脏上的压力;EKG传感器监测心脏在手术期间的状况;LED散布光能以用于成像并且还提供用于消融组织(在这种情况下,通常为诱使心动过速的组织)的消融能量;以及温度传感器控制温度以免损伤其它健康组织。整个系统被设计成特性不会随着气囊充气和放气而变化并可以可靠地操作。
该系统被设计为可以将例如温度、机械力、血流量和电图等关键高品质信息实时传递到手术队伍中。
i. 两种气囊直径:23mm和28mm
ii. 双气囊安全系统
iii. 可双向偏转(最大45度)
iv. 兼容12F
v. 工作长度为102cm
LASSO 2515可变环状标测导管含有一种可变环,可调整成适合于尺寸在25与15mm之间的静脉。
目前用于肾消融的导管系统包括消融导管和射频产生器,即
一些事实表明,某些高血压病例对纯药理学手段治疗有抗性,这种情况重新需要在治疗这些病例中使用创伤性技术。在历史上,在引入口服抗高血压药物的方式之前,手术去肾神经法针对严重高血压病例有显著治疗(Smithwick和Thompson,1953)。然而,这个类型的常规手术极富创伤性,且涉及大大限制其实用性的大量手术过程(DiBona,2003)。至少两个临床研究在一定程度上提供了在治疗抗性高血压中使用微创导管类射频(RF)肾神经消融的支持信息(Krum等人,2009;Esler等人,2009)。对抗高血压药物有抗性的高血压患者被选中参与这些研究,且这种创伤性手术在一小部分和特选的患者群体中证明了降低血压的临床成功率为89%。
尽管对使用这类极小创伤性介入技术治疗高血压的兴趣越来越大,但包含Ardian
当前介入治疗系统和技术中未考虑的重要方面为能否精准地将有效剂量的能量定位和传递到动脉壁中适合的消融点。当前普遍公认的经由导管执行肾神经消融的手术包括由向动脉壁投与4到6次消融的步骤,每次消融包括2分钟的RF能量释放,并且沿每一肾动脉的内壁纵向和弧向地隔开。消融须以这种螺旋方式“盲目地”传递,因为支配肾动脉的神经与消融导管的相对准确位置在传递消融能量之前和期间未知。不正确导向剂量的能量不仅对健康组织和非交感神经会造成不必要的损伤,而且更重要的是不能确保这种介入疗法达到预期的治疗高血压的目的。事实上,在除了两个已公开的研究外的某些临床设置中,对这种“盲目”介入疗法的反应者率可低至50%(Medical devices:pg 1-2,2012年2月22日)。
在理论上,动脉壁中的精准神经消融可通过在传递所述剂量的能量之前标测支配动脉壁神经的位置来实现。在刺激传递到动脉壁上的所选择的位置时,通过监测伴随自主紧张神经系统的生理参数,如血压、心率和肌肉活性,紧邻这个位置的自主神经的表现将会从监测的生理参数中的变化反映出来(Wang,US 2011/0306851 Al)。
另外,自主神经系统的交感神经和副交感神经常常在人体中发挥相反影响,包含其对血压和心率的控制的影响。尽管消融支配动脉壁的交感神经将缓解高血压,但存在同样机会的是,例如副交感神经的其它组织在“盲目”介入手术中会被消融。从若干动物研究可推断出,盲目地减少或去除神经活性的结果可使高血压恶化(Ueda等人,1967;Beacham和Kunze,1969;Aars和Akre,1970;Ma和Ho,1990;Lu等人,1995)。
当前治疗失败的原因归因于在消融之后神经的再生(Esler等人,2010),且还有可能是无法将所需剂量的能量传递到目标神经和针对有效消融所传递的能量的剂量不足。目前,去肾神经的成功与否仅可通过在介入手术之后至少数天测量去甲肾上腺素溢出量的继发作用来评定(Krum等人,2009),且缺乏即时术后评定的方法。为了改进介入手术的成功率,不仅需要在动脉壁上定位适合的消融点,而且要确保能量在消融手术期间精确和准确地传递到目标神经,且要紧接在消融后确认所传递剂量的能量已有效消融目标神经。
为了解决当前神经消融系统和方法的缺点,本发明通过以下方式实现改进:提供在肾动脉壁上准确和精确定位适合消融点的系统和方法;确保足够的消融能量准确地导向到目标神经中,且立即执行神经消融的手术后评定。本发明还涉及到肾神经标测优化的导管系统。
发明内容
考虑到前述内容中的需要,本发明公开的实施例包括用于在动脉壁上准确和精确定位神经支配区域的导管、系统和方法;确保足够的能量可以准确地导向到目标神经中以引起例如刺激和消融的所需反应;以及执行充分的神经消融即时手术后评定。另外,本发明公开的实施例还包括提供可用于清楚表示支配动脉壁上神经位置和类型的界面。
本发明涉及到用于通过一剂量的能量所在位置识别支配人体中动脉壁的功能性交感神经和副交感神经存在位置的方法。方法包括以下步骤中的一个或多个:在将一剂量的能量传递到动脉壁之前设定好一个或多个生理参数的初始基线值;将一剂量的能量传递到动脉壁;检测由于所传递能量导致的生理变化;基于一组经验预定值对变化进行评估;以及基于评估来确定传递能量的区域是否位于功能交感神经或副交感神经附近。
在一个实施例证中,所述方法用于在神经消融手术之前,定位包含动脉壁中交感神经和副交感神经系统的,与压力反射相关的,适合的神经消融位点的定位。在某些实施例中,神经消融手术用于去肾动脉的神经。在另一实施例中,涉及到用于确保在神经消融手术期间将消融能量准确传递到动脉壁中目标神经的方法。在另一实施例中,涉及到用于手术后即时评定神经消融手术,以确保目标神经通过神经消融手术中所传递的能量所消融的方法
在某些实施例中,涉及到将适合于对神经进行刺激的剂量的能量以传递到动脉壁。在其它实施例中,涉及到将适合于进行神经消融的剂量的能量传递到动脉壁。
在一个实施例中,涉及到的生理参数包括:血压,心率,如肾上腺素、去甲肾上腺素、肾素-血管紧张素II和血管加压素等生化物质的水平,心肌电活性,肌肉活性,骨骼神经活性,细胞动作电位,或由于如光瞳反应、肌电图和血管收缩的这些生理变化的其它可测量反应。在一种实施例中,由于生理学参数变化所致的可测量反应进一步包括下列一项或多项的变化率:血压、心率、生化水平(例如肾上腺素、去甲肾上腺素、肾素-血管紧张素II和加压素)、心电活动、肌肉活动、骨神经活动、细胞活动趋势。在另一项实施例中,正向和反向的生理学参数变化可用作神经的读出指标。在另一项实施例中,利用一项或多项生理学参数建立的数学模型而计算出的某一参数可以用来评估某一神经是否发生了神经传导。
在一些实施例中,动脉壁上的一个区域被交感神经支配,在受到刺激时可导致血压升高和心率增加,而相反,动脉壁上的一个区域被副交感神经支配,在受到刺激时可导致血压降低和心率减小。
在一个实施例中,当生理参数在消融手术期间显著偏离初始基线时,可以认为用于消融的能量被准确地传递到支配动脉壁的目标神经。
在一个实施例中,在传递消融能量到达以所述方法确认的,由神经支配的区域之前,当刺激能量传递到这个点时不再导致如血压和心率的生理参数变化时,神经消融手术被视为是成功的。
本发明还涉及到用于定位和识别支配动脉壁的神经的系统。该系统包括:能够将一剂量的能量传递到动脉壁的一个或多个装置;接收生理参数信号的一个或多个传感器;用于分析来自传感器的信号的一个或多个装置;以及能够显示分析结果的一个或多个指示器或指示面板。
在一个实施例中,可控制通过能量传递装置所传递的这一剂量的能量,来刺激神经或消融神经。在另一实施例中,两个单独装置用于独立地进行神经刺激和神经消融。
在另一实施例中,所传递的能量为电能、机械能、超声能量、辐射能量、光学能量和热能中的一种或多种。
在一些实施例中,所述传感器可以检测生理参数,所述生理参数包括:血压,心率,如肾上腺素、去甲肾上腺素、肾素-血管紧张素II和血管加压素的生化物质的水平,心肌电活性,肌肉活性,骨骼神经活性,细胞动作电位,和由于如光瞳反应、肌电图和血管收缩的上文生理变化的其它可测量反应。在某些实施例中,对应于生理参数的信号可以用本领域已知的商业化技术检测。
在另一实施例中,用于进行生理信号数字分析的装置可以是一种微控制器或计算机。
在一个实施例中,所分析的结果使用不同颜色的指示器显示出。由交感神经支配的区域以绿色指示器表示,而由副交感神经支配的区域以红色指示器表示。在另一实施例中,所分析的数据可在数字面板上显示出。
在一个实施例中,集成的指示器或面板可建构到,例如能量传递装置,系统装置中。在某些实施例中,集成的指示器或面板可以独立的实体存在于系统中。
本发明还涉及到专门设计的导管,其远端(即导管尖端)呈按照肾结构定制的形状,具有一个或多个电极以标测肾神经分布,用来执行肾消融,用来执行消融后的评定,并可以执行血管造影。在某些实施例中,这类导管的电极沿导管尖端的长度方向相继间隔分布,其中电极面与肾动脉内腔的分段部分进行接触。在某些实施例中,导管的尖端为可操纵的且具有发射射频能量的单一电极。在某些实施例中,导管尖端的形状为单螺旋的形态,其中螺旋线圈的形状为圆形或扁平的。在其它实施例中,导管尖端为双螺旋的,其中螺旋线圈的形状为圆形或扁平的。在其它实施例中,导管尖端可包括一种气囊,由螺旋线圈缠绕在所述气囊周围,其中沿螺旋线圈的长度方向间隔分布有电极;或者,导管尖端可包括一种气囊,在所述气囊周围为包封气囊的伞形组件,并且其中沿伞形组件间隔分布有电极。在两个实施例的变化例中,线圈或伞形组件的形状可为圆形或扁平的,因此沿线圈或伞形的长度方向间隔分布电极的形状可为圆形或扁平的,视线圈或伞形的底层形状而定。
在其它实施例中,导管尖端可包括具有封闭端的伞形组件或框架,或具有开口端的伞形组件。
在某些实施例中,上文所述导管尖端可引入到动脉结构中来实现血管(内)支架的功能。
在一个实施例中,这些导管尖端的直径可在0.5mm到10mm范围内变化;导管尖端的长度可在20mm到80mm范围内变化;线圈的直径可在3.0mm到7.5mm范围内变化;每一线圈之间的距离可在4mm到6mm范围内变化;以及线圈的完全未卷绕长度可在31mm到471mm范围内变化。
导管的电极可彼此独立地激活,或可以任何组合形式激活,来发射电刺激或射频能量。各电极具有传递电刺激或射频能量的双重功能。电刺激用于识别和标测肾动脉内腔区段内,位于所述肾动脉内腔区段下方重要的肾神经。所述识别和标测可通过监测对所施加电刺激后的一个或多个生理反应来实现,所述生理反应如血压反应和心率或肌肉交感神经活性(Schiaich等人,NEJM 2009),或肾去甲肾上腺素溢出量(Esler等人,2009,和Schiaich等人,J Htn.,2009)的变化,其中生理反应中的变化指示了底层交感神经分布在该激活电极的附近。在另一实施例中,导管的个别电极可以由医务操作员所设定的组合形式激活,以便评定最大生理反应和底层肾神经的所在位置。导管的电极能够不仅发射足够强度的电流以刺激肾神经,而且能够发射如射频能量等热能,根据肾神经标测结果来消融底层肾神经组织。在其它实施例中,导管的多个单独电极可选择性分别激活,以释放如高射频能量等的消融能量,其中激活电极是根据标测神经的结果来选择的。在其它实施例中,根据肾神经的标测结果,使用,如激光能量、高强度聚焦超声或冷冻消融技术等,其它类型消融能量的消融技术也可在肾动脉壁上使用,以消融交感肾神经。
在某些实施例中,这些导管可与现有的射频产生器互换地使用,所述现有的射频产生器可与现有的心脏导管系统一起使用。
在一个实施例中,前述导管系统可与事先插入到病人身体中的,任何多种可接受导管引导线一起使用,以将导管尖端导引到所需位置。导管系统还可与可用于有助于心脏血管和肾血管系统内类似装置通过的装置和其它器具一起使用,如外管鞘和扩张器。在需要时,前述导管系统还可与一种拉线一起使用,用以放置导管尖端。
本发明还涉及到使用本文中所描述的导管来标测肾神经分布的方法,包括以下步骤:使用电刺激同时监测如血压和心率等的生理反应的变化,标测肾神经分布和识别肾动脉内的消融点,以实现理想地去肾神经术。这些方法包括激活所述导管的独立电极以释放电荷,来刺激底层肾神经,同时监测如血压和心率等的生理反应;生理反应中的变化可以指示底层交感神经在激活电极的附近,并表示消融作用处于优良位置。标测数据的聚集可以反映肾神经分布的,临床上有用的导引形式,以帮助临床医生执行消融。
附图说明
图1为用于定位和识别支配动脉壁功能性神经的示意图。系统包括:用于将能量传递到动脉壁的装置101;用于对装置101供电的电源102;用于检测生理参数信号的传感器103;用于分析来自传感器103的数据的装置104;以及显示来自装置104的结果的指示器105。
图2为确认功能交感神经或副交感神经是否在传递到动脉壁的一剂量能量附近的方法的一种实施例中步骤的示意图。该图表说明了可能记录的生理信号。
图3A是根据本发明一个实施例中的单螺旋消融导管的远侧部分(导管尖端)的正视图,其中电极301沿螺旋长度方向以90°间隔放置,其中螺旋线圈303自身为圆形的,并且其中“L”指远侧部分的长度,“l”指单一线圈的一匝的长度,“d”指导管尖端的直径,且“D”指螺旋线圈的直径。
图3B展示了电极301在图3A中所展示消融导管螺旋形单一完整线圈中的分布。
图3C展示了图3A所示实施例中,从导线的传递方向的,仅显示电极301的第一匝线圈的,单螺旋消融导管的远侧部分的端视图。。
图3D展示了根据本发明中一种实施例中的单螺旋消融导管远侧部分的正视图,其中电极305沿螺旋长度方向以120°间隔放置,并且其中螺旋线圈307自身为圆形的。
图3E展示了电极305在图3D中所示消融导管的呈螺旋形单一完整线圈中的分布。
图3F展示了图3D所示实施例中,从导线的传递方向的,仅显示电极305的第一匝线圈的,单螺旋消融导管的远侧部分的端视图。
图3G展示了根据本发明中一种实施例中的单螺旋消融导管远侧部分的正视图,其中电极309沿螺旋长度方向以90°间隔放置,并且其中螺旋线圈311自身为扁平的。
图3H展示了电极309在图3G中所示消融导管的呈螺旋形单一完整线圈中的分布。
图3I展示了根据本发明中一种实施例中的单螺旋消融导管远侧部分的正视图,其中电极313沿螺旋长度方向以120°间隔放置,并且其中螺旋线圈315自身为扁平的。
图3J展示了电极313在图3I中所示消融导管的呈螺旋形单一完整线圈中的分布。
图4A展示了根据本发明一个实施例中的双螺旋消融导管的远侧部分的正视图,其中电极417沿每一单独螺旋长度方向以90°间隔放置,其中螺旋线圈419为圆形的,并且其中“L”指远侧部分的长度,且“1”指每一螺旋线圈的一匝的长度。
图4B展示了图4A所示实施例中,从导线的传递方向的,仅显示电极417的每一线圈的第一匝的,双螺旋消融导管的远侧部分的端视图。
图4C展示了根据本发明一个实施例中的双螺旋消融导管的远侧部分的正视图,其中电极421沿每一单独螺旋长度方向以120°间隔开,其中螺旋线圈423为圆形的,并且其中“L”指远侧部分的长度,且“1”指每一螺旋线圈的一匝的长度。
图4D展示了图4C所示实施例中,从导线的传递方向的,仅显示电极421的每一线圈的第一匝的,双螺旋消融导管的远侧部分的端视图。
图4E展示了根据本发明中一种实施例中的双螺旋消融导管远侧部分的正视图,其中电极425沿每一单独螺旋的长度方向以90°间隔开,并且其中螺旋线圈427为扁平的。
图4F展示了根据本发明中一种实施例中的双螺旋消融导管远侧部分的正视图,其中电极429沿每一单独螺旋的长度方向以120°间隔开,并且其中螺旋线圈431为扁平的。
图5A展示了根据本发明中一种实施例中的气囊消融导管远侧部分的正视图,可对其中的气囊533充气,并且其中电极535沿形状为圆形且缠绕在气囊周围的螺旋线圈537均匀间隔开。
图5B展示了根据本发明中一种实施例的气囊消融导管的远侧部分的正视图,结合了包封气囊541的类伞形组件539,,可对其中的气囊充气,并且其中电极543沿包封气囊的伞形组件间隔分开。
图6A展示了根据本发明的一种实施例中,结合了闭口伞形框架645的消融导管的远侧部分的正视图,,,其中电极647沿类伞形框架间隔分开。
图6B展示了图6A所示实施例中,从导线的传递方向的消融导管远侧部分的端视图。
图6C展示了本发明的一种实施例中,结合了开口伞形框架649的消融导管的远侧部分的正视图,其中电极651沿伞形框架间隔分开。
图6D展示了从导线的传递方向的消融导管远侧部分的端视图。
图7A展示了本发明的一种实施例中的消融导管远侧部分的正视图,其中单一电极755位于可操纵导管尖端753处。
图7B展示了图7A所示实施例中,从导线的传递方向的,消融导管远侧部分的端视图,并显示了电极755。
图8展示了用于神经标测实验的急性猪实验的设定。
图9A展示了左侧肾动脉刺激对动脉收缩压(ASP)的最大和最小影响。所展示的为在电刺激左侧肾动脉(LRA)之后的动脉收缩压(ASP,以mmHg为单位测量);展示了初始基线的测量值以及刺激之后的最大和最小反应。
图9B展示了左侧肾动脉刺激对动脉舒张压(ADP)的最大和最小影响。所展示的为在电刺激左侧肾动脉(LRA)之后的动脉舒张压(ADP,以mmHg为单位测量);展示了初始基线的测量值以及刺激之后的最大和最小反应。
图9C展示了左侧肾动脉刺激对平均动脉压(MAP)的最大和最小影响。所展示的为在电刺激左侧肾动脉(LRA)之后的平均动脉压(MAP,以mmHg为单位测量);展示了初始基线的测量值以及刺激之后的最大和最小反应。
图9D展示了左侧肾动脉刺激对心率(HR)的最大和最小影响。所展示的为在电刺激左侧肾动脉(LRA)之后的心率中的最大和最小变化;展示了初始基线的测量值以及刺激之后的最大和最小心率。
图10A展示了右侧肾动脉刺激对动脉收缩压(ASP)的最大和最小影响。所展示的为在电刺激右侧肾动脉(RRA)之后的动脉收缩压(ASP,以mmHg为单位测量);展示了初始基线的测量值以及刺激之后的最大和最小反应。
图10B展示了右侧肾动脉刺激对动脉舒张压(ADP)的最大和最小影响。所展示的为在电刺激右侧肾动脉(RRA)之后的动脉舒张压(ADP,以mmHg为单位测量);展示了初始基线的测量值以及刺激之后的最大和最小反应。
图10C展示了在电刺激右侧肾动脉(RRA)之后的平均动脉压(MAP,以mmHg为单位测量);展示了初始基线的测量值以及刺激之后的最大和最小反应。
图10D展示了右侧肾动脉刺激对心率(HR)的最大和最小影响。所展示的为在电刺激右侧肾动脉(RRA)之后的心率中的最大和最小变化;展示了初始基线的测量值以及刺激之后的最大和最小心率。
图11展示了当肾动脉内刺激施加到肾动脉的某些位置时心率减小的情况。
图12A展示了在左侧肾动脉中四次单独肾消融期间动脉收缩压(ASP)的变化。所展示的为在左侧肾动脉(LRA)中四次单独肾消融期间动脉收缩压(ASP,以mmHg为单位测量)的变化。
图12B展示了在左侧肾动脉中四次单独肾消融期间动脉舒张压(ADP)的变化。所展示的为在左侧肾动脉(LRA)中四次单独肾消融期间动脉舒张压(ADP,以mmHg为单位测量)的变化。
图12C展示了在左侧肾动脉中四次单独肾消融期间平均动脉压(MAP)的变化。所展示的为在左侧肾动脉(LRA)中四次单独肾消融期间平均动脉压(MAP,以mmHg为单位测量)的变化。
图12D展示了在左侧肾动脉中四次单独肾消融期间心率(HR)的变化。所展示的为在左侧肾动脉(LRA)中四次单独肾消融期间心率的变化。
图13A展示了在右侧肾动脉中四次单独肾消融期间动脉收缩压(ASP)的变化。所展示的为在右侧肾动脉(RRA)中四次单独肾消融期间动脉收缩压(ASP,以mmHg为单位测量)的变化。
图13B展示了在右侧肾动脉中四次单独肾消融期间动脉舒张压(ADP)的变化。所展示的为在右侧肾动脉(RRA)中四次单独肾消融期间动脉舒张压(ADP,以mmHg为单位测量)的变化。
图13C展示了在右侧肾动脉中四次单独肾消融期间平均动脉压(MAP)的变化。所展示的为在右侧肾动脉(RRA)中四次单独肾消融期间平均动脉压(MAP,以mmHg为单位测量)的变化。
图13D展示了在右侧肾动脉中四次单独肾消融期间心率(HR)的变化。所展示的为在右侧肾动脉(RRA)中四次单独肾消融期间心率的变化。
图14展示了用于慢性肾神经消融实验的实验设定。
图15展示了取自已死亡动物肾动脉区段的组织结构标测方案。
图16展示了在各个位置处电刺激引起的收缩血压变化(RA:肾动脉;AA:腹主动脉)。
图17A展示了本发明实施例中全长消融的消融方案;肾动脉上的每一灰圈表示消融位点。
图17B展示了本发明实施例中近端消融的消融方案;肾动脉上的每一灰圈表示消融位点。
图18A展示了本发明实施例中全长消融导致的血压降低。
图18B展示了本发明实施例中近端消融导致的血压降低。
图19A展示了中国人样本群体中左侧主要肾动脉(mRA)长度的分布。左侧mRA的平均长度为28.46±12.09mm。从1mm到70mm,长度分成以5mm为间隔的14个区段。左侧主要肾动脉长度为25-30mm的人构成这个群体中的最大组(18.6%)。
图19B展示了中国人样本群体中右侧主要肾动脉(mRA)长度的分布。右侧mRA的平均长度为35.94±15.57mm。从1mm到70mm,长度分成以5mm为间隔的14个区段。右侧mRA的长度与左侧mRA相比相对多样化。右侧主要肾动脉长度为40-45mm的人构成这个群体中的最大组(16.4%)。
图20A展示了中国人样本群体中左侧主要肾动脉(mRA)在肾动脉开口处直径的分布情况。
图20B展示了中国人样本群体中左侧主要肾动脉在肾动脉长度1/3处直径的分布情况。
图20C展示了中国人样本群体中左侧主要肾动脉在肾动脉长度2/3处直径的分布情况。
图20D展示了中国人样本群体中左侧主要肾动脉在肾动脉分叉处直径的分布情况。
图20E展示了中国人样本群体中右侧主要肾动脉(mRA)在肾动脉开口处直径的分布情况。
图20F展示了中国人样本群体中右侧主要肾动脉在肾动脉长度1/3处直径的分布情况。
图20G展示了中国人样本群体中右侧主要肾动脉在肾动脉长度2/3处直径的分布情况。
图20H展示了中国人样本群体中右侧主要肾动脉在肾动脉分叉处直径的分布情况。
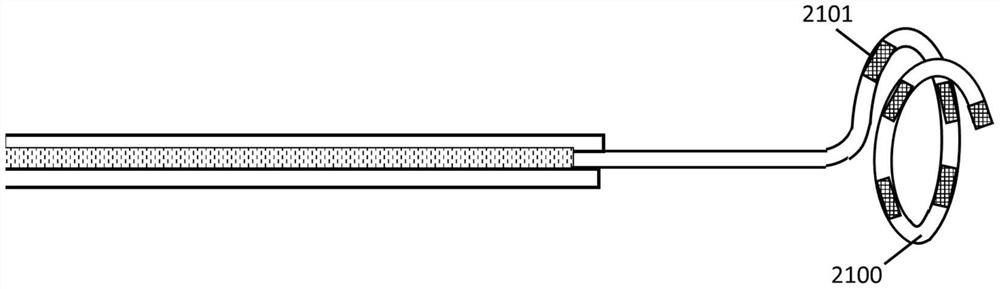
图21A展示了本发明一个实施例中的导管尖端,其包括一种具有多个电极2101的单环匝螺旋形结构2100。
图21B展示了图21A中相同导管尖端从远端观察的图示,该尖端包括一种具有多个电极2101的单环匝螺旋形结构2100的。
图21C展示了本发明一个实施例中的导管尖端,其包括一种具有多个电极2111的双环匝螺旋角锥形结构2110。
图21D展示了图21C中相同导管尖端从远端观察的图示,该尖端包括一种具有多个电极2111的双环匝角锥形结构2110。
图21E示出了采用本发明的一个实施例来进行精确标测和选择性消融肾神经的一个策略。
图21F示出了单环导管头端缩回到鞘管的一个实施例。
图21G示出了图21F的单环导管头端从鞘管中伸出而形成单环结构。
图21H示出了导管头端具有多个环状从鞘管伸出的一个实施例。每个环状的间距为2-10毫米。
图21I示出了导管头端带有导丝的一个实施例。
图21J示出了导管头端带有导丝的的另一个实施例。
图21K示出了一个显示屏的实施例,该显示屏用于指示使用本发明的导管的刺激结果。
图22A展示了本发明一个实施例中包括有多个电极2201的弹性部件2200的导管尖端。该弹性部件2200与其近端处的控制轴管2203相连接。弹性部件2200可回缩到管状结构2204中。
图22B展示了与图22A中相同的导管尖端,其具有弹性部件2200和电极2201,可通过控制轴管2203推出该管状结构2204的。
图22C展示了对图22A中实施例进行修改过的导管尖端。控制环2205包覆了弹性部件2200,且当弹性部件2200和电极2201通过控制轴管2203推出该管状结构2204时,可用于控制弹性部件2200的膨胀量。
图23A展示了本发明一个实施例中的包括有多个电极2301弹性部件2300的导管尖端。该弹性部件2300与其近端处的控制轴管2303相连接,而其末端与控制杆2305相连接。该弹性部件2300可回缩到管状结构2304中。
图23B展示了与图23A中相同的导管尖端,其具有弹性部件2300,可在不推回控制杆2305的情况下通过控制轴管2303推出该管状结构2304的。
图23C展示了与图23A中相同的导管尖端,其具有弹性部件2300,可通过控制轴管2303推出管状结构2304的。该控制杆2305可被推回以使得弹性部件2300凸出。
图24展示了用于近端消融的导管设计的一种实施例,其中有一种单导管具有用于进行电刺激的第一组电极2411和用于消融的第二组电极2421。
图25展示了用于近端消融的导管设计的一种实施例,其中有一个导管2510可用于进行电刺激,而另一导管2520可用于消融。
图26展示了当使用本发明一个实施例中的导管时,生理参数的变化。
图27A至27D表示了该发明中修正波形的不同实施例。
图28A表示该发明中神经标测系统实施例的细节特征,该导管(2800)的端头可以插入外表面分布有神经组织的血管,该端头包括一个远端电极组(2801)和一个近端电极组(2802)。
图28B表示根据图28A中实施例得到的不同段血管的末端视图。
图28C表示该远端电极(2801)位于靠近R1的区域,该近端电极(2802)靠近R2区域。
图28D表示一种实施例中的导管包括一个中间电极组(2803)。
图28E表示该发明一种实施例中的一种导管包括了一组可以覆盖对应血管三分之一长度的电极(2804)。
图29表示了图28E所示1-1’和7-7’位置处,从远端末端来视的电极结构。
图30A表示该发明一种实施例中的一种导管端头,包括至少两部分(3001,3002),其中每一部分可以通过控制实现不同的直径尺寸。
图30B表示与图30A中相同的导管端头,其控制杆(3005)缩进控制鞘管(3007),使其位于远端部分(3001)的弹性部件(3003)被迫处于突出的状态。
图30C表示与图30A中相同的导管端头,其控制杆(3005)与分离杆(3006)都缩进了该控制套管(3007),使其位于远端部分(3001)和近端部分(3002)的弹性元件(3003)都被迫处于突出的状态。
图30D表示该发明另一种实施例中的一种导管端头,其位于远端部分(3001)和近端部分(3002)的弹性部件(3003)布置于不同的分离杆(3006,3008)上,从而这两部分的距离可控。
图30E表示该发明另一种实施例中的一种导管端头,在其远端与近端部分之间包括了另外一种中间部分(3009)。
图31A表示该发明一种实施例中的一种弹性部件(3100),包括一种扁平部件(3101)与弯曲部件(3102)。
图31B表示与图31A中相同的弹性部件,其扁平部件(3101)与两端(箭头所示)挤压状态下的弯曲部件(3102)接连在一起。
图31C表示一种弹性部件(3100)中的弯曲部件薄于扁平部件。
图31D表示该发明一种实施例中的一种导管端头,包括了多个弹性部件(3100),这些弹性部件与连接环(3104)相接,并且该连接环可以与该控制杆嵌套。
图31E表示与图31D中相同的导管端头,在该控制杆收缩而导致该弹性部件凸起的状态。
图31F表示该发明另一种实施例中的一种导管端头,包括具有波浪预成形状的弹性部件(3105)。
图31G表示与图31F中相同的导管端头,在控制杆收缩状态下保持波浪预成形状的状态。
具体实施方式
请注意,本说明书通篇所提及的术语“导管”涉及到导管设备的整个长度,从适用于引入到所需目标解剖结构中用于消融或其它动作的远侧部分,延伸贯穿到连接导管和RF产生器的导管和电缆的接合点处。如本说明书所提及的术语“导管尖端”涉及到用于运载电极,和在身体内在目标作用点处执行刺激、消融和标测功能的导管的远侧部分。术语“导管尖端”可与涉及到所述导管的“远侧部分”的术语互换使用。
在可进行成功消融之前首要考虑肾神经结构;因此,在成功实现去神经导管插入术之前,必须仔细地考虑或标测单独的肾神经结构。个体中异常或反常的肾结构,以及肾神经结构中普通多样形式的存在需要在消融之前标测出来。换句话说,在导管去神经之前需要标测肾神经,因为消融的最佳位置点是“随机的”,意思是消融的最佳位置点会因人而异,且会因动脉不同而不同。由此,为了达到最优消融,需要在导管消融进行之前识别或标测肾神经。
本发明提供了用于定位支配动脉(尤其肾动脉)壁中的功能性神经位点的系统和方法,但相关领域的技术人员也可以通过本发明中的方法定位支配人体中其它动脉或血管的神经。系统包括:能够将一剂量的能量传递到动脉壁的一个或多个装置;接收生理参数输入信号的一个或多个传感器;用于分析来自传感器信号的一个或多个装置;以及能够显示分析结果的一个或多个指示器或指示面板。
图1描绘了与本发明某一方面相关的示范系统,即使用血压和心率作为识别神经反应生理参数的去肾神经系统。系统包括用于将能量传递到动脉壁的一个或多个装置101,并与电源102电连通。系统进一步包括用于检测生理信号的传感器103,与分析生理信号的装置104电连通。与装置104电连通的指示器105可显示来自装置104的分析的结果。在这个实施例展示了,呈双功能导管形式的装置101,经由极小创伤性介入手术插入到肾动脉中。装置101中至少一个电极可在所限定位置与肾动脉壁接触,且能够传递来自电源102的一剂量的能量,以用于刺激或消融支配该电极接触的动脉壁区域的神经。随着对于神经刺激或消融足够的能量从装置101上的电极传递到电极与动脉壁的接触点,传感器103可检测血压和/或心率的变化。将来自传感器103的信号将被输入到装置104中,装置104将以数字方式确定所引起的信号是否是源于交感神经或副交感神经,或两者皆不。指示器105可随后显示来自装置104的分析的结果。
在本发明的一个实施例中,装置101为一种介入性装置,可插入到能够将能量传递到支配动脉神经的动脉中,来产生神经刺激或消融的作用。在另一实施例中,装置101由两个单独实体组成,一个可传递用于神经刺激的能量,而另一个传递用于神经消融的能量。在一个不同实施例中,装置101为一种单电极导管或多电极导管。
在一个实施例中,电源102经由装置101将能量传递到动脉壁。在另一实施例中,能量在无装置101的情况下,由电源102通过人体远程传递到动脉壁中。在另一实施例中,电源102为一种多信道电源,能够将单独剂量的能量分别传递到动脉壁上的不同位置。在其它实施例中,电源102为一种单一信道电源,每次仅能够传递1个剂量的能量。在另一实施例中,通过电源102传递能量的剂量使可调节的,用以在目标神经上产生如刺激或消融的不同作用。在其它实施例中,通过电源102传递的能量为电能、机械能、超声能量、辐射能量、光学能量和热能中的一种或多种。
在一个实施例中,传感器103可检测来自生理参数的信号,所述生理参数包括:血压,心率,如肾上腺素、去甲肾上腺素、肾素-血管紧张素II和血管加压素的生化物质的水平,心肌电活性,肌肉活性,骨骼神经活性,细胞动作电位,或由于如光瞳反应、肌电图和血管收缩的上文生理变化的其它可测量反应。在另一实施例中,传感器103可在外部与人体的任何部分接触或不接触的情况下检测所述信号。在另一实施例中,传感器103可在人体内部,通过放置成与肾动脉、股动脉或任何其它相关动脉接触的内腔或内腔附近,来检测所述信号。在另一实施例中,传感器103可以是另一设备上的传感器,结合使用于介入手术中。
在一个实施例中,装置104可以是一个或多个微控制器或计算机,能够直接或间接地对传感器103产生的信号进行数字分析。
在一个实施例中,指示器105可以是一个或多个数字观察面板,能够显示来自装置104的分析结果。在另一实施例中,来自动脉壁上的多个位置的,所述分析的一个或多个结果,可以同时显示在指示器105上。在另一实施例中,指示器105还可以显示来自传感器103的一个或多个生理信号;来自电源102的能量相关信息,如电流、频率、电压;组织电极界面相关信息,如阻抗;以及与装置101相关的信息,如温度。在某些实施例中,指示器105包括一组不同颜色的光,每一种光分别表示交感神经、副交感神经或无神经。在其它实施例中,指示器105以文字、符号、颜色、声音或以上的组合来表示来自装置104的分析的结果。
在某些实施例中,装置104和指示器105可以整合为单一装置,并且,在其它实施例中,装置104和指示器105皆可集成到电源102中。
在另一实施例中,传感器103、装置104和指示器105与装置101和电源102独立存在,以使得传感器103、装置104和指示器105可与用于将能量传递到血管壁中的,如高强度聚焦超声的,其它外部或介入性方法一起使用。
本发明另外提供了一种方法,根据通过一剂量能量诱导的生理参数的变化,来识别支配动脉壁上所选区域功能性交感神经或副交感神经的存在。该方法包括以下一个或多个步骤:在将一剂量的能量传递到动脉壁之前,准备好待测量生理参数的初始基线;将一剂量的能量传递到动脉壁;检测由于所传递能量产生的生理变化;基于一组经验上的预定值对该生理变化进行评估;以及根据该评估,确定能量传递的位点附近是否存在功能性交感神经或副交感神经。
图2为判断支配动脉壁所选区域的任何功能性交感神经或副交感神经是否存在的方法步骤流程图。
在步骤1中,通过装置104可连续地记录来自传感器103的生理信号,以产生反映信号中任何瞬时变化的可靠参考初始基线。
随后通过装置101中电极中的一个,将能量传递到这个电极接触的动脉壁上的区域(步骤2)。传感器103可以检测由传递能量造成的任何生理变化,且可将变化以信号方式记录下来并传送到装置104中(步骤3)。
在步骤4中,装置104可以确定生理信号与步骤1中初始基线的偏差,并且,在步骤5中,根据与初始基线信息的偏差可以确定支配动脉壁上区域神经的类型。
在一个实施例中,通过传感器103检测到的生理信号包括以下中的一个或多个:血压,心率,如肾上腺素、去甲肾上腺素、肾素-血管紧张素II和血管加压素的生化物质的水平,心肌电活性,肌肉活性,骨骼神经活性,细胞动作电位,或由于如光瞳反应、肌电图和血管收缩的上文生理变化的其它可观测的身体反应。
在一个实施例中,在步骤2中传递的能量剂量是可调节的,以诱导目标神经产生不同的作用效果,如神经刺激或神经消融。
在某些实施例中,可以通过使用其它外部装置测量生理信号的数值,且可以在能量传递之前输入到装置104中以置换由装置104形成的初始基线。
在一个实施例中,生理参数的变化可以在步骤2中能量传递过程期间或之后检测到。在另一实施例中,生理参数的变化呈数值或波形形式。在其它实施例中,与步骤1中初始基线的偏差可以通过从信号中减去步骤1的初始基线值来评估。
在一个实施例中,经验预定组的数值可从几组临床数据种获得,或可从临床医生的经验中推论出。在一些实施例中,动脉壁上有一种区域,当传递到所述区域的能量造成心率每分钟至少增加10次和/或血压至少增加5mmHg时,该区域可以被视为是用交感神经来支配的。在其它实施例中,动脉壁上有一种区域,当传递到所述区域的能量造成心率每分钟至少降低5次和/或血压至少降低2mmHg时,该区域可以被视为是用副交感神经来支配的。
在另一实施例中,步骤5的结果将显示在指示器105上。
在一个实施例中,这种方法可以识别动脉壁中适合神经消融的位点,从而通过交感神经和副交感神经系统中断压力反射。在另一实施例中,这种方法可以提供消融能量是否准确传递到动脉壁中目标神经的指示。在另一实施例中,这种方法可以用于神经消融手术后的即时评估。
在一个实施例,可以通过在整个血管内壁重复应用本发明的方法来获得血管具有不同神经组分部位的测绘图。在另一个实施例,所述用于传递刺激能量的方法使用了一个在特定位置具有多个电极的导管,如图1所示,其中,所述具有多个电极的导管(101)插入肾动脉并与肾动脉内壁的特定位置接触。在一个实施例中,导管可以是本发明中描述的那些导管中的任何一个,例如图3、4、5、6、7、21、22。在一个实施例中,导管头端是一个具有多个电极的网状结构。在另一个实施例中,导管上电极的间隔是0.5至5mm,例如0.5、1、2、3、4或5mm。
在一实施例中,对血管中神经支配区域的标测,可以通过在血管全部内壁重复应用所述方法来实现。在另一实施例中,产生的所述标测结果可通过,例如使用磁共振成像、计算机断层扫描或超声波断层摄影成像技术预先获得的数据,与血管的3维(3D)结构相关连,以便在介入手术期间将支配区域的3D图像显示给医生。导管在血管中的瞬时位置,可以在介入手术期间,通过借助于如X射线或超声波实时成像技术来成像。在又一实施例中,高级图像处理技术可以使血管的3D结构与标测导管的瞬时位置相关连,并从而可以确定电刺激位置、神经分布、消融位置与血管的3D结构之间的关系。
本发明还涉及到一种专门设计的导管,其包含一种可操纵远端(即导管尖端),该远端的形状可以根据肾结构而定制,并具有一个或多个电极以标测肾神经分布,来执行肾消融,并可以执行血管造影。在某些实施例中,这类导管上的电极沿导管尖端的长度方向相继间隔开分布,其中的电极面与肾动脉内腔的分段部分进行接触。在某些实施例中,导管尖端的形状为单螺旋的,其中螺旋线圈的形状为圆形或扁平的(图3A-J)。在其它实施例中,导管尖端为双螺旋的,其中螺旋线圈的形状为圆形或扁平的(图4A-F)。在其它实施例中,导管尖端可包括一种气囊,并有螺旋线圈缠绕在所述气囊周围,其中沿螺旋线圈的长度方向间隔开分布有电极(图5A);或者,导管尖端可包括一种气囊,在所述气囊周围有一种包封气囊的伞形组件,并且沿伞形组件间隔开分布有电极(图5B)。在类似图5A和5B中所展示的两个实施例的多种种类中,线圈或伞形组件的形状可为圆形或扁平的,因此沿线圈或伞形的长度方向间隔开的电极的形状可为圆形或扁平的,视线圈或伞形的底层形状而定。
在其它实施例中,该导管尖端可包括具有封闭端的(图6A-B)或具有开口端的(图6C-D)伞形组件或框架,。
在另一实施例中,该导管具有可操纵的导管尖端,所述导管尖端在其尖端具有一种单电极(图7A-B)。
在某些实施例中,上文所述的导管尖端可引入到动脉结构中,来实现血管(内)支架的功能。
在一个实施例中,这些导管尖端的直径d可在0.5mm到10mm范围内变化;导管尖端的长度L可在20mm到80mm范围内变化;线圈直径D可在3.0mm到7.5mm范围内变化;每一匝线圈之间的距离l可在4mm到6mm范围内变化;线圈的数量可在3.3到20范围内变化;线圈上未卷绕的完全长度可在31mm到471mm范围内变化。
导管上的各个电极可彼此独立地被激活,或可以任何组合形式被激活,来释放电刺激或射频能量。电极各自具有传递电刺激或射频能量的双重功能。电刺激用于识别和标测肾动脉内腔区段中,位于所述肾动脉内腔区段下方的重要的肾神经。所述的识别和标测可以通过监测施加电刺激产生的一个或多个生理反应来实现,所述生理反应如血压反应和心率或肌肉交感神经活性(Schiaich等人,NEJM 2009)或肾去甲肾上腺素溢出量(Esler等人,2009,和Schiaich等人,J Htn.,2009)的变化,其中生理反应的变化可以指示底层交感神经就分布在激活的电极附近。在另一实施例中,导管的独立电极根据医务操作员所选的组合形式来激活,以便评估最大生理反应和由此判断出的底层肾神经的位置。导管的电极不仅能够释放足够强度的电流以刺激肾神经,而且能够释放如射频能量的热能,以根据肾神经标测结果对底层肾神经组织进行消融。在其它实施例中,导管的独立电极可选择性被激活,根据标测神经的结果,来释放如高射频能量的消融能量。在其它实施例中,根据标测肾神经的结果,可以通过运用使用其它消融能量的消融技术,如激光能量、高强度聚焦超声或冷冻消融技术,,在肾动脉壁上消融交感肾神经。
在某些实施例中,这些导管可与现有的射频发生器互换地使用,所述当前现有的射频发生器,可与现有的心脏导管系统一起使用。
在一个实施例中,前述的导管系统可与事先插入到病人身体中的任何多种导管引导线一起使用,以将导管尖端导引到所需位置。这种导管系统还可与其它有助于通过心脏血管和肾血管系统内的类似装置一起使用,如外鞘和扩张器。在需要时,前述的导管系统还可与拉线一起使用,来放置导管尖端。
本发明还涉及到使用本文中所描述的导管,来标测肾神经分布的方法,包括以下步骤:监测如血压和心率的生理反应变化的同时进行电刺激,来标测肾神经分布和识别肾动脉内的消融点,从而可以实现有效的去肾神经结果。这些方法包括激活所述导管的独立电极,通过释放电荷来刺激底层肾神经,同时监测如血压和心率的生理反应;生理反应的变化可以指示一条底层交感神经就在激活电极的附近,并且该位置是合适的消融位置。标测数据的累积,可采取临床上有用的关于肾神经分布导引的形式,以帮助临床医生执行消融。
在一个实施例中,所述导管的尖端,根据指定方法有选择性地在血管中移动,以便与肾动脉内腔的理想部分进行接触。在一个实施例中,上文中用于移动导管尖端的有选择性的方法包括将刺激或导管尖端的消融区段,从更接近肾内部肾动脉的一半位置,移动到更接近主动脉的肾动脉的另一半位置,且将一个或多个电刺激施加到两个半部中的每一个上。
在另一实施例中,这种用于移动导管尖端的有选择性的方法,包括通过以下顺序转动肾动脉内导管尖端的刺激或消融区段:(a)从动脉的前壁转动到后壁;(b)从动脉的后壁转动到上壁;以及(c)从动脉的上壁转动到下壁,其中每一转动的幅度为90°或更小。在一个实施例中,可在肾动脉内导管尖端的每一转动之后施加一个或多个电刺激。
在一个实施例中,所施加的电刺激被控制在在以下参数范围内:(a)电压在2到30伏之间;(b)电阻在100到1000欧姆之间;(c)电流在5到40毫安之间;(d)施加时间在0.1到20毫秒之间;(e)总施加时间在1到5分钟之间。
本发明还涉及到一种消融肾神经以治疗由系统性肾神经过度兴奋造成的疾病的方法,包括以下步骤:(a)应用本文中所描述的标测方法来标测肾神经;(b)通过导管将射频能量施加到肾动脉内腔的定点部分,以消融所标测的肾神经;以及(c)再次施加刺激以评估消融的有效性。在其它实施例中,根据标测的肾神经,本领域中一般已知的其它消融技术可应用于肾动脉壁上,来消融交感肾神经,例如使用其它消融能量的消融技术,如激光能量、高强度聚焦超声或冷冻消融技术。
本发明还涉及到一种用于定位或识别支配受试者血管壁功能性神经的方法,包括以下步骤:a)将能量传递到所述血管壁上的一个或多个位置,所述能量通过交感神经或副交感神经传递后,足以改变与所述血管神经分布相关的一个或多个生理参数;以及b)在每一次传递能量之后测量所述的一个或多个生理参数,并与无能量传递到所述血管的情况下所获得的参数进行对比,来确定对应参数的变化;其中若没有步骤b中所述生理参数的变化,则表示能量传递位置处不存在这种功能性神经,而如果步骤b中的所述生理参数有显著变化,则表示能量传递位置处存在这种功能性神经,且步骤b中所述生理参数的变化方向可确定能量传递位置处的神经为交感神经或副交感神经。在一个实施例中,这种动脉血管包含肾动脉。在一个实施例中,这种功能性神经与压力反射相关。在另一实施例中,方法的受试者为人类或非人类的动物。这应理解为,缺乏变化表示所属领域的技术人员认为这种变化是可忽略的或统计学上不显著的,而显著的变化表示属领域的技术人员认为这种变化是有意义的或统计学上显著的。
在一个实施例中,用于定位或识别支配受试者血管壁功能性神经的方法包括,将能量传递到已消融神经位置的一个步骤,其中所述生理参数如果缺乏变化,则可以确认神经已被消融。在一个实施例中,所传递的能量为可调节的,且由电能、机械能、超声能量、辐射能量、光学能量和热能构成。在另一实施例中,所传递的能量可引起神经刺激或进行神经消融。
在一个实施例中,用于定位或识别受试者中支配血管壁功能性神经的方法,其中所描述的生理参数选自:血压,心率,心肌电活性,肌肉活性,骨骼神经活性,细胞动作电位,光瞳反应,肌电图,血管收缩和选自肾上腺素、去甲肾上腺素、肾素-血管紧张素II和血管加压素的生化物质水平。在另一实施例中,功能性神经为交感神经或副交感神经。
在一个实施例中,用于定位或识别受试者中支配血管壁功能性神经的系统包括:a)能量传递装置,该装置可以将足以刺激支配所述血管神经的能量,传递到所述壁上的一个或多个位置;b)一个或多个测量装置,在能量通过所述能量传递装置传递到所述神经之前或之后,通过交感神经或副交感神经测量与所述血管神经分布相关的一个或多个生理参数;以及c)一种装置,该装置可以耦合到用于显示支配所述血管壁神经定位和识别结果的一个或多个测量装置。在一个实施例中,该测量装置可放置在血管内部或身体外部。在另一实施例中,测量装置包括一个或多个微控制器或计算机。
在一个实施例中,所述系统可以数字、文字、符号、颜色、声音、波形或其任一组合形式,来显示神经的定位和识别结果。
在一个实施例中,所述系统用于定位或识别受试者在支配血管壁功能性神经的一种方法,包括以下步骤:a)将能量传递到所述血管壁上的一个或多个位置,所述能量通过交感神经或副交感神经传递后,足以改变与所述血管神经分布相关的一个或多个生理参数;以及b)在每一次传递能量之后,测量所述的一个或多个生理参数,并与无能量传递到所述血管的情况下所获得的参数进行对比,来确定对应参数的变化;其中如果没有步骤b中所述生理参数的变化,则表示能量传递位置处没有功能性神经,如果有步骤b中所述生理参数的显著变化,则表示能量传递位置处存在功能性神经,且可以通过步骤b中所述生理参数的变化方向确定能量传递位置处的神经为交感神经或副交感神经。
本发明涉及到用于定位或识别受试者中支配血管壁功能性神经方法的一种导管,包括一种轴管,其中所述轴管的近端可以连接到能量来源,且所述轴管的远端(导管尖端)具有一个或多个呈单螺旋、双螺旋或多叉尖形式的电极。
在一个实施例中,所述导管包括一个或多个电极,所述电极可以释放足以刺激或消融所述血管上神经的能量。在另一实施例中,所述电极各自独立地被激活。
在一个实施例中,所述导管的长度在1与2m之间,其中导管尖端的长度在2与8cm之间,且直径在0.5mm与10mm之间。
在一个实施例中,所述导管包含形状为圆形或扁平的螺旋线圈或叉尖,且电极沿所述线圈或叉尖的长度方向间隔分布开,其中所述电极可嵌入于所述线圈或叉尖中,或位于所述线圈或叉尖的表面。在一个实施例中,该叉尖在远端处重新连接。在另一实施例中,该电极沿所述线圈的长度方向彼此以90°或120°均匀间隔分布开。
在一个实施例中,所述导管包含一种导管尖端,该导管尖端可以保持一种可充气气囊,来填充所述螺旋或叉尖线圈内的间隙。
本发明还涉及到一种使用导管来定位或识别受试者中支配血管壁功能性神经的方法,包括以下步骤:a)将所述导管插入到所述血管中,并激活导管上的电极,将能量传递到所述血管壁上的一个或多个位置,所述能量通过交感神经或副交感神经的传递,足以改变与所述血管神经分布相关的一个或多个生理参数;以及b)在每一次传递能量之后测量所述一个或多个生理参数,并与无能量传递到所述血管的情况下所获得的参数进行对比,来确定对应参数的变化;其中如果步骤b中所述生理参数没有变化,则表示能量传递位置处没有这种功能性神经,如果步骤b中所述生理参数有显著变化,则表示能量传递位置处存在这种功能性神经,且通过步骤b中所述生理参数的变化方向可以确定能量传递位置处的神经为交感神经或副交感神经。在一个实施例中,所述动脉血管包含肾动脉。在一个实施例中,功能性神经与压力反射相关。在一个实施例中,该传递能量的位置为已消融的神经区域,其中如果步骤b中所述生理参数没有变化,则可以确认神经已被消融。在另一实施例中,受试者为人类或非人类的动物。在另一实施例中,所描述的生理参数选自:血压,心率,心肌电活性,肌肉活性,骨骼神经活性,细胞动作电位,光瞳反应,肌电图,血管收缩和选自以下的生化物质水平:肾上腺素、去甲肾上腺素、肾素-血管紧张素II和血管加压素。在另一实施例中,所述能量为可调节的,且由电能、机械能、超声能量、辐射能量、光学能量和热能中的一种或多种构成。在一个实施例中,所述能量可以引起神经刺激或进行神经消融。在另一实施例中,功能性神经为交感神经或副交感神经。在另一实施例中,所传递的能量被控制在以下参数范围内:a)电压在2与30伏之间;b)阻力在100与1000欧姆之间;c)电流在5与40毫安之间;d)施加时间在0.1与20毫秒之间;e)总施加时间为1到5分钟。
在一个实施例中,所述导管在血管中可以按照以下顺序移动:a)从动脉的前壁向后壁转动90°或更小一个角度;b)从动脉的后壁向上壁转动90°或更小一个角度;以及c)从动脉的上壁向下壁转动90°或更小一个角度。
在一个实施例中,本发明涉及到一种用于消融邻近于受试者肾动脉的肾神经的方法,包括以下步骤:a)通过以下方法确定肾神经存在的情况:i)用一个或多个第一电极接触肾动脉内壁上的第一个位点;ii)通过所述第一电极施加到所述第一个位点电流的形式,释放第一个电刺激,其中将所述电流应该被控制为,足以通过在所述第一个位点处存在的底层神时引起一个或多个生理参数的变化,所述的一个或多个生理参数可以由以下参数组成:收缩血压、舒张血压、平均动脉压和心率;以及在所述第一个电刺激释放之后,测量所述一个或多个生理参数,其中如果所述生理参数与在该电刺激释放之前所获得的测量相比有所增加,则表示存在有这种肾神经;b)用一个或多个第二电极接触肾动脉内壁上的第二个位点,所述第二个位点与所述第一个位点相比,更接近所述肾动脉的肾动脉开口;c)经由所述第二电极将消融能量传递到所述的第二个位点;以及d)经由所述第一电极将第二个电刺激施加到所述第一个位点,并在所述第二个电刺激释放之后测量所述生理参数,在所述第二个电刺激释放之后,如果所述生理参数未增加,则表示该受试者的肾神经已被消融。
在一个实施例中,该方法进一步包括,如果初始第二个位点处的消融并未消融所述受试者的肾神经,那么可在新的第二个位点处重复步骤(b)到(d)。
在一个实施例中,在步骤(c)传递消融能量之前,通过所述一个或多个第二电极将电刺激施加到所述第二个位点,其中与施加所述电刺激之前所获得的测量相比,仅当所述电刺激引起的所述生理参数有所增加时,进行消融能量传递。
在一个实施例中,该第二个位点为所述肾动脉邻近肾动脉开口的三分之一长度内的位点。
在一个实施例中,该第一电极和第二电极可以定位于一种单一导管上。
在一个实施例中,该第一电极和第二电极可以定位于不同导管上。
在一个实施例中,该电流具有以下参数中的一个或多个:a)电压在2与30伏之间;b)电阻在100与1000欧姆之间;c)电流在5与40毫安之间;d)施加时间在0.1与20毫秒之间;以及e)总施加时间为1到5分钟。
在一个实施例中,该第一电极或第二电极可定位于导管上,所述导管的远端处包括一种可膨胀尖端。在另一实施例中,当从远端观察时,这种可膨胀尖端的直径在3.5mm到20mm范围内。在另一实施例中,这种可膨胀尖端包括一种管状结构,可以容纳具有预成型曲度的一个或多个弹性部件,其中所述的第一或第二电极可以安置在所述一个或多个弹性部件上,所述的一个或多个弹性部件可以在其近端处与控制轴相连接,其中所述控制轴的移动可以导致所述一个或多个弹性部件被推出所述的管状结构,以恢复预成型曲度或回缩到所述管状结构中。
在一个实施例中,该第一或第二电极可以安置在导管的区段上,所述导管包括一种螺旋结构,所述螺旋结构具有一个或多个环匝线圈。在另一实施例中,这种结构包括一种螺旋角锥,其含有一种从近端到远端逐渐地变小的环匝线圈结构。
在一个实施例中,本发明涉及到一种用于标测和消融分布在肾动脉上肾神经的导管,包括:a)第一组电极,包括一个或多个电极,用来传递电刺激和消融能量中的一个或两个;b)第二组电极,包括一个或多个电极,用来传递电刺激和消融能量中的一个或两个;其中所述的第一和第二组电极可以定位于所述导管的远端处,所述的第一组电极与所述第二组电极相比,更接近于所述导管的远端。
在一个实施例中,所述第一组电极与所述第二组电极之间的相对距离是可调节的。
在一个实施例中,所述导管的远端部分可以使所述第一组电极或所述第二组电极能在多个位点处接触肾动脉壁,当从远端观察时,其中所述导管远端的直径在3.5mm到20mm范围内。
在一个实施例中,该第一或第二组电极被安置在具有螺旋结构的远端上,所述螺旋结构具有一个或多个环匝线圈。在另一实施例中,该配置结构包括一种螺旋角锥,其具有从近端到远端逐渐地变小的环匝线圈结构。
在一个实施例中,所述导管的远端包括一种管状结构,可容纳具有预成型曲度的一个或多个弹性部件,其中所述的第一组或所述第二组电极可以安置在所述一个或多个弹性部件上,所述的一个或多个弹性部件可以在其近端处与控制轴相连接,其中所述的控制轴的移动可以导致所述一个或多个弹性部件被推出所述的管状结构,以恢复预成型曲度或回缩到所述的管状结构中。在另一实施例中,导管进一步包括一种控制线圈,来包覆所述一个或多个弹性部件,其中所述控制线圈可以沿所述弹性部件移动,来控制延伸情况,所述一个或多个弹性部件可以恢复其预成型的曲度。在另一实施例中,该导管进一步包括所述控制轴内的一种控制杆,其中所述控制杆的远端与所述一个或多个弹性部件的末端相连接,其中在将所述一个或多个弹性部件推出所述管状结构之后,可以回缩所述控制杆,使所述一个或多个弹性部件在其中间凸出。
在一个实施例,本发明提供一种具有肾神经标测功能的导管,其特征在于:所述导管包括一个具有多个双极电极的导管头端;其特征在于:所述多个双极电极排列成至少一个环状结构并且所述多个双极电极中的每一个双极电极包括一个阳极和一个阴极;其中电刺激能于所述多个双极电极中任何的阳极或阴极间传递。
在一个实施例,所述导管进一步包括导管头端能缩回到的鞘管。
在一个实施例,所述多个电极排列成两个或以上环状结构,每个环状结构之间相距2-10mm。
在一个实施例,所述至少一个环状结构的直径是2mm至15mm。
在一个实施例,所述多个双极性电极进一步传递消融能量。
在一个实施例,所述导管头端进一步包括用于传递消融能量的电极。在另一个实施例,所述消融能量选自射频能量、机械能、超声能量、辐射能量、光学能量或热能中的一种或多种。
在一个实施例,本发明提供一个基于导管上电极的位置来标测肾动脉上神经分布区域的系统,包括:(i)本发明的导管;(ii)一个或多个测量装置,用于测量与所述肾动脉上神经分布有关的一个或多个生理参数,所述生理参数选自收缩压、舒张压、平均动脉压或心率;(iii)与上述一个或多个测量装置耦合的计算装置,其设置用于计算相对于基线的任何生理参数的增加或减少;及(iv)用于显示所述肾动脉上副交感神经或交感神经位置的显示装置,所述位置基于所述导管上电极的位置。
在一个实施例,所述导管上的多个双极电极进一步传递消融能量。
在一个实施例,所述导管进一步包括用于传递消融能量的电极。在另一个实施例,所述消融能量选自射频能量、机械能、超声能量、辐射能量、光学能量或热能中的一种或多种。
在一个实施例,所述计算装置进一步设置用于接收及计算所述肾动脉三维结构数据。
在一个实施例,所述显示装置包括一个显示屏幕,显示施加于所述多个电极之间的任何一对电极之间的电刺激结果。
在一个实施例,本发明提供一种在标测肾动脉神经的方法,包括以下步骤:a)将本发明的导管置入所述肾动脉,使所述多个双极性电极接触所述肾动脉的一个内壁;b)在第一双极电极的阳极和第二双极电极的阴极之间传递电刺激前,测量一个或多个生理参数以获得基线测量值,所述生理参数选自收缩压、舒张压、平均动脉压或心率;c)在所述阳极与所述阴极之间施加电流导致电刺激,所述阳极与所述阴极之间的距离是第一刺激路径,所述电流被控制为当所述第一刺激途径中有潜在神经时将足以引起所述生理参数的变化;d)在电刺激的特定时间间隔后测量所述生理参数,其中,在所述电刺激后,所述生理参数相对于基线测量值的增加代表所述第一双极电极和所述第二双极电极之间标测有交感肾神经;在所述电刺激后,所述生理参数相对于基线测量值的降低代表所述第一双极电极和所述第二双极电极之间标测有副交感肾神经。
在一个实施例,本发明的方法进一步包括重复步骤(b)至(d),从另外一对双极电极施加所述电刺激,所述另外一对双极电极之间的距离较所述第一刺激路径短,当电刺激是从同一个双极电极的阳极和阴极施加时,将成功标测一个交感神经或副交感神经。
在一个实施例,传递的所述电流是在以下范围内:2至30伏之间的电压;电阻介于100到1000欧姆之间;电流在5到40毫安之间;应用时间介于0.1到20毫秒之间。
在一个实施方案中,所述收缩压增加的范围是4至29mmHg。
在一个实施方案中,所述舒张压增加的范围是1.5至20mmHg。
在一个实施例中,所述平均动脉压增加的范围是3至17mmHg。
在一个实施例中,所述心率增加的范围是4至12次/分钟。
在一个实施例,本发明提供一种用于标测分布在肾动脉上的肾神经的导管,所述导管包括一个具有多个电极的导管头端,所述导管头端可置于肾动脉管腔内;其特征在于:所述多个电极排列成至少一个环状结构并且所述多个电极中的任何一双电极能构成双极性电极令用于刺激肾神经的能量限定在所述一双电极之间。
在一个实施例,所述多个电极覆盖所述肾动脉长度的三分之一。
在一个实施例,所述导管头端包括具有所述多个电极的一个弹性部件组(3003),所述弹性部件组(3003)的每个弹性部件具有一个远端和一个近端;所述远端连接到一个控制杆(3005),所述近端连接到一个分离杆(3006);所述分离杆(3006)和所述控制杆(3005)两者相对自由移动;或所述远端连接到一个分离杆(3006),所述近端连接到一个控制鞘管(3007);所述控制鞘管内有所述控制杆(3005)和所述分离杆(3006)。
在一个实施例,所述弹性结构组(3003)的每个弹性部件包括一个扁平部件(3101)和一个弯曲部件(3102)。
在一个实施例,所述弹性结构包括用于将弯曲集中在弯曲部分的机制,所述机制包括:在扁平部件(3101)和弯曲部件(3102)的连接处有一处有凹陷位;所述扁平部件比所述弯曲部件分更硬;或所述弯曲部件比所述扁平部件更薄。
在一个实施例,所述导管头端包括一个远端节段和一个近段节段,所述多个电极被分成位于所述远端节段上的一个远端电极组和位于所述近端节段上的一个近端电极组。
在一个实施例,所述远端电极组位于一个远端弹性部件组上以及所述近端电极组位于一个近端弹性部件组上,所述远端弹性部件组的每个远端弹性部件具有一个连接到一个控制杆的远端及一个连接到一个连接环的近端,所述连接环环套所述控制杆;所述近端弹性部件组的每个近端弹性部件具有一个连接所述连接环的远端和一个连接一个控制管鞘的近端;所述连接环依所述远端弹性部件组和近端弹性部件组之间的力平衡而沿控制杆被动移动。
在一个实施例,所述导管头端包括一个控制杆、一个控制鞘管和一个或多个具有波浪预成形状的弹性部件(3105),所述一个或多个弹性部件包括一个远端和一个近端,所述远端连接到所述控制杆,所述近端连接到所述控制鞘管。
在一个实施例,所述一个或多个具有波浪预成形状的弹性结构(3105)包括接触所述控制杆的一个或多个点,所述一个或多个点中至少一个包括接触一个连接环。
在一个实施例,所述的多个电极适用于输送消融能量。
在一个实施例,所述至少一个环状结构的直径为2-15毫米。
在一个实施例,本发明提供一种基于导管上电极的位置来标测肾动脉上神经分布区域的系统,包括:(i)本发明的导管;(ii)一个或多个测量装置,用于测量与所述肾动脉神经分布有关的一个或多个生理参数;(iii)与上述一个或多个测量装置耦合的计算装置,其设置用于计算相对于基线的任何生理参数的增加或减少;及(iv)用于显示所述肾动脉上副交感神经或交感神经位置的显示装置,所述位置基于所述导管上电极的位置。
在一个实施例,所述显示装置包括一个显示屏幕,显示施加于所述多个电极之间的任何一对电极之间的电刺激结果。
本领域普通技术人员应当知道本文公开的导管、系统和方法可以用于肾动脉的神经消融以破坏通过交感神经系统和副交感神经系统的压力感受性反射,可是其应用可以扩展至人体内任何有神经支配的管道。
参考以下实验详情可以更好地理解本发明,但相关领域的技术人员将容易了解,本发明公开的特定实例仅出于说明性目,且不应限制其后由权利要求所定义的本发明的范围。
应注意,过渡术语“包括”,等同于“包含”、“含有”或“其特征在于”,是包含性的或为开放式的,且并不排除额外其它未列举的元件或方法步骤。
实例1
在急性猪实验中,设计和执行了通过传递适合剂量的能量之后,检查生理参数的变化,来定位支配动脉壁的神经的方法。这个实验的目标为:
1.出于肾神经标测和消融的目的,测试当前存在的心脏消融导管(7F,B型,间距2-5-2mm,
2.通过在左、右肾动脉内腔内的不同位点处发射电刺激,检查血压和心率的变化,来测试肾神经标测。
3.通过检查肾动脉壁和组织结构的可视变化,来确定待发射到肾动脉用于肾神经消融高射频能量的安全范围。
4.在肾消融期间,血压和心率的变化可作为肾神经高效消融的参考指数。
三只猪(体重为50-52kg)以15mg/kg静脉内注入戊巴比妥钠实施麻醉。监测的生理参数为:收缩血压、舒张血压、平均动脉压和心率。实验的设计和方法在图8中示出。
用于这组实验的消融导管为7F,B型,间距2-5-2mm,
在将电能传递到肾动脉壁的不同区域之前,测量收缩血压、舒张血压和平均动脉血压和心率的初始基线。随后,在传递能量之后5秒到2分钟内,测量平均动脉血压和心率,以记录任何的影响结果。通过识别与神经刺激相关的血压和心率的显著变化,发现了,尽管支配动脉壁的区段因每一动物而异,但本文中所描述的方法可以恰当地定位每一动物中的这些区域,并给出肾动脉中支配区域的标测结果。
实例2
为了证明传递到动脉壁上不同位置的能量可导致,对如血压和心率的生理参数的不同影响,且可利用这类特征来识别支配动脉壁神经的类型,根据数种策略,将电能传递到实验猪肾动脉壁上的神经支配区域。关于传递到1号猪、2号猪、3号猪的电能的详细参数,分别展示于表1、2及3中。
在1号猪中,在左侧肾动脉中进行四次单独刺激,且在右侧肾动脉中执行两次单独刺激。作为初步试探,在左侧肾动脉的腹侧上,传递两个单独剂量的电能:一个传递到动脉的前壁,另一个传递到动脉的后壁。在左侧肾动脉的肾侧上,传递两个单独剂量的电能:一个传递到动脉的前壁,另一个传递到动脉的后壁。观测这些能量对血压和心率造成的不同影响。在右侧肾动脉中,将一个剂量的电能分别传递到肾动脉的腹侧和肾侧。对于2号猪和3号猪使用相同刺激策略。
传递到肾动脉中不同位置的电能对所有测试猪的收缩血压、舒张血压、平均血压和心率造成了不同的影响。举例来说,对于传递到左肾电能的响应是,收缩血压中的最大变化分别为1号猪的19.5mmHg和3号猪的2.9mmHg;收缩血压中的最小变化分别为1号猪的2mmHg和3号猪的1mmHg。然而,在2号猪中,当电能传递到腹主动脉侧或肾侧时,收缩血压的变化是一致的。此外,造成最大影响或最小影响的刺激位置因动物而异,这表示肾自主神经的分布在动物之间并不一致。在将电能传递到左侧肾动脉壁期间,对收缩血压、舒张血压、平均动脉血压和心率这些现象进行观测,并且表4A、4B、4C和4D进一步分别概述了这些情况。在电刺激右侧肾动脉期间,对收缩血压、舒张血压、平均动脉血压和心率类似现象进行观测,并且表5A、5B、5C和5D进一步分别概述于了这些情况。
这些数据提供了定位和识别支配动脉壁神经的理论验证——确切地说,在这种情况下,所测量血压中的最大增加或降低的实质生理反应,可以通过放置在富有肾神经分支限定位置的导管传递的电能来诱导。从表4A-D和表5A-D计算出的平均数据(平均值±SD)以图形方式表示于图9和图10中,包括所有的子图。
1号猪:
2号猪:
3号猪:
在根据先前所描述的方法,在猪模型中执行的所有刺激实验中,肾动脉壁中某些位置的刺激可以导致心率显著降低,并且不会造成血压变化,或血压变化与心率降低相比影响极小(图11)。经常有记录显示血压(尤其舒张血压)有轻微降低。在包含实验中所评估的所有4个生理参数的56个数据点中,每一生理参数中至少有1个数据点,可以响应于所述剂量的能量,其数值会有所下降或无/不存在显著的变化;这种现象在这个实验中体现在23%以上的数据点中。这些响应于刺激的独特生理变化,可以指示支配这些位置的神经是副交感神经性质,且与支配通过刺激导致血压升高和心率增加位置处的那些交感神经不同。表6概述了,在涉及犬、猫和兔动物模型的不同研究中,将适合剂量的能量传递到传入肾神经的影响。结合本发明,表6中的研究已证明,当将适合剂量的能量传递到支配肾的神经时,诱导出等效于副交感神经活动的影响并非罕见。换句话说,存在以下说明:在肾动脉的神经电路中,存在可诱导副交感神经活动,而非交感神经活动的神经,并且因此当治疗血压相关疾病时,所述神经不应被消融。
实例3
在定位和识别动脉壁中神经的研究之后,适于消融剂量的能量再次传递到相同猪模型肾动脉壁中的神经支配点处。四次消融分别传递到左侧肾动脉和右侧肾动脉,从肾侧开始,按从前壁到后壁,到上壁,随后到下壁的移动次序,移动到腹主动脉侧;每次消融与先前消融的位置隔开≤5毫米,且消融导管的电极头(导管尖端)在每次消融之后转动90度。根据文献(Krum 2009,2010)中的内容,低水平的能量(5-8瓦)可以应用于肾消融,因此,5瓦和8瓦的能量将用于肾消融。对于左侧肾动脉消融,所施加的能量水平为5瓦,且消融的时长为120秒;对于右侧肾动脉,所施加的消融能量水平为8瓦,且时长为120秒。消融位点处温度的测量值为40℃到50℃。在消融期间检测的生理参数为:收缩血压、舒张血压、平均动脉压和心率。这些数据清楚地展示,肾动脉内不同位置处的消融,可以导致血压和心率的不同变化,进一步证明了,生理参数,如血压和心率等生理参数的变化,可用作消融能量已准确传递到目标神经时的指示标记,且可以提供动脉壁中神经的分布会因情况而异的其它证据。
在左肾肾动脉中的四次单独肾消融期间,收缩血压、舒张血压、平均动脉压和心率的变化分别概述于图12A、12B、12C和12D中。在右肾肾动脉中的四次单独肾消融期间,动脉收缩和舒张压力、平均动脉压和心率的变化分别概述于图13A、13B、13C和13D中。
实例4
这组实验涉及,确定用于肾神经去神经过程中,心肌消融导管能量水平安全性方法的概况。图14描述这个实验的细节。
用于这组实验的消融导管为7F,B型,间距2-5-2mm,
所应用的消融能量水平如下:右侧肾动脉消融,8W,120s;左侧肾动脉消融,16W,120s(n=3)。右侧肾动脉消融,16W,120s;左侧肾动脉消融,8W,120s(n=3)。
将实验猪麻醉,并对每一肾动脉(右侧和左侧)单独地执行4-5次肾消融。在消融之前和之后执行肾血管造影,以检查肾动脉的通畅。可以使实验猪从手术中恢复过来。为了确定消融能量的安全水平,牺牲一只实验猪(右侧肾动脉,16W,120s;左侧肾动脉消融,8W,120s)来评估由于两种不同能量水平消融而导致的急性病变。消融手术结束十二周之后,对动物两侧肾动脉执行血管造影。其后,处死这些实验动物,并对肾动脉和肾的任何可见异常进行检测;在对两肾纵向切开的情况下,对完整的和切开的肾动脉进行拍照。根据图15中所展示的组织结构标测情况,收集来自两侧肾动脉的样本,以用于其它的组织结构研究。
实例5
在此公开了与具有刺激、标测、消融和血管造影功能的新导管的相关设计。
该导管设备包括一种可伸长导管,所述可伸长导管在远端具有一种导管尖端,所述导管尖端一旦插入,将可以保持在肾血管结构内固定的位置;还包含一种近端;以及多个消融电极。在一个实施例中,消融电极沿这种可伸长导管尖端的长度方向均匀间隔分布开。多个这些消融电极通过导管不导电区段,从可伸长导管尖端的近端和远端间隔分布开。在一个实施例中,导管尖端一侧上,或导管末端侧上的第一电极,可当作刺激参考,用于对比任何其他电极传递的电刺激;或者,这些电极中的任一个,也可作为其它电极的参考。
在一个实施例中,可伸长导管的尖端具有螺旋形状的结构。
在另一实施例中,一个或多个导电电线可以与多个电极耦合,且可以经由一个或多个导电电线将直流电或交流电供应到多个电极。一种控制器可以独立方式或同步方式,将电流控制到多个电极中,同时导管尖端可以在肾动脉中保持固定的位置。
在另一实施例中,一个或多个导电电线可与多个电极耦合,且可将射频(RF)能量供应到多个电极中,RF能量可以是单极RF能量或双极RF能量。一种射频产生器可以通过一个或多个导电电线,将能量供应到多个电极中。控制器可以独立方式、依序方式或同步方式,控制能量来源,将能量供应到多个电极中,同时导管尖端可以在肾动脉中保持固定的位置。
传送到电极中的RF能量是可控的,以使得只有低水平能量电能脉冲可以由电极产生,以便仅刺激底层神经组织,且具体来说是肾神经组织。或者,传送到电极中的RF能量是可控的,以电极产生产生更大能量的电能脉冲,以便消融底层神经组织,且具体来说是肾神经组织。导管尖端,具体来说是这种电极,被设计成,在刺激和消融过程中,可以与肾动脉内腔在相同位置中保持接触。
在另一实施例中,该导管能够与当前应用于心脏组织消融的射频产生器一起使用。这些射频产生器可包含但不必限于当前由Medtronic、Cordis/Johnson&Johnson、St.Jude Medical和Biotronic所生产的那些射频发生器。
在下文更详细地描述中,包含本发明示范性实施例中涉及到的肾神经去神经设备。
图3到7为这些消融导管和电极的实例和示例。所展示的是本发明各种实施例涉及到的消融导管尖端远侧部分的前视图、横截面图和端视图。
在一个实施例中,该导管具有一种螺旋形状的可伸长尖端。多个电极通过不导电区段,,从导管尖端的近端开始通过导管尖端的远端均匀间隔发布开。
在某些实施例中,这种消融导管的导管尖端包括一种单螺旋结构;在其它实施例中,所述导管尖端可以是双螺旋的结构。该导管尖端的一个或多个螺旋结构中的一个或多个线圈可为圆形或扁平的。电极可沿线圈的长度方向均匀地放置;例如,其可以60°、90°或120°间隔分布开,但也可以其它构形放置,或以不同角度分隔分布开。
在一个实施例中,如果螺旋的线圈自身为扁平的,那么电极的形状可为扁平和矩形或正方形。或者,如果线圈自身为圆形的,那么电极可为圆形且/或可以建构到螺旋结构中。在另一实施例中,导管尖端的长度为2.0cm到8.0cm,且直径为0.5mm到10.0mm;线圈的直径可在3.0mm到7.5mm范围内变化;每一匝线圈的距离可在4mm到6mm范围内变化;以及线圈的未卷绕的完全长度可在31mm到471mm范围内变化;导管的总长度为1m到2m。
在另一实施例中,该消融导管的导管尖端包括一种气囊导管系统。在一个实施例中,电极沿形状为圆形或扁平,且缠绕在气囊周围的螺旋线圈上均匀间隔分布开;在其它实施例中,电极沿形状为圆形或扁平,且沿气囊长度方向向下缠绕的伞形框架结构上间隔分布开。在某些实施例中,该伞形框架结构具有一种开口端,且在其它实施例中,具有一种封闭端。在对气囊设备充气时,电极可与肾结构进行接触。在一个实施例中,当气囊未充气时,导管尖端的长度为2.0cm到8.0cm,且直径为0.5mm到10.0mm;线圈的直径可在3.0mm到8mm范围内变化;每一匝线圈的距离可在4mm到6mm范围内变化;线圈的数量可在3.3到20范围内变化;以及线圈的未卷绕的完全长度可在31mm到471mm范围内变化;导管的总长度为1m到2.0m。
在一个实施例中,在气囊充气时,导管尖端的直径可介于0.5mm到10mm范围内。气囊周围线圈的直径可介于3mm到10mm范围内,且完全充气的气囊直径为3mm到10mm。
本发明还可包括管状、圆柱形和具有可调节尺寸的自膨胀的导管尖端。在某些实施例中,用于制造这些导管尖端的材料可包括镍钛(nickel-titanium/nitinol)合金。
在本发明的一个实施例中,涉及到肾神经调节和消融方法(在左侧肾、右侧肾或两个上),包括将上文所描述的导管中的一种插入到左侧肾动脉(LRA)或右侧肾动脉(RRA)中,随后进行如上文描述的肾神经标测,随后通过独立电极进行靶标消融。
在一个实施例中,神经刺激可以通过利用以下参数执行:0.1ms-20ms,2V-30V,5mA-40mA,和100欧姆-1000欧姆。在一个实施例中,神经消融可以通过利用以下参数执行:低于12瓦和30秒-180秒。
实例6
使用上文中涉及肾动脉刺激和血压和/或心率变化的肾标测方法,发现刺激实验猪肾动脉的近侧部分可以造成血压的更显著升高,如图16中所展示。肾动脉完全消融(n=21)(图17A)相对于肾动脉近端消融(n=19)(图17B)对动脉收缩压和舒张压的影响,在两组患者中进一步进行了比较。如表7中所展示,结果显示,通过肾交感神经标测方法和使用肾动脉全长完全消融的方法时,左侧肾动脉和右侧肾动脉各自仅需要6或7个消融位点。当应用近端肾交感神经标测方法时,肾动脉各侧的消融位点就可进一步减少到约3个;同时,总消融时间、手术时间和阻抗,与全长消融方法相比,也显著减少。已经对这些患者进行了6个月时的间跟踪,以监测其血压。通过对肾动脉近侧较少部分周围进行肾神经消融,已经可以实现血压的显著降低(表8和图18A和18B)。P值是针对于重复测量ANOVA的结果。用Fisher最小显著性差异测法,在独立的每个群组内做比较。通过不成对t测试,来比较不同组之间每一时间点的血压(BP)值。近来,Sakakura等人研究表明了交感神经周动脉肾神经在男人群体中的分布,并表示周动脉肾交感神经纤维的密度,在远端和背侧位置较低,但在近端位置较高(J Am Coll Cardiol 2014;64:635-643)。这些结果可以为该近端消融方法提供在临床实践中的解剖基础。
表7.全长与近端消融参数
表8.收缩和舒张BP的初始基线和在后续6个月期间的数值
在一个实施例中,本发明涉及到用于通过仅在肾动脉近侧部分标测和消融,来治疗由系统性肾神经过度兴奋造成的疾病的一种方法。在一个实施例中,对肾动脉近侧部分中相同的位点进行标测和消融。在另一实施例中,在肾动脉近侧部分处的一个或多个位点实施消融,同时标测肾动脉中的其它的一个或多个位点,且在消融之前和之后释放电刺激以验证消融是否成功。
在一个实施例中,本发明涉及到以下方法:在肾动脉远侧部分处进行标测,以在消融之前和之后,向肾动脉近侧部分处释放电刺激,来验证消融是否成功。在一个实施例中,肾动脉远侧部分处所标测位点处的电刺激,如果不引起生理反应,那么在近侧部分处的消融为成功的。
在一个实施例中,本发明涉及到一种方法,可以通过肾动脉近侧部分处的电刺激,来识别对肾消融的反应,并观测所引起的任何生理变化。
本发明还涉及到一种用于进行有效肾消融的方法。在一个实施例中,标测和消融手术从肾动脉的近侧部分上开始,并朝向远侧部分进行,直到当传递电刺激时未观测到任何反应为止。在一个实施例中,对远侧部分处的一个或多个位点进行标测,且消融手术将从肾动脉的近侧部分上开始,并朝向远侧部分进行,直到当在肾动脉远侧部分处的一个或多个映射位点处传递电刺激时未观测到任何反应为止。
在一个实施例中,第一组的一个或多个电极可用于标测由肾神经支配的肾动脉远侧部分处的一个或多个位点,向所述一个或多个标测位置处传递的电刺激将引起生理参数的变化。第二组电极随后将在肾动脉的近侧部分处执行消融。在一个实施例中,来自第二组电极的消融能量被释放到肾动脉近侧部分处的随机位置。在另一实施例中,第二组的电极还将释放电刺激,在消融能量释放到标测位置之前,标测肾神经。在另一实施例中,在第二组电极释放消融能量之后,第一组的电极将电刺激释放到肾动脉远侧部分处的标测位置处,以检查是否会引起生理参数的任何变化,以便确认来自第二组电极的消融能量是否成功阻断肾神经。
实例7
根据本申请案中的研究结果,专门设计了具有电刺激和消融功能的导管,可以对肾动脉近侧部分进行消融。
在一个实施例中,该导管的远端可被设计为任何形状,从而可与肾动脉的近侧部分肾动脉的内壁,在一个或多个位置处进行接触。在一个实施例中,一种具有二、三、四、五、六、七或八个电极的导管,可被设计成螺旋形状,但仅可覆盖肾动脉的近侧部分。在另一实施例中,实例5中涉及到的任何导管,可被修改和调适,来仅接触肾动脉的近侧部分。在一个实施例中,导管的尖端被调整后,适用于具有亚洲人群中典型直径的肾动脉。在一个实施例中,该亚洲人群包括中国人群。图19A展示了中国人群样本中左侧主要肾动脉长度的分布情况,而图19B展示相同样本中右侧主要肾动脉长度的分布情况。图式20A到D分别展示了中国人群样本中,在肾动脉开口处、1/3长度处、2/3长度处和分支处所测量的左侧肾动脉直径的分布情况。图20E到H分别展示在相同样本中,在肾动脉开口处、1/3长度处、2/3长度处和在分支处所测量的右侧肾动脉直径的分布情况。
在一个实施例中,本发明中导管尖端处的螺旋、螺旋结构或其它结构的直径在3.5mm到20mm之间。在另一实施例中,该导管尖端的长度在2mm-1.5cm之间。
在一个实施例中,该导管尖端包括一种螺旋形结构。在另一实施例中,该导管尖端在激活时可呈现螺旋形状。在一个实施例中,该导管尖端包括在加热或冷却到特定转变温度时可以呈现螺旋形状的形状记忆合金或聚合物。在另一实施例中,该导管尖端的不同部分由具有不同转变温度的形状记忆合金或聚合物制成,以使得导管尖端在被激活后可以呈现超过一种的构形。在一个实施例中,该螺旋结构在被激活后可以根据肾动脉的尺寸呈现出不同直径。举例来说,该螺旋结构的直径可在介于3.5mm到20mm的范围内。在一个实施例中,该螺旋形结构包括一种可呈现螺旋角锥形状的弹性部件。在另一实施例中,该螺旋形结构包括一种单环匝的螺旋结构。图21A展示了本发明一个实施例中一种具有单环螺旋形结构2100的导管尖端,其包括多个电极2101。图21B展示了相同导管尖端从远端观察的图像。在一个实施例中,当从远端观察该螺旋结构时,它是完整圆圈的形状。在另一实施例中,该螺旋的直径在3.5mm到20mm范围内。在另一实施例中,该螺旋结构中可以存在多匝环结构。举例来说,螺旋结构中可存在一匝、1.5匝或两匝的环结构。在一个实施例中,沿该螺旋结构可以存在多个电极。举例来说,该螺旋结构上可存在4、5、6或8个电极。
在一个实施例中,该螺旋形状结构为如图21C和D中所展示的螺旋角锥形状,其中远端环匝的直径小于更近环匝的直径。当导管尖端插入到肾动脉中时,如果第一环匝太小而不能接触动脉壁,那么第二个稍大一些的环匝将能够接触动脉壁。在一个实施例中,该螺旋结构包括多个环匝,其中每一环匝的直径从远端到近端逐渐减小。在另一实施例中,每一更小环匝可以配合到更大环匝的内径中,以涵盖所述范围中的所有直径值。
在一个实施例,所述电极组(2121)的一个或多个电极是包括两个紧密间隔导电零件的双极电极。电刺激所采取的路径将是从一个导电零件到另一个零件。在另一实施例,当在导管头端上有两个或多个双极电极(2121)时,例如,在图21G的单环结构中,电刺激所采取的路径可以跨越两个以上的双极电极。在一个使用本发明的导管标测肾血管神经的实施例,通过在导管头端相对侧上的两个接触肾血管整个或部分周长的电极传递一个第一电刺激,可以快速确定该切面任何受神经支配的部分。由于每次电刺激都会筛查肾血管的一大横切面,因此与单点刺激相比,彻底筛查肾血管所需的时间将大大减少。例如,如图21E所示,如果该切面中有任何部分受神经支配,则跨越肾血管周长一半的电刺激将引起生理参数反应(请参见图顶部,电刺激跨越五个电极)。如果观察到生理参数反应,则可以使用较短的路径来精确定位神经,从而可以准确地传递消融能量。例如,可以依次缩短电刺激所采取的路径。图21E的第二和第三图示出了跨越分别四个和三个电极的电刺激路径。这些被缩短的电刺激路径会因为路径上仍有神经支配而引起生理参数反应。进一步缩短电刺激的路径直至其不再覆盖神经支配,就不会引起生理参数反应(参见图21E中的第四图)。最终,通过在单个双极电极中传递电刺激将精确定位神经支配的位置(请参见图21E中的最后一个图)。因此,神经分布和支配的位置可以被精确地标测和定位,并且消融能量可以精确地传递到该位点以消融神经。在一实施例,消融能量是从所述双极电极传递以消融所标测的神经。在另一实施例中,一个设置在双极电极旁边的单独电极被是专用于传递消融能量以消融所标测的神经。
在一个实施例,一个具有上述电极的螺旋导管,但是所述的电极之间相隔3-6毫米的距离。在一个实施例,所述导管头端可以缩回到一个管状结构之中,例如:一个鞘管,以及在有需要时可以伸出并形成环状,如图21F和21G所示。环状结构(2120)被鞘管所限制,一旦伸出展现双极电极(2121),将恢复环状结构。在另一个实施例,如图21H所示,环状结构存在多个环状。在一个实施例,环状的直径是可以调节。在一个实施例,每个环状之间的距离是2-10毫米。在进一步的实施例,双极电极可以应用于本申请的任何一个导管设计。在一个实施例,由双极电极所形成的环状的直径是可被调节。例如,如图21G和21H所示的导管头端的环状直径是可以通过控制线来调节,所述控制线连接头端较预制环状更远的部分并在预制环状后的近端部分进入一个内腔;环状的直径将取决于所述控制线的推动或拉动,并是由导管头端外交近端的部分所控制,例如,在手柄上。
在一个实施例,本发明的导管需要利用导丝(2130)部署。首先,将导丝(2130)插入有需要的目标区域,例如在图21I和21J中的(1),然后导管沿着该导丝被引导至相同的目标区域。在一个实施例,例如图21I,在引导导管(2131)中有一个用于插入导线(2130)的管腔,所述导管会沿着导线被引导到达目标区域,如图21I中(2)和(3)所示。如(4)所示,导管头端从鞘管内伸出可以形成环状结构(2120)。在另一个实施例,导管头端内有一个用于插入导丝的管腔,如图21J所示。如图21J中的(2)所示,导管会沿导丝行进,但是,由于导丝位于导管头端的内部,即使其从(4)所示的鞘管伸出,也不会形成环状结构。只有当导丝被拉出,才会形成环状结构(见图21J)。在进一步的实施例,当在导管内部如图21J存有管腔时,导管头端可以在引导导管(2131)一定距离之外,甚至在没有引导导管的情况下展开。
在一个实施例,导管的顶点直径包含如上述的电极,所述的导管顶点直径可在2-15毫米之间调节。在一个实施例中,导管兼容6-8F的引导导管、兼容0.014"的导丝,而且可以是同轴整体交换型导管。在一个实施例,该导管是丝上导管。在另一个实施例中,该导管是快速交换型导管。
在一个实施例,可以用一个具有如图21K所示的用户图形界面的显示屏显示电刺激、肾神经标测和肾神经消融的结果。在一个实施例,所述显示屏上的一个指示器会显示肾血管壁上热点、反作用点或冷点的位置(请参阅下面的进一步说明),所述位置对应导管上双极电极在的位置。在一个实施例,热点、反作用点或冷点可以分别由红、黄和绿灯表示。在一个实施例中,热点、反作用点和冷点的标示可以被再次确认或在成功消融更改标示。
在一个实施例中,该导管尖端包括膨胀结构。在一个实施例中,该膨胀结构可膨胀为直径在3.5mm到20mm之间的形态。在一个实施例中,该膨胀结构包括预成型有曲度的一个或多个弹性部件,所述部件与位于其近端处的控制轴管相连接,且可以在管状结构内部或外部被操控进行移动。本发明不同实施例中膨胀结构的实例于图22A到C中展示出。图22A展示了限制在管状结构2204内部的弹性部件2200。图22B展示了该弹性部件2200,当通过控制轴管2203推动时,可恢复其预成型曲度,从而可以移出管状结构2204。图22C展示了本发明的另一实施例,其中在弹性部件2200的近端处有一种控制线圈2205,且可以包裹所有弹性部件2200的。控制线圈2205可沿弹性部件2200的长度方向向上或向下独立推动,以控制弹性部件2200的膨胀量。
在一个实施例中,这种一个或多个弹性部件的末端可与可独立于控制轴管移动的控制杆相连接。图23A到C展示了具有这个特征的发明实施例。如图23B中所展示,当推出小管结构时,该弹性部件2300不能恢复其预成型曲度,因为在其末端与控制杆2305相连接。当拉回控制杆2305时,延伸出控制轴管的控制杆2305的长度短于弹性部件2300的长度,且这将造成该弹性部件将会以图23C中所展示的情况凸出。越拉回控制杆2305,弹性部件2300越凸出。换句话说,这将使这个导管尖端可以适应不同尺寸的肾动脉。
在一个实施例中,本发明中的弹性部件包括超级弹性材料制成的部件。在一个实施例中,这种超级弹性材料包括形状记忆合金。在一个实施例中,这种形状记忆合金包括镍钛或铜锌铝。在另一实施例中,这种超级弹性材料包括超级弹性聚合物。
在一个实施例中,如图24中所展示,标测和消融肾动脉可以通过相同导管上的不同部分实施。在一个实施例中,本发明中的导管具有两组或多组电极,至少包括可以执行标测肾动脉远端部分处肾神经的第一组电极2411,和可以执行消融肾动脉近侧部分肾神经的第二组电极2421。在一个实施例中,该第一组电极2411位于可膨胀的导管尖端上,使其可接触肾动脉远侧部分上的多个位点,且电刺激可单独或一起被传递到这些位点中的每一个。在另一实施例中,该第一组电极2411可以仅包括用于将电刺激传递到肾动脉中单一位点的一个电极。在一个实施例中,该第一组电极2411位于可操纵导管尖端上,这种导管尖端的曲度可调节。在一个实施例中,该第一组电极与该第二组电极之间的距离可调节。在一个实施例中,该第一组电极可以位于图3-7、21-23中所展示的任一个导管尖端上。
在一个实施例中,该第二组电极2421位于可膨胀导管尖端上,可以接触肾动脉近侧部分上的多个位点,且消融能量可单独或一起被传递到这些位点中的每一个。在另一实施例中,该第二组电极2421可以仅包括用于将消融能量传递到肾动脉中单一位点的一个电极。在一个实施例中,该第二组电极2421位于图3-7、21-23中所展示的任一个导管尖端中。
在一个实施例中,来自肾动脉内肾神经的电刺激和消融作用,可以通过如图25中所展示的两个独立导管实施。在一个实施例中,一种第一导管2510可以插入到肾动脉的远侧部分,以传递电刺激。举例来说,该第一导管2510的尖端可为图3-7、21-23中所展示的尖端中的任何一个。在一个实施例中,一种第二导管2520可以插入到肾动脉的近侧部分,以传递消融能量。举例来说,该第二导管2520的尖端可为图3-7、21-23中所展示的尖端中的任何一个。
图26展示了本发明消融肾动脉相关的一个方面中,使用图24中的导管,而导致的生理变化。首先将该导管插入到肾动脉中,以使得该第一组电极与肾动脉远侧部分内壁在多个位点处接触,且该第二组电极与肾动脉近侧部分的内壁接触,如图24中所展示。电刺激可从这些电极中的每一个传递到其接触的位点。如果观测到由于刺激而产生的生理参数变化(时间点A),那么该第二组电极可将消融能量传递到肾动脉的近侧部分(时间点B)。如果未观测到由于刺激而产生的生理参数变化(时间点O),那么将操控第一组电极,以使得每一电极接触到新的位点,且将电刺激再次传递到这些新位点,且重复这个过程,直到可以观测到响应于电刺激生理参数的变化为止(时间点A)。该第一组电极与该第二组电极之间的距离可调节,以使得这两组电极可放置在肾动脉中能发挥最优功能的位置。在第二组电极释放消融能量(时间点B)之后,保持第一组电极与肾动脉壁上多个位点相接触,并该第一组电极将再次释放电刺激,用以检查肾神经是否已消融。如果响应于电刺激的生理变化仍存在(时间点C),将在相同位点处释放消融能量,以完全消融肾神经(时间点D)。神经的完全消融,可通用第一组电极进一步释放电刺激,但是没有检测到相应生理变化来证实(时间点E)。或者,即使通过第一组电极确认了肾神经已消融,也可操控这些电极去接触肾动脉中新的位置,并释放电刺激,以确保通过第二组电极未消融的肾神经中不存在替代通路(时间点F)。
在一个实施例中,可任意地插入到肾动脉远侧部分的这种第一组电极上存在多个电极。因为存在多个电极,所以使一个或多个电极与肾神经支配位点接触的机会较高,且可传递电刺激能量而不必识别哪个或哪些电极可以引发生理变化。在另一实施例中,可任意地插入到肾动脉近侧部分的这种第二组电极上存在多个电极。因为第二组电极中存在多个电极,所以使这些电极中的一个或多个与肾神经支配位点接触的机会较高,且可传递消融能量而不必确认这些电极是否已与肾神经支配的位点接触。在一个实施例中,该第二组电极以螺旋方式布置,以便实现一种常规螺旋图案的消融。在另一实施例中,该电极位于一种可膨胀的导管尖端,如图5和6中所示,这样可以调整电极来接触不同尺寸的肾动脉的内壁。在另一实施例中,该第二组电极仅在可操纵导管尖端上包含一个电极,如图7和图24中所展示;可以常规方式在这个设置的情况下完成一种螺旋形消融。在另一实施例中,仅包括一个电极的第二组电极也可以释放电刺激,且消融能量仅会被释放到特定位点上,通过来自相同电极的电刺激引起生理变化。在消融之前和之后,来自第一组电极的电刺激将用于确认肾动脉近侧部分处的消融是否充分,并达到所需影响作用。
在一个实施例中,具有多个电极的第二组电极被程序控制,来从肾动脉近侧部分处的电极开始传递消融能量,并朝向肾动脉远侧部分处的那些电极进行,而且在每次传递消融能量之前或之后,或之前和之后,通过第一组电极在肾动脉远侧部分处的一个或多个标测位点释放电刺激。在另一实施例中,当来自第一组电极的电刺激能量不再引起相关生理参数的变化时,该消融能量的释放就将自动停止。在又一实施例中,仅在第二组所有电极释放消融能量之前和之后,释放来自第一组电极的电刺激。如果仍观测到相关生理变化,那么将操控第二组电极,以使得其中每一电极接触肾动脉近侧部分上新的位点以继续消融,并且持续这个过程,直到来自第一组电极的电刺激能量不再引起相关生理参数变化为止。
在一个实施例中,该导管可用于图1中所展示的系统中,该导管具有用于肾动脉远侧部分的第一组电极和用于肾动脉近侧部分的第二组电极。
实例8
肾交感神经去神经疗法的恰当候选患者,可通过检测某些血液神经激素水平的情况来选择。然而,包含肾上腺素、去甲肾上腺素和多巴胺的儿茶酚胺并非可以特定与交感神经系统的神经紧张度配合,因为儿茶酚胺的水平还受许多其它因素影响。举例来说,已经证明了血浆去甲变肾上腺素会随着以下参数的增加而增加:年龄(Ziegler MG等人:Plasmanoradrenaline increases with age.Nature 1976,261:333),抽烟(Cryer PE等人:Norepinephrine and epinephrine release and adrenergic mediation of smokingassociated hemodynamic and metabolic events.N Engl J Med 1976,295:573),咖啡碱(Robertson D等人:Effects of caffeine on plasma renin activity,catecholaminesand blood pressure.N Engl J Med 1978,298:181),身体活动(Planz G等人:Correlation between increased dopamine-β-hydroxylase activity andcatecholamine concentration in plasma:Determination of acute changes insympathetic activity in man.Eur J Clin Pharmacol 1975,8:181)和钠限制水平(Robertson D等人:Salt restriction increases serum catecholamines andurinarynormetanephrine excretion.Fed Proe 1977,36:956)。血浆和尿液中的甲变肾上腺素和去甲变肾上腺素的水平可以反映交感神经系统的活性,因此,可以进一步反映交感神经紧张度的水平(Robertson D等人,Hypertension 1979,1:118-124),因为甲变肾上腺素和去变甲肾上腺素受其它因素影响较小。然而,对尿液中甲变肾上腺素和去甲变肾上腺素的准确评定无法通过常规实验室方法完成。为了在交感神经活动期间测量尿液中的甲变肾上腺素和去甲变肾上腺素,Robertson等人使用无钠饮食和锻炼的方法,来激活交感神经系统,随后采用气相色谱质谱测定法,通过使用同位素比方法,来测量尿液中甲变肾上腺素和去甲变肾上腺素的水平,并使用辐射酶学方法来测量血浆中肾上腺素和去甲肾上腺素的水平。这些研究人员在24小时的时段内,从正常受试者和具有在高血压水平与正常血压的“边界”之间的高血压受试者中收集尿液和血液样本。从中发现,在正常和边界高血压受试者中,钠分离和切除都可以引起血浆去甲肾上腺素和尿液去甲变肾上腺素水平的增加,但在边界高血压组中,这些反应与正常受试者相比,有显著更高的血浆去甲肾上腺素和尿液去甲变肾上腺素的水平。近来,出于诊断嗜铬细胞瘤和副神经节瘤的目的,已经研发出更灵敏和特定的方法,来测量血浆和尿液中的儿茶酚胺的游离邻甲基化代谢物,甲变肾上腺素和去甲变肾上腺素,例如液相色谱与串联质谱测定法(LC-MS/MS)(Lagerstedt SA:ClinicalChemistry 2014,50:3603-611;Gabler等人,J Chromatograph Separat Techniq 2012,4:7;Marrington R等人:Ann Clin Biochem 2010;47:467-475;Peitzsch M:ClinicaChimica Acta 2013,418:50-58)。尽管这些研究人员全部使用LC-MS/MS来测量甲变肾上腺素和去甲变肾上腺素,然而,其方法有所不同。举例来说,Lagerstedt等人,对于固相萃取(SPE),必须使用Oasis HLB来增加其方法的灵敏度和特异性。因为Lagerstedt等人并不以色谱法将肾上腺素分离,因此,当血浆中的肾上腺素得水平高于10.0nmol/l时,其方法就会受肾上腺素的干扰。为了进一步增加灵敏度,且消除这种干扰,Gabler等人以色谱法将去甲变肾上腺素从肾上腺素中分离。Marrington研究组和Peitzsch研究组相信,使用LC-MS/MS测量尿液中的甲变肾上腺素和去甲变肾上腺素,比使用血液样本更为优良,因为“尿液中比血浆中代谢物的浓度更高,使其测量变得更简单,且更容易广泛接受”(Peitzsch M:Clinica Chimica Acta,2013:418,50-58)。Marrington等人测量了尿液中,包含游离和结合形式的,尿液甲变肾上腺素和泌尿去甲变肾上腺素的总量。Peitzsch等人相信尿液中甲变肾上腺素和去甲变肾上腺素游离形式的水平可以反映这两种激素在肾上腺嗜铬蛋白和嗜铬细胞瘤细胞内产生的情况。他们的方法可以测量出降至1.2nmol/L水平的泌尿儿茶酚胺和其游离以及去结合邻甲基化代谢物。所有这些研究证明,使用LC-MS/MS测量甲变肾上腺素和去甲变肾上腺素,可以用于诊断嗜铬细胞瘤和副神经节瘤。通过利用辐射酶学检定法来测量血浆中去甲变肾上腺素和游离去甲变肾上腺素的总量,Foti等人已可以预测初期高血压患者中甲变肾上腺素的水平和交感神经紧张度之间的关系(Foti等人,Relationships of Free to Conjugated Normetanephrine in Plasma and SpinalFluid of Hypertensive Patients.J Clin Endocrinol Metab 1982,55:81-85)。这些人发现,正常血压的人和高血压患者中的游离去甲变肾上腺素平均浓度分别为117±10和155±33纳克/升;正常血压的人和初期高血压患者中的结合去甲变肾上腺素平均浓度分别为1417±109和1670±320纳克/升。初期高血压的患者中,游离和结合的去甲变肾上腺素浓度会分别高出30%和18%。,综合而言,人们相信使用LC-MS/MS测量血浆和尿液中的甲变肾上腺素和去甲变肾上腺素,具体来说,测量这两种激素的总体水平以及游离形式的水平,可评估交感神经系统的紧张度,并且进一步选择恰当患者群体进行肾交感神经去神经疗法。
在一个实施例中,本发明涉及到一种将患有系统性肾神经过度兴奋的受试者甄别为适用于肾调节治疗候选者的方法,包括以下步骤:从所述受试者获取体液;使用HPLC-MS测量所述体液中代谢物的量,其中所述代谢物包括游离的甲变肾上腺素、结合的甲变肾上腺素、游离和结合的去甲变肾上腺素中的一种多种;将所述代谢物的水平与参考值进行比较;以及如果所述代谢物的水平以特定量高于参考值,那么可以将所述受试者甄别为候选人。
在一个实施例中,所述体液为血液或尿液。
在一个实施例中,该参考值为正常群体中代谢物的浓度。在一个实施例中,结合的去甲变肾上腺素的参考值为1417±109纳克/升。在另一实施例中,游离的去甲变肾上腺素的参考值为117±10纳克/升。
在一个实施例中,所测量的游离的去甲变肾上腺素量比参考值高30%。在另一实施例中,所测量的结合的去甲变肾上腺素量比参考值高18%。
在一个实施例中,该初始基线从相同体液中的参考代谢物中获得。
在一个实施例中,上述,将患有系统性肾神经过度兴奋受试者甄别为适用与肾调节治疗候选者的方法执行之后,是在实例1到7和本申请其它部分中所描述的标测和消融手术。
如先前所指出的,患有抗抗高血压药物的高血压患者可以被选于肾消融的研究中,且这种介入手术证明了在降低血压的应用中有89%的临床成功率。本发明已证明,来自肾动脉的电刺激可引起受试者的相关生理反应,并且,因此可以表明肾神经在高血压中会起一定的作用。在一个实施例中,本发明中的标测方法,因而可以充当甄别适用于消融反应者的方法。
在一个实施例中,本发明涉及到一种方法,可以识别适用于肾消融治疗的,由系统性肾神经过度兴奋引起疾病的患者,该方法包括以下步骤:a)将一种导管引入到患者肾动脉的内腔中,以使得导管的尖端可以接触肾动脉内壁上的位点;b)在将电流引入到该位点之前,测量一个或多个生理参数以获得初始测量基线,这类生理参数包含收缩血压、舒张血压、平均动脉压和/或心率;c)通过将电流经由导管引入到该位点的形式,施加电刺激,其中电流可被调控为一定量级,当该位点处存在底层神经时,足以引起相关生理参数值升高;以及d)在每一电刺激之后,在一定时间间隔间,测量上文所述生理参数,其中在电刺激之后,生理参数数值有所增加并超过初始基线测量数值时,将表示患者对肾消融起反应。
在一个实施例中,该导管为被设计为治疗心律失常时所使用的消融导管。在另一实施例中,该导管为被特定设计成用于消融手术中标测肾神经的消融导管。
在一个实施例中,步骤(d)中所需的时间间隔为约5秒到约2分钟。
在一个实施例中,所述的一个或多个生理参数包含收缩血压,且收缩血压的增量在4到29mmHg范围内。
在一个实施例中,所述的一个或多个生理参数包含舒张血压,且舒张血压的增量在1.5到20mmHg范围内。
在一个实施例中,所述的一个或多个生理参数包含平均动脉压,且平均动脉压的增量在3到17mmHg范围内。
在一个实施例中,所述的一个或多个生理参数包含心率,心率的增量在4到12次/min范围内。
在一个实施例中,足以引起相关生理参数变化的电流,包括以下参数中的一个或多个:a)2与30伏之间的电压;b)100与1000欧姆之间的电阻;c)5与40毫安之间的电流;d)施加时间在0.1与20毫秒之间;以及e)总施加时间为1到5分钟之间。
实例9
肾动脉刺激可以导致系统性血压/心率的升高或降低,并由此可以指示肾交感神经和副交感神经的位置分布。在实验中,已经证明电刺激可从肾动脉的内部传递。因为肾神经围绕血管中的肾动脉分布,且肾静脉与肾动脉相互平行,所以,电刺激可经由肾静脉(Madhavan等人:J Cardiovasc Electrophysiol,Vol.pp.1-4)或从肾动脉外部实现,也就是说,对肾神经进行直接刺激。根据Chinushi等人(Hypertension 2013;61:450-456)的研究,其展示了通过刺激肾神经可以导致血压的升高,Madhavan相信,血压的升高,可通过静脉刺激肾交感神经来实现。他们研究了七只犬和一只狒狒。一种导管被放置在动物的静脉中,并施加高频刺激(800-900pps,10V,30-200秒)。这些研究人员观测到收缩血压从117(±28)显著增加到128(±33)mmHg,且舒张血压从75[±19]增加到87[±29]mmHg。这个研究确认了先前通过刺激肾交感神经可以升高血压的发现(Wang,US2011/0306851)。然而,目前的研究人员相信可利用肾交感神经刺激对血压的影响,来治疗高血压症状,如神经心源性晕厥。因此,本文中所描述的肾神经刺激的方法,可通过肾动脉内的方法,还有例如直接对肾动脉刺激的肾动脉外的方法,或通过肾静脉内刺激的方法来实现。
实例10
总数11名病患参与了利用本发明中肾神经刺激及标测方法的临床试验。这些病患在此次临床试验前有下列状况:
每一位入组的病患明白本研究的目的,并且自愿签署了知情协议。病患愿意遵守规则并完成该临床试验的随访。
每一位入组病患的两侧肾动脉都进行刺激标测,该电刺激参数如下:频率:20Hz;脉宽:5ms;刺激强度:10-20mA;刺激时长:<120s。参数也可以是如下任一选择:频率:2-100Hz;脉宽:1-20ms;刺激强度:2-25mA。根据刺激后血压与心率的反应,可以发现到三种不同的位点。在本发明中,“副交感神经”、“降压点”、“血管舒张点”或者“冷点”等术语运用于肾血管中是指肾血管上任何一个接受刺激后能使其中一种或多种生理参数降低的位点。“交感神经”、“增压点”、“血管收缩点”或者“热点”等术语运用于肾血管中是指肾血管上任何一个接受刺激后能使其中一种或多种生理参数增加的位点。术语“中性点”是指刺激后无明显生理参数发生变化的任何一个位点。当找到热点后,可以传递消融能量对其下的神经进行消融。在一种实施例,消融是使用射频能量进行,其参数如下:能量:8-10W;温度:50-60℃;消融时长:120s。所使用的也可以是如下任一参数:能量:2-20W;温度:42-90℃;消融时长:20-180s。在消融后,传递第二次刺激,如果仍有残余反应,会进行第二次消融。虽然在第二次消融后,即使仍有残余反应,也不会进行第三次消融,但是熟悉操作的技术人员明白将可以进一步进行消融。
表9、10及11分別显示典型热点、中性点及冷点的试验结果。
表9.热点数据
表10.中性点数据
表11.冷点数据
在这项研究中,当刺激导致心率每分钟增加6次以上和/或血压升高超过5mmHg时,确定为热点,而当刺激引起心率降低5次以上和/或血压降低超过2mmHg时,则确定为冷点。表12显示生理反应的最大值。但是,临床医生还可以根据他们的经验来解释所产生的生理反应,从而得出一个部位是热点、冷点还是中性点的结论。
表12.刺激导致的最大变化
表13显示从临床试验中确定的热点获得的数据。表14和15显示来自这些热点的血压反应。
表13.热点数据
表14.热点消融前的血压反应
表15.热点消融后的血压反应
表16显示从临床试验中确定的中性点获得的数据。表17显示来自这些中性点的血压反应。
表16.中性点数据
表17.中性点的血压反应
在去肾神经术中,消融能量被传递到人类受试者体内以破坏肾交感神经以降低选定患者的血压。但是,消融能量的作用并不特定于交感神经组织,而相同的能量可能会对其他组织造成不必要的损害。如表13所示,肾动脉中仅54%的部位是热点。如果在血管内盲目进行消融,则会对从临床角度上不希望发生的部位或神经造成不必要的消融和损害。本发明通过刺激来识别热点,以使这种不必要的消融和损伤最小化,并且进一步提供了一种验证血管外层的交感神经是否完整消融的方法。为了使对除神经组织以外的其他组织的损害最小化,通常限制所传递的消融能量的量。因此,标准方案的消融能量可能不足以在理想状况以外的其他情况下完全消融神经,例如,距离肾脏血管较远的神经或更大的神经。大约40%的消融热点对第二刺激产生反应,并需要进行第二消融。换句话说,消融之前的刺激不仅识别出热点,而且有效地测量了先前的消融是否已经实现了预期的消融。在第二次消融后,仍然对刺激保持响应的热点数量急剧减少到仅10%左右。为限制对周围组织的过度损害没有进行进一步的消融,但是本领域技术人员应当知道,为消除来自热点的生理反应,可以进行进一步的消融。对比表14、15和17中的数据可以清楚地识别出对刺激的生理反应是否存在。换句话说,可以从中性点中清楚地识别出热点,并且还可以从未完全消融的热点中清楚地识别出已完全消融的热点。
表18显示从临床试验中确定的反作用/冷点获得的数据。表19显示来自这些反作用点的血压反应。
表18.冷点数据
表19.冷点的刺激反应
本发明进一步提供了一种用于识别肾血管中的冷点的方法,以刺激后导致生理参数的降低为特征。肾血管中冷点的数量显著约为15%。尽管尚未阐明该现象背后的确切生理机制,但据信这些部位的消融与热点作用相反。在肾血管中盲目进行的任何消融都会消融热点和冷点。消融热点而引起的血压降低效果将会因消融冷点而抵消。Brinkmann等人对12例患者进行盲目地进行去肾神经术之前和之后的3至6个月的血压进行了检查,他们发现3例患者表现出与临床相关的血压降低,而7例患者的血压保持不变或什至升高。Townsend等人代表Spyral HTN-OFF Med试验研究人员证明,在35位盲目进行去肾神经术的患者中,有10位患者的24小时动态收缩压升高。这些结果证明盲目进行肾动脉消融时,如果消融冷点对血压的生理作用比消融的热点的影响更为显着,则在手术后血压将升高。因此,在肾脏消融期间应避免冷点。对比表14、17和19中的数据证明,使用本发明的刺激方法,可以从热点和中性点清楚地识别出冷点。
实施例11
肾神经标测和消融方法通常涉及镇静或麻醉以解决能量传递时的疼痛问题。本发明进一步提供了用于减少或消除刺激或消融期间导致疼痛的方案或算法。在一个实施例中,为减少对疼痛感受器的刺激,而对用于传递刺激或消融能量的算法进行修改。“波形”或“算法”等术语当运用于减轻或消除疼痛时是指刺激强度随时间的变化,其可以在刺激与时间的关系图中以图形方式描绘。
在一个实施例中,所述算法包括能量的逐渐增加。在另一个实施例中,该算法是诸如图27A所示的斜线或曲线。在另一个实施例中,该算法以最大强度的1%开始,并以峰值结束。
在一个实施例中,所述算法具有一个预脉冲。在另一个实施例中,在传递刺激之前的一定时间段内,将预脉冲保持在最大强度的1-10%之间(图27B)。在另一个实施例中,所述预脉冲是矩形或倾斜脉冲的形式。在一个实施例中,单个刺激是由预脉冲和刺激脉冲的组合构成(图27C)。
在一个实施例中,所述算法取决于刺激的反应。在另一个实施例中,照常传递刺激,一旦检测到生理反应,则将刺激降低,然后再次升高刺激,直到再次检测到生理反应。重复此过程,直到可以确认标测位点为止。在一个实施例,刺激能量将提高直到检测到生理反应,然后将刺激降低至一小部分,然后再次升高至引起生理反应的水平。(图27D)。在一个实施方案中,所述生理反应包括血压、心率、生化物质的水平例如肾上腺素、去甲肾上腺素、肾素-血管紧张素II和血管加压素、心肌电活性,肌肉活性,骨骼神经活性,细胞动作电位或因这些生理反应而导致的其他可测量反应,例如光瞳反应、肌电图和血管收缩。在一个实施例,因这些生理反应而导致的其他可测量反应进一步包括选自以下的一种或多种的变化率:血压、心率、生化物质的水平,例如肾上腺素、去甲肾上腺素、肾素-血管紧张素II和血管加压素、心肌电活性、肌肉活性、骨骼神经活动、细胞的动作电位。在另一个实施例,生理反应的正向或负向变化可用作于识别神经。在另一实施例中,以一个或多个生理反应从数学模型中计算出一个评估标测位点是否被神经支配的参数。
本发明进一步提供了用于增加肾神经对刺激或消融敏感度的方案。为了增加肾神经的敏感度,对刺激算法进行修改以便在刺激时引起大的生理反应,并且可以容易且精确地识别出适当的神经。在一实施例中,还可以调整消融算法,以将消融能量传递到神经中并更有效地导致其消灭。
实施例12
本发明涉及人体管道内标测神经的系统。在一个实施例,所述血管是动脉、静脉或任何具有内腔的其他人体管道。在另一个实施例,所述神经是肾神经。在另一个实施例,所述动脉或静脉是肾动脉或肾静脉。在另一个实施例中,人体管道是输尿管。
在一个实施例,本发明的系统包括具有一个远端电极组和一个近端电极组的导管。所述远端电极组包括多个双极性电极,并用于插入人体管道的远端部分。电刺激从双极电极传递到人体管道远端的大面积区域。所述近端电极组可包括一个或多个双极或单极电极。所述近端电极组可以提供电刺激和/或消融能量。
在一个实施例中,本发明的系统包括一个显示器,所述显示器显示远端电极和近端电极的刺激结果。远端电极组的刺激覆盖人体管道中的大面积,以作为近端电极组在人体管道的近端区域处传递消融能量之前和之后神经回路的连续性的检查。所述近端电极组通过刺激定位人体管道中的特定位点,并确定用于输送消融能量的最佳位点。
图28A显示本发明系统的一个实施例,其中一个末端具有一个远端电极组(2801)和一个近端电极组(2802)的导管(2800)插入一个外表面上具有神经的人体管道。导管末端可以是本文描述的任何一个末端,或者任何可以控制电极使其接触人体管道壁一个或多个位置的其他末端。所述远端电极组(2801)接触人体管道远端部分多个位置。在该实施例中,所述远端电极是双极电极,其允许电刺激采取跨两个选定电极的任何路径。选择在刺激时引起生理反应的区域作为参考部位。例如,在图28B中,通过两个选定的电极在D3-D3’部分的上四分之一传递刺激能量将引起因刺激交感神经SN1有关的生理变化。另一方面,通过另一对选定的电极在D3-D3′部分的下四分之一传递刺激能量将引起与副交感神经PN3和PN4刺激有关的生理变化。D3-D3’的上四分之一和下四分之一将分别用作交感神经和副交感神经的参考部位。在另一个实施例中,除D3-D3’外,所述远端电极组向人体管道远端的其他部分传递刺激能量,例如,D1-D1′和D2-D2′。由于神经回路的复杂结构,刺激人体管道上的单个部分可能无法标测连接人体管道的所有神经。在D3-D3′的上四分之一处最大的神经SN1被P3-P3'处的消融能量消融后,在D3-D3′的上四分之一处的进一步刺激将不会引起任何生理反应。对于D1-D1′,情况也是相同的,因为同一条神经SN1穿过D1-D1′。但是,在D2-D2′中,由于神经SN2尚未消融,因此上四分之一仍会引起交感生理反应。
在一个实施例,每个参考部位因刺激而产生的生理变化将被记录并确定是否适合作为参考部位。对于同时具有交感和副交感反应的部位如D1-D1’的下四分之一,由于刺激而引起的生理变化可能较低,不被选作确认消融的参考部位。D1-D1′、D2-D2′和D3-D3′的上四分之一中,D2-D2′分别在上四分之一和下四分之一中引起最大的生理交感和副交感反应。因此,选择D2-D2′作为第一个参考部位。
当所述远端电极组识别出一个或多个参考部位之后,所述近端电极组将识别在近端区域被神经支配的位点,例如,使用如图21E所示的序列。从最近端区域开始识别由交感神经支配的位点。在图28B所示的实施例中,P3-P3′的上四分之一将被识别为热点,消融能量将被传递到交感神经SN1,而在P3-P3’的下四分之一的副交感神经PN1则将被识别为反作用点并避免消融。SN1消融后,P1-P1′和P2-P2′的上四分之一不应表现出与交感神经有关的任何进一步的生理反应,因此,本发明能避免如果从P1-P1’开始消融而导致的重复努力。在P2-P2’的下四分之一处,交感神经和副交感神经都非常接近。为了避免对附近的副交感神经造成损害,可以避免P2-P2′处的热点,并且可以识别位于P2-P2′远端的其他热点。在此示例中,P1-P1′下四分之一的热点将被识别并消融,以便有效切断与P2-P2′热点相同的交感神经SN2。在近端部分消融后,刺激能量将再次在D2-D2′处传递到参考部分。随着SN1和SN2的消融,刺激能量不应引起远端位点的任何交感反应。
在一个实施例中,除图21K所示的一个电极组刺激结果外,远端电极和近端电极的两个刺激结果都展示。当远端多于一个区域已测试作为参考部位,每对电极之间的刺激相关的生理变化将被记录并随时复取以便用户可以在最佳参考部位之间进行选择。
在一个实施例,所述近端电极组向人体管道近端部分多个位点传递刺激能量,而每个位点引起的生理反应将被记录,以供用户决定用于传递消融能量的最佳位点。在一实施例,热点和反作用点的位置将被显示给用户,以决定用于消融的最佳位点。在另一个实施例中,用户将基于引起的生理反应的大小、所识别的位点较接近人体管道近端或位点较远离反作用点等因素决定消融位点。消融能量可以同时或分开地从近端电极将传递到选定的消融位点。
本发明进一步提供了适于快速筛查大面积人体管道交感神经及消融的导管。在一个实施例,多个近端电极被选择作为一个单元传递刺激能量和消融能量。选定的近端电极将同时传递刺激能量,并记录引起的生理反应。如果记录了与交感神经活动相关的生理反应,则每个近端电极可同时或分别传递消融能量,以消融下面的交感神经。远端部分选择一个或多个参考部位,以确保下游的交感神经被消融能量切断。如此使用较少的时间已能精确地标测每个位点。
在一个实施例,所述近端电极是双极性电极,其允许电刺激采取跨两个选定电极的任何路径。一对电极之间传递的刺激能量将覆盖人体管道近端的大面积区域。如果录得与交感神经相关的生理反应,消融能量便通过所述两个选定电极之间传递,以消融该区域中的任何交感神经。由于上述对人体管道大面积快速筛查交感神经和消融并未精确地近端电极定位到热点上,远端电极组将需要确保近端区域的消融已有效切断交感神经。
在一个实施例中,从近端电极组传递刺激能量的位点是以医学成像技术大致定位,例如,超声,然后再决定在何处以及哪个近端电极应传递刺激能量。在另一个实施例中,使用医学成像技术对电极的放置进行实时监控。这将减少在人体管道中定位热点和反作用点所需的时间。刺激能量仍将用于将消融能量定向神经及区分交感神经和副交感神经。可以基于血管周围已知的神经解剖结构来设计刺激和消融模式。例如,在图28C中,医学图像显示由于与其他神经较分开的原因等区域R1是消融的最佳部位。所述近端电极组(2802)根据已知的解剖结构在该区域中更紧密地间隔开,刺激能量将从最适合于该解剖结构的近端电极(2802)传递以确保神经为交感神经,例如P1-P1′,P2-P2′和P3-P3′的上四分之一处。在确认为交感神经后,消融能量从该区域内紧密间隔的电极传递,以消融神经。在一个实施例中,还可以基于神经的解剖结构为远端电极(2801)组设计刺激模式,以确保刺激的效率,如图28C中的R2。
在一个实施例中,本发明的导管还包括如图28D所示的一个中间电极组(2803)。所述中间电极组可以包括一个或多个双极性或单极性电极。所述中间电极组可以提供电刺激和/或消融能量。在一个实施例,近端电极组、中间电极组和远端电极组各自均覆盖人体管道长度的三分之一。
在一个实施例,所述导管包括用于覆盖人体管道一部分的一组电极(2804)。在另一个实施例,所述人体管道一部分是人体管道中最可能有神经支配或最可能有效消融。在另一个实施例中,所述人体管道一部分如图28E所示覆盖了人体管道长度的三分之一。如图28E所示,导管末端插入人体管道的近端部分,并从电极传递刺激能量。在一个实施例,所述电极是双极性电极,并且使用将刺激能量传递到大面积的配置。例如,图28E中的1-1′至7-7′切面的电极采用的配置,其中如图29所示,两个有源电极A和A′被两个返回电极R和R′隔开,因此如果该部分中有神经支配,则将刺激整个部分。如果没有生理反应,用户可以根据经验来判断受试者是否对刺激无反应或应当调整刺激参数或电极的位置以进行进一步刺激。
一旦确认受试者是反应者,将从近端电极开始传递刺激能量,以识别该部分中的任何热点或反作用点,例如第7-7′切面。这可以基于诸如图21E所示的例程。然后将消融能量从导管传递到确定的热点。在消融第7-7′切面后,刺激能量将传递到第1-1′至6-6′切面以检查第7-7′切面的消融是否有效切断了支配这些部分的交感神经。随后在第二最近端的第6-6′切面继续进行例程直至刺激无法引起生理反应为止。在进一步的实施例,如图28E所示,导管末端将放置在人体管道的下一个三分之一长度以传递刺激能量来确认所有的交感神经已经消融直到所有合适的位点都已消融为止。
在一个实施例,本发明提供了一种导管,该导管包括具有至少两个段(3001、3002)的导管末端,每个段是可以控制达致不同的直径。如图30A至30C所示,导管末端的每个部分包括具有电极(3004)的多个弹性部件(3003)。远端部分(3001)的每个弹性部件(3003)具有一个远端和一个近端。所述远端连接到一个控制杆(3005),而所述近端连接到一个分离杆(3006)。所述分离杆(3006)将远端段(3001)与近端段(3002)分离,并在所述控制杆(3005)上自由移动。在近端段(3002)处的每个弹性部件(3003)也具有一个远端和一个近端。所述远端连接到分离杆(3006),而所述近端连接到控制鞘管(3007)。控制鞘管容纳控制杆(3005)和分离杆(3006)在其内。
当控制杆(3005)单独退回到控制鞘管(3007)内时,在远端段(3001)的弹性构件(3003)被迫胀出的尺寸是基于控制杆退回控制鞘管(3007)内多少(图29B)。另一方面,当控制杆(3005)和分离杆(3006)均退回到控制护套(3007)内时,近端段(3002)处的弹性部件(3003)被迫胀出的尺寸是基于控制杆(3005)和分离杆(3006)退回控制鞘管(3007)内多少(图30C)。因此,可以根据用户的要求控制近端段和远端段达到不同的尺寸。在另一个实施例中,远端段(3001)和近端段(3002)中的弹性部件(3003)连接到不同的分离杆(3006、3008),从而可以控制两个段之间的距离(图30D)。在又一个实施例,在远端段和近端段之间具有一个中间段(3009)。每个弹性部件的近端和远端连接接到不同的分离杆以控制中间段的尺寸(图30E)。
在一个实施例,所述弹性部件上有多个电极。所述电极可以是单极或双极。在一个实施例,远端段上的电极的作用是如图28A中的远端电极组,近端段上的电极的作用是如图28A中的近端电极组。在另一个实施例中,导管末端具有一个第三段,并且弹性部件上的电极的作用是如图28D中的中间电极组。
在一个实施例,所述弹性部件具有使电极与容器的内壁接触的机会最大化的预成形状。在一个实施例,所述预成形状是圆形或椭圆形使位于中间的电极将能够接触人体管道的内壁。在另一个实施例中,弹性部件(3100)包括扁平部件(3101)和弯曲部件(3102),如图31A。扁平部件(3101)具有用于接触人体管道内壁的多个电极(3103),而弯曲部件(3102)则用于直径变化。当弹性部件的两端受到压缩时(图31B中的箭头所示),由于预成形状,弯曲将集中在扁平部件(3101)与弯曲部件(3102)接合的位置。这也可以通过在扁平部件与弯曲部件相接之处设置凹陷位来实现。在一个实施例,扁平部件比弯曲部件坚硬得多,当弹性部件的两端被压缩时,仅弯曲部件将改变形状,而扁平部件则相对于人体管道的内壁保持平坦。在一个实施例,扁平部件和倾斜部分由相同的材料制成,但是弯曲部件被制成比扁平部件薄,使得它们比平坦部分较容易弯曲,例如图31C。在另一个实施例中,平坦部分和弯曲部分的横截面的设计使平坦部分更难弯曲。
在一个实施例中,如果需要相对较长的扁平部件,并且对扁平部件的支撑不足以使电极与血管壁建立牢固的接触,则可以串联连接多个弹性部件,如图31D。各个弹性部件与连接环(3104)连接,所述连接环环套控制杆。所述连接环没有与任何分离杆连接,并且仅基于弹性部件之间的力平衡而沿控制杆被动地移动。当控制杆如图31E所示回缩时,弹性部件将凸出并且大部分将保持相对平坦。在另一个实施例中,弹性部件具有波浪形的预成形状(3105),例如,图31F,因此与控制杆在多个点接触以支撑与人体管道内壁的牢固接触。当控制杆缩回时,将恢复波形结构,如图31G所示。在另一个实施例中,在波浪形预成形状接触控制杆的位置处也有用于提供进一步支撑的连接环。
参考文献
1.Aars,H.and Akre,S.,Reflex Changes in Sympathetic Activity andArterial Blood PressureEvoked by Afferent Stimulation of the Renal Nerve.ActaPhysiol.Scand 1970;78(2):184-188
2.Beacham,W.S.and Kunze,D.L.,Renal Receptors Evoking a SpinalVasometer Reflex.J.Physiol 1969;201(1):73-85
3.Campese,V.M.,Kogosov,E.,Renal afferent denervation preventshypertension in rats withchronic renal failure.Hypertension 1995;25(4Pt.2):878-882.
4.Campese,V.M.,and Krol,E.,Neurogenic factors in renal hypertension.CurrentHypertension Reports 2002;4(3):256-260.
5.Converse,R.L.Jr.,Jacobsen,T.N.,Toto,R.D.,Jost,C.M.,Cosentino,F.,Fouad-Tarazi,F.,Victor,R.G.,Sympathetic overactivity in patients with chronicrenal failure.New EnglandJournal of Medicine 1992;327(27):1912-1918.
6.Dibona,Gerald F.and Ulla C.Kopp,Neural Control of RenalFunction.PhysiologicalReviews 1997;77(1):75-197.
7.DiBona,G.F.,Neural control of the kidney:past,present andfuture.Hypertension 2003;41:621-624.
8.Esler,M.,Jennings,G.,Lambert,G.,Meredith,I.,Horne,M.,Eisenhofer,G.,Overflow ofcatecholamine neurotransmitters to the circulation:source,fate,andfunctions.PhysiologicalReviews 1990;70(4):963-985.
9.Esler,M.,Schlaich,M.,Sobotka,P.et al.,Catheter-based renaldenervation reduces totalbody and renal noradrenaline spillover and bloodpressure in resistant hypertension.Journalof Hypertension 2009;27(suppl 4):s167.
10.Esler,M.et al.,Renal sympathetic denervation in patients withtreatment-resistanthypertension(The Symplicity HTN-2 Trial):a randomizedcontrolled study.The Lancet2010;376:1903-1909.
11.Krum,H.,Schlaich,M.,Whitbourn,R.,Sobotka,P.A.,Sadowski,J.,Krzysztof,Bartus,K.,Kapelak,B.,Walton,A.,Sievert,H.,Thambar,S.,Abraham,W.T.,and Esler,M.,Catheter-based renal sympathetic denervation for resistanthypertension:a multicentre safetyand proof-of-principle cohort study.TheLancet 2009;373(9671):1275-1281.
12.Lu,M.,Wei,S.G.and Chai,X.S.,Effect of Electrical Stimulation ofAfferent Renal Nerveon Arterial Blood Pressure,Heart Rate and Vasopressin inRabbits.Acta Physiol.Sinica1995;47(5):471-477
13.Ma,G.and Ho,S.Y.,Hemodynamic Effects of Renal Interoreceptor andAfferent NerveStimulation in Rabbit.Acta Physiol.Sinica 1990;42(3):262-268
14.Mahfoud,F.,Schlaich,M.,Kindermann,I.,Ukena,C.,Cremers,B.,Brandt,M.C.,Hoppe,U.C.,Vonend,O.,Rump,L.C.,Sobotka,P.A.,Krum,H.,Esler,M.,and
15.Medical devices:pg 1-2,February 22,2012
16.Schlaich,M.P.,Sobotka,P.A.,Krum,H.,Lambert,E.,and Esler,M.,Renalsympathetic-nerve ablation for uncontrolled hypertension.New EnglandJournal ofMedicine 2009;36(9):932-934.
17.Schlaich,M.P.,Krum,H.,Whitbourn,R.et al.,A novel catheter basedapproach todenervate the human kidney reduces blood pressure and musclesympathetic nerve activityin a pateitn with end stage renal disease andhypertension.Journal of Hypertension 2009;27(suppl 4):s154.
18.Smithwick,R.H.,and Thompson,J.E.,Splanchnicectomy for essentialhypertension;resultsin 1,266 cases.J Am Med Association 1953;152(16):1501-1504.
19.Talenfeld,A.D.,Schwope,R.B.,Alper,H.J.,Cohen,E.I.,and Lookstein,R.A.,MDCTAngiography of the Renal Arteries in Patients with AtheroscleroticRenal Artery Stenosis:Implications for Renal Artery Stenting with DistalProjection.American Journal ofRoentgenology 2007;188:1652-1658.
20.Ueda,H.,Uchida,Y.,and Kamisaka,K.,Mechanism of the ReflexDepressor Effect byKidney in Dog.Jpn.Heart J.1967;8(6):597-606
21.Valente,J.F.,Dreyer,D.R.,Breda,M.A.,Bennett,W.M.,Laparoscopicrenal denervationfor intractable ADPKD-related pain.Nephrology DialysisTransplantation 2001;16(1):160.
22.Vigilance D.W.,Mutrie C.J.,Yi G.H.,Yu K.,Guo A.,Gelfand M.,SmithC.R.,Oz M.C.,Levin H.,Wang J.,A novel approach to increase total urine outputin acute heart failure:unilateral renal nerve blockade.Journal of theAmerican College of Cardiology Supplement2005,45(3):166A.
23.Wang,J.,Mapping sympathetic nerve distribution for renal ablationand catheters for thesame,US patent application no.2011/0306851 A1,filedAugust 26,2011.
24.Ye,S.,Zhong,H.,Yanamadala,V.,Campese,V.M.,Renal injury caused byintrarenalinjection of phenol increases afferent and efferent sympatheticnerve activity.AmericanJournal of Hypertension 2002;15(8):717-724.
25.Zieglcr M.G.,Lake C.R.,Kopin I.J.,Plasma noradrenaline in-creaseswith age.Nature 1976;261:333
26.Cryer P.E.,Haymond M.W.,Santiago J.V.,Shah S.D.,Norepinephrine andepinephrinerelease and adrenergic mediation of smoking associated hemodynamicand metabolic events.N Engl J Med 1976;295:573-577
27.Robertson D.,
28.Planz G.,Wiethold G.,Appel E.,
29.Robertson D.,Johnson G.A.,Brilia G.M.,Hill R.E.,Watson J.T.,OatesJ.A.Salt restrictionincreases serum catecholamines and urinarynormetanephrine excretion.Fed Proc 1977,36:956
30.Robertson D.,Shand D.G.,Hollifield J.W.,Nies A.S.,
31.Lagerstedt S.A.,O′Kane D.J.,Singh R.J.,Measurement of plasma freemetanephrine andnormetanephrine by liquid chromatography-tandem massspectrometry for diagnosis ofpheochromocytoma.Clinical Chemistry 2004;50(3):603-611.
32.Gabler J.,Yuan C.,Woroniecki W.,Liu H.,Wang S.,A Sensitive andInterference-FreeLiquid Chromatography Tandem Mass Spectrometry Method forMeasuring Metanephrinesin Plasma.J Chromatograph Separat Techniq 2013;4:195
33.Marrington R,Johnston J,Knowles S,Webster C,Measurement of urinarymetadrenalineand normetadrenaline by liquid chromatography tandem massspectrometry for thediagnosis of phaeochromocytoma.Ann Clin Biochem 2010;47:467–475
34.Peitzsch M.,Pelzel D.,
35.Foti et al,The Relationships of Free to Conjugated Normetanephrinein Plasma and SpinalFluid of Hypertensive Patients.J Clin Endocrinol Metab1982;55:81-85
36.Madhavan M.et al,Transvenous Stimulation of the Renal SympatheticNerves IncreasesSystemic Blood Pressure:A Potential New Treatment Option forNeurocardiogenic Syncope.J Cardiovasc Electrophysiol 2014;25:1115-1118
37.Chinushi M.,Izumi D.,Iijima K.,Suzuki K.,Furushima H.,Saitoh O.,Furuta Y.,Aizawa Y.,Iwafuchi M.,Blood pressure and autonomic responses toelectrical stimulation of the renalarterial nerves before and after ablationof the renal artery.Hypertension 2013;61:450-456.
38.Brinkmann J.,Heusser K.,Schmidt B.M.,Menne J.,Klein G.,BauersachsJ.,Haller H.,Sweep F.C.,Diedrich A.,Jordan J.,Tank J.,Catheter-Based RenalNerve Ablation andCentrally Generated Sympathetic Activity in Difficult-to-Control Hypertensive Patients.Hypertension 2012;60:1485-1490.
39.Townsend R.R.,Mahfoud F.,Kandzari D.E.,Kario K.,Pocock S.,WeberM.A.,Ewen S.,Tsioufis K.,Tousoulis D.,Sharp A.S.P.,Watkinson A.F.,SchmiederR.E.,Schmid A.,ChoiJ.W.,East C.,Walton A.,Hopper I.,Cohen D.L.,Wilensky R.,Lee D.P.,Ma A.,DevireddyC.M.,Lea J.P.,Lurz P.C.,Fengler K.,Davies J.,ChapmanN.,Cohen S.A.,DeBruin V.,Fahy M.,Jones D.E.,Rothman M.,
40.Mompeo B.,Maranillo E.,Garcia-touchard A.,Larkin T.,Sanudo J.,TheGross Anatomyof the Renal Sympathetic Nerves Revisited.Clinical Anatomy 2016;29:660–664
41.Wouter A.C.,Amsterdam V.,Blankestijn P.J.,Goldschmeding R.,BleysR.L.A.W.,Themorphological substrate for Renal Denervation:Nerve distributionpatterns andparasympathetic nerves.A post-mortem histological study.Annals ofAnatomy 2016;204:71–79
- 用于标测支配动脉壁功能性神经的系统和方法以及可实现相同功能的3D标测法和导管
- 用于标测支配动脉壁功能性神经的系统和方法以及可实现相同功能的3D标测法和导管
