一种检测新型冠状病毒(SARS-CoV-2)的引物探针和试剂盒
文献发布时间:2023-06-19 11:59:12
技术领域
本发明属于分子诊断技术领域,具体涉及一种检测新型冠状病毒(SARS-CoV-2)核酸RNA的引物探针、试剂盒。
背景技术
新型冠状病毒属于β属的新型冠状病毒,有包膜,颗粒成圆形或椭圆形,常为多形性,直径60-140nm。其基因特征与SARSr-CoV和MERSr-CoV有明显区别。目前研究显示与蝙蝠SARS样冠状病毒(bat-SL-CoVZC45)同源性达85%以上。人群普遍易感,老年人及有基础疾病者感染后病情较重,儿童及婴幼儿也有发病。以发热、乏力、干咳为主要表现。少数患者伴有鼻塞、流涕、腹泻等症状。重型病例多在一周后出现呼吸困难,严重者快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍。部分患者仅表现为低热、轻微乏力等,无肺炎表现,多在1周后恢复。实验室检查发病早期外周血白细胞总数正常或减低,淋巴细胞计数减少,部分患者出现肝酶、肌酶和肌红蛋白增高。多数患者C反应蛋白(CRP)和血沉升高,降钙素正常。严重者D-二聚体升高、外周血淋巴细胞进行性减少。在咽拭子、痰、下呼吸道分泌物、血液等标本中可检测出新型冠状病毒核酸。胸部影像学早期呈现多发小斑片影及间质改变,以肺外带明显。进而发展为双肺多发磨玻璃影、浸润影,严重者可出现肺实变,胸腔积液少见。
目前国家卫生健康委《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》将实时荧光RT-PCR检测新型冠状病毒核酸及病毒基因测序两种方法作为新型冠状病毒感染肺炎的确诊病例。实时荧光RT-PCR技术具有高灵敏度、高特异性、操作简便、检测时间短等诸多优势,能快速有效对疑似病例进行确诊,有效监测临床病情及预后。另外,随着此次疫情的发展与扩散,疑似患者在全国乃至全球范围还在不断增多,对确诊试剂的需求还在不断加大。灵敏度高、特异性强、准确、检测时间短,自动化程度高、操作简便快速,成本低、高通量的新型冠状病毒核酸检测试剂开发,对疑似病例的确诊、疫情的监测、确诊患者的预后和复发监控,以及对各企业顺利复工复产,恢复经济正常运行,保障社会稳定发展等都具有重大意义和实用价值。
目前市场上已有部分国内外的同类试剂,但国内取得国家药品监督管理局(NMPA)注册证书的同类试剂均为应急研发产品,部分产品性能未经充分验证,检测效果参差不齐,临床反馈部分产品灵敏度较差,假阴性率较高,漏检较多。部分产品为单基因检测产品,虽然因干扰较少,平均灵敏度相对最高,但因为病毒的变异非常快,中国国家基因组科学数据中心(NGDC)、美国NCBI、GISAID数据库一直以来不断发现随着新冠病毒的扩散复制,新出现病例中的新冠病毒株发生了大量的病毒突变,单靶标检测产品有可能因引物探针位置突变导致漏检;3靶标以上产品则因加入的引物探针过多导致互相干扰,更加容易导致检测灵敏度降低,造成漏检风险;另有部分产品多个靶标分2孔检测,虽然增加了检测靶标,且因为分孔检测灵敏度影响较小,但多孔检测导致所需样本量增加,且手工操作时间增加,检测流程变长,结果判读时间增加,容易出错,不利于大规模的一线快速高通量的筛查检测。早期基于应急使用的需要,包括中国、美国、德国等各国疾控中心及WHO均公开发布了用于检测新型冠状病毒ORF1ab、N、E基因等靶基因的引物探针组合供各国医疗机构使用,但因为当时已测得的临床隔离株序列过少,无法获得足够多的的同源性位点及病毒突变位点信息,导致部分引物探针组合设计位置不佳,存在非特异性较差,反应灵敏度低等缺陷;随着疫情的发展和在全球的不断蔓延,具有更好灵敏度、特异性、准确性的检测试剂盒存在非常大的市场需求及应用缺口。国家卫健委发布的《新型冠状病毒感染的肺炎实验室检测技术指南(第二版)》中推荐核酸检测选用的靶标为:ORF1ab和N基因。双靶标能实现1孔检测,且兼顾灵敏度和特异性,减少漏检,提升阳性检出率。
发明内容
本发明要解决的技术问题是,提供一种灵敏度高、特异性强、结果准确、操作简便快速、低成本和高通量的新型冠状病毒(SARS-CoV-2)核酸检测试剂盒,可以有效满足临床新型冠状病毒肺炎COVID-19疑似病例的确诊、疫情的监测、确诊患者的预后和复发监控,以及全国各地企事业单位复工返岗、学校复读等健康人群筛查需求。
为解决上述技术问题,本发明采用如下技术方案:
一组检测新型冠状病毒(SARS-CoV-2)核酸RNA的引物探针,包括如下扩增新型冠状病毒不同基因的引物对及探针:
(1)扩增ORF1ab基因的引物序列,其核苷酸序列如SEQ ID NO:1~2所示;
(2)扩增ORF1ab基因的探针序列,其核苷酸序列如SEQ ID NO:3所示;
(3)扩增N基因的引物序列,其核苷酸序列如SEQ ID NO:4~5所示;
(4)扩增N基因的探针序列,其核苷酸序列如SEQ ID NO:6所示。
本发明还提供另一技术方案:一组检测内源性人管家基因RPP30的引物探针,包括如下的引物对及探针:
(1)扩增RPP30基因的引物序列,其核苷酸序列如SEQ ID NO:7~8所示;
(2)扩增RPP30基因的探针序列,其核苷酸序列如SEQ ID NO:9所示;
上述9种核酸序列在一次1孔检测中使用。
本发明提供第三技术方案:一种用于检测新型冠状病毒(SARS-CoV-2)核酸的试剂盒,该试剂盒包括如下试剂:
(1)PCR反应液:包含Mg
(2)混合酶液:包含热启动DNA聚合酶、MMLV逆转录酶、UNG酶、RNase酶抑制剂等;
(3)引物探针预混合液:SEQ ID NO:1~9所示的核苷酸序列的混合液;
(4)阳性对照:包含含新型冠状病毒;ORF1ab基因和N基因核酸序列的RNA假病毒,以及健康人基因组DNA(gDNA)的溶液;
(5)阴性对照:TE水溶液。
作为优选,所述阳性对照中,含新型冠状病毒(SARS-CoV-2)ORF1ab基因和N基因核酸序列的RNA假病毒浓度约100000拷贝/mL,健康人基因组DNA(gDNA)浓度约400ng/mL。
与现有技术相比,本发明的有益效果:本发明通过设计多组新型冠状病毒(SARS-CoV-2)种内保守、种间特异的引物探针,并筛选出最优组合,配以优化的一步法RT-PCR反应液,在荧光定量PCR仪上,应用实时荧光PCR检测技术,通过荧光信号的变化实现对新型冠状病毒核酸的高灵敏检测:
(1)PCR检测体系包含有内源性管家基因的的内标引物和探针,通过检测内标是否正常来进行样本采集、提取和检测的全程质控,可有效避免假阴性结果。
(2)抗抑制剂能力强,可兼容柱式法抽提、磁珠法自动化核酸抽提,及免提取快速核酸裂解法前处理体系,实现快速、简便、高通量的检测新型冠状病毒;
(3)高效的UNG酶防污染体系,能高效去除高浓度阳性样本导致的环境气溶胶污染,有效避免假阳性。
该引物探针组合及配套一步法-荧光PCR检测试剂盒具有灵敏度高、特异性强、结果准确、操作简便快速,低成本、高通量,平台通用性强的显著优势,非常适宜大规模推广应用,具有良好的推广价值和应用前景。
附图说明
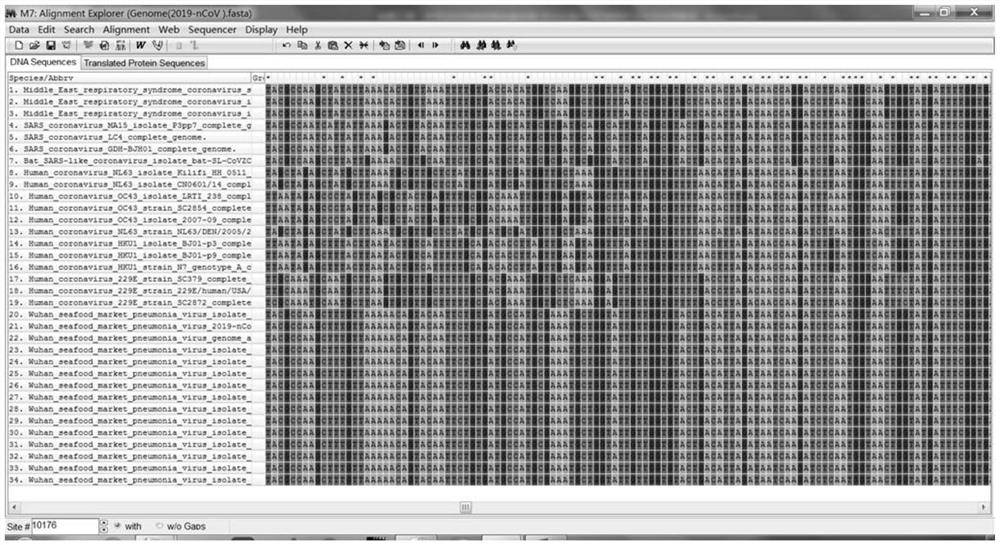
图1为不同种冠状病毒序列比对结果图。
图2为ORF1ab基因适宜用于设计SARS-CoV-2特异性检测引物探针的区域示例,该区域具有种内保守和种间特异性。
图3为N基因适宜用于设计SARS-CoV-2特异性检测引物探针的区域示例,该区域具有种内保守和种间特异性。
图4为E基因比对结果,E基因片段过小,且不同种冠状病毒间序列保守性强,仅一个碱基具有种间特异性,无法满足设计SARS-CoV-2特异性检测引物探针的需求。
图5为1组SARS-CoV-2特异性引物Blast结果,特异性好,分析显示无非特异性匹配产物。
图6为1组SARS-CoV-2特异性引物Blast结果,特异性不佳,分析显示与蝙蝠冠状病毒和SARS病毒有非特异性匹配产物,该组引物不合格,舍弃。
图7为FAM通道(ORF1ab)结果图
图8为VIC通道(N基因)结果图
图9为空白非特异性测试FAM通道结果图,除PC1和PC2 3平行均正常起峰,其余NTC孔均为阴性,无非特异性起峰。
图10为SARS-CoV-2RNA假病毒数字PCR绝对定量结果图。Ch1通道为FAM荧光通道,检测ORF1ab基因,紫色阈值线以上的蓝色荧光点即为阳性微滴,计算机自动换算成拷贝浓度,阈值线以下的灰色点为阴性微滴。Ch2通道为VIC荧光通道,检测N基因,紫色阈值线以上的绿色荧光点即为阳性微滴,计算机自动换算成拷贝浓度,阈值线以下的灰色点为阴性微滴。
图11为灵敏度实验三(250、125、62.5copies/mL)FAM通道结果图,结果显示,3个梯度60孔重复中,仅62.5copies/mL浓度梯度1孔(D9)ORF1ab基因结果阴性,其余孔均为阳性;阳性对照(PC)和NTC检测合格
图12为灵敏度实验三(250、125、62.5copies/mL)VIC通道结果图,结果显示,3个梯度60孔重复中,62.5copies/mL浓度梯度5孔(B9、D8、D9、E8、H7)N基因结果阴性,其余孔均为阳性;阳性对照(PC)和NTC检测合格
图13为灵敏度实验三(250、125、62.5copies/mL)CY5通道结果图,结果显示,3个梯度60孔重复内参基因结果均为阳性;阳性对照(PC)和NTC检测合格。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制本发明。
实施例1:检测SARS-CoV-2病毒核酸的特异性引物及探针的设计
从中国国家基因组科学数据中心(NGDC)、美国NCBI、GISAID等全球公共数据库下载2020年1月10号以来公布的所有具有不同国家、区域和时间分布的SARS-CoV-2隔离株的全基因组序列,并与进化关系最相近的蝙蝠冠状病毒、其他6种感染人的冠状病毒(包括SARS、MERS、229E、NL63、OC43、HKU1等)、牛冠状病毒以及其他常见呼吸道病毒序列比对分析,以新型冠状病毒的种内保守和种间特异性最优的ORF1ab基因和N基因的中选择多个靶标区域,分别设计多组特异引物探针组,采用MEGA7和ClustalX1.83软件进行种间和种内序列同源性比对分析,如图1-4所示,寻找种间特异、种内保守的区域作为引物探针设计备选靶区域,设计引物探针;比对结果显示,M、S、E基因等区域种间特异性或种内保守性较差,特别是E基因,种间差异过小,特异性不足,无法设计满足区分不同种冠状病毒要求的引物探针,ORF1ab和N基因具有多个种间特异和种内保守的区域,最适宜用来设计和筛选引物探针;采用Vector NTI Advance 10.0及Primer Express 3.0设计和评估SARS-CoV-2特异性引物探针组。
实施例2:引物探针组合的特异性分析
通过两种方法进行特异性分析验证:1)NCBI数据库Blast分析(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行特异性验证,如图5-6,剔除特异性不佳的引物探针组合;2)下载40种常见呼吸道感染相关病毒、肺炎支原体、肺炎衣原体及细菌、真菌等临床病原体隔离株全基因序列109株(表1),采用生物信息学软件PatMaN(PatternMatching in Nucleotide databases)对各引物探针组进行本地化同源性分析;验证所设计引物探针组的特异性。
表1部分常见呼吸道感染相关病原体隔离株列表
如上述109个不同病原体隔离株基因组存在同时满足以下3个条件的区域:a)大小2000bp内;2)该区域内存在任意2条引物同时匹配其正反向,且与匹配位置序列的同源性超过80%;3)探针与2条引物位置内侧的靶序列有超过80%的同源性匹配度;则认为有可能产生非特异性扩增产物及荧光信号,该组引物探针组合直接剔除。假定无法避开同源性较高区域,则必须经过后续样本真实性验证。其余的组合,视其为特异性合格,进入下一步筛选和优化。
实施例3:检测SARS-CoV-2病毒核酸的特异性引物及探针的合成
经虚拟分析后特异性合格的部分检测SARS-CoV-2病毒核酸及内标基因引物探针组,由上海百力格生物技术有限公司合成,序列如表1:
表1检测SARS-CoV-2病毒核酸及内标基因的特异性引物及探针组合
实施例4:测试不同PCR反应mix的反应性能
采用前期灭活冻存的高浓度RNA核酸模板(MPS,约3E+05copies/mL),用DEPC处理水10倍稀释5个梯度,测试多个厂家的扩增检测试剂(如下表)的反应性能,从中优选效果好的PCR mix:
其中,自主设计制作的6号PCR反应液组合,每一反应中,Taq酶的用量1.5-2.5U,逆转录酶的用量是5-10U,UNG酶用量0.1-0.3U,RNA酶抑制剂的用量为0.2-0.3μL,每一种dNTP浓度100-400μM。
按照各试剂说明书配制40uL反应mix,引物探针组合采用实例2中的6,11及18分别检测的ORF1ab、N基因和人内参基因RPP30;此外,加入不同浓度梯度的模板10uL,进行一步法RT-PCR,在LightCycler 480荧光定量PCR仪上进行检测,扩增检测程序如下:
其中酶1-5反应体系扩增检测程序:
酶6反应体系:因takara公司UNG酶可在室温5min内有效降解可能的污染,配制mix期间即可自动完成,且选用Thermo高效率逆转录酶,故程序调整至如下快速扩增检测程序:
每一个测试2个平行,分2台同型号LightCycler 480II仪器同时进行,测试孔布局如下:
板1:
板2:
结果:采用相同的引物探针组合,不同酶反应体系对同一样本不同稀释度的检测效果差异较大,包括荧光强度、本底及灵敏度(图7,8),结果整理如下表:
FAM通道结果:
备注:“+”表示结果为阳性;“-”表示结果为阴性,下同
VIC通道结果:
CY5通道结果:
上述结果显示,不同酶之间灵敏度有所不同,成本也有所高低;另外酶3反应mix本底信号高,影响判读;第6和1组酶反应体系可作为优选酶反应体系,5、4、2次之;自研酶6反应所需时间最短,约1h即可完成扩增检测。
综上,自研酶6反应液体系成本更低,检测时间还可比酶1反应体系缩短20min,最短,检出梯度也最佳,可作为优选;酶1反应体系可作为次选
实施例5:引物探针组合测试
一、测试不同引物探针组合效果(1)
采用前期灭活冻存的高浓度RNA核酸模板(2430号),测试实例2所合成的各组引物探针的反应性能,从中优选效果好的引物探针组合,主要包括如下:
采用酶6反应体系;
其扩增检测程序同实例3;
布局如下:
1)结果分析:
请参照各仪器使用说明书进行设置,基线调整取10-20个循环的荧光信号,阈值设定原则以阈值线刚好超过阴性对照品检测荧光曲线的最高点。
比较各引物探针组检测同一个阳性样本(2430)及阴性空白(NTC)扩增效果,以Ct值大小、S型曲线效果、2平行之间重复性及终点荧光强度为参考标准.
2)结果:测试结果如下所述:
FAM通道6组:
备注:数字表示阳性信号Ct值,下同。
VIC通道6组:
CY5通道6组:
结果显示:
检测ORF1ab基因的FAM通道6组引物探针中,3组最优,2、6组较优,次之,1、4组效果差,无显著S型曲线,信号很弱;
检测N基因的VIC通道6组引物探针中,8和9组最优,11、12组较优,次之,7、10组Ct值偏大,信号弱,扩增效率较低;
检测人内参基因的CY5通道6组引物探针中,6组效果均表现良好,Ct值各组之间差异不大,14、15、18组较优,13、16、17组次之;
二、测试不同引物探针组合效果(2)
采用前期灭活冻存的中浓度RNA核酸模板(2430号),用DEPC处理水10倍稀释,测试实例4初步筛选的各组引物探针随机组合后,对的检测灵敏度(最低检测限,LOD)反应性能,从中优选效果最佳的组合:
1)酶反应mix采用酶6反应体系;
2)扩增检测体系同实例3;
3)判读标准同实例4,考察不同引物探针组的最低检出浓度梯度;
4)结果:
3+9+14组合效果最优,可检出4个浓度梯度,2+12+15和6+8+18组合也表现良好,可用于备选优选组合。
实施例6:测试优选引物探针组合特异性(1)-空白特异性
采用优选引物探针组合(3+9+14)进行空白非特异性起峰测试,具体如下:
1)模板采用ddH
2)酶反应mix采用酶6体系;
3)扩增检测体系同实例3
4)观察3+9+14优选引物探针组合多重检测体系空白非特异性情况。
实验结果:
板子布局如下:
结果:除了两个PC各3个平行起峰之外,其余92孔NTC孔3个检测通道均无非特异性起峰(如图9),表明该组引物探针组合空白非特异性表现良好,具体如下表:FAM通道结果:
VIC通道:
CY5通道:
实施例7:测试优选引物探针组合特异性(2)-与其他常见呼吸道病原体的交叉反应
采用优选引物探针组合(3+9+14)进行阴性参考品(其他常见呼吸道病毒样本)的交叉反应测试,考察该优选组合的特异性,具体如下:
1.中高浓度的阴性参考品样本,从中检院、邦德盛、各省级疾控中心等不同机构单位购买或获赠的标准菌株或病毒株,人基因组DNA采用健康体检人外周血抽提DNA:
2.抽提体系采用自研高效磁珠法抽提试剂(样本400uL,洗脱100uL,可有效浓缩样本4倍),试剂主要组分如下:
采用黑马E96-II全自动核酸抽提系统,优选快速核酸提取程序如下:
3.酶反应mix采用酶6体系;
4.扩增检测体系同实例3;
5.观察3+9+14优选引物探针组合多重检测体系常见阴性参考品非特异性起峰情况。
6.实验结果:
板子布局如下:
结果:除PC1和PC2正常出峰外,其余所有常见呼吸道病毒阴性参考品、人基因组gDNA及生理盐水等FAM和VIC通道均无非特异性起峰:
FAM通道:
VIC通道:
CY5通道:
综上,交叉实验结果显示检测的优选引物探针组合与常见呼吸道病原体及正常人gDNA等无交叉反应,表现优异。
实施例8:SARS-CoV-2RNA假病毒标准品的绝对拷贝浓度确定
涵盖3+9+14引物探针组合扩增区域序列的RNA假病毒委托上海复百澳生物科技有限公司定制生产(出厂标定浓度:≥1.0E+08copies/mL,采用QPCR外标法测得),经自研高效率磁珠法进行全自动核酸抽提,并采用微滴式数字PCR系统进行绝对定量验证其精确浓度。主要步骤如下:
一、样本:
假病毒原液及10倍梯度稀释样本(用生理盐水稀释)如下:
1:原液
2:稀释10倍,-1次
3:稀释100倍,-2次
4:稀释1000倍,-3次
5:稀释10000倍,-4次
二、试剂:
1)抽提试剂:自研磁珠法抽提试剂
2)逆转录试剂:ThermoFisher,Maxima H Minus cDNA Synthesis Master Mixwith dsDNase(货号:M1682)
3)数字PCR试剂:Bio-rad,ddPCR Supermix for probes(货号:1863026)
4)引物探针mix采用中国CDC公布的组合6和11:
ORF1ab基因20*mix(上下游引物浓度各18uM,探针5uM)
N基因20*mix(上下游引物浓度各18uM,探针5uM)
5)仪器:
抽提仪:黑马E96-II
PCR扩增仪:Eppendorf Mastercycler proS定性PCR仪
数字PCR系统:Bio-rad,QX200微滴式数字PCR系统
三、方法
1)深孔板样本孔中加入不同梯度假病毒样本100ul,再加300ul生理盐水,每个样本各3个平行,按照抽提试剂盒说明书抽提;100ul洗脱;模板吸至1.5mL离心管备用;
2)逆转录:
体系:
逆转录程序:
3)数字PCR检测
PCR mix体系:
ddPCR程序:
四、结果:
1)如图10,有效微滴数均超过10000,合格;NTC(阴性对照)无阳性微滴,结果有效;
2)软件计算结果,不同梯度稀释样本ORF1ab及N基因的浓度如下:
结论:两个靶基因结果略有不同,以较高浓度N基因浓度为准,假病毒原液浓度为1.04E+10copies/mL。
实施例9:引物探针量测试
一、实验目的:
测试不同引物探针量检测效果。
二、样本:
SARS-CoV-2 RNA假病毒梯度稀释样本:
磁珠法抽提好RNA模板后备用。
三、试剂
1)酶反应液:酶6反应液试剂
2)引物探针组合编号:3+9+14
3)引物探针用量分组:
保持各引物和探针用量2:1的比例不变,改变不同靶基因引物探针总量:
a:0.5/0.5/0.5
b:1/1/0.5
c:1.5/1.5/0.5
四、体系
体系40ul;扩增、检测和分析方法同实施例4。
布局:
五、结果:不同通道靶基因的结果如下:
FAM通道:
VIC通道:
CY5通道:
总结:综上结果显示,b组引物探针用量最佳,可以最好的兼顾靶基因的灵敏度和内参基因的检出。
实施例10:退火延伸温度优化
一、实验目的:
测试不同退火延伸温度效果。
二、样本:
SARS-CoV-2 RNA假病毒梯度稀释样本:
磁珠法抽提好RNA模板后备用。
三、试剂
1)酶6反应液试剂
2)引物探针组合编号:3+9+14
3)3个通道基因引物探针用量分别为1uL、1uL和0.5uL
四、体系
体系40ul;扩增、检测和分析方法同实施例4;退火温度测试58和60℃两种,比较检测效果。
布局:
五、结果
结果汇总如下:
58℃,FAM通道:
58℃,VIC通道:
58℃,CY5通道:
60℃,FAM通道:
60℃,VIC通道:
60℃,CY5通道:
总结:
1)FAM通道一致,VIC通道58℃多检出一个梯度,内参通道一致;
2)综合以上结果,58℃是相对较优选的退火延伸温度。
实施例11:优选组合进行灵敏度考察测试
一、实验目的:
测试优选引物探针组合及检测试剂体系的检测灵敏度,即最低检测限(LOD)。
二、实验方案
采用实例8中描述的RNA假病毒(经ddPCR定量浓度为1.0E+10copies/mL)作为模拟样本,采用口咽拭子样本保存溶液进行10倍稀释,至1.0E+03copies/mL,然后进行连续2倍稀释至62.5copies/mL。参考实施例7采用磁珠法全自动抽提体系进行核酸抽提。
首先检测1.0E+06copies/mL到1.0E+03copies/mL浓度样本,每个稀释度重复3次,如果4个浓度梯度均为阳性,则继续检测更低浓度(1.0E+03,500,250,125,62.5copies/mL),每次重复20次,以检出95%阳性的最低浓度为该优选体系的LOD。
三、样本:
SARS-CoV-2 RNA假病毒梯度稀释样本:
自研磁珠法抽提,抽提程序参考实例7,抽提好RNA模板后备用。
四、试剂
1)优选酶6反应液试剂
2)优选引物探针组合编号:3+9+14
3)3个通道基因引物探针用量采用优选,ORF1ab、N基因、RPP30内参基因用量分别为1uL、1uL和0.5uL
五、体系
参考实施例3,终体系40ul;优选退火温度58。实验孔布局如下:
实验一:
实验二(假如需要):
实验三(假如需要):
六、结果
依次进行了3次实验,汇总结果如下:
综上所述,实验一至实验三结果显示,除62.5copies/mL外其余浓度全部重复检测孔均为阳性,而62.5copies/mL浓度检测20重复孔,检出19孔阳性(图11-图13),阳性率95%(19/20)。因此,口咽拭子保存液样本中,该优选体系的灵敏度(LOD)为62.5copies/mL,按照核酸抽提试剂4倍浓缩效果及90%得率,10uL上样量计算,该优选体系灵敏度为1-2copies/反应。该优选体系具有突出的检测灵敏度表现。
实施例12:不同仪器平台适用性测试
一、实验目的:
测试本发明所述优选引物探针组合及检测试剂体系在不同定量PCR仪上的适用性,考察其在不同仪器平台的通用程度。
二、实验方案
采用实例8中描述的RNA假病毒(经ddPCR定量浓度为1.0E+10copies/mL)作为模拟样本,采用口咽拭子样本保存溶液进行10倍稀释,至1.0E+03copies/mL,然后进行连续2倍稀释至125copies/mL。参考实施例7采用磁珠法全自动抽提体系进行核酸抽提。抽提好的RNA核酸模板分别在目前主流的进口及国产定量PCR仪上测试,考察该体系的平台通用程度。
三、样本:
SARS-CoV-2 RNA假病毒梯度稀释样本:
自研磁珠法抽提,抽提程序参考实例7,抽提好RNA模板后备用。
四、试剂
1)优选酶6反应液试剂
2)优选引物探针组合编号:3+9+14
2)3个通道基因引物探针用量采用优选,ORF1ab、N基因、RPP30内参基因用量分别为1uL、1uL和0.5uL。
五、体系
参考实施例3,终体系40uL;优选退火温度58。实验孔布局如下:
六、结果
1)阈值设置及结果分析同实施例4;
2)汇总样本结果如下:
Roche LightCycler 480 II实时荧光定量PCR系统(96孔)检测结果如下:
ABI 7500实时荧光定量PCR系统(96孔)检测结果如下:
ABI QuantStudio 5实时荧光定量PCR系统(384孔)检测结果如下:
宏石SLAN-96S实时荧光定量PCR系统检测结果如下:
七、结论
综上结果,显示该优选引物探针组合及试剂检测体系在不同定量仪器平台上具有一致的检测灵敏度效果,从中高浓度至临界浓度均能正常检出,显示该体系具有良好的平台通用性,能适用于国内外不同水平医院及第三方检验机构的各种品牌定量PCR仪器平台,满足不同通量检测需求。
实施例13:免提取试剂兼容测试
一、实验目的:
测试本发明所述优选引物探针组合及检测试剂体系在免提取前处理试剂的兼容性,考察其检测流程的优化效果。
二、实验方案
参考实施例11,采用自主研发的高效免提取保存液(灭活型)作为基质(加入400ng/mL的人基因组gDNA),将实例8中描述的RNA假病毒(经ddPCR定量浓度为1.0E+10copies/mL)作为模拟阳性样本,连续至1.0E+03copies/mL,然后2倍稀释。室温静置10min(灭活病毒并裂解释放病毒RNA核酸)后,直接将样本作为PCR模板进行扩增检测,考察该免提取扩增检测试剂体系检测效果及检测限。
三、样本:
SARS-CoV-2 RNA假病毒梯度稀释样本:
四、试剂
1)优选酶6反应液试剂
2)优选引物探针组合编号:3+9+14
3)3个通道基因引物探针用量采用优选,ORF1ab、N基因、RPP30内参基因用量分别为1uL、1uL和0.5uL。
五、体系
参考实施例3,终体系40uL;退火温度58。实验孔布局如下:
实验一:
实验二(如有必要):
实验三(如有必要):
六、结果
1)阈值设置及结果分析同实施例4;
2)汇总样本结果如下:
免提取模拟样本灵敏度检测结果如下:
七、结论
由实验一至实验二结果显示,250cipies/mL浓度20孔重复均为阳性,125copies/mL浓度20重复孔,检出15孔阳性,阳性率75%(15/20)。因此,免提取样本直接上样,优选体系灵敏度为2.5copies/反应,即250copies/mL原始样本。因为磁珠法抽提体系可将原始样本浓缩4倍,故实际上免抽提直扩体系灵敏度(LOD)与磁珠法抽提后的体系一致。
综上所述,采用与本发明所述检测体系兼容性良好的病毒保存液,能有效在短时间内灭活病毒,保护样本采集、运输和检测人员安全;同时快速裂解病毒RNA核酸,样本送至检测单位即可立即进行直接扩增,且扩增效率不受保存液组分影响,该快速检测体系与抽提后检测体系保持一致的高灵敏度,而检测时间可减少20-30min,使从样本到结果的整体流程时间缩短至1h内;可实现更高通量的对疑似和健康人群进行快速筛查检测。
实施例14:临床样本验证测试
将本发明所述的优选引物探针组合及检测试剂盒及检测体系用于部分冻存的SARS-CoV-2RNA核酸模板检测,方法参照实施例3,4,结果与前期用商品化试剂盒(灵敏度1000copies/mL)检测的结果进行比对,数据如下:
备注:临床结果以最终新冠肺炎(COVID-19)确诊与否作为确认或排除结果。
临床样本验证测试结果显示,本发明所述引物探针组合及试剂盒检测体系对冻存模板检测结果与商品化有证比对试剂结果具有良好的一致性,总体符合率97.7%;第23、46、74号样本本试剂盒检出阳性,但Ct值较大,接近阳性临界值,前期比对试剂盒检测结果为阴性,而临床结果为确诊COVID-19患者;原因推测是该样本中SARS-CoV-2病毒滴度低于比对试剂盒灵敏度,因此导致结果假阴性,造成漏检。
本发明通过设计多组新型冠状病毒(SARS-CoV-2)种内保守、种间特异的引物探针,并筛选出最优组合,配以优化的一步法RT-PCR反应液,在可在多种不同品牌的荧光定量PCR仪上,应用实时荧光PCR检测技术,通过荧光信号的变化实现对新型冠状病毒核酸的高灵敏检测;检测体系包含有内源性管家基因的的内标引物和探针,通过检测内标是否正常来进行样本采集、提取和检测的全程质控,可有效避免假阴性结果;优选的试剂检测体系抗抑制剂能力强,可兼容柱式法抽提、磁珠法自动化核酸抽提,以及免提取快速核酸裂解法等多种前处理体系,实现一线医疗机构更加快速、简便、高通量的检测SARS-CoV-2病毒核酸,有助于更快的筛查和确诊疑似患者和健康人群;高效的UNG酶防污染体系,能有效去除高浓度阳性样本导致的环境气溶胶污染,有效避免假阳性,避免因高通量检测大批量样本导致污染,影响检测结果准确性的错误事件发生;适用多个定量PCR仪器平台,可满足不同地区,不同水平医院及第三方检验机构的不同仪器平台上的应用所需。本发明所述引物探针组合及配套一步法-荧光PCR检测试剂盒,相比现有大部分同类试剂盒,具有样本兼容性高(可兼容各种抽提体系及免抽提快速裂解检测体系)、检测灵敏度高(62.5copies/mL临床样本,或1-2copies/反应)、特异性强(与其他冠状病毒及常见呼吸道相关病原体均无非特异性交叉反应)、结果跟准确(与临床确诊结果一致性高)、操作简便快速(免抽提体系可达1h内,约50min),低成本(优选自研6号酶反应体系低至1.5元/测试,酶1反应体系低至2.5元/测试)、高通量,平台通用性强的突出优势,可以有效满足临床新型冠状病毒肺炎(COVID-19)疑似病例的确诊、疫情的监测、确诊患者的预后和复发监控,以及全国各地企事业单位复工返岗、学校复读、入境人群等健康或高危人群筛查需求,非常适宜大规模推广应用,具有良好的推广价值和应用前景。
序列表
<120> 一种检测新型冠状病毒(SARS-CoV-2)的引物探针和试剂盒
<160> 9
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
tgcatcagca ttgtgggaaa 20
<210> 2
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ccatgctaaa ttaggtgaat tgtcc 25
<210> 3
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
ccaacaggtt gtagatgc 18
<210> 4
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
ggttcaccgc tctcactcaa c 21
<210> 5
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
ggtgttaatt ggaacgcctt gt 22
<210> 6
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
aagaccttaa attccctcg 19
<210> 7
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
gagctggact ccaagggtac aa 22
<210> 8
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
tgagaatcag gaagggctga tagt 24
<210> 9
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
cttctaagct tctaagt 17
- 一种检测新型冠状病毒(SARS-CoV-2)的引物探针和试剂盒
- 一种用于检测新型冠状病毒SARS-CoV-2的引物对、探针、组合物、试剂盒及应用
