使用溶液的药物递送系统
文献发布时间:2023-06-19 12:02:28
技术领域
本发明涉及用于向细胞中递送关注对象分子(核酸、蛋白质等)而进行转导的溶液。进一步地,本发明涉及使用这样的溶液将关注对象分子转导到细胞中的方法以及被转导了关注对象分子的细胞的制造方法。
背景技术
为了将核酸、蛋白质或这些的复合物等有效地向细胞内转染,本领域中正在研究各种细胞内递送系统。
专利文献1中记载了一种转导缓冲液,其包含(i)转导化合物、(ii)盐或钠-氢转运体的活化因子/增强因子、以及优选包含的(iii)渗透压保护剂。作为转导化合物,记载了甜菜碱(例:非表面活性剂型磺基甜菜碱)、GABA(γ-氨基丁酸)等。另外,作为实施例,记载了将gRNA和Cas9蛋白转导到KBM7细胞中并观察到了WDR85基因的切断。
非专利文献1中记载了:使用专利文献1中记载的特定化合物(GABA和非去污剂型磺基甜菜碱201(NDSB-201)等)转导sgRNA-Cas9蛋白,观察到了WDR85基因的切断。
专利文献2中记载了一种转导缓冲液,其包含(i)转导化合物、(ii)一种以上的盐(Na,Rb,Li,K或Cs)250-2500mM、(iii)渗透压诱导剂(渗透压:500-5000mOsmol/kg)和(iv)渗透压保护剂。另外,作为实施例,记载了将gRNA和Cas9蛋白转导到KBM7细胞中并观察到了目的基因的切断。
非专利文献2中记载了:通过向Cas9蛋白的N末端添加1-4个SV40 NLS,在体外(神经祖细胞)和体内(向小鼠脑内的注射)观察到了由Cas9/gRNA复合物的转导引起的目的基因的切断。
现有技术文献
专利文献
专利文献1:国际公开第2015/028969号
专利文献2:国际公开第2017/093326号
非专利文献
非专利文献1:D’Astolfo et a1.,Cell,161,674-690,Apr.23,2015
非专利文献2:Brett T Staahl et al.,Nature Biotechnology,35,431-434,2017
发明内容
发明所要解决的问题
本发明的目的在于,提供向细胞中导入核酸、蛋白质或这些的复合物等的导入效率优良的手段、特别是使用转导用溶液的方法。另外,另一方面,本发明的目的在于提供利用这样的手段进行了转导的细胞的制造方法。
用于解决问题的方法
本发明人为了解决上述问题进行了深入研究,结果发现,通过使用特定的化合物或分子等的溶液,能够以高的效率将核酸、蛋白质或这些的复合物等导入细胞内,能够解决上述问题,从而完成了本发明。
即,本发明至少涉及以下的发明。
[1]
一种用于向细胞中转导关注对象分子的方法,其包括使该细胞与该关注对象分子和转导用溶液接触的步骤,
上述转导用溶液包含下述(A1)~(A5)中的至少一者和(B)盐:
(A1)下述通式(I)所示的化合物或其盐,但不包括作为生物体的蛋白质的构成单元的20种L-氨基酸和S-甲基-L-甲硫氨酸,
[式中,n为0或1,
R
R
其中,R
R
R
(A2)下述通式(II)所示的化合物或其盐,
[式中,X表示氧原子或NR
R
R
Y表示氢原子或OR
R
R
R
其中,通式(II)所示的化合物还包括具有在水溶液中与通式(II)处于平衡关系的链状结构的化合物;
(A3)核酸碱基、核苷或核苷酸、或者其盐;
(A4)通式(III)所示的化合物或其盐,但不包括苹果酸,
Rx-CRyRzCOOH III
[式中,Rx表示被选自由C
Ry和Rz各自独立地表示氢原子或羟基(其中,至少一者为羟基),或者一起表示氧代基。];
(A5)选自由肌酸酐、羟脯氨酸、1,3-丁二醇、曲恩汀、D-纤维二糖、1,3-二甲基脲、泛酰内酯和三甲双酮组成的组中的至少1种或其盐。
[2]
根据项1所述的方法,其中,
(A1)为选自精氨基琥珀酸、1-甲基-L-组氨酸、泛酸、L-肌肽、N-氨甲酰基-L-天冬氨酸中的化合物或其盐;
(A2)为选自米格列醇、2-脱氧-D-葡萄糖-6-磷酸、α-D-葡萄糖-1-磷酸、1-脱氧野尻霉素中的化合物或其盐;
(A3)为选自胞嘧啶、胞苷、脱氧尿苷、脱氧胞苷、5’-肌苷酸中的化合物或其盐;
(A4)为选自6-磷酸-D-葡萄糖酸、3-甲基-2-氧代丁酸、2-羟基戊二酸中的化合物或其盐;
(A5)为选自肌酸酐、羟脯氨酸、1,3-丁二醇、1,3-二甲基脲、D-纤维二糖、1,3-二甲基脲、泛酰内酯、三甲双酮中的化合物或其盐。
[3]
根据项1所述的方法,其中,(A1)~(A5)中的至少一者为选自1-甲基-L-组氨酸、N-氨甲酰基-L-天冬氨酸、脱氧胞苷、2-脱氧-D-葡萄糖-6-磷酸、6-磷酸-D-葡萄糖酸中的化合物或其盐。
[4]
根据项1所述的方法,其中,上述盐(B)为选自由氯化钠、氯化镁和氯化钾组成的组中的至少1种。
[5]
根据项1所述的方法,其中,上述关注对象分子包含蛋白质和/或核酸。
[6]
根据项1所述的方法,其中,上述关注对象分子包含Cas蛋白和/或gRNA。
[7]
根据项1所述的方法,其中,上述细胞存在于生物体内。
[8]
根据项1所述的方法,其中,上述细胞为肌细胞。
[9]
一种被转导了关注对象分子的细胞的制造方法,其包括使该细胞与该关注对象分子和转导用溶液接触的步骤,
上述转导用溶液包含下述(A1)~(A5)中的至少一者和(B)盐:
(A1)下述通式(I)所示的化合物或其盐,但不包括作为生物体的蛋白质的构成单元的20种L-氨基酸和S-甲基-L-甲硫氨酸,
[式中,n为0或1,
R
R
其中,R
R
R
(A2)下述通式(II)所示的化合物或其盐,
[式中,X表示氧原子或NR
R
R
Y表示氢原子或OR
R
R
R
其中,通式(II)所示的化合物还包括具有在水溶液中与通式(II)处于平衡关系的链状结构的化合物;
(A3)核酸碱基、核苷或核苷酸、或者其盐;
(A4)通式(III)所示的化合物或其盐,但不包括苹果酸,
Rx-CRyRzCOOH III
[式中,Rx表示被选自C
Ry和Rz各自独立地表示氢原子或羟基(其中,至少一者为羟基),或者一起表示氧代基。];
(A5)选自由肌酸酐、羟脯氨酸、1,3-丁二醇、曲恩汀、D-纤维二糖、1,3-二甲基脲、泛酰内酯和三甲双酮组成的组中的至少1种或其盐。
[10]
根据项9所述的方法,其中,
(A1)为选自精氨基琥珀酸、1-甲基-L-组氨酸、泛酸、L-肌肽、N-氨甲酰基-L-天冬氨酸中的化合物或其盐;
(A2)为选自米格列醇、2-脱氧-D-葡萄糖-6-磷酸、α-D-葡萄糖-1-磷酸、1-脱氧野尻霉素中的化合物或其盐;
(A3)为选自胞嘧啶、胞苷、脱氧尿苷、脱氧胞苷、5’-肌苷酸中的化合物或其盐;
(A4)为选自6-磷酸-D-葡萄糖酸、3-甲基-2-氧代丁酸、2-羟基戊二酸中的化合物或其盐;
(A5)为选自肌酸酐、羟脯氨酸、1,3-丁二醇、1,3-二甲基脲、D-纤维二糖、1,3-二甲基脲、泛酰内酯、三甲双酮中的化合物或其盐。
[11]
根据项9所述的方法,其中,(A1)~(A5)中的至少一者为选自1-甲基-L-组氨酸、N-氨甲酰基-L-天冬氨酸、脱氧胞苷、2-脱氧-D-葡萄糖-6-磷酸、6-磷酸-D-葡萄糖酸中的化合物或其盐。
[12]
根据项9所述的方法,其中,上述盐(B)为选自由氯化钠、氯化镁和氯化钾组成的组中的至少1种。
[13]
根据项9所述的方法,其中,上述关注对象分子包含蛋白质和/或核酸。
[14]
根据项9所述的方法,其中,上述关注对象分子包含Cas蛋白和/或gRNA。
[15]
根据项9所述的方法,其中,上述细胞存在于生物体内。
[16]
根据项9所述的方法,其中,上述细胞为肌细胞。
[17]
一种转导用溶液,其包含下述(A1)~(A5)中的至少一者和(B)盐:
(A1)下述通式(I)所示的化合物或其盐,但不包括作为生物体的蛋白质的构成单元的20种L-氨基酸和S-甲基-L-甲硫氨酸,
[式中,n为0或1,
R
R
其中,R
R
R
(A2)下述通式(II)所示的化合物或其盐,
[式中,X表示氧原子或NR
R
R
Y表示氢原子或OR
R
R
R
其中,通式(II)所示的化合物还包括具有在水溶液中与通式(II)处于平衡关系的链状结构的化合物;
(A3)核酸碱基、核苷或核苷酸、或者其盐、
(A4)通式(III)所示的化合物或其盐,但不包括苹果酸,
Rx-CRyRzCOOH III
[式中,Rx表示被选自由C
Ry和Rz各自独立地表示氢原子或羟基(其中,至少一者为羟基),或者一起表示氧代基。];
(A5)选自由肌酸酐、羟脯氨酸、1,3-丁二醇、曲恩汀、D-纤维二糖、1,3-二甲基脲、泛酰内酯和三甲双酮组成的组中的至少1种或其盐。
[18]
根据项17所述的转导用溶液,其中,
(A1)为选自精氨基琥珀酸、1-甲基-L-组氨酸、泛酸、L-肌肽、N-氨甲酰基-L-天冬氨酸中的化合物或其盐;
(A2)为选自米格列醇、2-脱氧-D-葡萄糖-6-磷酸、α-D-葡萄糖-1-磷酸、1-脱氧野尻霉素中的化合物或其盐;
(A3)为选自胞嘧啶、胞苷、脱氧尿苷、脱氧胞苷、5’-肌苷酸中的化合物或其盐;
(A4)为选自6-磷酸-D-葡萄糖酸、3-甲基-2-氧代丁酸、2-羟基戊二酸中的化合物或其盐;
(A5)为选自肌酸酐、羟脯氨酸、1,3-丁二醇、1,3-二甲基脲、D-纤维二糖、1,3-二甲基脲、泛酰内酯、三甲双酮中的化合物或其盐。
[19]
根据项17所述的转导用溶液,其中,(A1)~(A5)中的至少一者为选自1-甲基-L-组氨酸、N-氨甲酰基-L-天冬氨酸、脱氧胞苷、2-脱氧-D-葡萄糖-6-磷酸、6-磷酸-D-葡萄糖酸中的化合物或其盐。
[20]
根据项17所述的转导用溶液,其中,上述盐(B)为选自由氯化钠、氯化镁和氯化钾组成的组中的至少1种。
[21]
一种药物组合物,其包含项17所述的转导用溶液和关注对象分子。
[22]
根据项21所述的药物组合物,其中,上述关注对象分子包含蛋白质和/或核酸。
[23]
根据项21所述的药物组合物,其中,上述关注对象分子包含Cas蛋白和/或gRNA。
需要说明的是,本说明书中,有时将“通式(I)所示的化合物”、“通式(II)所示的化合物”、“通式(III)所示的化合物”分别记作“化合物(I)”、“化合物(II)”、“化合物(III)”。有时将上述(A1)~(A5)项中记载的化合物及其盐等分别记作“(A1)的化合物”~“(A5)的化合物”。有时将上述(A1)~(A5)中的至少一者和(B)盐记作“成分(A1)~(A5)和(B)”。
发明效果
利用本发明的转导方法,能够将核酸、蛋白质或它们的复合物等以高的效率导入细胞内。例如,通过将CRISPR系统中使用的gRNA和Cas9蛋白的复合物利用本发明的转导方法以高的效率导入细胞内,能够实现基于CRISPR系统的高的DNA切断活性。通过利用这样的本发明的转导方法,能够高效地制造进行了转导的细胞。
附图说明
图1示出建立EGFP报告细胞的报告盒。
图2示出EGFP报告细胞的EGFP、HOECHST染色和在可见光下进行扫描的图像分析的结果。
图3示出Cas9蛋白的表达部分。
图4-1:图4(图4-1和图4-2)示出使用各种浓度的(A1)~(A5)的化合物时的EGFP阳性率和HOECHST细胞数的测定结果(参照实施例1)。
图4-2:同上。
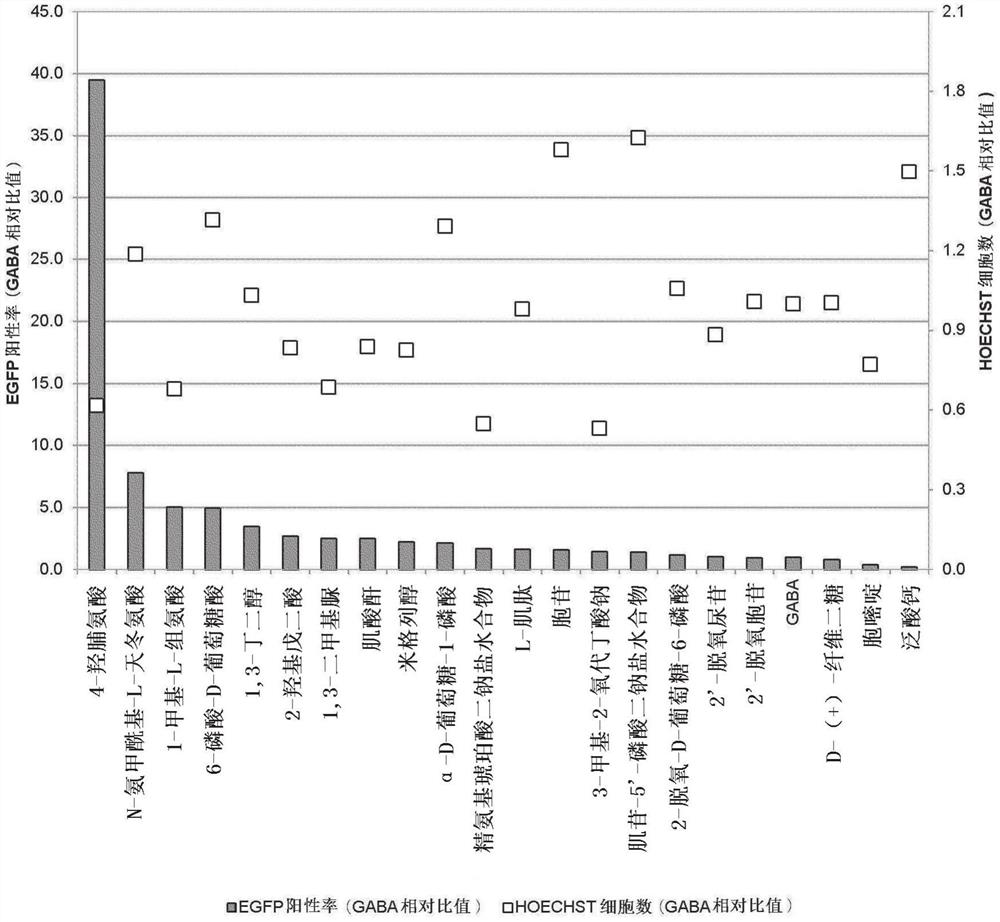
图5示出分别以特定的浓度使用(A1)~(A5)的化合物时的EGFP阳性率和HOECHST细胞数的测定结果(参照实施例1)。
图6示出分别以特定的浓度使用(A1)~(A5)的化合物时的EGFP阳性率和HOECHST细胞数的测定结果(参照实施例2)。
图7示出使用各种浓度的(B)盐时的EGFP阳性率和HOECHST细胞数的测定结果(参照实施例3)。
图8示出关于(A1)~(A5)的化合物的、改变作为盐(B)的氯化钠的浓度时的EGFP阳性率的测定结果(参照实施例4)。
图9示出将含有作为(A3)的化合物的2’-脱氧胞苷、各种浓度的氯化钠以及mRosa26 gRNA与Cas9蛋白的复合物的给药液(给药液1)局部给药于小鼠右下肢腓肠肌时的、突变导入效率(indel(%))的测定结果(参照实施例5)。
图10示出将含有各种(A1)~(A5)的化合物、氯化钠以及mRosa26gRNA与Cas9蛋白的复合物的给药液(给药液2)局部给药于小鼠右下肢腓肠肌时的、突变导入效率(indel(%))的测定结果(参照实施例6)。
图11示出将含有各种浓度的6-磷酸-D-葡萄糖酸或N-氨甲酰基-L-天冬氨酸、氯化钠以及mRosa26gRNA与Cas9蛋白的复合物的给药液(给药液3)局部给药于小鼠胫骨前肌时的、跳跃效率(skipping efficiency(%))的测定结果(参照实施例7)。
图12示出使用含有6-磷酸-D-葡萄糖酸或N-氨甲酰基-L-天冬氨酸(或作为对照的GABA)以及氯化钠的转导用溶液进行荧光标记葡聚糖的细胞内摄入评价时的、荧光显微镜照片(参照实施例8)。荧光显微镜照片中的亮部表示被摄入到细胞内的荧光标记葡聚糖。
具体实施方式
本说明书中,“转导”(转染)是指将任意的物质导入细胞的内部。细胞的内部至少包括细胞质内和细胞核内。
“培养(Culture)”或“进行培养”是指在组织外或体外、例如在培养盘、培养皿、培养瓶或培养槽(罐)中维持细胞、使其增殖和/或使其分化。
“包含(comprise(s)或comprising)~”是指:虽然表示包括了连接在该短语之后的要素、但不限于此。因此表示包括连接在短语之后的要素、但不表示排除其它的任意要素。
“由~构成(consist(s)of或consisting of)”是指:表示包括了连接在该短语之后的全部要素、并且仅限于这些。因此,“由~构成”这一短语表示:所列举的要素为需要的或必须的,其它要素实质上不存在。“基本由~构成”表示:包含连接在该短语之后的任意要素、并且对该要素限定了不影响本公开中规定的活性或作用的其它要素。因此,“基本由~构成”这一短语表示:所列举的要素为需要的或必须的,其它要素为任意选择,根据对所列举的要素的活性或作用是否有影响而有时使它们存在、有时使它们不存在。
本说明书中,将聚集的规则散布的短回文重复序列(clustered regularlyinterspersed short palindromic repeats:CRISPR)/CRISPR-相关(CRISPR-associated:Cas)系统记作“CRISPR系统”。
以下,对本说明书中使用的各取代基的定义进行详细说明。只要没有特别声明,则各取代基具有以下的定义。
本说明书中,作为“C
本说明书中,作为“C
本说明书中,作为“直链状C
本说明书中,作为C
以下对本发明的转导用溶液进行说明。
本发明的转导用溶液包含下述(A1)~(A5)中的至少一者和(B)盐。
(A1)的化合物为下述通式(I)所示的化合物或其盐,但不包括作为生物体的蛋白质的构成单元的20种L-氨基酸和S-甲基-L-甲硫氨酸。(A1)的化合物可以为水合物。(A1)的化合物既可以单独使用一种,也可以将两种以上组合使用。
式(I)中,
n为0或1,
R
R
其中,R
R
R
需要说明的是,R
式(I)中的n、R
n优选为0或1。
R
R
R
R
R
R
化合物(I)的优选的具体例如下所述。下述的化合物可以为盐和/或水合物。
化合物(I-i):n为0或1、R
化合物(I-ii):n为0或1、R
化合物(I-iii):n为0或1、R
化合物(I)的更优选的具体例如下所述。下述的化合物可以为盐和/或水合物。
化合物(I-a):n为0、R
化合物(I-b):n为0、R
化合物(I-c):n为1、R
化合物(I-d):n为0、R
化合物(I-e):n为0、R
在本发明的一个方面中,(A1)特别优选选自精氨基琥珀酸、1-甲基-L-组氨酸、泛酸、L-肌肽、N-氨甲酰基-L-天冬氨酸中的化合物或其盐(可以为水合物),尤其是选自精氨基琥珀酸、1-甲基-L-组氨酸、L-肌肽、N-氨甲酰基-L-天冬氨酸中的化合物或其盐(可以为水合物)。
在本发明的另一方面中,(A1)特别优选为选自1-甲基-L-组氨酸、N-氨甲酰基-L-天冬氨酸中的化合物或其盐(可以为水合物)。
(A2)的化合物为下述通式(II)所示的化合物或其盐。(A2)的化合物可以为水合物。(A2)的化合物既可以单独使用一种,也可以将两种以上组合使用。
式(II)中,
X表示氧原子或NR
R
R
Y表示氢原子或OR
R
R
R
其中,通式(II)所示的化合物也包括具有在水溶液中与通式(II)处于平衡关系的链状结构的化合物。
式(II)中的X、Y、R
X优选为氧原子或NR
Y优选为氢原子或OR
R
R
R
R
R
R
化合物(II)的优选的具体例如下所述。下述的化合物可以为盐和/或水合物。
化合物(II-i):X为NR
化合物(II-ii):X为氧原子、Y为OR
化合物(II)的更优选的具体例如下所述。下述的化合物可以为盐和/或水合物。
化合物(II-a):X为NR
化合物(II-b):X为氧原子、Y为OR
化合物(II-c):X为氧原子、Y为OR
化合物(II-d):X为NR
在本发明的一个方面中,(A2)特别优选选自米格列醇、2-脱氧-D-葡萄糖-6-磷酸、α-D-葡萄糖-1-磷酸、1-脱氧野尻霉素中的化合物或其盐(可以为水合物)。
在本发明的另一方面中,(A2)特别优选2-脱氧-D-葡萄糖-6-磷酸或其盐(可以为水合物)。
(A3)的化合物为核酸碱基、核苷或核苷酸、或其盐。(A3)的化合物可以为水合物。(A3)的化合物既可以单独使用一种,也可以将两种以上组合使用。
需要说明的是,一个实施方式中,关注对象分子可以为“核酸”,该“核酸”为多核苷酸或寡核苷酸,与此相对地,作为(A3)的化合物的“核苷酸”为单核苷酸或二核苷酸,两者可以这一点来区分。
作为核酸碱基,可列举腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶和尿嘧啶以及这些的修饰碱基等、例如甲基化胞嘧啶、羟甲基化胞嘧啶、甲基化鸟嘌呤、次黄嘌呤(脱氨基化的腺嘌呤、6-羟基脯氨酸)、假尿嘧啶、二氢尿嘧啶、硫尿嘧啶、甲基氨基硒尿嘧啶、牛磺酸甲基尿嘧啶(taurinomethyluracil)、rigisine、胍丁胺基胞嘧啶、古嘌苷、辫苷、怀俄苷、其他包含于基因组DNA、mRNA、tRNA、rRNA等中的修饰核酸碱基等。
核苷为在碱基上键合有核糖或其它的糖的化合物,包括核糖核苷、脱氧核糖核苷等。作为核糖核苷,可列举腺苷、鸟苷、胞苷、尿苷、5-甲基尿苷、和其它的在上述修饰核酸碱基等上键合有核糖的化合物。作为脱氧核糖核苷酸,可列举脱氧腺苷、脱氧鸟苷、脱氧胞苷、胸苷、脱氧尿苷、和其它的在上述修饰核酸碱基等上键合有脱氧核糖的化合物。核苷还包括肌苷(次黄嘌呤上键合有核糖的化合物)、核黄素(维生素B2,在二甲基异咯嗪上键合有经还原而呈链状的核糖(核糖醇)的化合物)等。
核苷酸为在核糖核苷、脱氧核糖核苷等糖残基上键合有磷酸基的化合物。作为核苷酸,可列举腺苷一磷酸(AMP)、腺苷二磷酸(ADP)、腺苷三磷酸(ATP)、鸟苷一磷酸(GMP)、鸟苷二磷酸(GDP)、鸟苷三磷酸(GTP)、胞苷一磷酸(CMP)、胞苷二磷酸(CDP)、胞苷三磷酸(CTP)、尿苷一磷酸(UMP)、尿苷二磷酸(UDP)、尿苷三磷酸(UTP)、其它的在核糖核苷上键合有1个以上的磷酸基的化合物;脱氧腺苷一磷酸(dAMP)、脱氧腺苷二磷酸(dADP)、脱氧腺苷三磷酸(dATP)、脱氧鸟苷一磷酸(dGMP)、脱氧鸟苷二磷酸(dGDP)、脱氧鸟苷三磷酸(dGTP)、脱氧胞苷一磷酸(dCMP)、脱氧胞苷二磷酸(dCDP)、脱氧胞苷三磷酸(dCTP)、胸苷一磷酸(dTMP)、胸苷二磷酸(dDMP)、胸苷三磷酸(dTMP)、脱氧尿苷一磷酸(dUMP)、脱氧尿苷二磷酸(dUDP)、脱氧尿苷三磷酸(dUTP)、其它的在脱氧核糖核苷上键合有1个以上的磷酸基的化合物。核苷酸还包括肌苷酸(肌苷一磷酸)、黄素单核苷酸(FMN)、黄素腺嘌呤二核苷酸(FAD)等。另外,环状AMP(cAMP)、环状GMP(cGMP)之类的在核苷上键合有环状的磷酸基的化合物也包括在核苷酸中。
(A3)的化合物的优选的具体例如下所述。下述的化合物可以为盐和/或水合物。
核酸碱基:腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶、尿嘧啶和次黄嘌呤。
核苷:腺苷、鸟苷、胞苷、尿苷、5-甲基尿苷、脱氧腺苷、脱氧鸟苷、脱氧胞苷、胸苷、脱氧尿苷、肌苷。
核苷酸:腺苷一磷酸、鸟苷一磷酸、胞苷一磷酸、尿苷一磷酸、脱氧腺苷一磷酸、脱氧腺苷二磷酸、脱氧鸟苷一磷酸、脱氧胞苷一磷酸、脱氧胞苷二磷酸、胸苷一磷酸、脱氧尿苷一磷酸、肌苷酸。
(A3)的化合物的更优选的具体例如下所述。下述的化合物可以为盐和/或水合物。
核酸碱基:胞嘧啶。
核苷:胞苷、脱氧尿苷、脱氧胞苷。
核苷酸:5’-肌苷酸。
在本发明的一个方面中,(A3)特别优选为选自胞嘧啶、胞苷、脱氧尿苷、脱氧胞苷、5’-肌苷酸中的化合物或其盐(可以为水合物),尤其是选自胞苷、脱氧胞苷、5’-肌苷酸中的化合物或其盐(可以为水合物)。
在本发明的另一方面中,(A3)特别优选为脱氧胞苷或其盐(可以为水合物)。
(A4)的化合物为通式(III)所示的化合物或其盐,但不包括苹果酸。(A4)的化合物可以为水合物。(A4)的化合物既可以单独使用一种,也可以将两种以上组合使用。
Rx-CRyRzCOOH III
式(III)中,
Rx表示被选自由C
Ry和Rz各自独立地表示氢原子或羟基(其中,至少一者为羟基)或者一起表示氧代基。
作为Rx中的可被取代的羟基,可列举例如被膦酸基取代的羟基。
式(III)中的Rx、Ry和Rz各自的优选例如下所述。
Rx优选为被选自由C
Ry优选为羟基、或与Rz形成氧代基。
Rz优选为氢原子、或与Ry形成氧代基。
化合物(III)的优选的具体例如下所述。
化合物(III-i):Rx为可被选自由C
化合物(III-ii):Rx为可被选自由C
化合物(III)的更优选的具体例如下所述。
化合物(III-a):Rx为被羟基和磷酸基取代的丁基、Ry为羟基、Rz为氢原子的化合物,例如6-磷酸-D-葡萄糖酸。
化合物(III-b):Rx为被C
化合物(III-c):Rx为被羧基取代的乙基、Ry为羟基、Rz为氢原子的化合物,例如2-羟基戊二酸。
在本发明的一个方面中,(A4)特别优选为选自6-磷酸-D-葡萄糖酸、3-甲基-2-氧代丁酸、2-羟基戊二酸中的化合物或其盐(可以为水合物)。
在本发明的另一方面中,(A4)特别优选为6-磷酸-D-葡萄糖酸或其盐(可以为水合物)。
(A5)的化合物为选自由肌酸酐、羟脯氨酸、1,3-丁二醇、曲恩汀、D-纤维二糖、1,3-二甲基脲、泛酰内酯和三甲双酮组成的组中的至少1种或其盐。(A5)的化合物可以为水合物。
在本发明的一个方面中,(A5)特别优选为选自肌酸酐、羟脯氨酸、1,3-丁二醇、1,3-二甲基脲、泛酰内酯、三甲双酮中的化合物或其盐(可以为水合物)。
作为(A1)~(A5)的各定义中所包含的盐,优选药理学上可接受的盐,可列举例如与无机碱的盐、与有机碱的盐、与无机酸的盐、与有机酸的盐、与碱性或酸性氨基酸的盐。
作为与无机碱的盐的优选例,可列举:钠盐、钾盐等碱金属盐;钙盐、镁盐等碱土金属盐;铝盐、铵盐。优选钠盐、钾盐、钙盐、镁盐,更优选钠盐、钾盐、镁盐。
作为与有机碱的盐的优选例,可列举与三甲基胺、三乙基胺、吡啶、甲基吡啶、乙醇胺、二乙醇胺、三乙醇胺、氨基丁三醇[三(羟甲基)甲基胺]、叔丁基胺、环己基胺、苯甲基胺、二环己基胺、N,N-二苯甲基乙二胺的盐。
作为与无机酸的盐的优选例,可列举与氢氟酸、盐酸、氢溴酸、氢碘酸、硝酸、硫酸、磷酸的盐。优选与盐酸的盐、与磷酸的盐。
作为与有机酸的盐的优选例,可列举与甲酸、乙酸、三氟乙酸、邻苯二甲酸、富马酸、草酸、酒石酸、马来酸、柠檬酸、琥珀酸、苹果酸、甲磺酸、苯磺酸、对甲苯磺酸的盐。
作为与碱性氨基酸的盐的优选例,可列举与精氨酸、赖氨酸、鸟氨酸的盐。
作为与酸性氨基酸的盐的优选例,可列举与天冬氨酸、谷氨酸的盐。
(B)盐与(A1)~(A5)各定义中所包含的盐不同,为本发明的转导用溶液所含有的化合物。本发明中,对应于(A1)~(A5)的盐不包括在(B)盐中。
作为(B)盐,可列举例如锂盐、钠盐、镁盐、钾盐、钙盐、铷盐、铯盐等碱金属盐和碱土金属盐;碳酸盐、磺酸盐、硫酸盐等无机酸盐;天冬氨酸盐等有机酸盐;硫化物;氯化物、溴化物、碘化物、氟化物等卤化物。(B)盐中,优选碱金属盐和碱土金属盐、有机酸盐以及氯化物,更优选例如氯化钠、氯化镁、氯化钾、天冬氨酸镁等之类的由碱金属或碱土金属(阳离子)与有机酸或卤原子(阴离子)形成的盐。(B)盐优选为这些中的两种以上的组合。作为两种以上(B)盐的组合,没有特别限定,有氯化钠、氯化镁与氯化钾这3种的组合。使用氯化钠、氯化镁与氯化钾这3种的组合时,作为其摩尔比,优选氯化钠为0.75~0.95、氯化镁为0.05~0.15、氯化钾为0.025~0.075。
关于作为本发明的转导用溶液中所含的成分(A1)~(A5)和(B)使用的化合物的种类(组合)和其浓度,从向细胞内导入关注对象分子的效率等观点出发,例如可根据对象细胞的种类来适当调节,没有特别限定。
(A1)~(A5)的化合物在转导用溶液中的浓度通常为0.1mM~1000mM,但最适浓度根据转导物质而不同。在2’-脱氧胞苷的情况下,优选为12.5mM以上,更优选为100mM~250mM。泛酸钙的情况下,优选为160mM至250mM。精氨基琥珀酸二钠盐水合物的情况下,优选为30mM以上,更优选为100mM~250mM。3-甲基2-氧代丁酸钠的情况下,优选为40mM以上,更优选为100mM~200mM。1,3-丁二醇的情况下,优选为0.6mM以上,更优选为0.6mM~3mM。1,3-二甲基脲的情况下,优选为30mM以上,更优选为60mM~500mM。2’-脱氧尿苷的情况下,优选为10mM以上,更优选为100mM以上。6-磷酸-D-葡萄糖酸的情况下,优选为60mM以上,更优选为100mM~500mM。肌酸酐的情况下,优选为5mM以上,更优选为100mM~500mM。胞嘧啶的情况下,优选为20mM以上,更优选为25mM~250mM。D(+)-纤维二糖的情况下,优选为3mM以上,更优选为200mM~500mM。2-脱氧-D-葡萄糖-6-磷酸的情况下,优选为30mM以上,更优选为125mM~500mM。α-D-葡萄糖-1-磷酸优选为60mM以上,更优选为125mM~500mM。N-氨甲酰基-L-天冬氨酸的情况下,优选为60mM以上,更优选为125mM~500mM。L-肌肽的情况下,优选为1mM以上,更优选为60mM~500mM。米格列醇的情况下,优选为1mM以上,更优选为60mM~250mM。肌苷-5’-磷酸二钠盐水合物的情况下,优选为100mM以上,更优选为250mM~500mM。2-羟基戊二酸的情况下,优选为1mM以上,更优选为60mM~500mM。1-甲基-L-组氨酸的情况下,优选为10mM以上,更优选为100mM~250mM。胞苷的情况下,优选为100mM以上,更优选为125mM~500mM。6-磷酸-D-葡萄糖酸的情况下,优选为30mM以上,更优选为100mM~250mM。
关于(B)盐在转导用溶液中的浓度,一种时或两种以上组合时的合计浓度通常为200mM以上,优选为200~2000mM,更优选为300mM~900mM。
(A1)~(A5)的化合物和(B)盐可通过公知的方法来制造(合成、分离、纯化等),另外也可以使用市售的产品。
本发明的转导用溶液可通过将(A1)~(A5)中的至少一种化合物和(B)盐溶解于合适的溶剂中来制备。
用于溶解成分(A1)~(A5)和(B)的溶剂只要能够以规定的量溶解这些成分就没有特别限定,优选缓冲液(buffer)。作为缓冲液,可列举例如乙酸缓冲液、柠檬酸缓冲液、2-吗啉代乙磺酸(MES)缓冲液、磷酸缓冲液等酸性缓冲液;和4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)缓冲液、三(羟甲基)氨基甲烷(Tris)缓冲液、磷酸缓冲液、磷酸缓冲生理盐水(PBS)等中性缓冲液。
本发明的转导溶液的渗透压没有特别限定,通常为300mOsmol/kg以上,优选为300~2000mOsmol/kg,更优选为700~1700mOsmol/kg。
需要说明的是,本发明中,即使不伴随有公知的转导(转染)方法中所使用的选自病毒质粒、纳米粒子、脂质体、阳离子性脂质、囊泡或其它脂质泡囊等(包括胶束)、细胞膜透过性肽等中的跨膜载体,也能够发挥本发明的作用效果,能够将关注对象分子以高的效率导入到细胞内。
以下对本发明的转导方法进行说明。
本发明的转导方法至少包括使细胞与关注对象分子和转导用溶液接触的步骤(本说明书中称为“接触步骤”),可根据需要进一步包括与向细胞内导入关注对象分子相关的其它步骤。另外,本发明的转导方法中为了向细胞内导入关注对象分子而使用本说明书中记载的规定的转导用溶液,此外的技术事项可基本上沿用使用以往的溶液向细胞内导入关注对象分子的方法。
需要说明的是,本发明中即使不进行公知的转导(转染)方法中使用的电穿孔等特殊处理也能够发挥本发明的作用效果,能够将关注对象分子以高的效率导入细胞内。
·关注对象分子
本发明中,使用转导用溶液而导入细胞内的关注对象分子只要是能在细胞内发挥期望目的的分子即可,没有特别限定。作为关注对象分子,可列举例如核酸、蛋白质和它们的复合物、以及高分子化合物(例:葡聚糖),作为优选的关注对象分子,可列举例如核酸、蛋白质和它们的复合物。
“核酸”只要为核苷酸和与该核苷酸具有同等功能的分子聚合而得到的分子,则任何分子均可,可列举例如:作为核糖核苷酸的聚合物的RNA、作为脱氧核糖核苷酸的聚合物的DNA、核糖核苷酸和脱氧核糖核苷酸混合而成的聚合物、和包含核苷酸类似物的核苷酸聚合物,进一步地,可以为包含核酸衍生物的核苷酸聚合物。另外,核酸可以为单链核酸或双链核酸。另外,双链核酸还包括将一条链与另一条链在严谨条件下进行杂交的双链核酸。
作为核苷酸类似物,只要是为了与RNA或DNA相比提高核酸酶抗性或使其稳定化、为了提高与互补链核酸的亲和性、或为了提高细胞透过性、或为了使其可视化而对核糖核苷酸、脱氧核糖核苷酸、RNA或DNA加以修饰而成的分子,则任何分子均可。作为核苷酸类似物,可以为天然存在的分子或非天然的分子,可列举例如糖部修饰核苷酸类似物、磷酸二酯键修饰核苷酸类似物等。
作为糖部修饰核苷酸类似物,只要是对核苷酸的糖的化学结构的一部分或全部添加或置换任意的化学结构物质而成的物质,则任何物质均可,作为其具体例,可列举用2’-O-甲基核糖进行置换而成的核苷酸类似物、用2’-O-丙基核糖进行置换而成的核苷酸类似物、用2’-甲氧基乙氧基核糖进行置换而成的核苷酸类似物、用2’-O-甲氧基乙基核糖进行置换而成的核苷酸类似物、用2’-O-[2-(胍鎓)乙基]核糖进行置换而成的核苷酸类似物、用2’-氟核糖进行置换而成的核苷酸类似物、将糖部置换为吗啉代环而成的核酸类似物(吗啉代核酸)、通过向糖部导入交联结构而具有2个环状结构的桥结构型人工核酸(BridgedNucleic Acid)(BNA)、更具体而言2’位的氧原子与4’位的碳原子介由亚甲基而桥接的锁式人工核酸(Bridged Nucleic Acid)(LNA)以及亚乙基桥结构型人工核酸(Ethylenebridged nucleic acid)(ENA)[Nucleic Acid Research,32,e175(2004)]、2’位的碳原子与4’位的碳原子介由酰胺键而桥接的酰胺桥结构型人工核酸(Amido-Bridged NucleicAcids)(AmNA),还可列举肽核酸(PNA)[Acc.Chem.Res.,32,624(1999)]、氧肽核酸(OPNA)[J.Am.Chem.Soc.,123,4653(2001)]和肽核糖核酸(PRNA)[J.Am.Chem.Soc.,122,6900(2000)]等。
作为磷酸二酯键修饰核苷酸类似物,只要是对核苷酸的磷酸二酯键的化学结构的一部分或全部添加或置换任意的化学物质而成的物质,则任何物质均可,作为其具体例,可列举被置换为硫代磷酸酯键的核苷酸类似物、被置换为N3’-P5’-膦酰胺酯键的核苷酸类似物等[细胞工学,16,1463-1473(1997)][RNAi法和反义法、讲谈社(2005)]。
作为核酸衍生物,只要是为了与核酸相比提高核酸酶耐受性、为了稳定化、为了提高与互补链核酸的亲和性、为了提高细胞透过性、或为了可视化而对该核酸添加其它化学物质而成的分子,则任何分子均可,作为其具体例,可列举5’-添加多胺的衍生物、添加胆甾醇的衍生物、添加类固醇的衍生物、添加胆汁酸的衍生物、添加维生素的衍生物、添加Cy5的衍生物、添加Cy3的衍生物、添加6-FAM的衍生物、和添加生物素的衍生物等。
作为核酸的具体例,可列举mRNA、siRNA、shRNA、miRNA、miRNA mimic、反义核酸、核酶、诱饵核酸、适体、质粒DNA、粘粒DNA、BAC DNA以及CRISPR系统中的引导RNA(gRNA)。这些核酸可以为实施了人工修饰的类似物或衍生物。
作为蛋白质的具体例,可列举酶、转录因子、细胞因子、组织生长因子、抗体、治疗用蛋白质。作为酶,可列举例如限制酶、内切核酸酶、Cre重组酶、翻转酶等、用于靶向核酸(特别是靶细胞内的基因组DNA)并改变其碱基序列的酶。作为内切核酸酶,可列举例如TAL效应物核酸酶(TALEN)、锌指核酸酶(ZFN)、大范围核酸酶(归巢核酸酶)、引导分子(RNA)诱导型内切核酸酶(例:Cas9、Cas12a)、其它的用于基因组编辑系统的内切核酸酶。
作为本发明中的关注对象分子的优选的具体例,可列举用于诱导细胞中的目的基因座的基因改造的、所谓的基因组编辑用物质,特别是用于通过CRISPR系统诱导基因改造的物质。具体而言,本发明的一个优选实施方式中,核酸为CRISPR系统中是引导RNA(gRNA),蛋白质为CRISPR系统中的RNA诱导型核酸酶。本发明的一个优选实施方式中,关注对象分子为CRISPR系统中的gRNA与Cas9等RNA诱导型核酸酶的复合物。
关于CRISPR系统的基本情况是众所周知的,各种应用情况也是公知的。本领域技术人员可根据目的设计、选择、制造合适的CRISPR系统的核酸、蛋白质、其它各要素、并且使用它们进行利用CRISPR系统的基因改造。
“引导RNA”可以为由crRNA和tracrRNA连接而成的1条RNA的形态、即嵌合RNA(有时也称为单引导RNA、sgRNA等),也可以为未连接的各自为1条的RNA(两条RNA的组合或更多条RNA的组合)的形态。另外,引导RNA可以为靶向1个碱基序列的形态(1条sgRNA、或1组crRNA和tracrRNA)で,也可以为靶向2个以上碱基序列的形态(两条以上的sgRNA、或两组以上的crRNA和tracrRNA)。
crRNA与细胞内的基因组或基因座中的、作为基因改造靶点的碱基序列(本说明书中有时称为“靶序列”)进行杂交,包含17~20个碱基左右的核酸序列(本说明书中有时称为“靶点识别序列”)。靶序列与被CRISPR系统识别的短序列(PAM(原间隔序列邻近基序))邻接。PAM的序列和长度条件根据所使用的核酸酶的种类而不同,PAM典型情况下为与靶序列邻接的2~5个碱基对序列。
靶序列只要满足上述的PAM的条件就没有特别限定,可根据目的适当选择。靶序列典型情况下与基因疾病有关,是包含于可成为基因治疗对象的基因座中的序列、或者包含于与细菌或病毒等病原体的感染有关的基因座中的序列。
本发明的一个优选实施方式中,靶序列为包含肌养蛋白基因的基因座中的碱基序列。更具体而言,靶序列为通过对其碱基序列进行改造(缺失或插入)来修复肌养蛋白基因的移码突变或无义突变、由此能够预防或治疗肌养蛋白异常症(例如肌营养不良症(例:杜氏肌营养不良症、贝氏肌营养不良症)、肌养蛋白基因型扩张型心肌病)的碱基序列。或者,靶序列为能够通过修复移码突变或无义突变而产生修复型肌养蛋白的、肌养蛋白基因上的碱基序列。
肌养蛋白异常症是指:以肌养蛋白基因突变为原因的由功能缺失型或功能异常型肌养蛋白引起的各种疾病,包括杜氏(Duchenne)肌营养不良症、贝氏(Becker)肌营养不良症、肌养蛋白基因相关扩张型心肌病等。通常以骨骼肌障碍为主要症状,但是也存在观察不到骨骼肌症状的病例。有时也伴有高肌酐血症、肌红蛋白尿症、扩张型心肌病、认知功能障碍等。
肌营养不良症被定义为“以骨骼肌变性、坏死为主要病变,临床上可观察到进行性的肌力下降的遗传性疾病”。作为肌营养不良症,已知有杜氏肌营养不良症、贝氏肌营养不良症、Emery-Dreifuss型肌营养不良症、肢带型肌营养不良症、先天性肌营养不良症、三好型肌营养不良症、远端型肌营养不良症、面肩肱型肌营养不良症、以及强直性肌营养不良等。
杜氏肌营养不良症是小儿肌营养不良症中患者人数最多的疾病,发病率为每10万人中4~5名。以进行性的肌肉萎缩为主要症状,病因是X染色体上的肌养蛋白基因因突变而功能不全。杜氏肌营养不良症中,有一半以上的患者具有单个或多个外显子的缺失。因肌养蛋白基因突变而产生蛋白质读码框移位,中间出现终止密码子则无法合成肌养蛋白,由此引起一系列的症状。
肌养蛋白基因是存在于X染色体上的、碱基数超过220万的巨大基因。根据转录起始点的不同而存在各种同种型,已知在全身表达的Dp71、在末梢神经细胞中表达的Dp116、在脑和肾脏中表达的Dp140、在视网膜中表达的Dp260、在浦肯野神经细胞中表达的Dp417p、在脑中表达的Dp427b、以及在骨骼肌中表达的Dp427m等。其中,由Dp427m同种型产生的肌养蛋白是主要在肌细胞内表达的蛋白质,通过存在于N末端侧的肌动蛋白结合结构域与细胞骨架肌动蛋白结合,通过存在于C末端侧的高半胱氨酸结构域与肌养蛋白聚糖复合物结合,与肌动蛋白一起构成细胞骨架。Dp427m同种型的肌养蛋白基因由79个外显子构成。
杜氏肌营养不良症患者的情况下,由于肌养蛋白基因的任一外显子具有缺失或重复突变,或者由于外显子中的碱基的点突变(无义突变)或插入缺失突变(移码突变),几乎不表达功能性的肌养蛋白(通过蛋白质印迹法检测时,蛋白质量为健康人的3%以下)。另一方面,症状比杜氏肌营养不良症轻的贝氏肌营养不良症患者的情况下,即使存在外显子的缺失、碱基的点突变也不在中间产生终止密码子的情况下,表达氨基酸序列比正常的肌养蛋白短或部分氨基酸被置换的肌养蛋白。
作为肌养蛋白基因的突变,在杜氏肌营养不良症和贝氏肌营养不良症中,单个或多个外显子的缺失占一半以上。作为缺失特别常见的部位,已知有外显子44与外显子55之间。可以根据肌养蛋白基因的缺失外显子的部位、例如参照已发表的论文等(例如vanDeutekom JC,van Ommen GJ.,Nat Rev Genet.2003),来确认以哪个外显子为对象进行外显子跳跃能够表达合适的修复型肌养蛋白。另外,作为使用基因组编辑来表达修复型肌养蛋白的方法,除了外显子跳跃以外还可以通过向肌养蛋白基因中导入微小缺失或插入来调节读码框的方法、或通过同源重组等插入所缺失的外显子来实施。
当上述那样的肌养蛋白基因发生异常时,可以通过下述任一操作来修复其的异常:(i)通过使1个或2个以上的外显子不整合到mRNA中(跳过),并且以不发生移码的方式将其前后的外显子彼此连接;(ii)通过插入1个或2个以上碱基或者使其缺失,来修正移码;(iii)敲入发生缺失的外显子;等。在上述(i)或(ii)时,将会产生比正常的肌养蛋白的氨基酸序列短或长、或者一部分氨基酸被置换的肌养蛋白。另外,通过上述(ii)或(iii),还能够产生正常的肌养蛋白。通过这样的肌养蛋白基因的修正,蒙古预防或治疗肌营养不良症等疾病。
人的肌养蛋白基因的核苷酸序列例如可由National Center for Biotechnology Information获得(https://www.ncbi.nlm.nih.gov/gene/1756)。
修复型肌养蛋白是指:作为基因组编辑的结果的、恢复了表达的肌养蛋白。特别地,对于具有移码突变或无义突变的肌养蛋白基因而言,是指通过使用基因组编辑而恢复表达的、保持了N末端的肌动蛋白结合结构域和C末端的高半胱氨酸结构域的肌养蛋白。当由于外显子重复而发生移码突变时,在通过基因组编辑而跳过了该重复外显子中的一者时,有时也会恢复表达与健康型具有100%同源性的修复型肌养蛋白。作为修复型肌养蛋白,特别是指跳过了缺失外显子44的人肌养蛋白基因中的外显子45、而将外显子43和外显子46连接的mRNA所翻译出的人肌养蛋白。此外,修复型肌养蛋白还包括例如跳过了缺失外显子12-44、18-44、46-47、46-48、46-49、46-51、46-53或46-55的人肌养蛋白基因中的各规定外显子而产生的人肌养蛋白,但不限于这些。能否产生修复型肌养蛋白这一点例如可通过利用PCR来检测细胞内的编码修复型肌养蛋白的mRNA来确认。或者,也可以使用识别肌养蛋白的抗体进行蛋白质印迹法,根据肌养蛋白的分子量来进行确以。
另外,在本发明的优选的另一个实施方式中,靶序列为包含肌生成抑制蛋白基因的基因座中的碱基序列。更具体而言,靶序列为通过对其碱基序列进行改造(缺失或插入)来诱导肌生成抑制蛋白基因的移码突变或无义突变、从而使肌生成抑制蛋白的功能缺失或减弱、由此能够诱导肌肥大的碱基序列。
本发明的一个实施方式中,优选引导RNA的至少一部分为如本说明书所记载的核苷酸类似物。作为核苷酸类似物,优选糖部修饰核苷酸和磷酸二酯键修饰核苷酸,更具体而言,优选2’-O-甲基核糖和磷酸二酯键置换为硫代磷酸酯键的置换体。引导RNA中,优选至少序列的3’和5’这两个末端各一个碱基为核苷酸类似物,更优选至少序列的3’和5’这两个末端的各两个碱基或各三个碱基为核苷酸类似物。
在引导RNA为crRNA和tracrRNA的嵌合RNA时,优选至少其序列的3’和5’这两个末端各一个碱基为核苷酸类似物。在引导RNA为crRNA与tracrRNA未连接的各自为1条的RNA(两条RNA的组合)或更多条RNA的形态时,优选至少各RNA序列的3’和5’这两个末端的各一个碱基为核苷酸类似物(例如,优选crRNA的3’和5’这两个末端、和tracrRNA的3’和5’这两个末端为核苷酸类似物)。
“RNA引导性内切核酸酶”包含至少1个核酸酶结构域和与gRNA相互作用的至少1个结构域,是通过与gRNA形成复合物而被诱导至靶位点的蛋白质。
RNA引导性内切核酸酶可来自CRISPR系统。CRISPR系统可以设为1类中的I型、III型、IV型、或2类中的II型、V型和VI型系统。作为合适的CRISPR/Cas蛋白的非限定例子,包括Cas3、Cas4、Cas5、Cas5e(或CasD)、Cas6、Cas6e、Cas6f、Cas7、Cas8a1、Cas8a2、Cas8b、Cas8c、Cas9、Cas10、Cas10d、Cas12a(或Cpf1)、Cas12b(或C2c1)、Casl2c、Cas13a1(或C2c2)、Casl3a2、Cas13b、CasF、CasG、CasH、Csy1、Csy2、Csy3、Cse1(或CasA)、Cse2(或CasB)、Cse3(或CasE)、Cse4(或CasC)、Csc1、Csc2、Csa5、Csn2、Csm2、Csm3、Csm4、Csm5、Csm6、Cmr1、Cmr3、Cmr4、Cmr5、Cmr6、Csb1、Csb2、Csb3,Csx17、Csx14、Csx10、Csx16、CsaX、Csx3、Csz1、Csx15、Csf1、Csf2、Csf3、Csf4和Cu1966。
一个方式中,RNA引导性内切核酸酶来自2类II型的CRISPR系统。特定的方式中,RNA引导性内切核酸酶来自Cas9蛋白。Cas9蛋白可以来自化脓性链球菌(Streptococcuspyogenes)、嗜热链球菌、链球菌属、金黄色葡萄球菌、葡萄球菌属、达松维尔拟诺卡氏菌、始旋链霉菌、绿色产色链霉菌(Streptomyces viridochromogenes)、玫瑰链孢囊菌、酸土脂环酸芽孢杆菌、假蕈状芽孢杆菌、还原硒酸盐芽孢杆菌、西伯利亚微小杆菌(Exiguobacteriumsibiricum)、新凶手弗朗西丝菌(Francisella novicida)、保加利亚乳杆菌、唾液乳杆菌、嗜热脂肪土芽孢杆、海洋微颤菌(Micorscilla marina)、伯克霍尔德氏菌、食萘极单胞菌、单胞菌属的种、海洋固氮蓝藻(Crocosphaera watsonii)、蓝丝菌属、铜绿微囊藻(Microcystis aeruginosa)、聚球藻属、阿拉伯糖醋盐杆菌、丹氏制氨菌(Ammonifexdegensii)、热解纤维素菌(Caldicellulosiruptor becscii)、空肠弯曲菌(Campylobacterjejuni)、结肠弯曲菌(Campylobacter coli)、脑膜炎奈瑟菌(Neisseria meningitides)、金矿菌(Candidatus Desulforudis)、肉毒梭菌、艰难梭菌、大芬戈尔德菌、嗜热盐碱厌氧菌(Natranaerobius thermophilusm)、热丙酸盐暗色厌氧香肠状菌(Pelotomaculumthermopropionicum)、喜温嗜酸硫杆菌(Acidithiobacillus caldus)、氧化亚铁硫杆菌(Acidithiobacillusferrooxidans)、酒色别样着色菌、海杆菌属、嗜盐亚硝化球菌(Nitrosococcus halophilus)、瓦氏亚硝化球菌(Nitrosococccus watsoni)、游海假交替单胞菌、消旋纤线杆菌(Ktedonobacter racemifer)、调查甲烷盐菌(Methanohalbiumevestigatum)、多变鱼腥藻、泡沫节球藻、念珠藻属、极大节旋藻、钝顶节旋藻、节旋藻属、鞘丝藻属、原型微鞘藻(Microcoleus chthonoplastes)、颤藻属、运动石袍菌、非洲栖热腔菌)或深海单细胞蓝藻。
一个方式中,RNA引导性内切核酸酶为来自2类V型的CRISPR-Cas12a/Cpf1系统。特定的方式中,RNA引导性内切核酸酶来自Cpf1蛋白。Cpf1蛋白可以来自氨基酸球菌属(Acidaminococcus)、毛螺菌科(Lachnospiraceae)、莱茵衣藻(Chlamydomonasreinhardtii)、新凶手弗朗西斯菌(Francisellanovicida)。
CRISPR/Cas蛋白可以为野生型CRISPR/Cas蛋白、修饰型CRISPR/Cas蛋白、或者野生型或修饰型CRISPR/Cas蛋白的片段。CRISPR/Cas蛋白可以为了增加核酸结合亲和性和/或特异性、改变酶活性或改变蛋白质其它特性而进行了修饰。
RNA引导性核酸酶可以为Cas核酸酶或Cas切口酶。在此,Cas核酸酶或Cas切口酶是指CRISPR/Cas系统中必需的蛋白质成分,是指在与被称为CRISPR RNA(crRNA)和反式激活crRNA(tracrRNA)的两种RNA形成复合物的情况下具有活性的内切核酸酶或切口酶。切口酶是指仅在一个DNA链中切出切口(nick)的DNA切割酶。通常,Cas9蛋白包含至少两个核酸酶(即,DNase)结构域。例如,Cas9蛋白可以包含RuvC样核酸酶结构域和HNH样核酸酶结构域。RuvC和HNH结构域为了在DNA中进行双链的切割而协作地对单链进行切割(Jinek et al.,Science,337:816-821)。一个方式中,来自Cas9的蛋白质可以以仅包含一个功能性核酸酶结构域(RuvC样或HNH样核酸酶结构域中的任一者)的方式进行修饰。例如,来自Cas9的蛋白质可以以发生缺失或突变以使核酸酶结构域中的一个已不发挥功能(即,不具有核酸酶活性)的方式来进行修饰。在核酸酶结构域中的一个为非活性的方式中,来自Cas9的蛋白质可以在双链核酸中导入切口,但无法将双链DNA切断。例如,RuvC样结构域中的天冬氨酸向丙氨酸的转换(D10A)是将来自Cas9的蛋白质转换为切口酶。同样地,HNH结构域中的组氨酸向丙氨酸的转换(H840A或H839A)是将来自Cas9的蛋白质转换为切口酶。各核酸酶结构域可以使用定点诱变法、PCR介导的诱变法和全基因合成、以及该技术领域中公知的其他方法等周知的方法进行修饰。
RNA引导性核酸酶可以使用特别是来自链球菌属菌(Streptococcus sp.)或葡萄球菌属菌(Staphylococcus sp.)、新凶手弗朗西斯菌(Francisella novicida)、空肠弯曲菌(Campylobacter jejuni)的Cas核酸酶或Cas切口酶。其中,作为来源,在链球菌属菌中优选化脓性链球菌(S.pyogenes),在葡萄球菌属菌中优选金黄色葡萄球菌(S.aureus)。来自化脓性链球菌的Cas9核酸酶或Cas9切口酶识别NGG或NAG三核苷酸作为PAM序列。
作为RNA引导性核酸酶,优选Cas9。本发明的一个优选实施方式中,Cas9为来自化脓性链球菌(S.pyogenes)的Cas9(SpCas9)。作为Cas9,已知来自各种细菌或古细菌的Cas9,在本发明中,除了SpCas9以外,还可以使用例如来自金黄色葡萄球菌(S.aureus)的Cas9(SaCas9)等具有所期望的核酸酶活性的Cas9。
本发明的转导方法中的关注对象分子的使用量可根据转导的条件、目的等而变更,本领域技术人员可适当地进行调节。例如,关注对象分子为gRNA时的使用量相对于1×10
·细胞
作为利用本发明的转导用溶液导入关注对象分子的对象细胞,没有特别限定,可以根据目的适当地进行选择。作为对象细胞,可列举例如间充质干细胞、神经干细胞、皮肤干细胞、脾细胞、神经细胞、神经胶质细胞、胰岛B细胞、骨髓细胞、系膜细胞、朗格汉斯细胞、表皮细胞、上皮细胞、内皮细胞、成纤维细胞、纤维细胞、肌细胞(例如骨骼肌细胞、心肌细胞、成肌细胞、肌卫星细胞、平滑肌细胞)、脂肪细胞、血细胞(例如巨噬细胞、T细胞、B细胞、自然杀伤细胞、肥大细胞、白细胞、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、单核细胞、巨核细胞、造血干细胞)、滑膜细胞、软骨细胞、骨细胞、成骨细胞、破骨细胞、乳腺细胞、肝细胞、间质细胞、卵细胞和精细胞、以及可分化诱导为这些细胞的前体细胞、干细胞(例如包括诱导性多能干细胞(iPS细胞)、胚胎干细胞(ES细胞))、原始生殖细胞、卵母细胞和受精卵。这些细胞可以为癌变的细胞(癌细胞)。
在生物体外(ex vivo)或培养环境下(in vitro)进行本发明的转导方法时,对象细胞所来自的组织或脏器、或者在生物体内(in vivo)进行本发明的转导方法时对象细胞所存在的组织或器官只要是包含对象细胞的组织或器官就没有特别限定。作为包含对象细胞的组织或器官,可列举例如脑、脑的各部位(例如嗅球、扁桃核、大脑基底核、海马、丘脑、下丘脑、丘脑底核、大脑皮质、延髓、小脑、枕叶、额叶、颞叶、壳核、尾状核、胼胝体、黑质)、脊髓、下垂体、胃、胰腺、肾脏、肝脏、生殖腺、甲状腺、胆囊、骨髓、肾上腺、皮肤、肺、消化道(例如大肠、小肠)、血管、心脏、胸腺、脾脏、颌下腺、外周血、外周血细胞、前列腺、胎盘、子宫、骨、关节和肌肉(例如,骨骼肌、平滑肌、心肌)等。本发明的一个优选实施方式中,包含对象细胞的组织或器官为肌肉、脑和脑的各部位。本发明的一更优选实施方式中,包含对象细胞的组织或器官为肌肉。这些组织或器官可以为癌变的组织或器官(癌组织等)。
对象细胞可以为来自人的细胞,也可以为来自人以外的哺乳动物(非人哺乳动物)的细胞。作为非人哺乳动物,可列举例如小鼠、大鼠、仓鼠、豚鼠、兔子、狗、猫、猪、牛、马、绵羊、人以外的灵长类(非人灵长类、例:食蟹猴、恒河猴、黑猩猩)。
本发明的一个优选实施方式中,对象细胞为肌细胞(例:心肌细胞、骨骼肌细胞、肌卫星细胞)、神经干细胞、神经细胞、神经胶质细胞、成纤维细胞、间充质干细胞、血细胞或iPS细胞。本发明的一更优选实施方式中,对象细胞为肌细胞,尤其是骨骼肌细胞或肌卫星细胞。作为肌细胞,可列举例如:由人(患者或健康人)或其它哺乳动物(例如非人灵长类(例:食蟹猴、恒河猴、黑猩猩)、牛、猪、小鼠、大鼠等疾病模型动物)采集的肌细胞、存在于活体内的(例:人等的活体内的组织中的)肌细胞、肌细胞株、和由干细胞(例:iPS细胞、ES细胞)分化诱导而得到的肌细胞。
·使细胞与关注对象分子和转导用溶液接触的步骤
本发明的转导方法中,使细胞与关注对象分子和转导用溶液接触的方式没有特别限定,可以选择能够以期望的效率向细胞内导入关注对象分子的各种方式。
在生物体外(ex vivo)或培养环境下(in vitro)进行本发明的转导方法时,可以通过将关注对象分子和转导用溶液(根据需要,以将它们预先混合而成的溶液的形态)添加到培养基中,用该培养基培养对象细胞,由此使关注对象分子和转导用溶液与细胞接触。
作为培养基,可以使用适合于培养包含对象细胞的细胞群的、现有公知的培养基。可使用例如BME培养基、BGJb培养基、CMRL 1066培养基、Glasgow MEM培养基、改良的MEM(IMEM)培养基、改良的MDM(IMDM)培养基、Medium 199培养基、伊戈尔MEM培养基、αMEM培养基、DMEM培养基(高葡萄糖、低葡萄糖)、DMEM/F12培养基、HAM培养基、RPMI 1640培养基、Fischer′s培养基、StemFit AK02N、灵长类ES细胞培养基和这些的混合培养基等。培养基的种类和使用量可以由本领域技术人员根据细胞、培养条件来适当设定。
培养基中,可以根据需要添加必需或非必需氨基酸、GlutaMAX(产品名)、维生素、抗生素(例如青霉素、链霉素或它们的混合物)、抗菌剂(例如两性霉素B)、抗氧化剂、丙酮酸、缓冲剂、无机盐类等添加物。添加物的种类和使用量可以由本领域技术人员根据细胞、培养条件来适当设定。
在培养环境下(in vitro)使细胞与关注对象分子和转导用溶液接触的情况下,该步骤的时间(期间)没有特别限定,可以设为能达到期望的导入效率时间,通常为10分钟~180分钟、优选15分钟~60分钟。期间(时间)以外的各种培养条件、例如温度、气氛(二氧化碳浓度)等也可以由本领域技术人员适当调节。
在生物体内(in vivo)进行本发明的转导方法的情况下,将关注对象分子混合到转导用溶液中,制成静脉内注射、动脉内注射、肌肉内注射、皮下注射、腹腔内注射等注射剂并给药于生物体,由此能够使关注对象分子和转导用溶液与对象细胞接触。用于这样的实施方式的转导用溶液除了成分(A1)~(A5)和(B)以外还可以包含制成注射剂时药学上可接受的添加剂,例如生理盐水、缓冲生理盐水、注射用水、稳定剂、增溶剂、表面活性剂、缓冲剂、防腐剂、等渗剂、填充剂、润滑剂、增稠剂等。
本发明的一个优选实施方式中,为了在肌细胞中通过CRISPR系统改造肌养蛋白基因、换言之为了通过CRISPR系统改造肌养蛋白基因得到改造的细胞或者为了通过改造肌养蛋白基因而产生修复型肌养蛋白,而利用转导方法。
以下对本发明的细胞制造方法进行说明。
本发明的细胞制造方法至少包括使细胞与关注对象分子和转导用溶液接触的步骤(接触步骤),根据需要可以还包括与制造被转导了关注对象分子的细胞有关的其它步骤。另外,本发明的细胞制造方法中为了向细胞内导入关注对象分子而使用本说明书中记载的规定的转导用溶液,此外的技术事项可基本上沿用使用以往的溶液制造导入了关注对象分子的细胞的方法。
本发明的细胞制造方法所包括的接触步骤在与本发明的转导方法的关系方面与本说明书中记载的接触步骤相同。
作为本发明的细胞制造方法可以根据需要进一步包括的、与制造被转导了关注对象分子的细胞有关的其它步骤,可列举例如:(a)在接触步骤之后进行的、对导入了关注对象分子的细胞进行选择的步骤;(b)在接触步骤之前进行的、由iPS细胞等多能性干细胞或其它干细胞等分化诱导对象细胞的步骤。
上述步骤(a)中的、导入了关注对象分子的细胞的选择可以使用公知的方法来进行。例如,在关注对象分子为CRISPR系统用的物质(代表性的是gRNA与Cas9蛋白的复合物)时,可以通过碱基序列的PCR和测序、或通过利用电泳确认表达蛋白来选择导入了关注对象分子、进行了期望的基因改造的细胞。或者,将抗药基因、编码荧光蛋白的基因、其它的阳性选择标记基因或阴性选择标记基因与关注对象分子一起导入细胞,进行与各基因对应的处理(例如,向培养基中添加与抗药基因对应的药剂;或者,照射与荧光蛋白对应的激发波长的光,并且用荧光显微镜、细胞分选仪等检测通过该照射而发出的荧光;或者,添加识别由基因生成的蛋白质的抗体,对发生结合的抗体进行荧光标记,通过荧光显微镜、细胞分选仪等检测所发出的荧光),由此可以选择导入了关注对象分子的细胞。
上述步骤(b)中的、由iPS细胞等多能性干细胞或其它干细胞等向对象细胞的分化诱导可以使用公知的方法来进行。例如,作为由多能性干细胞向对象细胞进行分化诱导的方法,可列举Laflamme MA等报道的方法(Laflamme MA&Murry CE,Nature 2011,Review)。需要说明的是,在通过这样的分化诱导而得到对象细胞的情况下,包含对象细胞的细胞群可以为胚状体。
以下对本发明的药物组合物进行说明。需要说明的是,本领域技术人员可以基于以下的记载和说明书中的其它记载、技术常识将涉及“药物组合物”的本发明进一步转变为例如涉及“治疗方法”(例如,包括对人或其它动物给药有效量的转导用溶液和关注对象分子的步骤的方法)的发明等。
本发明的药物组合物包含本发明的转导用溶液和关注对象分子。“转导用溶液”和“关注对象分子”的详细情况、优选实施方式等如本说明书中的另外的记载所述。
本发明的药物组合物的用途由其中所含的关注对象分子决定。可通过选择关注对象分子来制备具有各种用途的药物组合物。
本发明的一个优选实施方式中,药物组合物为肌养蛋白异常症的预防/治疗药、或修复型肌养蛋白产生药。该实施方式中,关注对象分子可以为构成用于靶向包含肌养蛋白基因的基因座的碱基序列并改造该碱基序列的CRISPR系统的要素,例如靶向规定的碱基序列的gRNA与Cas蛋白的复合物。
本发明的药物组合物的剂形没有特别限定,可以根据用途适当选择。例如,在与本发明的转导方法的关系中,如上所述本发明的药物组合物可以制成静脉内注射、动脉内注射、肌肉内注射、皮下注射、腹腔内注射等注射剂。
本发明的药物组合物可以根据剂形而进一步含有转导用溶液和关注对象分子以外的、制药学上可接受的添加剂等物质。本发明的药物组合物中的活性成分(关注对象分子)的量或浓度可以在考虑剂型、给药途径、每次的给药量、一定期间内的给药次数等的情况下进行适当调整,使得能够将对于期望的预防效果或治疗效果而言有效的量的活性成分递送到目标细胞。
实施例
在以下的实施例中,使用了下表所示的化合物。
[表1-1]
[表1-2]
[表1-3]
[表1-4]
[表1-5]
FUJIFILM Wako Pure Chemical Corporation、TCI-JP;Tokyo ChemicalIndustry Co.,Ltd.,
TRC;Toronto research chemicals、OY;Oriental Yeast Co.,Ltd.,
CC;Cayman Chemical Company
材料
BL21(DE3)感受态大肠杆菌(NEB,C2527)
Ni-NTA Superflow Cartridges(GE,30765)
HiLoad 26/60Superdex 200pg(GE,17-1071-01)
Resource S(GE,17-1180-01)
TEV蛋白酶(Sigma,T4455)
Complete,EDTA free(Roche,1873580)
SEM核酸酶,重组,溶液(WAKO,196-16181)
DTT(WAKO,049-08972)
咪唑(WAKO,095-00015)
1M氯化镁水溶液(WAKO,310-90361)
天冬氨酸镁(MP Biomedicals Inc.,150496)
10×TBS(Takarabio,T9141)
1M HEPES缓冲液(Nacalai Tesque Inc.,17557-94)
0.5M EDTA溶液(Invitrogen,15575-038)
LB培养基(Lennox),(Sigma,L7275-500TAB)
2×YT培养基,(Sigma,Y2627-1kg)
IPTG(WAKO,096-05143)
氨苄西林钠(WAKO,014-23302)
氯化钾(WAKO,161-03541)
Pierce 660nm蛋白质分析(Thermo scientific,22660)
含L-谷氨酰胺和酚红的D-MEM(高葡萄糖)(WAKO,044-29765)
含酚红的0.25w/v%胰蛋白酶-1mmol/lEDTA·4Na溶液(WAKO,201-16945)
D-PBS(-),(WAKO,043-29791)
5M氯化钠,(Invitrogen,AM9759)
UltraPure DNase/RNase-Free蒸馏水(Invitrogen,10977015)
获得USDA批准的合格胎牛血清(Gibco,10437028)
CellCarrier Ultra PDL涂层96孔板(PerkinElmer,6055500)
HOECHST(注册商标)33342(ThermoFisher,H3570)
C2C12(ATCC(注册商标),CRL-1772(商标))
Millex-GV 0.22μm PVDF 4mm EtO Ster灭菌后(Merck,SLGV004SL)
3-(1-吡啶基)丙磺酸(NDSB-201)(TCI-JP,S0813)
甘油(WAKO,075-00616)
甘氨酸(WAKO,070-05281)
L-谷氨酰胺水溶液,×100(WAKO,073-05391)
NEAA,×100(Life technologies,11140-035)
N2添加剂,×100(Gibco,17502-048)
B27添加剂(Gibco,12587-010)
EGF(WAKO,059-07873)
bFGF(WAKO,064-05381)
Opti-MEM(商标)I减血清培养基(Life technologies,31985-062)
10×PBS-磷酸盐缓冲液(10×)pH 7.4,无RNase(Invitrogen)
Amicon
葡聚糖,Alexa Fluor
4%多聚甲醛磷酸缓冲液(WAKO)
含有NucBlue
crRNA和gRNA的碱基序列
MmDmdEx51 crRNA(GeneDesign,Inc):序列号1
(mN:2’-O-甲基RNA修饰、*:硫代磷酸酯修饰)
tracrRNA(GeneDesign,Inc):序列号2
(mN:2’-O-甲基RNA修饰、*:硫代磷酸酯修饰)
MmDmd Ex51 gRNA#1(mod):序列号3
(mN:2’-O-甲基RNA修饰、*:硫代磷酸酯修饰、GeneDesign,Inc)
mRosa26 gRNA(mod):序列号4
(mN:2’-O-甲基RNA修饰、*:硫代磷酸酯修饰、GeneDesign,Inc,或Sumitomokagaku,Inc.)
hEx45#1 gRNA(mod):序列号5
(mN:2’-O-甲基RNA修饰、*:硫代磷酸酯修饰、GeneDesign,Inc)
hEx45#23 gRNA(mod):序列号6
(mN:2’-O-甲基RNA修饰、*:硫代磷酸酯修饰、GeneDesign,Inc)
<备品>
FACS Asia(商标)(BD)
NEPA21转染系统(NEPA GENE)
AKTAprime(GE)
Opera Phenix(商标)高内涵筛选系统(PerkinElmer)
Harmony(商标)(PerkinElmer)
<化合物>
将化合物的供应商和商品编号以及化合物储备溶液的浓度汇总于表1。
<使用的术语的说明>
EGFP-SSA分析:EGFP单链退火分析的缩写。在EGFP报告细胞中插入了图1的报告盒,在该EGFP序列正中间插入了MmDMD-Ex51序列。通常,存在该MmDMD-Ex51序列则EGFP ORF被切断,因此不翻译EGFP蛋白。但是,若通过Cas9蛋白/gRNA复合物切断MmDMD-Ex51的靶序列,则EGFP ORF的上游(EG部位)和下游(FP部位)借助同源区域而发生单链退火,出现全长型的EGFP ORF,产生EGFP蛋白。利用该原理的EGFP-SSA分析可通过调查EGFP产生细胞数的比例来预测Cas9蛋白/gRNA复合物的细胞内递送量。
<试剂的准备、反应液和给药液的制备>
裂解缓冲液
按照终浓度达到1×TBS、20mM咪唑、0.005U/μL SEM核酸酶、1mM DTT、0.5mM EDTA2Na、1mM氯化镁的方式加入10×TBS 20mL、500U/μL SEM核酸酶0.002mL、0.5M EDTA溶液0.2mL、1M氯化镁水溶液0.2mL、DTT 30.85mg、咪唑272.308mg,用milliQ水溶解后定容至200mL。加入6片Complete EDTA free并搅拌后,使用孔径0.22μm的过滤器进行过滤灭菌。
GF缓冲液
按照终浓度达到20mM HEPES、150mM氯化钾、1mM DTT(pH 7.5)的方式加入1MHEPES溶液20mL、氯化钾11.182g、DTT 154.25mg,用milliQ水溶解。调节为pH 7.5后,定容至1000mL,用孔径0.22μm的过滤器进行过滤灭菌。
C2C12(小鼠横纹肌细胞)细胞培养基
含有10%FBS(体积/体积)的、含有L-谷氨酰胺和酚红的D-MEM(高葡萄糖)培养基。
储备化合物溶液
将化合物的供应商和储备化合物的终浓度记载于表1。称量各化合物,以达到表1的终浓度的方式溶解于UltraPure DNase/RNase-Free蒸馏水后,使用0.22μm过滤器进行过滤灭菌,作为储备化合物溶液。
反应液1
按照终浓度达到8ng/μL Cas9蛋白、0.68ng/μL tracr RNA、0.59ng/μL MmDmdEx51crRNA、1mM HEPES、550mM氯化钠、250mM化合物的方式将Cas9蛋白0.4μg、tracrRNA34.18ng、MmDmd Ex51crRNA29.48ng、1M HEPES缓冲液0.05μL、5M氯化钠水溶液5.5μL混合,用UltraPure DNase/RNase-Free蒸馏水将液量调整为37.5μL。对于该溶液,加入12.5μL的1000mM化合物溶液,在常温下孵育15分钟。需要说明的是,在化合物的终浓度为0.1mM、0.15mM、0.34mM、0.69mM、1mM、1.38mM、5mM、6.38mM、10mM、20mM、40mM、60mM、80mM、100mM、125mM、200mM、500mM时,将储备化合物溶液分别用UltraPure DNase/RNase-Free蒸馏水稀释为0.4mM、0.6mM、1.36mM、2.76mM、4mM、5.52mM、20mM、25.5mM、40mM、80mM、160mM、240mM、320mM、400mM、500mM、800mM、2000mM的浓度后加入。
反应液2
按照终浓度达到8ng/μL Cas9蛋白、0.68ng/μL tracr RNA、0.59ng/μL MmDmdEx51crRNA、50mM HEPES、485mM氯化钠、250mM化合物的方式将Cas9蛋白0.4μg、tracrRNA34.18ng、MmDmd Ex51crRNA 29.48ng、1M HEPES缓冲液2.5μL、5M氯化钠水溶液4.85μL混合,用UltraPure DNase/RNase-Free蒸馏水将液量调整为37.5μL。对于该溶液,加入12.5μL的1000mM化合物溶液,在常温下孵育15分钟。需要说明的是,在化合物的终浓度为0.69mM、25mM、100mM、125mM、160mM、200mM、500mM时,将储备化合物溶液用UltraPureDNase/RNase-Free蒸馏水分别稀释为2.76mM、100mM、400mM、500mM、640mM、800mM、2000mM的浓度后加入。
iTOP-1250缓冲液
按照专利文献2制备iTOP-1250缓冲液。对于Opti-MEM基溶液,按照终浓度达到200mM GABA、50mM NDSB-201、15mM甘氨酸、30mM甘油、425mM氯化钠、0.75×谷氨酰胺、0.75×Non-Essentialamino Acids、0.75×N-2添加剂、0.75×B-27添加剂、100ng/μL FGF2、100ng/μL EGF、8ng/μL Cas9蛋白、0.68ng/μL tracrRNA、0.59ng/μLMmDmd Ex51crRNA的方式添加各试剂,在常温下孵育15分钟。制备时,参考非专利文献1。iTOP-1250缓冲液包含60%的Opti-MEM。
反应液3-1
按照终浓度达到8ng/μL Cas9蛋白、0.68ng/μL tracr RNA、0.59ng/μL MmDmdEx51crRNA、50mM HEPES、250mM GABA、367mM氯化钠的方式将Cas9蛋白2.0μg、tracrRNA170.9ng、MmDmd Ex51crRNA 147.4ng、1M HEPES缓冲液12.5μL、5M氯化钠水溶液18.35μL、1MGABA水溶液62.5μL混合,用UltraPure DNase/RNase-Free蒸馏水将液量调整为250μL。在常温下孵育15分钟。需要说明的是,在485mM氯化钠的情况下,将5M氯化钠水溶液的添加量变更为24.25μL,同样地,在550mM氯化钠的情况下变更为27.5μL。
反应液3-2
按照终浓度达到8ng/μL Cas9蛋白、0.68ng/μL tracr RNA、0.59ng/μL MmDmdEx51crRNA、50mM HEPES、250mM GABA、367mM氯化钾的方式将Cas9蛋白2.0μg、tracrRNA170.9ng、MmDmd Ex51crRNA 147.4ng、1M HEPES缓冲液12.5μL、1M氯化钾水溶液91.75μL、1MGABA水溶液62.5μL混合,用UltraPure DNase/RNase-Free蒸馏水将液量调整为250μL。在常温下孵育15分钟。需要说明的是,在485mM氯化钾的情况下将1M氯化钾水溶液的添加量变更为121.25μL,同样地,在550mM氯化钾的情况下变更为137.5μL。
反应液3-3
按照终浓度达到8ng/μL Cas9蛋白、0.68ng/μL tracr RNA、0.59ng/μL MmDmdEx51crRNA、50mM HEPES、250mM GABA、367mM氯化镁的方式将Cas9蛋白2.0μg、tracrRNA170.9ng、MmDmd Ex51crRNA 147.4ng、1M HEPES缓冲液12.5μL、1M氯化镁水溶液91.75μL、1MGABA水溶液62.5μL混合,用UltraPure DNase/RNase-Free蒸馏水将液量调整为250μL。在常温下孵育15分钟。需要说明的是,在323mM氯化镁的情况下,将1M氯化镁水溶液的添加量变更为80.75μL,同样地,在485mM氯化镁的情况下变更为121.25μL,在550mM氯化镁的情况下变更为137.5μL。
反应液3-4
按照终浓度达到8ng/μL Cas9蛋白、0.68ng/μL tracrRNA、0.59ng/μL MmDmdEx51crRNA、50mM HEPES、250mM GABA、485mM天冬氨酸镁的方式将Cas9蛋白2.0μg、tracrRNA 170.9ng、MmDmdEx51 crRNA 147.4ng、1M HEPES缓冲液12.5μL、1M天冬氨酸镁水溶液121.25μL、1M GABA水溶液62.5μL混合,用UltraPureDNase/RNase-Free蒸馏水将液量调整为250μL。在常温下孵育15分钟。需要说明的是,在550mM天冬氨酸镁的情况下,将1M天冬氨酸镁水溶液的添加量变更为137.5μL。
反应液3-5
按照终浓度达到8ng/μL Cas9蛋白、0.68ng/μL tracr RNA、0.59ng/μL MmDmdEx51crRNA、50mM HEPES、250mM GABA、395.8mM氯化钠、45.2mM氯化镁、21.4mM氯化钾的方式将Cas9蛋白2.0μg、tracrRNA 170.9ng、MmDmd Ex51 crRNA 147.4ng、1M HEPES缓冲液12.5μL、5M氯化钠水溶液19.8μL、1M氯化镁水溶液11.3μL、1M氯化钾水溶液5.4μL、1M GABA水溶液62.5μL混合,用UltraPure DNase/RNase-Free蒸馏水将液量调整为250μL。在常温下孵育15分钟。
反应液3-6
按照终浓度达到8ng/μL Cas9蛋白、0.68ng/μL tracrRNA、0.59ng/μL MmDmdEx51crRNA、50mM HEPES、250mM GABA、447.4mM氯化钠、51.1mM氯化镁、24.2mM氯化钾的方式将Cas9蛋白2.0μg、tracrRNA 170.9ng、MmDmd Ex51crRNA 147.4ng、1M HEPES缓冲液12.5μL、5M氯化钠水溶液22.4μL、1M氯化镁水溶液12.8μL、1M氯化钾水溶液6.1μL、1M GABA水溶液62.5μL混合,用UltraPure DNase/RNase-Free蒸馏水将液量调整为250μL。在常温下孵育15分钟。
反应液4
按照终浓度达到16ng/μL Cas9蛋白、4ng/μL MmDmd Ex51gRNA、1mM HEPES、550mM氯化钠、250mM化合物的方式将Cas9蛋白800ng、MmDmd Ex51 gRNA 200ng、1M HEPES缓冲液0.05μL、5M氯化钠水溶液5.5μL混合,用UltraPure DNase/RNase-Free蒸馏水将液量调整为25μL。对于该溶液,按照终浓度达到250mM的方式加入规定量的化合物储备溶液,在常温下孵育15分钟。需要说明的是,在氯化钠的终浓度为150mM、350mM的情况下,将5M氯化钠水溶液分别加入1.5μL、3.5μL。
反应液5
按照终浓度达到1mg/mL异硫氰酸荧光素-葡聚糖,平均摩尔重量70000(FITC-Dextran)、1mM HEPES、550mM氯化钠、250mM化合物的方式将100mg/mL FITC-Dextran 2.5μL、1M HEPES缓冲液0.25μL、5M氯化钠水溶液27.5μL混合,用UltraPure DNase/RNase-Free蒸馏水将液量调整为250μL。对于该溶液,按照达到终浓度的方式加入规定量的化合物储备溶液,制备反应液。
给药液1
按照终浓度达到400ng/μL Cas9蛋白、100ng/μL mRosa26 gRNA、533mM氯化钠、250mM 2’-脱氧胞苷水溶液的方式将Cas9蛋白20μg、mRosa26 gRNA 5μg、10×PBS 5μL、2.0M2’-脱氧胞苷水溶液6.25μL混合,使用5M氯化钠水溶液调整浓度至533mM后,用UltraPureDNase/RNase-Free蒸馏水将液量调整为50μL,在常温下孵育15分钟。需要说明的是,在终浓度为163mM、233mM、333mM、433mM时,适当调整5M氯化钠的添加量。另外,所使用的Cas9蛋白使用通过Amicon
给药液2
按照终浓度达到800ng/μL Cas9蛋白、200ng/μL mRosa26 gRNA、533mM氯化钠、250mM化合物的方式将Cas9蛋白40μg、mRosa26gRNA 10μg、10×PBS 5μL、500M化合物储备溶液25μL混合,使用5M氯化钠水溶液调整浓度至533mM后,用UltraPure DNase/RNase-Free蒸馏水将液量调整为50μL,在常温下孵育15分钟。需要说明的是,在终浓度为25mM化合物的情况下,添加500mM化合物储备溶液2.5μL。所使用的Cas9蛋白使用通过Amicon
给药液3
按照终浓度达到2400ng/μL Cas9蛋白、300ng/μL hDMD Ex45#1gRNA、300ng/μLhDMD Ex45#23gRNA、158mM氯化钠、25mM或250mM化合物的方式将Cas9蛋白120μg、hDMDEx45#1gRNA 15μg、hDMD Ex45#23gRNA 15μg、10×PBS 25μL混合,按照达到25mM或250mM的方式添加500mM化合物储备溶液之后,用UltraPureDNase/RNase-Free蒸馏水将液量调整为250μL,在常温下孵育15分钟。所使用的Cas9蛋白使用通过Amicon
<方法>
EGFP-SSA报告细胞的建立
为了评价Cas9向细胞内的摄入,建立EGFP-SSA报告细胞株。通过电穿孔法(NEPA21转染系统)将包含EF1α-EGxxFP-MmDMD-Ex51报告盒的质粒转染到C2C12细胞中(图1)。使用NEPA21的电穿孔使用1×10
Cas9蛋白的表达、纯化
参考下述论文(Jinek,et al.2012)的pMJ806构建了具有关注对象的基因的蛋白质表达质粒。具体而言,构建了在化脓性链球菌Cas9基因中表达6×His标签序列、MBP序列、TEV蛋白酶切序列和2个SV40来源核转移(NLS)序列的载体(图3)。将该载体转化大肠杆菌系統BL21(DE3)感受态细胞,使其过量表达蛋白质。转化按照制造商的规程进行。培养和纯化规程参照(Jinek,et al.2012)。将转化体用添加了0.1mg/mL氨苄西林钠的LB培养基在37℃下振荡培养一晚,将该培养液添加到2×YT培养基中,在37℃下振荡培养至OD 0.6。添加IPTG,在冰上静置30分钟后,在16℃下进一步振荡培养18小时,进行离心,将得到的菌体用裂解缓冲液进行溶菌。通过离心分离将溶解物净化,上样到Ni-NTA Superflow Cartridges中,按照制造商的规程(Ni-NTASuperflow Cartridge手册)通过咪唑梯度洗脱出添加有His标签的Cas9蛋白。为了除去该洗脱级分中的咪唑,进行使用HiLoad 26/60Superdex200pg的凝胶过滤层析,将蛋白质分子量级分合并。按照制造商的指示书对该蛋白质级分进行TEV消化,将6×His-MBP标签和Cas9蛋白切断分离。将TEV消化蛋白质液上样到Ni-NTA柱中,按照制造商的规程吸附除去6×His-MBP标签,从穿透液中回收包含Cas9蛋白的级分。将该回收级分上样到Resource S柱中,通过氯化钙梯度洗脱出Cas9蛋白。为了除去洗脱缓冲液中的氯化钙,利用用GF缓冲液平衡化后的HiLoad 26/60Superdex 200pg柱进行凝胶过滤层析,回收Cas9蛋白级分。对于洗脱级分,通过Pierce 660nm蛋白质分析法以及SDS凝胶电泳和考马斯染色实施蛋白质测定,判定蛋白质的浓度和纯度。在纯度判定后进行过滤灭菌。
实施例所参考的论文
Jinek,Martin,Krzysztof Chylinski,Ines Fonfara,Michael Hauer,JenniferA Doudna,and Emmanuelle Charpentier.″A Programmable Dual-RNA-Guided DNAEndonuclease in Adaptive Bacterial Immunity.″Science,2012:816-821
EGFP-SSA分析
将EGFP报告细胞以1×10
EGFP阳性率(%)=(EGFP阳性细胞数/HOECHST检测数)×100
人DMD外显子45敲入-小鼠Dmd外显子44敲除小鼠的制作
将含有包含10μg的人DMD外显子45和其5’侧0.7kb、3’侧0.6kb的序列1.5kb、被FRT序列夹住的新霉素抗性基因表达单元和小鼠Dmd内含子44和内含子45来源序列各1.5kb的敲入载体,与2.5μg的pCAG-Cas9表达载体和两种2.5μg的pU6-sgRNA表达载体(靶序列;序列号7和序列号8)一起对5×10
序列号7
序列号8
序列号9
序列号10
序列号11
C57BL/6J小鼠中的、使用mRosa26 gRNA的DNA突变导入效率评价
向9周龄的雄性C57BL/6J小鼠(CLEA Japan,Inc)的右下肢腓肠肌给药给药液1或给药液2、PBS 50μL。给药液1对于同一位置每天1次、总计3次地进行给药。给药液2仅进行1次给药。末次给药起4天后,在3.5%异氟烷麻醉下通过颈椎脱臼而处死后,摘出右下肢腓肠肌组织,用干冰快速冷冻。从冷冻肌肉组织中,使用QIAamp Fast DNA Tissue Kit(Qiagen)提取纯化基因组DNA,使用PrimeSTAR GXL DNA polymerase(TAKARA)进行PCR(正向引物;序列号12、反向引物;序列号13)。将PCR产物用QIAquick PCR purification kit(QIAGEN)纯化,用T7内切核酸酶I(NEB)处理后,用Agilent 4200TapeStation(Agilent)进行分析。使用得到的数值通过下述计算式(数学式1)求出突变导入效率。
序列号12
序列号13
[数学式1]
a:未被切断的条带来源的峰面积
b,c:被切成预测分子量的条带来源的峰面积
人DMD外显子45敲入-小鼠Dmd外显子44敲除小鼠的骨骼肌中的外显子跳跃效率评价
向4周龄的雄性人DMD外显子45敲入-小鼠Dmd外显子44敲除小鼠的胫骨前肌中,将给药液3分别以50μL给药一次。给药起7天后摘出胫骨前肌组织,用干冰快速冷冻。向冷冻的肌组织中加入QIAzol Lysis Reagent(QIAGEN)而破碎组织后,添加氯仿(WAKO),混合并离心后,将包含RNA的水槽分离回收,使用High Capacity RNA-to-cDNA kit(Thermo Fisherscientific.Inc)对总RNA进行逆转录。接着,在跳跃后的产物的定量测定中,使用FastStart Universal Probe Master(Roche)以及序列号14、15的异物和序列16的探针。另外,在未进行跳跃的产物的定量测定中,使用FastStart Universal Probe Master(Roche)以及序列号17、18的异物和序列19的探针。各PCR产物的测定使用ViiA7
序列号14
(mEx43-46skipTaqF 114:Thermo Fisher Scientific)
序列号15
(mEx43-46skipTaqR191:Thermo Fisher Scientific)
序列号16
(FAM label,mEx43-46skipTaqP144:Thermo Fisher Scientific)
序列号17
(hEx45TaqF252:Thermo Fisher Scientific)
序列号18
(hEx45 TaqR316:Thermo Fisher Scientific)
序列号19
(FAM label,hEx45TaqP278:Thermo Fisher Scientific)
[数学式2]
外显子跳跃效率(%)=100×a/(a+b)
a:发生了跳跃的产物的绝对量
b:未发生跳跃的产物的绝对量
使用葡聚糖的细胞内摄入评价
将C2C12细胞以1×10
统计处理
在图10和图11中,为了调查GABA与各化合物条件的统计学上的差异显著性,使用DNA突变导入效率Indel(%)和外显子跳跃效率(exon skipping efficiency)实施Dunnetttype多重比较检验。在P值小于0.05时,判断为统计学上有显著差异。统计处理使用EXSUSVer 8.0。
[实施例1]
通过下述步骤制备包含各种(A1)~(A5)的化合物和(B)盐的转导用溶液,向该溶液中进一步溶解gRNA与Cas9蛋白的复合物后,在体外与小鼠成肌细胞(C2C12细胞)接触,评价目的基因切断活性和细胞存活率。
转导化合物的活性评价和与GABA的相对比较
通过使用Cas9蛋白/gRNA复合物的EGFP-SSA分析评价每一化合物的活性。将EGFP报告细胞以1×10
表2记载了图4-1和图4-2的箭头所示的浓度下的EGFP阳性率和HOECHST细胞数,另外记载了与该化合物设于同一平板上的阳性对照组的EGFP阳性率和HOECHST细胞数。通过下述的式(1)、(2)计算每一化合物的相对活性,作出图5的图。
EGFP阳性率(GABA相对比值)=化合物的记载浓度下的EGFP阳性率(%)/同一平板的阳性对照的EGFP阳性率(%)……(1)
HOECHST检测数(GABA相对比值)=化合物的记载浓度下的HOECHST检测数/同一平板的阳性对照的HOECHST检测数……(2)
[表2]
与GABA相比EGFP阳性率(转导效率)高1.2倍以上的化合物为4-羟脯氨酸、N-氨甲酰基-L-天冬氨酸、1-甲基-L-组氨酸、6-磷酸-D-葡萄糖酸、1,3-丁二醇、2-羟基戊二酸、1,3-二甲基脲、肌酸酐、米格列醇、α-D-葡萄糖-1-磷酸、精氨基琥珀酸二钠盐水合物、L-肌肽、胞苷、3-甲基-2-氧代丁酸钠、肌苷-5’-磷酸二钠盐水合物。
[实施例2]转导化合物与iTOP-1250的活性比较
通过EGFP-SSA分析评价每一化合物的Cas9蛋白/gRNA复合物的细胞内导入效率。将EGFP报告细胞以1×10
[实施例3]
通过EGFP-SSA分析评价(B)盐中的Cas9蛋白/gRNA复合物的细胞内导入效率。将EGFP报告细胞以1×10
[实施例4]氯化钠的各浓度下的Cas9/gRNA复合物的细胞内导入评价
通过EGFP-SSA分析来评价(B)的氯化钠的各浓度下每一化合物的Cas9蛋白/gRNA复合物的细胞内导入效率。将EGFP报告细胞以1×10
[实施例5]使用C57BC/6J小鼠的(B)盐浓度下的DNA突变导入效率评价
制备包含作为(A3)的化合物的2’-脱氧胞苷和作为(B)盐的氯化钠的转导用溶液,向其溶液中进一步溶解mRosa26gRNA与Cas9蛋白的复合物,将其作为实施例5的给药液(给药液1、参照上述而制备)使用。将给药液1局部给药于小鼠右下肢腓肠肌,评价目的基因切断活性。给药液1以氯化钠浓度为163mM、233mM、333mM、433mM或533mM的方式来制备。给药液以每次50μL、连续3天的方式进行给药,末次给药起第4天提取右下肢腓肠肌组织,进行T7E1分析。将其结果示于图9。任一盐浓度下,在正常小鼠中均确认到基因组编辑。
[实施例6]使用C57BC/6J小鼠的(A)的各化合物浓度下的DNA突变导入效率评价
制备包含各种(A1)~(A5)的化合物和作为(B)盐的氯化钠的转导用溶液,向该溶液中进一步溶解mRosa26 gRNA与Cas9蛋白的复合物,将其作为实施例6的给药液(给药液2、参照上述而制备)使用。将给药液2局部给药于小鼠右下肢腓肠肌,评价目的基因切断活性。给药液2包含2’-脱氧胞苷、6-磷酸-D-葡萄糖酸、N-氨甲酰基-L-天冬氨酸或2-脱氧-D-葡萄糖-6-磷酸作为化合物,以给药液中的终浓度为25mM或250mM的方式而制备。将给药液2以50μL给药1次,第4天提取右下肢腓肠肌组织,进行T7E1分析。将其结果示于图10。任一化合物在正常小鼠中均显示出与作为对照化合物的250mM GABA同等或更高的基因组编辑效率。特别是N-氨甲酰基-L-天冬氨酸、2-脱氧-D-葡萄糖-6-磷酸,得到了与GABA相比在统计学上显著的结果。
[实施例7]人DMD外显子45敲入-小鼠Dmd外显子44敲除小鼠中的使用h DMD Ex45#1gRNA、hDMD Ex45#23gRNA的外显子跳跃效果
制备包含各种(A1)、(A4)的化合物和作为(B)盐的氯化钠的转导用溶液,向该溶液中进一步溶解hEx45#1gRNA、hEx45#23gRNA与Cas9蛋白的复合物,将其作为实施例7的给药液(给药液3、参照上述而制备)使用。将给药液3局部给药于小鼠胫骨前肌,评价人DMD外显子45序列的跳跃效率。给药液3包含6-磷酸-D-葡萄糖酸或N-氨甲酰基-L-天冬氨酸作为化合物或包含GABA作为对照化合物,以给药液中的终浓度为25mM或250mM的方式来制备。将给药液3以50μL给药1次,第7天提取胫骨前肌组织,进行外显子跳跃效率的测定。将其结果示于图11。任一化合物在hEx45KI-mdx44小鼠中均显示出比250mM GABA更高的目的基因(肌养蛋白基因)的外显子跳跃活性。特别是25mM N-氨甲酰基-L-天冬氨酸,得到了与250mM GABA相比在统计学上显著的结果。
[实施例8]使用葡聚糖的细胞内摄入试验
使用进行了荧光标记的葡聚糖(FITC-Dextran),进行C2C12细胞的细胞内摄入评价。氯化钠浓度为550mM,化合物的终浓度为250mMGABA(对照)、125mM N-氨甲酰基-L-天冬氨酸、250mM 2-脱氧-D-葡萄糖-6-磷酸。对细胞添加添加了各化合物的反应液5,30分钟后进行切换为培养基并孵育30分钟或90分钟,将结果示于图12。通过将本发明中规定的化合物与盐组合使用,荧光标记葡聚糖的细胞内透过得到促进。确认:通过本发明,不仅能够高效率地递送蛋白质(Cas9)、核酸(gRNA),还能够高效率地递送葡聚糖之类的高分子化合物。
产业上的可利用性
本发明的转导用溶液和使用其的本发明的转导方法能够将核酸、蛋白质等关注对象分子以高效率导入到各种细胞内。例如,通过使CRISPR系统中使用的gRNA与Cas蛋白的复合物和本发明的转导用溶液一起与细胞接触而能够以高效率导入到该细胞内,能够进行利用CRISPR系统的基因组编辑。另外,通过本发明的转导方法,能够高效率地制造被转导了核酸、蛋白质等关注对象分子的细胞。
序列表
<110> 国立大学法人京都大学
武田药品工业株式会社
<120> 使用溶液的药物递送系统
<130> PT38-9043
<150> JP 2018-224965
<151> 2018-11-30
<160> 19
<170> PatentIn version 3.5
<210> 1
<211> 42
<212> RNA
<213> 人工序列
<220>
<223> MmDmdEx51 crRNA
<220>
<221> modified_base
<222> (1)..(1)
<223> 2'-O-methylcytidine (cm)
<220>
<221> modified_base
<222> (2)..(2)
<223> 2'-O-methyladenosine
<220>
<221> modified_base
<222> (3)..(3)
<223> 2'-O-methylcytidine (cm)
<220>
<221> modified_base
<222> (39)..(39)
<223> 2'-O-methyluridine (um)
<220>
<221> modified_base
<222> (40)..(40)
<223> 2'-O-methyluridine (um)
<220>
<221> modified_base
<222> (41)..(41)
<223> 2'-O-methyluridine (um)
<400> 1
cacuagagua acagucugac guuuuagagc uaugcuguuu ug 42
<210> 2
<211> 70
<212> RNA
<213> 人工序列
<220>
<223> tracrRNA
<220>
<221> modified_base
<222> (1)..(1)
<223> 2'-O-methylcytidine (cm)
<220>
<221> modified_base
<222> (2)..(2)
<223> 2'-O-methyladenosine
<220>
<221> modified_base
<222> (3)..(3)
<223> 2'-O-methyladenosine
<220>
<221> modified_base
<222> (4)..(4)
<223> 2'-O-methyladenosine
<220>
<221> modified_base
<222> (67)..(67)
<223> 2'-O-methylguanosine (gm)
<220>
<221> modified_base
<222> (68)..(68)
<223> 2'-O-methyluridine (um)
<220>
<221> modified_base
<222> (69)..(69)
<223> 2'-O-methylguanosine (gm)
<220>
<221> modified_base
<222> (70)..(70)
<223> 2'-O-methylcytidine (cm)
<400> 2
caaaacagca uagcaaguua aaauaaggcu aguccguuau caacuugaaa aaguggcacc 60
gagucggugc 70
<210> 3
<211> 101
<212> RNA
<213> 人工序列
<220>
<223> MmDmd Ex51 gRNA#1
<220>
<221> modified_base
<222> (1)..(1)
<223> 2'-O-methyluridine (um)
<220>
<221> modified_base
<222> (2)..(2)
<223> 2'-O-methylcytidine (cm)
<220>
<221> modified_base
<222> (3)..(3)
<223> 2'-O-methyladenosine
<220>
<221> modified_base
<222> (98)..(98)
<223> 2'-O-methyladenosine
<220>
<221> modified_base
<222> (99)..(99)
<223> 2'-O-methyladenosine
<220>
<221> modified_base
<222> (100)..(100)
<223> 2'-O-methyladenosine
<400> 3
ucacuagagu aacagucuga cguuuuagag cuagaaauag caaguuaaaa uaaggcuagu 60
ccguuaucaa cuugaaaaag uggcaccgag ucggugcuuu u 101
<210> 4
<211> 94
<212> RNA
<213> 人工序列
<220>
<223> mRosa26 gRNA
<220>
<221> modified_base
<222> (1)..(1)
<223> 2'-O-methylguanosine (gm)
<220>
<221> modified_base
<222> (2)..(2)
<223> 2'-O-methyladenosine
<220>
<221> modified_base
<222> (3)..(3)
<223> 2'-O-methyluridine (um)
<220>
<221> modified_base
<222> (91)..(91)
<223> 2'-O-methylguanosine (gm)
<220>
<221> modified_base
<222> (92)..(92)
<223> 2'-O-methyluridine (um)
<220>
<221> modified_base
<222> (93)..(93)
<223> 2'-O-methylguanosine (gm)
<400> 4
gaugggcggg agucuucugu uuuagagcua gaaauagcaa guuaaaauaa ggcuaguccg 60
uuaucaacuu gaaaaagugg caccgagucg gugc 94
<210> 5
<211> 96
<212> RNA
<213> 人工序列
<220>
<223> hEx45#1 gRNA
<220>
<221> modified_base
<222> (1)..(1)
<223> 2'-O-methyluridine (um)
<220>
<221> modified_base
<222> (2)..(2)
<223> 2'-O-methylguanosine (gm)
<220>
<221> modified_base
<222> (3)..(3)
<223> 2'-O-methylguanosine (gm)
<220>
<221> modified_base
<222> (93)..(93)
<223> 2'-O-methylguanosine (gm)
<220>
<221> modified_base
<222> (94)..(94)
<223> 2'-O-methyluridine (um)
<220>
<221> modified_base
<222> (95)..(95)
<223> 2'-O-methylguanosine (gm)
<400> 5
ugguaucuua caggaacucc guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugc 96
<210> 6
<211> 96
<212> RNA
<213> 人工序列
<220>
<223> hEx45#23 gRNA
<220>
<221> modified_base
<222> (1)..(1)
<223> 2'-O-methyladenosine
<220>
<221> modified_base
<222> (2)..(2)
<223> 2'-O-methylguanosine (gm)
<220>
<221> modified_base
<222> (3)..(3)
<223> 2'-O-methylcytidine (cm)
<220>
<221> modified_base
<222> (93)..(93)
<223> 2'-O-methylguanosine (gm)
<220>
<221> modified_base
<222> (94)..(94)
<223> 2'-O-methyluridine (um)
<220>
<221> modified_base
<222> (95)..(95)
<223> 2'-O-methylguanosine (gm)
<400> 6
agcugucaga cagaaaaaag guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugc 96
<210> 7
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 7
atgaatgtgc ctacatatgg 20
<210> 8
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 8
catagcatgc atttggcttc 20
<210> 9
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 9
gaatgaggta gtgttgtagg 20
<210> 10
<211> 20
<212> DNA
<213> 小鼠(Mus musculus)
<400> 10
gcaggaaatc atcttatagc 20
<210> 11
<211> 120
<212> DNA
<213> 人工序列
<220>
<223> ssODN
<400> 11
gagcaagctg ggttagaaca aaggtctgtc agagtcagca tgggaatgag gtagtgttgt 60
agcaggaaat agtgtggttt aggtctctcc ccgccctctg tgtatgtgtg tgtgtgtgtt 120
<210> 12
<211> 35
<212> DNA
<213> 人工序列
<220>
<223> 正向引物
<400> 12
ctccgaggcg gatcacaagc aataataacc tgtag 35
<210> 13
<211> 35
<212> DNA
<213> 人工序列
<220>
<223> 反向引物
<400> 13
tgcaagcacg tttccgactt gagttgcctc aagag 35
<210> 14
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> mEx43-46skipTaqF114
<400> 14
cgtggcacag atggatttcc 20
<210> 15
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> mEx43-46skipTaqR191
<400> 15
ttcttttgtt cttcaatccc ttgtc 25
<210> 16
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> FAM 标记, mEx43-46skipTaqP144
<400> 16
acttcataga atgtacaagg aa 22
<210> 17
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> hEx45 TaqF252
<400> 17
tcctcaaaaa cagatgccag tattc 25
<210> 18
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> hEx45 TaqR316
<400> 18
tcctgccacc gcagattc 18
<210> 19
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> FAM 标记, hEx45 TaqP278
<400> 19
acaggaaaaa ttgggaagc 19
- 使用溶液的药物递送系统
- 药物递送系统和使用方法
