治疗慢性肾脏疾病相关的瘙痒的方法和装置
文献发布时间:2023-06-19 12:14:58
相关申请的交叉引用
本申请要求2018年10月18日提交的美国临时专利申请号62/747,506的权益,其全部内容通过引用合并于此。
技术领域
当前公开的主题涉及治疗慢性肾脏疾病相关的瘙痒的方法和装置。特别地,当前公开的主题包括包含纳美芬的经粘膜的膜组合物,其可以将其向需要治疗的受试者颊施用或舌下施用。
背景技术
瘙痒发生在许多疾病和病症中,诸如慢性肾脏疾病。特别地,慢性肾脏疾病相关的瘙痒在患有慢性肾脏功能障碍的患者中是常见的,发生在约20%-50%的患者中。为此,在美国,超过410万患者患有与慢性肾脏疾病相关的瘙痒
发明内容
在一些实施方案中,当前公开的主题涉及治疗受试者中瘙痒的方法。特别地,该方法包括向需要这种治疗的受试者经粘膜施用治疗有效量的纳美芬或其药学上可接受的盐。
在一些实施方案中,所述受试者患有瘙痒,所述瘙痒作为慢性肾脏疾病、肾功能降低、肝疾病、结节性痒疹或其组合的症状。
在一些实施方案中,瘙痒的治疗降低了所述受试者中P物质的水平。
在一些实施方案中,所述受试者正在经历透析治疗。
在一些实施方案中,所述治疗有效量包含约1至约32mg纳美芬或药学上可接受的纳美芬盐。
在一些实施方案中,将所述纳美芬或药学上可接受的纳美芬盐每天1或2次向所述受试者施用。在一些实施方案中,将约1至约8mg的所述纳美芬或药学上可接受的纳美芬盐一天一次向所述受试者施用,然后滴定至有效剂量。在一些实施方案中,将约1至约8mg的所述纳美芬或药学上可接受的纳美芬盐作为初始剂量一天两次向所述受试者施用,然后滴定至约4至约32mg的有效剂量。在一些实施方案中,将所述纳美芬或药学上可接受的纳美芬盐在24小时时间段内作为第一剂量和第二剂量施用,并且其中所述第一剂量大于所述第二剂量或所述第二剂量大于所述第一剂量。
在一些实施方案中,所述经粘膜施用选自颊施用或舌下施用。在一些实施方案中,所述舌下或颊施用在少于约5、30或60分钟内将约1至约32mg纳美芬或药学上可接受的纳美芬盐递送至所述受试者的血流。
在一些实施方案中,所述舌下或颊施用在约5分钟内将约1至约5ng/mL纳美芬或药学上可接受的纳美芬盐递送至所述受试者的血流。
在一些实施方案中,在施用所述纳美芬或药学上可接受的纳美芬盐之后,受试者最大血液浓度C
在一些实施方案中,在施用所述纳美芬或药学上可接受的纳美芬盐之后,在时间0至无穷大处的受试者血液AUC为约5至约500ng-hr/mL。
在一些实施方案中,将所述纳美芬或药学上可接受的纳美芬盐配置在速释经粘膜剂型中。
在一些实施方案中,所述纳美芬或药学上可接受的纳美芬盐是至少约50%可透析的。
在一些实施方案中,通过单层、自支撑、粘膜粘附的膜施用所述纳美芬或药学上可接受的纳美芬盐。特别地,所述膜包含第一离散域(discrete domain),基于所述第一离散域的总重量,其包含约50-100重量%的聚合物基质和约0-50重量%的一种或多种渗透促进剂、pH调节缓冲剂、掩味剂和矫味剂。所述膜包含第二离散域,其包含所述纳美芬或药学上可接受的纳美芬盐。在一些实施方案中,所述第二离散域是非自支撑的。
在一些实施方案中,所述受试者是人。
在一些实施方案中,当前公开的主题涉及单层、自支撑、粘膜粘附的膜。所述膜包含第一离散域,基于所述第一离散域的总重量,其包含约50-100重量%的聚合物基质和约0-50重量%的一种或多种渗透促进剂、pH调节缓冲剂、掩味剂和矫味剂。所述膜还包含第二离散域,其包含所述纳美芬或药学上可接受的纳美芬盐,其中所述第二离散域是非自支撑的。
在一些实施方案中,所述纳美芬或药学上可接受的纳美芬盐作为固溶体存在或实质上均匀、分散的固溶体存在,其为驻留在所述第一离散域的表面上的无定形或单形态结晶微粒。
在一些实施方案中,所述纳美芬或药学上可接受的纳美芬盐的尺寸小于约25μm、10μm或1μm。
在一些实施方案中,所述第一离散域的厚度为第二域的厚度的约50%、100%、500%、750%、1000%、2000%、3000%、4000%、5000%、7500%或10000%。
在一些实施方案中,所述第二离散域在物理上与所述第一离散域不可分离。
在一些实施方案中,所述第一离散域位于直接邻近所述第二离散域。
在一些实施方案中,所述第一离散域的局部pH为约3.5至约8.5,并且所述第二离散域的局部pH为4至9,并且所述两个域的pH不同。
在一些实施方案中,所述聚合物基质选自水溶性(water soluble)、水溶胀性(water swellable)和/或水蚀性(water erodible)聚合物。
在一些实施方案中,基于所述层的总重量,所述第二离散域还包含约0.1-50重量%的自聚集部分、自组装部分或两者。在其他的实施方案中,所述自聚集和/或自组装部分可以以所述第二域的总重量的约25-70重量%的量存在。
在一些实施方案中,所述自聚集或自组装部分选自一种或多种磷脂、胆汁酸、胆汁盐、纳米片(nanoplatelet)结构或可食用粘土。
在一些实施方案中,药物活性物(active)与自聚集部分或自组装部分的比例按重量计为约100:1至约1:10。
在一些实施方案中,所述第二域还包含约0.1-5重量%的除氧剂。
在一些实施方案中,所述第二结构域还包含约0.1-5重量%的药物增溶剂。
在一些实施方案中,将所述膜配置为当被放置在与受试者的口腔粘膜接触时提供药物活性物的定向递送。
在一些实施方案中,所述膜还包含一个或多个另外的离散域,其中所述另外的离散域中的每一个实质上在物理上与所述膜装置不可分离。
附图说明
将参照附图阅读先前的发明内容和以下的发明详述,这些附图阐明了当前公开的主题的一些(但不是全部)实施方案。
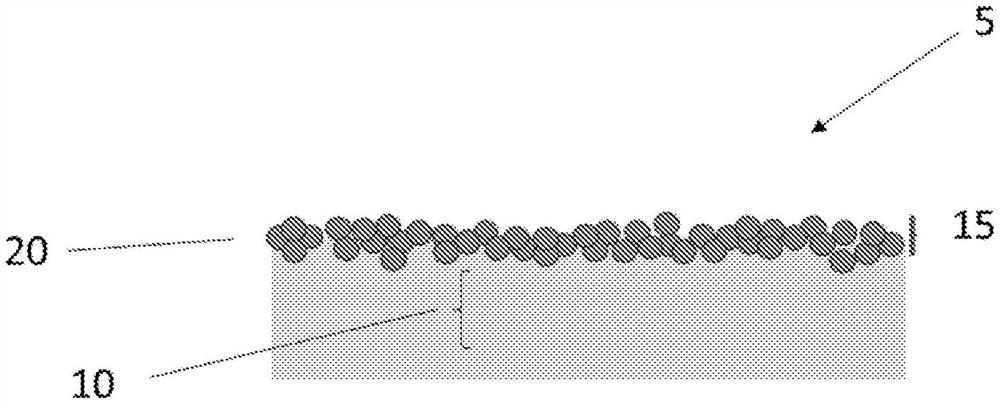
图1a-1e是包含第一和第二离散域的经粘膜的膜的代表。
图2a是柱状图,其阐明了用SP(组1)和盐水(组2)注射的小鼠中抓挠的总数。
图2b是柱状图,其阐明了用低浓度和高浓度的SP(组1和3)注射的小鼠中抓挠的总数。
图3是柱状图,其阐明了在施用PBS(组5)、PBS和SP(组6)或纳美芬和SP(组4)之后在0-30分钟和0-60分钟时间点每只小鼠的抓挠的平均数。
图4是柱状图,其阐明了在注射PBS(组10)、0.5mM SP(组11)或0.75mg纳美芬(组12)之后在10分钟间隔每只小鼠的抓挠数。
图5是柱状图,其阐明了在0-30分钟和30-60分钟时组10、11和12小鼠的抓挠的平均数。
图6是柱状图,其阐明了在施用低剂量SP(组13)和高剂量SP(组14)之后每10分钟间隔的抓挠数。
图7是阐明在20小时的时间段血浆浓度随时间的线图。
图8是阐明在1小时的时间段血浆浓度随时间的线图。
发明详述
用足够的细节引入当前公开的主题,以提供对更广泛的发明主题的一个或多个特定实施方案的理解。这些描述阐述和示例了那些实施方案的特征,而没有将本发明的主题限于明确描述的实施方案和特征。在不脱离当前公开的主题的范围的情况下,基于这些描述的考虑将可能引起另外的和类似的实施方案和特征。
除非另有定义,否则本文所使用的所有技术和科学术语具有与当前公开的主题所属领域的普通技术人员通常所理解的相同的含义。尽管类似于或等同于本文描述的那些方法、装置和材料的任何方法、装置和材料都可以被用在实践或测试当前公开的主题中,但是现在描述代表性的方法、装置和材料。
遵循长期存在的专利法惯例,当在主题说明书(包括权利要求书)中使用时,术语“一(a)”,“一个(an)”和“所述(the)”指的是“一个或多个”。因此,例如,提及“一个膜(afilm)”可以包括多个这样的膜等。
除非另有说明,否则在说明书和权利要求书中使用的所有表示组分、病症等的数量的所有数字在所有情况下均应被理解为由术语“约”调整(modify)。因此,除非有相反的指示,否则在本说明书和所附权利要求书中所述的数字参数是近似值,其可以根据试图通过当前公开的主题获得的期望性质而变化。
如本文所用,当涉及质量、重量、时间、体积、浓度和/或百分比的值或量时,术语“约”在一些实施方案中可以涵盖从指定量+/-20%的变化,在一些实施方案中可以涵盖从指定量+/-10%的变化,在一些实施方案中可以涵盖从指定量+/-5%的变化,在一些实施方案中可以涵盖从指定量+/-1%的变化,在一些实施方案中可以涵盖从指定量+/-0.5%的变化,和在一些实施方案中可以涵盖从指定量+/-0.1%的变化,因为这样的变化在所公开的包装(package)和方法中是适当的。
当前公开的主题涉及治疗慢性肾脏疾病相关的瘙痒的有效方法。术语“慢性肾脏疾病”是指医学病症,其中患者具有(i)每1.73m
在一些实施方案中,经粘膜施用纳美芬可以治疗慢性肾脏疾病相关的瘙痒,以及胆汁郁积性瘙痒和/或结节性痒疹。胆汁郁积性瘙痒是由于肝疾病的痒觉。胆汁郁积是指胆汁流动减慢或停止,可能由多种肝(产生胆汁)、胆囊(存储胆汁)或胆道(使胆汁离开肝和胆囊并进入小肠的管道)的疾病引起。当胆汁郁积发生时,结合的胆红素和相关的废弃产物沉积回到血流中。据信,沉积到皮肤中的胆汁盐是引起瘙痒的原因。
结节性痒疹是皮肤疾病,其特征在于通常出现在受试者的手臂或腿上的瘙痒(痒)结节。患者经常表现出由抓挠引起的多发性表皮脱落的病变。
P物质(SP)是神经肽,其在瘙痒的诱导和维持中发挥作用。由于SP由在突触前传入的NK-1受体和在突触后传入的KOR受体表达,并且两种受体均在皮肤和CNS中大量表达,因此SP是用于新的止痒治疗的合理靶标。不受理论的束缚,据信纳美芬以多种方式起作用:1)通过阻断NK-1受体上P物质的表达(拮抗剂)和/或2)通过阻断到CNS的疼痛信号,其作为高亲和性κ阿片样物质受体(KOR)。在不区别任何一种的情况下,通过任何一种或两种作用机制缓和瘙痒。
所公开的治疗方法包括向患有慢性肾脏疾病相关的瘙痒、胆汁郁积性瘙痒和/或结节性痒疹的受试者经粘膜施用纳美芬。纳美芬(C
纳美芬是混合的μ阿片样物质(mu-opioid)受体(MOR)拮抗剂和κ阿片样物质受体(KOR)激动剂,其在美国被批准用作阿片样物质过量的解毒剂
如上所述,可以向受试者经粘膜施用纳美芬以治疗慢性肾脏疾病相关的瘙痒以及胆汁郁积性瘙痒和/或结节性痒疹。经粘膜递送是指药物制剂跨口腔、咽腔或食管中的粘膜的递送。因此,药物制剂通过颊、舌下、龈、咽和/或食管粘膜被吸收。在一些实施方案中,纳美芬的经粘膜施用是颊或舌下递送的。如本文所用,“颊”是指从口内通过面颊(cheeks)衬里的粘膜(即,通过颊粘膜)朝向面颊施用。术语“舌下”是指通过在舌下的口底部衬里的粘膜(即通过舌下粘膜)在舌下施用。
在一些实施方案中,所述纳美芬可以被配制成片剂(例如,口服溶解的片剂)、液体、凝胶、树胶、圆片(disc)和/或口服可溶性膜。然而,纳美芬的口服施用可能给患有肾或肝病损的患者带来严重的安全风险,由于肾脏无法除去其不需要的代谢物。对于在患有终末期肾疾病或肝衰竭的患者中的使用,可以通过避免首过代谢的施用途径递送纳美芬。特别地,避免首过代谢显著地减少了在病损的肝和肾脏功能中必须减少的氧化葡糖苷酸代谢物。
例如,在一些实施方案中,可以通过使用口腔膜(oral film)经粘膜递送纳美芬。如本文所用,术语“膜”是指薄的柔性材料片,并且旨在涵盖涂覆的膜和膜产品。特别地,可以配制包含无定形或结晶的纳美芬纳米粒和微粒的口腔薄膜。术语“纳米粒”是指亚微米大小的纳美芬颗粒。在一些实施方案中,合适的纳米粒的平均最长尺寸不大于约1,000纳米、500纳米、200纳米、100纳米、75纳米、50纳米、40纳米、25纳米或20纳米。术语“结晶”是指具有相对明确的晶体结构的化合物。术语“无定形”是指处于非结晶态,没有结晶性区域的化合物。
在一些实施方案中,纳美芬纳米粒和微粒驻留在口腔膜表面上的离散域中。在一些实施方案中,所述膜可以是包括两个或更多个离散域的单层膜,其中至少一个域包括纳美芬纳米粒和微粒。如本文所用,术语“域”是指膜内的区域,该区域与所述膜的另一区域相比,包括实质上不同的物理组成、化学组成和/或可测量的物理性质(诸如纳美芬的溶解、粘膜粘附和/或水分含量)。
图1阐明了包含多个离散域的单层口腔膜5的一个实施方案,其中所述域中的至少一个包含纳美芬或其盐。特别地,膜5包含第一域10和第二域15,所述第一域10包含一种或多种聚合物基质,所述第二域15包含药物活性物20(例如纳美芬或其盐)。在一些实施方案中,第二域15不是自支撑域,并且不能在物理上与第一域分离以维持机械完整性。术语“非自支撑”描述了不能在物理上分离以维持机械完整性的结构。这样的域可以包括(但不限于)极薄、易碎、离散和/或不连续的区域。在一些实施方案中,第一域10是自支撑的。在一些实施方案中,第一离散域位于邻近或直接邻近第二离散域。如本文所用,术语“邻近”是指彼此直接接触或与在其间的另一层接触的两层定位(positioning)。术语“直接邻近”是指彼此接触而在其间没有任何其他层的层。
第一域10可以包含一种或多种聚合物基质和任选地一种或多种渗透促进剂、pH调节缓冲剂、掩味剂和/或矫味剂。可以使用任何期望的聚合物基质,包括(但不限于)水溶性、水溶胀性和/或水蚀性聚合物。例如,在一些实施方案中,所述聚合物基质可以选自羟丙基甲基纤维素(HPMC)、甲基纤维素、羟乙基纤维素(HPC)、羟丙基纤维素、聚乙烯吡咯烷酮、羧甲基纤维素钠、聚环氧乙烷(PEO)、普鲁兰(pullulan)、海藻酸、海藻酸钠、聚乙二醇、果胶、黄原胶、黄芪胶、瓜尔胶、金合欢胶(acacia gum)、阿拉伯树胶(arabic gum)、槐豆胶、吉兰糖胶(gellan gum)及其组合、聚丙烯酸、
如本文所用,短语“水溶性聚合物”及其变体是指至少部分溶于水中,完全或主要溶于水中或吸收水的聚合物。吸收水的聚合物通常被称为水溶胀性聚合物。在一些实施方案中,在第一域10的聚合物基质中所使用的材料在室温和/或其他温度(诸如超过室温的温度)下可以是水溶性的或水溶胀性的。
在一些实施方案中,所述聚合物基质可以以第一域的总重量的约5-100重量%的量存在(例如,基于域的总重量,约5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100重量%)。聚合物基质提供自支撑结构和期望停留时间,以改善生物利用度。
第一域可以任选地包括掩味剂和/或矫味剂以改善膜的味。术语“掩味剂”是指被添加到组合物中以掩盖一种或多种令人不愉快的味道组分的味道的试剂。术语“矫味剂”是指使所公开的膜具有期望的味道或气味的任何添加剂。合适的掩味剂可以包括(但不限于)醋酸纤维素、醋酸丁酸纤维素、乙基纤维素、甲基纤维素及其组合。合适的矫味剂可以包括(但不限于)天然和人工香料(flavors),诸如薄荷油、薄荷醇、留兰香油、香草、肉桂油、冬青油、柠檬油、橙皮油、葡萄油、白柠檬油(lime oil)、葡萄柚油、苹果香料油、覆盆子油、草莓油、梨油、蓝莓油(blueberry oil)、黑莓油、西瓜香料、樱桃油、甘草油、杏仁精油(essence)、丁香油、茴油、小豆蔻油(cardamom oil)、芫荽油(coriander oil)、桉树油、小茴香油、柠檬草油、肉豆蔻油及其组合。在一些实施方案中,掩味剂和/或矫味剂可以以第一域的总重量的约0-5重量%的量存在(例如,0、0.5、1、1.5、2、2.5、3、3.5、4、4.5或5重量%)。
在一些实施方案中,所述第一离散域的局部pH为约3.5至约8.5,诸如约3.5、4、4.5、5、5.5、6、6.5、7、7.5、8或8.5。在一些实施方案中,所述第二离散域的局部pH在4和9之间,诸如在5和8之间,或在6和7之间。在一些实施方案中,膜5的pH在3和9之间,诸如在4.5和7.5之间或在5和7之间。
在一些实施方案中,膜5的第二域包含治疗有效量的纳美芬。术语“治疗有效量”是指有效减轻、消除、治疗和/或控制慢性肾脏疾病相关的瘙痒、胆汁郁积性瘙痒和/或结节性痒疹的症状的药物活性物的量。在一些实施方案中,膜5的第二域包含约1至约32mg的纳美芬。因此,膜5可以包含至少约(或不超过约)1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31或32mg纳美芬。
如图1b中所示,在一些实施方案中,第二域15可以包含多种药物活性物20。因此,图1b的膜可以包括纳美芬和一种或多种另外的化合物(例如,NK-1拮抗剂化合物)。例如,在一些实施方案中,所公开的膜可以包括有效剂量的一种或多种药物试剂,诸如(但不限于)司洛匹坦(serlopitant)(C
在一些实施方案中,膜5可以包含约1至约32mg的另外的药物制剂(例如,司洛匹坦)。因此,第二活性剂(或随后的活性剂)可以以约1-20mg、1-15mg、1-10mg或1-5mg的量存在。
在一些实施方案中,膜5的第二域可以包括纳美芬和司洛匹坦的固定药物比例。例如,当组合时,固定药物比例可以是约1:10、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1或10:1(纳美芬:司洛匹坦)。然而,膜5不限于此并且可以包括具有在上述范围之外的固定药物比例的药物组合。
图1c、1d和1e阐明了膜5的替代实施方案,其中药物活性物20驻留在第二域15中,该第二域15被配置为在第一域的表面上的屏障基质。如图1d中所示,与第一域10相比,第二域15可以实质上更薄,诸如比所述膜的总厚度至少薄一个数量级。例如,第一域10的厚度可以是第二域15的厚度的约500%、750%、1000%、2000%、3000%、4000%、5000%、7500%或10000%。在一些实施方案中,膜5的第二域在物理上与第一域不可分离。类似地,例如,第一域10的表面积可以是第二域15的表面积的约100%、150%、200%、250%、300%、350%、400%、450%或500%。
如图1c中所示,第二域15的厚度可以是与第一域10相比大概相同的厚度,诸如第二域为所述膜的总厚度的约0-50%,而第一域为所述膜的总厚度的约50-100%(或约1:1)。例如,第二域15的厚度可以为第一域10的厚度的约10%、25%、50%、75%或90%。在一些实施方案中,膜5的第二域15在物理上与第一域不可分离。此外,如图1e中所示,第一域10的表面积可以为第二域15的表面积的约100%、150%、200%、250%、300%、350%、400%、450%或500%。
在一些实施方案中,第二离散域15可以包含一种或多种提供渗透增强特性的自聚集和/或自组装部分。如本文所用,术语“自组装”是指分子结构,其在诱导的物理变化和/或触发的相变时自行排列,以使装置的总自由能最小化,从而导致热力学稳定的装置。术语“自聚集”是指由于分子聚集成高浓度域或“富域”的能力而产生的结构。在一些实施方案中,自聚集和/或自组装部分可以以第二域的总重量的约0-5重量%的量存在(例如0、0.5、1、1.5、2、2.5、3、3.5、4、4.5或5重量%)。在其他实施方案中,自聚集和/或自组装部分可以以第二域的总重量的约25-75重量%的量存在(例如25、30、35、40、45、50、55、60、65、70或75重量%)。所述自聚集和/或自组装部分提供定向渗透。
在一些实施方案中,合适的自聚集和/或自组装部分可以包括(但不限于)磷脂、胆汁盐、纳米片、粘土、极性脂质或其组合。自聚集和/或自组装部分的合适实例可以包括磷脂酰胆碱、磷脂酸、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰甘油、磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰肌醇、磷脂酰肌醇磷酸酯、磷脂酰肌醇双磷酸酯、磷脂酰肌醇三磷酸酯和/或鞘磷脂。更具体地,所述自聚集和/或自组装部分可以包含1,2-二癸酰基-sn-甘油-3-磷酸胆碱、1,2-二芥酰基(dierucoyl)-sn-甘油-3-磷酸盐(钠盐)、1,2-二芥酰基-sn-甘油-3-磷酸胆碱、1,2-二芥酰基-sn-甘油-3-磷酸乙醇胺、1,2-二芥酰基-sn-甘油-3[磷酸-rac-(1-甘油...)(钠盐)、1,2-二亚油酰基(dilinoleoyl)-sn-甘油-3-磷酸胆碱、1,2-二月桂酰基-sn-甘油-3-磷酸盐(钠盐)、1,2-二月桂酰基-sn-甘油-3-磷酸胆碱、1,2-二月桂酰基-sn-甘油-3-磷酸乙醇胺、1,2-二月桂酰基-sn-甘油-3[p磷酸-rac-(1-甘油)(钠盐)、1,2-二月桂酰基-sn-甘油-3[磷酸-rac-(1-甘油)(铵盐)、1,2-二月桂酰基-sn-甘油-3-磷酸丝氨酸(钠盐)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸盐(钠盐)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺、1,2-二肉豆蔻酰基-sn-甘油-3[磷酸-rac-(1甘油...)(钠盐)、1,2-二肉豆蔻酰基-sn-甘油-3[磷酸-rac-(1-甘油...)(铵盐)、1,2-二肉豆蔻酰基-sn-甘油-3[磷酸-rac-(1-甘油...)(钠/铵盐)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸丝氨酸(钠盐)、1,2-二油酰基-sn-甘油-3-磷酸盐(钠盐)、1,2-二油酰基-sn-甘油-3-磷酸胆碱、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺、1,2-二油酰基-sn-甘油-3[磷酸-rac-(1-甘油...)(钠盐)、1,2-二油酰基-sn-甘油-3-磷酸丝氨酸(钠盐)、1,2-二棕榈酰基-sn-甘油-3-磷酸盐(钠盐)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱、1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺、1,2-二棕榈酰基-sn-甘油-3[磷酸-rac-(1-甘油)(钠盐)、1,2-二棕榈酰基-sn-甘油-3[磷酸-rac-(1-甘油)(铵盐)、1,2-二棕榈酰基-sn-甘油-3-磷酸丝氨酸(钠盐)、1,2-二硬脂酰基-sn-甘油-3-磷酸盐(钠盐)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱、1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺、1,2-二硬脂酰基-sn-甘油-3[磷酸-rac-(1-甘油...)(钠盐)、1,2-二硬脂酰基-sn-甘油-3[磷酸-rac-(1-甘油)铵盐)、1,2-二硬脂酰基-sn-甘油-3-磷酸丝氨酸(钠盐)、氢化卵PC氢化大豆PC、1-肉豆蔻酰基-sn-甘油-3-磷酸胆碱、1-棕榈酰基-sn-甘油-3-磷酸胆碱、1-硬脂酰基-sn-甘油-3-磷酸胆碱、1-肉豆蔻酰基-2-棕榈酰基-sn-甘油3-磷酸胆碱、1-肉豆蔻酰基-2-硬脂酰基-sn-甘油-3-磷酸胆碱、1-棕榈酰基-2-肉豆蔻酰基-sn-甘油-3-磷酸胆碱、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸胆碱、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸乙醇胺、1-棕榈酰基-2-油酰基-sn-甘油-3[磷酸-rac-(1-甘油)](钠盐)、1-棕榈酰基-2-硬脂酰基-sn-甘油-3-磷酸胆碱、1-硬脂酰基-2-肉豆蔻酰基-sn-甘油-3-磷酸胆碱、1-硬脂酰基-2-油酰基-sn-甘油-3-磷酸胆碱、1-硬脂酰基-2-棕榈酰基-sn-甘油-3-磷酸胆碱、1-硬脂酰基-2-棕榈酰基-sn-甘油-3-磷酸胆碱;可食用的粘土组分,诸如钠膨润土、聚磷酸盐、蒙脱石、高岭土、cloisite;胆汁酸和盐,其包括胆酸、胆酸钠和钙盐、鹅脱氧胆酸、鹅脱氧胆酸钠和钙盐、鹅脱氧胆酸、鹅脱氧胆酸钠和钙盐、甘氨胆酸(glycocholic acid)、甘氨胆酸钠和钙盐、甘草次酸、甘草次酸钠、牛磺胆酸、牛磺胆酸钠和钙盐、石胆酸、石胆酸钠和钙盐;纳米片、膨润土、cloisite和/或其组合。
在一些实施方案中,第二域15可以任选地包含一种或多种除氧剂。如本文所用,术语“除氧剂”是指减少或消除不需要的氧化产物的产生的组合物。在一些实施方案中,所述除氧剂有效吸收氧。可以被并入到第二域15的合适的除氧剂可以包括(但不限于)抗坏血酸盐、异抗坏血酸盐、单宁、亚硫酸盐、可氧化的聚合物、多酸、多核酸、蛋白质、多糖、多肽、乙二胺四乙酸(EDTA)及其盐、有机谷氨酸及其盐、柠檬酸及其盐、膦酸盐、组氨酸、植物螯合素(phytochelatin)、血红蛋白、叶绿素、腐殖酸、转铁蛋白、去铁敏(desferrioxamine)、维生素E乙酸酯、生育酚及其组合。在一些实施方案中,所述除氧剂可以以第二域的总重量的约0-5重量%的量存在(例如0、0.5、1、1.5、2、2.5、3、3.5、4、4.5或5重量%)。
在一些实施方案中,膜5的第一和/或第二域可以包含一种或多种生物增强剂、pH控制成分(element)、溶解增强剂和/或溶剂,以使通过受试者口腔粘膜的吸收最大化。术语“生物增强剂”是指增加纳美芬的生物活性、生物利用度和/或功效的物质。合适的生物增强剂可以包括(但不限于)一种或多种脂肪酸、生物碱、胡椒碱、蒜素(allicin)、姜黄素、槲皮素等。在一些实施方案中,所述生物增强剂可以以第一域的总重量的约0-5重量%的量存在(例如0、0.5、1、1.5、2、2.5、3、3.5、4、4.5,或5重量%)。
术语“pH控制成分”是指可以抵抗pH变化的任何成分(诸如缓冲剂)。例如,在一些实施方案中,pH控制元素可以选自磷酸盐、乙酸盐、柠檬酸盐、精氨酸、TRIS或组氨酸缓冲剂中的一种或多种。在一些实施方案中,所述pH控制成分可以以第一域的总重量的约0-5重量%的量存在(例如,0、0.5、1、1.5、2、2.5、3、3.5、4、4.5或5重量%)。
术语“溶解增强剂”是指形成药物活性物(例如纳美芬)的增溶相的制剂。合适的药物增溶剂可以包括(但不限于)溶剂、油、表面活性剂和/或磷脂。在一些实施方案中,所述药物增溶剂可以以第二域的总重量的约0-5重量%的量存在(例如0、0.5、1、1.5、2、2.5、3、3.5、4、4.5或5重量%)。
术语“溶剂”是指溶解溶质的物质。合适的溶剂可以包括(但不限于)水、醇、多元醇或其组合。在一些实施方案中,所述溶剂可以以第一域的总重量的约0-5重量%的量存在(例如0、0.5、1、1.5、2、2.5、3、3.5、4、4.5或5重量%)。
在一些实施方案中,膜5可以包括超过2个的离散域。例如,所公开的膜可以包括第一离散域,所述第一离散域包含成膜的聚合物基质和任选的一种或多种pH调节缓冲剂、掩味剂和/或香料,以提供有效的掩味和/或定向渗透。所述膜可以包括第二离散域,所述第二离散域包含自组装的磷脂和/或胆汁盐以提供渗透增强。所述膜可还可以包含第三离散域,所述第三离散域包括至少一种药物活性物或其盐和任选的粘膜粘附的聚合物、pH调节缓冲剂和/或除氧剂,以当被放置在与口腔粘膜接触时提供由高浓度微环境引起的粘膜粘附和/或高驱动力。
在一些实施例中,膜5可以是粘膜粘附的膜。如本文所用,术语“粘膜粘附”是指合成的或天然的聚合物与生物学基底(biological substrate)的附着,如通过Robinson,JR,“Rationale of Bioadhesion/mucoadhesion”,在Gurny R.,JungingerH.E.eds.Bioadhesion:Possibilities and Future Trends,Stuttgart:Wissenschaftliche Verlagsesellschaft,Stuttgart,pages Vol.13page 15(1990)中所定义,其全部内容通过引用并入本文。当前不存在包含多个离散域的已知单层膜结构,其中至少一个结构域富含药物活性物,并且当包含药物活性物的离散域被放置在与口腔粘膜接触时,至少一个离散域提供有效的掩味和增强的经粘膜吸收。在一些实施方案中,至少一个离散域提供增强的经粘膜吸收。在一些实施方案中,当第一离散域被放置在与受试者的粘膜组织接触时,粘膜粘附的聚合物提供增强的吸收。
如上所述,膜5是单层膜。术语“单层”是指不包括可以容易地彼此分离(诸如通过将区域彼此剥离或楔入)的层的结构。因此,所公开的膜包括具有两个或更多个域的单层,但不是多层的层压结构。应当理解,不像必须是连续的层,域10、15在结构上可以是离散的或连续的。在一些实施方案中,所公开的单层膜在非水合状态下包含至少一个厚度不超过500μm的域。在一些实施方案中,膜5中的每个域具有500μm或更小的厚度。
当前公开的主题还包含形成连续且均匀的单层膜产品的方法,所述膜产品包含第一域和第二离散域,其中所述第一和第二离散域实质上不可分离并且具有不同浓度的药物活性物。例如,在一些实施方案中,可以通过使用第一溶剂制备第一域来构造所公开的膜,所述第一域包含湿聚合物基质和任选地一种或多种渗透促进剂、pH调节缓冲剂、掩味剂和/或矫味剂。通过铸塑第一湿聚合物基质来形成第一湿膜。可以使用干燥设备以干燥湿的聚合物基质并且将湿的膜暴露于足以闪蒸出第一溶剂的温度,从而干燥作为连续单层膜层压材料(laminate)的膜。然后可以使用第二溶剂制备包含药物活性物(例如纳美芬)的第二湿溶液或悬浮液。经由喷涂、电喷涂、雾化涂覆和/或超薄网纹涂覆(web coating)方法将预定量的第二湿溶液沉积在第一干燥膜的表面上的选定区域上,以形成湿的多域膜。然后将膜在干燥设备中干燥,并暴露于足以闪蒸出第二溶剂的温度,以形成包含第一和第二离散域的干燥的连续单层膜层压材料。在一些实施方案中,温度可以在约室温至约250℃的范围内。
在膜5是经粘膜单层膜装置的实施方案中,可以通过从合适的供应商(诸如Lohmann Therapie Systeme(LTS)、Tapemark Inc、Aquestive Therapeutics或ARx LLC)采购的干燥、不含药物的网纹涂覆的聚合物基质层压材料卷(roll)制备所述膜。然后可以使用第二溶剂制备包含药物活性物的第二湿溶液或悬浮液。可以通过喷涂、电喷涂、雾化涂覆和/或超薄网纹涂覆方法将预定量的第二湿溶液或悬浮液沉积到第一干燥膜表面的选定区域上。然后可以将湿的多域膜沉积在干燥设备中,并暴露于足以闪蒸出第二溶剂的温度(例如,约室温至250℃)以形成包含第一和第二离散域的干燥的连续单层膜层压材料。在一些实施方案中,包含药物活性物的第二离散域比包含聚合物的第一离散域实质上更薄。
在一些实施方案中,可以通过使用第一溶剂制备第一湿聚合物基质和一种或多种渗透促进剂、pH调节缓冲剂、掩味剂和/或香料来构造经粘膜单层膜装置5。可以通过铸塑湿的聚合物基质来形成第一湿膜。可以在第二溶剂中制备包含药物活性物20(或其盐)和除氧剂和/或药物增溶剂的第二湿溶液或悬浮液。然后可以使用喷涂、电喷涂、雾化涂覆和/或超薄网纹涂覆方法将预定量的第二湿溶液或悬浮液沉积在第一湿膜的表面上以形成湿的多域膜。可以将湿的多域膜沉积在干燥设备中并且暴露于足以闪蒸出第一和第二溶剂的温度(例如,约室温至250℃)以形成包含第一和第二离散域的单层经粘膜的膜装置。在一些实施方案中,第二离散域比第一离散域实质上更薄。
在一些实施方案中,可以通过使用第一溶剂制备第一湿聚合物基质和一种或多种渗透促进剂、pH调节缓冲剂、掩味剂、自聚集部分(诸如膨润土)和/或香料来构造经粘膜单层膜装置5。可以通过铸塑湿的聚合物基质来形成第一湿膜。可以将第一湿聚合物基质沉积在干燥器设备上,并暴露于足以闪蒸出第一溶剂的温度,以形成被铸塑为连续单层膜层压材料的第一干燥膜。然后可以在第二溶剂中制备第二湿溶液或悬浮液,所述第二湿溶液或悬浮液包含药物活性物20(或其盐)和任选的除氧剂和/或药物增溶剂(诸如自组装磷脂和/或胆汁盐)。可以使用喷涂、电喷涂、雾化涂覆和/或超薄网纹涂覆方法将预定量的第二湿溶液或悬浮液沉积在第一干燥膜的表面(或表面的选定区域)上。可以将湿的多域膜沉积在干燥设备中并且暴露于足以闪蒸出第一和/或第二溶剂的温度(例如,约室温至250℃)以形成干燥的连续单层膜层压材料,所述层压材料包含第一和第二离散域。在一些实施方案中,第二离散域比第一离散域实质上更薄。
可以以任何期望的形式配置膜5,诸如(但不限于)膜条、片(sheet)、盘(disc)、薄片(wafer)等。所公开的膜可以具有任何期望的厚度,诸如约50至约500μm,尽管具有更大或更小的厚度的膜也被包括在当前公开的主题的范围内。可以以任何期望的形状配置膜5,诸如矩形、正方形、圆形、三角形、抽象形状(abstract)等。应当理解,膜5可以具有适合用于预期用途的任何期望的厚度和/或大小。例如,所述膜可以是单剂量大小的单元,其将被放置到使用者的口腔中。
膜5可以从膜的连续卷中形成,或者可以定大小为期望的长度和宽度。
在使用中,将所公开的包含药物活性物(例如纳美芬)的膜放置在受试者的舌下(例如,在舌下或颊空间中)。所述膜迅速粘着、分解和溶解,从而使药物活性物溶解并随后被直接吸收到血流中。如上所述,纳美芬是KOR激动剂和NK-1受体拮抗剂。以此方式,据信SP的表达在突触前传入时降低,同时作为KOR激动剂阻断痒信号。因此,施用纳美芬以结合NK-1受体调整了(例如,降低或抑制)SP的表达,并阻断痒信号传递至CNS,这些已经与瘙痒有关。
当施用时,药物活性物以高浓度以分子状态驻留在紧邻受试者的粘膜的微环境中。以这种方式,提供了药物活性物的快速经粘膜吸收。在一些实施方案中,药物活性物的溶解速率显著地快于基质的溶解速率。
在一些实施方案中,可以将膜5向此需要的受试者每天约1-2次施用。但是,应当理解,剂量可以取决于许多因素,诸如病症的严重性、纳美芬的浓度、受试者的重量等。如本文所用的术语“受试者”是指动物,包括灵长类(猴、猿、人等)或非灵长类(母牛、马、猪、猫、狗、大鼠、小鼠、禽类、鱼等)。
可以经颊或舌下施用经粘膜的膜,以向受试者递送约1-32mg的纳美芬。例如,在一些实施方案中,可以将所述纳美芬以约1-5mg的初始剂量一天一次或两次经粘膜施用,然后滴定至有效剂量(诸如约5-32mg)。在一些实施方案中,可以将纳美芬在第一时间点(例如,在早上)用第一剂量经粘膜施用,并且在第二时间点(例如,在下午)用第二剂量经粘膜施用,其中所述第一剂量和第二剂量相等或不等。
在一些实施方案中,所述纳美芬在速释经粘膜剂型中,并通过颊或舌下途径施用,其在患者中提供约1-50ng/mL的平均C
在一些实施方案中,所述纳美芬在速释经粘膜剂型中,并颊或舌下施用,并在受试者中提供约5-500ng-hr/mL的平均AUC
在一些实施方案中,所述受试者患有慢性肾脏疾病相关的瘙痒、胆汁郁积性瘙痒和/或结节性痒疹。在一些实施方案中,所述受试者正在透析治疗。如本领域众所周知的,透析是用于患有急性或慢性肾功能不全的受试者的血液纯化的方法。在一些实施方案中,所述受试者患有慢性肾脏疾病或肾功能降低。当患者在透析治疗时,纳美芬和/或纳美芬葡糖苷酸可以为至少约50%可透析的(例如,至少50%、60%、70%、80%、90%或100%可透析的)。“可透析的”是指能够通过透析膜(即半透膜)的分子。
因此,所公开的膜可以用于治疗受试者中慢性肾脏疾病相关的瘙痒、胆汁郁积性瘙痒和/或结节性痒疹。迄今为止,尚不存在纳美芬的口腔经粘膜制剂来治疗这些病症。结果,当前公开的主题向受折磨的患者提供改变生活(life-changing)的缓解。
至少部分由于纳美芬的药理学安全和/或合适的口腔经粘膜施用途径,纳美芬有潜力成为用于治疗慢性瘙痒、慢性肾脏疾病相关的瘙痒和胆汁郁积性瘙痒的护理标准(standard-of-care)。
实施例
已经包括以下实施例以为本领域的普通技术人员提供指导,用于实施当前公开的主题的代表性实施方案。根据本公开内容和本领域技术的一般水平,本领域技术人员可以理解,以下实施例仅是示例性的,并且在不脱离当前公开的主题的范围的情况下可以采用多种改变、调整和替代。
实施例1
在小鼠中注射SP
使用C57BL小鼠建立了瘙痒的治疗方法,其中产生诱导瘙痒的P物质(SP)以诱导疾病状态。C57BL小鼠和ICR小鼠模型是建立良好并被证实的引起瘙痒的模型,并且当用SP皮内诱导时,C57BL小鼠和ICR小鼠模型已经成功被用在引起瘙痒的药效学示范(demonstration)中。
在实施例中使用~6-8周龄的健康雄性C57BL/6小鼠,并且其在研究开始时体重在21.2至26.8克的范围。在研究开始之前,使小鼠适应至少5天。通过尾标记和笼标签识别小鼠。该研究没有致盲(blind)。给小鼠喂食物种特异性的食物,并向动物随意供给食物和水。
在雄性C57BL小鼠的仅右侧或两侧皮内(ID)注射0.0168μg SP(N=4,组1)或PBS(N=2,组2)。从注射时间开始,由两名独立的观察员监测注射位点的抓挠行为持续30分钟。如图2a中所示,在用SP注射的小鼠中局部位点抓挠行为比在注射PBS的小鼠中更频繁,这证明SP注射可有效地诱导瘙痒。
将原始剂量的0.0168μg SP(组1)与更高剂量的33.7μg SP(N=4,组3)比较。如图2b中所示,与较低剂量相比,较高剂量的SP与小鼠中抓挠增加有关。因此得出的结论是,抓挠行为是对SP的存在和量的直接反应。
实施例2
在小鼠I中注射SP和纳美芬
为了测试纳美芬对SP诱导的抓挠行为的作用,在雄性C57BL小鼠中以33.7μg的SPID注射之前1小时,经由皮下(SC)注射给予纳美芬的剂量模拟100%的生物利用度(N=5,组4)。在SP注射之后监测抓挠行为持续30和60分钟。对照包括接受PBS代替SP的小鼠(N=6,组5)和接受安慰剂剂量的PBS和ID剂量的SP的小鼠(N=4,组6)。
如图3中所示,纳美芬完全缓和了对SP的引起瘙痒的反应。
实施例3
在小鼠II中注射SP和纳美芬
如下用SP或纳美芬对给雄性C57BL小鼠给药:组7(N=4)接受以250nM/50μL的剂量的在乙酸钠中的SP。组8(N=4)接受以250nM/50μL的剂量的在磷酸盐缓冲盐水(PBS)中的SP。组9(N=4)接受以0.5mM/50μL的剂量的在PBS中的SP。视频记录并评估了各种抓挠行为。
十五只雄性C57BL/6小鼠接受了单次皮内(ID)推注注射(bolus injection)P物质(SP)或PBS。组10(N=6)接受单次50μL PBS注射。组11(N=4)接受以0.5mM/50μl的剂量的在PBS中的SP。组12(N=5)在接受以0.5mM/50μL的剂量的在PBS中的SP之前30分钟接受纳美芬0.075mg/75μL皮下(SC)。视频记录并评估了抓挠行为。
然后根据以下规程为每个组进行活体(in-life)给药:
组7:在测试前30分钟,将所有小鼠放置在透明的圆柱形盒子(enclosure)中以适应。施用在乙酸钠中的SP的ID推注注射。
组8和组9:在测试前30分钟,将所有小鼠放置在透明的圆柱形盒子中以适应。施用在PBS中的SP的ID推注注射。注射SP后记录立即开始,并记录持续30分钟。
组10和组11:在测试前60分钟,将所有小鼠放置在透明的圆柱形盒子中以适应。施用在PBS中的SP的ID推注注射。注射SP后记录立即开始,并记录持续60分钟。
组12:在测试前,将所有小鼠置于透明的圆柱形盒子中60分钟以适应。施用纳美芬的SC推注注射。纳美芬注射后30分钟,施用在PBS中的SP的ID推注注射。注射SP后记录立即开始,并记录持续60分钟。
下表1中列出了研究设计的小结。
表1
在记录之前,使组7-9中的动物适应1小时。行为记录持续了30分钟(T0-T30)。
在记录之前,使组10-12中的动物适应1小时。行为记录持续60分钟(T0-T60)。对于组12,对6只动物给药,但是仅测试了5只动物,因为由于对SP注射无反应而将一只动物作为异常值排除在外。
下表2中给出了对于组7-9每0-30分钟的抓挠数。对于组7和组8的抓挠数一起取平均值。
下表3中给出了对于组10-12每10分钟时间间隔的抓挠数。数据也以图表方式显示在图4中。
表2
表3
下表4中给出了对于组10(PBS)、组11(0.5mM SP)和组12(0.75mg纳美芬)每0-30分钟和30-60分钟时间间隔的抓挠数。数据也以图表方式显示在图5中。
数据表明,纳美芬控制抓挠行为的能力(以及通过扩展(extension)瘙痒)可以在一个小时内保持。
表4
实施例4
SP剂量递增
递增施用到雄性C57BL/6小鼠的SP剂量,并记录痒用于分析。组13(N=8)在头端背部(rostral back)的右侧接受了135μg SP的ID注射。组14(N=8)在头端背部的右侧接受了233μg SP的ID注射。在剂量施用后的T0-60,摄像机立即开始记录以监测痒行为。在T60时,完成了最终的痒评估,结束了摄像机记录,并做出该研究的结论。
回顾记录以计算痒行为。两名研究人员回顾了记录,并计数在60分钟的收集时间期间每只小鼠的抓挠数。将两次观察的平均值记录为每60分钟的抓挠数。
下表5中列出了该研究设计,并且表6中给出了平均抓挠计数。
表5
对于每只测试的动物,每10分钟时间间隔观察随时间的抓挠。数据列于下表6中,并在图6中以图表方式显示。
表6
实施例5
测量在犬中的血浆浓度
使用犬进行测试以评估当使用示例性膜装置递送时随时间的纳美芬血浆浓度。测试了两个示例性膜装置。还测试了对照片剂用于比较。向犬施用18mg片剂,然后用饮用水冲洗10mL。颊施用纳美芬膜装置。同时施用两片8mg膜,总剂量为16mg。将犬麻醉,然后将膜装置放置在适当的位置。如下进行血液采样:给药前、给药后5mins、10mins、15mins、30mins、1小时、2小时、4小时、8小时、12小时、24小时和48小时。图7是线图,其显示了两个膜装置样品和对照片剂在20小时的时间段内的血浆浓度(ng/mL)。如图7中所示,使用膜装置施用的纳美芬的血浆浓度在一小时内高达50ng/mL。使用片剂施用的纳美芬的血浆浓度从未超过1ng/mL。因此,使用该薄膜装置可以显著更快速地达到纳美芬的更高浓度。图8是线图,其显示了3只犬的血浆浓度(ng/mL),每只犬均使用示例性膜装置施用纳美芬。图8显示了1小时的时间段内的血浆浓度,这有助于理解使用示例性膜装置可以多快速地递送纳美芬。显示了对于每只犬的各个血浆浓度数据点。绘制的线是三只犬的平均血浆浓度。如图8中所示,纳美芬的平均血浆浓度在5分钟内接近5ng/mL。在10分钟内,纳美芬的平均血浆浓度超过5ng/mL。
参考文献
1.ESRD Patients,in 2013–A Global Perspective.Fresenius Medical Care,2014.
2.Pisani,RL,et al,“Pruritus in Hemodialysis patients:Intl Resultsfrom Dialysis Outcomes and Practical Pattern Study,”Nephrol.Dial.Transplant,2006,21:3495-3505.
3.Coresh,et al.,JAMA(2007),298:2038-47.
4.
5.Cara Therapeutics Doses First Patient in Second Pivotal Phase3Efficacy Trial of KORSUVA
6.Trevi Therapeutics Raises$50 Million Series C Financing Led by NewEnterprise Associates,July 17,2017 Press Release.
7.Ko MC,Lee H,Song MS,Sobczyk-Kojiro K,Mosberg HI,Kishioka S,“Activation of kappa-opioid receptors inhibits pruritus evoked bysubcutaneous or intrathecal administration of morphine in monkeys,”JPharmacol.Exp.Ther.2003;305:173–9.
8.Lee H,Naughton NN,Woods JH,Ko MC.Effects of butorphanol onmorphine-induced itch and analgesia in primates.Anesthesiology.2007;107:478–85.
9.Charuluxananan S,Kyokong O,Somboonviboon W,Lertmaharit S,Ngamprasertwong P,Nimcharoendee K.“Nalbuphine versus Propofol for treatmentof--intrathecal morphine-induced pruritus after cesarean delivery,”AnesthAnalg.2001;93:162–5.
10.Charuluxananan S,Kyokong O,Somboonviboon W,Narasethakamol A,Promlok P.,“Nalbuphine versus ondansetron for prevention of intrathecalmorphine-induced pruritus after cesarean delivery,”Anesth Analg.2003;96:1789–93.
- 治疗慢性肾脏疾病相关的瘙痒的方法和装置
- 粘膜组织收缩性治疗剂、与粘膜组织相关的疾病的治疗方法、注射器及治疗装置
