脂质纳米颗粒的制备及其施用方法
文献发布时间:2023-06-19 12:14:58
相关申请
本申请要求2018年9月20日提交的美国临时申请号62/733,974的优先权和权益,所述临时申请的全部内容以引用的方式并入文本。
序列表以引用的方式并入
于2019年9月20日创建且大小为1KB的名称为“MRNA-048_001WO_ST25.txt”的文件的内容特此以引用的方式整体并入。
技术领域
本公开提供了产生核酸脂质纳米颗粒(LNP)制剂的新颖方法、其产生的制剂以及相关的治疗和/或诊断用途。
背景技术
生物活性物质(如小分子药物、蛋白质和核酸)的有效靶向递送代表了持续的医学挑战。特别地,由于此类物质的相对不稳定性和低细胞渗透性,使得核酸向细胞的递送变得困难。因此,需要开发有助于将治疗剂和预防剂(如核酸)递送至细胞的方法和组合物。
含脂质的纳米颗粒或脂质纳米颗粒、脂质体和脂质复合物作为生物活性物质如小分子药物、蛋白质和核酸进入细胞和/或细胞内区室中的转运媒介物已被证明是有效的。尽管已展示了多种此类含脂质纳米颗粒,但仍缺乏安全性、功效和特异性方面的改进。
发明内容
在一些方面,本公开提供了一种产生脂质纳米颗粒(LNP)组合物的方法,所述方法包括:(i)将水性缓冲溶液和有机溶液混合,从而形成包含脂质纳米颗粒(LNP)的脂质纳米颗粒(LNP)制剂,所述脂质纳米颗粒包封核酸;和(ii)加工所述脂质纳米颗粒(LNP)制剂,从而形成所述脂质纳米颗粒组合物;其中所述有机溶液包含有机溶剂中的有机溶剂性可溶性核酸和可电离脂质;并且其中所述有机溶剂可溶性核酸包含疏水性有机阳离子。
在一些方面,本公开提供了一种向患者施用脂质纳米颗粒(LNP)制剂的方法,所述方法包括:(i)提供具有在约7.0至约9.0范围内的第一pH并且包含水性缓冲液中的治疗剂和/或预防剂的水溶液,以及包含有机溶剂中的可电离脂质和包封剂的有机溶液;(ii)通过将所述水溶液和所述有机溶液混合而形成包含包封所述治疗剂和/或预防剂的脂质纳米颗粒的脂质纳米颗粒制剂,以使得所述脂质纳米颗粒制剂具有在约7.0至约9.0范围内的第二pH并且包含相对于所述脂质纳米颗粒制剂的总体积至少1体积%的所述有机溶剂;以及(iii)在所述混合后不到约72小时向所述患者施用所述脂质纳米颗粒制剂。
在一些方面,本公开提供了一种向患者施用脂质纳米颗粒(LNP)制剂的方法,所述方法包括:(i)提供具有在约4.5至约小于7.0范围内的第一pH并且包含水性缓冲液中的治疗剂和/或预防剂的水溶液,以及包含有机溶剂中的可电离脂质的有机溶液;(ii)通过将所述水溶液和所述有机溶液混合而形成包含包封所述治疗剂和/或预防剂的脂质纳米颗粒的脂质纳米颗粒制剂,以使得所述脂质纳米颗粒制剂具有在约4.5至约小于7.0范围内的第二pH并且包含相对于所述脂质纳米颗粒制剂的总体积至少1体积%的所述有机溶剂;以及(iii)在所述混合后不到约72小时向所述患者施用所述脂质纳米颗粒制剂。
在一些方面,本公开提供了一种向患者施用脂质纳米颗粒(LNP)制剂的方法,所述方法包括:(i)提供具有在约7.0至约9.0范围内的第一pH的水性缓冲溶液,以及包含有机溶剂中的可电离脂质、包封剂和治疗剂和/或预防剂的有机溶液;(ii)通过将所述水性缓冲溶液和所述有机溶液混合而形成包含包封所述治疗剂和/或预防剂的脂质纳米颗粒的脂质纳米颗粒制剂,以使得所述脂质纳米颗粒制剂具有在约7.0至约9.0范围内的第二pH并且包含相对于所述脂质纳米颗粒制剂的总体积至少约1体积%的所述有机溶剂;以及(iii)在所述混合后不到约72小时向所述患者施用所述脂质纳米颗粒制剂。
在一些方面,本公开提供了一种向患者施用脂质纳米颗粒(LNP)制剂的方法,所述方法包括:(i)提供具有在约4.5至约小于7.0范围内的第一pH的水性缓冲溶液,以及包含有机溶剂中的可电离脂质和治疗剂和/或预防剂的有机溶液;(ii)通过将所述水性缓冲溶液和所述有机溶液混合而形成包含包封所述治疗剂和/或预防剂的脂质纳米颗粒的脂质纳米颗粒制剂,以使得所述脂质纳米颗粒制剂具有在约4.5至约小于7.0范围内的第二pH并且包含相对于所述脂质纳米颗粒制剂的总体积至少1体积%的所述有机溶剂;以及(iii)在所述混合后不到约72小时向所述患者施用所述脂质纳米颗粒制剂。
在一些方面,本公开提供了一种治疗或预防疾病或病症的方法,所述方法包括根据本文所公开的方法向有需要的受试者施用脂质纳米颗粒(LNP)制剂。
在一些方面,本公开提供了通过本文所公开的方法制备的脂质纳米颗粒(LNP)制剂和/或脂质纳米颗粒(LNP)组合物。
在一些方面,本公开提供了通过本文所公开的方法制备的脂质纳米颗粒(LNP)制剂和/或脂质纳米颗粒(LNP)组合物,所述脂质纳米颗粒制剂和/或脂质纳米颗粒组合物用于治疗或预防疾病或病症。
在一些方面,本公开提供了一种本文所公开的水性缓冲溶液和一种本文所公开的有机溶液。
在一些方面,本公开提供本文所公开的水性缓冲溶液和/或有机溶液在制造用于治疗或预防疾病或病症的药物(例如脂质纳米颗粒(LNP)制剂和/或脂质纳米颗粒(LNP)组合物)中的用途。
在一些方面,本公开提供了一种药盒,所述药盒包括本文所公开的水性缓冲溶液和本文所公开的有机溶液。
除非另外定义,否则本文使用的所有技术术语和科学术语具有与本公开所属领域的普通技术人员通常所理解的相同的含义。尽管在实践或测试本公开时可使用与本文所述的那些方法和材料类似或等效的方法和材料,但以下描述了合适的方法和材料。本文提及的所有公布、专利申请、专利以及其它参考文献以引用的方式整体并入。在冲突的情况下,以包括定义在内的本说明书为准。另外,材料、方法以及实例仅仅是示意性的并且并不打算是限制性的。
根据以下具体实施方式和权利要求书,本发明的其他特征和优点将是显而易见的。
附图说明
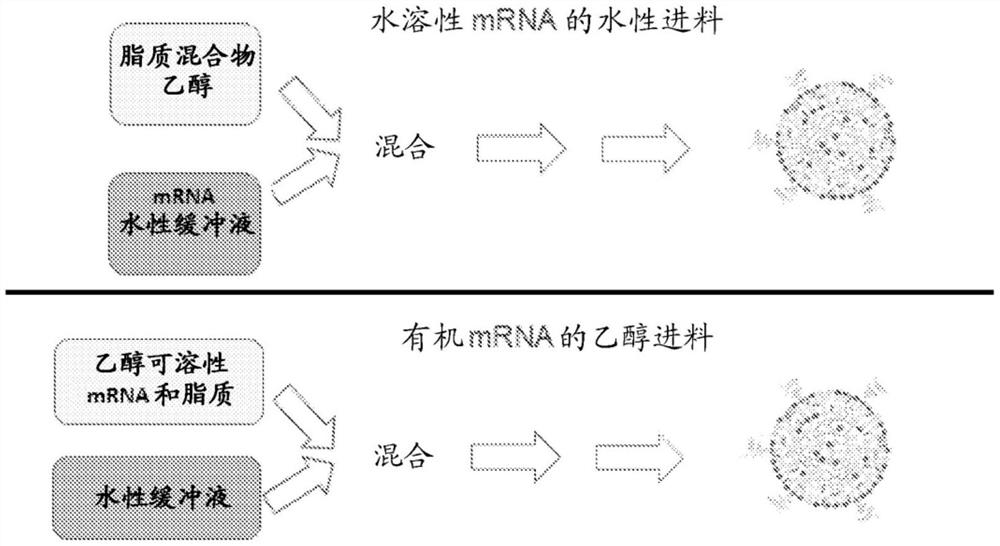
图1是说明水性进料mRNA(AFM)与有机进料mRNA(OFM)脂质纳米颗粒配制工艺之间的差异的示意图。
图2是有机进料mRNA形成的脂质纳米颗粒的冷冻图像。
图3是比较水性进料mRNA(AFM)和有机进料mRNA(OFM)的体外表达的图。正方形代表AFM,并且圆圈代表OFM。
图4是比较水性进料mRNA(AFM)NanoAssemblr混合、AFM纳米沉淀混合和有机进料mRNA(OFM)纳米沉淀混合的体外表达的图。
图5是说明实验性T混合过程设置的示意图。
图6是有机进料mRNA形成的脂质纳米颗粒的冷冻图像。
图7是比较水性进料mRNA(AFM)96孔混合以及单独地和合并的有机进料mRNA(OFM)96孔混合的体外表达的图。正方形代表OFM 96孔重复样品A,深色三角形代表OFM 96孔重复样品B,浅色三角形代表OFM 96孔重复样品C,圆圈代表合并的OFM 96孔,并且菱形代表AFM96孔。
图8是比较通过96孔混合和微流体混合形成的OFM脂质纳米颗粒和AFM脂质纳米颗粒的平均脂质纳米颗粒直径和包封效率的图。
图9是比较静脉内施用PBS(1);通过对照水性进料mRNA方法制备的0.5mg/kg脂质纳米颗粒制剂(2);以及通过本公开的方法采用有机进料mRNA T-混合(3)和96孔板高通量混合(4)制备的0.5mg/kg脂质纳米颗粒制剂6小时后小鼠中的荧光素酶表达水平(全身通量)的图。
图10是比较静脉内施用PBS(1);通过对照水性进料mRNA方法制备的0.5mg/kg脂质纳米颗粒制剂(2);以及通过本公开的方法采用有机进料mRNA T-混合(3)和96孔板高通量混合(4)制备的0.5mg/kg脂质纳米颗粒制剂24小时后小鼠中的荧光素酶表达水平(全身通量)的图。
图11A-11D是静脉内施用PBS(图11A);通过对照水性进料mRNA方法制备的0.5mg/kg脂质纳米颗粒制剂(图11B);以及通过本公开的方法采用有机进料mRNA T-混合(图11C)和96孔板高通量混合(图11D)制备的0.5mg/kg脂质纳米颗粒制剂6小时后小鼠的全身体内成像系统(IVIS)生物发光图像。
图12A-12D是静脉内施用PBS(图12A);通过对照水性进料mRNA方法制备的0.5mg/kg脂质纳米颗粒制剂(图12B);以及通过本公开的方法采用有机进料mRNA T-混合(图12C)和96孔板高通量混合(图12D)制备的0.5mg/kg脂质纳米颗粒制剂6小时后小鼠肺(1)、肝脏(2,圆圈)和脾(3)组织分布的离体生物发光图像。
图13A-13C是比较静脉内施用PBS(1);通过对照水性进料mRNA方法制备的0.5mg/kg脂质纳米颗粒制剂(2);以及通过本公开的方法采用有机进料mRNA T-混合(3)和96孔板高通量混合(4)制备的0.5mg/kg脂质纳米颗粒制剂6小时后离体小鼠肝脏(图13A)、肺(图13B)和脾(图13C)组织中的荧光素酶表达水平的图。
图14A-14D是静脉内施用PBS(图14A);通过对照水性进料mRNA方法制备的0.5mg/kg脂质纳米颗粒制剂(图14B);以及通过本公开的方法采用有机进料mRNA T-混合(图14C)和96孔板高通量混合(图14D)制备的0.5mg/kg脂质纳米颗粒制剂24小时后小鼠的全身体内成像系统(IVIS)生物发光图像。
图15是比较肌肉内背侧施用PBS(1);通过对照水性进料mRNA方法制备的0.1mg/kg脂质纳米颗粒制剂(2);以及通过本公开的方法采用有机进料mRNA T-混合(3)和96孔板高通量混合(4)制备的0.1mg/kg脂质纳米颗粒制剂6小时后小鼠中的荧光素酶表达水平(全身通量)的图。
图16是比较肌肉内背侧施用PBS(1);通过对照水性进料mRNA方法制备的0.1mg/kg脂质纳米颗粒制剂(2);以及通过本公开的方法采用有机进料mRNA T-混合(3)和96孔板高通量混合(4)制备的0.1mg/kg脂质纳米颗粒制剂24小时后小鼠中的荧光素酶表达水平(全身通量)的图。
图17A-17D是肌肉内施用PBS(图17A);通过对照水性进料mRNA方法制备的0.1mg/kg脂质纳米颗粒制剂(图17B);以及通过本公开的方法采用有机进料mRNA T-混合(图17C)和96孔板高通量混合(图17D)制备的0.1mg/kg脂质纳米颗粒制剂6小时后小鼠的全身体内成像系统(IVIS)生物发光图像。
图18A-18D是比较肌肉内施用PBS(1);通过对照水性进料mRNA方法制备的0.1mg/kg脂质纳米颗粒制剂(2);以及通过本公开的方法采用有机进料mRNA T-混合(3)和96孔板高通量混合(4)制备的0.1mg/kg脂质纳米颗粒制剂6小时后离体小鼠注射部位(图18A)、肝脏(图18B)、肺(图18C)和脾(图18D)组织中的荧光素酶表达水平的图。
图19A-19D是肌肉内施用PBS(图19A);通过对照水性进料mRNA方法制备的0.1mg/kg脂质纳米颗粒制剂(图19B);以及通过本公开的方法采用有机进料mRNA T-混合(图19C)和96孔板高通量混合(图19D)制备的0.1mg/kg脂质纳米颗粒制剂6小时后小鼠肺(1)、肝脏(2)、脾(3)和注射部位(4,圆圈)组织分布的离体生物发光图像。
图20A-20D是肌肉内施用PBS(图20A);通过对照水性进料mRNA方法制备的0.1mg/kg脂质纳米颗粒制剂(图20B);以及通过本公开的方法采用有机进料mRNA T-混合(图20C)和96孔板高通量混合(图20D)制备的0.1mg/kg脂质纳米颗粒制剂24小时后小鼠的全身体内成像系统(IVIS)生物发光图像。
图21A-21D是比较肌肉内施用PBS(1);通过对照水性进料mRNA方法制备的0.1mg/kg脂质纳米颗粒制剂(2);以及通过本公开的方法采用有机进料mRNA T-混合(3)和96孔板高通量混合(4)制备的0.1mg/kg脂质纳米颗粒制剂24小时后离体小鼠注射部位(图21A)、肝脏(图21B)、肺(图21C)和脾(图21D)组织中的荧光素酶表达水平的图。
图22A-22D是肌肉内施用PBS(图22A);通过对照水性进料mRNA方法制备的0.1mg/kg脂质纳米颗粒制剂(图22B);以及通过本公开的方法采用有机进料mRNA T-混合(图22C)和96孔板高通量混合(图22D)制备的0.1mg/kg脂质纳米颗粒制剂24小时后小鼠肺(1)、肝脏(2)、脾(3)和注射部位(4,圆圈)组织分布的离体生物发光图像。
图23是比较肌肉内施用PBS;通过对照水性进料mRNA方法制备的0.1mg/kg脂质纳米颗粒制剂;以及通过本公开的方法采用有机进料mRNA T-混合和96孔板高通量混合制备的0.1mg/kg脂质纳米颗粒制剂6小时后的细胞因子诱导水平(IFN-α、IP-10、MCP-1)的图。圆圈代表PBS,正方形代表水性进料mRNA NanoAssemblr(AFM-Na),向上指向的三角形代表有机进料mRNA T-混合(OFM-T混合),并且向下指向的三角形代表OFM 96孔。
图24是比较水性进料mRNA NanoAssemblr混合以及有机进料mRNA(OFM)混合和96孔混合的体外表达的图。圆圈代表水性进料mRNA NanoAssemblr(AFM-Na),正方形代表有机进料mRNA T-混合(OFM-T混合),并且三角形代表OFM 96孔。
图25是比较采用通过切向流过滤法在无冻干的情况下制备的三乙胺(TEA)、三丙胺(TPA)和三丁胺(TBA)的有机可溶性mRNA盐,通过搅拌板台式小瓶混合制备的脂质纳米颗粒制剂在初始形成后、在用PBS缓冲液渗析后以及在使用离心过滤器浓缩后的平均粒径的图。
图26是比较采用通过切向流过滤法在无冻干的情况下制备的三乙胺(TEA)、三丙胺(TPA)和三丁胺(TBA)的有机可溶性mRNA盐,通过搅拌板台式小瓶混合制备的脂质纳米颗粒制剂在初始形成后、在用PBS缓冲液渗析后以及在使用离心过滤器浓缩后的多分散性指数(PDI)的图。
图27是比较采用通过切向流过滤法在无冻干的情况下制备的三乙胺(TEA)、三丙胺(TPA)和三丁胺(TBA)的有机可溶性mRNA盐,通过搅拌板台式小瓶混合制备的脂质纳米颗粒制剂的包封效率(%EE)(如通过RiboGreen测定所测量)的图。
图28是比较通过将有机进料mRNA储备液和脂质混合物与25mM乙酸盐缓冲液(pH约5)或20mM tris缓冲液/8%蔗糖(pH约7.4)的水相混合或水性进料mRNA储备液制备的脂质纳米颗粒的包封效率(%EE)的图。
图29是比较体内床边脂质纳米颗粒制剂在6小时的表达水平的图。
图30是比较体内床边脂质纳米颗粒制剂在24小时的表达水平的图。
图31是比较水性进料mRNA(AFM)NanoAssemblr混合和96孔混合AFM以及有机进料mRNA(OFM)96孔混合的体外表达的图。圆圈表示水性进料mRNANanoAssemblr(AFM-Na);正方形表示96孔合并的AFM;并且三角形表示96孔合并的OFM。
图32是比较水性进料mRNA(AFM)NanoAssemblr混合和L型注射器混合AFM以及有机进料mRNA(OFM)L型注射器混合的体外表达的图。深色圆圈表示NanoAssemblr水性进料mRNA(AFM-Na),浅色圆圈表示L型注射器混合AFM(L型注射器-AFM),并且正方形表示L型注射器混合OFM(L型注射器-OFM)。
图33是比较水性进料mRNA(AFM)NanoAssemblr混合和K型注射器混合AFM以及有机进料mRNA(OFM)K型注射器混合的体外表达的图。圆圈表示NanoAssemblr水性进料mRNA(AFM-Na),三角形表示K型注射器混合AFM(K型注射器-AFM),并且菱形表示K型注射器混合OFM(K型注射器-OFM)。
图34是比较水性进料mRNA(AFM)NanoAssemblr混合、96孔混合AFM、K型注射器混合AFM和L型注射器混合AFM的体外表达的图。深色圆圈表示NanoAssemblr水性进料mRNA;正方形表示96孔合并的AFM;三角形表示K型注射器混合AFM(K型注射器-AFM);并且浅色圆圈表示L型注射器混合AFM(L型注射器-AFM)。
图35是示出CD-1小鼠在6小时在对数尺度上的hEPO表达的图,其示出给药pH对N:P为5.8、4和3的相同制剂的影响。
图36是示出CD-1小鼠在6小时在线性尺度上的hEPO表达的图,其示出给药pH对N:P为5.8、4和3的相同制剂的影响。
图37是示出CD-1小鼠在24小时在对数尺度上的hEPO表达的图,其示出给药pH对N:P为5.8、4和3的相同制剂的影响。
图38是示出CD-1小鼠在24小时在线性尺度上的hEPO表达的图,其示出给药pH对N:P为5.8、4和3的相同制剂的影响。
图39A-39C是示出CD-1小鼠在6小时的细胞因子应答的图,其比较了制剂的给药pH和N:P比例。
图40示出实施例8中用于中性pH床边配制程序的较高pKa阳离子的结构。
图41是示出给药后6小时的hEPO表达的图,其示出使用中性pH方法制备的制剂与传统对照的可比性。配制第2组并在pH 5下给药,而第3组是在给药前中和至pH 7.4的第2组样品。制备第4组和第5组,并在pH 7.4下给药。
图42是示出给药后24小时的hEPO表达的图,其示出使用中性pH方法制备的制剂与传统对照的可比性。配制第2组并在pH 5下给药,而第3组是在给药前中和至pH 7.4的第2组样品。制备第4组和第5组,并在pH 7.4下给药。
图43A-43C是示出CD-1小鼠在6小时的细胞因子应答的图,其比较了配制工艺和高pKa脂质添加。
图44是示出使用中性pH配制方法测试的另外高pKa阳离子的结构的图。
图45是示出给药后6小时的hEPO表达的图,其示出使用EA-III系列中的替代高pKa阳离子制备的制剂与使用中性pH床边纳米沉淀方法的可比性。
图46是示出给药后24小时的hEPO表达的图,其示出使用EA-III系列中的替代高pKa阳离子制备的制剂与使用中性pH床边纳米沉淀方法的可比性。
图47A-47B是示出CD-1小鼠在6小时的细胞因子应答的图,其比较了在EA-III系列至EA-1和传统LNP对照中高pKa阳离子的影响。
图48是示出给药和样品收集时间表的图。
图49是示出床边第3至6组的剂量2大颗粒(>0.8μm)表征数据的图。
图50是示出床边第3至6组的剂量2大颗粒(>2μm)表征数据的图。
图51是示出第1-6组的IgG(五聚体)效价的图,其证明在所有测试的制剂中的免疫应答,包括用酸性或中性pH床边纳米沉淀程序产生的那些制剂。
图52是示出第1-6组的IgG(gB)效价的图,其证明在所有测试的制剂中的免疫应答,包括用酸性或中性pH床边纳米沉淀程序产生的那些制剂。
图53是示出给药和样品收集时间表的图。
图54是示出对于对照和使用中性或酸性条件的床边纳米沉淀制剂观察到的对CA-A、CA-B和CA-C再刺激的I类应答的图。
图55是示出对于对照和使用中性或酸性条件的床边纳米沉淀制剂观察到的对CA-D和CA-E再刺激的II类应答的图。
图56是示出给药后6小时全身发光的图。
图57是示出给药后6小时离体肝脏发光的图。
图58是示出给药后6小时离体脾发光的图。
图59是示出给药后6小时离体肺发光的图。
图60示出实施例13中使用的高pKa脂质(EA-13)的结构。
图61是示出给药后6小时hEPO浓度的图。
图62是示出给药后24小时hEPO浓度的图。
图63是示出给药后6小时IP-10水平的图。
图64是示出给药后6小时MCP-1水平的图。
具体实施方式
本公开部分地基于以下发现:如本文所公开的产生脂质纳米颗粒(LNP)制剂的方法可影响和/或决定所述LNP制剂的物理性质(例如,LNP稳定性)、化学性质(例如,核酸稳定性)和/或生物学性质(例如功效、细胞内递送、免疫原性)。
在一些实施方案中,本公开的方法减轻所产生的脂质纳米颗粒(LNP)制剂的不希望的性质变化。在一些实施方案中,与通过可比较的方法(例如,没有如本文所公开的一个或多个步骤的方法)产生的LNP制剂相比,本公开的方法减轻所产生的脂质纳米颗粒(LNP)制剂的不希望的性质变化。
在一些实施方案中,不希望的性质变化是由对LNP制剂或其中的LNP的应力引起的。在一些实施方案中,在产生、纯化、包装、储存、运输和/或使用LNP制剂过程中诱导了应力。在一些实施方案中,应力是热、剪切、过度搅拌、膜浓度极化(电荷状态的变化)、脱水、冻结应力、干燥应力、冻/融应力和/或雾化应力。在一些实施方案中,在冷冻或冻干LNP制剂的过程中诱导了应力。
在一些实施方案中,不希望的性质变化是LNP制剂的物理稳定性降低。在一些实施方案中,不希望的性质变化是LNP制剂中的杂质和/或次可见颗粒的量增加或LNP的平均尺寸增加。
在一些实施方案中,与通过如本文所公开的可比较的方法产生的LNP制剂相比,本公开的方法使所产生的LNP制剂的物理稳定性的降低程度(例如,LNP的平均尺寸的增加)减轻。
在一些实施方案中,与通过如本文所公开的可比较的方法产生的LNP制剂的平均LNP直径相比,通过本公开的方法产生的LNP制剂具有约99%或更小、约98%或更小、约97%或更小、约96%或更小、约95%或更小、约90%或更小、约85%或更小、约80%或更小、约75%或更小、约70%或更小、约65%或更小、约60%或更小、约55%或更小、约50%或更小、约40%或更小、约30%或更小、约20%或更小或约10%或更小的平均LNP直径。
在一些实施方案中,不希望的性质变化是LNP制剂的化学稳定性降低。在一些实施方案中,不希望的性质变化是LNP制剂中核酸(例如,RNA(例如,mRNA))的完整性降低。
在一些实施方案中,不希望的性质变化是LNP制剂的生物学性质降低。在一些实施方案中,不希望的性质变化是LNP制剂的功效、细胞内递送和/或免疫原性降低。
在一些实施方案中,通过本公开的方法产生的LNP制剂具有的功效、细胞内递送和/或免疫原性高于通过如本文所述公开的可比较的方法产生的LNP制剂的功效、细胞内递送和/或免疫原性。
在一些实施方案中,通过本公开的方法产生的LNP制剂具有的功效、细胞内递送和/或免疫原性比通过可比较的方法产生的LNP制剂的功效、细胞内递送和/或免疫原性高了约5%或更高、约10%或更多、约15%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约1倍或更多、约2倍或更多、约3倍或更多、约4倍或更多、约5倍或更多、约10倍或更多、约20倍或更多、约30倍或更多、约40倍或更多、约50倍或更多、约100倍或更多、约200倍或更多、约300倍或更多、约400倍或更多、约500倍或更多、约1000倍或更多、约2000倍或更多、约3000倍或更多、约4000倍或更多、约5000倍或更多或约10000倍或更多。
在一些实施方案中,通过本公开的方法产生的LNP制剂表现出比通过可比较的方法产生的LNP制剂的核酸表达(例如,mRNA表达)更高的核酸表达(例如,mRNA表达)。
在一些实施方案中,通过本公开的方法产生的LNP制剂表现出的核酸表达(例如,mRNA表达)比通过可比较的方法产生的LNP制剂的核酸表达(例如,mRNA表达)高了约5%或更高、约10%或更多、约15%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约1倍或更多、约2倍或更多、约3倍或更多、约4倍或更多、约5倍或更多、约10倍或更多、约20倍或更多、约30倍或更多、约40倍或更多、约50倍或更多、约100倍或更多、约200倍或更多、约300倍或更多、约400倍或更多、约500倍或更多、约1000倍或更多、约2000倍或更多、约3000倍或更多、约4000倍或更多、约5000倍或更多或约10000倍或更多。
产生脂质纳米颗粒(LNP)制剂的方法和施用脂质纳米颗粒制剂的方法
本发明通过在LNP形成过程中引入水相之前在有机相中预先合并寡核苷酸和脂质组分而克服了由在传统脂质纳米颗粒(LNP)形成过程中使用的复杂混合所带来的一些限制。这通过使用溶解度已通过离子配对改变以使其可溶于与传统LNP形成工艺相容的有机溶液中的mRNA来实现。产生与磷酸盐主链相关的阳离子为疏水性有机分子的mRNA盐将mRNA的溶解度特征从高度水溶性转变为现在可溶于有机溶剂和具有高乙醇含量的溶剂混合物中的物质。与传统程序相反,这使得在LNP形成过程中与水相混合之前,寡核苷酸有效负载直接与LNP的疏水性脂质和阳离子脂质组分一起溶解于有机相中。
典型脂质纳米颗粒(LNP)形成程序包括溶解于有机溶剂(如乙醇)中的疏水性脂质组分与含有待负载到所得颗粒中的寡核苷酸的水性缓冲溶液的受控混合。由于混合的复杂性以及成功地将寡核苷酸包埋于颗粒核心中所需的各种离子相互作用,在整个颗粒形成过程中存在大量起作用的变量,所述变量可影响所得颗粒的质量、稳定性和功能。
本发明通过在与水相混合之前将mRNA或其他寡核苷酸与脂质组分合并于有机溶剂中而简化LNP形成过程。有机溶剂可溶性mRNA(OSSM)确保缩合阳离子脂质在整个混合过程中可自由进入mRNA,并避免了在混合过程中需要将mRNA分配到疏水性环境中或用疏水性组分包被以使其掺入LNP核心中。这预期降低与受控混合工艺相关的复杂性,生成更脱水的LNP核心,并提供围绕LNP表面参数的更多组成灵活性,因为mRNA是从有机相(更脱水的状态)开始的。这种额外的脱水应该对制剂中的颗粒稳定性和mRNA化学稳定性具有有益的作用,同时降低的混合负担和有效负载从大量水相中转移出来应简化配制过程。
除了简化混合之外,还预期在引入水相之前寡核苷酸与构成LNP核心的疏水性组分一起驻留在有机相中将通过消除对寡核苷酸有效负载从水相转移至LNP核心的需要而使LNP表面具有更大柔性。当寡核苷酸从水相进料时,高密度的分子(如聚乙二醇化脂质)在传统形成技术下可产生mRNA交换的空间屏障。OSSM确保在水相引入之前,mRNA已经非常接近LNP的疏水性组分,从而使得LNP组成的灵活性提高,尤其是对于LNP表面改性组分而言。
本发明涉及使得能够使用溶解于有机溶剂相中的mRNA形成LNP的方法。第一步骤涉及将mRNA的水溶性钠盐形式转化为有机溶剂可溶性mRNA(OSSM)形式。下一步骤是将OSSM溶解于有机溶剂或溶剂混合物中,以使得能够与有机溶液进料的mRNA一起形成LNP。
将mRNA的水溶性形式(如钠盐)溶解于水中。将此溶液与缓冲溶液合并,其中缓冲液的基本部分由具有增加的有机溶解度的有机化合物组成。然后用缓冲液交换过程对此溶液进行处理,以从所述溶液中消除残余无机阳离子,并且仅留下所需的疏水性阳离子,以与mRNA的磷酸酯主链相互作用。
这一过程能够以多种方式来实现。在一些实施方案中,使用切向流过滤,通过将mRNA溶液交换为缓冲液以驱动阳离子交换为疏水性阳离子来对mRNA溶液进行加工。在缓冲液交换步骤之后,可将mRNA溶液进一步交换为ddH
在一些实施方案中,渗析用于将水溶性mRNA转化为疏水性盐形式。在此实施方案中,将起始mRNA溶液溶解于缓冲液中,所述缓冲液的基本组分是疏水性有机阳离子。然后将mRNA用添加缓冲液进行渗析,以驱动阳离子交换过程,以及额外的缓冲液更换。然后可将含mRNA的溶液用ddH
在一些实施方案中,疏水性离子配对反相方法用于产生mRNA的所需疏水性盐形式。在这种程序中,可使用疏水性离子配对方法使mRNA结合至反相载体上。然后可用有机溶剂和水性缓冲液的组合(其阳离子部分为疏水性有机分子)从反相柱上洗脱mRNA。可将所得的含mRNA的级分进一步干燥以提供呈所需疏水性阳离子形式的mRNA。所述方法是特别有用的,因为产生mRNA的疏水性盐的过程可并入通常用于mRNA和其他寡核苷酸构建体的产生和纯化的反相纯化技术中。
在另一个实施方案中,可使用离子交换树脂来将mRNA从水溶性阳离子盐形式转化为疏水性盐形式。对于这种程序,将离子交换树脂负载所需的疏水性阳离子,并用mRNA溶液进行处理,以提供mRNA的所需疏水性盐形式。将mRNA溶液通过蒸发或冻干进行干燥,以提供用于溶解于LNP工艺所需的有机相中的材料。
在另一个实施方案中,可使用用含疏水性阳离子的缓冲液预平衡的尺寸排阻柱将疏水性阳离子添加至mRNA中。将mRNA溶液通过蒸发或冻干进行干燥,以提供用于溶解于LNP工艺所需的有机相中的材料。
在一些实施方案中,可使用适当的分子量离心装置;来将mRNA上的阳离子交换为疏水性更高且有机可溶性的阳离子。将含mRNA的水溶性阳离子盐的mRNA溶液用含所需疏水性阳离子作为缓冲液的基本组分的缓冲液稀释。用交换缓冲液步骤进行重复浓缩和稀释,然后与ddH
一旦将mRNA的疏水性盐形式干燥,就可将材料溶解于有机溶液中以进行LNP配制。
在一些实施方案中,将有机溶剂可溶性mRNA(OSSM)直接溶解于所需的有机溶剂如mRNA中。
在一些实施方案中,首先将OSSM溶解于少量有机溶剂如苄醇中以促进疏水性mRNA盐的湿润和溶解,然后使用用于本体相中的所需溶剂(如乙醇)稀释以得到混合有机溶剂系统。
可将此溶液与阳离子脂质、辅助脂质、聚乙二醇化脂质合并,以生成适合于LNP产生的mRNA和脂质的有机溶液。
可将mRNA和脂质的有机溶液沉淀到水性缓冲液(如pH 5的乙酸盐缓冲液)中,以确保所需阳离子脂质组分的质子化并促进与mRNA的阳离子交换,并且取代用于产生初始有机可溶性mRNA材料的疏水性阳离子。
可使用微流体或T混合方法将mRNA和脂质的有机溶液与水性缓冲液(如pH 5的乙酸盐缓冲液)混合,以确保所需阳离子脂质组分的质子化并促进与mRNA的阳离子交换,并且取代用于产生初始有机可溶性mRNA材料的疏水性阳离子。
本公开部分地基于以下发现:产生脂质纳米颗粒的方法可影响脂质纳米颗粒内某些组分的分布,并且这种分布可影响和/或决定脂质纳米颗粒的物理性质(例如稳定性)和/或生物学性质(例如功效、细胞内递送、免疫原性)。
在本公开中,描述了产生组合物的方法,所述组合物包含具有有利组分分布的脂质纳米颗粒。
有利地,有机可溶性mRNA和/或水溶性mRNA可实现mRNA LNP的床边配制。以未配制状态储存的mRNA应提供显著的储存和稳定性优势,而阳离子pKa和配制参数可用于减少或消除配制期间对缓冲液或pH调节的需要。
提供LNP溶液
在一些方面,本公开提供了产生脂质纳米颗粒(LNP)制剂的方法,所述方法包括:(i)提供包含脂质纳米颗粒(LNP)的LNP溶液,其中所述LNP包含核酸和可电离脂质;和(ii)加工所述LNP溶液,从而形成所述LNP制剂。
在一些方面,本公开提供了一种产生脂质纳米颗粒(LNP)组合物的方法,所述方法包括:(i)将水性缓冲溶液和有机溶液混合,从而形成包含脂质纳米颗粒(LNP)的脂质纳米颗粒(LNP)制剂,所述脂质纳米颗粒包封核酸;和(ii)加工所述脂质纳米颗粒(LNP)制剂,从而形成所述脂质纳米颗粒组合物;其中所述有机溶液包含有机溶剂中的有机溶剂性可溶性核酸和可电离脂质;并且其中所述有机溶剂可溶性核酸包含疏水性有机阳离子。
本文进一步公开了用于本公开的方法的合适的核酸。在一些实施方案中,核酸是RNA(例如,mRNA)。
本文进一步公开了用于本公开的方法的合适的可电离脂质。
在一些实施方案中,LNP还包含磷脂、PEG脂质、结构脂质或它们的任何组合。本文进一步公开了用于本公开的方法的合适的磷脂、PEG脂质和结构脂质。
在一些实施方案中,提供LNP溶液的步骤包括将水性缓冲溶液和有机溶液混合,其中所述有机溶液包含有机溶剂中的有机溶剂可溶性核酸和可电离脂质;并且其中所述有机溶剂可溶性核酸包含疏水性有机阳离子。
在一些实施方案中,提供LNP溶液的步骤包括:
ia)在所述混合之前将核酸的水溶性盐转化为有机溶剂可溶性核酸,从而形成所述有机溶剂-溶剂可溶性核酸。
在一些实施方案中,提供LNP溶液的步骤包括:
iaa)在所述转化后将所述有机溶剂可溶性核酸冻干。
在一些实施方案中,转化包括渗析。
在一些实施方案中,转化包括切向流过滤(TFF)。
在一些实施方案中,转化包括采用疏水性离子配对反相柱。
在一些实施方案中,转化包括采用离子交换树脂。
在一些实施方案中,转换包括采用尺寸排阻柱。
在一些实施方案中,有机溶剂可溶性核酸是叔胺盐。
在一些实施方案中,有机溶剂可溶的核酸是三丁胺(TBA)盐。
在一些实施方案中,有机溶剂可溶性核酸是三丙胺(TPA)盐。
在一些实施方案中,有机溶剂可溶性核酸是三甲胺(TEA)盐。
在一些实施方案中,其中核酸的水溶性盐是钠盐。
在一些实施方案中,核酸的水溶性盐是三(羟甲基)氨基甲烷(Tris)盐。
在一些实施方案中,有机溶剂是醇。
在一些实施方案中,有机溶剂是乙醇。
在一些实施方案中,有机溶剂包含第一有机溶剂和第二有机溶剂。
在一些实施方案中,第一有机溶剂是醇,并且第二有机溶剂是醇。
在一些实施方案中,第一有机溶剂是乙醇,并且第二有机溶剂是苄醇。
在一些实施方案中,其中第一有机溶剂与第二有机溶剂的wt/wt比在约100:1至约1:1的范围内。
在一些实施方案中,第一有机溶剂与第二有机溶剂的wt/wt比在约50:1至约1:1的范围内。
在一些实施方案中,第一有机溶剂与第二有机溶剂的wt/wt比在约20:1至约1:1的范围内。
在一些实施方案中,第一有机溶剂与第二有机溶剂的wt/wt比在约10:1至约1:1的范围内。
在一些实施方案中,水性缓冲溶液具有在约4至约6范围内的pH。
在一些实施方案中,水性缓冲溶液具有在约4.5至约5.5范围内的pH。
在一些实施方案中,水性缓冲溶液具有在约4.8至约5.2范围内的pH。
在一些实施方案中,水性缓冲溶液具有在约4至约6、约4.5至约5.5或约4.8至约5.2范围内的pH。
在一些实施方案中,有机溶液具有在约7.0至约9.0、约7.0至约8.1、或约7.1至约7.8、或约7.2至约7.7、或约7.3至约7.6、或约7.4至约7.5范围内的pH。
在一些实施方案中,水性缓冲溶液是乙酸盐缓冲液。
在一些实施方案中,混合包括湍流混合。
在一些实施方案中,混合包括层流混合。
在一些实施方案中,混合包括微流体混合。
在一些实施方案中,通过NanoAssembr
在一些实施方案中,混合不是湍流混合,并且具有小于5.0x10
在一些实施方案中,混合不是湍流混合,并且具有小于1.0x10
在一些实施方案中,混合不是湍流混合,并且具有小于5.0x10
在一些实施方案中,混合不是湍流混合,并且具有小于2.5x10
在一些实施方案中,混合具有小于5.0x10
在一些实施方案中,混合具有小于约1000、小于约500或小于约250的雷诺数。
加工LNP溶液
如本文所用,术语“加工”包括用于纯化、pH调节、缓冲液交换和/或浓缩LNP的一个或多个步骤。
在一些实施方案中,加工LNP溶液的步骤包括:
iia)过滤所述LNP溶液。
在一些实施方案中,过滤从LNP溶液中除去有机溶剂(例如,醇或乙醇)。在一些实施方案中,加工包括切向流过滤(TFF)。在一些实施方案中,在除去有机溶剂(例如醇或乙醇)后,将LNP溶液转化为在中性pH、pH 6.5至7.8、pH 6.8至pH 7.5、优选pH 7.0至pH 7.2下缓冲的溶液(例如磷酸盐或HEPES缓冲液)。在一些实施方案中,优选在储存或使用之前,例如通过过滤(例如,通过0.1-0.5μm过滤器)对所得LNP溶液进行灭菌。
在一些实施方案中,加工LNP溶液的步骤还包括包装LNP溶液。
如本文所用,“包装”可指以药物产品的最终状态储存药物产品或在将LNP放入最终包装之前LNP的工艺中储存。储存和/或包装的方式包括但不限于无菌袋中冷藏、小瓶中的冷藏或冷冻制剂、小瓶和注射器中的冻干制剂等。
在一些实施方案中,包装LNP溶液的步骤包括以下步骤中的一个或多个:
iib)将冷冻保护剂添加至所述LNP溶液中;
iic)将所述LNP溶液冻干,从而形成冻干LNP组合物;
iid)储存所述LNP溶液或所述冻干LNP组合物;以及
iie)将缓冲溶液添加至所述LNP溶液或所述冻干LNP组合物中,从而形成所述LNP制剂。
在一些实施方案中,在冻干之前将冷冻保护剂添加至LNP溶液中。在一些实施方案中,冷冻保护剂包括一种或多种冷冻保护剂,并且所述一种或多种冷冻保护剂中的每一种独立地是多元醇(例如,二醇或三醇,如丙二醇(即,1,2-丙二醇)、1,3-丙二醇、甘油、(+/-)-2-甲基-2,4-戊二醇、1,6-己二醇、1,2-丁二醇、2,3-丁二醇、乙二醇或二甘醇)、非洗涤剂磺基甜菜碱(例如,NDSB-201(3-(1-吡啶并)-1-丙烷磺酸酯)、渗透剂(例如,L-脯氨酸或三甲胺N-氧化物二水合物)、聚合物(例如聚乙二醇200(PEG 200)、PEG 400、PEG 600、PEG 1000、PEG 3350、PEG 4000、PEG 8000、PEG 10000、PEG 20000、聚乙二醇单甲醚550(mPEG 550)、mPEG 600、mPEG 2000、mPEG 3350、mPEG 4000、mPEG 5000、聚乙烯吡咯烷酮(例如聚乙烯吡咯烷酮K15)、季戊四醇丙氧基化物或聚丙二醇P 400)、有机溶剂(例如二甲基亚砜(DMSO)或乙醇)、糖(例如D-(+)-蔗糖,D-山梨醇)、海藻糖、D-(+)-麦芽糖一水合物、内消旋-赤藓糖醇、木糖醇、肌醇、D-(+)-棉子糖五水合物、D-(+)-海藻糖二水合物或D-(+)-葡萄糖一水合物)、或盐(例如乙酸锂、氯化锂、甲酸锂、硝酸锂、硫酸锂、乙酸镁、氯化钠、甲酸钠、丙二酸钠、硝酸钠、硫酸钠或其任何水合物)或它们的任何组合。在一些实施方案中,冷冻保护剂包括蔗糖。
在一些实施方案中,冻干在合适的玻璃容器(例如10mL圆柱形玻璃小瓶)中进行。玻璃容器优选地在短时间段内承受低于-40℃至高于室温的极端温度变化,和/或被切割成均匀的形状。在一些实施方案中,冻干步骤包括在高于约-40℃且优选低于约-30℃的温度下冷冻LNP溶液,从而形成冷冻的LNP溶液;以及干燥所述冷冻的LNP溶液以形成冻干LNP组合物。冷冻步骤优选地导致温度在约6分钟内线性降低至最终温度,优选以每分钟约1℃从20℃降低至-40℃。在一些实施方案中,可使用12%-15%的蔗糖,并且干燥步骤在约50毫托至约150毫托范围内的真空下,优选首先在约-35℃至约-15℃范围内的低温下、然后在室温至约25℃范围内的较高温度下进行,并且优选地,干燥步骤在三至七天内完成。在一些实施方案中,干燥步骤在约50毫托至约100毫托范围内的真空下,优选首先在约-15℃至约0℃范围内的低温下、然后在较高温度下进行。
在一些实施方案中,在添加缓冲溶液之前,将LNP溶液或冻干LNP组合物储存在约-40℃、约-35℃、约-30℃、约-25℃、约-20℃、约-15℃、约-10℃、约-5℃、约0℃、约5℃、约10℃、约15℃、约20℃或约25℃的温度下。
在一些实施方案中,在添加缓冲溶液之前,将LNP溶液或冻干LNP组合物储存在约-40℃至约0℃、约-35℃至约-5℃、约-30℃至约-10℃、约-25℃至约-15℃、约-22℃至约-18℃或约-21℃至约-19℃的温度下。
在一些实施方案中,在添加缓冲溶液之前,将LNP溶液或冻干LNP组合物储存在约-20℃的温度下。
施用LNP制剂
在一个方面,本公开涉及一种向患者施用脂质纳米颗粒(LNP)制剂的方法,所述方法包括:(i)提供具有在约7.0至约9.0范围内的第一pH并且包含水性缓冲液中的治疗剂和/或预防剂的水溶液,以及包含有机溶剂中的可电离脂质和包封剂的有机溶液;(ii)通过将所述水溶液和所述有机溶液混合而形成包含包封所述治疗剂和/或预防剂的脂质纳米颗粒的脂质纳米颗粒制剂,以使得所述脂质纳米颗粒制剂具有在约7.0至约9.0范围内的第二pH并且包含相对于所述脂质纳米颗粒制剂的总体积至少1体积%的所述有机溶剂;以及(iii)在所述混合后不到约72小时向所述患者施用所述脂质纳米颗粒制剂。
在一个方面,本公开涉及一种向患者施用脂质纳米颗粒(LNP)制剂的方法,所述方法包括:(i)提供具有在约4.5至约小于7.0范围内的第一pH并且包含水性缓冲液中的治疗剂和/或预防剂的水溶液,以及包含有机溶剂中的可电离脂质的有机溶液;(ii)通过将所述水溶液和所述有机溶液混合而形成包含包封所述治疗剂和/或预防剂的脂质纳米颗粒的脂质纳米颗粒制剂,以使得所述脂质纳米颗粒制剂具有在约4.5至约小于7.0范围内的第二pH并且包含相对于所述脂质纳米颗粒制剂的总体积至少1体积%的所述有机溶剂;以及(iii)在所述混合后不到约72小时向所述患者施用所述脂质纳米颗粒制剂。
在一个方面,本公开涉及一种向患者施用脂质纳米颗粒(LNP)制剂的方法,所述方法包括:(i)提供具有在约7.0至约9.0范围内的第一pH的水性缓冲溶液,以及包含有机溶剂中的可电离脂质、包封剂和治疗剂和/或预防剂的有机溶液;(ii)通过将所述水性缓冲溶液和所述有机溶液混合而形成包含包封所述治疗剂和/或预防剂的脂质纳米颗粒的脂质纳米颗粒制剂,以使得所述脂质纳米颗粒制剂具有在约7.0至约9.0范围内的第二pH并且包含相对于所述脂质纳米颗粒制剂的总体积至少约1体积%的所述有机溶剂;以及(iii)在所述混合后不到约72小时向所述患者施用所述脂质纳米颗粒制剂。
在一个方面,本公开涉及一种向患者施用脂质纳米颗粒(LNP)制剂的方法,所述方法包括:(i)提供具有在约4.5至约小于7.0范围内的第一pH的水性缓冲溶液,以及包含有机溶剂中的可电离脂质和治疗剂和/或预防剂的有机溶液;(ii)通过将所述水性缓冲溶液和所述有机溶液混合而形成包含包封所述治疗剂和/或预防剂的脂质纳米颗粒的脂质纳米颗粒制剂,以使得所述脂质纳米颗粒制剂具有在约4.5至约小于7.0范围内的第二pH并且包含相对于所述脂质纳米颗粒制剂的总体积至少1体积%的所述有机溶剂;以及(iii)在所述混合后不到约72小时向所述患者施用所述脂质纳米颗粒制剂。
在一些实施方案中,第一pH和第二pH在约7.0至约8.1、或约7.1至约7.8、或约7.2至约7.7、或约7.3至约7.6、或约7.4至约7.5的范围内。
在一些实施方案中,第一pH和第二pH在约4.5至约6.5、或约4.6至约6.0、或约4.8至约5.5的范围内。
在一些实施方案中,所述施用在所述混合后不到约72小时,优选在所述混合后不到约60小时、优选在所述混合后不到约48小时、优选在所述混合后不到约36小时、优选在所述混合后不到约24小时、优选在所述混合后不到约20小时、优选在所述混合后不到约16小时、优选在所述混合后不到约12小时、优选在所述混合后不到约8小时进行。
在一些实施方案中,所述施用在所述混合后不到约120分钟,优选在所述混合后不到约100分钟、优选在所述混合后不到约90分钟、优选在所述混合后不到约80分钟、优选在所述混合后不到约70分钟、优选在所述混合后不到约60分钟、优选在所述混合后不到约50分钟、优选在所述混合后不到约40分钟、优选在所述混合后不到约30分钟、优选在所述混合后不到约20分钟、优选在所述混合后不到约15分钟、优选在所述混合后不到约10分钟进行。
在一些实施方案中,在所述混合与所述施用之间不对所述脂质纳米颗粒制剂进行加工。
在一些实施方案中,本公开的方法在所述混合与所述施用之间不包括pH调节。
在一些实施方案中,在所述混合与所述施用之间不对所述脂质纳米颗粒制剂进行过滤。
在一些实施方案中,所述方法还包括在混合和施用装置的第一入口处接收所述有机溶液。
在一些实施方案中,所述方法还包括在混合和施用装置的第二入口处接收所述水性缓冲溶液。
在一些实施方案中,所述混合在混合和施用装置的混合器位置处进行。
在一些实施方案中,所述脂质纳米颗粒制剂通过混合和施用装置的出口进行施用。
在一些实施方案中,所述提供、形成、混合和施用都采用单一混合和施用装置,优选流体连接的混合和施用装置进行。
在一些实施方案中,混合和施用装置包括双筒注射器。
在一些实施方案中,混合和施用装置包括选自由K型注射器和L型注射器组成的组的至少一种。
在一些实施方案中,混合和施用装置包括在混合器位置处的静态混合器。
在一些实施方案中,静态混合器是螺旋静态混合器。
在一些实施方案中,水性缓冲溶液的pH和脂质纳米颗粒制剂的pH大约相同。
在一些实施方案中,脂质纳米颗粒制剂包含相对于所述脂质纳米颗粒制剂的总体积约1体积%至约50体积%的所述有机溶剂,相对于所述脂质纳米颗粒制剂的总体积优选约2体积%至约45体积%、优选约3体积%至约40体积%、优选约4体积%至约35体积%、优选约5体积%至约33体积%的所述有机溶剂。
在一些实施方案中,有机溶剂是醇。
在一些实施方案中,有机溶剂是乙醇。
在一些实施方案中,有机溶剂包含第一有机溶剂和第二有机溶剂。
在一些实施方案中,第一有机溶剂是醇,并且第二有机溶剂是醇。
在一些实施方案中,第一有机溶剂是乙醇,并且第二有机溶剂是苄醇。
在一些实施方案中,第一有机溶剂与第二有机溶剂的wt/wt比在约100:1至约1:1、或约50:1至约1:1、或约20:1至约1:1、或约10:1至约1:1的范围内。
在一些实施方案中,有机溶液还包含湿润剂。如本文所用,湿润剂可指提高、降低或改善液体保持与诸如固体表面和/或液体表面的表面接触的能力的剂。
在一些实施方案中,湿润剂是有机溶剂。
在一些实施方案中,湿润剂是二甲基亚砜(DMSO)。
在一些实施方案中,湿润剂与有机溶剂的wt/wt比在约1000:1至约1:1、或约500:1至约5:1、或约100:1至约10:1的范围内。
在一些实施方案中,水性缓冲溶液是选自由以下组成的组的至少一种:乙酸盐缓冲液、柠檬酸盐缓冲液、磷酸盐缓冲液和tris缓冲液。在一些实施方案中,水性缓冲溶液可以是适合于维持生理pH的任何缓冲液。在一些实施方案中,水性缓冲溶液可以是适合于维持适于向患者、优选哺乳动物患者、优选人患者施用的pH的任何缓冲液。
在一些实施方案中,水性缓冲溶液还包含张度剂。如本文所用,张度剂可指提高、降低或改善有效渗透压梯度(如由两种溶液的水势所定义)或溶质溶解于溶液中的相对浓度、从而影响扩散的方向和程度的剂。
在一些实施方案中,张度剂是糖。
在一些实施方案中,糖是蔗糖。
LNP制剂
在一些方面,本公开的LNP制剂通过本文所公开的方法来制备。
在一些方面,本公开的LNP制剂包含多个LNP,其中所述LNP包含核酸和可电离脂质。
本文进一步公开了用于本公开的方法的合适的核酸。在一些实施方案中,核酸是RNA(例如,mRNA)。
本文进一步公开了用于本公开的方法的合适的可电离脂质。
在一些实施方案中,LNP还包含磷脂、PEG脂质、结构脂质或它们的任何组合。本文进一步公开了用于本公开的方法的合适的磷脂、PEG脂质和结构脂质。
在一些实施方案中,本公开的LNP制剂包含至少一种脂质纳米颗粒组分。脂质纳米颗粒可包含脂质组分和一种或多种另外的组分,如治疗和/或预防剂,如核酸。LNP可被设计用于一种或多种特定应用或靶标。可基于特定应用或靶标和/或基于一种或多种要素的功效、毒性、费用、易用性、可用性或其他特征来选择LNP的要素。类似地,可根据例如要素的特定组合的功效和毒性为特定应用或靶标选择LNP的特定制剂。LNP制剂的功效和耐受性可受到制剂稳定性的影响。
LNP的脂质组分可包括例如根据式(IL-I)、(IL-IA)、(IL-IB)、(IL-II)、(IL-IIa)、(IL-IIb)、(IL-IIc)、(IL-IId)、(IL-IIe)、(IL-IIf)、(IL-IIg)、(IL-III)、(IL-IIIa1)、(IL-IIIa2)、(IL-IIIa3)、(IL-IIIa4)、(IL-IIIa5)、(IL-IIIa6)、(IL-IIIa7)或(IL-IIIa8)的脂质、磷脂(如不饱和脂质,例如DOPE或DSPC)、PEG脂质和结构脂质。LNP的脂质组分可包括例如根据式(IL-I)、(IL-IA)、(IL-IB)、(IL-II)、(IL-IIa)、(IL-IIb)、(IL-IIc)、(IL-IId)、(IL-IIe)、(IL-IIf)、(IL-IIg)、(IL-III)、(IL-IIIa1)、(IL-IIIa2)、(IL-IIIa3)、(IL-IIIa4)、(IL-IIIa5)、(IL-IIIa6)、(IL-IIIa7)或(IL-IIIa8)的脂质、磷脂(如不饱和脂质,例如DOPE或DSPC)和结构脂质。脂质组分的要素可以特定的分数提供。
在一些实施方案中,LNP的脂质组分包括根据式(IL-I)、(IL-IA)、(IL-IB)、(IL-II)、(IL-IIa)、(IL-IIb)、(IL-IIc)、(IL-IId)、(IL-IIe)、(IL-IIf)、(IL-IIg)、(IL-III)、(IL-IIIa1)、(IL-IIIa2)、(IL-IIIa3)、(IL-IIIa4)、(IL-IIIa5)、(IL-IIIa6)、(IL-IIIa7)或(IL-IIIa8)的脂质、磷脂、PEG脂质和结构脂质。在一些实施方案中,脂质纳米颗粒的脂质组分包括约30mol%至约60mol%的式(IL-I)、(IL-IA)、(IL-IB)、(IL-II)、(IL-IIa)、(IL-IIb)、(IL-IIc)、(IL-IId)、(IL-IIe)、(IL-IIf)、(IL-IIg)、(IL-III)、(IL-IIIa1)、(IL-IIIa2)、(IL-IIIa3)、(IL-IIIa4)、(IL-IIIa5)、(IL-IIIa6)、(IL-IIIa7)或(IL-IIIa8)化合物,约0mol%至约30mol%的磷脂,约18.5mol%至约48.5mol%的结构脂质和约0mol%至约10mol%的PEG脂质,条件是总mol%不超过100%。在一些实施方案中,脂质纳米颗粒的脂质组分包括约35mol%至约55mol%的式(IL-I)、(IL-IA)、(IL-IB)、(IL-II)、(IL-IIa)、(IL-IIb)、(IL-IIc)、(IL-IId)、(IL-IIe)、(IL-IIf)、(IL-IIg)、(IL-III)、(IL-IIIa1)、(IL-IIIa2)、(IL-IIIa3)、(IL-IIIa4)、(IL-IIIa5)、(IL-IIIa6)、(IL-IIIa7)或(IL-IIIa8)化合物,约5mol%至约25mol%的磷脂,约30mol%至约40mol%的结构脂质和约0mol%至约10mol%的PEG脂质。在特定实施方案中,脂质组分包括约50mol%的所述化合物、约10mol%的磷脂、约38.5mol%的结构脂质和约1.5mol%的PEG脂质。在另一个特定实施方案中,脂质组分包括约40mol%的所述化合物、约20mol%的磷脂、约38.5mol%的结构脂质和约1.5mol%的PEG脂质。在一些实施方案中,磷脂可以是DOPE或DSPC。在一些实施方案中,PEG脂质可以是PEG-DMG,和/或结构脂质可以是胆固醇。
脂质纳米颗粒可被设计用于一种或多种特定应用或靶标。在一些实施方案中,LNP可被设计成向哺乳动物体内的特定细胞、组织、器官或系统或它们的组递送治疗剂和/或预防剂,诸如RNA。脂质纳米颗粒的物理化学性质可改变,以增加对特定身体靶标的选择性。例如,可基于不同器官的开窗部尺寸来调节颗粒尺寸。LNP中包含的治疗剂和/或预防剂也可基于所需的一种或多种递送靶标进行选择。在一些实施方案中,可针对特定适应症、疾患、疾病或病症和/或向特定细胞、组织、器官或其系统或组的递送(例如,局部或特异性递送)而选择治疗剂和/或预防性剂。在一些实施方案中,LNP可包含编码能够在细胞内翻译以产生目标多肽的目标多肽的mRNA。可将这样的组合物设计为特异性地递送至特定器官。在一些实施方案中,可将组合物设计为特异性地递送至哺乳动物肝脏。
LNP中治疗剂和/或预防剂的量可取决于脂质纳米颗粒的尺寸、组成、所需靶标和/或应用或其他性质以及治疗剂和/或预防剂的性质。在一些实施方案中,可用于LNP中的RNA的量可取决于RNA的大小、序列和其他特征。LNP中治疗剂和/或预防剂和其他要素(例如脂质)的相对量也可变化。在一些实施方案中,LNP中脂质组分与治疗剂和/或预防剂(如核酸)的wt/wt比可以是约5:1至约60:1,如5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、20:1、25:1、30:1、35:1、40:1、45:1、50:1和60:1。在一些实施方案中,脂质组分与治疗剂和/或预防剂的wt/wt比可以是约10:1至约40:1。在一些实施方案中,所述wt/wt比是约20:1。LNP中的治疗剂和/或预防剂的量可例如使用吸收光谱法(例如,紫外-可见光谱法)来测量。
在一些实施方案中,LNP包含一种或多种RNA,并且可选择一种或多种RNA、脂质及其量以提供特定N:P比例。组合物的N:P比例是指一种或多种脂质中的氮原子与RNA中磷酸基团的数量的摩尔比。一般来说,较低的N:P比例是优选的。可选择一种或多种RNA、脂质及其量以提供约2:1至约30:1,如2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、12:1、14:1、16:1、18:1、20:1、22:1、24:1、26:1、28:1或30:1的N:P比例。在一些实施方案中,N:P比例可以是约2:1至约8:1。在一些实施方案中,N:P比例是约5:1至约8:1。在一些实施方案中,N:P比例可以是约5.0:1、约5.5:1、约5.67:1、约6.0:1、约6.5:1或约7.0:1。在一些实施方案中,N:P比例可以是约5.67:1。
在一些实施方案中,包含LNP的制剂还可包含盐,如氯化物盐。
在一些实施方案中,包含LNP的制剂还可包含糖,如二糖。在一些实施方案中,所述制剂还包含糖,但不包含盐(如氯化物盐)。
物理性质
本公开的LNP的物理性质可通过多种方法来表征。在一些实施方案中,显微术(例如,透射电子显微术或扫描电子显微术)可用于检查LNP的形态和尺寸分布。动态光散射或电位测定法(例如电位滴定)可用于测量ζ电位。动态光散射也可用于确定粒度。诸如Zetasizer Nano ZS(Malvern Instruments Ltd,Malvern,Worcestershire,UK)的仪器也可用于测量LNP的多种特征,如粒度、多分散性指数和ζ电位。
LNP制剂的平均LNP直径可介于10nm与100nm之间,例如通过动态光散射(DLS)所测量。在一些实施方案中,LNP制剂的平均LNP直径可以是约40nm至约150nm,如约40nm、45nm、50nm、55nm、60nm、65nm、70nm、75nm、80nm、85nm、90nm、95nm、100nm、105nm、110nm、115nm、120nm、125nm、130nm、135nm、140nm、145nm或150nm。在一些实施方案中,LNP制剂的平均LNP直径可以是50nm至约100nm、约50nm至约90nm、约50nm至约80nm、约50nm至约70nm、约50nm至约60nm、约60nm至约100nm、约60nm至约90nm、约60nm至约80nm、约60nm至约70nm、约70nm至约100nm、约70nm至约90nm、约70nm至约80nm、约80nm至约100nm、约80nm至约90nm或约90nm至约100nm。在一些实施方案中,LNP制剂的平均LNP直径可以是约70nm至约100nm。在特定实施方案中,LNP制剂的平均LNP直径可以是约80nm。在一些实施方案中,LNP制剂的平均LNP直径可以是约100nm。
在一些实施方案中,LNP制剂的平均LNP直径在约1mm至约500mm、约5mm至约200mm、约10mm至约100mm、约20mm至约80mm、约25mm至约60mm、约30mm至约55mm、约35mm至约50mm或约38mm至约42mm的范围内。
在一些实施方案中,与通过可比较的方法产生的LNP制剂相比,所述LNP制剂的平均LNP直径是约99%或更小、约98%或更小、约97%或更小、约96%或更小、约95%或更小、约90%或更小、约85%或更小、约80%或更小、约75%或更小、约70%或更小、约65%或更小、约60%或更小、约55%或更小、约50%或更小、约40%或更小、约30%或更小、约20%或更小或约10%或更小。
LNP可以是相对均匀的。多分散性指数可用于指示LNP的均匀性,例如脂质纳米颗粒的粒度分布。小的(例如,小于0.3的)多分散性指数通常指示窄的粒度分布。LNP可具有约0至约0.25,如0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.20、0.21、0.22、0.23、0.24或0.25的多分散性指数。在一些实施方案中,LNP的多分散性指数可以是约0.10至约0.20。
LNP的ζ电位可用于指示组合物的电动电位。在一些实施方案中,ζ电位可描述LNP的表面电荷。通常希望具有相对低的正或负电荷的脂质纳米颗粒,因为带更高电荷的物质可能与体内的细胞、组织和其他元件不希望地相互作用。在一些实施方案中,LNP的ζ电位可以是约-10mV至约+20mV、约-10mV至约+15mV、约-10mV至约+10mV、约-10mV至约+5mV、约-10mV至约0mV、约-10mV至约-5mV、约-5mV至约+20mV、约-5mV至约+15mV、约-5mV至约+10mV、约-5mV至约+5mV、约-5mV至约0mV、约0mV至约+20mV、约0mV至约+15mV、约0mV至约+10mV、约0mV至约+5mV、约+5mV至约+20mV、约+5mV至约+15mV或约+5mV至约+10mV。
治疗剂和/或预防剂(如核酸)的包封效率描述相对于所提供的初始量,在制备后被包封或以其他方式与LNP缔合的治疗剂和/或预防剂的量。期望包封效率高(例如,接近100%)。可例如通过比较在用一种或多种有机溶剂或洗涤剂破碎脂质纳米颗粒之前和之后含有所述脂质纳米颗粒的溶液中的治疗剂和/或预防剂的量来测量包封效率。阴离子交换树脂可用于测量溶液中的游离治疗剂和/或预防剂(例如,RNA)的量。荧光可用于测量溶液中的游离治疗剂和/或预防剂(例如,RNA)的量。对于本文所述的脂质纳米颗粒,治疗剂和/或预防剂的包封效率可以是至少50%,例如50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。在一些实施方案中,包封效率可以是至少80%。在一些实施方案中,包封效率可以是至少90%。在一些实施方案中,包封效率可以是至少95%。
LNP可任选地包含一种或多种包衣。在一些实施方案中,LNP可配制在具有包衣的胶囊、薄膜或片剂中。包含本文所述的组合物的胶囊、薄膜或片剂可具有任何有用的尺寸、抗张强度、硬度或密度。
化学性质
本公开的LNP、LNP溶液、冻干LNP组合物或LNP制剂的化学性质可通过多种方法来表征。在一些实施方案中,可使用电泳(例如,毛细管电泳)或色谱法(例如,反相液相色谱法)来检查mRNA完整性。
在一些实施方案中,本公开的LNP、LNP溶液、冻干LNP组合物或LNP制剂的LNP完整性为约20%或更高、约25%或更高、约30%或更高、约35%或更高、约40%或更高、约45%或更高、约50%或更高、约55%或更高、约60%或更高、约65%或更高、约70%或更高、约75%或更高、约80%或更高、约85%或更高、约90%或更高、约95%或更高、约96%或更高、约97%或更高、约98%或更高或约99%或更高。
在一些实施方案中,本公开的LNP、LNP溶液、冻干LNP组合物或LNP制剂的LNP完整性比通过可比较的方法产生的LNP、LNP溶液、冻干LNP组合物或LNP制剂的LNP完整性高了约5%或更高、约10%或更多、约15%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约1倍或更多、约2倍或更多、约3倍或更多、约4倍或更多、约5倍或更多、约10倍或更多、约20倍或更多、约30倍或更多、约40倍或更多、约50倍或更多、约100倍或更多、约200倍或更多、约300倍或更多、约400倍或更多、约500倍或更多、约1000倍或更多、约2000倍或更多、约3000倍或更多、约4000倍或更多、约5000倍或更多或约10000倍或更多。
在一些实施方案中,本公开的LNP、LNP溶液、冻干LNP组合物或LNP制剂的T
在一些实施方案中,本公开的LNP、LNP溶液、冻干LNP组合物或LNP制剂的T
在一些实施方案中,本公开的LNP、LNP溶液、冻干LNP组合物或LNP制剂的T
在一些实施方案中,本公开的LNP、LNP溶液、冻干LNP组合物或LNP制剂的T
定义
如本文所用,术语“烷基(alkyl)”或“烷基(alkyl group)”是指包含一个或多个碳原子(例如,一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四、十五、十六、十七、十八、十九、二十个或更多个碳原子)的直链或支链饱和烃,其任选地被取代。符号“C
如本文所用,术语“烯基(alkenyl)”或“烯基(alkenyl group)”是指包含两个或更多个碳原子(例如,二、三、四、五、六、七、八、九、十、十一、十二、十三、十四、十五、十六、十七、十八、十九、二十个或更多个碳原子)和至少一个双键的直链或支链烃,其任选地被取代。符号“C
如本文所用,术语“碳环”或“碳环基团”是指包含碳原子的一个或多个环的任选取代的单环或多环系统。环可以是三、四、五、六、七、八、九、十、十一、十二、十三、十四、十五、十六、十七、十八、十九或二十元环。符号“C
如本文所用,术语“杂环”或“杂环基团”是指包含一个或多个环的任选取代的单环或多环系统,其中至少一个环包含至少一个杂原子。杂原子可以是例如氮、氧或硫原子。环可以是三、四、五、六、七、八、九、十、十一、十二、十三或十四元环。杂环可包含一个或多个双键或三键,并且可以是非芳族的或芳族的(例如,杂环基或杂芳基)。杂环的实例包括咪唑基、咪唑烷基、噁唑基、噁唑烷基、噻唑基、噻唑烷基、吡唑烷基、吡唑基、异噁唑烷基、异噁唑基、异噻唑烷基、异噻唑基、吗啉基、吡咯基、吡咯烷基、呋喃基、四氢呋喃基、苯硫基、吡啶基、哌啶基、喹啉基和异喹啉基。如本文所用的术语“杂环烷基”是指非芳族杂环,并且可以或可以不包含任何双键或三键。除非另有说明,否则本文所述的杂环是指未取代的和取代的杂环基团,即任选取代的杂环。
如本文所用,“生物可降解基团”是可促进脂质在哺乳动物实体中更快代谢的基团。生物可降解基团可选自由以下组成的组:但不限于-C(O)O-、-OC(O)-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、
-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)
除非另有说明,否则烷基、烯基和环基(例如,碳环基和杂环基)可任选地被取代。任选的取代基可选自由以下组成的组:但不限于卤素原子(例如氯、溴、氟或碘基团)、羧酸(例如-C(O)OH)、醇(例如,羟基、-OH)、酯(例如,-C(O)OR或-OC(O)R)、醛(例如,-C(O)H)、羰基(例如,-C(O)R,或者由C=O表示)、酰基卤(例如,-C(O)X,其中X是选自溴化物、氟化物、氯化物和碘化物的卤化物)、碳酸根(例如,-OC(O)OR)、烷氧基(例如,-OR)、缩醛(例如,-C(OR)
约、大约:如本文所用,在应用于一个或多个目标值时,术语“大约”和“约”是指类似于所阐述的参考值的值。在一些实施方案中,术语“大约”或“约”是指在所阐述的参考值的任一方向上的(大于或小于)25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小范围内的值范围,除非另外说明或以另外的方式从上下文显而易见(除了这样的数值将超过可能值的100%的情况)。在一些实施方案中,当在LNP的脂质组分中给定化合物的量的背景下使用时,“约”可意指所叙述值的+/-10%。例如,包含具有约40%给定化合物的脂质组分的LNP可包含30%-50%的化合物。
如本文所使用,术语“化合物”是指包括所描绘的结构的所有异构体和同位素。“同位素”是指具有相同原子数但具有由原子核中的中子数不同而产生的不同质量数的原子。在一些实施方案中,氢的同位素包括氚和氘。此外,本公开的化合物、盐或复合物可通过常规方法与溶剂或水分子组合以形成溶剂合物和水合物来制备。
如本文所用,术语“接触”是指在两个或更多个实体之间建立物理连接。在一些实施方案中,使哺乳动物细胞与LNP接触是指使哺乳动物细胞和纳米颗粒共享物理连接。使细胞与外部实体在体内和离体接触的方法是生物学领域中众所周知的。在一些实施方案中,使LNP与置于哺乳动物体内的哺乳动物细胞接触可通过不同的施用途径(例如,静脉内、肌肉内、皮内和皮下)进行,并且可涉及不同量的脂质纳米颗粒。此外,LNP可接触多于一种哺乳动物细胞。
如本文所用,术语“可比较的方法”是指与被比较的方法(例如,产生本公开的LNP制剂)相比具有可比较的参数或步骤的方法。在一些实施方案中,“可比较的方法”是具有被比较的方法的步骤i)、ia)、iaa)、ib)、ii)、iia)、iib)、iic)、iid)和iie)中的一个或多个的方法。在一些实施方案中,“可比较的方法”是没有被比较的方法的步骤i)、ia)、iaa)、ib)、ii)、iia)、iib)、iic)、iid)和iie)中的一个或多个的方法。在一些实施方案中,“可比较的方法”是没有被比较的方法的步骤ia)和ib)中的一个或多个的方法。在一些实施方案中,“可比较的方法”是采用核酸的水溶性盐的方法。在一些实施方案中,“可比较的方法”是采用不包含有机溶剂可溶性核酸的有机溶液的方法。在一些实施方案中,“可比较的方法”是包括在施用脂质纳米颗粒制剂之前加工脂质纳米颗粒的方法。
如本文所用,术语“递送”是指将实体提供至目的地。在一些实施方案中,向受试者递送治疗剂和/或预防剂可涉及向受试者施用包含治疗剂和/或预防剂的LNP(例如,通过静脉内、肌肉内、皮内或皮下途径)。向哺乳动物或哺乳动物细胞施用LNP可涉及使一种或多种细胞与脂质纳米颗粒接触。
如本文所用,术语“增强的递送”是指与通过对照纳米颗粒(例如,MC3、KC2或DLinDMA)向目标靶组织递送治疗剂和/或预防剂的水平相比,通过纳米颗粒向目标靶组织(例如,哺乳动物肝脏)递送更多(例如,多至少1.5倍、多至少2倍、多至少3倍、多至少4倍、多至少5倍、多至少6倍、多至少7倍、多至少8倍、多至少9倍、多至少10倍)的治疗剂和/或预防剂。向特定组织递送纳米颗粒的水平可通过比较组织中产生的蛋白质的量与所述组织的重量、比较组织中的治疗剂和/或预防剂的量与所述组织的重量、比较组织中产生的蛋白质的量与所述组织中的总蛋白质的量或者比较组织中治疗剂和/或预防剂的量与所述组织中的总治疗剂和/或预防剂的量来进行测量。应理解,纳米颗粒向靶组织的增强的递送不需要在所治疗的受试者中确定,它可在诸如动物模型(例如,大鼠模型)的替代物中确定。
如本文所用,术语“特异性递送(specific delivery)”、“特异性地递送(specifically deliver)”或“特异性地递送(specifically delivering)”是指与脱靶组织(例如,哺乳动物脾脏)相比,通过纳米颗粒向目标靶组织(例如,哺乳动物肝脏)递送更多(例如,多至少1.5倍、多至少2倍、多至少3倍、多至少4倍、多至少5倍、多至少6倍、多至少7倍、多至少8倍、多至少9倍、多至少10倍)的治疗剂和/或预防剂。向特定组织递送纳米颗粒的水平可通过比较组织中产生的蛋白质的量与所述组织的重量、比较组织中的治疗剂和/或预防剂的量与所述组织的重量、比较组织中产生的蛋白质的量与所述组织中的总蛋白质的量或者比较组织中治疗剂和/或预防剂的量与所述组织中的总治疗剂和/或预防剂的量来进行测量。在一些实施方案中,对于肾血管靶向,如果在全身施用治疗剂和/或预防剂后与递送至肝脏或脾脏的治疗剂和/或预防剂相比,每1g组织多1.5倍、2倍、3倍、5倍、10倍、15倍或20倍的治疗剂和/或预防剂被递送至肾脏,则与肝脏和脾脏相比,治疗剂和/或预防剂被特异性地提供至哺乳动物肾脏。应理解,纳米颗粒向靶组织特异性递送的能力不需要在所治疗的受试者中确定,它可在诸如动物模型(例如,大鼠模型)的替代物中确定。
如本文所用,“包封效率”是指相对于在LNP制备中使用的治疗剂和/或预防剂的初始总量,成为LNP的一部分的治疗剂和/或预防剂的量。在一些实施方案中,如果将初始提供至组合物的总计100mg治疗剂和/或预防剂中的97mg治疗剂和/或预防剂包封在LNP中,则包封效率可给出为97%。如本文所用,“包封”可指完全、实质或部分封住、约束、包围或包住。
如本文所用,核酸序列的“表达”是指mRNA翻译成多肽或蛋白质和/或多肽或蛋白质的翻译后修饰。
如本文所用,术语“体外”是指事件发生在人工环境中,例如在试管或反应容器中、在细胞培养物中、在皮氏培养皿(Petri dish)中等,而非在生物体(例如,动物、植物或微生物)内。
如本文所用,术语“体内”是指事件发生在生物体(例如,动物、植物或微生物或其细胞或组织)内。
如本文所用,术语“离体”是指事件发生在生物体(例如,动物、植物或微生物或其细胞或组织)外部。离体事件可在从天然(例如,体内)环境最小改变的环境中发生。
如本文所用,术语“异构体”是指化合物的任何几何异构体、互变异构体、两性离子、立体异构体、对映异构体或非对映异构体。化合物可包含一个或多个手性中心和/或双键,并且因此可以立体异构体如双键异构体(即,几何E/Z异构体)或非对映异构体(例如,对映异构体(即(+)或(-))或顺式/反式异构体)的形式存在。本公开涵盖本文所述的化合物的任何和所有异构体,包括立体异构纯形式(例如,几何纯、对映异构纯或非对映异构纯)以及对映异构混合物和立体异构混合物,例如外消旋体。化合物的对映异构混合物和立体异构混合物以及将它们拆分成其组分对映异构体或立体异构体的方式是众所周知的。
如本文所用,“脂质组分”是包含一种或多种脂质的脂质纳米颗粒的组分。在一些实施方案中,脂质组分可包含一种或多种阳离子/可电离脂质、聚乙二醇化脂质、结构脂质或其他脂质,如磷脂。
如本文所用,“接头”是连接两个部分的部分,例如,帽物种的两个核苷之间的连接。接头可包含一个或多个基团,包括但不限于磷酸根基团(例如磷酸根、硼酸磷酸根、硫代磷酸根、硒代磷酸根和膦酸酯)、烷基、酰胺化物或甘油。在一些实施方案中,帽类似物的两个核苷可在它们的5'位置通过三磷酸基团或通过包括两个磷酸基团和硼磷酸根部分的链连接。
如本文所用,“施用方法”可包括静脉内、肌肉内、皮内、皮下或将组合物递送至受试者的其他方法。可选择施用方法以使递送靶向(例如,特异性地递送至)身体的特定区域或系统。
如本文所用,“经修饰的”是指非天然的。在一些实施方案中,RNA可以是经修饰的RNA。即,RNA可包含一个或多个非天然存在的核碱基、核苷、核苷酸或接头。“经修饰的”物质在本文中也可称为“改变的”物质。物质可在化学、结构或功能上进行修饰或改变。在一些实施方案中,经修饰的核碱基种类可包含一个或多个非天然存在的取代。
如本文所用,“N:P比例”是例如,包含脂质组分和RNA的LNP中,脂质中的可电离氮原子(在生理pH范围内)与RNA中的磷酸基团的摩尔比。
如本文所用,“脂质纳米颗粒”是包含一种或多种脂质的组合物。脂质纳米颗粒的尺寸通常为近似微米或更小,并且可包括脂质双层。除非另有说明,否则如本文所用的脂质纳米颗粒涵盖脂质纳米颗粒(LNP)、脂质体(例如脂质囊泡)和脂质复合物。在一些实施方案中,LNP可以是具有500nm或更小直径的脂质双层的脂质体。
如本文所用,“天然存在的”意指不需要人工辅助在自然中存在。
如本文所用,“患者”是指可寻求或有治疗需要、要求治疗、正接受治疗、将接受治疗的受试者,或针对特定疾病或疾患在受过训练的专业人员的护理下的受试者。
如本文所用,“PEG脂质”或“聚乙二醇化脂质”是指包含聚乙二醇组分的脂质。
本文使用短语“药学上可接受的”来指在合理医学判断范围内、适用于与人和动物组织接触而无过量毒性、刺激、过敏反应或其它问题或并发症、与合理的利益/风险比相称的那些化合物、材料、组合物和/或剂型。
如本文所用的短语“药学上可接受的赋形剂”是指除了本文描述的化合物以外的任何成分(例如,能够悬浮、复合或溶解活性化合物的媒介物)并且在患者中具有大致上无毒和非炎性的特性。赋形剂可包括例如:抗粘剂、抗氧化剂、粘合剂、包衣、压缩助剂、崩解剂、染料(颜料)、软化剂、乳化剂、填充剂(稀释剂)、成膜剂或包衣、调味剂、香料、助流剂(流动增强剂)、润滑剂、防腐剂、印刷油墨、吸附剂、悬浮剂或分散剂、甜味剂以及水合作用的水。示例性赋形剂包括但不限于:丁羟甲苯(BHT)、碳酸钙、磷酸钙(二碱式)、硬脂酸钙、交联羧甲纤维素、交联聚乙烯吡咯烷酮、柠檬酸、交聚维酮、半胱氨酸、乙基纤维素、明胶、羟丙基纤维素、羟丙基甲基纤维素、乳糖、硬脂酸镁、麦芽糖醇、甘露醇、甲硫氨酸、甲基纤维素、对羟基苯甲酸甲酯、微晶纤维素、聚乙二醇、聚乙烯吡咯烷酮、聚维酮、预胶凝淀粉、对羟基苯甲酸丙酯、棕榈酸视黄酯、虫胶、二氧化硅、羧甲基纤维素钠、柠檬酸钠、淀粉羟基乙酸钠、山梨糖醇、淀粉(玉米)、硬脂酸、蔗糖、滑石、二氧化钛、维生素A、维生素E(α-生育酚)、维生素C、木糖醇以及本文所公开的其他物质。
组合物还可包含一种或多种化合物的盐。盐可以是药学上可接受的盐。如本文所使用,“药学上可接受的盐”是指所公开的化合物的衍生物,其中母体化合物通过将现有酸或碱部分转化为其盐形式(例如,通过使自由碱基团与合适的有机酸反应)来改变。药学上可接受的盐的实例包括但不限于碱性残基的矿物盐或有机酸盐,诸如胺,酸性残基(如羧酸等)的碱盐或有机盐。代表性酸加成盐包括乙酸盐、己二酸盐、海藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、氢溴酸盐、盐酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐、十一酸盐、戊酸盐等。代表性碱金属盐或碱土金属盐包括钠、锂、钾、钙、镁等以及无毒的铵、季铵和胺阳离子,包括但不限于铵、四甲铵、四乙铵、甲胺、二甲胺、三甲胺、三乙胺、乙胺等。本公开的药学上可接受的盐包括例如从无毒无机酸或有机酸形成的母体化合物的常规无毒盐。可通过常规化学方法从含有碱性部分或酸性部分的母体化合物合成本公开的药学上可接受的盐。通常,此类盐可通过使游离酸或游离碱形式的这些化合物与化学计量的量的适当碱或酸在水或在有机溶剂中或者在水与有机溶剂的混合物中反应来制备;通常,优选诸如醚、乙酸乙酯、乙醇、异丙醇或乙腈的非水性介质。合适的盐的列表见于Remington’s Pharmaceutical Sciences,第17版,Mack Publishing Company,Easton,Pa.,1985,第1418页,Pharmaceutical Salts:Properties,Selection,and Use,P.H.Stahl和C.G.Wermuth(编著),Wiley-VCH,2008和Berge等人,Journal ofPharmaceutical Science,66,1-19(1977),所述参考文献各自以引用的方式整体并入本文。
如本文所用,“磷脂”是包含磷酸酯部分和一个或多个碳链,如不饱和脂肪酸链的脂质。磷脂可包含一个或多个多重(例如双或三)键(例如一个或多个不饱和度)。磷脂或其类似物或衍生物可包括胆碱。磷脂或其类似物或衍生物可不包括胆碱。特定磷脂可促进与膜的融合。在一些实施方案中,阳离子磷脂可与膜(例如,细胞或细胞内膜)的一种或多种带负电荷的磷脂相互作用。磷脂与膜的融合可允许含脂质组合物的一种或多种要素穿过所述膜,从而允许例如将一种或多种要素递送至细胞。
如本文所用,“多分散性指数”是描述系统的粒度分布的均匀性的比率。较小的值(例如,小于0.3)通常指示窄的粒度分布。
如本文所用,两亲“聚合物”是包含低聚物或聚合物的两亲性化合物。在一些实施方案中,两亲性聚合物可包含低聚物片段,如两个或更多个PEG单体单元。在一些实施方案中,本文所述的两亲性聚合物可以是PS 20。
如本文所用,术语“多肽”或“目标多肽”是指通常通过肽键连接的氨基酸残基的聚合物,其可天然(例如,分离或纯化)或合成产生。
如本文所用,“RNA”是指可天然或非天然存在的核糖核酸。在一些实施方案中,RNA可包括经修饰的和/或非天然存在的组分,如一个或多个核碱基、核苷、核苷酸或接头。RNA可包括帽结构、链终止核苷、茎环、polyA序列和/或聚腺苷酸化信号。RNA可具有编码目标多肽的核苷酸序列。在一些实施方案中,RNA可以是信使RNA(mRNA)。编码特定多肽的mRNA的翻译(例如,哺乳动物细胞内部的mRNA的体内翻译)可产生编码的多肽。RNA可选自由以下组成的非限制性组:小干扰RNA(siRNA)、不对称干扰RNA(aiRNA)、微小RNA(miRNA)、Dicer-底物RNA(dsRNA)、小发夹RNA(shRNA)、mRNA、长非编码RNA(lncRNA)以及它们的混合物。
如本文所使用,“单个单位剂量”是以一次剂量/一次/单一途径/单个接触点施用的任何治疗剂的剂量,即,单次施用事件。
如本文所使用,“分剂量”是单个单位剂量或总每日剂量分成两次或更多次剂量。
如本文所使用,“总每日剂量”是24小时时期内给予或规定的量。总每日剂量可作为单个单位剂量施用。
如本文所用,术语“受试者”是指可例如出于实验、诊断、预防和/或治疗目的向其施用根据本公开的组合物或制剂的任何生物体。典型受试者包括动物(例如,哺乳动物如小鼠、大鼠、兔、非人灵长类动物和人)和/或植物。
如本文所用,“T
如本文所使用,“靶细胞”是指任何一种或多种目标细胞。细胞可存在于体外、体内、原位或在生物体的组织或器官中。生物体可以是动物,优选哺乳动物,更优选人,并且最优选患者。
如本文所用,“靶组织”是指其中治疗剂和/或预防剂的递送将产生所需的生物学和/或药理学作用的任何一种或多种目标组织类型。目标靶组织的实例包括特定组织、器官和系统或它们的组。在特定应用中,靶组织可以是肾脏、肺、脾脏、血管中的血管内皮(例如,冠状动脉内或股内)或肿瘤组织(例如,通过肿瘤内注射)。“脱靶组织”是指其中编码的蛋白质的表达不会产生所需的生物学和/或药理学作用的任何一种或多种组织类型。在特定应用中,脱靶组织可包括肝脏和脾脏。
术语“治疗剂”或“预防剂”是指当向受试者施用时具有治疗、诊断和/或预防作用和/或引发所需生物学和/或药理学作用的任何剂。治疗剂也称为“活性物质”或“活性剂”。此类剂包括但不限于细胞毒素、放射性离子、化学治疗剂、小分子药物、蛋白质和核酸。
如本文所用,术语“治疗有效量”意指在向遭受或易感感染、疾病、病症和/或疾患的受试者施用时足以实现感染、疾病、病症和/或疾患的治疗、症状改善、诊断、预防和/或发作延迟的待递送的剂(例如,核酸、药物、组合物、治疗剂、诊断剂、预防剂等)的量。
如本文所用,“转染”是指将物质(例如,RNA)引入细胞中。转染可例如在体外、离体或体内发生。
如本文所用,术语“治疗”是指部分或完全地实现特定感染、疾病、病症和/或疾患的一种或多种症状或特征的减轻、改善、改进、缓解、发作延迟、进展抑制、严重性降低和/或发生率降低。在一些实施方案中,“治疗”癌症可指抑制肿瘤的存活、生长和/或扩散。可出于降低发展与疾病、病症和/或疾患相关的病理的风险的目的,向未表现出疾病、病症和/或疾患的体征的受试者和/或向仅表现出疾病、病症和/或疾患的早期体征的受试者施用治疗。
如本文所用,“ζ电位”是脂质例如在颗粒组合物中的电动电位。
可电离脂质
在一些方面,本公开的可电离脂质可以是一种或多种式(IL-1)化合物:
或其N-氧化物,或其盐或异构体,其中:
R
R
R
每个R
每个R
M和M’独立选自-C(O)O-、-OC(O)-、-OC(O)-M”-C(O)O-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)
R
R
R
每个R独立地选自由以下组成的组:C
每个R'独立地选自由以下组成的组:C
每个R”独立地选自由以下组成的组:C
每个R*独立地选自由以下组成的组:C
每个Y独立地是C
每个X独立地选自由以下组成的组:F、Cl、Br和I;并且
m选自5、6、7、8、9、10、11、12和13;并且其中当R
在一些实施方案中,式(IL-I)化合物的子集包括式(IL-IA)的那些:
或其N-氧化物,或其盐或异构体,其中l选自1、2、3、4和5;m选自5、6、7、8和9;M
在一些实施方案中,式(I)化合物的子集包括式(IL-IB)的那些:
或其N-氧化物,或其盐或异构体,其中所有变量均如本文所定义。在一些实施方案中,m选自5、6、7、8和9;R
在一些实施方案中,式(IL-I)化合物的子集包括式(IL-II)的那些:
或其N-氧化物,或其盐或异构体,其中l选自1、2、3、4和5;M1是键或M’;R
在一些实施方案中,式(IL-I)化合物是式(IL-IIa):
或其N-氧化物,或其盐或异构体,其中R
或其N-氧化物,或其盐或异构体,其中R
或其N-氧化物,或其盐或异构体,其中R
或其N-氧化物,或其盐或异构体,其中M是-C(O)O-或-OC(O)-,M”是C
在另一实施方案中,式(IL-I)化合物是式(IL-IId):
或其N-氧化物,或其盐或异构体,其中n是2、3或4;并且m、R’、R”以及R
在另一实施方案中,式(IL-I)化合物是式(IL-IIg):
或其N-氧化物,或其盐或异构体,其中l选自1、2、3、4和5;m选自5、6、7、8和9;M
在一些实施方案中,可电离脂质是美国申请号62/220,091、62/252,316、62/253,433、62/266,460、62/333,557、62/382,740、62/393,940、62/471,937、62/471,949、62/475,140和62/475,166以及PCT申请号PCT/US2016/052352中描述的一种或多种化合物。
在一些实施方案中,可电离脂质选自美国申请号62/475,166中描述的化合物1-280。
在一些实施方案中,可电离脂质是
在一些实施方案中,可电离脂质是
在一些实施方案中,可电离脂质是
在一些实施方案中,可电离脂质是
在一些实施方案中,可电离脂质是
在一些方面,本公开的可电离脂质可以是一种或多种式(IL-III)化合物:
或其盐或立体异构体,其中,
W是
环A是
t是1或2;
A
Z是CH
R
R
每个M独立地选自由以下组成的组:-C(O)O-、-OC(O)-、-OC(O)O-、-C(O)N(R’)-、-N(R’)C(O)-、-C(O)-、-C(S)-、-C(S)S-、-SC(S)-、-CH(OH)-、-P(O)(OR’)O-、-S(O)
M*是C
W
每个R
X
每个Y独立地是C
每个R*独立地选自由以下组成的组:C
每个R独立地选自由以下组成的组:C
每个R’独立地选自由以下组成的组:C
每个R”独立地选自由以下组成的组:C
n是1-6的整数;
其中当环A是
i)X
ii)R
在一些实施方案中,所述化合物是式(IL-IIIa1)-(IL-IIIa8)中的任一种:
在一些实施方案中,可电离脂质是美国申请号62/271,146、62/338,474、62/413,345和62/519,826以及PCT申请号PCT/US2016/068300中描述的一种或多种化合物。
在一些实施方案中,可电离脂质选自美国申请号62/519,826中描述的化合物1-156。
在一些实施方案中,可电离脂质选自美国申请号62/519,826中描述的化合物1-16、42-66、68-76和78-156。
在一些实施方案中,可电离脂质是
根据式(IL-1)、(IL-IA)、(IL-IB)、(IL-II)、(IL-IIa)、(IL-IIb)、(IL-IIc)、(IL-IId)、(IL-IIe)、(IL-IIf)、(IL-IIg)、(IL-III)、(IL-IIIa1)、(IL-IIIa2)、(IL-IIIa3)、(IL-IIIa4)、(IL-IIIa5)、(IL-IIIa6)、(IL-IIIa7)或(IL-IIIa8)的脂质的中心胺部分可在生理pH下质子化。因此,脂质可在生理pH下具有正或部分正电荷。此类脂质可被称为阳离子或可电离(氨基)脂质。脂质也可以是两性离子性的,即具有正电荷和负电荷的中性分子。
聚乙二醇(PEG)脂质
如本文所用,术语“PEG脂质”是指聚乙二醇(PEG)修饰的脂质。PEG-脂质的非限制性实例包括PEG修饰的磷脂酰乙醇胺和磷脂酸、PEG-神经酰胺缀合物(例如,PEG-CerC14或PEG-CerC20)、PEG修饰的二烷基胺和PEG修饰的1,2-二酰氧基丙-3-胺。此类脂质也称为聚乙二醇化脂质。在一些实施方案中,PEG脂质可以是PEG-c-DOMG、PEG-DMG、PEG-DLPE、PEG-DMPE、PEG-DPPC或PEG-DSPE脂质。
在一些实施方案中,PEG脂质包括但不限于1,2-二肉豆蔻酰基-sn-甘油甲氧基聚乙二醇(PEG-DMG)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-N-[氨基(聚乙二醇)](PEG-DSPE)、PEG-二甾醇基甘油(PEG-DSG)、PEG-二棕榈油基、PEG-二油基、PEG-二硬脂基、PEG-二酰基甘油酰胺(PEG-DAG)、PEG-二棕榈酰基磷脂酰乙醇胺(PEG-DPPE)或PEG-l,2-二肉豆蔻酰基氧基丙基-3-胺(PEG-c-DMA)。
在一些实施方案中,PEG脂质选自由以下组成的组:PEG修饰的磷脂酰乙醇胺、PEG修饰的磷脂酸、PEG修饰的神经酰胺、PEG修饰的二烷基胺、PEG修饰的二酰基甘油、PEG修饰的二烷基甘油以及它们的混合物。
在一些实施方案中,PEG脂质的脂质部分包括长度为约C
在一些实施方案中,本文所述的脂质纳米颗粒可包含PEG脂质,其是非扩散性PEG。非扩散性PEG的非限制性实例包括PEG-DSG和PEG-DSPE。
PEG脂质是本领域已知的,如美国专利号8158601和国际公布号WO 2015/130584A2中描述的那些,所述专利以引用的方式整体并入本文。
一般来说,本文所述的各种式一些其他脂质组分(例如,PEG脂质)可如2016年12月10日提交的题为“Compositions and Methods for Delivery of Therapeutic Agents”的国际专利申请号PCT/US2016/000129所述来合成,所述专利申请以引用的方式整体并入本文。
脂质纳米颗粒组合物的脂质组分可包括一种或多种包含聚乙二醇的分子,如PEG或PEG修饰的脂质。此类物质可替代地称为聚乙二醇化脂质。PEG脂质是用聚乙二醇修饰的脂质。PEG脂质可选自包括以下的非限制性组:PEG修饰的磷脂酰乙醇胺、PEG修饰的磷脂酸、PEG修饰的神经酰胺、PEG修饰的二烷基胺、PEG修饰的二酰基甘油、PEG修饰的二烷基甘油以及它们的混合物。在一些实施方案中,PEG脂质可以是PEG-c-DOMG、PEG-DMG、PEG-DLPE、PEG-DMPE、PEG-DPPC或PEG-DSPE脂质。
在一些实施方案中,PEG修饰的脂质是PEG DMG的经修饰形式。PEG-DMG具有以下结构:
在一些实施方案中,可用于本发明的PEG脂质可以是国际公布号WO2012099755中描述的聚乙二醇化脂质,所述国际公布的内容以引用的方式整体并入本文。可修饰本文所述的这些示例性PEG脂质中的任一者以在PEG链上包含羟基。在一些实施方案中,PEG脂质是PEG-OH脂质。如本文一般定义的,“PEG-OH脂质”(在本文中也称为“羟基-聚乙二醇化脂质”)是在脂质上具有一个或多个羟基(-OH)的聚乙二醇化脂质。在一些实施方案中,PEG-OH脂质在PEG链上包含一个或多个羟基。在一些实施方案中,PEG-OH或羟基-聚乙二醇化脂质在PEG链的末端包含-OH基团。每种可能性代表本发明的单独实施方案。
在一些实施方案中,可用于本发明的PEG脂质是式(PL-I)化合物。本文提供了式(PL-I)化合物:
或其盐,其中:
R
R
r是介于1与100之间的整数,包括端值;
L
D是通过点击化学获得的部分或在生理条件下可裂解的部分;
m是0、1、2、3、4、5、6、7、8、9或10;
A具有式:
L
R
R
环B是任选取代的碳环基、任选取代的杂环基、任选取代的芳基或任选取代的杂芳基;并且
p是1或2。
在一些实施方案中,式(PL-I)化合物是PEG-OH脂质(即,R
或其盐。
在一些实施方案中,可用于本发明的PEG脂质是聚乙二醇化脂肪酸。在一些实施方案中,可用于本发明的PEG脂质是式(PL-II)化合物。本文提供了式(PL-II)化合物:
或其盐,其中:
R
R
r是介于1与100之间的整数,包括端值;
R
R
在一些实施方案中,式(PL-II)化合物是式(PL-II-OH):
或其盐。在一些实施方案中,r是45。
在一些实施方案中,式(PL-II)化合物是:
或其盐。
在一些实施方案中,式(PL-II)化合物是
在一些实施方案中,PEG脂质可以是美国申请号62/520,530中描述的一种或多种PEG脂质。
在一些实施方案中,可用于本发明的PEG脂质是式(PL-IV)化合物。
或其盐,其中:
R
r是介于0与100之间的整数,包括端值。
在一些实施方案中,r是0。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,式(PL-IV)化合物是
在一些实施方案中,式(PL-IV)化合物是
在一些实施方案中,式(PL-IV)化合物是
在一些实施方案中,式(PL-IV)化合物是
在一些方面,本文描述的药物组合物的脂质组合物不包含PEG脂质。
结构脂质
如本文所用,术语“结构脂质”是指固醇以及含固醇部分的脂质。
不希望受理论束缚,在脂质纳米颗粒中并入结构脂质可有助于减轻颗粒中其他脂质的聚集。结构脂质可选自包括但不限于以下的组:胆固醇、粪固醇、谷固醇、麦角固醇、菜油固醇、豆固醇、菜籽固醇、番茄碱、番茄苷、熊果酸、α-生育酚、藿烷类、植物固醇、类固醇以及其混合物。在一些实施方案中,结构脂质是固醇。如本文所定义,“固醇”是由类固醇组成的类固醇的亚组。在一些实施方案中,结构脂质是类固醇。在一些实施方案中,结构脂质是胆固醇。在一些实施方案中,结构脂质是胆固醇的类似物。在一些实施方案中,结构脂质是α-生育酚。
在一些实施方案中,结构脂质可以是美国申请号62/520,530中描述的一种或多种结构脂质。
包封剂
在本公开的一些实施方案中,包封剂是式(EA-I)化合物:
或其盐或异构体,其中
R
R
R
n1选自1、2、3、4、5、6、7、8、9和10。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,n1选自1、2、3、4、5、6、7、8、9和10;n1选自1、2、3、4、5和6;n1选自2、3和4。
在一些实施方案中,n1是3。
在本公开的一些实施方案中,包封剂是式(EA-II)化合物:
或其盐或异构体,其中
X
R
R
n1选自1、2、3、4、5、6、7、8、9和10。
在一些实施方案中,X
在一些实施方案中,X
在一些实施方案中,X
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,n1选自1、2、3、4、5、6、7、8、9和10;n1选自1、2、3、4、5和6;或n1选自2、3和4。
在一些实施方案中,n1是3。
示例性包封剂包括但不限于月桂酰基精氨酸乙酯、肉豆蔻酰基精氨酸乙酯、棕榈酰基精氨酸乙酯、油酸精氨酸乙酯、癸酸精癸酸乙酯和辛酸精氨酸乙酯。
在某些实施方案中,包封剂是月桂酰基精氨酸乙酯、
在某些实施方案中,包封剂是选自由以下组成的组的至少一种化合物:
或其盐和异构体,例如游离碱、TFA盐和/或HCl盐。在本公开的一些实施方案中,包封剂是式(EA-III)化合物:
或其盐或异构体,其中
R
R
R
R
n2选自1、2、3、4、5、6、7、8、9和10。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,n2选自1、2、3、4、5、6、7、8、9和10。
在一些实施方案中,n2选自1、2、3、4、5和6。
在一些实施方案中,n2选自2、3和4。
在一些实施方案中,n2是3。
示例性包封剂包括但不限于EA-11、EA-12、EA-13和EA-14。
在某些实施方案中,包封剂是选自由以下组成的组的至少一种化合物:
或其盐和异构体,例如游离碱、TFA盐和/或HCl盐。
磷脂
磷脂可组装成一个或多个脂质双层。一般来说,磷脂包含磷脂部分和一个或多个脂肪酸部分。
磷脂部分可选自,例如,由以下组成的非限制性组:磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰甘油、磷脂酰丝氨酸、磷脂酸、2-溶血磷脂酰胆碱和鞘磷脂。
脂肪酸部分可选自,例如,由以下组成的非限制性组:月桂酸、肉豆蔻酸、肉豆蔻脑酸、棕榈酸、棕榈油酸、硬脂酸、油酸、亚油酸、α-亚麻酸、芥酸、植烷酸、花生酸、花生四烯酸、二十碳五烯酸、山嵛酸、二十二碳五烯酸和二十二碳六烯酸。
特定磷脂可促进与膜的融合。在一些实施方案中,阳离子磷脂可与膜(例如,细胞或细胞内膜)的一种或多种带负电荷的磷脂相互作用。磷脂与膜的融合可允许含脂质组合物(例如,LNP)的一种或多种要素(例如,治疗剂)穿过所述膜,从而允许例如将一种或多种要素递送至靶组织(例如,肿瘤组织)。
还考虑了非天然磷脂物质,包括具有修饰和取代(包括支化、氧化、环化和炔烃)的天然物质。在一些实施方案中,磷脂可用一种或多种炔烃官能化或交联(例如,其中一个或多个双键被三键置换的烯基)。在适当反应条件下,炔烃基团可在暴露于叠氮化物时经历铜催化的环加成反应。此类反应可用于官能化纳米颗粒组合物的脂质双层以促进膜渗透或细胞识别或将纳米颗粒组合物与有用组分如靶向或成像部分(例如染料)缀合。
磷脂包括但不限于甘油磷脂,如磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇、磷脂酰甘油和磷脂酸。磷脂还包括鞘磷脂(phosphosphingolipid),如鞘磷脂(sphingomyelin)。
在一些实施方案中,在本发明中有用或可能有用的磷脂是DSPC的类似物或变体。在一些实施方案中,在本发明中有用或可能有用的磷脂是式(PL-I)化合物:
或其盐,其中:
每个R
n是1、2、3、4、5、6、7、8、9或10;
m是0、1、2、3、4、5、6、7、8、9或10;
A具有式:
L
R
R
环B是任选取代的碳环基、任选取代的杂环基、任选取代的芳基或任选取代的杂芳基;并且
p是1或2;
前提是所述化合物不具有下式:
其中R
在一些实施方案中,磷脂可以是美国申请号62/520,530中描述的一种或多种磷脂。
i)磷脂头部修饰
在一些实施方案中,在本发明中有用或可能有用的磷脂包含经修饰的磷脂头部(例如,经修饰的胆碱基团)。在一些实施方案中,具有经修饰的头部的磷脂是具有经修饰的季胺的DSPC或其类似物。在一些实施方案中,在式(PL-I)的实施方案中,至少一个R
或其盐,其中:
每个t独立地是1、2、3、4、5、6、7、8、9或10;
每个u独立地是0、1、2、3、4、5、6、7、8、9或10;并且
每个v独立地是1、2或3。
在一些实施方案中,式(PL-I)化合物是式(PL-I-a):
或其盐。
在一些实施方案中,在本发明中有用或可能有用的磷脂包含代替甘油酯部分的环状部分。在一些实施方案中,在本发明中有用的磷脂是具有代替甘油酯部分的环状部分的DSPC或其类似物。在一些实施方案中,式(PL-I)化合物是式(PL-I-b):
或其盐。
ii)磷脂尾部修饰
在一些实施方案中,在本发明中有用或可能有用的磷脂包含经修饰的尾部。在一些实施方案中,在本发明中有用或可能有用的磷脂是具有经修饰的尾部的DSPC或其类似物。如本文所述,“经修饰的尾部”可以是具有更短或更长脂族链、具有引入的支化的脂族链、具有引入的取代基的脂族链、其中一个或多个亚甲基被环状或杂原子基团置换的脂族链或它们的任何组合的尾部。在一些实施方案中,(PL-I)的化合物是式(PL-I-a)或其盐,其中R
在一些实施方案中,式(PL-I)化合物是式(PL-I-c):
或其盐,其中:
每个x独立地是介于0-30之间的整数(包括端值);并且
G的每个实例独立地选自由以下组成的组:任选取代的亚碳环基、任选取代的亚杂环基、任选取代的亚芳基、任选取代的亚杂芳基、-N(R
在一些实施方案中,在本发明中有用或可能有用的磷脂包含经修饰的磷酸胆碱部分,其中将季胺连接至磷酰基的烷基链不是亚乙基(例如,n不是2)。因此,在一些实施方案中,在本发明中有用或可能有用的磷脂是式(PL-I)化合物,其中n是1、3、4、5、6、7、8、9或10。在一些实施方案中,式(PL-I)化合物是以下式之一:
或其盐。
替代脂质
在一些实施方案中,使用替代脂质代替本公开的磷脂。此类替代脂质的非限制性实例包括以下:
佐剂
在一些实施方案中,包含一种或多种本文描述的脂质的LNP还可包含一种或多种佐剂,例如,吡喃葡萄糖基脂质佐剂(GLA)、CpG寡脱氧核苷酸(例如,A或B类)、聚(I:C)、氢氧化铝和Pam3CSK4。
治疗剂
脂质纳米颗粒可包含一种或多种治疗剂和/或预防剂,如核酸。本公开的特征是向哺乳动物细胞或器官递送治疗剂和/或预防剂(如核酸)、在哺乳动物细胞中产生目标多肽以及治疗有需要的哺乳动物中的疾病或病症的方法,所述方法包括向哺乳动物施用包含治疗剂和/或预防剂(如核酸)的LNP和/或使哺乳动物细胞与包含治疗剂和/或预防剂(如核酸)的LNP接触。
治疗剂和/或预防剂包括生物活性物质,并且可替代地称为“活性剂”。治疗剂和/或预防剂可以是一旦被递送至细胞或器官就在细胞、器官或其他身体组织或系统中引起令人希望的变化的物质。此类物质可用于治疗一种或多种疾病、病症或疾患。在一些实施方案中,治疗剂和/或预防剂是可用于治疗特定疾病、病症或疾患的小分子药物。可用于脂质纳米颗粒中的药物的实例包括但不限于抗肿瘤剂(antineoplastic agent)(例如,长春新碱、阿霉素、米托蒽醌、喜树碱、顺铂、博来霉素、环磷酰胺、甲氨蝶呤和链脲霉素)、抗肿瘤剂(antitumor agent)(例如,放线菌素D、长春新碱、长春碱、胞嘧啶阿拉伯糖苷、蒽环类药物、烷化剂、铂化合物、抗代谢物和核苷类似物,如甲氨蝶呤和嘌呤以及嘧啶类似物)、抗感染剂、局部麻醉剂(例如,地布卡因和氯丙嗪)、β-肾上腺素能阻滞剂(例如,普萘洛尔、噻吗洛尔和拉贝洛尔)、抗高血压剂(例如,可乐定和肼苯哒嗪)、抗抑郁药(例如,丙咪嗪、阿米替林和多虑平)、抗惊厥剂(anti-conversant)(例如,苯妥英)、抗组胺药(例如,苯海拉明、氯苯那敏和异丙嗪)、抗生素/抗细菌剂(例如,庆大霉素、环丙沙星和头孢西丁)、抗真菌剂(例如,咪康唑、特康唑、益康唑、异康唑、布康唑、克霉唑、伊曲康唑、制霉菌素、萘替芬和两性霉素B)、抗寄生虫剂、激素、激素拮抗剂、免疫调节剂、神经递质拮抗剂、抗青光眼剂、维生素、麻醉剂和成像剂。
在一些实施方案中,治疗剂和/或预防剂是细胞毒素、放射性离子、化学治疗剂、疫苗、引发免疫应答的化合物和/或另一种治疗剂和/或预防剂。细胞毒素或细胞毒性剂包括可对细胞有害的任何剂。实例包括但不限于紫杉醇、细胞松弛素B、短杆菌肽D、溴化乙锭、吐根碱、丝裂霉素、依托泊苷、替尼泊苷、长春新碱、长春碱、秋水仙碱、阿霉素、柔红霉素、二羟基炭疽菌素二酮、米托蒽醌、光神霉素、放线菌素D、1-去氢睾固酮、糖皮质激素、普鲁卡因、丁卡因(teracaine)、利多卡因、普萘洛尔、嘌呤霉素、美登木素生物碱(例如美登醇)、拉奇霉素(CC-1065)以及其类似物或同系物。放射性离子包括但不限于碘(例如,碘125或碘131)、锶89、磷、钯、铯、铱、磷酸盐、钴、钇90、钐153以及镨。疫苗包括能够提供针对一种或多种与传染性疾病(如流感、麻疹、人乳头瘤病毒(HPV)、狂犬病、脑膜炎、百日咳、破伤风、瘟疫、肝炎和结核病)有关的一种或多种疾患的免疫力的化合物和制剂,并且可包括编码传染性疾病来源的抗原和/或表位的mRNA。疫苗还包括指导针对癌细胞的免疫应答的化合物和制剂,并且可包括编码肿瘤细胞来源的抗原、表位和/或新表位的mRNA。引发免疫应答的化合物可包括但不限于疫苗、皮质类固醇(例如,地塞米松)和其他物质。
在一些实施方案中,治疗剂和/或预防剂是蛋白质。可用于本公开的纳米颗粒中的治疗性蛋白质包括但不限于庆大霉素、阿米卡星、胰岛素、促红细胞生成素(EPO)、粒细胞集落刺激因子(G-CSF)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、因子VIR、促黄体生成激素释放激素(LHRH)类似物、干扰素、肝素、乙型肝炎表面抗原、伤寒疫苗和霍乱疫苗。在一些实施方案中,经由包含根据式(IL-I)、(IL-IA)、(IL-IB)、(IL-II)、(IL-IIa)、(IL-IIb)、(IL-IIc)、(IL-IId)、(IL-IIe)、(IL-IIf)、(IL-IIg)、(IL-III)、(IL-IIIa1)、(IL-IIIa2)、(IL-IIIa3)、(IL-IIIa4)、(IL-IIIa5)、(IL-IIIa6)、(IL-IIIa7)或(IL-IIIa8)的化合物(例如,化合物3、18、20、26或29)的组合物肌肉内施用能够引发免疫应答的疫苗和/或化合物。其他治疗剂和/或预防剂包括但不限于抗代谢药(例如,甲氨蝶呤、6-巯基嘌呤、6-硫代鸟嘌呤、阿糖胞苷、5-氟尿嘧啶达卡巴嗪)、烷化剂(例如,氮芥、塞替派、苯丁酸氮芥、拉奇霉素(CC-1065)、美法仑、卡莫司汀(BSNU)、洛莫司汀(CCNU)、环磷酰胺、白消安、二溴甘露醇、链脲霉素、丝裂霉素C以及顺式-二氯二胺铂(II)(DDP)顺铂)、蒽环类药物(,例如,柔红霉素(以前称为道诺霉素)和阿霉素)、抗生素(例如,更生霉素(以前称为放线菌素)、博来霉素、光神霉素和安曲霉素(AMC))以及抗有丝分裂剂(例如,长春新碱、长春碱、紫杉醇和美登木素生物碱)。
多核苷酸和核酸
在一些实施方案中,治疗剂是多核苷酸或核酸(例如,核糖核酸或脱氧核糖核酸)。术语“多核苷酸”在其广义上包括作为寡核苷酸链或者可并入寡核苷酸链中的任何化合物和/或物质。根据本公开使用的示例性多核苷酸包括但不限于脱氧核糖核酸(DNA)、包括信使RNA(mRNA)的核糖核酸(RNA)、其杂合体、RNAi诱导剂、RNAi剂、siRNA、shRNA、miRNA、反义RNA、核酶、催化DNA、诱导三螺旋形成的RNA、适体、载体等中的一者或多者。在一些实施方案中,治疗剂和/或预防剂是RNA。在本文所述的组合物和方法中有用的RNA可选自由以下组成的组:但不限于短链体(shortmer)、antagomir、反义、核酶、小干扰RNA(siRNA)、不对称干扰RNA(aiRNA)、微小RNA(miRNA)、Dicer-底物RNA(dsRNA)、小发夹RNA(shRNA)、转移RNA(tRNA)、信使RNA(mRNA)以及它们的混合物。在一些实施方案中,RNA是mRNA。
在一些实施方案中,治疗剂和/或预防剂是mRNA。mRNA可编码任何目标多肽,包括任何天然或非天然存在的或以其他方式修饰的多肽。由mRNA编码的多肽可具有任何大小,并且可具有任何二级结构或活性。在一些实施方案中,当在细胞中表达时,由mRNA编码的多肽可具有治疗作用。
在一些实施方案中,治疗剂和/或预防剂是siRNA。siRNA可能能够选择性地敲低或下调目标基因的表达。在一些实施方案中,在向有需要的受试者施用包含siRNA的LNP时,可选择siRNA以使与特定疾病、病症或疾患相关的基因沉默。siRNA可包含与编码目标基因或蛋白质的mRNA序列互补的序列。在一些实施方案中,siRNA可以是免疫调节性siRNA。
在一些实施方案中,治疗剂和/或预防剂是shRNA或编码所述shRNA的载体或质粒。在将合适的构建体递送至细胞核后,可在靶细胞内部产生shRNA。与shRNA有关的构建体和机制在相关领域中是众所周知的。
可用于本公开中的核酸和多核苷酸通常包含编码目标多肽的连接核苷的第一区域(例如,编码区)、位于所述第一区域的5'-末端的第一侧翼区域(例如,5’-UTR)、位于所述第一区域的3'-末端的第二侧翼区域(例如,3’-UTR)、至少一个5'-帽区域和3'稳定区域。在一些实施方案中,核酸或多核苷酸还包含poly-A区或Kozak序列(例如在5'-UTR中)。在一些情况下,多核苷酸可含有一个或多个能够从多核苷酸中切除的内含子核苷酸序列。在一些实施方案中,多核苷酸或核酸(例如,mRNA)可包含5'帽结构、链终止核苷酸、茎环、polyA序列和/或聚腺苷酸化信号。核酸的任何一个区域可包含一种或多种替代组分(例如,替代核苷)。在一些实施方案中,3'-稳定区可含有替代核苷(如L-核苷)、反向胸苷或2'-O-甲基核苷和/或编码区5;-UTR、3'-UTR,或者帽区域可包含替代核苷,如5-取代的尿苷(例如5-甲氧基尿苷)、1-取代的假尿苷(例如1-甲基-假尿苷)和/或5-取代的胞苷(例如,5-甲基-胞苷)。
一般来说,多核苷酸的最短长度可以是足以编码二肽的多核苷酸序列的长度。在另一个实施方案中,多核苷酸序列的长度足以编码三肽。在另一个实施方案中,多核苷酸序列的长度足以编码四肽。在另一个实施方案中,多核苷酸序列的长度足以编码五肽。在另一个实施方案中,多核苷酸序列的长度足以编码六肽。在另一个实施方案中,多核苷酸序列的长度足以编码七肽。在另一个实施方案中,多核苷酸序列的长度足以编码八肽。在另一个实施方案中,多核苷酸序列的长度足以编码九肽。在另一个实施方案中,多核苷酸序列的长度足以编码十肽。
替代多核苷酸序列可编码的二肽的实例包括但不限于肌肽和鹅肌肽。
在一些情况下,多核苷酸的长度大于30个核苷酸。在另一个实施方案中,多核苷酸分子的长度大于35个核苷酸。在另一个实施方案中,长度是至少40个核苷酸。在另一个实施方案中,长度是至少45个核苷酸。在另一个实施方案中,长度是至少50个核苷酸。在另一个实施方案中,长度是至少55个核苷酸。在另一个实施方案中,长度是至少60个核苷酸。在另一个实施方案中,长度是至少80个核苷酸。在另一个实施方案中,长度是至少90个核苷酸。在另一个实施方案中,长度是至少100个核苷酸。在另一个实施方案中,长度是至少120个核苷酸。在另一个实施方案中,长度是至少140个核苷酸。在另一个实施方案中,长度是至少160个核苷酸。在另一个实施方案中,长度是至少180个核苷酸。在另一个实施方案中,长度是至少200个核苷酸。在另一个实施方案中,长度是至少250个核苷酸。在另一个实施方案中,长度是至少300个核苷酸。在另一个实施方案中,长度是至少350个核苷酸。在另一个实施方案中,长度是至少400个核苷酸。在另一个实施方案中,长度是至少450个核苷酸。在另一个实施方案中,长度是至少500个核苷酸。在另一个实施方案中,长度是至少600个核苷酸。在另一个实施方案中,长度是至少700个核苷酸。在另一个实施方案中,长度是至少800个核苷酸。在另一个实施方案中,长度是至少900个核苷酸。在另一个实施方案中,长度是至少1000个核苷酸。在另一个实施方案中,长度是至少1100个核苷酸。在另一个实施方案中,长度是至少1200个核苷酸。在另一个实施方案中,长度是至少1300个核苷酸。在另一个实施方案中,长度是至少1400个核苷酸。在另一个实施方案中,长度是至少1500个核苷酸。在另一个实施方案中,长度是至少1600个核苷酸。在另一个实施方案中,长度是至少1800个核苷酸。在另一个实施方案中,长度是至少2000个核苷酸。在另一个实施方案中,长度是至少2500个核苷酸。在另一个实施方案中,长度是至少3000个核苷酸。在另一个实施方案中,长度是至少4000个核苷酸。在另一个实施方案中,长度是至少5000个核苷酸,或大于5000个核苷酸。
核酸和多核苷酸可包含一种或多种天然存在的组分,包括规范核苷酸A(腺苷)、G(鸟苷)、C(胞嘧啶)、U(尿苷)或T(胸苷)。在一些实施方案中,所有或基本上所有的包含(a)5'-UTR、(b)开放阅读框(ORF)、(c)3'-UTR、(d)poly A尾和(以上a、b、c或d)的任何组合的核苷酸包含天然存在的规范核苷酸A(腺苷)、G(鸟苷)、C(胞嘧啶)、U(尿苷)或T(胸苷)。
核酸和多核苷酸可包含如本文所述的一种或多种替代组分,所述一种或多种替代组分赋予有用的性质,包括增加的稳定性和/或缺乏实质性诱导其中引入多核苷酸的细胞的先天型免疫应答。在一些实施方案中,相对于相应未改变的多核苷酸或核酸,替代多核苷酸或核酸在其中引入了所述多核苷酸或核酸的细胞中表现出降低的降解。这些替代物质可增强蛋白质产生的效率、多核苷酸的细胞内保留和/或所接触细胞的活力,以及具有降低的免疫原性。
多核苷酸和核酸可以是天然或非天然存在的。多核苷酸和核酸可包含一种或多种经修饰的(例如,改变的或替代)核碱基、核苷、核苷酸或它们的组合。可用于LNP中的核酸和多核苷酸可包含任何有用的修饰或改变,如对核碱基、糖或核苷间键联(例如,对连接磷酸酯、对磷酸二酯键联、对磷酸二酯主链)的修饰或改变。在一些实施方案中,改变(例如,一种或多种改变)存在于核碱基、糖和核苷间键联中的每一者中。根据本公开的改变可以是核糖核酸(RNA)改变为脱氧核糖核酸(DNA)(例如核糖呋喃糖基环的2'-OH取代为2'-H)、苏糖核酸(TNA)、乙二醇核酸(GNA)、肽核酸(PNA)、锁核酸(LNA)或其杂合体。另外的改变在本文中进行了描述。
多核苷酸和核酸可以或可以不沿着分子的整个长度均匀地改变。在一些实施方案中,一种或多种或所有类型的核苷酸(例如,嘌呤或嘧啶,或A、G、U、C中的任何一者或多者或全部)可以或可以不在多核苷酸或核酸中或在其给定的预先确定的序列区域中均匀地改变。在一些实例中,多核苷酸中(或其给定序列区中)的所有核苷酸X被改变,其中X可以是核苷酸A、G、U、C中的任一者或组合A+G、A+U、A+C、G+U、G+C、U+C、A+G+U、A+G+C、G+U+C或A+G+U+C中的任一者。
不同的糖改变和/或核苷间键联(例如,主链结构)可存在于多核苷酸中的不同位置处。本领域的普通技术人员将了解核苷酸类似物或一种或多种其它改变可位于多核苷酸的任何一个或多个位置处,以使得多核苷酸的功能基本上不被降低。改变还可以是5'或3'-末端改变。在一些实施方案中,多核苷酸在3'-末端包含改变。多核苷酸可含有约1%至约100%的替代核苷酸(相对于总体核苷酸含量或相对于一种或多种类型的核苷酸,即,A、G、U或C中的任何一者或多者)或任何中间百分比(例如,1%至20%、1%至25%、1%至50%、1%至60%、1%至70%、1%至80%、1%至90%、1%至95%、10%至20%、10%至25%、10%至50%、10%至60%、10%至70%、10%至80%、10%至90%、10%至95%、10%至100%、20%至25%、20%至50%、20%至60%、20%至70%、20%至80%、20%至90%、20%至95%、20%至100%、50%至60%、50%至70%、50%至80%、50%至90%、50%至95%、50%至100%、70%至80%、70%至90%、70%至95%、70%至100%、80%至90%、80%至95%、80%至100%、90%至95%、90%至100%以及95%至100%)。应理解,任何剩余的百分比是由于规范核苷酸(例如,A、G、U或C)的存在。
多核苷酸可含有至少零个和至多100%的替代核苷酸,或任何中间百分比,如至少5%的替代核苷酸、至少10%的替代核苷酸、至少25%的替代核苷酸、至少50%的替代核苷酸、至少80%的替代核苷酸或至少90%的替代核苷酸。在一些实施方案中,多核苷酸可含有替代嘧啶,如替代尿嘧啶或胞嘧啶。在一些实施方案中,多核苷酸中至少5%、至少10%、至少25%、至少50%、至少80%、至少90%或100%的尿嘧啶被替代尿嘧啶(例如,5-取代的尿嘧啶)置换。替代尿嘧啶可被具有单一独特结构的化合物置换,或者可被具有不同结构(例如,2、3、4种或更多种独特结构)的多种化合物置换。在一些实例中,多核苷酸中至少5%、至少10%、至少25%、至少50%、至少80%、至少90%或100%的胞嘧啶被替代胞嘧啶(例如,5-取代的胞嘧啶)置换。替代胞嘧啶可被具有单一独特结构的化合物置换,或者可被具有不同结构(例如,2、3、4种或更多种独特结构)的多种化合物置换。
在一些实施方案中,核酸基本上不诱导其中引入了多核苷酸(例如,mRNA)的细胞的先天性免疫应答。诱导的先天性免疫应答的特征包括1)促炎性细胞因子的表达增加,2)细胞内PRR(RIG-I、MDA5等)的活化,和/或3)蛋白质翻译的终止或减少。
核酸可任选地包括其它剂(例如,RNAi-诱导剂、RNAi剂、siRNA、shRNA、miRNA、反义RNA、核酶、催化性DNA、tRNA、诱导三螺旋形成的RNA、适体、载体)。在一些实施方案中,核酸可包含具有一个或多个替代核苷或核苷酸(即,替代mRNA分子)的一种或多种信使RNA(mRNA)。
在一些实施方案中,与其相关的核酸(例如,mRNA)分子、式、组合物或方法包含一种或多种多核苷酸,所述多核苷酸包含如WO2002/098443、WO2003/051401、WO2008/052770、WO2009127230、WO2006122828、WO2008/083949、WO2010088927、WO2010/037539、WO2004/004743、WO2005/016376、WO2006/024518、WO2007/095976、WO2008/014979、WO2008/077592、WO2009/030481、WO2009/095226、WO2011069586、WO2011026641、WO2011/144358、WO2012019780、WO2012013326、WO2012089338、WO2012113513、WO2012116811、WO2012116810、WO2013113502、WO2013113501、WO2013113736、WO2013143698、WO2013143699、WO2013143700、WO2013/120626、WO2013120627、WO2013120628、WO2013120629、WO2013174409、WO2014127917、WO2015/024669、WO2015/024668、WO2015/024667、WO2015/024665、WO2015/024666、WO2015/024664、WO2015101415、WO2015101414、WO2015024667、WO2015062738、WO2015101416中描述的特征,所述专利全部以引用的方式并入本文。
核碱基替代物
替代核苷和核苷酸可包含替代核碱基。核酸的核碱基是有机碱基,如嘌呤或嘧啶或其衍生物。核碱基可以是规范碱基(例如,腺嘌呤、鸟嘌呤、尿嘧啶、胸腺嘧啶和胞嘧啶)。可改变或完全取代这些核碱基,以提供具有增强的性质(例如增加的稳定性,如对核酸酶的抗性)的多核苷酸分子。非规范或经修饰的碱基可包含例如一种或多种取代或修饰,包括但不限于烷基、芳基、卤代基、氧代基、羟基、烷氧基和/或硫代取代;一个或多个稠环或开环;氧化和/或还原。
替代核苷酸碱基配对不仅涵盖标准腺嘌呤-胸腺嘧啶、腺嘌呤-尿嘧啶或鸟嘌呤-胞嘧啶碱基对,而且涵盖在核苷酸和/或包含非标准或替代碱基的替代核苷酸之间形成的碱基对,其中氢键供体和氢键受体的排列允许非标准碱基与标准碱基之间或两个互补的非标准碱基结构之间的氢键合。这种非标准碱基配对的一个实例是替代核苷酸肌苷与腺嘌呤、胞嘧啶或尿嘧啶之间的碱基配对。
在一些实施方案中,核碱基是替代尿嘧啶。具有替代尿嘧啶的示例性核碱基和核苷包括但不限于假尿苷(ψ)、吡啶-4-酮核糖核苷、5-氮杂-尿嘧啶、6-氮杂-尿嘧啶、2-硫代-5-氮杂-尿嘧啶、2-硫代-尿嘧啶(s
在一些实施方案中,核碱基是替代胞嘧啶。具有替代胞嘧啶的示例性核碱基和核苷包括但不限于5-氮杂-胞嘧啶、6-氮杂-胞嘧啶、假异胞苷、3-甲基-胞嘧啶(m3C)、N4-乙酰基-胞嘧啶(ac4C)、5-甲酰基-胞嘧啶(f5C)、N4-甲基-胞嘧啶(m4C)、5-甲基-胞嘧啶(m5C)、5-卤代-胞嘧啶(例如,5-碘-胞嘧啶)、5-羟甲基-胞嘧啶(hm5C)、1-甲基-假异胞苷、吡咯并-胞嘧啶、吡咯并-假异胞苷、2-硫代-胞嘧啶(s2C)、2-硫代-5-甲基-胞嘧啶、4-硫代-假异胞苷、4-硫代-1-甲基-假异胞苷、4-硫代-1-甲基-1-脱氮-假异胞苷、1-甲基-1-脱氮-假异胞苷,泽布拉恩、5-氮杂-泽布拉恩、5-甲基-泽布拉恩、5-氮杂-2-硫代-泽布拉恩、2-硫代-泽布拉恩、2-甲氧基-胞嘧啶、2-甲氧基-5-甲基-胞嘧啶、4-甲氧基-假异胞苷、4-甲氧基-1-甲基-假异胞苷、赖胞苷(k2C)、5,2'-O-二甲基-胞苷(m5Cm)、N4-乙酰基-2'-O-甲基-胞苷(ac4Cm)、N4,2'-O-二甲基-胞苷(m4Cm)、5-甲酰基-2'-O-甲基-胞苷(f5Cm)、N4,N4,2′-O-三甲基-胞苷(m42Cm)、1-硫代-胞嘧啶、5-羟基-胞嘧啶、5-(3-叠氮基丙基)-胞嘧啶以及5-(2-叠氮基乙基)-胞嘧啶。
在一些实施方案中,核碱基是替代腺嘌呤。具有替代腺嘌呤的示例性核碱基和核苷包括但不限于2-氨基-嘌呤、2,6-二氨基嘌呤、2-氨基-6-卤代-嘌呤(例如,2-氨基-6-氯-嘌呤)、6-卤代-嘌呤(例如,6-氯-嘌呤)、2-氨基-6-甲基-嘌呤、8-叠氮基-腺嘌呤、7-脱氮-腺嘌呤、7-脱氮-8-氮杂-腺嘌呤、7-脱氮-2-氨基-嘌呤、7-脱氮-8-氮杂-2-氨基-嘌呤、7-脱氮-2,6-二氨基嘌呤、7-脱氮-8-氮杂-2,6-二氨基嘌呤、1-甲基-腺嘌呤(m1A)、2-甲基-腺嘌呤(m2A)、N6-甲基-腺嘌呤(m6A)、2-甲硫基-N6-甲基-腺嘌呤(ms2m6A)、N6-异戊烯基-腺嘌呤(i6A)、2-甲硫基-N6-异戊烯基-腺嘌呤(ms2i6A)、N6-(顺式-羟基异戊烯基)腺嘌呤(io6A)、2-甲硫基-N6-(顺式-羟基异戊烯基)腺嘌呤(ms2io6A)、N6-甘氨酰基氨甲酰基-腺嘌呤(g6A)、N6-苏氨酰基氨甲酰基-腺嘌呤(t6A)、N6-甲基-N6-苏氨酰基氨甲酰基-腺嘌呤(m6t6A)、2-甲硫基-N6-苏氨酰基氨甲酰基-腺嘌呤(ms2g6A)、N6,N6-二甲基-腺嘌呤(m62A)、N6-羟基正缬氨酰基氨甲酰基-腺嘌呤(hn6A)、2-甲硫基-N6-羟基正缬氨酰基氨甲酰基-腺嘌呤(ms2hn6A)、N6-乙酰基-腺嘌呤(ac6A)、7-甲基-腺嘌呤、2-甲硫基-腺嘌呤、2-甲氧基-腺嘌呤、N6,2′-O-二甲基-腺苷(m6Am)、N6,N6,2′-O-三甲基-腺苷(m62Am)、1,2′-O-二甲基-腺苷(m1Am)、2-氨基-N6-甲基-嘌呤、1-硫代-腺嘌呤、8-叠氮基-腺嘌呤、N6-(19-氨基-五氧杂十九烷基)-腺嘌呤、2,8-二甲基-腺嘌呤、N6-甲酰基-腺嘌呤以及N6-羟甲基-腺嘌呤。
在一些实施方案中,核碱基是替代鸟嘌呤。具有替代鸟嘌呤的示例性核碱基和核苷包括但不限于肌苷(I)、1-甲基-肌苷(m1I)、怀俄苷(wyosine)(imG)、甲基怀俄苷(mimG)、4-去甲基-怀俄苷(imG-14)、异怀俄苷(imG2)、怀丁苷(yW)、过氧怀丁苷(o2yW)、羟基怀丁苷(OHyW)、修饰不足的羟基怀丁苷(OHyW*)、7-脱氮-鸟嘌呤、辫苷(Q)、环氧辫苷(oQ)、半乳糖基-辫苷(galQ)、甘露糖基-辫苷(manQ)、7-氰基-7-脱氮-鸟嘌呤(preQ0)、7-氨基甲基-7-脱氮-鸟嘌呤(preQ1)、古嘌苷(G+)、7-脱氮-8-氮杂-鸟嘌呤、6-硫代-鸟嘌呤、6-硫代-7-脱氮-鸟嘌呤、6-硫代-7-脱氮-8-氮杂-鸟嘌呤、7-甲基-鸟嘌呤(m7G)、6-硫代-7-甲基-鸟嘌呤、7-甲基-肌苷、6-甲氧基-鸟嘌呤、1-甲基-鸟嘌呤(m1G)、N2-甲基-鸟嘌呤(m2G)、N2,N2-二甲基-鸟嘌呤(m22G)、N2,7-二甲基-鸟嘌呤(m2,7G)、N2,N2,7-二甲基-鸟嘌呤(m2,2,7G)、8-氧代基-鸟嘌呤、7-甲基-8-氧代基-鸟嘌呤、1-甲基-6-硫代-鸟嘌呤、N2-甲基-6-硫代-鸟嘌呤、N2,N2-二甲基-6-硫代-鸟嘌呤、N2-甲基-2′-O-甲基-鸟苷(m2Gm)、N2,N2-二甲基-2′-O-甲基-鸟苷(m22Gm)、1-甲基-2′-O-甲基-鸟苷(m1Gm)、N2,7-二甲基-2′-O-甲基-鸟苷(m2,7Gm)、2′-O-甲基-肌苷(Im)、1,2′-O-二甲基-肌苷(m1Im)、1-硫代-鸟嘌呤以及O-6-甲基-鸟嘌呤。
核苷酸的替代核碱基可独立地为嘌呤、嘧啶、嘌呤或嘧啶类似物。在一些实施方案中,核碱基可以是腺嘌呤、胞嘧啶、鸟嘌呤、尿嘧啶或次黄嘌呤的替代物。在另一个实施方案中,核碱基还可包括,例如,碱基的天然存在的和合成的衍生物,包括但不限于吡唑并[3,4-d]嘧啶,5-甲基胞嘧啶(5-me-C),5-羟甲基胞嘧啶,黄嘌呤,次黄嘌呤,2-氨基腺嘌呤,腺嘌呤和鸟嘌呤的6-甲基和其它烷基衍生物,腺嘌呤和鸟嘌呤的2-丙基和其它烷基衍生物,2-硫尿嘧啶,2-硫代胸腺嘧啶和2-硫代胞嘧啶,5-丙炔基尿嘧啶和胞嘧啶,6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶,5-尿嘧啶(假尿嘧啶),4-硫尿嘧啶,8-卤代(例如,8-溴)、8-氨基、8-硫醇、8-硫代烷基、8-羟基和其它8-取代的腺嘌呤和鸟嘌呤,5-卤代基、特别是5-溴、5-三氟甲基和其它5-取代的尿嘧啶和胞嘧啶,7-甲基鸟嘌呤和7-甲基腺嘌呤,8-氮杂鸟嘌呤和8-氮杂腺嘌呤,脱氮鸟嘌呤,7-脱氮鸟嘌呤,3-脱氮鸟嘌呤,脱氮腺嘌呤,7-脱氮腺嘌呤,3-脱氮腺嘌呤,吡唑并[3,4-d]嘧啶,咪唑并[1,5-a]1,3,5三嗪酮,9-脱氮嘌呤,咪唑并[4,5-d]吡嗪,噻唑并[4,5-d]嘧啶,吡嗪-2-酮,1,2,4-三嗪,哒嗪;或1,3,5三嗪。当使用简写A、G、C、T或U描绘核苷酸时,每个字母是指其代表性碱基和/或衍生物,例如,A包括腺嘌呤或腺嘌呤类似物,例如,7-脱氮腺嘌呤)。
糖上的改变
核苷包含与核碱基组合的糖分子(例如,5-碳或6-碳糖,如戊糖、核糖、阿拉伯糖、木糖、葡萄糖、半乳糖或其脱氧衍生物),而核苷酸是含有核苷和磷酸酯基团或替代基团(例如,硼烷磷酸酯、硫代磷酸酯、硒代磷酸酯、膦酸酯、烷基、酰胺化物和甘油)的核苷。核苷或核苷酸可以是规范物质,例如,包含规范核碱基、糖并且在核苷酸的情况下磷酸酯基团的核苷或核苷酸,或者可以是包含一种或多种替代组分的替代核苷或核苷酸。在一些实施方案中,可在核苷或核苷酸的糖上改变替代核苷和核苷酸。在一些实施方案中,替代核苷或核苷酸包括以下结构:
在式IV、V、VI和VII中的每一者中,
m和n中的每一者独立地是0至5的整数,
U和U’中的每一者独立地是O、S、N(R
R
Y
每个Y
每个Y
B是修饰的或未修饰的核碱基。
在一些实施方案中,2'-羟基(OH)可用许多不同的取代基修饰或置换。2’-位置处的示例性取代包括但不限于H、叠氮基、卤代基(例如,氟)、任选取代的C
一般来说,RNA包括糖基核糖,所述糖基核糖是具有氧的5元环。示例性、非限制性的替代核苷酸包括核糖中的氧的置换(例如,用S、Se或亚烷基如亚甲基或亚乙基置换);添加双键(例如,以便用环戊烯基或环己烯基置换核糖);核糖的环缩反应(例如,以便形成环丁烷或环氧丙烷的4元环);核糖的扩环反应(例如,以便形成具有额外碳或杂原子的(也具有氨基磷酸酯主链)的6元或7元环,如对于失水己糖醇、阿卓糖醇、甘露醇、环己烷基、环己烯基以及吗啉代来说);多环形式(例如,三环;以及“非锁定”形式,如乙二醇核酸(GNA)(例如,R-GNA或S-GNA,其中核糖被连接至磷酸二酯键的乙二醇单元置换)、苏糖核酸(TNA,其中核糖被α-L-苏型呋喃糖基-(3'→2')置换),和肽核酸(PNA,其中2-氨基-乙基-甘氨酸键联置换核糖和磷酸二酯主链)。
在一些实施方案中,糖基团含有一个或多个具有与核糖中的相应碳的立体化学构型相反的立体化学构型的碳。因此,多核苷酸分子可包含含有例如阿拉伯糖或L-核糖作为糖的核苷酸。
在一些实施方案中,多核苷酸包含至少一个核苷,其中糖是L-核糖、2'-O-甲基-核糖、2'-氟-核糖、阿拉伯糖、己糖醇、LNA或PNA。
核苷间键联上的改变
可在核苷间键联(例如,磷酸酯主链)上改变替代核苷酸。在本文中,在多核苷酸主链的背景下,短语“磷酸酯”和“磷酸二酯”可互换使用。主链磷酸酯基团可通过用不同的取代基置换一个或多个氧原子来改变。
替代核苷酸可包括用如本文所描述的另一种核苷间键联全部置换未改变的磷酸酯部分。替代磷酸酯基团的实例包括但不限于,硫代磷酸酯、硒代磷酸酯、硼烷磷酸酯(boranophosphate)、硼烷磷酸酯(boranophosphate ester)、氢膦酸酯、氨基磷酸酯、二氨基磷酸酯、烷基或芳基膦酸酯以及磷酸三酯。二硫代磷酸酯具有的两个非连接的氧均被硫置换。磷酸酯接头还可通过用氮(桥联氨基磷酸酯)、硫(桥联硫代磷酸酯)和碳(桥联亚甲基-膦酸酯)置换连接的氧来修饰。
替代核苷和核苷酸可包括用硼烷部分(BH
通过非天然硫代磷酸酯主链键联,提供在磷酸酯部分的α位置(例如,α-硫代磷酸酯)处的一个或多个氧原子的置换,以赋予RNA和DNA稳定性(如针对核酸外切酶和核酸内切酶)。硫代磷酸酯DNA和RNA具有增加的核酸酶抗性并且因此在细胞环境中具有更长的半衰期。
本文描述了可根据本公开采用的其它核苷间键联,包括不含磷原子的核苷间键联。
内部核糖体进入位点
多核苷酸可含有内部核糖体进入位点(IRES)。IRES可用作唯一核糖体结合位点或可用作mRNA的多个核糖体结合位点之一。含有多于一个功能性核糖体结合位点的多核苷酸可编码独立地通过核糖体翻译的几种肽或多肽(例如,多顺反子mRNA)。当多核苷酸具有IRES时,进一步任选地提供第二可翻译区。可根据本公开使用的IRES序列的实例包括但不限于来自以下病毒的那些:细小核糖核酸病毒(例如FMDV)、害虫病毒(CFFV)、脊髓灰质炎病毒(PV)、脑心肌炎病毒(ECMV)、口蹄疫病毒(FMDV)、丙型肝炎病毒(HCV)、典型猪瘟病毒(CSFV)、鼠白血病病毒(MLV)、猿猴免疫缺陷病毒(SIV)或蟋蟀麻痹病毒(CrPV)。
5’-帽结构
多核苷酸(例如,mRNA)可包含5'-帽结构。多核苷酸的5’-帽结构参与核输出以及增加多核苷酸稳定性,并且结合mRNA帽结合蛋白(CBP),所述mRNA帽结合蛋白通过CBP与poly-A结合蛋白缔合以形成成熟的环状mRNA物质来负责细胞中的多核苷酸稳定性和翻译能力。所述帽在mRNA剪接过程中进一步帮助去除5’-近端内含子。
内源性多核苷酸分子可以是5'-端加帽的,从而在末端鸟苷帽残基与多核苷酸的5'-末端转录的有义核苷酸之间产生5'-ppp-5'-三磷酸酯键联。这种5’-鸟苷酸帽然后可被甲基化以产生N7-甲基-鸟苷酸残基。多核苷酸的5'端的末端和/或前末端转录的核苷酸的核糖也可任选地2'-O-甲基化。通过鸟苷酸帽结构的水解和裂解进行的5'-脱帽可靶向降解的多核苷酸分子,如mRNA分子。
对多核苷酸的改变可产生不可水解的帽结构,从而防止脱帽并因此增加多核苷酸半衰期。因为帽结构水解要求5’-ppp-5’磷酸二酯键联的裂解,所以可在加帽反应过程中使用替代核苷酸。在一些实施方案中,来自New England Biolabs(Ipswich,MA)的牛痘加帽酶可根据制造商的说明书与α-硫代-鸟苷核苷酸一起使用以便在5’-ppp-5’帽中形成硫代磷酸酯键联。可使用另外的替代鸟苷核苷酸,如α-甲基-膦酸酯和硒代-磷酸酯核苷酸。
另外的改变包括但不限于多核苷酸(如上所述)在糖的2’-羟基上的5’-末端和/或5’-前末端核苷酸的核糖的2’-O-甲基化。多种不同的5'-帽结构可用于产生多核苷酸如mRNA分子的5'-帽。
5'-帽结构包括在国际专利公布号WO2008127688、WO2008016473和WO 2011015347中描述的那些,所述专利公布中的每一个的帽结构均以引用的方式并入本文。
帽类似物,在本文还被称为合成帽类似物、化学帽、化学帽类似物或结构或功能帽类似物,在其化学结构上与天然(即内源性、野生型或生理的)5’-帽不同,同时保留帽功能。帽类似物可以是化学(即非酶)或酶合成的并且/连接至多核苷酸。
例如,抗-反向帽类似物(ARCA)帽含有通过5'-5'-三磷酸酯基团连接的两个鸟苷,其中一个鸟苷包含N7-甲基以及3'-O-甲基(即,N7,3'-O-二甲基-鸟苷-5'-三磷酸酯-5'-鸟苷,m
另一种示例性帽是mCAP,其与ARCA类似但在鸟苷上具有2'-O-甲基(即N7,2'-O-二甲基-鸟苷-5'-三磷酸酯-5'-鸟苷,m
帽可以是二核苷酸帽类似物。作为非限制性实例,二核苷酸帽类似物可在不同磷酸酯位置处用硼烷磷酸酯基团或硒代磷酸酯基团修饰,如在美国专利号8,519,110中描述的二核苷酸帽类似物,所述专利的帽结构以引用的方式并入本文。
或者,帽类似物可以是本领域中已知和/或本文描述的N7-(4-氯苯氧基乙基)取代的二核苷酸帽类似物。N7-(4-氯苯氧基乙基)取代的二核苷酸帽类似物的非限制性实例包括N7-(4-氯苯氧基乙基)-G(5’)ppp(5’)G和N7-(4-氯苯氧基乙基)-m3'-OG(5')ppp(5')G帽类似物(参见例如,在Kore等人Bioorganic&Medicinal Chemistry 201321:4570-4574中描述的各种帽类似物和合成帽类似物的方法;所述文献的帽结构以引用的方式并入本文)。在其他实例中,可用于本公开的多核苷酸中的帽类似物是4-氯/溴苯氧基乙基类似物。
虽然帽类似物允许多核苷酸在体外转录反应中的伴随加帽,但高达20%的转录物可仍保持未加帽。这种情况以及帽类似物与通过内源性细胞转录机器产生的多核苷酸的内源性5’-帽结构的结构差异可导致降低的翻译能力和降低的细胞稳定性。
替代多核苷酸还可在转录后使用酶加帽,以产生更真实的5'-帽结构。如本文所用,短语“更真实的”是指在结构或功能上接近地反映或模拟内源性或野生型特征的特征。也就是说,“更真实的”特征是与现有技术的合成特征或类似物相比,内源性、野生型、天然或生理细胞功能和/或结构的更好表示,或在一个或多个方面胜过对应的内源性、野生型、天然或生理特征的特征。可用于本公开的多核苷酸中的更真实的5’-帽结构的非限制性实例是与本领域已知的合成5’-帽结构(或与野生型、天然或生理5’-帽结构)相比,除其他事项之外具有帽结合蛋白的增强的结合、增加的半衰期、对5’-内切核酸酶减少的敏感性和/或减少的5’-脱帽的那些。在一些实施方案中,重组牛痘病毒加帽酶和重组2’-O-甲基转移酶可在多核苷酸的5’-末端核苷酸与鸟苷帽核苷酸之间形成规范的5’-5’-三磷酸酯键联,其中所述帽鸟苷含有N7甲基化并且多核苷酸的5’-末端核苷酸含有2’-O-甲基。这种结构被称为帽1结构。与例如本领域中已知的其他5'帽类似物结构相比,这种帽产生更高的翻译能力、细胞稳定性和减少的细胞促炎性细胞因子的活化。其他示例性帽结构包括7mG(5′)ppp(5′)N,pN2p(帽0)、7mG(5′)ppp(5′)NlmpNp(帽1)、7mG(5′)-ppp(5′)NlmpN2mp(帽2)和m(7)Gpppm(3)(6,6,2′)Apm(2′)Apm(2′)Cpm(2)(3,2′)Up(帽4)。
因为替代多核苷酸可在转录后加帽,并且因为这种方法是更有效的,所以接近100%的替代多核苷酸可被加帽。这与在体外转录反应过程中帽类似物被连接至多核苷酸时的约80%形成对比。
5’-末端帽可包括内源性帽或帽类似物。5’-末端帽可包括鸟苷类似物。有用的鸟苷类似物包括肌苷、N1-甲基-鸟苷、2'-氟-鸟苷、7-脱氮-鸟苷、8-氧代基-鸟苷、2-氨基-鸟苷、LNA-鸟苷和2-叠氮基-鸟苷。
在一些情况下,多核苷酸含有经修饰的5'-帽。5'-帽上的修饰可增加多核苷酸的稳定性,增加多核苷酸的半衰期,并且可提高多核苷酸翻译效率。经修饰的5'-帽可包括但不限于以下修饰中的一种或多种:在加帽的鸟苷三磷酸(GTP)的2'-和/或3'-位置的修饰、用亚甲基部分(CH2)置换糖环氧(产生碳环的糖环氧)、帽结构的三磷酸酯桥部分的修饰或核碱基(G)部分的修饰。
5’-UTR
可提供5’-UTR作为多核苷酸(例如,mRNA)的侧翼区。5’-UTR可与多核苷酸中发现的编码区同源或异源。多个5’-UTR可包含于侧翼区中并且可以是相同的或具有不同的序列。侧翼区的任何部分(包括没有)可为密码子优化的,并且任何一个可在密码子优化之前和/或之后独立地含有一种或多种不同的结构或化学改变。
美国临时申请号61/775,509中的表21和美国临时申请号61/829,372中的表21和表22中示出了替代多核苷酸(例如,mRNA)的起始和终止位点的列表,所述临时申请以引用的方式并入本文。在表21中,每个5'-UTR(5'-UTR-005至5'-UTR 68511)通过其起始和终止位点相对于其天然或野生型(同源)转录物(ENST;ENSEMBL数据库中使用的标识符)来鉴定。
为了改变多核苷酸(例如,mRNA)的一种或多种性质,可工程化与替代多核苷酸(例如,mRNA)的编码区异源的5'-UTR。然后可将多核苷酸(例如,mRNA)施用于细胞、组织或生物体,并且可测量诸如蛋白质水平、定位和/或半衰期的结果,以评估异源5'-UTR可对替代多核苷酸(mRNA)具有的有益作用。可利用5'-UTR的变体,其中一个或多个核苷酸被添加或移除至末端,包括A、T、C或G。5'-UTR也可被密码子优化或以本文描述的任何方式改变。
5'-UTR、3'-UTR和翻译增强子元件(TEE)
多核苷酸(例如,mRNA)的5'-UTR可包含至少一个翻译增强子元件。术语“翻译增强子元件”是指增加由多核苷酸产生的多肽或蛋白质的量的序列。作为非限制性实例,TEE可位于转录启动子与起始密码子之间。在5'-UTR中具有至少一个TEE的多核苷酸(例如,mRNA)可在5'-UTR处包含帽。此外,至少一个TEE可位于经历帽依赖性或帽非依赖性翻译的多核苷酸(例如,mRNA)的5'-UTR中。
在一方面,TEE是UTR中的保守元件,其可促进多核苷酸的翻译活性,如但不限于帽依赖性或帽非依赖性翻译。Panek等人(Nucleic Acids Research,2013,1-10)先前已经跨包括人的14种物种示出了这些序列的保守性。
在一个非限制性实例中,已知的TEE可位于Gtx同源结构域蛋白的5'-前导序列中(Chappell et al.,Proc.Natl.Acad.Sci.USA 101:9590-9594,2004,所述文献的TEE以引用的方式并入本文)。
在另一个非限制性实例中,TEE公开于美国专利公布号2009/0226470和2013/0177581、国际专利公布号WO2009/075886、WO2012/009644和WO1999/024595、美国专利号6,310,197和6,849,405中,所述专利各自的TEE序列以引用的方式并入本文。
在又一个非限制性实例中,TEE可以是内部核糖体进入位点(IRES)、HCV-IRES或IRES元件,如但不限于美国专利号7,468,275、美国专利公布号2007/0048776和2011/0124100以及国际专利公布号WO2007/025008和WO2001/055369中描述的那些,所述专利各自的IRES序列以引用的方式并入本文。IRES元件可包括但不限于由Chappell等人(Proc.Natl.Acad.Sci.USA 101:9590-9594,2004)和Zhou等人(PNAS 102:6273-6278,2005)以及美国专利公布号2007/0048776和2011/0124100和国际专利公布号WO2007/025008中描述的Gtx序列(例如,Gtx9-nt、Gtx8-nt、Gtx7-nt),其各自的IRES序列以引用的方式并入本文。
“翻译增强子多核苷酸”是包含本文例示和/或本领域中公开的一种或多种特异性TEE的多核苷酸(参见例如美国专利号6,310,197、6,849,405、7,456,273、7,183,395,美国专利公布号20090/226470、2007/0048776、2011/0124100、2009/0093049、2013/0177581,国际专利公布号WO2009/075886、WO2007/025008、WO2012/009644、WO2001/055371、WO1999/024595,以及欧洲专利号2610341和2610340;其各自的TEE序列以引用的方式并入本文)或其变体、同源物或功能衍生物。特异性TEE的一个或多个拷贝可存在于多核苷酸(例如,mRNA)中。翻译增强子多核苷酸中的TEE可组构在一个或多个序列区段中。序列区段可拥有本文例示的一种或多种特异性TEE,每种TEE以一个或多个拷贝存在。当多个序列区段存在于翻译增强子多核苷酸中时,它们可以是同源的或异质的。因此,翻译增强子多核苷酸中的多个序列区段可拥有相同或不同类型的本文提供的TEE、每个TEE的相同或不同数量的拷贝和/或每个序列区段内TEE的相同或不同组构。
多核苷酸(例如,mRNA)可包含在国际专利公布号WO1999/024595、WO2012/009644、WO2009/075886、WO2007/025008、WO1999/024595,欧洲专利公布号2610341和2610340,美国专利号6,310,197、6,849,405、7,456,273、7,183,395以及美国专利公布号2009/0226470、2011/0124100、2007/0048776、2009/0093049和2013/0177581中描述的至少一种TEE,所述专利各自的TEE序列以引用的方式并入本文。TEE可位于多核苷酸(例如,mRNA)的5'-UTR中。
多核苷酸(例如,mRNA)可包含至少一种TEE,所述TEE与美国专利公布号2009/0226470、2007/0048776、2013/0177581和2011/0124100,国际专利公布号WO1999/024595、WO2012/009644、WO2009/075886和WO2007/025008,欧洲专利公布号2610341和2610340,美国专利号6,310,197、6,849,405、7,456,273、7,183,395中描述的TEE具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%同一性,所述专利各自的TEE序列以引用的方式并入本文。
多核苷酸(例如,mRNA)的5'-UTR可包含至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少30、至少35、至少40、至少45、至少50、至少55或超过60个TEE序列。多核苷酸(例如,mRNA)的5'-UTR中的TEE序列可以是相同或不同的TEE序列。TEE序列可呈重复一次、两次、三次或多于三次的诸如ABABAB、AABBAABBAABB或ABCABCABC的图案或其变体形式。在这些图案中,每个字母A、B或C表示在核苷酸层次上的不同TEE序列。
在一些情况下,5'-UTR可包含用于分隔两个TEE序列的间隔区。作为非限制性实例,间隔区可以是15个核苷酸的间隔区和/或本领域中已知的其他间隔区。作为另一个非限制性示例,5'-UTR可包含在5'-UTR中重复至少一次、至少两次、至少3次、至少4次、至少5次、至少6次、至少7次、至少8次、至少9次或超过9次的TEE序列-间隔区模块。
在其他实例中,分隔两个TEE序列的间隔区可包含本领域已知的可调控本公开的多核苷酸(例如,mRNA)的翻译的其他序列,如但不限于miR序列(例如,miR结合位点和miR种子)。作为非限制性实例,用于分隔两个TEE序列的每个间隔区可包含不同的miR序列或miR序列的组分(例如,miR种子序列)。
在一些实例中,多核苷酸(例如,mRNA)的5'-UTR中的TEE可包含美国专利公布号2009/0226470、2007/0048776、2013/0177581和2011/0124100,国际专利公布号WO1999/024595、WO2012/009644、WO2009/075886和WO2007/025008,欧洲专利公布号2610341和2610340以及美国专利号6,310,197、6,849,405、7,456,273、7,183,395中公开的TEE序列的至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%或超过99%,所述专利各自的TEE序列以引用的方式并入本文。在另一个实施方案中,本公开的多核苷酸(例如,mRNA)的5'-UTR中的TEE可包含在美国专利公布号2009/0226470、2007/0048776、2013/0177581和2011/0124100,国际专利公布号WO1999/024595、WO2012/009644、WO2009/075886和WO2007/025008,欧洲专利公布号2610341和2610340以及美国专利号6,310,197、6,849,405、7,456,273和7,183,395中公开的TEE序列的5-30个核苷酸片段、5-25个核苷酸片段、5-20个核苷酸片段、5-15个核苷酸片段、5-10个核苷酸片段;所述专利各自的TEE序列以引用的方式并入本文。
在一些情况下,本公开的多核苷酸(例如,mRNA)的5'-UTR中的TEE可包含在Chappell等人(Proc.Natl.Acad.Sci.USA 101:9590-9594,2004)和Zhou等人(PNAS 102:6273-6278,2005)中、在由Wellensiek等人(Genome-wide profiling of human cap-independent translation-enhancing elements,Nature Methods,2013;DOI:10.1038/NMETH.2522)公开的补充表1和补充表2中公开的TEE序列的至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少99%或超过99%;所述文献各自的TEE序列以引用的方式并入本文。在另一个实施方案中,本公开的多核苷酸(例如,mRNA)的5'-UTR中的TEE可包含在Chappell等人(Proc.Natl.Acad.Sci.USA 101:9590-9594,2004)和Zhou等人(PNAS 102:6273-6278,2005)中、在由Wellensiek等人(Genome-wide profiling of human cap-independenttranslation-enhancing elements,Nature Methods,2013;DOI:10.1038/NMETH.2522)公开的补充表1和补充表2中公开的TEE序列的5-30个核苷酸片段、5-25个核苷酸片段、5-20个核苷酸片段、5-15个核苷酸片段、5-10个核苷酸片段;所述文献各自的TEE序列以引用的方式并入本文。
在一些情况下,在多核苷酸(例如,mRNA)的5'-UTR中使用的TEE是IRES序列,如但不限于美国专利号7,468,275和国际专利公布号WO2001/055369中描述的那些,所述专利各自的TEE序列以引用的方式并入本文。
在一些实例中,可通过美国专利公布号2007/0048776和2011/0124100以及国际专利公布号WO2007/025008和WO2012/009644中描述的方法来鉴定在多核苷酸(例如,mRNA)的5'-UTR中使用的TEE,所述专利各自的方法以引用的方式并入本文。
在一些情况下,本公开的多核苷酸(例如,mRNA)的5'-UTR中使用的TEE可以是美国专利号7,456,273和7,183,395、美国专利公布号2009/0093049和国际公布号WO2001/055371中描述转录调控元件,所述专利各自的TEE序列以引用的方式并入本文。转录调控元件可通过本领域已知的方法来鉴定,所述方法如但不限于美国专利号7,456,273和7,183,395、美国专利公布号2009/0093049和国际公布号WO2001/055371中描述的方法,所述专利各自的方法以引用的方式并入本文。
在其他实例中,多核苷酸(例如,mRNA)的5'-UTR中使用的TEE是多核苷酸或其部分,如美国专利号7,456,273和7,183,395、美国专利公布号2009/0093049和国际公布号WO2001/055371中所描述,所述专利各自的TEE序列以引用的方式并入本文。
可将包含至少一种本文所述的TEE的5'-UTR并入单顺反子序列,如但不限于载体系统或多核苷酸载体中。作为非限制性实例,载体系统和多核苷酸载体可包括在美国专利号7,456,273和7,183,395、美国专利公布号2007/0048776、2009/0093049和2011/0124100以及国际专利公布号WO2007/025008和WO2001/055371中描述的那些,所述专利各自的TEE序列以引用的方式并入本文。
本文所述的TEE可位于多核苷酸(例如,mRNA)的5'-UTR和/或3'-UTR中。位于3'-UTR中的TEE可与位于5'-UTR中和/或描述用于并入5'-UTR中的TEE相同和/或不同。
在一些情况下,多核苷酸(例如,mRNA)的3'-UTR可包含至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少30、至少35、至少40、至少45、至少50、至少55或超过60个TEE序列。本公开的多核苷酸(例如,mRNA)的3'-UTR中的TEE序列可以是相同或不同的TEE序列。TEE序列可呈重复一次、两次、三次或多于三次的诸如ABABAB、AABBAABBAABB或ABCABCABC的图案或其变体形式。在这些图案中,每个字母A、B或C表示在核苷酸层次上的不同TEE序列。
在一个实例中,3'-UTR可包含用于分隔两个TEE序列的间隔区。作为非限制性实例,间隔区可以是15个核苷酸的间隔区和/或本领域中已知的其他间隔区。作为另一个非限制性示例,3'-UTR可包含在3'-UTR中重复至少一次、至少两次、至少3次、至少4次、至少5次、至少6次、至少7次、至少8次、至少9次或超过9次的TEE序列-间隔区模块。
在其他情况下,分隔两个TEE序列的间隔区可包含本领域已知的可调控本公开的多核苷酸(例如,mRNA)的翻译的其他序列,如但不限于本文描述的miR序列(例如,miR结合位点和miR种子)。作为非限制性实例,用于分隔两个TEE序列的每个间隔区可包含不同的miR序列或miR序列的组分(例如,miR种子序列)。
在一些实施方案中,本公开的多核糖核苷酸包含miR和/或TEE序列。在一些实施方案中,将miR序列和/或TEE序列并入本公开的多核糖核苷酸中可改变茎环区的形状,这可增加和/或减少翻译。参见例如,Kedde等人,Nature Cell Biology 2010 12(10):1014-20,其以引用的方式整体并入本文)。
传感器序列和微小RNA(miRNA)结合位点
传感器序列包含例如,微小RNA(miRNA)结合位点、转录因子结合位点、结构化mRNA序列和/或基序、工程化以充当内源核酸结合分子的假受体的人工结合位点以及它们的组合。传感器序列的非限制性实例描述于美国公布2014/0200261中,其内容以引用的方式整体并入本文。
在一些实施方案中,本公开的包含编码多肽的开放阅读框(ORF)的多核糖核苷酸(例如,核糖核酸(RNA),例如信使RNA(mRNA))还包含传感器序列。在一些实施方案中,传感器序列是miRNA结合位点。
miRNA是19-25个核苷酸长的非编码RNA,其结合至多核糖核苷酸并通过降低稳定性或通过抑制多核糖核苷酸的翻译来下调基因表达。miRNA序列包含“种子”区域,即成熟miRNA的位置2-8的区域中的序列。miRNA种子可包含成熟miRNA的位置2-8或2-7。在一些实施方案中,miRNA种子可包含7个核苷酸(例如,成熟miRNA的核苷酸2-8),其中相应miRNA结合位点中的种子互补位点侧接与miRNA位置1相反的腺苷(A)。在一些实施方案中,miRNA种子可包含6个核苷酸(例如成熟miRNA的核苷酸2-7),其中相应miRNA结合位点中的种子互补位点侧接与miRNA位置1相反的腺苷(A)。参见例如,Grimson A,Farh KK,Johnston WK,Garrett-Engele P,Lim LP,Bartel DP;Mol Cell.2007年7月6日;27(1):91-105。可进行靶细胞或组织的miRNA谱分析,以确定细胞或组织中是否存在miRNA。在一些实施方案中,本公开的多核糖核苷酸(例如,核糖核酸(RNA),例如信使RNA(mRNA))包含一个或多个微小RNA靶序列、微小RNA序列或微小RNA种子。此类序列可对应于任何已知的微小RNA,如美国公布US2005/0261218和美国公布US2005/0059005中所教导的那些,所述公布各自的内容以引用的方式整体并入本文。
如本文所用,术语“微小RNA(miRNA或miR)结合位点”是指多核糖核苷酸内(例如DNA内或RNA转录物内)的序列,包括5'UTR和/或3'UTR中的序列,所述序列对miRNA的全部或区域具有足够的互补性以与所述miRNA相互作用、缔合或结合至所述miRNA。在一些实施方案中,本公开的包含编码多肽的ORF的多核糖核苷酸还包含miRNA结合位点。在示例性实施方案中,多核糖核苷酸(例如,核糖核酸(RNA),例如信使RNA(mRNA))的5'UTR和/或3'UTR包含miRNA结合位点。
与miRNA具有足够互补性的miRNA结合位点是指互补性程度足以促进miRNA介导的多核糖核苷酸调控(例如miRNA介导的多核糖核苷酸的翻译阻遏或降解)。在本公开的示例性方面,与miRNA具有足够互补性的miRNA结合位点是指互补性程度足以促进miRNA介导的多核糖核苷酸降解(例如miRNA引导的RNA诱导的沉默复合物(RISC)介导的mRNA裂解)。miRNA结合位点可与例如19-25个核苷酸的miRNA序列、19-23个核苷酸的miRNA序列或22个核苷酸的miRNA序列具有互补性。miRNA结合位点可与miRNA的仅一部分互补,例如与天然存在的miRNA序列的全长的少于1、2、3或4个核苷酸的部分互补。当所需的调控是mRNA降解时,优选完整或完全互补性(例如,天然存在的miRNA的长度的全部或显著部分上的完整互补性或完全互补性)。
在一些实施方案中,miRNA结合位点包括与miRNA种子序列具有互补性(例如,部分或完全互补性)的序列。在一些实施方案中,miRNA结合位点包括与miRNA种子序列具有完全互补性的序列。在一些实施方案中,miRNA结合位点包括与miRNA序列具有互补性(例如,部分或完全互补性)的序列。在一些实施方案中,miRNA结合位点包括与miRNA序列具有完全互补性的序列。在一些实施方案中,miRNA结合位点与miRNA序列具有完全互补性,但具有1、2或3个核苷酸取代、末端添加和/或截短。
在一些实施方案中,miRNA结合位点与相应的miRNA的长度相同。在一些实施方案中,miRNA结合位点比5'末端、3'末端或两者处的相应miRNA短一个、两个、三个、四个、五个、六个、七个、八个、九个、十个、十一个或十二个核苷酸。在其他实施方案中,微小RNA结合位点比5'末端、3'末端或两者处的相应微小RNA短两个核苷酸。比相应miRNA短的miRNA结合位点仍然能够降解并入一个或多个miRNA结合位点的mRNA或阻止所述mRNA翻译。
在一些实施方案中,miRNA结合位点结合至相应的成熟miRNA,其是含有Dicer的活性RISC的一部分。在另一个实施方案中,miRNA结合位点与RISC中的相应miRNA的结合降解含有所述miRNA结合位点的mRNA或阻止所述mRNA被翻译。在一些实施方案中,miRNA结合位点与miRNA具有足够互补性,以使得包含所述miRNA的RISC复合物裂解包含所述miRNA结合位点的多核糖核苷酸。在一些实施方案中,miRNA结合位点具有不完全互补性,以使得包含所述miRNA的RISC复合物诱导包含所述miRNA结合位点的多核糖核苷酸中的不稳定性。在另一个实施方案中,miRNA结合位点具有不完全互补性,以使得包含所述miRNA的RISC复合物阻遏包含所述miRNA结合位点的多核糖核苷酸的转录。
在一些实施方案中,miRNA结合位点具有来自相应miRNA的一个、两个、三个、四个、五个、六个、七个、八个、九个、十个、十一个或十二个错配。
在一些实施方案中,miRNA结合位点具有分别与相应miRNA的至少约十个、至少约十一个、至少约十二个、至少约十三个、至少约十四个、至少约十五个、至少约十六个、至少约十七个、至少约十八个、至少约十九个、至少约二十个或至少约二十一个连续核苷酸互补的至少约十个、至少约十一个、至少约十二个、至少约十三个、至少约十四个、至少约十五个、至少约十六个、至少约十七个、至少约十八个、至少约十九个、至少约二十个或至少约二十一个连续核苷酸。
通过将一个或多个miRNA结合位点工程化到本公开的多核糖核苷酸中,所述多核糖核苷酸可被靶向以获得降解或降低的翻译,条件是可获得所论述的miRNA。这可减少递送多核糖核苷酸时的脱靶效应。在一些实施方案中,如果本公开的多核糖核苷酸不意图被递送至组织或细胞但在所述组织或细胞中结束,则在将miRNA的一个或多个结合位点工程化到多核糖核苷酸的5'UTR和/或3'UTR中的情况下,在所述组织或细胞中丰富的miRNA可抑制目标基因的表达。
相反,可从它们所天然存在的多核糖核苷酸序列中除去miRNA结合位点,以增加特定组织中的蛋白质表达。在一些实施方案中,可从多核糖核苷酸中除去特定miRNA的结合位点,以改进含有所述miRNA的组织或细胞中的蛋白质表达。
在一些实施方案中,本公开的多核糖核苷酸可在5'UTR和/或3'UTR中包含至少一个miRNA结合位点,以指导针对特定细胞如但不限于正常细胞和/或癌细胞的细胞毒性或细胞保护性mRNA治疗剂。在另一个实施方案中,本公开的多核糖核苷酸可在5'-UTR和/或3'-UTR中包含两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个miRNA结合位点,以指导针对特定细胞如但不限于正常细胞和/或癌细胞的细胞毒性或细胞保护性mRNA治疗剂。
多种组织中的表达的调控可通过引入或去除一个或多个miRNA结合位点来实现。是除去还是插入miRNA结合位点的决定可基于miRNA表达模式和/或它们在疾病中的分布来进行。已经报告了miRNA、miRNA结合位点及其表达模式和在生物学中的作用的鉴定(例如,Bonauer等人,Curr Drug Targets 2010 11:943-949;Anand和Cheresh Curr OpinHematol 2011 18:171-176;Contreras和Rao Leukemia2012 26:404-413(2011年12月20日.doi:10.1038/leu.2011.356);Bartel Cell 2009 136:215-233;Landgraf等人,Cell,2007 129:1401-1414;Gentner和Naldini,Tissue Antigens.2012 80:393-403以及其中的所有参考文献;其各自以引用的方式整体并入本文)。
miRNA和miRNA结合位点可对应于任何已知序列,包括美国公布号2014/0200261、2005/0261218和2005/0059005中描述的非限制性实例,所述公布各自以引用的方式整体并入本文。
已知miRNA在其中调控mRNA并因此调控蛋白质表达的组织的实例包括但不限于,肝(miR-122)、肌肉(miR-133、miR-206、miR-208)、内皮细胞(miR-17-92、miR-126)、骨髓细胞(miR-142-3p、miR-142-5p、miR-16、miR-21、miR-223、miR-24、miR-27)、脂肪组织(let-7、miR-30c)、心脏(miR-1d、miR-149)、肾(miR-192、miR-194、miR-204)以及肺上皮细胞(let-7、miR-133、miR-126)。
具体地,已知miRNA在免疫细胞(也称为造血细胞),如抗原呈递细胞(APC)(例如,树突细胞和巨噬细胞)、巨噬细胞、单核细胞、B淋巴细胞、T淋巴细胞、粒细胞、自然杀伤细胞等中差异表达。免疫细胞特异性miRNA涉及免疫原性、自身免疫性、对感染的免疫应答、炎症以及基因治疗和组织/器官移植后的不想要的免疫应答。免疫细胞特异性miRNA还调控造血细胞(免疫细胞)的发育、增殖、分化和凋亡的许多方面。在一些实施方案中,miR-142和miR-146仅在免疫细胞中表达,特别是在骨髓树突细胞中丰富。已经证明,通过将miR-142结合位点添加至多核苷酸的3'-UTR,可关闭对多核苷酸的免疫应答,从而使组织和细胞中的基因转移能够更稳定。miR-142有效降解抗原呈递细胞中的外源性多核糖核苷酸并遏制转导的细胞的细胞毒性消除(例如,Annoni A等人,blood,2009,114,5152-5161;Brown BD,等人,Nat med.2006,12(5),585-591;Brown BD,等人,blood,2007,110(13):4144-4152,其各自以引用的方式整体并入本文)。
抗原介导的免疫应答可指由外来抗原触发的免疫应答,所述外来抗原在进入生物体时由抗原呈递细胞加工并展示在抗原呈递细胞的表面上。T细胞可识别呈递的抗原并诱导表达抗原的细胞的细胞毒性消除。
将miR-142结合位点引入本公开的多核糖核苷酸的5'UTR和/或3'UTR中可通过miR-142介导的降解选择性地阻遏抗原呈递细胞中的基因表达,从而限制抗原呈递细胞(例如,树突细胞)中的抗原呈递,并且由此在递送所述多核糖核苷酸后防止抗原介导的免疫应答。所述多核苷酸然后在靶组织或细胞中稳定地表达,而不触发细胞毒性消除。
在一些实施方案中,已知在免疫细胞、特别是抗原呈递细胞中表达的miRNA的结合位点可被工程化到本公开的多核糖核苷酸中以通过miRNA介导的RNA降解遏制所述多核糖核苷酸在抗原呈递细胞中的表达,从而抑制抗原介导的免疫应答。多核糖核苷酸的表达在不表达免疫细胞特异性miRNA的非免疫细胞中维持。在一些实施方案中,为了防止针对肝特异性蛋白的免疫原性反应,可除去任何miR-122结合位点并且可将miR-142(和/或mirR-146)结合位点工程化到本公开的多核糖核苷酸的5'UTR和/或3'UTR中。
为了进一步推动APC和巨噬细胞中的选择性降解和遏制,本公开的多核糖核苷酸可在5'UTR和/或3'UTR中包含单独或与miR-142和/或miR-146结合位点组合的另外负调控元件。作为非限制性实例,其他负调控元件是组成型衰变元件(CDE)。
免疫细胞特异性miRNA包括但不限于hsa-let-7a-2-3p、hsa-let-7a-3p、hsa-7a-5p、hsa-let-7c、hsa-let-7e-3p、hsa-let-7e-5p、hsa-let-7g-3p、hsa-let-7g-5p、hsa-let-7i-3p、hsa-let-7i-5p、miR-10a-3p、miR-10a-5p、miR-1184、hsa-let-7f-1--3p、hsa-let-7f-2--5p、hsa-let-7f-5p、miR-125b-1-3p、miR-125b-2-3p、miR-125b-5p、miR-1279、miR-130a-3p、miR-130a-5p、miR-132-3p、miR-132-5p、miR-142-3p、miR-142-5p、miR-143-3p、miR-143-5p、miR-146a-3p、miR-146a-5p、miR-146b-3p、miR-146b-5p、miR-147a、miR-147b、miR-148a-5p、miR-148a-3p、miR-150-3p、miR-150-5p、miR-151b、miR-155-3p、miR-155-5p、miR-15a-3p、miR-15a-5p、miR-15b-5p、miR-15b-3p、miR-16-1-3p、miR-16-2-3p、miR-16-5p、miR-17-5p、miR-181a-3p、miR-181a-5p、miR-181a-2-3p、miR-182-3p、miR-182-5p、miR-197-3p、miR-197-5p、miR-21-5p、miR-21-3p、miR-214-3p、miR-214-5p、miR-223-3p、miR-223-5p、miR-221-3p、miR-221-5p、miR-23b-3p、miR-23b-5p、miR-24-1-5p、miR-24-2-5p、miR-24-3p、miR-26a-1-3p、miR-26a-2-3p、miR-26a-5p、miR-26b-3p、miR-26b-5p、miR-27a-3p、miR-27a-5p、miR-27b-3p、miR-27b-5p、miR-28-3p、miR-28-5p、miR-2909、miR-29a-3p、miR-29a-5p、miR-29b-1-5p、miR-29b-2-5p、miR-29c-3p、miR-29c-5p、miR-30e-3p、miR-30e-5p、miR-331-5p、miR-339-3p、miR-339-5p、miR-345-3p、miR-345-5p、miR-346、miR-34a-3p、miR-34a-5p、miR-363-3p、miR-363-5p、miR-372、miR-377-3p、miR-377-5p、miR-493-3p、miR-493-5p、miR-542、miR-548b-5p、miR548c-5p、miR-548i、miR-548j、miR-548n、miR-574-3p、miR-598、miR-718、miR-935、miR-99a-3p、miR-99a-5p、miR-99b-3p以及miR-99b-5p。此外,可通过微阵列杂交和切片机分析在免疫细胞中鉴定新颖的miRNA(例如,Jima DD等人,Blood,2010,116:e118-e127;Vaz C等人,BMC Genomics,2010,11,288,其各自的内容以引用的方式整体并入本文。)
已知在肝脏中表达的miRNA包括但不限于miR-107、miR-122-3p、miR-122-5p、miR-1228-3p、miR-1228-5p、miR-1249、miR-129-5p、miR-1303、miR-151a-3p、miR-151a-5p、miR-152、miR-194-3p、miR-194-5p、miR-199a-3p、miR-199a-5p、miR-199b-3p、miR-199b-5p、miR-296-5p、miR-557、miR-581、miR-939-3p以及miR-939-5p。可将来自任何肝脏特异性miRNA的miRNA结合位点引入本公开的多核糖核苷酸中或从本公开的多核糖核苷酸中除去,以调控肝脏中所述多核糖核苷酸的表达。肝脏特异性miRNA结合位点可单独或进一步与本公开的多核糖核苷酸中的免疫细胞(例如APC)miRNA结合位点组合工程化。
已知在肺中表达的miRNA包括但不限于let-7a-2-3p、let-7a-3p、let-7a-5p、miR-126-3p、miR-126-5p、miR-127-3p、miR-127-5p、miR-130a-3p、miR-130a-5p、miR-130b-3p、miR-130b-5p、miR-133a、miR-133b、miR-134、miR-18a-3p、miR-18a-5p、miR-18b-3p、miR-18b-5p、miR-24-1-5p、miR-24-2-5p、miR-24-3p、miR-296-3p、miR-296-5p、miR-32-3p、miR-337-3p、miR-337-5p、miR-381-3p以及miR-381-5p。可将来自任何肺特异性miRNA的MiRNA结合位点引入本公开的多核糖核苷酸中或从本公开的多核糖核苷酸中除去,以调控肺中所述多核糖核苷酸的表达。肺特异性miRNA结合位点可单独或进一步与本公开的多核糖核苷酸中的免疫细胞(例如APC)miRNA结合位点组合工程化。
已知在心脏中表达的miRNA包括但不限于miR-1、miR-133a、miR-133b、miR-149-3p、miR-149-5p、miR-186-3p、miR-186-5p、miR-208a、miR-208b、miR-210、miR-296-3p、miR-320、miR-451a、miR-451b、miR-499a-3p、miR-499a-5p、miR-499b-3p、miR-499b-5p、miR-744-3p、miR-744-5p、miR-92b-3p以及miR-92b-5p。可将来自任何心脏特异性微小RNA的MiRNA结合位点引入本公开的多核糖核苷酸中或从本公开的多核糖核苷酸中除去,以调控心脏中所述多核苷酸的表达。心脏特异性miRNA结合位点可单独或进一步与本公开的多核糖核苷酸中的免疫细胞(例如APC)miRNA结合位点组合工程化。
已知在神经系统中表达的miRNA包括但不限于miR-124-5p、miR-125a-3p、miR-125a-5p、miR-125b-1-3p、miR-125b-2-3p、miR-125b-5p,miR-1271-3p、miR-1271-5p、miR-128、miR-132-5p、miR-135a-3p、miR-135a-5p、miR-135b-3p、miR-135b-5p、miR-137、miR-139-5p、miR-139-3p、miR-149-3p、miR-149-5p、miR-153、miR-181c-3p、miR-181c-5p、miR-183-3p、miR-183-5p、miR-190a、miR-190b、miR-212-3p、miR-212-5p、miR-219-1-3p、miR-219-2-3p、miR-23a-3p、miR-23a-5p,miR-30a-5p、miR-30b-3p、miR-30b-5p、miR-30c-1-3p、miR-30c-2-3p、miR-30c-5p、miR-30d-3p、miR-30d-5p、miR-329、miR-342-3p、miR-3665、miR-3666、miR-380-3p、miR-380-5p、miR-383、miR-410、miR-425-3p、miR-425-5p、miR-454-3p、miR-454-5p、miR-483、miR-510、miR-516a-3p、miR-548b-5p、miR-548c-5p、miR-571、miR-7-1-3p、miR-7-2-3p、miR-7-5p、miR-802、miR-922、miR-9-3p以及miR-9-5p。在神经系统中富含的MiRNA还包括在神经元中特异性表达的那些,包括但不限于miR-132-3p、miR-132-3p、miR-148b-3p、miR-148b-5p、miR-151a-3p、miR-151a-5p、miR-212-3p、miR-212-5p、miR-320b、miR-320e、miR-323a-3p、miR-323a-5p、miR-324-5p、miR-325、miR-326、miR-328、miR-922;以及在神经胶质细胞中特异性表达的那些,包括但不限于miR-1250、miR-219-1-3p、miR-219-2-3p、miR-219-5p、miR-23a-3p、miR-23a-5p、miR-3065-3p、miR-3065-5p、miR-30e-3p、miR-30e-5p、miR-32-5p、miR-338-5p以及miR-657。可将来自任何CNS特异性miRNA的MiRNA结合位点引入本公开的多核糖核苷酸或从本公开的多核糖核苷酸中除去,以调控神经系统中所述多核糖核苷酸的表达。神经系统特异性miRNA结合位点可单独或进一步与本公开的多核糖核苷酸中的免疫细胞(例如APC)miRNA结合位点组合工程化。
已知在胰腺中表达的miRNA包括但不限于miR-105-3p、miR-105-5p、miR-184、miR-195-3p、miR-195-5p、miR-196a-3p、miR-196a-5p、miR-214-3p、miR-214-5p、miR-216a-3p、miR-216a-5p、miR-30a-3p、miR-33a-3p、miR-33a-5p、miR-375、miR-7-1-3p、miR-7-2-3p、miR-493-3p、miR-493-5p以及miR-944。可将来自任何胰腺特异性miRNA的MiRNA结合位点引入本公开的多核糖核苷酸中或从本公开的多核糖核苷酸中除去,以调控胰腺中所述多核糖核苷酸的表达。胰腺特异性miRNA结合位点可单独或进一步与本公开的多核糖核苷酸中的免疫细胞(例如APC)miRNA结合位点组合工程化。
已知在肾脏中表达的miRNA包括但不限于miR-122-3p、miR-145-5p、miR-17-5p、miR-192-3p、miR-192-5p、miR-194-3p、miR-194-5p、miR-20a-3p、miR-20a-5p、miR-204-3p、miR-204-5p、miR-210、miR-216a-3p、miR-216a-5p、miR-296-3p、miR-30a-3p、miR-30a-5p、miR-30b-3p、miR-30b-5p、miR-30c-1-3p、miR-30c-2-3p、miR30c-5p、miR-324-3p、miR-335-3p、miR-335-5p、miR-363-3p、miR-363-5p以及miR-562。可将来自任何肾脏特异性miRNA的MiRNA结合位点引入本公开的多核糖核苷酸中或从本公开的多核糖核苷酸中除去,以调控肾脏中所述多核糖核苷酸的表达。肾脏特异性miRNA结合位点可单独或进一步与本公开的多核糖核苷酸中的免疫细胞(例如APC)miRNA结合位点组合工程化。
已知在肌肉中表达的miRNA包括但不限于let-7g-3p、let-7g-5p、miR-1、miR-1286、miR-133a、miR-133b、miR-140-3p、miR-143-3p、miR-143-5p、miR-145-3p、miR-145-5p、miR-188-3p、miR-188-5p、miR-206、miR-208a、miR-208b、miR-25-3p以及miR-25-5p。可将来自任何肌肉特异性miRNA的MiRNA结合位点引入本公开的多核糖核苷酸中或从本公开的多核糖核苷酸中除去,以调控肌肉中所述多核糖核苷酸的表达。肌肉特异性miRNA结合位点可单独或进一步与本公开的多核糖核苷酸中的免疫细胞(例如APC)miRNA结合位点组合工程化。
miRNA也在不同类型的细胞,如但不限于内皮细胞、上皮细胞和脂肪细胞中差异表达。
已知在内皮细胞中表达的miRNA包括但不限于let-7b-3p、let-7b-5p、miR-100-3p、miR-100-5p、miR-101-3p、miR-101-5p、miR-126-3p、miR-126-5p、miR-1236-3p、miR-1236-5p、miR-130a-3p、miR-130a-5p、miR-17-5p、miR-17-3p、miR-18a-3p、miR-18a-5p、miR-19a-3p、miR-19a-5p、miR-19b-1-5p、miR-19b-2-5p、miR-19b-3p、miR-20a-3p、miR-20a-5p、miR-217、miR-210、miR-21-3p、miR-21-5p、miR-221-3p、miR-221-5p、miR-222-3p、miR-222-5p、miR-23a-3p、miR-23a-5p、miR-296-5p、miR-361-3p、miR-361-5p、miR-421、miR-424-3p、miR-424-5p、miR-513a-5p、miR-92a-1-5p、miR-92a-2-5p、miR-92a-3p、miR-92b-3p以及miR-92b-5p。在来自深度测序分析的内皮细胞中发现了许多新颖的miRNA(例如,Voellenkle C等人,RNA,2012,18,472-484,其以引用的方式整体并入本文)。可将来自任何内皮细胞特异性miRNA的MiRNA结合位点引入本公开的多核糖核苷酸或从本公开的多核糖核苷酸中除去,以调控内皮细胞中所述多核苷酸的表达。
已知在上皮细胞中表达的miRNA包括但不限于let-7b-3p、let-7b-5p、miR-1246、miR-200a-3p、miR-200a-5p、miR-200b-3p、miR-200b-5p、miR-200c-3p、miR-200c-5p、miR-338-3p、miR-429、miR-451a、miR-451b、miR-494、miR-802和miR-34a、miR-34b-5p、miR-34c-5p、miR-449a、miR-449b-3p、在呼吸道纤毛上皮细胞中具有特异性的miR-449b-5p、let-7家族、miR-133a、miR-133b、在肺上皮细胞中具有特异性的miR-126、miR-382-3p、在肾上皮细胞中具有特异性的miR-382-5p以及在角膜上皮细胞中具有特异性的miR-762。可将来自任何上皮细胞特异性miRNA的MiRNA结合位点引入本公开的多核糖核苷酸或从本公开的多核糖核苷酸中除去,以调控上皮细胞中所述多核苷酸的表达。
此外,大量的miRNA富含胚胎干细胞,从而控制干细胞自我更新以及各种细胞谱系(如神经细胞、心脏细胞、造血细胞、皮肤细胞、成骨细胞和肌肉细胞)的发育和/或分化(例如,Kuppusamy KT等人,Curr.Mol Med,2013,13(5),757-764;Vidigal JA和Ventura A,Semin Cancer Biol.2012,22(5-6),428-436;Goff LA等人,PLoS One,2009,4:e7192;Morin RD等人,Genome Res,2008,18,610-621;Yoo JK等人,Stem Cells Dev.2012,21(11),2049-2057,其各自以引用的方式整体并入本文)。在胚胎干细胞中丰富的MiRNA包括但不限于let-7a-2-3p、let-a-3p、let-7a-5p、let7d-3p、let-7d-5p、miR-103a-2-3p、miR-103a-5p、miR-106b-3p、miR-106b-5p、miR-1246、miR-1275、miR-138-1-3p、miR-138-2-3p、miR-138-5p、miR-154-3p、miR-154-5p、miR-200c-3p、miR-200c-5p、miR-290、miR-301a-3p、miR-301a-5p、miR-302a-3p、miR-302a-5p、miR-302b-3p、miR-302b-5p、miR-302c-3p、miR-302c-5p、miR-302d-3p、miR-302d-5p、miR-302e、miR-367-3p、miR-367-5p、miR-369-3p、miR-369-5p、miR-370、miR-371、miR-373、miR-380-5p、miR-423-3p、miR-423-5p、miR-486-5p、miR-520c-3p、miR-548e、miR-548f、miR-548g-3p、miR-548g-5p、miR-548i、miR-548k、miR-548l、miR-548m、miR-548n、miR-548o-3p、miR-548o-5p、miR-548p、miR-664a-3p、miR-664a-5p、miR-664b-3p、miR-664b-5p、miR-766-3p、miR-766-5p、miR-885-3p、miR-885-5p、miR-93-3p、miR-93-5p、miR-941、miR-96-3p、miR-96-5p、miR-99b-3p以及miR-99b-5p。许多预测的新颖miRNA是通过人胚胎干细胞中的深度测序发现的(例如,Morin RD等人,GenomeRes,2008,18,610-621;Goff LA等人,PLoS One,2009,4:e7192;Bar M等人,Stem cells,2008,26,2496-2505,其各自的内容以引用的方式整体并入本文)。
在一些实施方案中,胚胎干细胞特异性miRNA的结合位点可包含于本公开的多核糖核苷酸的3'UTR中或从本公开的多核糖核苷酸的3'UTR中除去,以调节胚胎干细胞的发育和/或分化,抑制退行性疾患(例如,退行性疾病)中干细胞的衰老,或刺激处于疾病状态的干细胞(例如,癌症干细胞)的衰老和凋亡。
进行许多miRNA表达研究以分析各种癌细胞/组织和其他疾病中miRNA的差异表达。一些miRNA在某些癌细胞中异常过表达,而其他则表达不足。在一些实施方案中,miRNA在以下中差异表达:癌细胞(WO2008/154098、US2013/0059015、US2013/0042333、WO2011/157294);癌症干细胞(US2012/0053224);胰腺癌和疾病(US2009/0131348、US2011/0171646、US2010/0286232、US8389210);哮喘和炎症(US8415096);前列腺癌(US2013/0053264);肝细胞癌(WO2012/151212、US2012/0329672、WO2008/054828、US8252538);肺癌细胞(WO2011/076143、WO2013/033640、WO2009/070653、US2010/0323357);皮肤T细胞淋巴瘤(WO2013/011378);结肠直肠癌细胞(WO2011/0281756、WO2011/076142);癌症阳性淋巴结(WO2009/100430、US2009/0263803);鼻咽癌(EP2112235);慢性阻塞性肺病(US2012/0264626、US2013/0053263);甲状腺癌(WO2013/066678);卵巢癌细胞(US2012/0309645、WO2011/095623);乳腺癌细胞(WO2008/154098、WO2007/081740、US2012/0214699)、白血病和淋巴瘤(WO2008/073915、US2009/0092974、US2012/0316081、US2012/0283310、WO2010/018563,其各自的内容以引用的方式整体并入本文)。
作为非限制性实例,可从本公开的多核糖核苷酸的3'UTR中除去在某些癌症和/或肿瘤细胞中过表达的miRNA的miRNA结合位点,从而恢复由癌细胞中过表达的miRNA抑制的表达,由此改善相应的生物学功能,例如转录刺激和/或阻遏、细胞周期停滞、细胞凋亡和细胞死亡。其中miRNA表达未上调的正常细胞和组织将保持不受影响。
MiRNA还可调控复杂生物过程如血管生成(例如,miR-132)(Anand和Cheresh CurrOpin Hematol 2011 18:171-176)。在本公开的多核糖核苷酸中,可除去或引入在此类过程中涉及的miRNA结合位点,以便针对生物上相关的细胞类型或针对相关生物过程定制多核糖核苷酸的表达。在这种背景下,本公开的多核糖核苷酸被定义为营养缺陷型多核糖核苷酸。
茎环
多核苷酸(例如,mRNA)可包含茎环,如但不限于组蛋白茎环。茎环可以是长度为约25或约26个核苷酸的核苷酸序列,如但不限于如国际专利公布号WO2013/103659中所描述的那些,所述专利以引用的方式并入本文。组蛋白茎环可相对于编码区位于3'(例如,在编码区的3'-末端)。作为非限制性实例,茎环可位于本文所述的多核苷酸的3'-末端。在一些情况下,多核苷酸(例如,mRNA)包含多于一个茎环(例如,两个茎环)。茎环序列的实例描述于国际专利公布号WO2012/019780和WO201502667中,其茎环序列以引用的方式并入本文。在一些实例中,多核苷酸包含茎环序列CAAAGGCTCTTTTCAGAGCCACCA(SEQ ID NO:1)。在其他中,多核苷酸包含茎环序列CAAAGGCUCUUUUCAGAGCCACCA(SEQ ID NO:2)。
茎环可位于多核苷酸的第二末端区域中。作为非限制性实例,茎环可位于第二末端区域中的非翻译区(例如3'-UTR)内。
在一些情况下,可通过添加3'稳定区(例如,包含至少一个链终止核苷的3'-稳定区)来稳定化包含组蛋白茎环的多核苷酸(如但不限于mRNA)。不希望受理论束缚,添加至少一个链终止核苷可减慢多核苷酸的降解,并且因此可增加多核苷酸的半衰期。
在其他情况下,包含组蛋白茎环的多核苷酸(如但不限于mRNA)可通过对多核苷酸的3'-区域的改变而稳定化,从而能够防止和/或抑制oligio(U)的添加(参见例如国际专利公布号WO2013/103659)。
在其他情况下,可通过添加终止于3'-脱氧核苷、2',3'-二脱氧核苷3'-O-甲基核苷、3'-O-乙基核苷、3'-阿拉伯糖苷以及本领域中已知和/或本文所述的其他替代核苷的寡核苷酸来稳定化包含组蛋白茎环的多核苷酸(如但不限于mRNA)。
在一些实例中,本公开的多核苷酸可包含组蛋白茎环、poly-A区和/或5'-帽结构。组蛋白茎环可在poly-A区之前和/或之后。包含组蛋白茎环和poly-A区序列的多核苷酸可包含本文所述的链终止核苷。
在其他实例中,本公开的多核苷酸可包含组蛋白茎环和5'-帽结构。5'-帽结构可包括但不限于本文所述和/或本领域中已知的那些。
在一些情况下,保守的茎环区可包含本文所述的miR序列。作为非限制性实例,茎环区可包含本文所述的miR序列的种子序列。在另一个非限制性实例中,茎环区可包含miR-122种子序列。
在某些实例中,保守的茎环区可包含本文所述的miR序列,并且还可包含TEE序列。
在一些情况下,并入miR序列和/或TEE序列可改变茎环区的形状,这可增加和/或减少翻译。(参见例如,Kedde等人A Pumilio-induced RNA structure switch in p27-3′UTR controls miR-221and miR-22accessibility.Nature Cell Biology.2010,所述文献以引用的方式整体并入本文)。
多核苷酸可包含至少一个组蛋白茎环和poly-A区或聚腺苷酸化信号。编码至少一个组蛋白茎环和poly-A区或聚腺苷酸化信号的多核苷酸序列的非限制性实例描述于国际专利公布号WO2013/120497、WO2013/120629、WO2013/120500、WO2013/120627、WO2013/120498、WO2013/120626、WO2013/120499和WO2013/120628中,所述专利各自的序列以引用的方式并入本文。在某些情况下,编码组蛋白茎环和poly-A区或聚腺苷酸化信号的多核苷酸可编码病原体抗原或其片段,如国际专利公布号WO2013/120499和WO2013/120628中描述的多核苷酸序列,所述专利两者的序列以引用的方式并入本文。在其他情况下,编码组蛋白茎环和poly-A区或聚腺苷酸化信号的多核苷酸可编码治疗性蛋白质,如国际专利公布号WO2013/120497和WO2013/120629中所述的多核苷酸序列,所述专利两者的序列以引用的方式并入本文。在一些情况下,编码组蛋白茎环和poly-A区或聚腺苷酸化信号的多核苷酸可编码肿瘤抗原或其片段,如国际专利公布号WO2013/120500和WO2013/120627中描述的多核苷酸序列,所述专利两者的序列以引用的方式并入本文。在其他情况下,编码组蛋白茎环和poly-A区或聚腺苷酸化信号的多核苷酸可编码变应原性抗原或自身免疫自身抗原,如国际专利公布号WO2013/120498和WO2013/120626中描述的多核苷酸序列,所述专利各自的序列以引用的方式整体并入本文。
poly-A区
多核苷酸或核酸(例如,mRNA)可包含polyA序列和/或聚腺苷酸化信号。polyA序列可全部或大部分包含腺嘌呤核苷酸或其类似物或衍生物。polyA序列可以是位于核酸的3'非翻译区附近的尾部。
在RNA加工过程中,通常将腺苷核苷酸(poly-A区)的长链添加至信使RNA(mRNA)分子中,以增加分子的稳定性。紧随转录之后,转录物的3'-端被裂解以释放3'-羟基。然后poly-A聚合酶将腺嘌呤核苷酸链添加至RNA。所述过程(称为聚腺苷酸化)添加长度介于100与250个残基之间的poly-A区。
独特的poly-A区长度可为本公开的替代多核苷酸提供某些优点。
一般来说,本公开的poly-A区的长度是至少30个核苷酸长。在另一个实施方案中,poly-A区的长度是至少35个核苷酸。在另一个实施方案中,长度是至少40个核苷酸。在另一个实施方案中,长度是至少45个核苷酸。在另一个实施方案中,长度是至少55个核苷酸。在另一个实施方案中,长度是至少60个核苷酸。在另一个实施方案中,长度是至少70个核苷酸。在另一个实施方案中,长度是至少80个核苷酸。在另一个实施方案中,长度是至少90个核苷酸。在另一个实施方案中,长度是至少100个核苷酸。在另一个实施方案中,长度是至少120个核苷酸。在另一个实施方案中,长度是至少140个核苷酸。在另一个实施方案中,长度是至少160个核苷酸。在另一个实施方案中,长度是至少180个核苷酸。在另一个实施方案中,长度是至少200个核苷酸。在另一个实施方案中,长度是至少250个核苷酸。在另一个实施方案中,长度是至少300个核苷酸。在另一个实施方案中,长度是至少350个核苷酸。在另一个实施方案中,长度是至少400个核苷酸。在另一个实施方案中,长度是至少450个核苷酸。在另一个实施方案中,长度是至少500个核苷酸。在另一个实施方案中,长度是至少600个核苷酸。在另一个实施方案中,长度是至少700个核苷酸。在另一个实施方案中,长度是至少800个核苷酸。在另一个实施方案中,长度是至少900个核苷酸。在另一个实施方案中,长度是至少1000个核苷酸。在另一个实施方案中,长度是至少1100个核苷酸。在另一个实施方案中,长度是至少1200个核苷酸。在另一个实施方案中,长度是至少1300个核苷酸。在另一个实施方案中,长度是至少1400个核苷酸。在另一个实施方案中,长度是至少1500个核苷酸。在另一个实施方案中,长度是至少1600个核苷酸。在另一个实施方案中,长度是至少1700个核苷酸。在另一个实施方案中,长度是至少1800个核苷酸。在另一个实施方案中,长度是至少1900个核苷酸。在另一个实施方案中,长度是至少2000个核苷酸。在另一个实施方案中,长度是至少2500个核苷酸。在另一个实施方案中,长度是至少3000个核苷酸。
在一些实例中,在本文描述的替代多核苷酸分子上,poly-A区的长度可以是80个核苷酸、120个核苷酸、160个核苷酸。
在其他实例中,在本文所述的替代多核苷酸分子上,poly-A区的长度可以是20、40、80、100、120、140或160个核苷酸。
在一些情况下,相对于整个替代多核苷酸的长度设计poly-A区。这种设计可基于替代多核苷酸的编码区的长度、替代多核苷酸(如mRNA)的特定特征或区域的长度,或者基于由替代多核苷酸表达的最终产物的长度。当相对于替代多核苷酸的任何特征(例如,除包含poly-A区的mRNA部分以外)时,poly-A区的长度可比另外的特征大10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。poly-A区还可被设计为它所属的替代多核苷酸的一部分。在这种背景下,poly-A区可以是构建体的总长度或构建体减去poly-A区的总长度的10%、20%、30%、40%、50%、60%、70%、80%或90%或更多。
在某些情况下,可使用工程化的结合位点和/或poly-A结合蛋白的多核苷酸(例如(,mRNA)的缀合来增强表达。工程化的结合位点可以是传感器序列,其可用作多核苷酸(例如,mRNA)的局部微环境的配体的结合位点。作为非限制性实例,多核苷酸(例如,mRNA)可包含至少一个工程化的结合位点,以改变poly-A结合蛋白(PABP)及其类似物的结合亲和力。至少一个工程化的结合位点的并入可增加PABP及其类似物的结合亲和力。
另外,多个不同的多核苷酸(例如,mRNA)可使用poly-A尾的3’-末端处的替代核苷酸经由3’-端一起连接至PABP(poly-A结合蛋白)。在转染后12小时、24小时、48小时、72小时和第7天可在相关细胞系中进行转染实验并且可通过ELISA测定蛋白质产生。作为非限制性实例,由于添加至少一个工程化的结合位点,转染实验可用于评估对PABP或其类似物结合亲和力的作用。
在某些情况下,poly-A区可用于调节翻译起始。尽管不希望受理论束缚,但是poly-A区募集PABP,PABP进而可与翻译起始复合物相互作用并且因此对于蛋白质合成可能是必不可少的。
在一些情况下,在本公开中也可使用poly-A区来保护免受3'-5'-核酸外切酶消化。
在一些实例中,多核苷酸(例如,mRNA)可包含polyA-G四联体。G-四联体是可通过DNA和RNA两者中的富含G的序列形成的四个鸟苷核苷酸的环状氢键合阵列。在这个实施方案中,G-四联体并入在poly-A区的末端。在不同时间点针对稳定性、蛋白质产生和包括半衰期的其他参数来对所得多核苷酸(例如,mRNA)进行测定。已发现polyA-G四联体使得蛋白质产生等效于单独使用120个核苷酸的poly-A区所观察到的蛋白质产生的至少75%。
在一些情况下,多核苷酸(例如,mRNA)可包含poly-A区,并且可通过添加3'-稳定区来稳定化。具有poly-A区的多核苷酸(例如,mRNA)还可包含5'-帽结构。
在其他情况下,多核苷酸(例如,mRNA)可包含poly-A-G四联体。具有poly-A-G四联体的多核苷酸(例如,mRNA)还可包含5'-帽结构。
在一些情况下,可用于稳定化包含poly-A区或poly-AG四联体的多核苷酸(例如,mRNA)的3'稳定区可以是但不限于国际专利公布号WO2013/103659中描述的那些,其poly-A区和poly-A-G四联体以引用的方式并入本文。在其他情况下,可用于本公开的3'-稳定区包括链终止核苷,如3'-脱氧腺苷(虫草素)、3'-脱氧尿苷、3'-脱氧胞嘧啶、3'-脱氧鸟苷、3'-脱氧胸腺嘧啶、2',3'-二脱氧核苷如2',3'-二脱氧腺苷、2',3'-二脱氧尿苷、2',3'-二脱氧胞嘧啶、2',3'-二脱氧鸟苷、2',3'-二脱氧胸腺嘧啶、2'-脱氧核苷或O-甲基核苷。
在其他情况下,包含polyA区或poly-A-G四联体的多核苷酸(如但不限于mRNA)可通过对多核苷酸的3'-区域的改变而稳定化,从而能够防止和/或抑制oligio(U)的添加(参见例如国际专利公布号WO2013/103659)。
在其他实例中,可通过添加终止于3'-脱氧核苷、2',3'-二脱氧核苷3'-O-甲基核苷、3'-O-乙基核苷、3'-阿拉伯糖苷以及本领域中已知和/或本文所述的其他替代核苷的寡核苷酸来稳定化包含polyA区或poly-A-G四联体的多核苷酸(如但不限于mRNA)。
链终止核苷
核酸可包含链终止核苷。在一些实施方案中,链终止核苷可包括在其糖基的2'和/或3'位置脱氧的那些核苷。此类物质可包括3'-脱氧腺苷(虫草素)、3'-脱氧尿苷、3'-脱氧胞嘧啶、3'-脱氧鸟苷、3'-脱氧胸腺嘧啶和2',3'-脱氧核苷如2',3'-脱氧腺苷、2',3'-二脱氧尿苷、2',3'-二脱氧胞嘧啶、2',3'-二脱氧鸟苷和2',3'-二脱氧胸腺嘧啶。
基因组编辑技术
在一些实施方案中,核酸适合于基因组编辑技术。
在一些实施方案中,基因组编辑技术是成簇规律间隔的短回文重复序列(CRISPR)或转录活化因子样效应物核酸酶(TALEN)。
在一些实施方案中,核酸是适合于基因组编辑技术的选自由以下组成的组的至少一种核酸:CRISPR RNA(crRNA)、反式活化crRNA(tracrRNA)、单向导RNA(sgRNA)和DNA修复模板。
疫苗
在一些实施方案中,治疗剂和/或预防剂是可安全地指导身体的细胞机器来产生几乎任何目标癌蛋白或其片段的RNA(例如信使RNA(mRNA))的核糖核酸(RNA)癌症疫苗。在一些实施方案中,RNA是经修饰的RNA。例如,本公开的RNA疫苗可用于诱导针对癌症的平衡的免疫应答,包括细胞免疫和体液免疫,而没有插入诱变的风险。
取决于癌症的盛行性或未满足医学需求的程度或水平,RNA疫苗可用于各种环境中。RNA疫苗可用于治疗和/或预防各种阶段或转移程度的癌症。RNA疫苗具有优异的性质,因为与替代抗癌疗法(包括癌症疫苗)相比,它们产生大得多的抗体效价并且更早产生应答。虽然不希望受理论束缚,但据信作为mRNA多核苷酸的RNA疫苗被更好地设计来在RNA疫苗选择天然细胞机器时在翻译后产生适当的蛋白质构象。与离体制造且可触发不想要的细胞应答的传统疫苗不同,RNA疫苗以更天然的方式呈递至细胞系统。
本公开的一些实施方案提供癌症疫苗,所述癌症疫苗包含至少一种核糖核酸(RNA)多核苷酸,所述多核苷酸具有编码至少一种癌症抗原多肽或其免疫原性片段(例如能够诱导针对癌症的免疫应答的免疫原性片段)的开放阅读框。其他实施方案包括至少一种具有编码两种或更多种能够诱导针对癌症的免疫应答的抗原或表位的开放阅读框的核糖核酸(RNA)多核苷酸。
在一些方面,本发明是具有编码癌症抗原的开放阅读框的mRNA和具有编码免疫检查点调节剂的开放阅读框的mRNA的疫苗。在一些实施方案中,免疫检查点调节剂是抑制性检查点多肽。在一些实施方案中,抑制性检查点多肽是特异性地结合至选自由以下组成的组的分子的抗体或其片段:PD-1、TIM-3、VISTA、A2AR、B7-H3、B7-H4、BTLA、CTLA-4、IDO、KIR和LAG3。在一些实施方案中,抑制性检查点多肽是抗CTLA4或抗PDl抗体。任选地,疫苗包含脂质纳米颗粒。在一些实施方案中,将具有编码癌症抗原的开放阅读框的mRNA的疫苗施用于受试者。在一些实施方案中,检查点抑制剂在3-10周后施用。在一些实施方案中,检查点抑制剂在4周后施用。
在一些方面,本发明是具有编码至少2种癌症抗原的开放阅读框的mRNA和脂质纳米颗粒载体的个人化癌症疫苗,其中所述至少2种癌症抗原是患者特异性癌症抗原。在一些实施方案中,脂质纳米颗粒具有50-200nm的平均直径。
在一些方面,本发明是具有编码至少2种癌症抗原的开放阅读框的mRNA的个人化癌症疫苗,其中所述至少2种癌症抗原代表患者的抗原。在一些实施方案中,患者的抗原是患者的外来体鉴定的抗原。在一些实施方案中,单一mRNA编码癌症抗原。在一些实施方案中,多种mRNA编码癌症抗原。
在一些实施方案中,每种mRNA可编码5-10种癌症抗原或单一癌症抗原。在一些实施方案中,mRNA编码2-100种癌症抗原。在一些实施方案中,mRNA编码10-100、20-100、50-100、100-200、300-400、500-600、600-700、700-800、900-1,000或1,000-10,000种癌症抗原。
在一些实施方案中,
a)编码每种癌症抗原的mRNA间杂有裂解敏感性位点;
b)编码每种癌症抗原的mRNA在无接头的情况下彼此直接连接;
c)编码每种癌症抗原的mRNA以单一核苷酸接头彼此连接;
d)每种癌症抗原包含25-35个氨基酸并且包含位于中心的SNP突变;
e)至少30%的癌症抗原对来自受试者的I类MHC分子具有最高亲和力;
f)至少30%的癌症抗原对来自受试者的II类MHC分子具有最高亲和力;
g)至少50%的癌症抗原对HLA-A、HLA-B和/或DRB 1具有IC>500nM的预测结合亲和力;
h)mRNA编码20种癌症抗原;
i)50%的癌症抗原对I类MHC具有结合亲和力并且50%的所述癌症抗原对II类MHC具有结合亲和力;和/或
j)编码癌症抗原的mRNA被排列成使得癌症抗原有序以使假表位最小化。
在一些实施方案中,每种癌症抗原包含31个氨基酸,并且包含位于中心的SNP突变,在所述SNP突变的每侧上具有15个侧接氨基酸。
在一些实施方案中,疫苗是个人化癌症疫苗,并且其中癌症抗原是受试者特异性癌症抗原。在一些实施方案中,受试者特异性癌症抗原可代表受试者的肿瘤样品的外显子组或受试者的肿瘤样品的转录组。在一些实施方案中,受试者特异性癌症抗原可代表受试者的外来体。
在一些实施方案中,开放阅读框进一步编码一种或多种传统癌症抗原。在一些实施方案中,传统癌症抗原是非突变抗原。在一些实施方案中,传统癌症抗原是突变的抗原。
在一些实施方案中,mRNA疫苗还包含具有编码一种或多种传统癌症抗原的开放阅读框的mRNA。
在一些实施方案中,单一mRNA编码癌症抗原。在一些实施方案中,多种mRNA编码癌症抗原。在一些实施方案中,每种癌症抗原的长度是10-50个氨基酸。在一些实施方案中,每种癌症抗原的长度是15-20个氨基酸。在一些实施方案中,癌症抗原的长度是20-50、25-100、100-200、200-300、300-400、400-500、500-1,000或1,000-10,000个氨基酸。
在一些实施方案中,疫苗还包含佐剂。
本公开的一些实施方案提供了癌症疫苗,所述癌症疫苗包含配制在脂质纳米颗粒内的至少一种核糖核酸(RNA)多核苷酸,所述多核苷酸具有编码至少一种癌症多肽的开放阅读框、至少一个5'末端帽和至少一种化学修饰。在一些实施方案中,5’末端帽是7mG(5')ppp(5')NlmpNp。
在一些实施方案中,至少一种化学修饰选自假尿苷、Nl-甲基假尿苷、Nl-乙基假尿苷、2-硫代尿苷、4’-硫代尿苷、5-甲基胞嘧啶、2-硫代-l-甲基-1-脱氮-假尿苷、2-硫代-l-甲基-假尿苷、2-硫代-5-氮杂-尿苷、2-硫代-二氢假尿苷、2-硫代-二氢尿苷、2-硫代-假尿苷、4-甲氧基-2-硫代-假尿苷、4-甲氧基-假尿苷、4-硫代-l-甲基-假尿苷、4-硫代-假尿苷、5-氮杂-尿苷、二氢假尿苷、5-甲基尿苷、5-甲氧基尿苷以及2’-O-甲基尿苷。在一些实施方案中,化学修饰的核苷酸的并入程度已被优化以改善对疫苗制剂的免疫应答。
在一些实施方案中,脂质纳米颗粒包含阳离子脂质、PEG修饰的脂质、固醇以及非阳离子脂质。在一些实施方案中,阳离子脂质是可电离阳离子脂质,并且非阳离子脂质是中性脂质,并且固醇是胆固醇。在一些实施方案中,阳离子脂质选自2,2-二亚油基-4-二甲基氨基乙基-[l,3]-二氧戊环(DLin-KC2-DMA)、二亚油基-甲基-4-二甲基氨基丁酸酯(DLin-MC3-DMA)以及二((Z)-壬-2-烯-1-基)9-((4-(二甲基氨基)丁酰基)氧基)十七烷二酸酯(L319)。
在一些实施方案中,脂质纳米颗粒制剂包含免疫增效剂(例如TLR激动剂),以增强疫苗(制剂)的免疫原性。
在一些实施方案中,所述开放阅读框中的尿嘧啶的100%具有化学修饰。在一些实施方案中,化学修饰位于尿嘧啶的5-位置中。在一些实施方案中,化学修饰是Nl-甲基假尿苷。
在一些实施方案中,编码APC重新编程分子的mRNA包含于疫苗中,或与疫苗共同施用。APC重新编程分子可以是CIITA、伴侣蛋白(如CLIP、HLA-DO、HLA-DM)、共刺激分子(如CD40、CD80、CD86)、CIITA片段如CIITA的氨基酸26-137或与CIITA具有80%序列同一性的蛋白质。
在其他方面,提供了在受试者中引发免疫应答的方法,所述方法通过以下方式来进行:从受试者的样品中鉴定至少2种癌症抗原其中所述至少2种癌症抗原包含选自由移码突变和重组组成的组的突变;以及向所述受试者施用具有编码所述至少2种癌症抗原的开放阅读框的mRNA疫苗。
在一些实施方案中,癌症抗原是从受试者的外来体中鉴定的。在一些实施方案中,从外来体中鉴定了2-100种抗原。在一些实施方案中,mRNA疫苗具有编码2-100种抗原的开放阅读框。单一mRNA或多种mRNA可编码抗原。
在一些实施方案中,抗原是癌症抗原。癌症抗原可具有选自点突变、移码突变和重组的突变。所述方法可进一步包括通过外显子组分析确认所述癌症抗原是受试者特异性的。
在一些实施方案中,所述方法可进一步包括通过转录组分析确认所述癌症抗原是受试者特异性的。
在一些实施方案中,所述方法还涉及在施用mRNA疫苗之后至少一个月,从所述受试者的样品中鉴定至少2种癌症抗原以产生第二组癌症抗原;以及向所述受试者施用具有编码所述第二组癌症抗原的开放阅读框的mRNA疫苗。
在一些实施方案中,受试者的样品是肿瘤样品。
在其他方面,本发明包括在受试者中引发免疫应答的方法,所述方法通过以下方式来进行:从受试者的样品中鉴定至少2种癌症抗原以产生第一组癌症抗原,向所述受试者施用具有编码所述第一组癌症抗原的开放阅读框的mRNA疫苗;在施用所述mRNA疫苗后至少一个月,从受试者的样品中鉴定至少2种癌症抗原以产生第二组癌症抗原;以及向所述受试者施用具有编码所述第二组癌症抗原的开放阅读框的mRNA疫苗。
在一些实施方案中,具有编码第二组抗原的开放阅读框的mRNA疫苗在具有编码第一组癌抗原的开放阅读框的mRNA疫苗后6个月至1年施用于受试者。在一些实施方案中,具有编码第二组抗原的开放阅读框的mRNA疫苗在具有编码第一组癌抗原的开放阅读框的mRNA疫苗后1-2年施用于受试者。
在一些实施方案中,单一mRNA具有编码癌症抗原的开放阅读框。在一些实施方案中,多种mRNA编码所述抗原。在一些实施方案中,第二组癌症抗原包括2-100种抗原。在一些实施方案中,癌症抗原具有选自点突变、移码突变和重组的突变。
在其他方面,本发明包括在受试者中引发免疫应答的方法,所述方法通过以下方式来进行:从受试者的样品中鉴定至少2种癌症抗原;向所述受试者施用具有编码所述至少2种癌症抗原的开放阅读框的mRNA;以及向所述受试者施用癌症治疗剂。在一些实施方案中,癌症治疗剂是靶向疗法。靶向疗法可以是BRAF抑制剂,如威罗菲尼(PLX4032)或达拉菲尼。
在一些实施方案中,癌症治疗剂是T细胞治疗剂。T细胞治疗剂可以是检查点抑制剂,如抗PD-1抗体或抗CTLA-4抗体。在一些实施方案中,抗PD-1抗体是BMS-936558(纳武单抗)。在一些实施方案中,抗CTLA-4抗体是伊匹单抗。在一些实施方案中,T细胞治疗剂是OX40L。在一些实施方案中,癌症治疗剂是包含基于群体的肿瘤特异性抗原的疫苗。
在一些实施方案中,癌症治疗剂是包含mRNA的疫苗,所述mRNA具有编码一种或多种传统癌症抗原的开放阅读框。
在一些实施方案中,将具有编码至少2种癌症抗原的开放阅读框的mRNA与癌症治疗剂同时施用于受试者。在一些实施方案中,在施用癌症治疗剂之前,将具有编码至少2种癌症抗原的开放阅读框的mRNA施用于受试者。在一些实施方案中,在施用癌症治疗剂之后,将具有编码至少2种癌症抗原的开放阅读框的mRNA施用于受试者。
在本发明的其他方面,提供了一种方法,所述方法包括将具有编码癌症抗原的开放阅读框的mRNA与脂质纳米颗粒制剂混合以产生mRNA癌症疫苗,以及在混合的24小时内将所述mRNA癌症疫苗施用于受试者。在一些实施方案中,在混合的12小时内将所述mRNA癌症疫苗施用于受试者。在一些实施方案中,在混合的1小时内将所述mRNA癌症疫苗施用于受试者。在一些实施方案中,所述mRNA癌症疫苗编码2-100种癌症抗原或10-100种癌症抗原。
在一些实施方案中,疫苗是个人化癌症疫苗,并且其中癌症抗原是受试者特异性癌症抗原。
在一些实施方案中,单一mRNA编码癌症抗原。在一些实施方案中,多种mRNA编码癌症抗原。在一些实施方案中,每种mRNA编码5-10种癌症抗原或单一癌症抗原。在一些实施方案中,每种癌症抗原的长度是10-50个氨基酸或长度是15-20个氨基酸。
本文进一步提供了癌症疫苗在制造用于在受试者中诱导抗原特异性免疫应答的方法中使用的药剂中的用途,所述方法包括以有效产生抗原特异性免疫应答的量向所述受试者施用所述癌症疫苗。
在其他方面提供了治疗有需要的受试者的癌症的方法,所述方法通过以下方式来进行:从分离自所述受试者的外来体中鉴定至少2种癌症抗原;基于所鉴定的抗原,产生具有编码所述抗原的开放阅读框的mRNA疫苗;以及向所述受试者施用所述mRNA疫苗,其中所述mRNA疫苗在所述受试者中诱导肿瘤特异性免疫应答,从而治疗所述受试者的癌症。在其他方面,本发明是可根据一种方法制备的RNA疫苗,所述方法包括:从分离自受试者的外来体中鉴定至少2种癌症抗原;基于所鉴定的抗原,产生具有编码所述抗原的开放阅读框的mRNA疫苗。
在本发明的方面中提供了在受试者中引发针对癌症抗原的免疫应答的方法。所述方法包括向所述受试者施用RNA疫苗,所述RNA疫苗包含具有编码至少一种抗原多肽或其免疫原性片段的开放阅读框的至少一种RNA多核苷酸,从而在所述受试者中诱导对所述抗原多肽或其免疫原性片段具有特异性的免疫应答,其中疫苗接种后所述受试者中的抗抗原多肽抗体效价相对于接种预防有效剂量的针对所述癌症的传统疫苗的受试者中的抗抗原多肽抗体效价增加。“抗抗原多肽抗体”是与抗原多肽特异性地结合的血清抗体。
预防有效剂量是在临床可接受的水平上预防癌症进展的治疗有效剂量。在一些实施方案中,治疗有效剂量是疫苗的包装插页中列出的剂量。如本文所用,传统疫苗是指除本发明的mRNA疫苗以外的疫苗。例如,传统疫苗包括但不限于活微生物疫苗、灭活微生物疫苗、亚单位疫苗、蛋白抗原疫苗、DNA疫苗等。在示例性实施方案中,传统疫苗是已获得监管批准的疫苗和/或已由国家药品监管机构如美国食品与药物管理局(FDA)或欧洲药品管理局(EMA)注册。
在一些实施方案中,在疫苗接种后所述受试者中的抗抗原多肽抗体效价相对于接种预防有效剂量的针对所述癌症的传统疫苗的受试者中的抗抗原多肽抗体效价增加了1log至10log。
在一些实施方案中,在疫苗接种后所述受试者中的抗抗原多肽抗体效价相对于接种预防有效剂量的针对所述癌症的传统疫苗的受试者中的抗抗原多肽抗体效价增加了1log。
在一些实施方案中,在疫苗接种后所述受试者中的抗抗原多肽抗体效价相对于接种预防有效剂量的针对所述癌症的传统疫苗的受试者中的抗抗原多肽抗体效价增加了2log。
在一些实施方案中,在疫苗接种后所述受试者中的抗抗原多肽抗体效价相对于接种预防有效剂量的针对所述癌症的传统疫苗的受试者中的抗抗原多肽抗体效价增加了3log。
在一些实施方案中,在疫苗接种后所述受试者中的抗抗原多肽抗体效价相对于接种预防有效剂量的针对所述癌症的传统疫苗的受试者中的抗抗原多肽抗体效价增加了5log。
在一些实施方案中,在疫苗接种后所述受试者中的抗抗原多肽抗体效价相对于接种预防有效剂量的针对所述癌症的传统疫苗的受试者中的抗抗原多肽抗体效价增加了10log。
在本发明的其他方面中提供了在受试者中引发针对癌症抗原的免疫应答的方法。所述方法包括向所述受试者施用RNA疫苗,所述RNA疫苗包含具有编码至少一种抗原多肽或其免疫原性片段的开放阅读框的至少一种RNA多核苷酸,从而在所述受试者中诱导对抗原多肽或其免疫原性片段具有特异性的免疫应答,其中所述受试者中的免疫应答等效于相对于所述RNA疫苗以2倍至100倍的剂量水平接种针对所述癌症抗原的传统疫苗的受试者中的免疫应答。
在一些实施方案中,所述受试者中的免疫应答等效于相对于所述RNA疫苗以两倍剂量水平接种传统疫苗的受试者中的免疫应答。
在一些实施方案中,所述受试者中的免疫应答等效于相对于所述RNA疫苗以三倍剂量水平接种传统疫苗的受试者中的免疫应答。
在一些实施方案中,所述受试者中的免疫应答等效于相对于所述RNA疫苗以4倍剂量水平接种传统疫苗的受试者中的免疫应答。
在一些实施方案中,所述受试者中的免疫应答等效于相对于所述RNA疫苗以5倍剂量水平接种传统疫苗的受试者中的免疫应答。在一些实施方案中,所述受试者中的免疫应答等效于相对于所述RNA疫苗以10倍剂量水平接种传统疫苗的受试者中的免疫应答。
在一些实施方案中,所述受试者中的免疫应答等效于相对于所述RNA疫苗以50倍剂量水平接种传统疫苗的受试者中的免疫应答。
在一些实施方案中,所述受试者中的免疫应答等效于相对于所述RNA疫苗以100倍剂量水平接种传统疫苗的受试者中的免疫应答。
在一些实施方案中,所述受试者中的免疫应答等效于相对于所述RNA疫苗以10倍至1000倍剂量水平接种传统疫苗的受试者中的免疫应答。
在一些实施方案中,所述受试者中的免疫应答等效于相对于所述RNA疫苗以100倍至1000倍剂量水平接种传统疫苗的受试者中的免疫应答。
在一些实施方案中,通过测定受试者中的抗体效价来评估免疫应答。
在其他方面,本发明包括在受试者中引发针对的免疫应答的方法,所述方法通过以下方式来进行:向所述受试者施用RNA疫苗,所述RNA疫苗包含具有编码至少一种癌症抗原多肽或其免疫原性片段的开放阅读框的至少一种RNA多核苷酸,从而在所述受试者中诱导对所述抗原多肽或其免疫原性片段具有特异性的免疫应答,其中相对于接种预防有效剂量的针对所述癌症抗原的传统疫苗的受试者中诱导的免疫应答,所述受试者中的免疫应答提前2天至10周诱导。在一些实施方案中,所述受试者中的免疫应答在接种预防有效剂量的传统疫苗的受试者中相对于所述RNA疫苗以2倍至100倍的剂量水平诱导。
在一些实施方案中,相对于在接种预防有效剂量的传统疫苗的受试者中诱导的免疫应答,所述受试者中的免疫应答提前2天诱导。
在一些实施方案中,相对于在接种预防有效剂量的传统疫苗的受试者中诱导的免疫应答,所述受试者中的免疫应答提前3天诱导。在一些实施方案中,相对于在接种预防有效剂量的传统疫苗的受试者中诱导的免疫应答,所述受试者中的免疫应答提前1周诱导。
在一些实施方案中,相对于在接种预防有效剂量的传统疫苗的受试者中诱导的免疫应答,所述受试者中的免疫应答提前2周诱导。
在一些实施方案中,相对于在接种预防有效剂量的传统疫苗的受试者中诱导的免疫应答,所述受试者中的免疫应答提前3周诱导。
在一些实施方案中,相对于在接种预防有效剂量的传统疫苗的受试者中诱导的免疫应答,所述受试者中的免疫应答提前5周诱导。
在一些实施方案中,相对于在接种预防有效剂量的传统疫苗的受试者中诱导的免疫应答,所述受试者中的免疫应答提前10周诱导。
通过向受试者施用具有编码第一抗原多肽的开放阅读框的癌症RNA疫苗来在受试者中引发针对癌症的免疫应答的方法,其中所述RNA多核苷酸不包含稳定化元件,并且其中佐剂不与所述疫苗共同配制或共同施用。
在其他方面,本发明包括产生包含1000与3000个之间的核苷酸的编码多联癌抗原的mRNA的方法,所述方法包括:
(a)使包含编码多联癌抗原的开放阅读框的第一多核苷酸和包含5'-UTR的第二多核苷酸结合至与固体载体缀合的多核苷酸;
(b)在适合条件下使所述第二多核苷酸的3'-末端连接至所述第一多核苷酸的5'-末端,其中所述适合条件包括DNA连接酶,由此产生第一连接产物;
(c)在适合条件下使包含3'-UTR的第三多核苷酸的5’末端连接至所述第一连接产物的3’-末端,其中所述适合条件包括RNA连接酶,由此产生第二连接产物;以及
(d)使所述第二连接产物从所述固体载体释放,由此产生包含1000与3000个核苷酸的编码多联癌抗原的mRNA。在所提供的组合物或方法中的任一项的一些实施方案中,mRNA编码一种或多种频发多态性。在一些实施方案中,一种或多种频发多态性包含p53中的频发体细胞癌突变。在一些此类实施方案中,p53中的一种或多种频发体细胞癌突变选自由以下组成的组:
(1)在规范5'剪接位点处邻近密码子p.T125的突变;
(2)在规范5'剪接位点处邻近密码子p.331的突变;
(3)在规范3'剪接位点处邻近密码子p.126的突变;
(4)在规范5'剪接位点处邻近密码子p.224的突变,从而诱导隐蔽选择性内含子5'剪接位点。
在一些实施方案中,本发明提供了包含编码开放阅读框(ORF)的mRNA的癌症治疗性疫苗,所述开放阅读框编码新抗原肽(1)至(4)中的一者或多者。在一些实施方案中,本发明提供了基于患者的肿瘤含有任何以上突变来选择性施用含有或编码肽(1)-(4)中的一者或多者的疫苗。在一些实施方案中,本发明提供了基于以下双重准则来选择性施用疫苗:受试者的肿瘤含有任何以上突变以及受试者的正常HLA类型含有被预测为结合至所得新抗原的相应HLA等位基因。
在本发明的其他方面中提供了用个人化mRNA癌症疫苗治疗受试者的方法,所述方法通过以下方式来进行:通过分析所述样品中的患者转录组和/或患者外显子组来鉴定一组新表位以产生患者特异性突变组,基于MHC结合强度、MHC结合多样性、预测的免疫原性程度、低自身反应性和/或T细胞反应性来从所述突变组中选择一组用于疫苗的新表位,制备所述mRNA疫苗以编码所述组新表位,以及在从所述受试者分离所述样品的2个月内向所述受试者施用所述mRNA疫苗。在一些实施方案中,在从所述受试者分离样品的一个月内向所述受试者施用所述mRNA疫苗。
在其他方面,本发明包括鉴定用于个人化mRNA癌症疫苗中的一组新表位的方法,所述癌症疫苗具有一种或多种编码所述组新表位的多核苷酸,所述方法通过以下方式来进行:a.通过分析患者转录组和患者外显子组来鉴定患者特异性突变组,b.使用所述新表位的基于以下中的至少三者的加权值来从所述突变组中选择15-500种新表位的子集:在患者RNA-seq中对基因或转录物水平表达的评估;变体识别置信度评分;RNA-seq等位基因特异性表达;保守性氨基酸取代对非保守性氨基酸取代;点突变的位置(关于增加的TCR接合的中心化评分);点突变的位置(关于差异性HLA结合的锚定评分);自身性:与患者WES数据具有<100%核心表位同源性;HLA-A和HLA-B对8聚体-11聚体的IC50;HLA-DRB1对15聚体-20聚体的IC50;杂乱评分(即预期结合的患者HLA的数量);HLA-C对8聚体-11聚体的IC50;HLA-DRB3-5对15聚体-20聚体的IC50;HLA-DQB1/A1对15聚体-20聚体的IC50;HLA-DPB1/A1对15聚体-20聚体的IC50;I类相对于II类比例;涵盖的患者HLA-A、HLA-B和DRB1同种异型的多样性;点突变相对于复杂表位(例如移码)的比例;和/或假表位HLA结合评分,以及c.基于最高加权值来从所述子集中选择所述组用于个人化mRNA癌症疫苗中的新表位,其中所述组新表位包含15-40种新表位。
在一些实施方案中,对本文所述的核酸疫苗进行化学修饰。在一些实施方案中,所述核酸疫苗未修饰。
一些方面提供用于对受试者接种疫苗的组合物和对受试者接种疫苗的方法,所述方法包括向所述受试者施用包含一种或多种RNA多核苷酸的核酸疫苗,所述一种或多种RNA多核苷酸具有编码第一抗原多肽或多联多肽的开放阅读框,其中所述RNA多核苷酸不包含稳定化元件,并且其中佐剂不与所述疫苗共同配制或共同施用。
在其他方面,本发明是用于对受试者接种疫苗的组合物或对受试者接种疫苗的方法,所述方法包括向所述受试者施用包含一种或多种RNA多核苷酸的核酸疫苗,所述一种或多种RNA多核苷酸具有编码第一抗原多肽的开放阅读框,其中向所述受试者施用10ug/kg与400ug/kg之间剂量的所述核酸疫苗。在一些实施方案中,RNA多核苷酸的剂量是每剂量1-5ug、5-10ug、10-15ug、15-20ug、10-25ug、20-25ug、20-50ug、30-50ug、40-50ug、40-60ug、60-80ug、60-100ug、50-100ug、80-120ug、40-120ug、40-150ug、50-150ug、50-200ug、80-200ug、100-200ug、120-250ug、150-250ug、180-280ug、200-300ug、50-300ug、80-300ug、100-300ug、40-300ug、50-350ug、100-350ug、200-350ug、300-350ug、320-400ug、40-380ug、40-100ug、100-400ug、200-400ug或300-400ug。在一些实施方案中,所述核酸疫苗通过皮内或肌内注射施用至受试者。在一些实施方案中,所述核酸疫苗在第零天施用至受试者。在一些实施方案中,所述核酸疫苗的第二剂量在第二十一天施用至受试者。
在一些实施方案中,25微克剂量的RNA多核苷酸包含于施用至受试者的核酸疫苗中。在一些实施方案中,100微克剂量的RNA多核苷酸包含于施用至受试者的核酸疫苗中。在一些实施方案中,50微克剂量的RNA多核苷酸包含于施用至受试者的核酸疫苗中。在一些实施方案中,75微克剂量的RNA多核苷酸包含于施用至受试者的核酸疫苗中。在一些实施方案中,150微克剂量的RNA多核苷酸包含于施用至受试者的核酸疫苗中。在一些实施方案中,400微克剂量的RNA多核苷酸包含于施用至受试者的核酸疫苗中。在一些实施方案中,200微克剂量的RNA多核苷酸包含于施用至受试者的核酸疫苗中。在一些实施方案中,所述RNA多核苷酸在局部淋巴结中相较于远端淋巴结中以高100倍的水平累积。在一些实施方案中,对核酸疫苗进行化学修饰,并且在一些实施方案中,核酸疫苗未进行化学修饰。
本发明的方面提供核酸疫苗,所述核酸疫苗包含一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有编码第一抗原多肽或多联多肽的开放阅读框,其中所述RNA多核苷酸不包含稳定化元件;以及药学上可接受的载体或赋形剂,其中佐剂不包含于所述疫苗中。在一些实施方案中,稳定化元件是组蛋白茎-环。在一些实施方案中,稳定化元件是相对于野生型序列具有增加的GC含量的核酸序列。
本发明的方面提供核酸疫苗,所述核酸疫苗包含一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有编码第一抗原多肽的开放阅读框,其中所述RNA多核苷酸存在于用于体内施用至宿主的制剂中,所述制剂赋予对于可接受百分比的人受试者而言优于所述第一抗原的血清保护标准的抗体效价。在一些实施方案中,由本发明的mRNA疫苗产生的抗体效价是中和抗体效价。在一些实施方案中,中和抗体效价大于蛋白质疫苗。在一些实施方案中,由本发明的mRNA疫苗产生的中和抗体效价大于佐剂化蛋白质疫苗。在一些实施方案中,由本发明的mRNA疫苗产生的中和抗体效价是1,000-10,000、1,200-10,000、1,400-10,000、1,500-10,000、1,000-5,000、1,000-4,000、1,800-10,000、2000-10,000、2,000-5,000、2,000-3,000、2,000-4,000、3,000-5,000、3,000-4,000或2,000-2,500。中和效价通常表示为实现噬菌斑数量的50%减少所需的最高血清稀释度。
在优选的方面,本发明的疫苗(例如,包封LNP的mRNA疫苗)在接种疫苗的受试者的血液或血清中产生抗原特异性抗体的预防和/或治疗有效的水平、浓度和/或效价。如本文所定义,术语抗体效价是指在受试者(例如人受试者)中产生的抗原特异性抗体的量。在示例性实施方案中,抗体效价表示为仍然给出阳性结果的最大稀释度(在连续稀释中)的倒数。在示例性实施方案中,通过酶联免疫吸附测定(ELISA)测定或测量抗体效价。在示例性实施方案中,通过中和测定,例如通过微量中和测定来测定或测量抗体效价。在某些方面,抗体效价测量值以比率表示,例如1:40、1:100等。
在本发明的示例性实施方案中,有效的疫苗产生大于1:40、大于1:100、大于1:400、大于1:1000、大于1:2000、大于1:3000、大于1:4000、大于1:500、大于1:6000、大于1:7500、大于1:10000的抗体效价。在示例性实施方案中,到疫苗接种后10天、到疫苗接种后20天、到疫苗接种后30天、到疫苗接种后40天或到疫苗接种后50天或更多天产生或达到抗体效价。在示例性实施方案中,在向受试者施用单剂量的疫苗后产生或达到所述效价。在一些实施方案中,在多次剂量后,例如在第一和第二剂量(例如,加强剂量)后产生或达到所述效价。
在本发明的示例性方面,以μg/ml为单位测量抗原特异性抗体,或者以IU/L(国际单位/升)或mlU/ml(毫国际单位/ml)为单位测量抗原特异性抗体。在本发明的示例性实施方案中,有效的疫苗产生>0.5μg/ml、>0.1μg/ml、>0.2μg/ml、>0.35μg/ml、>0.5μg/ml、>1μg/ml、>2μg/ml、>5μg/ml或>10μg/ml。在本发明的示例性实施方案中,有效的疫苗产生>10mlU/ml、>20mlU/ml、>50mlU/ml、>100mlU/ml、>200mlU/ml、>500mlU/ml或>1000mlU/ml。在示例性实施方案中,到疫苗接种后10天、到疫苗接种后20天、到疫苗接种后30天、到疫苗接种后40天或到疫苗接种后50天或更多天产生或达到抗体水平或浓度。在示例性实施方案中,在向受试者施用单剂量的疫苗后产生或达到所述水平或浓度。在一些实施方案中,在多次剂量后,例如在第一和第二剂量(例如,加强剂量)后产生或达到所述水平或浓度。在示例性实施方案中,通过酶联免疫吸附测定(ELISA)来测定或测量抗体水平或浓度。在示例性实施方案中,通过中和测定,例如通过微量中和测定来测定或测量抗体水平或浓度。还提供了核酸疫苗,所述核酸疫苗包含一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有编码第一抗原多肽或多联多肽的开放阅读框,其中所述RNA多核苷酸存在于用于体内施用至宿主以用于引发比由具有稳定化元件或与佐剂一起配制且编码所述第一抗原多肽的mRNA疫苗引发的抗体效价更持久的高抗体效价的制剂中。在一些实施方案中,所述RNA多核苷酸被配制成在单次施用一周内产生中和抗体。在一些实施方案中,佐剂选自阳离子肽和免疫刺激性核酸。在一些实施方案中,阳离子肽是鱼精蛋白。
方面提供了核酸疫苗,所述核酸疫苗包含一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有包含至少一种化学修饰或任选地不包含核苷酸修饰的开放阅读框,所述开放阅读框编码第一抗原多肽或多联多肽,其中所述RNA多核苷酸存在于用于体内施用至宿主以使得所述宿主中的抗原表达水平显著超过由具有稳定化元件或与佐剂一起配制且编码所述第一抗原多肽的mRNA疫苗产生的抗原表达水平的制剂中。
其他方面提供了核酸疫苗,所述核酸疫苗包含一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有包含至少一种化学修饰或任选地不包含核苷酸修饰的开放阅读框的,所述开放阅读框编码第一抗原多肽或多联多肽,其中所述疫苗具有比未修饰的mRNA疫苗产生等效抗体效价所需的少至少10倍的RNA多核苷酸。在一些实施方案中,所述RNA多核苷酸以25-100微克的剂量存在。
本发明的方面还提供被配制用于递送至人受试者的单位使用疫苗,所述疫苗包含10ug与400ug之间的一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有包含至少一种化学修饰或任选地不包含核苷酸修饰的开放阅读框,所述开放阅读框编码第一抗原多肽或多联多肽;以及药学上可接受的载体或赋形剂。在一些实施方案中,所述疫苗还包含阳离子脂质纳米颗粒。
本发明的方面提供了产生、维持或恢复个体或个体群体中对肿瘤的抗原记忆的方法,所述方法包括向所述个体或群体施用抗原记忆加强核酸疫苗,所述疫苗包含(a)至少一种RNA多核苷酸,所述多核苷酸包含至少一种化学修饰或任选地不包含核苷酸修饰和两个或更多个密码子优化的开放阅读框,所述开放阅读框编码一组参考抗原多肽;以及(b)任选地药学上可接受的载体或赋形剂。在一些实施方案中,所述疫苗经由选自由以下组成的组的途径施用至个体:肌肉内施用、皮内施用和皮下施用。在一些实施方案中,施用步骤包括使受试者的肌肉组织与适合于注射所述组合物的装置相接触。在一些实施方案中,施用步骤包括使受试者的肌肉组织与适合于注射所述组合物与电穿孔的组合的装置相接触。
本发明的方面提供了对受试者接种疫苗的方法,所述方法包括以有效量向所述受试者施用25ug/kg与400ug/kg之间的单次剂量的核酸疫苗以对所述受试者接种疫苗,所述核酸疫苗包含一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有编码第一抗原多肽或多联多肽的开放阅读框。
其他方面提供了核酸疫苗,所述核酸疫苗包含一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有包含至少一种化学修饰的开放阅读框,所述开放阅读框编码第一抗原多肽或多联多肽,其中所述疫苗具有比未修饰的mRNA疫苗产生等效抗体效价所需的少至少10倍的RNA多核苷酸。在一些实施方案中,所述RNA多核苷酸以25-100微克的剂量存在。
其他方面提供了包含LNP配制的RNA多核苷酸的核酸疫苗,所述RNA多核苷酸具有不包含核苷酸修饰(未修饰)的开放阅读框,所述开放阅读框编码第一抗原多肽或多联多肽,其中所述疫苗具有比未在LNP中配制的未修饰的mRNA疫苗产生等效抗体效价所需的少至少10倍的RNA多核苷酸。在一些实施方案中,所述RNA多核苷酸以25-100微克的剂量存在。
在其他方面,本发明涵盖治疗60岁或60岁以上的老年受试者的方法,所述方法包括以有效量向所述受试者施用核酸疫苗以对所述受试者接种疫苗,所述核酸疫苗包含一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有编码抗原多肽或多联多肽的开放阅读框。
在其他方面,本发明涵盖治疗17岁或17岁以下的年轻受试者的方法,所述方法包括以有效量向所述受试者施用核酸疫苗以对所述受试者接种疫苗,所述核酸疫苗包含一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有编码抗原多肽或多联多肽的开放阅读框。
在其他方面,本发明涵盖治疗成人受试者的方法,所述方法包括以有效量向所述受试者施用核酸疫苗以对所述受试者接种疫苗,所述核酸疫苗包含一种或多种RNA多核苷酸,所述一种或多种RNA多核苷酸具有编码抗原多肽或多联多肽的开放阅读框。
在一些方面,本发明包括用包含编码抗原的至少两个核酸序列的组合疫苗对受试者接种疫苗的方法,其中疫苗的剂量是合并的治疗剂量,其中编码抗原的每种单独核酸的剂量是亚治疗剂量。在一些实施方案中,合并的剂量是施用至受试者的核酸疫苗中的25微克RNA多核苷酸。在一些实施方案中,合并的剂量是施用至受试者的核酸疫苗中的100微克RNA多核苷酸。在一些实施方案中,合并的剂量是施用至受试者的核酸疫苗中的50微克RNA多核苷酸。在一些实施方案中,合并的剂量是施用至受试者的核酸疫苗中的75微克RNA多核苷酸。在一些实施方案中,合并的剂量是施用至受试者的核酸疫苗中的150微克RNA多核苷酸。在一些实施方案中,合并的剂量是施用至受试者的核酸疫苗中的400微克RNA多核苷酸。在一些实施方案中,编码抗原的每种单独核酸的亚治疗剂量是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20微克。在一些实施方案中,对核酸疫苗进行化学修饰,并且在一些实施方案中,核酸疫苗未进行化学修饰。
其他组分
除了前述章节中描述的那些组分外,LNP还可包含一种或多种组分。在一些实施方案中,LNP可包含一种或多种小的疏水分子,如维生素(例如,维生素A或维生素E)和/或固醇。
脂质纳米颗粒还可包含一种或多种渗透性增强剂分子、碳水化合物、聚合物、表面改变剂或其他组分。渗透性增强剂分子可以是美国专利申请公布号2005/0222064中描述的分子,所述专利申请的内容以引用的方式整体并入本文。碳水化合物可包括单糖(例如,葡萄糖)和多糖(例如,糖原及其衍生物和类似物)。
聚合物可包含于LNP中和/或用于包封或部分包封LNP。聚合物可以是生物可降解的和/或生物相容的。聚合物可选自但不限于聚胺、聚醚、聚酰胺、聚酯、聚氨基甲酸酯、聚脲、聚碳酸酯、聚苯乙烯、聚酰亚胺、聚砜、聚氨酯、聚乙炔、聚乙烯、聚乙烯亚胺、聚异氰酸酯、聚丙烯酸、聚甲基丙烯酸酯、聚丙烯腈以及聚芳酯。在一些实施方案中,聚合物可包括聚(己内酯)(PCL)、乙烯乙酸乙烯酯聚合物(EVA)、聚(乳酸)(PLA)、聚(L-乳酸)(PLLA)、聚(乙醇酸)(PGA)、聚(乳酸-共-乙醇酸)(PLGA)、聚(L-乳酸-共-乙醇酸)(PLLGA)、聚(D,L-丙交酯)(PDLA)、聚(L-丙交酯)(PLLA)、聚(D,L-丙交酯-共-己内酯)、聚(D,L-丙交酯-共-己内酯-共-乙交酯)、聚(D,L-丙交酯-共-PEO-共-D,L-丙交酯)、聚(D,L-丙交酯-共-PPO-共-D,L-丙交酯)、聚氰基丙烯酸烷基酯、聚氨酯、聚-L-赖氨酸(PLL)、甲基丙烯酸羟丙酯(HPMA)、聚乙二醇、聚-L-谷氨酸、聚(羟基酸)、聚酸酐、聚原酸酯、聚(酯酰胺)、聚酰胺、聚(酯醚)、聚碳酸酯、聚烯烃如聚乙烯和聚丙烯、聚亚烷基二醇如聚(乙二醇)(PEG)、聚环氧烷(PEO)、聚对苯二甲酸亚烷基酯如聚(对苯二甲酸乙二醇酯)、聚乙烯醇(PVA)、聚乙烯醚、聚乙烯酯如聚(乙酸乙烯酯)、聚乙烯卤化物如聚(氯乙烯)(PVC)、聚乙烯吡咯烷酮(PVP)、聚硅氧烷、聚苯乙烯、聚氨酯、衍生的纤维素如烷基纤维素、羟烷基纤维素、纤维素醚、纤维素酯、硝基纤维素、羟丙基纤维素、羧甲基纤维素、丙烯酸的聚合物如聚((甲基)丙烯酸甲酯)(PMMA)、聚((甲基)丙烯酸乙酯)、聚((甲基)丙烯酸丁酯)、聚((甲基)丙烯酸异丁酯)、聚((甲基)丙烯酸己酯)、聚((甲基)丙烯酸异癸酯)、聚((甲基)丙烯酸月桂酯)、聚((甲基)丙烯酸苯酯)、聚(丙烯酸甲酯)、聚(丙烯酸异丙酯)、聚(丙烯酸异丁酯)、聚(丙烯酸十八烷基酯)及其共聚物和混合物、聚二氧杂环己酮及其共聚物、聚羟基烷酸酯、聚丙烯富马酸酯、聚甲醛、泊洛沙姆(poloxamer)、泊洛沙胺(poloxamine)、聚(原酸)酯、聚(丁酸)、聚(戊酸)、聚(丙交酯-共-己内酯)、三亚甲基碳酸酯、聚(N-丙烯酰吗啉)(PAcM)、具(2-甲基-2-噁唑啉)(PMOX)、具(2-乙基-2-噁唑啉)(PEOZ)以及聚甘油。
表面改变剂可包括但不限于阴离子蛋白(例如,牛血清白蛋白)、表面活性剂(例如,阳离子表面活性剂如二甲基双十八烷基溴化铵)、糖或糖衍生物(例如环糊精)、核酸、聚合物(例如,肝素、聚乙二醇和泊洛沙姆)、粘液溶解剂(例如,乙酰半胱氨酸、艾蒿、菠萝蛋白酶、木瓜蛋白酶、龙吐珠(clerodendrum)、溴己新、羧甲司坦、依普拉酮、美司钠、氨溴索、索布瑞醇、多米奥醇、来托司坦(letosteine)、司替罗宁(stepronin)、硫普罗宁(tiopronin)、凝溶胶蛋白、胸腺素β4、阿法链道酶、奈替克新和厄多司坦)以及DNA酶(例如,rhDNA酶)。可将表面改变剂设置在纳米颗粒内和/或在LNP的表面上(例如,通过包被、吸附、共价键联或其他工艺)。
LNP也可包含一种或多种官能化脂质。在一些实施方案中,脂质可用炔基官能化,所述炔基在适当的反应条件下暴露于叠氮化物时可经历环加成反应。特别地,脂质双层可用一种或多种可用于促进膜渗透、细胞识别或成像的基团以这种方式官能化。LNP的表面也可与一种或多种有用的抗体缀合。在靶向细胞递送、成像和膜渗透中有用的官能团和缀合物是本领域众所周知的。
除这些组分外,脂质纳米颗粒可包含在药物组合物中有用的任何物质。在一些实施方案中,脂质纳米颗粒可包含一种或多种药学上可接受的赋形剂或辅助成分,如但不限于一种或多种溶剂、分散介质、稀释剂、分散助剂、悬浮助剂、制粒助剂、崩解剂、填充剂、助流剂、液体媒介物、粘合剂、表面活性剂、等渗剂、增稠剂或乳化剂、缓冲剂、润滑剂、油、防腐剂以及其他物质。也可包含赋形剂,如蜡、黄油、着色剂、包衣剂、调味剂和芳香剂。药学上可接受的赋形剂在本领域中是众所周知的(参见例如Remington’s The Science andPractice of Pharmacy,第21版,A.R.Gennaro;Lippincott,Williams&Wilkins,Baltimore,MD,2006)。
稀释剂的实例可包括但不限于碳酸钙、碳酸钠、磷酸钙、磷酸二钙、硫酸钙、磷酸氢钙、磷酸钠、乳糖、蔗糖、纤维素、微晶纤维素、高岭土、甘露醇、山梨糖醇、肌醇、氯化钠、干淀粉、玉米淀粉、糖粉和/或它们的组合。成粒剂和分散剂可选自由以下组成的非限制性列表:土豆淀粉、玉米淀粉、木薯淀粉、羟乙酸淀粉钠、粘土、海藻酸、瓜尔胶、柑橘浆、琼脂、膨润土、纤维素和木材产品、天然海绵、阳离子交换树脂、碳酸钙、硅酸盐、碳酸钠、交联聚(乙烯基-吡咯烷酮)(交聚维酮)、羧甲基淀粉钠(羟乙酸淀粉钠)、羟甲基纤维素、交联羟甲基纤维素钠(交联羧甲纤维素)、甲基纤维素、预胶凝淀粉(淀粉1500)、微晶淀粉、水不可溶淀粉、羧甲基纤维素钙、硅酸镁铝
表面活性剂和/或乳化剂可包括但不限于天然乳化剂(例如,阿拉伯树胶、琼脂、海藻酸、海藻酸钠、黄芪胶、角叉菜属(chondrux)、胆固醇、黄原胶、果胶、明胶、蛋黄、酪蛋白、羊毛脂、胆固醇、蜡以及卵磷脂)、胶状粘土(例如膨润土[硅酸铝]和
结合剂可以是淀粉(例如,玉米淀粉和淀粉糊)、明胶、糖类(例如,蔗糖、葡萄糖、右旋糖、糊精、糖蜜、乳糖、乳糖醇、甘露醇)、天然胶和合成胶(例如,阿拉伯胶、海藻酸钠、角叉菜提取物、潘瓦尔胶(panwar gum)、印度胶(ghatti gum)、依莎贝果壳粘液(mucilage ofisapol husks)、羧甲基纤维素、甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、微晶纤维素、乙酸纤维素、聚(乙烯基-吡咯烷酮)、硅酸镁铝
防腐剂的实例可包括但不限于抗氧化剂、螯合剂、抗微生物防腐剂、抗真菌防腐剂、醇防腐剂、酸性防腐剂和/或其他防腐剂。抗氧化剂的实例包括但不限于α生育酚、抗坏血酸、棕榈酸抗坏血酸酯、丁羟茴醚、丁羟甲苯、单硫代甘油、焦亚硫酸钾、丙酸、没食子酸丙酯、抗坏血酸钠、亚硫酸氢钠、焦亚硫酸钠和/或亚硫酸钠。螯合剂的实例包括乙二胺四乙酸(EDTA)、柠檬酸单水合物、依地酸二钠、依地酸二钾、依地酸、富马酸、苹果酸、磷酸、依地酸钠、酒石酸和/或依地酸三钠。抗微生物防腐剂的实例包括但不限于苯扎氯铵、苄索氯铵、苄醇、溴硝醇、西曲溴铵、氯化十六烷基吡啶、氯己定、氯丁醇、氯甲酚、氯二甲苯酚、甲酚、乙醇、甘油、海克替啶、咪脲、苯酚、苯氧乙醇、苯乙醇、硝酸苯汞、丙二醇和/或硫柳汞。抗真菌防腐剂的实例包括但不限于对羟基苯甲酸丁酯、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、苯甲酸、羟基苯甲酸、苯甲酸钾、山梨酸钾、苯甲酸钠、丙酸钠和/或山梨酸。醇防腐剂的实例包括但不限于乙醇、聚乙二醇、苄醇、苯酚、酚类化合物、双酚、氯丁醇、羟基苯甲酸酯和/或苯乙醇。酸性防腐剂的实例包括但不限于维生素A、维生素C、维生素E、β-胡萝卜素、柠檬酸、乙酸、脱氢乙酸、抗坏血酸、山梨酸和/或植酸。其他防腐剂包括但不限于,生育酚、生育酚乙酸酯、甲磺酸去铁敏、溴化十六烷基三甲铵、丁羟茴醚(BHA)、丁羟甲苯(BHT)、乙二胺、月桂基硫酸钠(SLS)、月桂基乙醚硫酸钠(SLES)、亚硫酸氢钠、焦亚硫酸钠、亚硫酸钾、焦亚硫酸钾、
缓冲剂的实例包括但不限于柠檬酸盐缓冲溶液、乙酸盐缓冲溶液、磷酸盐缓冲溶液、氯化铵、碳酸钙、氯化钙、柠檬酸钙、葡乳醛酸钙、葡庚糖酸钙、葡糖酸钙、d-葡糖酸、甘油磷酸钙、乳酸钙、乳糖醛酸钙、丙酸、乙酰丙酸钙、戊酸、磷酸氢钙、磷酸、磷酸三钙、羟基磷酸钙、乙酸钾、氯化钾、葡糖酸钾、钾混合物、磷酸氢二钾、磷酸二氢钾、磷酸钾混合物、乙酸钠、碳酸氢钠、氯化钠、柠檬酸钠、乳酸钠、磷酸氢二钠、磷酸二氢钠、磷酸钠混合物、氨基丁三醇、氨基磺酸盐缓冲液(例如HEPES)、氢氧化镁、氢氧化铝、海藻酸、无热原水、等渗盐水、林格氏液、乙醇和/或它们的组合。润滑剂可选自由以下组成的非限制性组:硬脂酸镁、硬脂酸钙、硬脂酸、二氧化硅、滑石、麦芽、山嵛酸甘油酯、氢化植物油、聚乙二醇、苯甲酸钠、乙酸钠、氯化钠、亮氨酸、月桂基硫酸镁、月桂基硫酸钠以及它们的组合。
油的实例包括但不限于扁桃仁油、杏仁油、鳄梨油、巴巴苏油、佛手柑油、黑加仑种子油、琉璃苣油、杜松油、甘菊油、菜籽油、葛缕子(caraway)油、巴西棕榈油、蓖麻油、肉桂油、可可脂油、椰子油、鳕鱼肝油、咖啡油、玉米油、棉花籽油、鸸鹋(emu)油、桉树油、月见草油、鱼油、亚麻籽油、香叶醇油、葫芦油、葡萄种子油、榛子油、牛膝草(hyssop)油、肉豆寇酸异丙酯油、荷荷巴油、夏威夷果油、醒目薰衣草油、熏衣草油、柠檬油、山苍子(litseacubeba)油、澳洲坚果油、锦葵油、芒果种子油、白芒花籽油、水貂油、肉豆蔻油、橄榄油、橙油、橙连鳍鲑(orange roughy)油、棕榈油、棕榈仁油、桃仁油、花生油、罂粟籽油、南瓜籽油、油菜籽油、米糠油、迷迭香油、红花油、檀香油、山茶花(sasquana)油、香薄荷(savoury)油、沙棘油、芝麻油、乳木果油、硅酮油、大豆油、向日葵油、茶树油、蓟油、山茶(tsubaki)油、岩兰草油、胡桃油和小麦胚芽油,以及硬脂酸丁酯、辛酸甘油三酯、癸酸甘油三酯、环甲硅油、癸二酸二乙酯、聚二甲基硅氧烷360、肉豆蔻酸异丙酯、矿物油、辛基十二烷醇、油醇、硅油和/或它们的组合。
药物组合物
包含脂质纳米颗粒的制剂可全部或部分配制为药物组合物。药物组合物可包含一种或多种脂质纳米颗粒。在一些实施方案中,药物组合物可包含一种或多种脂质纳米颗粒,所述脂质纳米颗粒包含一种或多种不同的治疗剂和/或预防剂。药物组合物还可包含一种或多种药学上可接受的赋形剂或辅助成分,如本文所述的那些。用于配制和制造药物组合物和剂的一般准则可例如在Remington’s The Science and Practice of Pharmacy,第21版,A.R.Gennaro;Lippincott,Williams&Wilkins,Baltimore,MD,2006中获得。常规赋形剂和辅助成分可用于任何药物组合物中,除非任何常规的赋形剂或辅助成分可能与本公开的制剂中的LNP的一种或多种组分不相容。如果赋形剂或辅助成分与LNP的组分的组合可能导致任何不令人希望的生物学作用或其他有害作用,则所述赋形剂或辅助成分与制剂的LNP的组分不相容。
在一些实施方案中,一种或多种赋形剂或辅助成分可占包含LNP的药物组合物的总质量或体积的大于50%。在一些实施方案中,一种或多种赋形剂或辅助成分可构成药物组合物的50%、60%、70%、80%、90%或更多。在一些实施方案中,药学上可接受的赋形剂为至少95%、至少96%、至少97%、至少98%、至少99%或100%纯。在一些实施方案中,赋形剂被批准用于人和用于兽医使用。在一些实施方案中,赋形剂由美国食品与药品管理局批准。在一些实施方案中,赋形剂为药用级。在一些实施方案中,赋形剂满足美国药典(USP)、欧洲药典(EP)、英国药典和/或国际药典的标准。
根据本公开的药物组合物中的一种或多种脂质纳米颗粒、一种或多种药学上可接受的赋形剂和/或任何另外成分的相对量将取决于所治疗的受试者的身份、尺寸和/或疾患并且进一步取决于待施用组合物的途径而改变。举例来说,药物组合物可包含介于0.1%与100%(wt/wt)之间的一种或多种脂质纳米颗粒。作为另一个实例,药物组合物可包含介于0.1%与15%(wt/vol)之间的一种或多种两亲性聚合物(例如,0.5%、1%、2.5%、5%、10%或12.5%w/v)。
在一些实施方案中,将本公开的脂质纳米颗粒和/或药物组合物冷藏或冷冻以用于储存和/或运输(例如,储存在4℃或更低的温度,如介于约-150℃与约0℃℃之间或介于约-80℃与约-20℃之间的温度(例如,约-5℃、-10℃、-15℃、-20℃、-25℃、-30℃、-40℃、-50℃、-60℃、-70℃、-80℃、-90℃、-130℃或-150℃)。例如,包含一种或多种脂质纳米颗粒的药物组合物是溶液或固体(例如,通过冻干),其被冷藏以在例如约-20℃、-30℃、-40℃、-50℃、-60℃、-70℃或-80℃下储存和/或运输。在某些实施方案中,本公开还涉及通过将脂质纳米颗粒和/或其药物组合物储存在4℃或更低的温度,如介于约-150℃与约0℃之间或介于约-80℃与约-20℃之间的温度(例如约-5℃、-10℃、-15℃、-20℃、-25℃、-30℃、-40℃、-50℃、-60℃、-70℃、-80℃、-90℃、-130℃或-150℃)下来增加脂质纳米颗粒的稳定性的方法。
可将脂质纳米颗粒和/或包含一种或多种脂质纳米颗粒的药物组合物施用于任何患者或受试者,包括可受益于通过将治疗剂和/或预防剂递送至一种或多种特定细胞、组织、器官或其系统或组,如肾脏系统而提供的治疗作用的那些患者或受试者。尽管本文提供的脂质纳米颗粒和包含脂质纳米颗粒的药物组合物的描述主要涉及适用于向人施用的组合物,但是熟练的业内人士将理解此类组合物通常适用于向任何其他动物施用。修改适用于向人施用的组合物以便使得组合物适用于向各种动物施用为众所周知的,并且普通兽医药理学家可仅仅通过普通实验(如果存在)来设计和/或进行此种修改。考虑施用所述组合物的受试者包括但不限于人、其他灵长类动物和其他哺乳动物,包括商业相关的哺乳动物,如牛、猪、马、绵羊、猫、狗、小鼠和/或大鼠。
包含一种或多种脂质纳米颗粒的药物组合物可通过药理学领域中已知的或以后开发的任何方法来制备。通常,此类制备方法包括使活性成分与赋形剂和/或一种或多种其他辅助成分缔合,并且然后如果希望和/或必要,将产品划分、成形和/或包装为所需的单剂量或多剂量单位。
根据本公开的药物组合物可以单一单位剂量和/或以多个单一单位剂量大批量制备、包装和/或销售。如本文所用,“单位剂量”是包含预先确定的量的活性成分(例如脂质纳米颗粒)的药物组合物的离散量。活性成分的量通常等于将要向受试者施用的活性成分的剂量和/或这种剂量的合宜分数,例如像这种剂量的一半或三分之一。
药物组合物可以适合各种施用途径和方法的各种形式制备。在一些实施方案中,药物组合物可制备成液体剂型(例如,乳液、微乳液、纳米乳液、溶液、悬浮液、糖浆和酏剂)、可注射形式、固体剂型(例如,胶囊、片剂、丸剂、粉末和颗粒剂)、用于局部和/或经皮施用的剂型(例如,软膏剂、糊剂、乳膏剂、洗剂、凝胶、粉末、溶液、喷雾剂、吸入剂和贴剂)、悬浮液、粉末和其他形式。
用于口服和胃肠外施用的液体剂型包括但不限于药学上可接受的乳液、微乳液、溶液、悬浮液、糖浆和/或酏剂。除了活性成分以外,液体剂型还可包含在本领域中通常使用的惰性稀释剂,例如像水或其他溶剂、溶解剂和乳化剂如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、二甲基甲酰胺、油(特别为棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和脱水山梨糖醇的脂肪酸酯以及它们的混合物。除了惰性稀释剂以外,口服组合物还可包含另外的治疗剂和/或预防剂,另外的剂如湿润剂、乳化剂和悬浮剂、甜味剂、调味剂和/或芳香剂。在用于胃肠外施用的某些实施方案中,组合物与溶解剂如
可注射制剂,例如无菌可注射水性或油性悬浮液可根据已知技术使用合适的分散剂、湿润剂和/或悬浮剂配制。无菌可注射制剂可以是非毒性胃肠外可接受的稀释剂和/或溶剂中的无菌可注射溶液、悬浮液和/或乳液,如在1,3-丁二醇中的溶液。可采用的可接受的媒介物和溶剂是水、林格氏溶液(U.S.P.)和等渗氯化钠溶液。无菌、非挥发性油通常用作溶剂或悬浮介质。为了这个目的,可采用任何温和不挥发性油,包括合成的甘油单酯或甘油二酯。脂肪酸如油酸可用于可注射剂的制备中。
可注射制剂可例如通过经细菌截留过滤器过滤和/或通过并入呈无菌固体组合物形式的灭菌剂来进行灭菌,所述无菌固体组合物可在使用前溶解或分散于无菌水或其它无菌可注射介质中。
为了延长活性成分的作用,常常希望减缓对来自皮下注射或肌内注射的活性成分的吸收。这可通过使用水溶性不良的结晶或非晶物质的液体悬浮液来达成。药物的吸收速率取决于其溶解速率,而溶解速率又取决于晶体尺寸和结晶形式。或者,通过将药物溶解或悬浮于油媒介物中来实现胃肠外施用的药物形式的延迟吸收。可注射储库形式通过在生物可降解聚合物如聚丙交酯-聚乙交酯中形成药物的微囊化基质来制得。取决于药物与聚合物的比率以及所使用的特定聚合物的性质,可对药物释放的速率进行控制。其他生物可降解的聚合物的实例包括聚(原酸酯)和聚(酸酐)。储库可注射制剂通过将药物包埋在与身体组织相容的脂质体或微乳液中来制备。
用于直肠或阴道施用的组合物通常为栓剂,其可通过将组合物与在环境温度下为固体但在体温下为液体并且因此在直肠或阴道腔中熔化并释放活性成分的合适的非刺激性赋形剂如可可脂、聚乙二醇或栓剂蜡混合来制备。
用于经口施用的固体剂型包括胶囊、片剂、丸剂、粉末以及颗粒剂。在此类固体剂型中,活性成分与至少一种惰性药学上可接受的赋形剂如柠檬酸钠或磷酸二钙和/或填充剂或增量剂(例如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸)、粘合剂(例如羧甲基纤维素、海藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和阿拉伯树胶)、保湿剂(例如甘油)、崩解剂(例如琼脂、碳酸钙、土豆或木薯淀粉、海藻酸、某些硅酸盐和碳酸钠)、溶解延缓剂(例如石蜡)、吸收促进剂(例如季铵化合物)、湿润剂(例如鲸蜡醇和单硬脂酸甘油酯)、吸收剂(例如高岭土和膨润土、硅酸盐)以及润滑剂(例如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月桂基硫酸钠)以及它们的混合物混合。在胶囊、片剂和丸剂的情况下,剂型可以含缓冲剂。
类似类型的固体组合物可使用诸如乳糖(lactose或milk sugar)以及高分子量聚乙二醇等的赋形剂作为软填充和硬填充明胶胶囊中的填充剂。可制备具有诸如肠溶包衣和药物配制领域中熟知的其它包衣的包衣和外壳的片剂、糖衣丸、胶囊、丸剂以及颗粒剂的固体剂型。它们可任选地包含乳浊剂,并且可具有使其在肠道的某一部分中任选地以延迟方式仅仅或优先释放一种或多种活性成分的组成。可使用的包埋组合物的实例包括聚合物质和蜡。类似类型的固体组合物可使用诸如乳糖(lactose或milk sugar)以及高分子量聚乙二醇等的赋形剂作为软填充和硬填充明胶胶囊中的填充剂。
用于局部和/或透皮施用组合物的剂型可包括软膏剂、糊剂、乳膏剂、洗剂、凝胶、粉末、溶液、喷雾剂、吸入剂和/或贴剂。通常,在无菌条件下将活性成分与药学上可接受的赋形剂和/或任何所需的防腐剂和/或可能需要的缓冲剂混合。另外,本公开涵盖透皮贴剂的使用,所述透皮贴剂常常具有提供将化合物受控递送至身体的额外优点。此类剂型可例如通过将化合物溶解和/或分散于适当的介质中来制备。可替代地或另外地,可通过提供速率控制膜和/或通过将化合物分散于聚合物基质和/或凝胶中来控制速率。
用于递送本文描述的皮内药物组合物的适合装置包括如描述于美国专利4,886,499;5,190,521;5,328,483;5,527,288;4,270,537;5,015,235;5,141,496以及5,417,662中的那些短针装置。皮内组合物可通过限制针进入皮肤中的有效穿透长度的装置来施用,如描述于PCT公布WO 99/34850中的那些装置及其功能等效物。通过液体喷射注射器和/或通过穿刺角质层并产生到达真皮的射流的针将液体组合物递送至真皮的喷射注射装置为合适的。喷射注射装置例如描述于美国专利5,480,381;5,599,302;5,334,144;5,993,412;5,649,912;5,569,189;5,704,911;5,383,851;5,893,397;5,466,220;5,339,163;5,312,335;5,503,627;5,064,413;5,520,639;4,596,556;4,790,824;4,941,880;4,940,460以及PCT公布WO 97/37705和WO 97/13537中。使用压缩气体加速呈粉末形式的疫苗穿过皮肤外层到达真皮的弹道式粉末/颗粒递送装置是合适的。可替代地或另外地,常规注射器可用于皮内施用的经典芒图氏(mantoux)方法中。
适用于局部施用的制剂包括但不限于液体和/或半液体制剂如擦剂、洗剂、水包油和/或油包水乳液如乳膏剂、软膏剂和/或糊剂、和/或溶液和/或悬浮液。可局部施用的制剂可例如包含约1%至约10%(wt/wt)活性成分,虽然活性成分的浓度可高达所述活性成分在溶剂中的溶解度极限。用于局部施用的制剂还可包含本文所述的一种或多种另外成分。
药物组合物可以适用于经过口腔进行肺施用的制剂形式制备、包装和/或销售。这样的制剂可包含含有活性成分的干燥颗粒。此类组合物合宜地呈干粉末形式,所述干粉末使用包括可指导推进剂流向其以分散粉末的干粉末储器的装置和/或使用自推进溶剂/粉末分散容器如包括溶解和/或悬浮于密封容器中的低沸点推进剂中的活性成分的装置来施用。干粉末组合物可包含固体精细粉末稀释剂如糖并且合宜地以单位剂型提供。
低沸点推进剂通常包括在大气压力下具有低于65℉的沸点的液体推进剂。通常,推进剂可占组合物的50%至99.9%(wt/wt),并且活性成分可占组合物的0.1%至20%(wt/wt)。推进剂还可包含另外的成分,如液体非离子型和/或固体阴离子表面活性剂和/或固体稀释剂(其可具有与包含活性成分的颗粒相同数量级的粒度)。
配制用于肺部递送的药物组合物可以溶液和/或悬浮液的液滴形式提供活性成分。此类制剂可呈任选无菌的、包含活性成分的水性和/或稀释醇溶液和/或悬浮液形式制备、包装和/或销售,并且可合宜地使用任何喷雾和/或雾化装置施用。此类制剂还可包含一种或多种另外的成分,包括但不限于调味剂如糖精钠、挥发性油、缓冲剂、表面活性剂和/或防腐剂如羟基苯甲酸甲酯。通过这种施用途径提供的液滴可具有在约1nm至约200nm范围内的平均直径。
本文描述为适用于肺部递送的制剂适用于药物组合物的鼻内递送。适合用于鼻内施用的另一种制剂是包含活性成分且具有约0.2μm至500μm的平均颗粒的粗糙粉末。这种制剂以采用鼻吸的方式施用,即通过从置于鼻子附近的粉末容器快速吸入穿过鼻通道。
适用于鼻施用的制剂可例如包含少至0.1%(wt/wt)并且多至100%(wt/wt)的活性成分,并且可包含本文描述的一种或多种另外成分。药物组合物可以适用于经颊施用的制剂形式制备、包装和/或销售。此类制剂可例如以使用常规方法制得的片剂和/或锭剂的形式存在,并且可例如包含0.1%至20%(wt/wt)活性成分,其余包含经口可溶解和/或可降解的组合物和任选地本文描述的一种或多种另外成分。或者,适用于经颊施用的制剂可包含含有活性成分的粉末和/或气雾化和/或雾化的溶液和/或悬浮液。此类粉状、气雾化和/或气雾化的制剂在分散时可具有在约0.1nm至约200nm范围内的平均颗粒和/或液滴大小,并且还可包含一种或多种本文描述的任何另外成分。
药物组合物可以适用于眼部施用的制剂形式制备、包装和/或销售。此类制剂可例如以滴眼剂的形式存在,包括例如活性成分在水性或油性液体赋形剂中的0.1%/1.0%(wt/wt)溶液和/或悬浮液。此类滴剂还可包含缓冲剂、盐和/或一种或多种本文描述的其他任何另外成分。有用的其他眼部可施用的制剂包括呈微晶形式和/或呈脂质体制剂形式的包含活性成分的那些。滴耳剂和/或滴眼剂涵盖在本公开的范围内。
在细胞中产生多肽的方法
本公开提供了在哺乳动物细胞中产生目标多肽的方法。产生多肽的方法包括使细胞与本公开的包含LNP的制剂接触,所述LNP包含编码目标多肽的mRNA。当使细胞与脂质纳米颗粒接触后,mRNA可被吸收并在细胞中翻译以产生目标多肽。
通常,使哺乳动物细胞与包含编码目标多肽的mRNA的LNP接触的步骤可在体内、离体、在培养物中或在体外进行。与细胞接触的脂质纳米颗粒的量和/或其中的mRNA的量可取决于所接触的细胞或组织的类型、施用方式、脂质纳米颗粒和其中的mRNA的物理化学特性(例如大小、电荷和化学组成)以及其他因素。通常,有效量的脂质纳米颗粒将允许细胞中的有效多肽产生。效率的度量标准可包括多肽翻译(由多肽表达指示)、mRNA降解水平和免疫应答指标。
使包含mRNA的LNP与细胞接触的步骤可能涉及或引起转染。LNP的脂质组分中包含的磷脂可例如通过与细胞或细胞内膜相互作用和/或融合而促进转染和/或提高转染效率。转染可允许细胞内mRNA的翻译。
在一些实施方案中,本文所述的脂质纳米颗粒可治疗性地使用。例如,LNP中包含的mRNA可编码治疗性多肽(例如,在可翻译区中),并且在接触和/或进入(例如,转染)到细胞中时产生所述治疗性多肽。在一些实施方案中,LNP中包含的mRNA可编码可改善或增加受试者的免疫力的多肽。在一些实施方案中,mRNA可编码粒细胞集落刺激因子或曲妥珠单抗。
在一些实施方案中,LNP中包含的mRNA可编码重组多肽,所述重组多肽可置换与脂质纳米颗粒接触的细胞中可能基本上不存在的一种或多种多肽。由于编码基因的遗传突变或其调控途径,可能缺乏一种或多种基本上不存在的多肽。可替代地,通过mRNA的翻译产生的重组多肽可拮抗存在于细胞中、细胞表面上或从细胞分泌的内源性蛋白质的活性。可能希望拮抗性重组多肽对抗由内源性蛋白的活性引起的有害作用,如活性改变或由突变引起的定位。在另一个替代方案中,通过mRNA的翻译产生的重组多肽可间接或直接拮抗存在于细胞中、细胞表面上或从细胞分泌的生物部分的活性。拮抗的生物部分可包括但不限于脂质(例如胆固醇)、脂蛋白(例如低密度脂蛋白)、核酸、碳水化合物和小分子毒素。通过mRNA的翻译产生的重组多肽可被工程化以定位在细胞内,如在特定的区室如细胞核内,或者可被工程化以从细胞分泌至或易位至细胞的质膜。
在一些实施方案中,使细胞与包含mRNA的LNP接触可减少细胞对外源性核酸的先天性免疫应答。可使细胞与包含第一量的包含可翻译区的第一外源性mRNA的第一脂质纳米颗粒接触,并且可测定所述细胞对所述第一外源性mRNA的先天性免疫应答的水平。随后,可使所述细胞与包含第二量的第一外源性mRNA的第二组合物接触,与所述第一量相比,所述第二量是较少量的第一外源性mRNA。可替代地,第二组合物可包含第一量的不同于第一外源性mRNA的第二外源性mRNA。使所述细胞与第一和第二组合物接触的步骤可重复一次或多次。另外,可任选地确定细胞中多肽产生(例如,翻译)的效率,并且可使细胞与第一和/或第二组合物反复重复接触,直到达到目标蛋白质产生效率。
向细胞和器官递送治疗剂的方法
本公开提供了将治疗剂和/或预防剂(如核酸)递送至哺乳动物细胞或器官的方法。将治疗剂和/或预防剂递送至细胞涉及向受试者施用本公开的制剂,所述制剂包含LNP,所述LNP包含治疗剂和/或预防剂(如核酸),其中所述组合物的施用包括使所述细胞与所述组合物接触。在一些实施方案中,可将蛋白质、细胞毒性剂、放射性离子、化学治疗剂或核酸(如RNA,例如mRNA)递送至细胞或器官。在治疗剂和/或预防剂是mRNA的情况下,当使细胞与脂质纳米颗粒接触时,可翻译的mRNA可在细胞中翻译以产生目标多肽。然而,基本上不可翻译的mRNA也可递送至细胞。基本上不可翻译的mRNA可用作疫苗和/或可隔离细胞的翻译组分以减少细胞中其他物质的表达。
在一些实施方案中,LNP可靶向特定类型或类别的细胞(例如,特定器官或其系统的细胞)。在一些实施方案中,可将包含目标治疗剂和/或预防剂的LNP特异性地递送至哺乳动物肝脏、肾脏、脾脏、股骨或肺。特异性递送至特定类别的细胞、器官或其系统或组意味着例如在向哺乳动物施用LNP后,相对于其他目的地,更高比例的包含治疗剂和/或预防剂的脂质纳米颗粒被递送至目标目的地(例如组织)。在一些实施方案中,特异性递送可使得相较于另一目的地(例如脾脏),每1g靶向目的地的组织(例如,目标组织,如肝脏)中治疗剂和/或预防剂的量增加大于2倍、5倍、10倍、15倍或20倍。在一些实施方案中,目标组织选自由以下组成的组:肝脏、肾脏、肺、脾脏、股骨、血管中的血管内皮(例如冠状动脉内或股骨内)或肾脏以及肿瘤组织(例如,通过肿瘤内注射)。
作为靶向或特异性递送的另一个实例,编码蛋白结合配偶体(例如抗体或其功能片段、支架蛋白或肽)或细胞表面上的受体的mRNA可包含于LNP中。mRNA可另外地或替代地用于指导脂质、碳水化合物或其他生物部分的合成和细胞外定位。可替代地,LNP的其他治疗剂和/或预防剂或要素(例如,脂质或配体)可基于它们对特定受体(例如低密度脂蛋白受体)的亲和力进行选择,以使得LNP可以更容易地与包含所述受体靶细胞群体相互作用。在一些实施方案中,配体可包括但不限于特异性结合对的成员、抗体、单克隆抗体、Fv片段、单链Fv(scFv)片段、Fab'片段、F(ab')2片段、单结构域抗体、骆驼化抗体及其片段、人源化抗体及其片段以及它们的多价型式;多价结合试剂,包括单特异性或双特异性抗体,如二硫键稳定的Fv片段、scFv串联、双抗体、三抗体或四抗体;以及适体、受体和融合蛋白。
在一些实施方案中,配体可以是表面结合抗体,其可容许调整细胞靶向特异性。这尤其有用,因为高度特异性的抗体可针对用于所需靶向位点的目标表位而产生。在一些实施方案中,多种抗体在细胞的表面上表达,并且每种抗体可对所需靶标具有不同的特异性。此类方法可增加靶向相互作用的亲合力和特异性。
配体可例如由生物学领域的技术人员基于所需的细胞定位或功能来选择。在一些实施方案中,雌激素受体配体(如他莫昔芬)可使细胞靶向在细胞表面上具有增加的雌激素受体数量的雌激素依赖性乳腺癌细胞。配体/受体相互作用的其它非限制性实例包括CCR1(例如,用于治疗类风湿关节炎和/或多发性硬化中的发炎关节组织或脑)、CCR7、CCR8(例如,靶向淋巴结组织)、CCR6、CCR9、CCR10(例如,靶向肠组织)、CCR4、CCR10(例如用于靶向皮肤)、CXCR4(例如,用于一般的增强的移行)、HCELL(例如用于治疗炎症和炎性病症、骨髓)、α4β7(例如用于肠粘膜靶向)以及VLA-4NCAM-1(例如靶向内皮)。通常,涉及靶向(例如,癌症转移)的任何受体可用于本文描述的方法和组合物中。
靶向细胞可包括但不限于肝细胞、上皮细胞、造血细胞、上皮细胞、内皮细胞、肺细胞、骨细胞、干细胞、间质细胞、神经细胞、心脏细胞、脂肪细胞、血管平滑肌细胞、心肌细胞、骨骼肌细胞、β细胞、垂体细胞、滑液衬里细胞、卵巢细胞、睾丸细胞、成纤维细胞、B细胞、T细胞、网织红细胞、白细胞、粒细胞和肿瘤细胞。
在一些实施方案中,LNP可靶向肝细胞。载脂蛋白如载脂蛋白E(apoE)已显示与体内中性或接近中性的含脂质的脂质纳米颗粒缔合,并且已知与肝细胞表面上发现的受体如低密度脂蛋白受体(LDLR)缔合。因此,施用于受试者的包含具有中性或接近中性电荷的脂质组分的LNP可在受试者体内获得apoE,并且可随后以靶向方式向包含LDLR的肝细胞递送治疗剂和/或预防剂(例如,RNA)。
治疗疾病和病症的方法
脂质纳米颗粒可用于治疗疾病、病症或疾患。特别地,此类组合物可用于治疗以缺失或异常蛋白质或多肽活性为特征的疾病、病症或疾患。在一些实施方案中,可将本公开的包含LNP的制剂施用或递送至细胞,所述LNP包含编码缺失或异常多肽的mRNA。随后的mRNA翻译可产生多肽,从而减少或消除由于缺乏所述多肽或由所述多肽引起的异常活性引起的问题。因为翻译可快速发生,所以所述方法和组合物可用于治疗急性疾病、病症或疾患,如败血症、中风和心肌梗塞。LNP中包含的治疗剂和/或预防剂也可能能够改变给定物质的转录速率,从而影响基因表达。
可针对其施用组合物的以功能障碍性或异常蛋白质或多肽活性为特征的疾病、病症和/或疾患包括但不限于罕见疾病、感染性疾病(作为疫苗和治疗剂两者)、癌症和增生性疾病、遗传疾病(例如,囊性纤维化)、自身免疫性疾病、糖尿病、神经退行性疾病、心血管和肾血管疾病以及代谢疾病。多种疾病、病症和/或疾患的特征可在于蛋白质活性缺失(或显著降低,以致适当的蛋白质功能不存在)。此类蛋白质可能不存在,或者它们可能基本上没有功能。功能障碍性蛋白质的具体实例是囊性纤维化跨膜传导调控因子(CFTR)基因的错义突变变体,其产生引起囊性纤维化的CFTR蛋白的功能障碍性蛋白质变体。本公开提供了通过施用包含RNA和脂质组分的LNP来治疗受试者中的此类疾病、病症和/或疾患的方法,所述脂质组分包括根据式(I)的脂质、磷脂(任选地不饱和)、PEG脂质和结构脂质,其中所述RNA可以是编码可拮抗或克服受试者细胞中存在的异常蛋白质活性的多肽的mRNA。
本公开提供了涉及施用包含一种或多种治疗剂和/或预防剂(如核酸)的脂质纳米颗粒的方法,以及包含所述脂质纳米颗粒的药物组合物。关于本公开的特征和实施方案,术语治疗剂和预防剂在本文中可互换使用。可使用对于疾病、病症和/或疾患预防、治疗、诊断或成像和/或任何其他目的有效的任何合理量和任何施用途径向受试者施用治疗性组合物或其成像组合物、诊断组合物或预防组合物。施用至给定受试者的具体量可取决于受试者的种类、年龄和一般状况;施用的目的;特定组合物;施用方式等变化。根据本公开的组合物可被配制成便于施用和剂量均匀的剂量单位形式。然而,应理解的是,本公开的组合物的每日总剂量将由主治医师在合理医学判断范围内决定。任何特定患者的具体治疗有效、预防有效或其它适当的剂量水平(例如,用于成像)将取决于各种因素,所述因素包括所治疗的病症的严重性和鉴定,如果存在;所采用的一种或多种治疗剂和/或预防剂;所采用的具体组合物;患者的年龄、体重、一般健康状况、性别和饮食;所采用的具体药物组合物的施用时间、施用途径和排泄速率;治疗的持续时间;与所采用的具体药物组合物组合或同时使用的药物;以及医学领域中熟知的类似因素。
可通过任何途径施用包含一种或多种治疗剂和/或预防剂(如核酸)的LNP。在一些实施方案中,通过多种途径中的一种或多种施用包含本文所述的一种或多种脂质纳米颗粒的组合物(包括预防组合物、诊断组合物或成像组合物),所述途径包括经口、静脉内、肌肉内、动脉内、髓内、鞘内、皮下、心室内、经皮或皮内、真皮间、直肠、阴道内、腹膜内、局部(例如,通过粉末、软膏剂、乳膏剂、凝胶、洗剂和/或滴剂)、粘膜、经鼻、经颊、经肠、肠内、玻璃体内、肿瘤内、舌下、鼻内;通过气管内滴注、支气管滴注和/或吸入;作为口服喷雾剂和/或粉末、鼻喷雾剂和/或气雾剂,和/或通过门静脉导管。在一些实施方案中,可静脉内、肌肉内、皮内、动脉内、肿瘤内、皮下或通过吸入施用组合物。然而,考虑到药物递送科学中可能的进展,本公开涵盖通过任何合适的途径递送或施用本文所述的组合物。通常,最合适的施用途径将取决于多种因素,所述因素包括包含一种或多种治疗剂和/或预防剂的脂质纳米颗粒的性质(例如,其在各种身体环境如血流和胃肠道中的稳定性)、患者的状况(例如,患者是否能够耐受特定的施用途径)等。
在某些实施方案中,可以足以递送约0.0001mg/kg至约10mg/kg、约0.001mg/kg至约10mg/kg、约0.005mg/kg至约10mg/kg、约0.01mg/kg至约10mg/kg、约0.05mg/kg至约10mg/kg、约0.1mg/kg至约10mg/kg、约1mg/kg至约10mg/kg、约2mg/kg至约10mg/kg、约5mg/kg至约10mg/kg、约0.0001mg/kg至约5mg/kg、约0.001mg/kg至约5mg/kg、约0.005mg/kg至约5mg/kg、约0.01mg/kg至约5mg/kg、约0.05mg/kg至约5mg/kg、约0.1mg/kg至约5mg/kg、约1mg/kg至约5mg/kg、约2mg/kg至约5mg/kg、约0.0001mg/kg至约2.5mg/kg、约0.001mg/kg至约2.5mg/kg、约0.005mg/kg至约2.5mg/kg、约0.01mg/kg至约2.5mg/kg、约0.05mg/kg至约2.5mg/kg、约0.1mg/kg至约2.5mg/kg、约1mg/kg至约2.5mg/kg、约2mg/kg至约2.5mg/kg、约0.0001mg/kg至约1mg/kg、约0.001mg/kg至约1mg/kg、约0.005mg/kg至约1mg/kg、约0.01mg/kg至约1mg/kg、约0.05mg/kg至约1mg/kg、约0.1mg/kg至约1mg/kg、约0.0001mg/kg至约0.25mg/kg、约0.001mg/kg至约0.25mg/kg、约0.005mg/kg至约0.25mg/kg、约0.01mg/kg至约0.25mg/kg、约0.05mg/kg至约0.25mg/kg或约0.1mg/kg至约0.25mg/kg的给定剂量的治疗剂和/或预防剂(例如,mRNA)的剂量水平施用根据本公开的组合物,其中1mg/kg(mpk)的剂量提供每1kg受试者体重1mg的治疗剂和/或预防剂。在一些实施方案中,可施用约0.001mg/kg至约10mg/kg的LNP的治疗剂和/或预防剂(例如,mRNA)的剂量。在一些实施方案中,可施用约0.005mg/kg至约2.5mg/kg的治疗剂和/或预防剂的剂量。在某些实施方案中,可施用约0.1mg/kg至约1mg/kg的剂量。在一些实施方案中,可施用约0.05mg/kg至约0.25mg/kg的剂量。剂量可以相同或不同的量每天一次或多次施用,以获得所需水平的mRNA表达和/或治疗、诊断、预防或成像效果。所希望的剂量可以例如通过以下方式递送:一天三次、一天两次、一天一次、两天一次、三天一次、一周一次、两周一次、三周一次或四周一次。在某些实施方案中,可使用多次施用(例如,两次、三次、四次、五次、六次、七次、八次、九次、十次、十一次、十二次、十三次、十四次或更多次施用)递送所需的剂量。在一些实施方案中,可例如在外科手术之前或之后或在急性疾病、病症或疾患的情况下施用单剂量。
包含一种或多种治疗剂和/或预防剂(如核酸)的脂质纳米颗粒可与一种或多种其他治疗剂、预防剂、诊断剂或成像剂组合使用。“组合”并非意图暗示剂必须同时施用和/或被配制用于一起递送,虽然这些递送方法在本公开的范围内。在一些实施方案中,可组合施用包含一种或多种不同的治疗剂和/或预防剂的一种或多种脂质纳米颗粒。组合物可在一种或多种其他所需的治疗剂或医学程序同时、之前或之后施用。通常,每种剂将在一定剂量下和/或根据针对所述剂确定的时间表施用。在一些实施方案中,本公开涵盖与改进其生物利用度、减少和/或改变其代谢、抑制其排泄和/或改变其在身体内分布的剂组合递送组合物或成像组合物、诊断组合物或预防组合物。
将进一步了解的是,组合使用的治疗活性剂、预防活性剂、诊断活性剂或成像活性剂可以单一组合物一起施用或以不同的组合物分开施用。通常,预期组合使用的剂将在不超过它们单独使用的水平下使用。在一些实施方案中,组合使用的水平可低于单独使用的那些水平。
用于以组合方案使用的疗法(治疗剂或程序)的特定组合将考虑到所需治疗剂和/或程序和要实现的所需治疗效果的可相容性。还应了解,所采用的疗法可针对相同病症实现所需效果(例如,可用于治疗癌症的组合物可与化学治疗剂同时施用),或者它们可实现不同效果(例如,控制任何不利作用,如灌注相关反应)。
LNP可与用于增加组合物的有效性和/或治疗窗的剂组合使用。这种剂可以是例如抗炎化合物、类固醇(例如皮质类固醇)、他汀类、雌二醇、BTK抑制剂、S1P1激动剂、糖皮质激素受体调节剂(GRM)或抗组胺。在一些实施方案中,LNP可与地塞米松、甲氨蝶呤、对乙酰氨基酚、H1受体阻滞剂或H2受体阻滞剂组合使用。在一些实施方案中,治疗有需要的受试者或向受试者(例如,哺乳动物)递送治疗剂和/或预防剂的方法可包括在施用LNP之前用一种或多种剂对所述受试者进行预治疗。在一些实施方案中,可用有用量(例如,10mg、20mg、30mg、40mg、50mg、60mg、70mg、80mg、90mg、100mg或任何其他有用量)的地塞米松、甲氨蝶呤、对乙酰氨基酚、H1受体阻滞剂或H2受体阻滞剂对受试者进行预治疗。预治疗可在施用脂质纳米颗粒之前24小时或更少小鼠(例如24小时、20小时、16小时、12小时、8小时、4小时、2小时、1小时、50分钟、40分钟、30分钟、20分钟或10分钟)发生,并且可例如以递增剂量的量发生一次、两次或更多次。
本领域的技术人员将认识到,或仅使用常规实验就能够确定本文描述的根据本公开的具体实施方案的许多等效物。本公开的范围不意图限于以上描述,而是如所附权利要求书中所阐述。
在权利要求中,除非相反指出或另外从上下文明显看出,否则冠词如“一个/种(a/an)”以及“所述(the)”可意指一个或多于一个。除非相反指出或另外从上下文明显看出,否则如果一个、多于一个或所有组成员存在于、被用于或以其他方式关联于给定的产物或方法,那么认为包括在组的一个或多个成员之间的“或”的权利要求或描述得到了满足。本公开包括其中恰有组中的一个成员存在于、被用于或以其他方式关联于给定产物或方法的实施方案。本公开包括其中多于一个或所有的组成员存在于、被用于或以其他方式关联于给定产物或方法的实施方案。
还应该注意术语“包含”意图为开放的并且容许但并非要求包括另外的要素或步骤。当本文中使用术语“包含”时,因此还涵盖并且公开术语“基本上由……组成”和“由……组成”。在整个说明书中,在组合物被描述为具有、包括或包含特定组分的情况下,预期组合物也基本上由所列举的组分组成或由所列举的组分组成。类似地,在将方法或工艺描述为具有,包括或包括特定工艺步骤的情况下,所述工艺也基本上由所列举的加工步骤组成或由所列举的加工步骤组成。此外,应了解,只要本发明仍可操作,则步骤的顺序或进行某些操作的顺序是不重要的。此外,两个或多个步骤或操作可同时进行。
在给出范围时,端点被包括在内。此外,应了解,除非另外指出或另外从上下文和本领域普通技术人员的理解显而易见,否则在本公开的不同实施方案中,表述为范围的值可假定为所述范围内的任何特定值或子范围,到所述范围的下限的单位的十分之一,除非在上下文中另有明确规定。
另外,应了解,在现有技术内的本公开的任何特定实施方案可从任何一个或多个权利要求中明确排除。因为认为此类实施方案为本领域普通技术人员所已知的,即使本文没有明确阐述排除,也可排除它们。
所有引用的来源例如参考文献、出版物、专利申请、数据库、数据库条目和本文引用的技术均以引用的方式并入本申请,即使在引用中没有明确陈述。在引用的来源和本申请的陈述冲突的情况下,应当以本申请中的陈述为准。
在已描述本公开的情况下,提供以下实施例以作说明而非限制。
实施例
实施例1:有机可溶性mRNA的制备
已经发现,mRNA可溶解于有机溶剂中,以使得能够使用多种纳米颗粒递送平台和方法进行配制。有机可溶性mRNA可简化纳米沉淀过程中的混合要求(图1)。混合的简化显示了实现高通量配制方法和对于床边应用考虑的策略的前景。mRNA的中间体盐使mRNA能够通过有机相并入纳米颗粒中。在限制颗粒形成之前和过程中的控制的工艺中,标准LNP配制技术依赖于在颗粒配制过程中从水性流中提取mRNA。
由水溶性mRNA直接形成阳离子脂质-mRNA盐具有挑战性。将水性mRNA和阳离子脂质混合通常导致界面沉淀,其中沉淀物不再是水溶性的,但通常也不溶于有机溶剂中。快速沉淀可导致阳离子交换效率低下,其中产物是同时含有亲水性(例如钠)和疏水性(例如阳离子脂质)抗衡离子的mRNA盐。因此,检查了通过跨水性和有机溶解度谱的中间体mRNA盐形式进行。中间体盐形式(例如TBA-mRNA、三丁胺盐形式)可从用于寡核苷酸纯化的反相离子配对色谱技术中提取。设想所述方法赋予mRNA足够的疏水性以实现有机溶解度,同时避免mRNA沉淀。
用热循环对mRNA进行预处理可包括在有机可溶性mRNA转化过程中。将初始水溶性形式的约1mg/mL mRNA的溶液加热至65℃,在目标温度下保持5分钟,然后在水/冰浴中快速冷却。
简单的缓冲液交换产生中间体盐,并且可根据所需的mRNA规模通过多种方式完成。例如,可将mRNA(1-10mg/mL)稀释于10mM乙酸三丁铵(TBAA,约pH 6.5)中,并放入适当的MWCO渗析管或盒中。可用缓冲液对mRNA进行充分渗析,以用TBA分子置换亲水性阳离子。例如,可在24小时内用10透滤体积的10mM TBAA(约pH6.5)进行渗析,并更换缓冲液约3次,并且可将渗析袋/盒内容物冻干成白色粉末。对于较大规模,可在基本过程、缓冲液和概念保持相同的情况下进行切向流过滤(TFF)。
残留在颗粒中的中间体阳离子是不希望的。中间体阳离子和阳离子脂质的化学性质可决定配制期间的去除效率。可筛选替代中间体阳离子,以限定有机溶剂中的mRNA溶解度所需的疏水性。这可集中于寻找能够在中间体阳离子的疏水性较低的情况下产生有机溶剂可溶性mRNA盐的最低疏水性的抗衡离子,从而在纳米颗粒形成过程中促进提取和与阳离子脂质的离子交换。阳离子之间log D值的大Δ和大表面与体积比(用于使有机液滴塌陷)的组合可产生有效交换。鉴定为可能的中间体盐的示例性的合适阳离子包括但不限于三丁胺(TBA,cLog P=4.7,cLog D5.0=1.6)、三丙胺(TPA,cLog P=3.2,cLog D5.0=0.1)、三乙胺(TEA,cLog P=1.7,cLog D5.0=-1.5)、二异丙醇胺(cLog P=-1.1,cLog D5.0=-4.1)等。
(TBAA)储备溶液的制备
首先从三丁胺和乙酸制备储备浓度的乙酸三丁铵(TBAA)。简言之,在水中以100mM制备三丁胺,并在室温下搅拌1小时。添加冰醋酸(初始1:1化学计量),并监测pH。添加额外的冰醋酸,直到将pH调节至介于6.3-6.6之间。将TBAA储备液充分混合,并在通风橱中搅拌过夜。然后将此溶液在4℃下冷却。
用于制备TBA:mRNA盐的渗析方法
首先将100mM TBAA储备溶液用水稀释至10mM,并冷却至约4℃。此程序特定于制备15mL的体积,但可基于所需的mRNA盐的量进行调整。将特定质量的mRNA添加至50mL锥形管中。基于344g/mol的平均核苷一磷酸分子量,计算mRNA的摩尔数。TBA:mRNA的比例最初保持在1:1与3:1之间。将适量的TBAA储备液添加至mRNA中,并将体积调节至15mL。将此溶液保持在冰上,直到添加至渗析盒(20kDa MWCO)中。将mRNA:TBA溶液用冷TBAA(10mM,2L)渗析2小时。将渗析培养基更换为新鲜TBAA(10mM,2L)。在另外2小时后,将mRNA:TBA溶液从渗析盒中取出,并在含有液氮的50mL锥形管中快速冷冻。将此材料冻干,从而得到片状白色粉末。
用于制备TBA:mRNA盐的切向流过滤(TFF)方法
首先将100mM TBAA溶液用水稀释至10mM,并冷却至约4℃。此程序特定于将200mgmRNA转化为TBA盐,但可相应地进行调整。为了得到1:1TBA:mRNA的初始比例,添加TBAA(10mM,104mL),并且用水使总体积达到200mL。将此溶液保持在冰上,并针对5透滤体积的TBAA(10mM)循环通过冷TFF(300kDa MWCO膜)持续5-10分钟。然后将5透滤体积送至废物中,并收集保留的mRNA:TBA溶液(约200mL)。将此溶液分到适当数量的50mL锥形管中,并用液氮快速冷冻。将此材料冻干,从而得到片状白色粉末。
mRNA-TBA溶解于苄醇和乙醇中
在苄醇中以10mg/mL(6.5mg/mL游离mRNA)制备mRNA-三丁胺(TBA)盐的初始储备溶液。将苄醇添加至相应mRNA-TBA盐后,将溶液在室温下置于涡旋振荡器上15-60分钟。一旦溶解于苄醇中,就可用乙醇进行进一步稀释。使用RiboGreen测定确定乙醇/苄醇储备溶液中的mRNA含量。
实施例2:有机进料mRNA(OFM)脂质纳米颗粒(LNP)制剂的制备
纳米颗粒组合物的表征
Zetasizer Nano ZS(Malvern Instruments Ltd,Malvern,Worcestershire,UK)可用于测定纳米颗粒组合物的粒度、多分散性指数(PDI)和ζ电位,在1×PBS中测定粒度并且在15mM PBS中测定ζ电位。
紫外-可见光谱法可用于测定纳米颗粒组合物中治疗剂和/或预防剂(例如RNA)的浓度。将100μL在1×PBS中的稀释制剂添加至900μL的甲醇与氯仿的4:1(v/v)混合物中。在混合后,例如在DU 800分光光度计(Beckman Coulter,Beckman Coulter有限公司,Brea,CA)上在230nm与330nm之间记录溶液的吸收光谱。可基于所述组合物中使用的治疗剂和/或预防剂的消光系数以及在例如260nm波长处的吸光度与在例如330nm波长处的基线值之间的差异来计算纳米颗粒组合物中的治疗剂和/或预防剂的浓度。
对于包含RNA的纳米颗粒组合物,可使用QUANT-ITTM
有机进料mRNA的通用程序
为了研究用于将治疗剂和/或预防剂递送至细胞的安全切有效的纳米颗粒组合物,制备并测试了一系列制剂。具体地,对纳米颗粒组合物的脂质组分中的特定要素及其比例进行了优化。可通过混合过程(如微流体和两种流体流的T型接合混合)来制备纳米颗粒,所述两种流体流中的一种是含有治疗剂和/或预防剂(即mRNA)以及脂质组分(即可电离/阳离子脂质、结构脂质、磷脂/辅助脂质、PEG脂质)的有机流体流,并且另一种是缓冲以促进脂质纳米颗粒的形成的水性流体流。
可将有机可溶性mRNA(如本文所述制备)与标准脂质混合物在乙醇中共溶以产生功能性脂质纳米颗粒(LNP)。可通过将在乙醇中约50mM浓度的根据本文所述的式之一的脂质、磷脂(如DOPE或DSPC,可获自Avanti Polar Lipids,Alabaster,AL)、PEG脂质(如1,2-二肉豆蔻酰基-sn-甘油甲氧基聚乙二醇,也称为PEG-DMG,可获自Avanti Polar Lipids,Alabaster,AL,或根据本文所述的式之一的PEG脂质)以及结构脂质(如胆固醇,可获自Sigma-Aldrich,Taufkirchen,Germany)与大约0.05-0.50mg/mL浓度的mRNA组合来制备脂质组合物和mRNA的有机进料溶液。应将溶液冷藏以在例如-20℃下储存。将脂质合并以产生所需的摩尔比,并用水和/或乙醇稀释至介于约5.5mM与约25mM之间的最终脂质浓度。
通过将有机进料溶液与水溶液(即乙酸盐缓冲液5-10mM,pH约5.0)以约1:1与约50:1之间的体积比合并来制备包含治疗剂和/或预防剂(即RNA,mRNA)和脂质组分的纳米颗粒组合物。可使用基于NanoAssemblr微流体的系统以约10ml/min与约18ml/min之间的流速将有机溶液快速注入水溶液中,以产生水与乙醇比例介于约1:1与约4:1之间的悬浮液。
可通过渗析加工纳米颗粒组合物以除去乙醇并实现缓冲液交换。可使用Slide-A-Lyzer盒(Thermo Fisher Scientific Inc.Rockford,IL)将制剂用pH 7.4、体积为初产物200倍的磷酸盐缓冲盐水渗析两次,其中分子量截断是10kD。第一次渗析可在室温下进行3小时。然后可将制剂在4℃下渗析过夜。可将所得纳米颗粒悬浮液通过0.2μm无菌过滤器(Sarstedt,Nümbrecht,Germany)过滤到玻璃小瓶中并用卷边封闭物密封。通常获得0.01mg/ml至0.10mg/ml的纳米颗粒组合物溶液。
上述一般方法诱导纳米沉淀和颗粒形成。可使用包括但不限于T-接合和直接注入以及通过翻转盘或高通量混合进行搅拌的替代方法来实现相同的纳米沉淀。乙醇进料中的有机可溶性mRNA具有改善mRNA LNP的工艺效率、可再现性和可扩展性的潜力。广义上讲,与标准脂质混合物一起有机(即乙醇)进料mRNA的潜力较高,包括简化混合、减少结垢和组成灵活性。就简化的合而言,在颗粒形成过程中无需从水相中提取mRNA。这可允许通过传统表面活性剂和混合能技术进行更大的尺寸控制。预期结垢减少是为了防止颗粒形成过程中水/乙醇界面处的mRNA沉淀。就组成灵活性而言,在配制过程中去除mRNA分配应允许增加的赋形剂灵活性,尤其是在油/水界面物质(如PEG脂质)方面。这些方法具有降低对LNP表面改性稳定剂的后插入的依赖性以及替代有机溶剂与溶剂比例的灵活性的进一步潜力,
为了评估通过中间体盐形式的mRNA的活性,使用疏水性荧光素酶mRNA有机进料来通过纳米沉淀由标准脂质组合物生成LNP。可使用在搅拌小瓶或NanoAssemblr
表1:使用TBA-mRNA的有机进料纳米沉淀LNP的总结
有机mRNA进料NanoAssemblr
可使用微流体混合室(NanoAssemblrTM),将水性缓冲溶液(乙酸盐缓冲液6.25mM,pH 5.0)与含有有机进料mRNA(约0.1-0.5mg/mL)、阳离子脂质(可电离脂质1)的乙醇溶液合并使用,作为结构脂质的胆固醇、作为磷脂的辅助脂质(DSPC)和PEG脂质(PEG2K-DMG)(48:40.5:10:1.5摩尔比)的乙醇溶液以3:1的体积比合并而形成脂质纳米颗粒(LNP)。可将所得的含LNP溶液在4℃下用4000mL PBS缓冲液(pH 7.4)进行渗析,并在18小时内交换2次。使用Ribogreen定量测定测试所收集的纳米颗粒的可及mRNA,并且通过动态光散射(DLS)进行颗粒尺寸测量(particle sizing)。在体内给药之前,使用离心过滤装置(Millipore AmiconUltra 100kDA MWCO,4℃)浓缩颗粒。浓缩后,将样品过滤(0.2μm)。
有机进料mRNA程序的T-混合程序
将含有50:38.5:10:1.5摩尔比的阳离子脂质(可电离脂质1)、作为结构脂质的胆固醇、作为磷脂的辅助脂质DSPC和PEG脂质(摩尔比为50:38.5:10:1.5)的脂质储备液与溶解于苄醇/乙醇中的mRNA混合。将含有脂质mRNA的有机进料负载到注射器中,并使用PEEK T接合与乙酸钠以3:1的体积比混合。使用Tech Dev设备成功运行了5mg规模的初始T-混合批次。将T-混合产物(TMP)在线稀释,调节至所需的最终pH,并浓缩负载mRNA的脂质纳米颗粒,并且通过切向流过滤除去残留的乙醇。
开发了T-混合工艺以评估较大规模LNP批次,并通过提高的包封效率来验证减少的结垢。T-混合工艺的简要示意图和概述在图5中呈现。简言之,组分包括如本文所述制备的有机进料mRNA(OFM)Luc-TBA mRNA、可电离脂质-1(50mol%)、DSPC磷脂(10mol%)、胆固醇结构脂质(38.5mol%)和PEG-DMG PEG脂质(1.5mol%)。工艺参数包括60mL/min mRNA流、20mL/min脂质流、pH调节前保持30分钟以及5重量%、0.1mL/s pH调节。可对设置进行进一步的修改,包括水性:乙醇比例和有机溶剂,以使颗粒更快地固化,以及在混合过程中使有机相脱水。对于最终脂质纳米颗粒制剂(表2)获得了一致且理想的尺寸测量和包封效率值(EE%,RiboGreen测定),并且注意到在另外测定中计算的包封值之间的优异相关性。用冷冻电子显微术(cryo-EM)观察到大体上均匀的颗粒形态(图6)。
表2:使用TBA-mRNA/DSPC/胆固醇/PEG-DMG/可电离脂质-1的有机进料T-混合LNP的总结
有机进料mRNA的96孔板混合程序
有机可溶性mRNA减少了对严格混合环境的需求。快速并行混合和纯化可显著增加制剂筛选带宽。另一种有机可溶性mRNA进料的颗粒制剂采用高通量混合来产生颗粒。以这种方式,制备具有相同组成的单独制剂。将有机可溶性mRNA溶解于乙醇相中,并通过简单混合以96孔格式产生颗粒。每种颗粒组成均相同,并含有50μg的mRNA。形成后,可将颗粒制剂合并在一起并用PBS渗析。
这种工艺的LNP是使用以800rpm搅拌的翻转盘在96孔板混合器(VP710E3)的搅拌孔中形成的。简言之,将0.412mL的缓冲液(乙酸缓冲液6.25mM,pH 5.0)添加至每个孔中,并使用翻转盘方法搅拌。通过手动移液管将含有mRNA-TBA盐(0.364mg/mL)以及阳离子脂质(可电离脂质-1)、作为结构脂质的胆固醇、作为磷脂的辅助脂质(DSPC)和PEG脂质(PEG2K-DMG)(50:38.5:10:1.5摩尔比)的乙醇溶液(0.137mL)添加至搅拌水溶液中以形成LNP。合并重复孔(N=20),并将所得的含LNP溶液在4℃下用4000mL的PBS缓冲液渗析,并在18小时内交换2次。使用Ribogreen定量测定测试所收集的纳米颗粒的可及mRNA,并且通过DLS进行颗粒尺寸测量。在体内给药之前,使用离心过滤装置(Millipore Amicon Ultra 100kDAMWCO,4℃)浓缩颗粒。浓缩后,将样品过滤(0.2μm)。对于最终的脂质纳米颗粒制剂,获得了一致且理想的尺寸测量和包封效率值(EE%,RiboGreen测定)(表3)。此外,在单独孔和合并的孔中,96孔板LNP制剂颗粒的体外表达与小瓶搅拌和NanoAssemblr制剂相当(图7)。另外证明,有机进料mRNA(OFM)最适合并行混合颗粒形成(图8)。有机相mRNA比水相mRNA更易于较低能量混合。高能量混合(即micro Tee,Gilson)显示没有基于mRNA相的颗粒差异。此外,与水性进料mRNA(AFM)NanoAssemblr混合样品制剂相比,利用Laurdan的荧光测定表明,对于高通量96孔板混合和T-混合有机进料mRNA(OFM)样品制剂,表面破坏较少。荧光测量值表明与传统的AFM颗粒相比,OFM颗粒的较低极性表面。
表3:使用TBA-mRNA/DSPC/胆固醇/PEG-DMG/可电离脂质-1的有机进料高通量96孔混合LNP的总结
实施例3:在用有机进料mRNA(OFM)配制的LNP给药后,小鼠中的荧光素酶(Luc)表达
体内制剂研究
为了监测各种纳米颗粒组合物如何有效地将治疗剂和/或预防剂递送至靶细胞,制备了包括特定治疗剂和/或预防剂(例如,经修饰的或天然存在的RNA,如mRNA)的不同纳米颗粒组合物,并施用至啮齿动物群体。向小鼠静脉内、肌肉内、动脉内或肿瘤内施用包括纳米颗粒组合物的单剂量,所述纳米颗粒组合物具有如本文提供的那些的制剂。在一些情况下,可使小鼠吸入剂量。剂量大小可在0.001mg/kg至10mg/kg的范围内,其中10mg/kg描述对于每1kg小鼠体重在纳米颗粒组合物中包含10mg治疗剂和/或预防剂的剂量。也可使用包含PBS的对照组合物。
将纳米颗粒组合物施用于小鼠后,可通过酶联免疫吸附测定(ELISA)、生物发光成像或其他方法来测量特定制剂及其剂量的剂量递送曲线、剂量响应和毒性。对于包含mRNA的纳米颗粒组合物,还可评价蛋白质表达的时程。从啮齿动物中收集的用于评价的样品可包括血液、血清和组织(例如,来自肌肉内注射部位的肌肉组织和内部组织);样品采集可涉及动物的处死。
包含mRNA的纳米颗粒组合物可用于评价各种制剂用于递送治疗剂和/或预防剂的功效和有用性。通过施用包含mRNA的组合物诱导的更高的蛋白质表达水平将指示更高的mRNA翻译和/或纳米颗粒组合物mRNA递送效率。由于认为非RNA组分本身不会影响翻译机制,因此较高的蛋白质表达水平可能指示相对于其他纳米颗粒组合物或所述纳米颗粒组合物不存在的情况,给定纳米颗粒组合物对治疗剂和/或预防剂的递送效率更高。
通过生物发光研究评价了本文所述的纳米颗粒组合物的功效。所述研究评价了小鼠中肌肉内(i.m.)或静脉内(i.v)给药的有机进料LNP配制的荧光素酶(Luc)mRNA的表达。所述研究测试了与标准水性进料LNP制剂相比,小鼠体内的表达和生物分布相似性。制剂包含可电离脂质1和通过本文所述的方法使用有机可溶性mRNA三丁胺(TBA)盐产生的各种有机可溶性mRNA进料溶液。将用于LNP制剂的两种有机可溶性mRNA进料颗粒制备方法(T-混合有机进料mRNA和96孔板混合有机进料mRNA)与传统的水性mRNA NanoAssemblrTM LNP制剂进行了比较。以0.1mg/kg(mpk)肌肉内和0.5mg/kg(mpk)静脉内的剂量向小鼠(雌性品系CD-1,6周,20-22g,n=10)肌肉内(i.m.)或静脉内(i.v.)施用制剂。在给药后6小时(n=5)和24小时(n=5),通过全身以及肝脏、肺、脾脏和肌肉内施用的注射部位的离体IVIS成像来评价荧光素酶的表达。在6小时(n=5)和24小时(n=5)收集血液用于细胞因子分析。评价标准水性进料LNP制剂和PBS对照以进行比较。
使用NanoAssemblrTM混合程序的标准水性mRNA进料(比较对照)
比较对照工艺是使用NanoAssemblrTM微流体混合产生的标准水性mRNA制剂。这是使用标准水性进料mRNA(AFM)条件的标准LNP工艺。水相含有mRNA,并用乙酸盐缓冲液(pH5,6.25mM)缓冲。使用NanoAssemblrTM形成颗粒,并渗析到PBS中。
使用微流体混合室(NanoAssemblrTM),将mRNA(0.121mg/mL)于缓冲液(乙酸盐缓冲液6.25mM,pH 5.0)中的水溶液与含有阳离子脂质(可电离脂质1)、作为结构脂质的胆固醇、作为磷脂的辅助脂质(DSPC)和PEG脂质(PEG2K-DMG)(48:40.5:10:1.5摩尔比)的乙醇溶液合并而形成用于比较对照工艺的脂质纳米颗粒(LNP)。将所得的含LNP溶液在4℃下用4000mL PBS缓冲液(pH 7.4)进行渗析,并在18小时内交换2次。使用Ribogreen定量测定测试所收集的纳米颗粒的可及mRNA,并且通过动态光散射(DLS)进行颗粒尺寸测量(particlesizing)。在体内给药之前,使用离心过滤装置(Millipore Amicon Ultra100kDA MWCO,4℃)浓缩颗粒。浓缩后,将样品过滤(0.2μm)。
有机进料mRNA程序的T-混合程序
将含有50:38.5:10:1.5摩尔比的阳离子脂质(可电离脂质1)、作为结构脂质的胆固醇、作为磷脂的辅助脂质DSPC和PEG脂质(摩尔比为50:38.5:10:1.5)的脂质储备液与溶解于苄醇/乙醇中的mRNA混合。将含有脂质mRNA的有机进料负载到注射器中,并使用PEEK T接合与乙酸钠以3:1的体积比混合。使用Tech Dev设备成功运行了5mg规模的初始T-混合批次。将T-混合产物(TMP)在线稀释,调节至所需的最终pH,并浓缩负载mRNA的脂质纳米颗粒,并且通过切向流过滤除去残留的乙醇。
有机进料mRNA的96孔板混合程序
第二种有机可溶性mRNA进料的颗粒制剂采用高通量混合来产生颗粒。以这种方式,制备具有相同组成的20种单独制剂。将有机可溶性mRNA溶解于乙醇相中,并通过简单混合以96孔格式产生颗粒。每种颗粒组成均相同,并含有50μg的mRNA。形成后,将颗粒制剂合并在一起并用PBS渗析。
这种工艺的LNP是使用以800rpm搅拌的翻转盘在96孔板混合器(VP710E3)的搅拌孔中形成的。简言之,将0.412mL的缓冲液(乙酸缓冲液6.25mM,pH 5.0)添加至每个孔中,并使用翻转盘方法搅拌。通过手动移液管将含有mRNA-TBA盐(0.364mg/mL)以及阳离子脂质(可电离脂质-1)、作为结构脂质的胆固醇、作为磷脂的辅助脂质(DSPC)和PEG脂质(PEG2K-DMG)(48:40.5:10:1.5摩尔比)的乙醇溶液(0.137mL)添加至搅拌水溶液中以形成LNP。合并重复孔(N=20),并将所得的含LNP溶液在4℃下用4000mL的PBS缓冲液渗析,并在18小时内交换2次。使用Ribogreen定量测定测试所收集的纳米颗粒的可及mRNA,并且通过DLS进行颗粒尺寸测量。在体内给药之前,使用离心过滤装置(Millipore Amicon Ultra 100kDAMWCO,4℃)浓缩颗粒。浓缩后,将样品过滤(0.2μm)。
所有组的尺寸和PDI值看起来都一致,即使是通过96孔板混合和合并制备那些。此外,如使用RiboGreen测定所测量的,在所有组中均观察到良好的包封。表4中总结了这项研究中使用的制剂的表征。
表4:用于体内生物发光研究的LNP配制方法和相关性质的总结
静脉内和肌肉内施用的实验制剂在体内表达良好。T-混合制剂可比得上传统的水性进料mRNA LNP制剂。96孔板混合制剂降低大约10倍,但考虑到进行混合的简便性,因此有前景(图9、图10、图11A-11D、图12A-12D、图13A-13C、图14A-14D、图15、图16、图17A-17D、图18A-18D、图19A-19D、图20A-20D、图21A-21D和图22A-22D)。
肌肉内给药的所有有机进料配制的LNP在全身成像中均展示荧光素酶表达,最高表达在6小时达到峰值并且到24小时时信号下降(约1-1.5log)。通过全身成像,T-混合有机进料mRNA三丁胺(TBA)盐制剂产生与标准水性进料比较对照制剂相当的表达,而96孔板混合有机进料mRNA三丁胺(TBA)盐制剂展示略低的表达(<0.5log)。所有测试的制剂展示与标准水性进料比较对照制剂相当或更低的注射部位、肝脏、肺和脾脏表达。在所有测试的制剂中,在成像的所有组织中表达在6小时达到峰值,并到24小时显示信号下降。除了在肌肉内处理的小鼠中水性进料mRNA(AFM)(NanoAssemblr)与有机进料mRNA(OFM)(T-混合)之间的可比蛋白质表达外,对于AFM-NanoAssemblr和OFM-T混合颗粒制剂,还存在可比细胞因子诱导(图23)。蛋白质表达在体外(在原代小鼠肝细胞中研究)与体内数据之间保持了良好的相关性(图24)。水性进料mRNA(AFM)(NanoAssemblr)和有机进料mRNA(OFM)(T-混合)样品在每种浓度下均显示相似的表达。有机进料mRNA(OFM)(96孔)样品展示蛋白质表达降低约8倍。体外表达的总体趋势与体内数据非常吻合。
实施例4:由交换到乙醇中并通过切向流过滤(TFF)溶解而无需冻干的各种有机进料mRNA(OFM)盐制备脂质纳米颗粒
为了评价新的有机可溶性mRNA工艺,开发了切向流过滤(TFF)工艺而无需冻干。通过切向流过滤进行阳离子交换的转化,然后切向流过滤交换到乙醇中。所述工艺被设计为消除对乙醇溶液中的任何苄醇来溶解冻干粉末的需要。另外,这种设计的工艺使从水溶性mRNA到有机可溶性mRNA的周转时间更快(与数天相比,数小时)。此外,这些工艺促进较低疏水性阳离子(即三甲胺),较低疏水性阳离子已被证明更难以使用冻干/重构程序产生可溶性mRNA。比较了使用切向流过滤(TFF)制备的各种有机mRNA盐[三乙胺(TEA)、三丙胺(TPA)和三丁胺(TBA)]。乙酸盐缓冲液(6.25mM,pH 5)用作水相。可电离脂质-1/DSPC/胆固醇/PEG-DMG(50:10:38.5:1.5摩尔比)用作脂质混合物。通过简单搅拌板台式小瓶混合(约1000rpm)制备脂质纳米颗粒,并在不过滤的情况下用1×PBS渗析。在颗粒形成、渗析和浓缩之后进行动态光散射(DLS)测量。
转化为三丁胺(TBA)盐、三丙胺(TPA)盐和三乙胺(TEA)盐
通过分别将三丁胺、三丙胺或三乙胺与乙酸以1:1摩尔比混合(即,各自100mM的最终浓度)并用去离子水达到体积来制备100mM乙酸三丁铵(TBAA)、乙酸三丙铵(TPAA)或乙酸三乙铵(TEAA)于水中的溶液。当完全溶解时,溶液的pH预期为大约6.0-6.5。然后用去离子水将储备液稀释至10mM的工作浓度。将预处理的mRNA添加至切向流过滤(TFF)装置的储器中,并用10mM TBAA、TPAA或TEAA稀释大约5倍。将mRNA与TBAA、TPAA或TEA一起孵育,同时在冷TFF系统中再循环大约10分钟。然后用另外10透滤体积的10mM TBAA洗涤mRNA。通过用20透滤体积洗涤将mRNA-TBA、mRNA-TPA或mRNA-TEA交换到无水乙醇中,然后收集乙醇中的mRNA-TBA、mRNA-TPA或mRNA-TEA,浓度通常为大约0.5-1.0mg/mL。
有机进料mRNA的小瓶混合程序
有机相含有50:38.5:10:1.5摩尔比的阳离子脂质(可电离脂质-1)、作为结构脂质的胆固醇、作为磷脂的辅助脂质(DSPC)和PEG脂质(PEG2K-DMG)以及乙醇中的有机可溶性mRNA盐(TEA、TPA或TBA盐形式的0.37mg/mL mRNA)。水相含有6.25mM乙酸盐缓冲液(pH5.0)。LNP通过纳米沉淀形成:将有机相添加至含有水性缓冲液的小瓶中,同时以3:1的体积比(水性与有机)用磁力搅拌棒以1000rpm搅拌。将所得的含LNP溶液在4℃下用4000mL PBS缓冲液(pH 7.4)进行渗析,并在18小时内交换两次。使用Ribogreen定量测定测试所收集的纳米颗粒的可及mRNA,并且通过DLS进行颗粒尺寸测量。使用离心过滤装置(Millipore AmiconUltra 100kDA MWCO,4℃)浓缩颗粒。
在小瓶混合的情况下,尺寸保持相对均匀并在100nm左右(图25和图26)。此外,对于所有盐形式,如使用RiboGreen测定所测定的包封效率(%EE)仍然较高(图27),如通过Ribo*所测量%EE的趋势保持,但展现较低绝对值。
实施例5:生理pH制剂和具有有机进料mRNA(OFM)的水溶液柔性
为了研究脂质纳米颗粒制剂在接近生理pH下的行为,使用Tris/蔗糖(pH约7.3)、20mM Tris 8%蔗糖(pH约7.4)或葡萄糖(5%w/v,pH约4.5)作为水相,将mRNA-TBA、DSPC/胆固醇/PEG-DMG/可电离脂质-1脂质混合物的有机(OFM)和水性(AFM)原料进行比较来对颗粒形成进行了研究(表5)。形成后立即通过DLS评价的粒度都大于150nm,具有良好的多分散性。通过这些简单的混合方法,实现了合理的包封效率、尺寸和多分散性。葡萄糖中保持的良好EE%可能是由于较低的pH(图28)。此外,将颗粒用1×PBS进行渗析,并在渗析后使用RiboGreen测定重新评价mRNA包封。
表5:具有有机进料mRNA(OFM)的水溶液柔性
实施例6:床边配制的脂质纳米颗粒的试点体内研究
针对作为床边制剂的潜在应用评价肌肉内施用使用简化台式纳米沉淀法(K型注射器混合)制备的LNP的体内表达。所述研究包括含有有机可溶性mRNA或标准水溶性mRNA的可电离脂质1制剂。此外,在一些制剂中使用月桂酰基精氨酸乙酯(EA-1)来驱动包封,而无需进行初始pH调节。所述研究将发现制剂的表达谱与标准可电离脂质1LNP制剂进行了比较。由于床旁应用,这些制剂含有残留溶剂,并在较低pH(约5)下注射。所设计的研究包括用2μg剂量(约0.1mpk)肌肉内(IM)处理的雌性Cd-1小鼠(每组n=8)。标准制剂包含可电离脂质-1:DSPC:胆固醇:PEG-DMG(50:10:38.5:1.5),读数包括注射部位的临床观察、EPO ELISA(3小时、6小时、24小时)和细胞因子水平(6小时)。由于注射器类型的混合体积,以4:1的水性:有机比例形成颗粒。与水性进料mRNA(AFM)相反,有机进料mRNA(OFM)包含冻干的hEPOTBA和DMSO。EA-1DMSO以N:P=2并入。所有床边混合组均在给药前约24小时制备。使用标准后处理程序加工对照制剂(1)(即,在给药前进行NanoAssemblr混合和渗析)。混合后无需进一步加工或纯化就可给予床边制剂。所有床边制剂均表现出良好的体内性能,hEPO表达与NanoAssemblr对照相当(参见图29和图30)。
表6:用于体内床边制剂研究的LNP配制方法和相关性质的总结
需要少量的DMSO来溶解组2和3中的冻干TBA盐以及组3和5中的EA-1。这种DMSO在以后的研究中可避免。值基于2μg mRNA剂量与0.02kg动物体重计算,假定DMSO储备液中100mg/mL EA-1;DMSO储备液中4.2mg/mL hEPO TBA。在给药前将第2-5组稀释约1.75倍。第2-5组在给药浓度下含有约11%的乙醇。将第2组和第4组用6.25mM乙酸盐8%蔗糖(pH 5)稀释。将第3组和第5组用20mM tris 8%蔗糖(pH 7.4)稀释。
总之,与NanoAssemblr混合对照颗粒相比,体内评价显示所有护理点(“床边”)配制的LNP的良好hEPO表达。具有线内静态混合的双注射器设备产生了具有良好颗粒性质(尺寸、%EE和PDI)的LNP。有机和水性mRNA原料在体内均成功。在5℃下24小时内,颗粒和mRNA的物理稳定性良好。月桂酰基精氨酸乙酯(ELA)的添加使得能够在生理pH条件下配制有机和水性mRNA。此外,残留的有机溶剂水平不会对体内表达产生不利影响。
此外,检查了混合对LNP制剂和生物学性能的影响,以确定混合严格性对脂质纳米颗粒的体外性能的影响,以与体内研究相对应。所设计的研究包括标准制剂,包括可电离脂质-1:DSPC:胆固醇:PEG-DMG(50:10:38.5:1.5),N:P 5.8。OFM是EtOH中的hEPO TEA盐,并且AFM是未经处理的hEPO。有机溶剂是乙醇,并且水性是6.25mM乙酸盐(pH 5),注射器类型的混合体积使得以4:1的水性:有机比例形成颗粒。加工包括在1X PBS中渗析,通过离心过滤浓缩并进行0.2μm过滤。所有混合策略都产生具有良好尺寸和高%EE(RiboGreen)的颗粒,与OFM相比,AFM颗粒的直径倾向于略小。在原代小鼠肝细胞中测试了hEPO的表达,并且对于所有三种混合技术中,AFM在体外均优于OFM。用于K型和L型注射器混合的AFM的表达与NanoAssemblr对照的表达相当,从而使这些装置非常适合将来的研究(图31、图32、图33和图34)
表7:用于体内床边制剂研究的LNP配制方法和相关性质的总结
实施例7:在pH 5对比7.4下以变化的N:P进行给药
使用AFM和在pH 5下静态混合4:1水性:有机通过纳米沉淀产生了四种独特的床边AFM制剂。每种hEPO mRNA制剂在酸性纳米沉淀pH 5下和在用PBS中和至1X pH 7.4之后给药。对照制剂也在中性pH下给药。表8示出纳米沉淀过程中乙醇相中的脂质浓度、%PEG
剂量制备稀释剂对应于所用的缓冲液,从而在注射前稀释样品以达到在所需pH下每只动物2μg的mRNA剂量。
表8:制剂表征和剂量制备稀释剂
使用以每只动物2μg IM给药的雌性CD-1小鼠(n=5)进行了体内研究。在6小时时分析细胞因子,并在6小时和24小时测量hEPO水平(图35-38)。在所有研究组中,与在pH 5下给药的那些相比,用PBS中和至pH 7.4的制剂表达更多的hEPO。这种趋势在6小时和24小时时间点均保持。除IP10外,使用中和制剂还观察到细胞因子减少。第10组是1X PBS。图39A-39C中示出CD-1小鼠在6小时的细胞因子应答,比较了制剂的给药pH和N:P比例。
实施例8:中性pH制剂比较
在实施例7中观察到的给药pH的影响突出了用水性进料mRNA(AFM)进行中性pH给药所提供的益处。酸性制剂程序将需要额外的中和步骤,从而使使用点或床边应用复杂化。pKa值高于pH 7.4的阳离子去除了在纳米沉淀过程中进行酸化的需要,从而消除了在给药前进行中和的需要。中性pH制剂中使用的EA-5和EA-13阳离子在图40中示出。
在实施例7中所述的条件下使用床边静态混合方法(第2-5组)以及表9中描述的制剂具体细节制备LNP,示出时间0点和在5℃下保持20小时后的表征数据。向雌性CD-1小鼠(n=5)给予2μg的hEPO mRNA,在6小时读取细胞因子,在6小时和24小时读取hEPO。使用传统纳米沉淀程序制得LNP对照。除传统阳离子脂质的5.8N:P外,第4组和第5组相对于所添加的EA-5或EA-13的磷酸盐具有2个电荷当量。
表9:制剂描述和时间零点的表征数据
在表10给药之前,将制剂在5℃下保持20小时。第2组和第3组由相同的pH 5纳米沉淀产生,第3组分离并用PBS中和至pH 7.4。在给药之前再次对制剂进行表征。与中性pH制剂稀释剂匹配的tris蔗糖溶液也作为对照给予。
表10:制剂描述和在给药前在5℃下保持20小时后的表征数据
使用雌性CD-1小鼠(n=5)对每只动物给药2μg hEPO mRNA IM进行体内研究。在6小时分析细胞因子,并在6小时(图41)和24小时(图42)测量hEPO水平。在给药前将第3组制剂中和至pH 7.4,同时制备第4组和第6组并在pH 7.4下给药。在图43A-43C中示出CD-1小鼠在6小时的细胞因子应答,其比较了配制工艺和高pKa脂质添加。
对于在中性pH下制剂剂量,包括在较高pKa脂质存在下在pH7.4下制备的制剂,表达仍然保持高水平。
实施例9:直接pH配制剂筛选EA-III系列
筛选另外的高pKa脂质(图44),以确定水性进料mRNA(AFM)、中性pH和静态混合床边配制程序的合适属性,所述程序被设计为实现mRNA的床边配制。使用实施例8中概述的中性pH配制条件来配制hEPO mRNA。取决于PEG
表11:制剂描述和时间=0时的表征
表12:制剂描述和在给药前在5℃下20小时后的表征。
使用雌性CD-1小鼠(n=5),每只动物给药2ug hEPO mRNA IM进行体内研究。在6小时(图45)和24小时(图46)测量hEPO的表达水平,并在6小时分析细胞因子(图47A-47B)。第9组是1X PBS对照。
实施例10:研究2869:CMV实施例
应用中性pH床边AFM纳米沉淀技术来验证其在疫苗应用中的功效。使用了巨细胞病毒(CMV)疫苗,所述疫苗由编码五聚体蛋白复合物(5种mRNA)和gB蛋白(1种mRNA)的6种单独mRNA组成。
所有制剂均使用相同的适当阳离子脂质,但配制工艺不同。第1组和第2组是传统制备的LNP,其以传统纳米沉淀方式制造,并在给药前根据行业规范进行纯化。第3组至第6组使用静态混合床边纳米沉淀工艺制备,在给药前不进行纯化。第3组和第4组直接在pH 5下给药而不中和。第5组和第6组使用中性pH床边程序通过添加2个电荷当量的EA-1作为高pKa包封脂质来构建。
取决于PEG
向雌性BALB/c小鼠(n=8)施用2.5ug/剂量的CMV mRNA IM。在第1天和第22天施用剂量(图48)。在第21天和第36天进行了CMV五聚体和gB ELISA。所有床边剂量均在给药前一天新鲜制备,并在5℃下保持24小时。在初免后3周(第21天)和加强后2周(第36天)对小鼠放血以测量五聚体和gB效价。
表13:剂量1制剂描述和时间零点的表征
表14:剂量1制剂描述和在给药前在5℃下保持24小时后的表征
以与剂量1类似的方式制备剂量2。
表15实施例10剂量2制剂描述和时间零点的表征
表16:剂量2制剂描述和在给药前在5℃下保持24小时后的表征
在0小时和24小时对剂量2进行大颗粒计数测量。图49中示出>0.8μm的颗粒,并且图50中示出>2μm的颗粒。
五聚体(图51)和gB蛋白(图52)的ELISA效价显示所有制剂的免疫应答,包括使用酸性或中性床边纳米沉淀工艺制备的那些制剂。
实施例11:用于个人化疫苗接种的床边纳米沉淀
床边水性进料mRNA(AFM)纳米沉淀可减少与个人化治疗(如患者特异性癌症或其他疫苗)相关的时间和成本。为了验证使用床边纳米沉淀工艺产生的制剂的生物学性能,配制了已知的鼠表位构建体并测试了构建体特异性免疫应答。
将通过静态混合方法制得的三种床边纳米沉淀制剂与含有相同mRNA构建体的标准制剂和不含任何mRNA的空脂质纳米颗粒制剂进行了比较。对酸性(pH 5)和中性(pH 7.4)床边制剂进行了测试。制剂含有以下组成:取决于PEG水平,N:P 5.8且脂质摩尔比为50:10:38.5:1.5或50:10:39.5:0.5的可电离脂质-1:DSPC:Chol:PEG
表1:制剂、工艺和给药描述
向雌性Bl/6给予2次剂量(第1天、第8天)的5μg/剂量(分成2.5μg/四次/剂量)IM(图53)。表1中列出各自的稀释剂。每次给药后6小时通过IFNγELISpot分析读取三种I类癌症抗原(CA-A、CA-B和CA-C)(图54)以及两种II类癌症抗原(CA-D和CA-E)(图55)的细胞因子。
表28:剂量1制剂表征
表3:剂量2制剂表征
实施例12:通过床边纳米沉淀制备的低PEG LNP和无PEG LNP
配制具有减少的PEG覆盖或无PEG输入的脂质纳米颗粒,以确定床边纳米沉淀程序所需的短稳定性窗口是否减少了制剂中对空间稳定剂(如PEG)的需要。
将通过静态混合方法在酸性(pH 5条件)下制备的床边纳米沉淀制剂与标准制剂进行了比较。在给药之前,将制剂在酸性(pH 5)稀释剂中给药或用PBS(pH 7.4)中和。制剂含有以下组成:N:P 5.8且脂质摩尔比为50:10:39.5:0.5的可电离脂质1:DSPC:Chol:(PEG
表20:体内给药的PEG减少的制剂和无PEG制剂的制剂描述
向雌性CD-1小鼠(n=5)IV给药0.5mg/kg荧光素酶mRNA,在6小时取得全身(图56)、离体肝脏(图57)、脾脏(图58)和肺(图59)读数。PBS作为对照组给药。
实施例13:具有EA-13的床边纳米沉淀N与P比例筛选
使用静态混合方法和作为高pKa脂质的EA-13制备床边纳米沉淀制剂,以驱动包封。将制剂纳米沉淀并在中性pH下给药。相对于mRNA磷酸盐,以2个电荷当量将EA-13添加至每种制剂中。实施例13中的制剂中使用的EA-13脂质在图60中示出。
向雌性Cd-1小鼠给予2ug hEPO mRNA IM,在6小时(图61)和24小时(图62)取得hEPO读数,并且在6小时取得IP10(图63)和MCP-1(图64)的细胞因子读数。
表21:在时间零点实施例13给药制剂的表征
表22:在5℃下20小时后实施例13给药制剂的表征
等效方案
本发明的一个或多个实施方案的细节在上文随附描述中进行阐述。虽然与本文所描述的那些方法和材料类似或等效的任何方法和材料可用于本公开的实践或测试中,但现在描述优选的方法和材料。本发明的其他特征、目的和优点将是从说明书和权利要求书清楚的。在说明书和所附权利要求书中,除非上下文另外清楚地指出,否则单数形式包括复数指示物。除非另外定义,否则本文所用的所有技术和科学术语都具有与本公开所属领域中的普通技术人员通常所理解的相同含义。本说明书中引用的所有专利和公布均以引用的方式并入。
前述描述仅出于说明的目的给出,并且不意图将本发明限制于所公开的精确形式,而是由所附的权利要求书来限定。
- 脂质纳米颗粒的制备及其施用方法
- 一种可电离脂质分子及其制备方法及其在制备脂质纳米颗粒的应用
