一种利用三维荧光光谱检测黄素蛋白的方法
文献发布时间:2023-06-19 12:22:51
技术领域
本发明涉及一种利用三维荧光光谱检测黄素蛋白的方法,属于酶蛋白检测领域。
背景技术
黄素蛋白是一类结合黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)或黄素单核苷酸(flavin mononucleotide,FMN)辅酶的酶类,在机体内执行氧化还原、生物能量合成、生物降解、细胞凋亡、神经发育、生物合成等重要的生物学功能。例如肌氨酸氧化酶被广泛用于临床试验中肌酐水平的测定,在农业领域中可以加快N-甲基有机氮农药的生物降解,在食品领域用于检测葡萄酒样品中的有机酸;胆固醇氧化酶可用于临床样品中胆固醇含量的测定,还可用于生物催化获得甾体激素药物前体的制备。
黄素氧化酶的应用范围不断扩大,尤其在精细化学品生物合成领域中,相比化学法氧化还原的苛刻条件,黄素氧化酶具有高效、高选择性、条件温和等特点,是一类环境友好的生物催化剂,在化学品生物合成中越来越受到人们的青睐。研究黄素氧化酶可为其在医疗诊断和精细化工方面的应用提供技术支持。此外,黄素蛋白以FAD或FMN为辅基的蛋白,探讨辅基对黄素氧化酶蛋白催化性能的相互作用、酶蛋白分子结构的进化意义等,具有一定的理论价值。通用检测黄素蛋白的方法主要有考马斯亮蓝法或紫外检测,它们会随着样品中的蛋白种类和纯度的不同,存在结果特异性或灵敏度低的情况。尤其在黄素蛋白粗酶液样品测试中,黄素蛋白的特异性很低。
发明内容
本发明的目的是为了快速和准确的检测黄素蛋白,解决了在基因工程菌发酵的黄素蛋白粗酶液中杂蛋白影响黄素蛋白准确、快速和高灵敏度的定性目的蛋白的技术问题。
本发明提供了一种利用三维荧光光谱检测黄素蛋白的方法,所述方法的步骤如下:
利用三维荧光光谱技术获得待检测的样品溶液的三维荧光图谱,如果三维荧光图谱中有FAD或FMA的荧光特征峰,FAD或FMA在激发波长280-550nm范围和发射波长的450-650nm范围下具有荧光特征峰,则待检测的样品溶液含有黄素蛋白。
在一种实施方式中,所述黄素蛋白为肌氨酸氧化酶、胆固醇氧化酶、黄嘌呤氧化酶或芳香基醇氧化酶。。
在一种实施方式中,所述三维荧光光谱技术的条件为PMT电压为700V。
本发明还提供了一种利用三维荧光光谱技术定量黄素蛋白的方法,利用三维荧光光谱技术检测获得待测样品中黄素蛋白的三维荧光光谱,根据回归方程定量待检测的黄素蛋白。
在一种实施方式中,所述回归方程代表的是FAD荧光强度与黄素蛋白的浓度之间的线性关系。
在一种实施方式中,所述黄素蛋白为肌氨酸氧化酶。
在一种实施方式中,所述回归方程为I
本发明还提供了上述检测黄素蛋白和定量黄素蛋白的方法在筛选或鉴定表达黄素蛋白的基因工程菌中的应用。
在一种实施方式中,所述基因工程菌为细菌或者真菌。所述细菌不限于大肠杆菌和枯草芽孢杆菌。所述真菌不限于酵母菌。
本发明还提供了上述检测黄素蛋白和定量黄素蛋白的方法在定性或定量在粗酶液中黄素蛋白含量中的应用。
有益效果:
(1)本发明在实践中应用三维荧光光谱技术对粗酶液的三维荧光光谱数据进行定性分析,根据FAD荧光特征峰的存在,判断出粗酶液是否含有黄素蛋白。基于不同黄素蛋白浓度样本建立FAD荧光强度与蛋白浓度拟合曲线,后期仅需检测黄素蛋白中FAD荧光强度即可快速测量粗酶液中黄素蛋白的蛋白浓度,为其他以FAD为辅酶的黄素类蛋白快速检测分析提供借鉴。
(2)与现有技术相比,三维荧光光谱分析灵敏度高、操作简单,无需复杂的样品预处理步骤。
(3)本发明提供的三维荧光光谱法定量基因工程菌表达的粗酶液中SOX酶,预测均方根误差(RMSEP)为0.0978,平均浓度回收率为99.7%,准确度高,灵敏度为1.46×10
附图说明
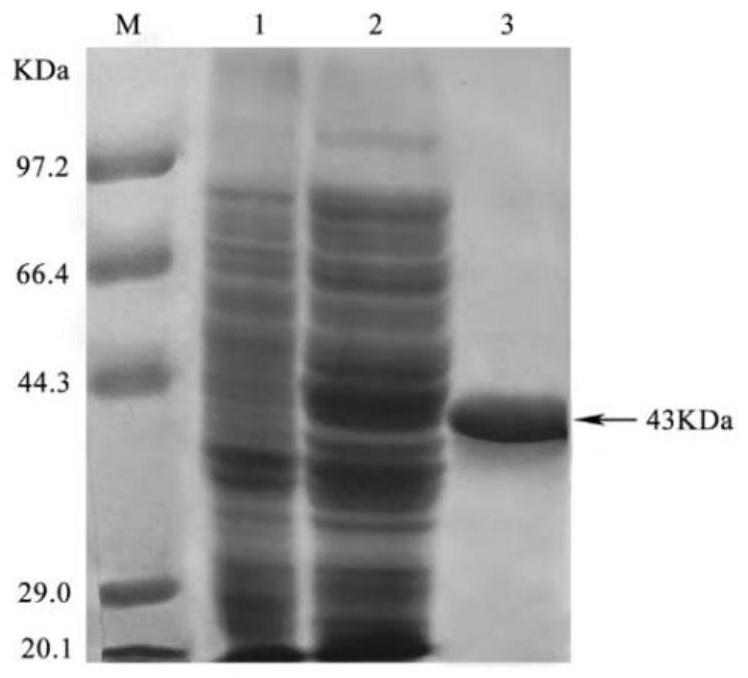
图1为BL21(DE3)/pET28a粗酶液(1),BL21(DE3)/pET28a-sox粗酶液(2)和SOX溶液(3)SDS-PAGE分析,其中,M为蛋白质相对分子质量标准,1为BL21(DE3)/pET28a粗酶液;2为BL21(DE3)/pET28a-sox粗酶液,3为0.5mg/mL SOX溶液;
图2为游离FAD分子式与结构;
图3为游离FAD纯物质三维荧光图谱;
图4为肌氨酸氧化酶的纯酶液中及对照Tris-HCl缓冲液在400/700V PMT电压下三维荧光图谱,其中,a为20mmol/L Tris-HCl缓冲液(700PMT电压),b为0.5mg/mL SOX的纯酶液(700PMT电压);
图5为不同酶浓度的SOX的纯酶液中FAD荧光强度与SOX蛋白浓度拟合曲线,其中,横坐标是蛋白质浓度,纵坐标是荧光强度;
图6为不同稀释倍数的BL21(DE3)/pET28a粗酶液和pET28a-sox粗酶液三维荧光图谱,其中,a为BL21(DE3)/pET28a粗酶液,b为BL21(DE3)/pET28a粗酶液稀释10倍,c为BL21(DE3)/pET28a粗酶液稀释100倍,d为BL21(DE3)/pET28a-sox粗酶液,e为BL21(DE3)/pET28a-sox粗酶液稀释10倍,f为BL21(DE3)/pET28a-sox粗酶液稀释100倍;
图7为胆固醇氧化酶在700V PMT电压下三维荧光图谱;
图8为不含胆固醇氧化酶的粗酶液对照组和含有胆固醇氧化酶的粗酶液的三维荧光图谱,其中,A为不含胆固醇氧化酶的粗酶液对照组的三维荧光图谱,B为含有胆固醇氧化酶的粗酶液的三维荧光图谱;
图9为不同蛋白浓度的SOX的纯酶液和Tris-HCl缓冲液中FAD三维荧光特征峰位置及荧光强度,其中,a为20mmol·L
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的保护范围不仅局限于这些实例。
检测SOX酶的酶活的方法记载在Lee S,Jia B,Pham B P,Shao Y,Kwak J M,Cheong G W.Extremophiles,2012,16(1):87-93.和Ji W M,Chen Y L,Zhang H C,WangW.J Food Science and Biotechnol,2000,19(3):251-254.
F-7000荧光光谱仪(日本日立公司);pHS-3TC型pH计(德国赛多利斯股份有限公司);电热恒温水浴锅(上海医疗器械五厂);蛋白质电泳仪(美国BIO-RAD公司)。
黄素腺嘌呤二核苷酸(FAD)(纯度约为97%,上海麦克林生化科技有限公司);L-色氨酸(纯度约为99%,上海麦克林生化科技有限公司);SDS-PAGE凝胶电泳试剂盒(上海生物工程有限公司)。实验用水为超纯水,其他试剂均为分析纯。
LB培养基:10.0g·L
TB培养基:12.0g·L
选用均方根误差(RMSEP)和平均浓度回收率(RE)评价定量模型是否适用于SOX浓度测定。平均回收率是衡量预测SOX蛋白浓度相对真实蛋白浓度的准确度,回收率的理想范围被认为是居于80%-120%之间。均方根误差是指实际蛋白浓度与根据荧光特征峰荧光强度计算得到的预测值之间差值的平方与样本个数n比值后开平方,其对预测值中出现较小以及较大的误差都较为灵敏,能够很好地反映出定量曲线预测结果的精密度,其计算公式为:
粗酶液是指发酵液离心后获得菌体,菌体破碎后离心,得到的上清液叫粗酶液。
实施例1.利用三维荧光光谱检测黄素蛋白的方法
检测肌氨酸氧化酶(SOX酶)
1.配制5μmol FAD溶液,避光保存,取3mL FAD溶液,利用在F-7000荧光光谱仪,在PMT电压为700V条件下采集FAD图谱如图3所示,结果显示FAD荧光特征峰在λex=330-500nm和λem=500-600nm范围内,FAD荧光峰的荧光强度最大值出现在λex/λem=396/456nm处。
2.重组肌氨酸氧化酶(SOX)纯酶制备
将Bacillus sp.BSD-8来源的肌氨酸氧化酶基因(GenBank:AY626822.2)克隆至载体pET28a,将重组表达质粒pET28a-sox转化至E.coli BL21(DE3)中进行诱导表达。从固体平板挑取单菌落,接入LB培养基,37℃培养过夜。按照5%接种量接入TB培养基,37℃,200r/min培养至菌体浓度OD
取含有SOX的粗酶液上清用Ni-NTA琼脂糖凝胶色谱柱液进行纯化,将纯化后得到的肌氨酸氧化酶纯酶样品用超滤管浓缩除盐后作为一级储备液在4℃条件下避光保存得到SOX的纯酶液。
SOX酶活测定方法:测定SOX酶活,在5mL EP管中添加10μL待测酶液,然后添加3mL显色液,混匀后添加150μL肌氨酸底物(0.2mol/L),混匀后置于37℃水浴锅中反应10min后,沸水煮3min终止反应,冷却后在500nm处测定吸光度SOX酶活定义:在37℃下,每分钟内催化1μmol肌氨酸生成过氧化氢所需要的SOX定义成一个酶活单位(U)。
经过SDS-PAGE和酶活的分析结果如图1所示:含有SOX的粗酶液(泳道2)与不含有SOX的粗酶液(泳道1)相比,在43kDa处有蛋白质特异条带,表达量约占总蛋白质的30%。泳道3为亲和纯化后脱盐的SOX,在相对分子质量43kDa处有明显单一蛋白质条带,比酶活为33.82U/mg。
3.三维荧光图谱采集及数据处理
使用日立F-7000荧光光谱仪采集三维荧光图谱,设置荧光激发波长为:240-519nm,间隔3nm;发射波长为240-660nm,间隔3nm;仪器设置参数分别为:激发狭缝5nm,发射狭缝5nm,光电倍增管(PMT)电压400/700V,扫描速度2400nm/min,在1cm石英比色皿中测量。用编写的光谱特征参数提取算法对其进行解析,用Delaunay三角形内插值法去除瑞利散射。数据处理在MATLAB2018b版本中运行。
游离黄素腺嘌呤二核苷酸(FAD)的三维荧光图谱具有共轭π键结构(如杂环或芳香环)或刚性平面结构的物质可以产生较大强度的荧光。黄素蛋白质分子中具有杂环或芳香环的物质有FAD(分子式结构如图2)。FAD含有异咯嗪环,具有共轭π键结构,具有良好的荧光特征结构。使用400PMT电压无法检测到FAD的荧光,提高设备检测限可采集FAD三维荧光图谱,选取700PMT电压测量FAD荧光峰。
在PMT电压700V条件下采集20mmol/L Tri-HCl缓冲液(对照组)和0.5mg/mL SOX的纯酶液中FAD三维荧光图谱,三维荧光图谱如图4所示。观察0.5mg·mL
因为酶中FAD荧光特征峰是酶的二级结构和辅酶所共同作用形成的,所以波长范围会有一定偏移,需要加大荧光特征峰波长范围,所以据实施例1得知FAD荧光特征峰波长范围前后范围加上50nm得到的范围是:λex=280-550nm和λem=450-650nm,在PMT电压700V下检测肌氨酸氧化酶中FAD荧光特征峰在λ
4.观察不同蛋白浓度的SOX的纯酶液中FAD荧光特征峰和Tris-HCl缓冲液作为对照,PMT电压700V条件下SOX的纯酶液中FAD荧光峰与图3中的游离态FAD荧光峰相比,结果如图9所示,Tris-HCl缓冲液的荧光峰型与FAD荧光特征峰的峰型不同,没有FAD的荧光特征峰,没有FAD的荧光特征峰。
0.05mg·mL
实施例2.利用三维荧光光谱技术定量肌氨酸氧化酶
1.肌氨酸氧化酶纯酶内源荧光特征峰位置的确定
按梯度选取不同蛋白浓度的肌氨酸氧化酶纯酶液样本在700PMT电压下测量FAD荧光强度,以FAD荧光强度(ΔF,a.u.)对肌氨酸氧化酶蛋白浓度(c,mg/mL)进行线性拟合,SOX活性蛋白浓度在0.05-1.0mg/mL范围内线性关系良好,根据肌氨酸氧化酶的纯酶液中FAD荧光强度与肌氨酸氧化酶蛋白浓度之间的线性关系,如图5所示,回归方程I
2.为了验证在粗酶液中根据FAD荧光强度预测SOX蛋白浓度的准确度,将SOX用对照组粗酶液稀释成终浓度为0.05-0.5mg/mL 10个样本,计算样品的回收率(RE)与预测均方根误差(RMSEP),结果见表1和图6,FAD为SOX中特异性辅酶,区别于E.coli发酵的粗酶液中其他的杂蛋白,根据FAD荧光峰的存在,可以快速判断出粗酶液中含有SOX,根据FAD荧光强度可计算出粗酶液中所含SOX活性蛋白浓度。结果表明,根据FAD荧光强度预测SOX活性蛋白浓度模型的预测均方根误差(RMSEP)为0.0978,平均浓度回收率为99.7%,有较好的回收率和较低的预测均方根误差,证明在粗酶液中检测结果可靠,准确度高。
灵敏度:根据IUPAC检出限定义式,平行测定11次空白液的荧光强度,经检出限3σ/N计算,测得FAD的最低检出限为1.46×10
表1粗酶液中FAD荧光强度预测SOX活性蛋白浓度结果及预测准确度评价表
实施例3.利用三维荧光光谱技术检测胆固醇氧化酶粗酶液中胆固醇氧化酶的存在
1.胆固醇氧化酶纯酶内源荧光特征峰位置的确定
Burkholderia cepacia ZWS15来源的胆固醇氧化酶基因(GenBank:MK757498.1)克隆至载体pET28a,将重组表达质粒转化至E.coli BL21(DE3)中进行诱导表达。构建的工程菌E.coli BL21(DE3)-pET20b(+)-COD单菌落至培养基中,37℃,200rpm,过夜培养,接入LB培养基,37℃培养过夜。按照5%接种量接入TB培养基,37℃,200r/min培养至菌体浓度OD
2.在PMT电压700V条件下采集胆固醇氧化酶中FAD三维荧光图谱,三维荧光图谱如图7所示。在PMT电压700V下检测胆固醇氧化酶中FAD荧光特征峰波在:λ
3.分别将含有胆固醇氧化酶的粗酶液和不含有胆固醇氧化酶的粗酶液对照组在PMT电压700V条件下采集三维荧光图谱,三维荧光图谱图8。E.coli发酵的粗酶液中其他的杂蛋白(杂蛋白在这里指为表达宿主自带的蛋白,即非目的蛋白)即不含有胆固醇氧化酶的粗酶液,对照组的峰型与FAD荧光特征峰的峰型不同,没有FAD的荧光特征峰,说明粗酶液对照组不含有胆固醇氧化酶。
- 一种利用三维荧光光谱检测黄素蛋白的方法
- 一种利用细胞分泌蛋白SERS光谱检测药物细胞毒性方法
