有机电致发光元件和电子设备
文献发布时间:2023-06-19 18:35:48
技术领域
本发明涉及有机电致发光元件和电子设备。
背景技术
有机电致发光元件(以下有时称为“有机EL元件”。)被应用于移动电话和电视等的全彩显示器。若对有机EL元件施加电压,则从阳极向发光层注入空穴,而且从阴极向发光层注入电子。然后,在发光层中所注入的空穴与电子发生复合而形成激子。此时,根据电子自旋的统计规律,单重态激子以25%的比例生成,并且三重态激子以75%的比例生成。
为了实现有机EL元件的性能改善,例如在专利文献1~5中,对有机EL元件中使用的化合物进行了各种各样的研究。另外,在专利文献6中,为了实现有机EL元件的性能改善,记载了由于2个三重态激子的碰撞融合而生成单重态激子的现象(以下有时称为三重态三重态融合(Triplet-Triplet Fusion)=TTF现象)。
作为有机EL元件的性能,例如可以举出亮度、发光波长、色度、发光效率、驱动电压和寿命。
现有技术文献
专利文献
专利文献1:日本特开2013-157552号公报
专利文献2:日本特开2009-016478号公报
专利文献3:国际公开第2007/138906号
专利文献4:美国专利申请公开2019/280209号说明书
专利文献5:日本特开2007-294261号公报
专利文献6:国际公开第2010/134350号
发明内容
发明要解决的问题
本发明的目的在于,提供抑制了色度的下降且提高了发光效率的有机电致发光元件和搭载了该有机电致发光元件的电子设备。
用于解决问题的手段
根据本发明的一个方案,提供一种有机电致发光元件,其具有阳极、阴极、第一发光层和第二发光层,上述第一发光层和上述第二发光层配置于上述阳极与上述阴极之间,上述第一发光层包含第一主体材料、第一有机材料和第一掺杂剂材料,上述第二发光层包含第二主体材料和第二掺杂剂材料,上述第一主体材料、上述第一有机材料与上述第二主体材料彼此为结构不同的化合物,上述第一掺杂剂材料与上述第二掺杂剂材料彼此为结构相同的化合物、或者结构不同的化合物,上述第一主体材料、上述第一有机材料、上述第二主体材料、上述第一掺杂剂材料和上述第二掺杂剂材料满足下述数学式(数学式1)、(数学式2)、(数学式3)、(数学式5)和(数学式6)的关系。
T
T
T
S
S
(上述数学式(数学式1)、(数学式2)、(数学式3)、(数学式5)和(数学式6)中,
T
T
T
T
S
S
S
根据本发明的一个方案,提供搭载了上述的本发明的一个方案涉及的有机电致发光元件的电子设备。
根据本发明的一个方案,能够提供抑制了色度的下降且提高了发光效率的有机电致发光元件。另外,根据本发明的一个方案,能够提供搭载了该有机电致发光元件的电子设备。
附图说明
图1是示出本发明的一个实施方式涉及的有机电致发光元件的一例的大致构成的图。
具体实施方式
[定义]
在本说明书中,氢原子意味着包含中子数不同的同位素、即氕(protium)、氘(deuterium)和氚(tritium)。
在本说明书中,在化学结构式中,没有明确显示“R”等符号和表示氘原子的“D”的可键合位置设为键合有氢原子、即氕原子、氘原子或氚原子。
在本说明书中,成环碳数是指原子以环状键合的结构的化合物(例如单环化合物、稠环化合物、桥环化合物、碳环化合物和杂环化合物)的构成该环自身的原子之中的碳原子的数量。该环被取代基取代时,取代基中所含的碳不包括在成环碳数中。下文中记载的“成环碳数”只要没有另行记载就同样设定。例如,苯环的成环碳数为6,萘环的成环碳数为10,吡啶环的成环碳数为5,呋喃环的成环碳数为4。另外,例如9,9-二苯基芴基的成环碳数为13,9,9’-螺双芴基的成环碳数为25。
另外,在苯环上作为取代基例如取代有烷基时,该烷基的碳数不包括在苯环的成环碳数中。因此,取代有烷基的苯环的成环碳数为6。另外,在萘环上作为取代基例如取代有烷基时,该烷基的碳数不包括在萘环的成环碳数中。因此,取代有烷基的萘环的成环碳数为10。
在本说明书中,成环原子数是指原子以环状键合的结构(例如单环、稠环和集合环)的化合物(例如单环化合物、稠环化合物、桥环化合物、碳环化合物和杂环化合物)的构成该环自身的原子的数量。不构成环的原子(例如对构成环的原子的键进行封端的氢原子)、该环被取代基取代时的取代基中所含的原子不包括在成环原子数中。下文中记载的“成环原子数”只要没有另行记载就同样设定。例如,吡啶环的成环原子数为6,喹唑啉环的成环原子数为10,呋喃环的成环原子数为5。例如,键合于吡啶环的氢原子或构成取代基的原子的数量不包括在吡啶成环原子数的数量中。因此,键合有氢原子或取代基的吡啶环的成环原子数为6。另外,例如喹唑啉环的碳原子上键合的氢原子或构成取代基的原子不包括在喹唑啉环的成环原子数的数量中。因此,键合有氢原子或取代基的喹唑啉环的成环原子数为10。
在本说明书中,“取代或未取代的碳数XX~YY的ZZ基”这样的表述中的“碳数XX~YY”表示ZZ基为未取代时的碳数,发生了取代时的取代基的碳数不包括在内。在此,“YY”大于“XX”,“XX”是指1以上的整数,“YY”是指2以上的整数。
在本说明书中,“取代或未取代的原子数XX~YY的ZZ基”这样的表述中的“原子数XX~YY”表示ZZ基为未取代时的原子数,发生了取代时的取代基的原子数不包括在内。在此,“YY”大于“XX”,“XX”是指1以上的整数,“YY”是指2以上的整数。
在本说明书中,未取代的ZZ基是表示“取代或未取代的ZZ基”为“未取代的ZZ基”的情况,取代的ZZ基表示“取代或未取代的ZZ基”为“取代的ZZ基”的情况。
在本说明书中,表述为“取代或未取代的ZZ基”时的“未取代”是指ZZ基中的氢原子未与取代基发生置换。“未取代的ZZ基”中的氢原子为氕原子、氘原子或氚原子。
另外,在本说明书中,表述为“取代或未取代的ZZ基”时的“取代”是指,ZZ基中的1个以上的氢原子与取代基发生了置换。表述为“被AA基取代的BB基”时的“取代”也同样地是指BB基中的1个以上的氢原子与AA基发生了置换。
“本说明书中记载的取代基”
以下对本说明书中记载的取代基进行说明。
本说明书中记载的“未取代的芳基”的成环碳数只要本说明书中没有另行记载,则为6~50,优选为6~30,更优选为6~18。
本说明书中记载的“未取代的杂环基”的成环原子数只要本说明书中没有另行记载,则为5~50,优选为5~30,更优选为5~18。
本说明书中记载的“未取代的烷基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~20,更优选为1~6。
本说明书中记载的“未取代的烯基”的碳数只要本说明书中没有另行记载,则为2~50,优选为2~20,更优选为2~6。
本说明书中记载的“未取代的炔基”的碳数只要本说明书中没有另行记载,则为2~50,优选为2~20,更优选为2~6。
本说明书中记载的“未取代的环烷基”的成环碳数只要本说明书中没有另行记载,则为3~50,优选为3~20,更优选为3~6。
本说明书中记载的“未取代的亚芳基”的成环碳数只要本说明书中没有另行记载,则为6~50,优选为6~30,更优选为6~18。
本说明书中记载的“未取代的二价杂环基”的成环原子数只要本说明书中没有另行记载,则为5~50,优选为5~30,更优选为5~18。
本说明书中记载的“未取代的亚烷基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~20,更优选为1~6。
·“取代或未取代的芳基”
作为本说明书中记载的“取代或未取代的芳基”的具体例(具体例组G1),可以举出以下的未取代的芳基(具体例组G1A)和取代的芳基(具体例组G1B)等。(在此,未取代的芳基是指“取代或未取代的芳基”为“未取代的芳基”的情况,取代的芳基是指“取代或未取代的芳基”为“取代的芳基”的情况。)。在本说明书中,仅表述为“芳基”时,包括“未取代的芳基”和“取代的芳基”这两者。
“取代的芳基”是指“未取代的芳基”的1个以上的氢原子与取代基发生了置换后的基团。作为“取代的芳基”,例如可以举出下述具体例组G1A的“未取代的芳基”的1个以上的氢原子与取代基发生了置换后的基团、以及下述具体例组G1B的取代的芳基的例子等。需要说明的是,在此列举的“未取代的芳基”的例子和“取代的芳基”的例子仅为一例,本说明书中记载的“取代的芳基”中也包括下述具体例组G1B的“取代的芳基”中的芳基自身的碳原子上键合的氢原子进一步与取代基发生了置换后的基团、以及下述具体例组G1B的“取代的芳基”中的取代基的氢原子进一步与取代基发生了置换后的基团。
·未取代的芳基(具体例组G1A):
苯基、
对联苯基、
间联苯基、
邻联苯基、
对三联苯-4-基、
对三联苯-3-基、
对三联苯-2-基、
间三联苯-4-基、
间三联苯-3-基、
间三联苯-2-基、
邻三联苯-4-基、
邻三联苯-3-基、
邻三联苯-2-基、
1-萘基、
2-萘基、
蒽基、
苯并蒽基、
菲基、
苯并菲基、
非那烯基、
芘基、
苯并
三亚苯基、
苯并三亚苯基、
并四苯基、
并五苯基、
芴基、
9,9’-螺双芴基、
苯并芴基、
二苯并芴基、
荧蒽基、
苯并荧蒽基、
苝基和
从下述通式(TEMP-1)~(TEMP-15)所示的环结构除去1个氢原子由此衍生的一价芳基。
【化学式1】
【化学式2】
·取代的芳基(具体例组G1B):
邻甲苯基、
间甲苯基、
对甲苯基、
对二甲苯基、
间二甲苯基、
邻二甲苯基、
对异丙基苯基、
间异丙基苯基、
邻异丙基苯基、
对叔丁基苯基、
间叔丁基苯基、
邻叔丁基苯基、
3,4,5-三甲基苯基、
9,9-二甲基芴基、
9,9-二苯基芴基、
9,9-双(4-甲基苯基)芴基、
9,9-双(4-异丙基苯基)芴基、
9,9-双(4-叔丁基苯基)芴基、
氰基苯基、
三苯基甲硅烷基苯基、
三甲基甲硅烷基苯基、
苯基萘基、
萘基苯基和
从上述通式(TEMP-1)~(TEMP-15)所示的环结构衍生的一价基团的1个以上的氢原子与取代基发生了置换后的基团。
·“取代或未取代的杂环基”
本说明书中记载的“杂环基”是成环原子中包含至少1个杂原子的环状的基团。作为杂原子的具体例,可以举出氮原子、氧原子、硫原子、硅原子、磷原子和硼原子。
本说明书中记载的“杂环基”是单环的基团或者稠环的基团。
本说明书中记载的“杂环基”是芳香族杂环基或者非芳香族杂环基。
作为本说明书中记载的“取代或未取代的杂环基”的具体例(具体例组G2),可以举出以下的未取代的杂环基(具体例组G2A)和取代的杂环基(具体例组G2B)等。(在此,未取代的杂环基是指“取代或未取代的杂环基”为“未取代的杂环基”的情况,取代的杂环基是指“取代或未取代的杂环基”为“取代的杂环基”的情况。)在本说明书中,仅表述为“杂环基”时包括“未取代的杂环基”和“取代的杂环基”这两者。
“取代的杂环基”是指“未取代的杂环基”的1个以上的氢原子与取代基发生了置换后的基团。“取代的杂环基”的具体例可以举出下述具体例组G2A的“未取代的杂环基”的氢原子发生了取代后的基团、以及下述具体例组G2B的取代的杂环基的例子等。需要说明的是,在此列举的“未取代的杂环基”的例子、“取代的杂环基”的例子仅为一例,本说明书中记载的“取代的杂环基”中还包括具体例组G2B的“取代的杂环基”中的杂环基自身的成环原子上键合的氢原子进一步与取代基发生了置换后的基团、以及具体例组G2B的“取代的杂环基”中的取代基的氢原子进一步与取代基发生了置换后的基团。
具体例组G2A例如包括以下的包含氮原子的未取代的杂环基(具体例组G2A1)、包含氧原子的未取代的杂环基(具体例组G2A2)、包含硫原子的未取代的杂环基(具体例组G2A3)以及从下述通式(TEMP-16)~(TEMP-33)所示的环结构除去1个氢原子由此衍生的一价杂环基(具体例组G2A4)。
具体例组G2B例如包括以下的包含氮原子的取代的杂环基(具体例组G2B1)、包含氧原子的取代的杂环基(具体例组G2B2)、包含硫原子的取代的杂环基(具体例组G2B3)以及从下述通式(TEMP-16)~(TEMP-33)所示的环结构衍生的一价杂环基的1个以上的氢原子与取代基发生了置换后的基团(具体例组G2B4)。
·包含氮原子的未取代的杂环基(具体例组G2A1):
吡咯基、
咪唑基、
吡唑基、
三唑基、
四唑基、
噁唑基、
异噁唑基、
噁二唑基、
噻唑基、
异噻唑基、
噻二唑基、
吡啶基、
哒嗪基、
嘧啶基、
吡嗪基、
三嗪基、
吲哚基、
异吲哚基、
吲嗪基、
喹嗪基、
喹啉基、
异喹啉基、
噌啉基、
酞嗪基、
喹唑啉基、
喹喔啉基、
苯并咪唑基、
吲唑基、
菲咯啉基、
菲啶基、
吖啶基、
吩嗪基、
咔唑基、
苯并咔唑基、
吗啉基、
吩噁嗪基、
吩噻嗪基、
氮杂咔唑基以及二氮杂咔唑基。
·包含氧原子的未取代的杂环基(具体例组G2A2):
呋喃基、
噁唑基、
异噁唑基、
噁二唑基、
呫吨基、
苯并呋喃基、
异苯并呋喃基、
二苯并呋喃基、
萘并苯并呋喃基、
苯并噁唑基、
苯并异噁唑基、
吩噁嗪基、
吗啉基、
二萘并呋喃基、
氮杂二苯并呋喃基、
二氮杂二苯并呋喃基、
氮杂萘并苯并呋喃基以及
二氮杂萘并苯并呋喃基。
·包含硫原子的未取代的杂环基(具体例组G2A3):
噻吩基、
噻唑基、
异噻唑基、
噻二唑基、
苯并噻吩基(benzothienyl)、
异苯并噻吩基(isobenzothienyl)、
二苯并噻吩基(dibenzothienyl)、
萘并苯并噻吩基(naphthobenzothienyl)、
苯并噻唑基、
苯并异噻唑基、
吩噻嗪基、
二萘并噻吩基(dinaphthothienyl)、
氮杂二苯并噻吩基(azadibenzothienyl)、
二氮杂二苯并噻吩基(diazadibenzothienyl)、
氮杂萘并苯并噻吩基(azanaphthobenzothienyl)以及
二氮杂萘并苯并噻吩基(diazanaphthobenzothienyl)。
·从下述通式(TEMP-16)~(TEMP-33)所示的环结构除去1个氢原子由此衍生的一价杂环基(具体例组G2A4):
【化学式3】
【化学式4】
在上述通式(TEMP-16)~(TEMP-33)中,X
在上述通式(TEMP-16)~(TEMP-33)中,X
·包含氮原子的取代的杂环基(具体例组G2B1):
(9-苯基)咔唑基、
(9-联苯基)咔唑基、
(9-苯基)苯基咔唑基、
(9-萘基)咔唑基、
二苯基咔唑-9-基、
苯基咔唑-9-基、
甲基苯并咪唑基、
乙基苯并咪唑基、
苯基三嗪基、
联苯基三嗪基、
二苯基三嗪基、
苯基喹唑啉基以及联苯基喹唑啉基。
·包含氧原子的取代的杂环基(具体例组G2B2):
苯基二苯并呋喃基、
甲基二苯并呋喃基、
叔丁基二苯并呋喃基以及
螺[9H-呫吨-9,9’-[9H]芴]的一价残基。
·包含硫原子的取代的杂环基(具体例组G2B3):
苯基二苯并噻吩基、
甲基二苯并噻吩基、
叔丁基二苯并噻吩基以及
螺[9H-噻吨-9,9’-[9H]芴]的一价残基。
·从上述通式(TEMP-16)~(TEMP-33)所示的环结构衍生的一价杂环基的1个以上的氢原子与取代基发生了置换后的基团(具体例组G2B4):
上述“一价杂环基的1个以上的氢原子”是指,选自该一价杂环基的成环碳原子上键合的氢原子、XA和YA的至少任一个为NH时的氮原子上键合的氢原子以及XA和YA中的一者为CH2时的亚甲基的氢原子中的1个以上的氢原子。
·“取代或未取代的烷基”
作为本说明书中记载的“取代或未取代的烷基”的具体例(具体例组G3),可以举出以下的未取代的烷基(具体例组G3A)和取代的烷基(具体例组G3B)。(在此,未取代的烷基是指“取代或未取代的烷基”为“未取代的烷基”的情况,取代的烷基是指“取代或未取代的烷基”为“取代的烷基”的情况。)以下,仅表述为“烷基”时,包括“未取代的烷基”和“取代的烷基”这两者。
“取代的烷基”是指“未取代的烷基”中的1个以上的氢原子与取代基发生了置换后的基团。作为“取代的烷基”的具体例,可以举出下述的“未取代的烷基”(具体例组G3A)中的1个以上的氢原子与取代基发生了置换后的基团以及取代的烷基(具体例组G3B)的例子等。在本说明书中,“未取代的烷基”中的烷基是指链状的烷基。因此,“未取代的烷基”包括作为直链的“未取代的烷基”以及作为支链状的“未取代的烷基”。需要说明的是,在此列举的“未取代的烷基”的例子、“取代的烷基”的例子仅为一例,本说明书中记载的“取代的烷基”还包括具体例组G3B的“取代的烷基”中的烷基自身的氢原子进一步与取代基发生了置换后的基团以及具体例组G3B的“取代的烷基”中的取代基的氢原子进一步与取代基发生了置换后的基团。
·未取代的烷基(具体例组G3A):
甲基、
乙基、
正丙基、
异丙基、
正丁基、
异丁基、
仲丁基以及叔丁基。
·取代的烷基(具体例组G3B):
七氟丙基(包括异构体)、
五氟乙基、
2,2,2-三氟乙基以及
三氟甲基。
·“取代或未取代的烯基”
作为本说明书中记载的“取代或未取代的烯基”的具体例(具体例组G4),可以举出以下的未取代的烯基(具体例组G4A)以及取代的烯基(具体例组G4B)等。(在此,未取代的烯基是指“取代或未取代的烯基”为“未取代的烯基”的情况,“取代的烯基”是指“取代或未取代的烯基”为“取代的烯基”的情况。)在本说明书中,仅仅表述为“烯基”时,包括“未取代的烯基”和“取代的烯基”这两者。
“取代的烯基”是指“未取代的烯基”中的1个以上的氢原子与取代基发生了置换后的基团。作为“取代的烯基”的具体例,可以举出下述的“未取代的烯基”(具体例组G4A)具有取代基的基团以及取代的烯基(具体例组G4B)的例子等。需要说明的是,在此列举的“未取代的烯基”的例子、“取代的烯基”的例子仅为一例,本说明书中记载的“取代的烯基”还包括具体例组G4B的“取代的烯基”中的烯基自身的氢原子进一步与取代基发生了置换后的基团以及具体例组G4B的“取代的烯基”中的取代基的氢原子进一步与取代基发生了置换后的基团。
·未取代的烯基(具体例组G4A):
乙烯基、
烯丙基、
1-丁烯基、
2-丁烯基以及
3-丁烯基。
·取代的烯基(具体例组G4B):
1,3-丁二烯基、
1-甲基乙烯基、
1-甲基烯丙基、
1,1-二甲基烯丙基、
2-甲基烯丙基以及
1,2-二甲基烯丙基。
·“取代或未取代的炔基”
作为本说明书中记载的“取代或未取代的炔基”的具体例(具体例组G5),可以举出以下的未取代的炔基(具体例组G5A)等。(在此,未取代的炔基是指“取代或未取代的炔基”为“未取代的炔基”的情况。)以下仅表述为“炔基”时,包括“未取代的炔基”和“取代的炔基”这两者。
“取代的炔基”是指“未取代的炔基”中的1个以上的氢原子与取代基发生了置换后的基团。作为“取代的炔基”的具体例,可以举出下述的“未取代的炔基”(具体例组G5A)中的1个以上的氢原子与取代基发生了置换后的基团等。
·未取代的炔基(具体例组G5A):
乙炔基。
·“取代或未取代的环烷基”
作为本说明书中记载的“取代或未取代的环烷基”的具体例(具体例组G6),可以举出以下的未取代的环烷基(具体例组G6A)以及取代的环烷基(具体例组G6B)等。(在此,未取代的环烷基是指“取代或未取代的环烷基”为“未取代的环烷基”的情况,取代的环烷基是指“取代或未取代的环烷基”为“取代的环烷基”的情况。)在本说明书中,仅表述为“环烷基”时,包括“未取代的环烷基”和“取代的环烷基”这两者。
“取代的环烷基”是指“未取代的环烷基”中的1个以上的氢原子与取代基发生了置换后的基团。作为“取代的环烷基”的具体例,可以举出下述的“未取代的环烷基”(具体例组G6A)中的1个以上的氢原子与取代基发生了置换后的基团以及取代的环烷基(具体例组G6B)的例子等。需要说明的是,在此列举的“未取代的环烷基”的例子、“取代的环烷基”的例子仅为一例,本说明书中记载的“取代的环烷基”还包括具体例组G6B的“取代的环烷基”中的环烷基自身的碳原子上键合的1个以上的氢原子与取代基发生了置换后的基团以及具体例组G6B的“取代的环烷基”中的取代基的氢原子进一步与取代基发生了置换后的基团。
·未取代的环烷基(具体例组G6A):
环丙基、
环丁基、
环戊基、
环己基、
1-金刚烷基、
2-金刚烷基、
1-降冰片基以及
2-降冰片基。
·取代的环烷基(具体例组G6B):
4-甲基环己基。
·“-Si(R
作为本说明书中记载的-Si(R
-Si(G1)(G1)(G1)、
-Si(G1)(G2)(G2)、
-Si(G1)(G1)(G2)、
-Si(G2)(G2)(G2)、
-Si(G3)(G3)(G3)以及
-Si(G6)(G6)(G6)。在此,
G1为具体例组G1中记载的“取代或未取代的芳基”。
G2为具体例组G2中记载的“取代或未取代的杂环基”。
G3为具体例组G3中记载的“取代或未取代的烷基”。
G6为具体例组G6中记载的“取代或未取代的环烷基”。
-Si(G1)(G1)(G1)中的多个G1相互相同或不同。
-Si(G1)(G2)(G2)中的多个G2相互相同或不同。
-Si(G1)(G1)(G2)中的多个G1相互相同或不同。
-Si(G2)(G2)(G2)中的多个G2相互相同或不同。
-Si(G3)(G3)(G3)中的多个G3相互相同或不同。
-Si(G6)(G6)(G6)中的多个G6相互相同或不同。
·“-O-(R
作为本说明书中记载的-O-(R
-O(G1)、
-O(G2)、
-O(G3)以及
-O(G6)。
在此,
G1为具体例组G1中记载的“取代或未取代的芳基”。
G2为具体例组G2中记载的“取代或未取代的杂环基”。
G3为具体例组G3中记载的“取代或未取代的烷基”。
G6为具体例组G6中记载的“取代或未取代的环烷基”。
·“-S-(R
作为本说明书中记载的-S-(R
-S(G1)、
-S(G2)、
-S(G3)以及
-S(G6)。
在此,
G1为具体例组G1中记载的“取代或未取代的芳基”。
G2为具体例组G2中记载的“取代或未取代的杂环基”。
G3为具体例组G3中记载的“取代或未取代的烷基”。
G6为具体例组G6中记载的“取代或未取代的环烷基”。
·“-N(R
作为本说明书中记载的-N(R
-N(G1)(G1)、
-N(G2)(G2)、
-N(G1)(G2)、
-N(G3)(G3)以及
-N(G6)(G6)。
在此,
G1为具体例组G1中记载的“取代或未取代的芳基”。
G2为具体例组G2中记载的“取代或未取代的杂环基”。
G3为具体例组G3中记载的“取代或未取代的烷基”。
G6为具体例组G6中记载的“取代或未取代的环烷基”。
-N(G1)(G1)中的多个G1相互相同或不同。
-N(G2)(G2)中的多个G2相互相同或不同。
-N(G3)(G3)中的多个G3相互相同或不同。
-N(G6)(G6)中的多个G6相互相同或不同。
·“卤素原子”
作为本说明书中记载的“卤素原子”的具体例(具体例组G11),可以举出氟原子、氯原子、溴原子以及碘原子等。
·“取代或未取代的氟烷基”
本说明书中记载的“取代或未取代的氟烷基”是指“取代或未取代的烷基”中的构成烷基的碳原子上键合的至少1个氢原子与氟原子发生了置换后的基团,也包括“取代或未取代的烷基”中的构成烷基的碳原子上键合的全部氢原子经氟原子置换后的基团(全氟基团)。“未取代的氟烷基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~30,更优选为1~18。“取代的氟烷基”是指“氟烷基”的1个以上的氢原子与取代基发生了置换后的基团。需要说明的是,本说明书中记载的“取代的氟烷基”中也包括“取代的氟烷基”中的烷基链的碳原子上键合的1个以上的氢原子进一步与取代基发生了置换后的基团以及“取代的氟烷基”中的取代基的1个以上的氢原子进一步与取代基发生了置换后的基团。作为“未取代的氟烷基”的具体例,可以举出上述“烷基”(具体例组G3)中的1个以上的氢原子与氟原子发生了置换后的基团的例子等。
·“取代或未取代的卤烷基”
本说明书中记载的“取代或未取代的卤烷基”是指“取代或未取代的烷基”中的构成烷基的碳原子上键合的至少1个氢原子与卤素原子发生了置换后的基团,也包括“取代或未取代的烷基”中的构成烷基的碳原子上键合的全部氢原子经卤素原子取代后的基团。“未取代的卤烷基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~30,更优选为1~18。“取代的卤烷基”是指“卤烷基”的1个以上的氢原子与取代基发生了置换后的基团。需要说明的是,本说明书中记载的“取代的卤烷基”还包括“取代的卤烷基”中的烷基链的碳原子上键合的1个以上的氢原子进一步与取代基发生了置换后的基团以及“取代的卤烷基”中的取代基的1个以上的氢原子进一步与取代基发生了置换后的基团。作为“未取代的卤烷基”的具体例,可以举出上述“烷基”(具体例组G3)中的1个以上的氢原子与卤素原子发生了置换后的基团的例子等。卤烷基有时称为卤代烷基。
·“取代或未取代的烷氧基”
作为本说明书中记载的“取代或未取代的烷氧基”的具体例,为-O(G3)所示的基团,在此,G3为具体例组G3中记载的“取代或未取代的烷基”。“未取代的烷氧基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~30,更优选为1~18。
·“取代或未取代的烷硫基”
作为本说明书中记载的“取代或未取代的烷硫基”的具体例,为-S(G3)所示的基团,在此,G3为具体例组G3中记载的“取代或未取代的烷基”。“未取代的烷硫基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~30,更优选为1~18。
·“取代或未取代的芳氧基”
作为本说明书中记载的“取代或未取代的芳氧基”的具体例,为-O(G1)所示的基团,在此,G1为具体例组G1中记载的“取代或未取代的芳基”。“未取代的芳氧基”的成环碳数只要本说明书中没有另行记载,则为6~50,优选为6~30,更优选为6~18。
·“取代或未取代的芳硫基”
作为本说明书中记载的“取代或未取代的芳硫基”的具体例,为-S(G1)所示的基团,在此,G1为具体例组G1中记载的“取代或未取代的芳基”。“未取代的芳硫基”的成环碳数只要本说明书中没有另行记载,则为6~50,优选为6~30,更优选为6~18。
·“取代或未取代的三烷基甲硅烷基”
作为本说明书中记载的“三烷基甲硅烷基”的具体例,为-Si(G3)(G3)(G3)所示的基团,在此,G3为具体例组G3中记载的“取代或未取代的烷基”。-Si(G3)(G3)(G3)中的多个G3相互相同或不同。“三烷基甲硅烷基”的各烷基的碳数只要本说明书中没有另行记载,则为1~50,优选为1~20,更优选为1~6。
·“取代或未取代的芳烷基”
作为本说明书中记载的“取代或未取代的芳烷基”的具体例,为-(G3)-(G1)所示的基团,在此,G3为具体例组G3中记载的“取代或未取代的烷基”,G1为具体例组G1中记载的“取代或未取代的芳基”。因此,“芳烷基”为“烷基”的氢原子与作为取代基的“芳基”发生了置换后的基团,为“取代的烷基”的一个方案。“未取代的芳烷基”为取代有“未取代的芳基”的“未取代的烷基”,“未取代的芳烷基”的碳数只要本说明书中没有另行记载,则为7~50,优选为7~30,更优选为7~18。
作为“取代或未取代的芳烷基”的具体例,可以举出苄基、1-苯基乙基、2-苯基乙基、1-苯基异丙基、2-苯基异丙基、苯基叔丁基、α-萘基甲基、1-α-萘基乙基、2-α-萘基乙基、1-α-萘基异丙基、2-α-萘基异丙基、β-萘基甲基、1-β-萘基乙基、2-β-萘基乙基、1-β-萘基异丙基以及2-β-萘基异丙基等。
本说明书中记载的取代或未取代的芳基只要本说明书中没有另行记载,则优选为苯基、对联苯基、间联苯基、邻联苯基、对三联苯-4-基、对三联苯-3-基、对三联苯-2-基、间三联苯-4-基、间三联苯-3-基、问三联苯-2-基、邻三联苯-4-基、邻三联苯-3-基、邻三联苯-2-基、1-萘基、2-萘基、蒽基、菲基、芘基、
本说明书中记载的取代或未取代的杂环基只要本说明书中没有另行记载,则优选为吡啶基、嘧啶基、三嗪基、喹啉基、异喹啉基、喹唑啉基、苯并咪唑基、菲咯啉基、咔唑基(1-咔唑基、2-咔唑基、3-咔唑基、4-咔唑基或9-咔唑基)、苯并咔唑基、氮杂咔唑基、二氮杂咔唑基、二苯并呋喃基、萘并苯并呋喃基、氮杂二苯并呋喃基、二氮杂二苯并呋喃基、二苯并噻吩基、萘并苯并噻吩基、氮杂二苯并噻吩基、二氮杂二苯并噻吩基、(9-苯基)咔唑基((9-苯基)咔唑-1-基、(9-苯基)咔唑-2-基、(9-苯基)咔唑-3-基或(9-苯基)咔唑-4-基)、(9-联苯基)咔唑基、(9-苯基)苯基咔唑基、二苯基咔唑-9-基、苯基咔唑-9-基、苯基三嗪基、联苯基三嗪基、二苯基三嗪基、苯基二苯并呋喃基以及苯基二苯并噻吩基等。
在本说明书中,咔唑基只要本说明书中没有另行记载,则具体而言为以下任一个基团。
【化学式5】
在本说明书中,(9-苯基)咔唑基只要本说明书中没有另行记载,则具体而言为以下任一个基团。
【化学式6】
上述通式(TEMP-Cz1)~(TEMP-Cz9)中,*表示键合位置。
在本说明书中,二苯并呋喃基以及二苯并噻吩基只要本说明书中没有另行记载,则具体而言为以下任一个基团。
【化学式7】
上述通式(TEMP-34)~(TEMP-41)中,*表示键合位置。
本说明书中记载的取代或未取代的烷基只要本说明书中没有另行记载,则优选为甲基、乙基、丙基、异丙基、正丁基、异丁基以及叔丁基等。
·“取代或未取代的亚芳基”
本说明书中记载的“取代或未取代的亚芳基”只要没有另行记载,就是从上述“取代或未取代的芳基”除去芳基环上的1个氢原子由此衍生的二价基团。作为“取代或未取代的亚芳基”的具体例(具体例组G12),可以举出从具体例组G1中记载的“取代或未取代的芳基”除去芳基环上的1个氢原子由此衍生的二价基团等。
·“取代或未取代的二价杂环基”
本说明书中记载的“取代或未取代的二价杂环基”只要没有另行记载,就是从上述“取代或未取代的杂环基”除去杂环上的1个氢原子由此衍生的二价基团。作为“取代或未取代的二价杂环基”的具体例(具体例组G13),可以举出从具体例组G2中记载的“取代或未取代的杂环基”除去杂环上的1个氢原子由此衍生的二价基团等。
·“取代或未取代的亚烷基”
本说明书中记载的“取代或未取代的亚烷基”只要没有另行记载,就是从上述“取代或未取代的烷基”除去烷基链上的1个氢原子由此衍生的二价基团。作为“取代或未取代的亚烷基”的具体例(具体例组G14),可以举出从具体例组G3中记载的“取代或未取代的烷基”除去烷基链上的1个氢原子由此衍生的二价基团等。
本说明书中记载的取代或未取代的亚芳基只要本说明书中没有另行记载,则优选为下述通式(TEMP-42)~(TEMP-67)中的任一基团。
【化学式8】
【化学式9】
上述通式(TEMP-42)~(TEMP-52)中,Q
上述通式(TEMP-42)~(TEMP-52)中,*表示键合位置。
【化学式10】
上述通式(TEMP-53)~(TEMP-62)中,Q
式Q
上述通式(TEMP-53)~(TEMP-62)中,*表示键合位置。
【化学式11】
上述通式(TEMP-63)~(TEMP-68)中,Q
上述通式(TEMP-63)~(TEMP-68)中,*表示键合位置。
本说明书中记载的取代或未取代的二价杂环基只要本说明书中没有另行记载,则优选为下述通式(TEMP-69)~(TEMP-102)中的任一基团。
【化学式12】
【化学式13】
上述通式(TEMP-69)~(TEMP-82)中,Q
【化学式15】
【化学式16】
【化学式17】
【化学式18】
上述通式(TEMP-83)~(TEMP-102)中,Q
以上是对于“本说明书中记载的取代基”的说明。
·“键合而形成环的情况”
在本说明书中,表述为“相邻的2个以上所组成的组中的1组以上相互键合而形成取代或未取代的单环、或者相互键合而形成取代或未取代的稠环、或者不相互键合”的情况,是指“相邻的2个以上所组成的组中的1组以上相互键合而形成取代或未取代的单环”的情况、“相邻的2个以上所组成的组中的1组以上相互键合而形成取代或未取代的稠环”的情况和“相邻的2个以上所组成的组中的1组以上不相互键合”的情况。
以下,对于本说明书中的、“相邻的2个以上所组成的组中的1组以上相互键合而形成取代或未取代的单环”的情况以及“相邻的2个以上所组成的组中的1组以上相互键合而形成取代或未取代的稠环”的情况(以下有时将这些情况合称为“键合而形成环的情况”。)进行说明。以母骨架为蒽环的下述通式(TEMP-103)所示的蒽化合物的情况为例进行说明。
【化学式19】
例如,在R
上述“1组以上”是指,上述相邻的2个以上所组成的组中的2组以上可以同时形成环。例如,在R
【化学式20】
“相邻的2个以上所组成的组”形成环的情况不仅包括如前述例子那样由相邻的“2个”组成的组发生键合的情况,还包括由相邻的“3个以上”组成的组发生键合的情况。例如,是指R
【化学式21】
所形成的“单环”或“稠环”中,作为仅所形成的环的结构,可以为饱和的环也可以为不饱和的环。即便是“相邻的2个所组成的组中的1组”形成“单环”或“稠环”的情况下,该“单环”或“稠环”也可以形成饱和的环或不饱和的环。例如,在上述通式(TEMP-104)中所形成的环Q
“不饱和的环”是指芳香族烃环或芳香族杂环。“饱和的环”是指脂肪族烃环或非芳香族杂环。
作为芳香族烃环的具体例,可以举出具体例组G1中作为具体例举出的基团被氢原子封端而成的结构。
作为芳香族杂环的具体例,可以举出具体例组G2中作为具体例举出的芳香族杂环基被氢原子封端而成的结构。
作为脂肪族烃环的具体例,可以举出具体例组G6中作为具体例举出的基团被氢原子封端而成的结构。
“形成环”是指,仅由母骨架的多个原子形成环,或者由母骨架的多个原子与另外的1个以上的任选元素形成环。例如,上述通式(TEMP-104)所示的R
在此,“任选元素”只要本说明书中没有另行记载,则优选为选自由碳元素、氮元素、氧元素以及硫元素组成的组中的至少1种元素。在任选元素中(例如碳元素或氮元素的情况下),不形成环的键可以被氢原子等封端,也可以被后述的“任选取代基”所取代。在包含碳元素以外的任选元素时,所形成的环为杂环。
构成单环或稠环的“1个以上的任选元素”只要本说明书中没有另行记载,则优选为2个以上且15个以下,更优选为3个以上且12个以下,进一步优选为3个以上且5个以下。
本说明书中只要没有另行记载,则“单环”以及“稠环”之中优选为“单环”。
本说明书中只要没有另行记载,则“饱和的环”以及“不饱和的环”之中优选为“不饱和的环”。
本说明书中只要没有另行记载,则“单环”优选为苯环。
本说明书中只要没有另行记载,则“不饱和的环”优选为苯环。
“相邻的2个以上所组成的组中的1组以上”“相互键合而形成取代或未取代的单环”的情况下或者“相互键合而形成取代或未取代的稠环”的情况下,本说明书中只要没有另行记载,则优选为相邻的2个以上所组成的组中的1组以上相互键合而形成由母骨架的多个原子和1个以上且15个以下的选自由碳元素、氮元素、氧元素以及硫元素组成的组中的至少1种元素形成的取代或未取代的“不饱和的环”。
上述的“单环”或“稠环”具有取代基时的取代基例如为后述的“任选取代基”。上述的“单环”或“稠环”具有取代基时的取代基的具体例为在上述的“本说明书中记载的取代基”的项中所描述过的取代基。
上述的“饱和的环”或“不饱和的环”具有取代基时的取代基例如为后述的“任选取代基”。上述的“单环”或“稠环”具有取代基时的取代基的具体例为在上述的“本说明书中记载的取代基”的项中所描述过的取代基。
以上是对于“相邻的2个以上所组成的组中的1组以上相互键合而形成取代或未取代的单环”的情况以及“相邻的2个以上所组成的组中的1组以上相互键合而形成取代或未取代的稠环”的情况(“键合而形成环的情况”)的说明。
·表述为“取代或未取代的”时的取代基
在本说明书中的一个实施方式中,上述表述为“取代或未取代的”时的取代基(在本说明书中,有时称为“任选取代基”。)例如为选自由
未取代的碳数1~50的烷基、
未取代的碳数2~50的烯基、
未取代的碳数2~50的炔基、
未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、氰基、硝基、
未取代的成环碳数6~50的芳基以及
未取代的成环原子数5~50的杂环基
组成的组中的基团等,
在此,R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基或者取代或未取代的成环原子数5~50的杂环基。
R
R
R
R
R
R
R
在一个实施方式中,上述表述为“取代或未取代的”时的取代基为选自由
碳数1~50的烷基、
成环碳数6~50的芳基以及
成环原子数5~50的杂环基
组成的组中的基团。
在一个实施方式中,上述表述为“取代或未取代的”时的取代基是选自由
碳数1~18的烷基、
成环碳数6~18的芳基以及
成环原子数5~18的杂环基
组成的组中的基团。
上述任选取代基的各基的具体例是在上述的“本说明书中记载的取代基”的项中所描述的取代基的具体例。
在本说明书中只要没有另行记载,则可以由相邻的任选取代基彼此形成“饱和的环”或“不饱和的环”,优选形成取代或未取代的饱和的五元环、取代或未取代的饱和的六元环、取代或未取代的不饱和的五元环或者取代或未取代的不饱和的六元环,更优选形成苯环。
在本说明书中只要没有另行记载,则任选取代基可以还具有取代基。作为任选取代基进一步具有的取代基,则与上述任选取代基同样。
在本说明书中,使用“AA~BB”表示的数值范围是指以“AA~BB”之前记载的数值AA作为下限值、以“AA~BB”之后记载的数值BB作为上限值而包含的范围。
[第一实施方式]
(有机电致发光元件)
本实施方式涉及的有机电致发光元件具有阳极、阴极、第一发光层和第二发光层,上述第一发光层和上述第二发光层配置于上述阳极与上述阴极之间,上述第一发光层包含第一主体材料、第一有机材料和第一掺杂剂材料,上述第二发光层包含第二主体材料和第二掺杂剂材料,上述第一主体材料、上述第一有机材料和上述第二主体材料彼此为结构不同的化合物,上述第一掺杂剂材料与上述第二掺杂剂材料彼此为结构相同的化合物、或者结构不同的化合物,上述第一主体材料、上述第一有机材料、上述第二主体材料、上述第一掺杂剂材料和上述第二掺杂剂材料满足下述数学式(数学式1)、(数学式2)、(数学式3)、(数学式5)和(数学式6)的关系。
T
T
T
S
S
(上述数学式(数学式1)、(数学式2)、(数学式3)、(数学式5)和(数学式6)中,
T
T
T
T
S
S
S
根据本实施方式,能够提供抑制了色度的下降且提高了发光效率的有机电致发光元件。
以往,作为用于改善有机电致发光元件的发光效率的技术,已知三重态三重态湮灭(Tripret-Tripret-Annhilation)(有时称为TTA。)。TTA是三重态激子与三重态激子发生碰撞而生成单重态激子这样的机制(机理)。需要说明的是,TTA机理有时也如专利文献6所记载的那样称为TTF机理。
对TTF现象进行说明。从阳极注入的空穴与从阴极注入的电子在发光层内发生复合而生成激子。其自旋状态如以往所知,是单重态激子为25%、三重态激子为75%的比率。在以往已知的荧光元件中,25%的单重态激子弛豫至基态时发出光,其余的75%的三重态激子不发出光而经过热失活过程恢复到基态。因此,据称以往的荧光元件的内部量子效率的理论极限值为25%。
另一方面,在理论上对于在有机物内部生成的三重态激子的行为进行了研究。根据S.M.Bachilo等人(J.Phys.Cem.A,104,7711(2000)),若假定五重态等高次的激子立即恢复到三重态,则在三重态激子(以下记为
即,成为5
在想要利用如上所述的TTF机理来使层叠有多个发光层的有机EL元件的发光效率提高时,有时色度下降。本发明人等发现,通过配置于阳极侧的发光层含有多种的材料(例如第一主体材料和第一有机材料)而不是含有1种的主体材料(第一主体材料),由此能够使发光效率提高,并且抑制色度的下降。作为有机EL元件的色度下降的重要原因,可考虑主体材料的分子彼此的堆叠。据认为,本实施方式涉及的有机EL元件的发光层由于含有化合物结构彼此不同的第一主体材料和第一有机材料,因而主体材料的分子彼此的堆叠受到抑制,有机EL元件的色度下降受到抑制。
根据本实施方式涉及的有机电致发光元件,认为对于在第一发光层中通过空穴与电子复合而生成的三重态激子而言,即便在该第一发光层与直接相接的有机层的界面存在过剩的载流子,在第一发光层与该有机层的界面存在的三重态激子也不容易被淬灭。例如,在复合区域局部地存在于第一发光层与空穴传输层或电子阻挡层的界面的情况下,可考虑过剩的电子导致的淬灭。另一方面,在复合区域局部地存在于第一发光层与电子传输层或空穴阻挡层的界面的情况下,可考虑过剩的空穴导致的淬灭。
本实施方式涉及的有机电致发光元件具备满足规定的关系的至少2个发光层(即第一发光层和第二发光层),第一发光层中的第一主体材料的三重态能量T
通过如满足上述数学式(数学式1)和(数学式2)的关系那样具备第一发光层和第二发光层,由此,在第一发光层中生成的三重态激子没有被过剩载流子所淬灭而移动至第二发光层,另外,能够抑制从第二发光层向第一发光层反向移动。其结果,在第二发光层中,表现出TTF机理而高效生成单重态激子,发光效率改善。
如此,有机电致发光元件具备主要生成三重态激子的第一发光层和有效利用从第一发光层移动过来的三重态激子而主要表现TTF机理的第二发光层作为不同区域,作为第二发光层中的第二主体材料,使用具有比第一发光层中的第一主体材料和第一有机材料更小的三重态能量的化合物,设置三重态能量之差,由此发光效率改善。
在本实施方式中,第一主体材料和第一掺杂剂材料的三重态能量满足数学式(数学式3)的关系。通过满足该数学式(数学式3)的关系,在第一发光层内生成的三重态激子在第一主体材料的分子上移动而并非在具有更高三重态能量的第一掺杂剂材料上,因此易于移动至第二发光层。
通过第一主体材料、第一有机材料和第一掺杂剂材料满足数学式(数学式5)和(数学式6)的关系,在第一主体材料和第一有机材料的分子上生成的单重态激子易于进行从第一主体材料和第一有机材料至第一掺杂剂材料的能量移动,有助于第一掺杂剂材料的荧光性发光。
在本实施方式涉及的有机EL元件中,第一有机材料的三重态能量T
T
在本实施方式涉及的有机EL元件中,第一主体材料的三重态能量T
T
在本实施方式涉及的有机EL元件的一个方案中,第一主体材料的单重态能量S
S
另外,在本实施方式涉及的有机EL元件的一个方案中,第一主体材料的单重态能量S
S
(三重态能量T
作为三重态能量T
将成为测定对象的化合物溶解于EPA(二乙醚∶异戊烷∶乙醇=5∶5∶2(容积比))中以使得达到10
换算式(F1):T
对于磷光谱的短波长侧的升起的切线如下引出。从磷光谱的短波长侧起直至光谱的极大值之中最短波长侧的极大值为止在光谱曲线上进行移动时,朝向长波长侧考量曲线上的各点处的切线。该切线随着曲线升起(即随着纵轴增加)而斜率增加。在该斜率的值取极大值的点处所引的切线(即拐点处的切线)作为该对于磷光谱的短波长侧的升起的切线。
需要说明的是,具有光谱的最大峰值强度的15%以下的峰强度的极大点不包括在上述的最短波长侧的极大值中,将与最短波长侧的极大值最接近的、斜率的值取极大值的点处所引的切线作为该对于磷光谱的短波长侧的升起的切线。
磷光的测定可以使用株式会社日立高新技术制的F-4500型分光荧光光度计主体。需要说明的是,测定装置不限于此,可以将冷却装置以及低温用容器、激发光源和受光装置组合由此进行测定。
(单重态能量S
作为使用溶液的单重态能量S
制备成为测定对象的化合物的10
换算式(F2):S
作为吸收光谱测定装置,例如可以举出日立公司制的分光光度计(装置名:U3310),不限于此。
对于吸收光谱的长波长侧的下坠的切线如下引出。从吸收光谱的极大值之中最长波长侧的极大值起沿长波长方向在光谱曲线上移动时,考量曲线上的各点处的切线。该切线随着曲线下坠(即随着纵轴的值减少),其斜率重复减少而后增加的情况。将斜率的值在最长波长侧(其中不包括吸光度为0.1以下的情况)取极小值的点处所引的切线作为该对于吸收光谱的长波长侧的下坠的切线。
需要说明的是,吸光度的值为0.2以下的极大点不包括在上述最长波长侧的极大值中。
本实施方式涉及的有机EL元件优选相当于第一主体材料满足下述数学式(数学式7)的关系的情况以及第一有机材料满足下述数学式(数学式8)的关系的情况中的至少任一情况。
ΔFWHM(H1)=HWF(H1)-HWS(H1)≤15…(数学式7)
ΔFWHM(H2)=HWF(H2)-HWS(H2)≤15…(数学式8)
(上述数学式(数学式7)和(数学式8)中,
HWF(H1)为上述第一主体材料的膜的光致发光光谱中的峰的半峰宽(单位:nm),
HWS(H1)为上述第一主体材料的溶液的光致发光光谱中的峰的半峰宽(单位:nm),
ΔFWHM(H1)为HWF(H1)与HWS(H1)之差,
HWF(H2)为上述第一有机材料的膜的光致发光光谱中的峰的半峰宽(单位:nm),
HWS(H2)为上述第一有机材料的溶液的光致发光光谱中的峰的半峰宽(单位:nm),
ΔFWHM(H2)为HWF(H2)与HWS(H2)之差。)
据认为,本实施方式涉及的有机EL元件通过相当于第一主体材料满足数学式(数学式7)的关系、第一有机材料不满足数学式(数学式8)的关系的情况、第一主体材料不满足数学式(数学式7)的关系、第一有机材料满足数学式(数学式8)的关系的情况、以及第一主体材料满足数学式(数学式7)的关系、第一有机材料也满足数学式(数学式8)的关系的情况中的至少任一情况,并且使用膜的FWHM与溶液的FWHM之差为规定值以下的化合物作为主体材料,由此易于抑制主体材料的分子彼此的堆叠,其结果易于抑制色度的下降。
若在发光层等膜中主体材料的分子彼此堆叠,则该膜的光致发光光谱的半峰全宽(FWHM,full width at half maximum)相较于溶液的光致发光光谱的FWHM变得更宽。因此,认为若使用膜的FWHM与溶液的FWHM之差超过规定值的化合物作为主体材料,则在发光层中该主体材料的分子彼此容易堆叠,有机EL元件的色度下降。
·溶液的半峰宽(HWS)
化合物的溶液的半峰宽FWHM的测定方法如下所述。(需要说明的是,在本说明书中,有时将“化合物在溶液中的半峰宽FWHM”记为HWS。)
将成为测定对象的化合物以5.0×10
通过对所测定的荧光光谱的达到峰值波长的强度的一半强度的波长的宽度进行测量,算出HWS(单位:nm)。
·膜的半峰宽(HWF)
化合物的膜的半峰宽FWHM的测定方法如下所述。(需要说明的是,在本说明书中,有时将“化合物的膜的半峰宽FWHM”记为HWF。)
将20mm×10mm×1mm厚的石英基板在异丙醇中进行5分钟的超声波清洗后,进行30分钟的UV臭氧清洗。将UV臭氧清洗后的石英基板安装于真空蒸镀装置的基板架,使用测定对象的化合物,形成膜厚50nm的膜。如此进行,制作半峰宽测定用样品,测定该半峰宽测定用样品的膜的荧光光谱。荧光光谱测定例如使用日立高新技术科学公司的分光荧光光度计F-7000型。
通过对所测定的荧光光谱的达到峰值波长的强度的一半强度的波长的宽度进行测量,算出HWF(单位:nm)。
在本实施方式涉及的有机EL元件的一个方案中,第一主体材料和第一有机材料满足下述数学式(数学式9)的关系。
Ip(H1)≥Ip(H2)…(数学式9)
另外,在本实施方式涉及的有机EL元件的个方案中,第一主体材料和第一有机材料满足下述数学式(数学式9A)的关系。
Ip(H1)<Ip(H2)…(数学式9A)
(上述数学式(数学式9)和(数学式9A)中,Ip(H1)为上述第一主体材料的电离势(单位:eV),Ip(H2)为上述第一有机材料的电离势(单位:eV)。)
在本说明书中,电离势在空气中使用光电子分光装置进行测定。具体而言,可以通过实施例记载的方法测定电离势。
(有机EL元件的发光波长)
本实施方式涉及的有机电致发光元件优选在元件驱动时发射最大峰值波长为500nm以下的光。
本实施方式涉及的有机电致发光元件更优选在元件驱动时发射最大峰值波长为430nm以上且480nm以下的光。
在元件驱动时有机EL元件发射的光的最大峰值波长的测定如下进行。对于对有机EL元件施加电压使得电流密度达到10mA/cm
在本实施方式涉及的有机EL元件中,也可以第一发光层配置于阳极与阴极之间,第二发光层配置于第一发光层与阴极之间。
在本实施方式涉及的有机EL元件中,也可以第二发光层配置于阳极与阴极之间,第一发光层配置于第二发光层与阴极之间。
即,本实施方式涉及的有机EL元件可以从阳极侧起依次具有第一发光层和第二发光层,也可以从阳极侧起依次具有第二发光层和第一发光层。第一发光层和第二发光层的顺序为任一种的情况下,均通过选择满足上述数学式(数学式1)和(数学式2)的关系的材料的组合,能够期待发光层为层叠结构所带来的效果。
(第一发光层)
第一发光层包含第一主体材料和第一有机材料。第一主体材料、第一有机材料和第二发光层含有的第二主体材料彼此为不同结构的化合物。
第一发光层进一步包含第一掺杂剂材料。第一掺杂剂材料和第二发光层含有的第二掺杂剂材料彼此为结构相同的化合物、或者结构不同的化合物。
在本实施方式涉及的有机EL元件中,第一掺杂剂材料优选为在分子中不包含吖嗪环结构的化合物。
在本实施方式涉及的有机EL元件中,第一掺杂剂材料优选并非含硼络合物,更优选第一掺杂剂材料并非络合物。
在本实施方式涉及的有机EL元件中,第一发光层优选不含有金属络合物。另外,在本实施方式涉及的有机EL元件中,第一发光层也优选不含有含硼络合物。
在本实施方式涉及的有机EL元件中,第一发光层优选不含有磷光发光性材料(掺杂剂材料)。
另外,第一发光层优选不包含重金属络合物和磷光发光性的稀土金属络合物。此处,作为重金属络合物,例如可以举出铱络合物、锇络合物和铂络合物等。
在本实施方式涉及的有机EL元件中,第一掺杂剂材料优选为发光性化合物,更优选为荧光发光性化合物。在本实施方式涉及的有机EL元件中,第一掺杂剂材料优选为显示最大峰值波长为500nm以下的发光的化合物,更优选为显示最大峰值波长为470nm以下的发光的化合物。
在本实施方式涉及的有机EL元件中,第一掺杂剂材料优选为显示最大峰值波长为500nm以下的荧光发光的化合物,更优选为显示最大峰值波长为470nm以下的荧光发光的荧光发光性化合物。
化合物的最大峰值波长的测定方法如下所述。制备作为测定对象的化合物的5μmol/L甲苯溶液并加入石英比色池,在常温(300K)测定该试样的发光光谱(设定纵轴为发光强度、横轴为波长。)。发光光谱可以通过株式会社日立高新技术科学制的分光荧光光度计(装置名:F-7000)进行测定。需要说明的是,发光光谱测定装置不限定于在此使用的装置。
在发光光谱中,将发光强度达到最大的发光光谱的峰值波长作为最大峰值波长。需要说明的是,在本说明书中,有时将最大峰值波长称为荧光发光最大峰值波长(FL-peak)。
在上述第一掺杂剂材料的发光光谱中,将发光强度达到最大的峰作为最大峰,将该最大峰的高度设为1时,在该发光光谱中出现的其他峰的高度优选低于0.6。需要说明的是,发光光谱中的峰设为极大值。
另外,在第一掺杂剂材料的发光光谱中,优选峰的数量低于3个。
在本实施方式涉及的有机EL元件中,第一发光层优选在元件驱动时发射最大峰值波长为500nm以下的光,更优选在元件驱动时发射最大峰值波长为470nm以下的光。
·元件驱动时从发光层发射的光的最大峰值波长λp
对于元件驱动时从第一发光层发射的光的最大峰值波长λp
对于元件驱动时从第二发光层发射的光的最大峰值波长λp
在本说明书中,“主体材料”是指例如含量为“层的总质量的50质量%以上”的材料。
在本实施方式中,第一主体材料例如含量为第一发光层的总质量的50质量%以上。在本实施方式中,第一主体材料例如含量为第一发光层的总质量的60质量%以上、第一发光层的总质量的70质量%以上、第一发光层的总质量的80质量%以上、第一发光层的总质量的90质量%以上、或者第一发光层的总质量的95质量%以上。在本实施方式中,第一主体材料、第一有机材料和第一掺杂剂材料的合计量的上限为第一发光层的总质量的100质量%。
在本实施方式涉及的有机EL元件中,在第一发光层中,第一主体材料和第一有机材料的合计质量M
50≤(M
在本实施方式涉及的有机EL元件中,第一发光层中优选第一掺杂剂材料的含量为第一发光层的总质量的0.5质量%以上,更优选含量为第一发光层的总质量的1质量%以上,优选含量超过1.1质量%,更优选含量为第一发光层的总质量的1.2质量%以上,进一步优选含量为第-发光层的总质量的1.5质量%以上。
第一发光层中优选第一掺杂剂材料的含量为第一发光层的总质量的10质量%以下,更优选含量为第一发光层的总质量的7质量%以下,进一步优选含量为第一发光层的总质量的5质量%以下。
需要说明的是,本实施方式不排除在第一发光层中包含除第一主体材料、第一有机材料和第一掺杂剂材料以外的材料。
第一发光层可以仅包含1种第一主体材料,也可以包含2种以上。第一发光层可以仅包含1种第一有机材料,也可以包含2种以上。第一发光层可以仅包含1种第一掺杂剂材料,也可以包含2种以上。
在本实施方式涉及的有机EL元件中,第一发光层的膜厚优选为3nm以上,更优选为5nm以上。如果第一发光层的膜厚为3nm以上,则是足以在第一发光层中引起空穴和电子的复合的膜厚。
在本实施方式涉及的有机EL元件中,第一发光层的膜厚优选为15nm以下,更优选为10nm以下。如果第一发光层的膜厚为15nm以下,则是薄到足以使三重态激子向第二发光层移动的膜厚。
在本实施方式涉及的有机EL元件中,第一发光层的膜厚更优选为3nm以上且15nm以下。
(第二发光层)
第二发光层包含第二主体材料。第二主体材料和第一发光层含有的第一主体材料和第一有机材料彼此为不同结构的化合物。
第二发光层进一步包含第二掺杂剂材料。第二掺杂剂材料和第一发光层含有的第一掺杂剂材料彼此为结构相同的化合物、或者结构不同的化合物。
在本实施方式涉及的有机EL元件中,第二掺杂剂材料优选为发光性化合物,更优选为荧光发光性化合物。在本实施方式涉及的有机EL元件中,第二掺杂剂材料优选为显示最大峰值波长为500nm以下的发光的化合物,更优选为显示最大峰值波长为470nm以下的发光的化合物。
在本实施方式涉及的有机EL元件中,第一掺杂剂材料优选为显示最大峰值波长为500nm以下的荧光发光的化合物,更优选为显示最大峰值波长为470nm以下的荧光发光的荧光发光性化合物。
在本实施方式涉及的有机EL元件中,第二发光层优选为在元件驱动时发射最大峰值波长为500nm以下的光,更优选在元件驱动时发射最大峰值波长为470nm以下的光。
在本实施方式涉及的有机EL元件中,上述第二掺杂剂材料的最大峰的半峰宽优选为1nm以上、30nm以下,更优选为1nm以上、20nm以下。
在本实施方式涉及的有机EL元件中,第二掺杂剂材料的三重态能量T
T
在本实施方式涉及的有机EL元件中,通过第二掺杂剂材料与第二主体材料满足上述数学式(数学式12)的关系,由此在第一发光层中生成的三重态激子在移动至第二发光层时,不向具有更高三重态能量的第二掺杂剂材料而是向第二主体材料的分子发生能量移动。另外,在第二主体材料的分子上空穴与电子发生复合而产生的三重态激子不向具有更高三重态能量的第二掺杂剂材料移动。在第二掺杂剂材料的分子上复合而产生的三重态激子快速向第二主体材料的分子发生能量移动。
通过第二主体材料的三重态激子不移动至第二掺杂剂材料而是通过TTF现象在第二主体材料的分子上三重态激子彼此有效地发生碰撞,由此生成单重态激子。
在本实施方式涉及的有机EL元件中,第二主体材料的单重态能量S
S
在本实施方式涉及的有机EL元件中,通过第二掺杂剂材料与第二主体材料满足上述数学式(数学式13)的关系,由此第二掺杂剂材料的单重态能量小于第二主体材料的单重态能量,因此通过TTF现象生成的单重态激子从第二主体材料向第二掺杂剂材料发生能量移动,有助于第二掺杂剂材料的荧光性发光。
在本实施方式涉及的有机EL元件中,第二掺杂剂材料优选为在分子中不含吖嗪环结构的化合物。
在本实施方式涉及的有机EL元件中,第二掺杂剂材料优选不是含硼络合物,第二掺杂剂材料更优选不是络合物。
在本实施方式涉及的有机EL元件中,第二发光层优选不含有金属络合物。另外,在本实施方式涉及的有机EL元件中,第二发光层也优选不含有含硼络合物。
在本实施方式涉及的有机EL元件中,第二发光层优选不包含磷光发光性材料(掺杂剂材料)。
另外,第二发光层优选不包含重金属络合物和磷光发光性的稀土金属络合物。在此,作为重金属络合物,例如可以举出铱络合物、锇络合物以及铂络合物等。
在本实施方式中,第二发光层中例如第二主体材料的含量为第二发光层的总质量的50质量%以上。另外,在本实施方式中,第二主体材料的含量例如为第二发光层的总质量的60质量%以上、第二发光层的总质量的70质量%以上、第二发光层的总质量的80质量%以上、第二发光层的总质量的90质量%以上、或者第二发光层的总质量的95质量%以上。另外,例如第二主体材料的含量为第二发光层的总质量的99.5质量%以下、或者第二发光层的总质量的99质量%以下。在本实施方式中,第二主体材料和第二掺杂剂材料的合计量的上限为第二发光层的总质量的100质量%。
在本实施方式涉及的有机EL元件中,第二发光层中优选第二掺杂剂材料的含量为第二发光层的总质量的0.5质量%以上,更优选含量为第二发光层的总质量的1质量%以上,更优选含量超过第二发光层的总质量的1.1质量%,更优选含量为第二发光层的总质量的1.2质量%以上,进一步优选含量为第二发光层的总质量的1.5质量%以上。
第二发光层优选第二掺杂剂材料的含量为第二发光层的总质量的10质量%以下,更优选含量为第二发光层的总质量的7质量%以下,进一步优选含量为第二发光层的总质量的5质量%以下。
需要说明的是,本实施方式不排除在第二发光层中包含除第二主体材料和第二掺杂剂材料以外的材料。
第二发光层中,第二主体材料可以仅包含1种,也可以包含2种以上。第二发光层中,第二掺杂剂材料可以仅包含1种,也可以包含2种以上。
在本实施方式涉及的有机EL元件中,第二发光层的膜厚优选为5nm以上,更优选为10nm以上,进一步优选为15nm以上。如果第二发光层的膜厚为5nm以上,则易于抑制从第一发光层移动至第二发光层的三重态激子再次返回至第一发光层。另外,如果第二发光层的膜厚为5nm以上,则可以使三重态激子充分远离第一发光层中的复合部分。
在本实施方式涉及的有机EL元件中,第二发光层的膜厚优选为25nm以下,更优选为20nm以下。如果第二发光层的膜厚为25nm以下(更优选为20nm以下),则可以使第二发光层中的三重态激子的密度提高而进一步易于引起TTF现象。
在本实施方式涉及的有机EL元件中,第二发光层的膜厚优选为5nm以上、25nm以下,更优选为5nm以上、20nm以下。
(有机EL元件的其他层)
本实施方式涉及的有机EL元件在第一发光层和第二发光层以外还可以具有1个以上的有机层。作为有机层,例如可以举出选自空穴注入层、空穴传输层、发光层、电子注入层、电子传输层、空穴阻挡层和电子阻挡层中的至少任一层。
在本实施方式涉及的有机EL元件中,可以仅由第一发光层和第二发光层构成,也可以还具有例如选自空穴注入层、空穴传输层、电子注入层、电子传输层、空穴阻挡层以及电子阻挡层等中的至少任一层。
(空穴传输层)
在本实施方式涉及的有机EL元件中,优选在第一发光层和第二发光层之中的配置于阳极侧的发光层与阳极之间包含空穴传输层。
在本实施方式涉及的有机EL元件中,第一发光层配置于比第二发光层更靠阳极侧的情况下,优选在阳极与第一发光层之间包含空穴传输层。
在本实施方式涉及的有机EL元件中,第二发光层配置于比第一发光层更靠阳极侧的情况下,优选在阳极与第二发光层之间包含空穴传输层。
(电子传输层)
在本实施方式涉及的有机EL元件中,优选在第一发光层和第二发光层之中的配置于阴极侧的发光层与阴极之间包含电子传输层。
在本实施方式涉及的有机EL元件中,第二发光层配置于比第一发光层更靠阴极侧的情况下,优选在第二发光层与阴极之间包含电子传输层。
在本实施方式涉及的有机EL元件中,第一发光层配置于比第二发光层更靠阴极侧的情况下,优选在第一发光层与阴极之间包含电子传输层。
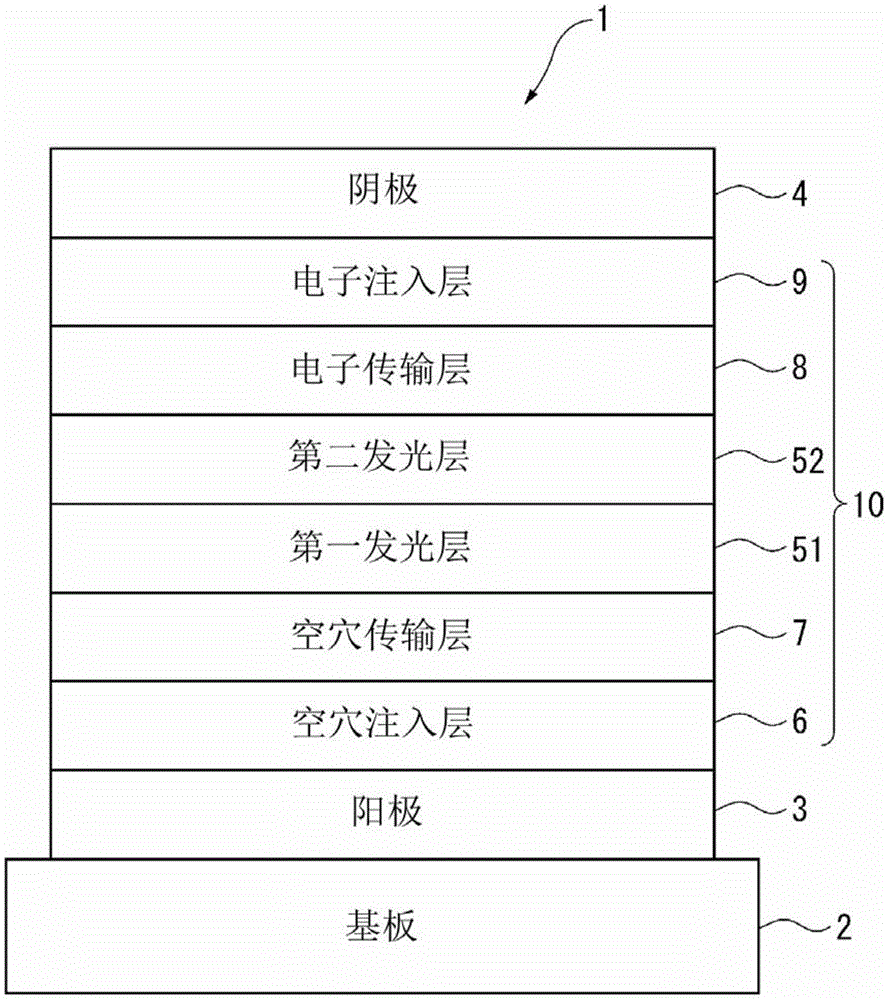
图1示出本实施方式涉及的有机EL元件的一例的大致构成。
有机EL元件1包含透光性的基板2、阳极3、阴极4和在阳极3与阴极4之间配置的有机层10。有机层10是从阳极3侧起依次地,空穴注入层6、空穴传输层7、第一发光层51、第二发光层52、电子传输层8以及电子注入层9依此顺序层叠而构成的。
本发明不限于图1所示的有机EL元件的构成。作为另外构成的有机EL元件,例如可以举出:有机层是从阳极侧起依次地,空穴注入层、空穴传输层、第二发光层、第一发光层、电子传输层以及电子注入层依此顺序层叠而构成的方案。
在本实施方式涉及的有机EL元件中,第一发光层与第二发光层优选直接相接。
在本说明书中,“第一发光层与第二发光层直接相接”的层结构例如也可以包含以下的方案(LS1)、(LS2)和(LS3)中的任一方案。
(LS1)在经过第一发光层涉及的化合物的蒸镀工序和第二发光层涉及的化合物的蒸镀工序的过程中产生第一主体材料和第二主体材料两者混存的区域,而该区域存在于第一发光层与第二发光层的界面的方案。
(LS2)在第一发光层和第二发光层包含发光性的化合物的情况下,在经过第一发光层涉及的化合物的蒸镀工序和第二发光层涉及的化合物的蒸镀工序的过程中生成第一主体材料、第二主体材料和发光性的化合物混存的区域,而该区域存在于第一发光层与第二发光层的界面的方案。
(LS3)在第一发光层和第二发光层包含发光性的化合物的情况下,在经过第一发光层涉及的化合物的蒸镀工序和第二发光层涉及的化合物的蒸镀工序的过程中生成由该发光性的化合物形成的区域、由第一主体材料形成的区域或由第二主体材料形成的区域,而该区域存在于第一发光层与第二发光层的界面的方案。
对有机EL元件的构成进行进一步的说明。以下有时省略符号的记载。
(基板)
基板被用作有机EL元件的支撑体。作为基板,例如可以使用玻璃、石英以及塑料等。另外,可以使用挠性基板。挠性基板是指,能够弯折的(柔性的)基板。例如可以举出塑料基板等。作为形成塑料基板的材料,例如可以举出聚碳酸酯、聚芳酯、聚醚砜、聚丙烯、聚酯、聚氟乙烯、聚氯乙烯、聚酰亚胺以及聚萘二甲酸乙二醇酯等。另外,也可以使用无机蒸镀膜。
(阳极)
形成在基板上的阳极优选使用功函数大(具体而言为4.0eV以上)的金属、合金、导电性化合物以及它们的混合物等。具体而言,例如可以举出氧化铟-氧化锡(ITO:IndiumTin Oxide,铟锡氧化物)、含有硅或氧化硅的氧化铟-氧化锡、氧化铟-氧化锌、含有氧化钨和氧化锌的氧化铟、石墨烯等。此外,可以举出金(Au)、铂(Pt)、镍(Ni)、钨(W)、铬(Cr)、钼(Mo)、铁(Fe)、钴(Co)、铜(Cu)、钯(Pd)、钛(Ti)或者金属材料的氮化物(例如氮化钛)等。
这些材料通常通过溅射法进行成膜。例如,氧化铟-氧化锌可以通过使用相对于氧化铟加入了1质量%以上且10质量%以下的氧化锌的靶利用溅射法而形成。另外,例如,含有氧化钨和氧化锌的氧化铟可以通过使用相对于氧化铟含有0.5质量%以上且5质量%以下氧化钨和0.1质量%以上且1质量%以下氧化锌的靶利用溅射法而形成。另外,也可以通过真空蒸镀法、涂布法、喷墨法、旋涂法等进行制作。
在形成在阳极上的EL层之中,与阳极相接地形成的空穴注入层由于使用与阳极的功函数无关地容易进行空穴(hole)注入的复合材料形成,因此,可以使用能够作为电极材料的材料(例如金属、合金、导电性化合物以及它们的混合物,此外也包括属于元素周期表的第一族或第二族的元素)。
也可以使用作为功函数小的材料的属于元素周期表的第一族或第二族的元素、即锂(Li)、铯(Cs)等碱金属和镁(Mg)、钙(Ca)、锶(Sr)等碱土金属以及包含它们的合金(例如MgAg、AlLi)、铕(Eu)、镱(Yb)等稀土金属以及包含它们的合金等。需要说明的是,使用碱金属、碱土金属以及包含它们的合金形成阳极时,可以使用真空蒸镀法、溅射法。此外,在使用银浆等时,可以使用涂布法、喷墨法等。
(阴极)
阴极优选使用功函数小的(具体而言为3.8eV以下)金属、合金、导电性化合物以及它们的混合物等。作为这样的阴极材料的具体例,可以举出属于元素周期表的第一族或第二族的元素、即锂(Li)、铯(Cs)等碱金属和镁(Mg)、钙(Ca)、锶(Sr)等碱土金属以及包含它们的合金(例如MgAg、AlLi)、铕(Eu)、镱(Yb)等稀土金属以及包含它们的合金等。
需要说明的是,在使用碱金属、碱土金属、包含它们的合金形成阴极时,可以使用真空蒸镀法、溅射法。另外,在使用银浆等时,可以使用涂布法、喷墨法等。
需要说明的是,通过设置电子注入层,可以与功函数的大小无关地使用Al、Ag、ITO、石墨烯、含有硅或氧化硅的氧化铟-氧化锡等各种各样的导电性材料形成阴极。这些导电性材料可以使用溅射法、喷墨法、旋涂法等进行成膜。
(空穴注入层)
空穴注入层是包含空穴注入性高的物质的层。作为空穴注入性高的物质,可以使用钼氧化物、钛氧化物、钒氧化物、铼氧化物、钌氧化物、铬氧化物、锆氧化物、铪氧化物、钽氧化物、银氧化物、钨氧化物、锰氧化物等。
另外,作为空穴注入性高的物质,也可以举出作为低分子有机化合物的4,4’,4”-三(N,N-二苯基氨基)三苯胺(简称:TDATA)、4,4’,4”-三[N-(3-甲基苯基)-N-苯基氨基]三苯胺(简称:MTDATA)、4,4’-双[N-(4-二苯基氨基苯基)-N-苯基氨基]联苯(简称:DPAB)、4,4’-双(N-{4-[N’-(3-甲基苯基)-N’-苯基氨基]苯基}-N-苯基氨基)联苯(简称:DNTPD)、1,3,5-三[N-(4-二苯基氨基苯基)-N-苯基氨基]苯(简称:DPA3B)、3-[N-(9-苯基咔唑-3-基)-N-苯基氨基]-9-苯基咔唑(简称:PCzPCA1)、3,6-双[N-(9-苯基咔唑-3-基)-N-苯基氨基]-9-苯基咔唑(简称:PCzPCA2)、3-[N-(1-萘基)-N-(9-苯基咔唑-3-基)氨基]-9-苯基咔唑(简称:PCzPCN1)等芳香族胺化合物等、二吡嗪并[2,3-f:20,30-h]喹喔啉-2,3,6,7,10,11-六甲腈(HAT-CN)。
另外,作为空穴注入性高的物质,也可以使用高分子化合物(低聚物、树状高分子、聚合物等)。例如可以举出聚(N-乙烯基咔唑)(简称:PVK)、聚(4-乙烯基三苯胺)(简称:PVTPA)、聚[N-(4-{N’-[4-(4-二苯基氨基)苯基]苯基-N’-苯基氨基}苯基)甲基丙烯酰胺](简称:PTPDMA)、聚[N,N’-双(4-丁基苯基)-N,N’-双(苯基)联苯胺](简称:Poly-TPD)等高分子化合物。另外,也可以使用聚(3,4-亚乙二氧基噻吩)/聚(苯乙烯磺酸)(PEDOT/PSS)、聚苯胺/聚(苯乙烯磺酸)(PAni/PSS)等添加了酸的高分子化合物。
(空穴传输层)
空穴传输层是包含空穴传输性高的物质的层。空穴传输层可以使用芳香族胺化合物、咔唑衍生物、蒽衍生物等。具体而言,可以使用4,4’-双[N-(1-萘基)-N-苯基氨基]联苯(简称:NPB)、N,N’-双(3-甲基苯基)-N,N’-二苯基-[1,1’-联苯]-4,4’-二胺(简称:TPD)、4-苯基-4’-(9-苯基芴-9-基)三苯胺(简称:BAFLP)、4,4’-双[N-(9,9-二甲基芴-2-基)-N-苯基氨基]联苯(简称:DFLDPBi)、4,4’,4”-三(N,N-二苯基氨基)三苯胺(简称:TDATA)、4,4’,4”-三[N-(3-甲基苯基)-N-苯基氨基]三苯胺(简称:MTDATA)、4,4’-双[N-(螺-9,9’-双芴-2-基)-N-苯基氨基]联苯(简称:BSPB)等芳香族胺化合物等。在此所述的物质主要是具有10
空穴传输层中也可以使用CBP、9-[4-(N-咔唑基)]苯基-10-苯基蒽(CzPA)、9-苯基-3-[4-(10-苯基-9-蒽基)苯基]-9H-咔唑(PCzPA)这样的咔唑衍生物、t-BuDNA、DNA、DPAnth这样的蒽衍生物。也可以使用聚(N-乙烯基咔唑)(简称:PVK)、聚(4-乙烯基三苯胺)(简称:PVTPA)等高分子化合物。
需要说明的是,只要是空穴的传输性比电子高的物质,就也可以使用这些以外的物质。需要说明的是,包含空穴传输性高的物质的层不仅可以设为单层,也可以设为由上述物质形成的层层叠二层以上而成的叠层。
(电子传输层)
电子传输层是包含电子传输性高的物质的层。电子传输层中可以使用1)铝络合物、铍络合物、锌络合物等金属络合物、2)咪唑衍生物、苯并咪唑衍生物、吖嗪衍生物、咔唑衍生物、菲咯啉衍生物等杂芳香族化合物、3)高分子化合物。具体而言,作为低分子的有机化合物,可以使用Alq、三(4-甲基-8-羟基喹啉)铝(简称:Almq
另外,电子传输层中也可以使用高分子化合物。例如可以使用聚[(9,9-二己基芴-2,7-二基)-co-(吡啶-3,5-二基)](简称:PF-Py)、聚[(9,9-二辛基芴-2,7-二基)-co-(2,2’-联吡啶-6,6’-二基)](简称:PF-BPy)等。
(电子注入层)
电子注入层是包含电子注入性高的物质的层。电子注入层中可以使用锂(Li)、铯(Cs)、钙(Ca)、氟化锂(LiF)、氟化铯(CsF)、氟化钙(CaF
或者,电子注入层中也可以使用将有机化合物与供电子体(供体)混合而成的复合材料。这样的复合材料由于通过供电子体而在有机化合物中产生电子,因此电子注入性和电子传输性优异。此时,作为有机化合物,优选为所产生的电子的传输优异的材料,具体而言,例如可以使用上述的构成电子传输层的物质(金属络合物、杂芳香族化合物等)。作为供电子体,只要是对于有机化合物显示给电子性的物质即可。具体而言,优选碱金属、碱土金属、稀土金属,可以举出锂、铯、镁、钙、铒、镱等。另外,优选碱金属氧化物、碱土金属氧化物,可以举出锂氧化物、钙氧化物、钡氧化物等。另外,也可以使用氧化镁这样的路易斯碱。另外,也可以使用四硫富瓦烯(简称:TTF)等有机化合物。
(层形成方法)
作为本实施方式的有机EL元件的各层的形成方法,除了在上文中特别提及的以外没有限制,可以采用真空蒸镀法、溅射法、等离子体法、离子镀法等干式成膜法、旋涂法、浸涂法、流涂法、喷墨法等湿式成膜法等公知的方法。
(膜厚)
本实施方式的有机EL元件的各有机层的膜厚除了在上文中特别提及的情况以外没有限定。一般而言,若膜厚过薄则容易产生针孔等缺陷,而若膜厚过厚则需要高的施加电压而效率恶化,因此通常有机EL元件的各有机层的膜厚优选为几nm至1μm的范围。
(第一主体材料)
在本实施方式涉及的有机EL元件中,第一主体材料优选为不具有蒽环的化合物。
在本实施方式涉及的有机EL元件中,第一主体材料优选为分子量为2000以下的化合物。
据认为,第一主体材料具有平面性高的骨架(例如芘和荧蒽等骨架)的情况下,容易发生色度的下降,因此,在使用具有这样的骨架的第一主体材料的情况下,更优选与第一有机材料组合来构成发光层。
在本实施方式涉及的有机EL元件中,第一主体材料例如也优选下述通式(1)、通式(11X)、通式(12X)、通式(13X)或通式(14X)所示的第一化合物。
(通式(1)所示的化合物)
在本实施方式涉及的有机EL元件中,第一主体材料也优选为通式(1)所示的化合物。
【化学式22】
(上述通式(1)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
上述通式(11)所示的基团,
其中,R
在上述通式(11)所示的基团存在多个的情况下,多个上述通式(11)所示的基团相互相同或不同,
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
mx为0、1、2、3、4或5,
在L
在Ar
在本实施方式涉及的有机EL元件中,上述通式(11)所示的基团优选为下述通式(111)所示的基团。
【化学式23】
(上述通式(111)中,
X
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
ma为0、1、2、3或4,
mb为0、1、2、3或4,
ma+mb为0、1、2、3或4,
Ar
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
mc为3,
3个R
md为3,
3个R
上述通式(111)所示的基团中的下述通式(111a)所示的环结构中的碳原子*1~*8的位置之中,L
【化学式24】
例如,在上述通式(111)所示的基团中,在L
【化学式25】
(上述通式(111b)中,
X
多个R
多个R
在本实施方式涉及的有机EL元件中,上述通式(111)所示的基团优选为上述通式(111b)所示的基团。
在本实施方式涉及的有机EL元件中,优选的是,
ma为0、1或2,
mb为0、1或2。
在本实施方式涉及的有机EL元件中,优选的是,
ma为0或1,
mb为0或1。
在本实施方式涉及的有机EL元件中,Ar
在本实施方式涉及的有机EL元件中,
Ar
取代或未取代的苯基、
取代或未取代的萘基、
取代或未取代的联苯基、
取代或未取代的三联苯基、
取代或未取代的芘基、
取代或未取代的菲基、或者
取代或未取代的芴基。
在本实施方式涉及的有机EL元件中,Ar
【化学式26】
(上述通式(12)、通式(13)和通式(14)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
上述通式(12)、通式(13)和通式(14)中的*表示与上述通式(11)中的L
在本实施方式涉及的有机EL元件中,上述第一化合物优选由下述通式(101)表示。
【化学式27】
(上述通式(101)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
其中,R
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
mx为0、1、2、3、4或5,
在L
在本实施方式涉及的有机EL元件中,L
在本实施方式涉及的有机EL元件中,上述第一化合物优选由下述通式(102)表示。
【化学式28】
(在上述通式(102)中,
R
其中,R
X
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
ma为0、1、2、3或4,
mb为0、1、2、3或4,
ma+mb为0、1、2、3或4,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
mc为3,
3个R
md为3,
3个R
在上述通式(102)所示的化合物中,优选的是,ma为0、1或2,mb为0、1或2。
在上述通式(102)所示的化合物中,优选的是,ma为0或1,mb为0或1。
在本实施方式涉及的有机EL元件中,优选R
在本实施方式涉及的有机EL元件中,优选的是,R
在本实施方式涉及的有机EL元件中,优选的是,
Ar
L
作为并非上述通式(11)所示的基团的R
在本实施方式涉及的有机EL元件中,优选的是,
并非上述通式(11)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在本实施方式涉及的有机EL元件中,优选的是,
并非上述通式(11)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数3~50的环烷基。
在本实施方式涉及的有机EL元件中,上述通式(1)所示的化合物例如不具有取代或未取代的碳数3~50的烷基。
在本实施方式涉及的有机EL元件中,并非上述通式(11)所示的基团的R
(通式(11X)所示的化合物)
在本实施方式涉及的有机EL元件中,第一主体材料也优选为具有至少1个下述通式(111X)所示的基团且由下述通式(11X)表示的化合物。
【化学式29】
(上述通式(11X)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
上述通式(111X)所示的基团,
其中,R
在上述通式(111X)所示的基团存在多个的情况下,多个上述通式(111X)所示的基团相互相同或不同,
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
mx1为1、2、3、4或5,
在L
在Ar
上述通式(111X)中的*表示与上述通式(11X)中的苯并[a]蒽环的键合位置。)
在上述通式(11X)所示的化合物中,Ar
在上述通式(11X)所示的化合物中,Ar
取代或未取代的苯基、
取代或未取代的萘基、
取代或未取代的联苯基、
取代或未取代的三联苯基、
取代或未取代的苯并[a]蒽基、
取代或未取代的芘基、
取代或未取代的菲基、或者
取代或未取代的芴基。
在上述通式(11X)所示的化合物中,L
在上述通式(11X)所示的化合物中,也优选R
在上述通式(11X)所示的化合物中,优选的是,R
在上述通式(11X)所示的化合物中,也优选R
上述通式(11X)所示的化合物也优选由下述通式(1101X)表示。
【化学式30】
(上述通式(1101X)中,R
在上述通式(11X)所示的化合物中,也优选
Ar
L
作为并非上述通式(11X)所示的基团的R
在上述通式(11X)所示的化合物中,优选的是,并非上述通式(111X)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在上述通式(11X)所示的化合物中,优选的是,并非上述通式(111X)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数3~50的环烷基。
在上述通式(11X)所示的化合物中,并非上述通式(111X)所示的基团的R
(通式(12X)所示的化合物)
在本实施方式涉及的有机EL元件中,第一主体材料也优选为具有至少1个下述通式(121X)所示的基团且由下述通式(12X)表示的化合物。
【化学式31】
(上述通式(12X)中,
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环,
未形成上述取代或未取代的单环且未形成上述取代或未取代的稠环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
上述通式(121X)所示的基团,
其中,上述取代或未取代的单环具有取代基时的该取代基、上述取代或未取代的稠环具有取代基时的该取代基以及R
在上述通式(1 21X)所示的基团存在多个的情况下,多个上述通式(121X)所示的基团相互相同或不同,
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
mx2为1、2、3、4或5,
在L
在Ar
上述通式(121X)中的*表示与上述通式(12X)所示的环的键合位置。)
上述通式(12X)中,R
在本实施方式涉及的有机EL元件中,R
在本实施方式涉及的有机EL元件中,R
在本实施方式涉及的有机EL元件中,上述通式(12X)所示的第一化合物优选为具有至少1个上述通式(121X)所示的基团且由下述通式(121)~(124)表示的任一化合物。
【化学式32】
【化学式33】
(上述通式(121)~(124)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
上述通式(121X)所示的基团,
其中,R
在上述通式(121X)所示的基团存在多个的情况下,多个上述通式(121X)所示的基团相互相同或不同,
上述通式(121)~(124)中,R
在本实施方式涉及的有机EL元件中,Ar
在本实施方式涉及的有机EL元件中,Ar
取代或未取代的苯基、
取代或未取代的萘基、
取代或未取代的联苯基、
取代或未取代的三联苯基、
取代或未取代的芘基、
取代或未取代的菲基、或者
取代或未取代的芴基。
在本实施方式涉及的有机EL元件中,mx2优选为1或2。
在本实施方式涉及的有机EL元件中,L
在本实施方式涉及的有机EL元件中,优选的是,mx2为1或2且L
在本实施方式涉及的有机EL元件中,优选的是,并非上述通式(121X)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在本实施方式涉及的有机EL元件中,优选的是,并非上述通式(121X)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、或者
取代或未取代的成环碳数6~50的芳基。
在本实施方式涉及的有机EL元件中,优选的是,并非上述通式(121X)所示的基团的R
(通式(13X)所示的化合物)
在本实施方式涉及的有机EL元件中,第一主体材料也优选为具有至少1个下述通式(131X)所示的基团且由下述通式(13X)表示的化合物。
【化学式34】
(上述通式(13X)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
上述通式(131X)所示的基团,
其中,R
在上述通式(131X)所示的基团存在多个的情况下,多个上述通式(131X)所示的基团相互相同或不同,
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
mx3为1、2、3、4或5,
在L
在Ar
在本实施方式涉及的有机EL元件中,并非上述通式(131X)所示的基团的R
在本实施方式涉及的有机EL元件中,Ar
在本实施方式涉及的有机EL元件中,Ar
取代或未取代的苯基、
取代或未取代的萘基、
取代或未取代的联苯基、
取代或未取代的三联苯基、
取代或未取代的芘基、
取代或未取代的菲基、或者
取代或未取代的芴基。
在本实施方式涉及的有机EL元件中,作为Ar
在本实施方式涉及的有机EL元件中,L
在本实施方式涉及的有机EL元件中,优选的是,并非上述通式(131X)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在本实施方式涉及的有机EL元件中,优选的是,并非上述通式(131X)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数3~50的环烷基。
在本实施方式涉及的有机EL元件中,并非上述通式(131X)所示的基团的R
在本实施方式涉及的有机EL元件中,mx3优选为1或2。
在本实施方式涉及的有机EL元件中,优选的是,mx3为1或2且L
(通式(14X)所示的化合物)
在本实施方式涉及的有机EL元件中,第一主体材料也优选为具有至少1个下述通式(141X)所示的基团且由下述通式(14X)表示的化合物。
【化学式35】
(上述通式(14X)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
上述通式(141X)所示的基团,
其中,R
在上述通式(141X)所示的基团存在多个的情况下,多个上述通式(141X)所示的基团相互相同或不同,
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
mx4为1、2、3、4或5,
在L
在Ar
上述通式(141X)中的*表示与上述通式(14X)所示的环的键合位置。)
在本实施方式涉及的有机EL元件中,Ar
在本实施方式涉及的有机EL元件中,也优选R
在本实施方式涉及的有机EL元件中,优选的是,R
在本实施方式涉及的有机EL元件中,mx4优选为1或2。
在本实施方式涉及的有机EL元件中,L
在本实施方式涉及的有机EL元件中,优选的是,mx4为1或2且L
在本实施方式涉及的有机EL元件中,优选的是,并非上述通式(141X)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在本实施方式涉及的有机EL元件中,并非上述通式(141X)所示的基团的R
本实施方式涉及的有机EL元件的第一主体材料中,R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
在R
在R
在R
在R
在R
在R
在R
在R
在R
本实施方式涉及的第一主体材料中,记载有“取代或未取代”的基团均优选为“未取代”的基团。
(第一主体材料的制造方法)
第一主体材料可以通过公知的方法进行制造。另外,第一主体材料也可以仿效公知的方法,使用与目标物质相应的已知的替代反应和原料来进行制造。
(第一主体材料的具体例)
作为第一主体材料的具体例,例如可以举出以下的化合物。其中,本发明不限定于这些第一主体材料的具体例。
【化学式36】
(第一有机材料)
在本实施方式涉及的有机EL元件中,第一有机材料优选为不具有蒽环的化合物。
在本实施方式涉及的有机EL元件中,第一有机材料优选为分子量为2000以下的化合物。
在本实施方式涉及的有机EL元件中,第一有机材料例如也优选为下述通式(21)、通式(22)、通式(23)、通式(24)、通式(25)、通式(26)、通式(27)、或者通式(28)所示的第二化合物。
(通式(21)所示的化合物)
在本实施方式涉及的有机EL元件中,第一有机材料也优选为下述通式(21)所示的化合物。
【化学式37】
(上述通式(21)中,
L
单键、
取代或未取代的成环碳数6~18的亚芳基、或者
取代或未取代的成环原子数5~13的二价杂环基,
A
取代或未取代的成环碳数6~30的芳基、
取代或未取代的成环原子数5~30的杂环基、或者
-Si(R
R
在R
在R
在R
上述通式(21)所示的化合物优选为下述通式(212)所示的化合物。
【化学式38】
(上述通式(212)中,
L
n1和n2各自独立地为0、1、2、3或4,
在R存在多个的情况下,多个R相互相同或不同,
在R存在多个的情况下,多个R之中的相邻的2个以上所组成的组中的1组以上
相互键合而形成取代或未取代的单环、
相互键合而形成取代或未取代的稠环、或者
不相互键合,
未形成上述取代或未取代的单环且未形成上述取代或未取代的稠环的R为
氰基、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
在上述通式(21)所示的化合物中,A
【化学式39】
(上述通式(21a)、通式(21b)、通式(21c)、通式(21d)和通式(21e)中,
X
在X
在X
相互键合而形成取代或未取代的单环
相互键合而形成取代或未取代的稠环、或者
不相互键合,
R
氢原子、
氰基、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤代烷基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
R2
相互键合而形成取代或未取代的单环、
相互键合而形成取代或未取代的稠环、
或者不相互键合,
未形成上述取代或未取代的单环且未形成上述取代或未取代的稠环的R2
氢原子、
氰基、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤代烷基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
上述通式(21a)、通式(21b)、通式(21c)、通式(21d)和通式(21e)中的*各自独立地为与LA
优选的是,并非选自由上述通式(21a)、通式(21b)、通式(21c)、通式(21d)和通式(21e)所示的基团组成的组中的基团的、A
第一发光层含有上述通式(21)所示的化合物作为第一有机材料的情况下,可以期待第一发光层的空穴传输性的改善。上述通式(21)所示的化合物相较于芘化合物具有平面性小的骨架,因此易于抑制色度下降。
(通式(22)所示的化合物)
在本实施方式涉及的有机EL元件中,第一有机材料也优选为下述通式(22)所示的化合物。
【化学式40】
(上述通式(22)中,
A
取代或未取代的成环碳数6~30的芳基、或者
取代或未取代的成环原子数5~30的杂环基,
Y
Y
Y
在R
未形成上述取代或未取代的单环且未形成上述取代或未取代的稠环的R
氢原子、
氰基、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
卤素原子、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
L
单键、
取代或未取代的成环碳数6~30的亚芳基、或者
取代或未取代的成环原子数5~30的二价杂环基。)
例如,在Y
上述通式(22)所示的化合物也优选为下述通式(221)所示的化合物。
【化学式41】
(上述通式(221)中,
Y
A
上述通式(22)所示的化合物中,优选的是,A
上述通式(22)所示的化合物中,优选的是,A
上述通式(22)所示的化合物中,优选的是,A
上述通式(22)所示的化合物中,优选的是,L
在第一发光层含有上述通式(22)所示的化合物作为第一有机材料的情况下,可以期待第一发光层的空穴传输性的改善。另外,上述通式(22)所示的化合物的电子耐性比胺化合物的电子耐性更优异。上述通式(22)所示的化合物相较于芘化合物具有平面性小的骨架,因此易于抑制色度下降。
(通式(23)所示的化合物)
在本实施方式涉及的有机EL元件中,第一有机材料也优选为下述通式(23)所示的化合物。
【化学式42】
(上述通式(23)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
上述通式(231)所示的基团,
在上述通式(231)所示的基团存在多个的情况下,多个上述通式(231)所示的基团相互相同或不同,
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
m23为1、2、3、4或5,
在L
在Ar
在上述通式(231)所示的化合物的分子中包含多个芘环的情况下,该多个芘环的至少任一个具有取代或未取代的碳数3~50的烷基,
上述通式(231)中的*表示与上述通式(23)中的芘环的键合位置。)
上述通式(23)所示的化合物也优选为在分子中具有多个芘环的化合物。在上述通式(23)所示的化合物在分子中具有多个芘环的情况下,该多个芘环均优选各自独立地具有取代或未取代的碳数3~50的烷基。各个芘环具有的取代或未取代的碳数3~50的烷基的数量为1个或多个,多个取代或未取代的碳数3~50的烷基相互相同或不同。
上述通式(23)所示的化合物中,也优选的是,Ar
上述通式(23)所示的化合物也优选为在分子中均具有1个芘环的化合物。
上述通式(23)所示的化合物中,也优选R
在本实施方式涉及的有机EL元件中,优选的是,
并非上述通式(231)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在本实施方式涉及的有机EL元件中,优选的是,
并非上述通式(231)所示的基团的R
氢原子、
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数3~50的环烷基。
第一发光层含有上述通式(23)所示的化合物作为第一有机材料的情况下,可以防止向第一发光层注入过量空穴而在第二发光层中发生空穴与电子的复合。另外,上述通式(23)所示的化合物的电子耐性和激发耐性分别比双咔唑化合物的电子耐性和激发耐性更优异。上述通式(23)所示的化合物相较于芘化合物具有平面性小的骨架,因此易于抑制色度下降。
(通式(24)所示的化合物)
在本实施方式涉及的有机EL元件中,第一有机材料也优选为下述通式(24)所示的化合物。
【化学式43】
(上述通式(24)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
上述通式(241)所示的基团,
其中,R
在上述通式(241)所示的基团存在多个的情况下,多个上述通式(241)所示的基团相互相同或不同,
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
m
在L
在Ar
上述通式(241)中的*表示与上述通式(24)中的苯并[a]蒽环的键合位置。)
通过第一发光层含有上述通式(24)所示的化合物作为第一有机材料,可以对第一发光层附加电子传输性。
(通式(25)所示的化合物)
在本实施方式涉及的有机EL元件中,第一有机材料也优选为下述通式(25)所示的化合物。
【化学式44】
(上述通式(25)中,
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环,
未形成上述取代或未取代的单环且未形成上述取代或未取代的稠环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
上述通式(251)所示的基团,
其中,上述取代或未取代的单环具有取代基时的该取代基、上述取代或未取代的稠环具有取代基时的该取代基以及R
在上述通式(251)所示的基团存在多个的情况下,多个上述通式(251)所示的基团相互相同或不同,
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
AT
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
m
在L
在Ar
通过第一发光层含有上述通式(25)所示的化合物作为第一有机材料,可以对第一发光层附加电子传输性。
(通式(26)所示的化合物)
在本实施方式涉及的有机EL元件中,第一有机材料也优选为下述通式(26)所示的化合物。
【化学式45】
(上述通式(26)中,
R
氢原子、
卤素原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤代烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的碳数7~50的芳烷基、
-O-(R
-S-(R
-N(R
取代或未取代的碳数7~60的芳烷基氨基、
-C(=O)R
氰基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
R
未形成上述取代或未取代的单环且未形成上述取代或未取代的稠环的R
氢原子、或者
取代或未取代的碳数1~50的烷基,
未形成上述取代或未取代的单环且未形成上述取代或未取代的稠环的R
氢原子、
卤素原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤代烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的碳数7~50的芳烷基、
-O-(R
-S-(R
-N(R
取代或未取代的碳数7~60的芳烷基氨基、
-C(=O)R
氰基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
其中,在R
取代或未取代的9-咔唑基、
取代或未取代的氮原子数2~5的氮杂咔唑基、
取代或未取代的二苯并呋喃基、
取代或未取代的二苯并噻吩基、
取代的苯基、或者
取代的联苯基,
该取代的苯基和取代的联苯基各自独立地具有选自由
取代或未取代的9-咔唑基、
取代或未取代的氮原子数2~5的氮杂咔唑基、
取代或未取代的二苯并呋喃基、和
取代或未取代的二苯并噻吩基组成的组中的至少1个基团,
其中,不存在由R
在R
R
X
上述通式(26)所示的化合物中,R
优选的是,R
优选的是,R
碳数7~60的芳烷基氨基为-N(R
(通式(27)所示的化合物和通式(28)所示的化合物)
在本实施方式涉及的有机EL元件中,第一有机材料也优选为下述通式(27)或通式(28)所示的化合物。
【化学式46】
【化学式47】
(上述通式(27)和通式(28)中,
Ar
取代或未取代的成环碳数6的芳香族烃基、或者
取代或未取代的成环原子数6的芳香族杂环基,
其中,Ar
取代基Y为
碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
碳数7~50的芳烷基、
-Si(R
-O-(R
取代或未取代的成环碳数6~50的芳基、或者
经碳-碳键与Ar
X
R
碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
碳数7~50的芳烷基、
-Si(R
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~24的杂环基,
r、p和q各自独立地为0或1,
s为1、2或3,
n为2、3或4,分别为以L
其中,在X
L
单键、
碳数1~50的亚烷基、
取代或未取代的成环碳数3~50的亚环烷基、
二价甲硅烷基或碳数2~20的二价取代甲硅烷基、
取代或未取代的成环碳数6~50的亚芳基、或者
经碳-碳键与Ar
L
单键、
碳数1~50的亚烷基、
取代或未取代的成环碳数3~50的亚环烷基、
二价甲硅烷基或碳数2~20的二价取代甲硅烷基、
取代或未取代的成环碳数6~50的亚芳基、或者
经碳-碳键与Ar
其中,在X
在n为2的情况下,L
单键、
碳数l~50的亚烷基、
取代或未取代的成环碳数3~50的亚环烷基、
二价甲硅烷基或碳数2~20的二价取代甲硅烷基、
取代或未取代的成环碳数6~50的亚芳基、或者
经碳-碳键与Ar
在n为3的情况下,L
碳数1~50的三价饱和烃基、
取代或未取代的成环碳数3~50的三价环状饱和烃基、
三价甲硅烷基或碳数1~20的三价取代甲硅烷基、
取代或未取代的成环碳数6~50的三价芳香族烃基、或者
经碳-碳键与Ar
在n为4的情况下,L
碳数1~50的四价饱和烃基、
取代或未取代的成环碳数3~50的四价环状饱和烃基、
硅原子、
取代或未取代的成环碳数6~50的四价芳香族烃基、或者
经碳-碳键与Ar
其中,在X
A
氢原子、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
取代或未取代的成环碳数6~50的芳基、或者
经碳-碳键与L
A
氢原子、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
取代或未取代的成环碳数6~50的芳基、或者
经碳-碳键与L
其中,在L
A
上述通式(27)并非下述通式(271)所示的结构、
上述通式(28)并非下述通式(281)所示的结构。)
【化学式48】
(上述通式(271)中,
X
Y
碳数1~20的烷基、
取代或未取代的成环碳数3~20的环烷基、
碳数1~20的烷氧基、
碳数7~24的芳烷基、
碳数3~20的甲硅烷基、
取代或未取代的成环碳数6~24的芳香族烃基、或者
经碳-碳键与苯环a、b和c中的任一个连接的取代或未取代的成环原子数5~24的杂环基,
d和f为3,e为2。)
【化学式49】
(上述通式(281)中,
X
Y
碳数1~20的烷基、
取代或未取代的成环碳数3~20的环烷基、
碳数1~20的烷氧基、
碳数7~24的芳烷基、
碳数3~20的甲硅烷基、
取代或未取代的成环碳数6~24的芳香族烃基、或者
经碳-碳键与苯环a、b和c中的任一个连接的取代或未取代的成环原子数5~24的杂环基,
d和f为3,e为2。)
作为第一有机材料的上述通式(25)~(28)所示的化合物具有宽范围的能隙(大的单重态能量)。
本实施方式涉及的有机EL元件的第一有机材料中,R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
在R
在R
在R
在R
在R
在R
在R
在R
在R
本实施方式涉及的第一有机材料中,记载有“取代或未取代”的基团均优选为“未取代”的基团。
(第一有机材料的制造方法)
第一有机材料可以通过公知的方法进行制造。另外,第一有机材料也可以仿效公知的方法,使用与目标物质相应的已知的替代反应和原料进行制造。
(第一有机材料的具体例)
作为第一有机材料的具体例,例如可以举出以下的化合物。其中,本发明不限定于这些第一有机材料的具体例。
【化学式50】
【化学式51】
【化学式52】
【化学式53】
【化学式54】
【化学式55】
【化学式56】
【化学式57】
(第二主体材料)
在本实施方式涉及的有机EL元件中,第二主体材料为与第一主体材料和第一有机材料结构不同的化合物。
作为第二主体材料的第三化合物满足上述数学式(数学式1)和(数学式2)。
在本实施方式涉及的有机EL元件中,作为第二主体材料的第三化合物例如优选为下述通式(3)所示的化合物。
另外,作为第二主体材料的第三化合物如果为满足上述数学式(数学式1)和(数学式2)的化合物,则也可以是选自由上述通式(1)、(11X)、(12X)、(13X)、(14X)、(21)、(22)、(23)、(24)、(25)、(26)、(27)和(28)所示的化合物组成的组中的任一种的化合物。
【化学式58】
(上述通式(3)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
(在本实施方式涉及的第三化合物中,R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
在R
在R
在R
在R
在R
在R
在R
在R
在R
在本实施方式涉及的有机EL元件中,优选的是,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数1~50的卤烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
取代或未取代的碳数7~50的芳烷基、
-C(=O)R
-COOR
卤素原子、
氰基、或者
硝基,
L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在本实施方式涉及的有机EL元件中,优选的是,
L
单键、或者
取代或未取代的成环碳数6~50的亚芳基,
Ar
在本实施方式涉及的有机EL元件中,优选的是,
Ar
苯基、
萘基、
菲基、
联苯基、
三联苯基、
二苯基芴基、
二甲基芴基、
苯并二苯基芴基、
苯并二甲基芴基、
二苯并呋喃基、
二苯并噻吩基、
萘并苯并呋喃基、或者
萘并苯并噻吩基。
在本实施方式涉及的有机EL元件中,上述通式(3)所示的第三化合物优选为下述通式(301)、通式(302)、通式(303)、通式(304)、通式(305)、通式(306)、通式(307)、通式(308)或通式(309)所示的化合物。
【化学式59】
【化学式60】
【化学式61】
【化学式62】
【化学式63】
【化学式64】
(上述通式(301)~(309)中,
L
R
上述通式(3)所示的第三化合物也优选为下述通式(321)、通式(322)、通式(323)、通式(324)、通式(325)、通式(326)、通式(327)、通式(328)或通式(329)所示的化合物。
【化学式65】
【化学式66】
【化学式67】
【化学式68】
【化学式69】
【化学式70】
(上述通式(321)、通式(322)、通式(323)、通式(324)、通式(325)、通式(326)、通式(327)、通式(328)和通式(329)中,
R
L
L
L
Ar
Ar
上述通式(3)所示的第三化合物也优选为下述通式(341)、通式(342)、通式(343)、通式(344)、通式(345)、通式(346)、通式(347)、通式(348)或通式(349)所示的化合物。
【化学式71】
【化学式72】
【化学式73】
【化学式74】
【化学式75】
【化学式76】
(上述通式(341)、通式(342)、通式(343)、通式(344)、通式(345)、通式(346)、通式(347)、通式(348)和通式(349)中,
R
L
L
L
Ar
Ar
上述通式(3)所示的第三化合物中,优选的是,并非-L
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、或者
-Si(R
优选的是,L
单键、或者
未取代的成环碳数6~22的亚芳基,
Ar
在本实施方式涉及的有机EL元件中,
在上述通式(3)所示的第三化合物中,优选的是,R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、或者
-Si(R
在本实施方式涉及的有机EL元件中,在上述通式(3)所示的第三化合物中,R
上述第三化合物中,记载有“取代或未取代”的基团均优选为“未取代”的基团。
(第二主体材料的制造方法)
第二主体材料可以通过公知的方法进行制造。另外,第二主体材料也可以仿效公知的方法,使用与目标物质相应的已知的替代反应和原料进行制造。
(第二主体材料的具体例)
作为第二主体材料的具体例,例如可以举出以下的化合物。其中,本发明不限定于这些第二主体材料的具体例。
【化学式77】
【化学式78】
【化学式79】
【化学式80】
【化学式81】
【化学式82】
【化学式83】
【化学式84】
【化学式85】
【化学式86】
【化学式87】
【化学式88】
【化学式89】
【化学式90】
【化学式91】
【化学式92】
【化学式93】
【化学式94】
【化学式95】
【化学式96】
【化学式97】
【化学式98】
【化学式99】
【化学式100】
【化学式101】
(第一掺杂剂材料和第二掺杂剂材料)
在本实施方式涉及的有机EL元件中,第一掺杂剂材料和第二掺杂剂材料例如各自独立地为选自由下述通式(4)所示的化合物、下述通式(5)所示的化合物、下述通式(6)所示的化合物、下述通式(7)所示的化合物、下述通式(8)所示的化合物、下述通式(9)所示的化合物和下述通式(10)所示的化合物组成的组中的1个以上的化合物。在一个实施方式中,第一掺杂剂材料与第二掺杂剂材料彼此为结构相同的化合物。在一个实施方式中,第一掺杂剂材料与第二掺杂剂材料彼此为结构不同的化合物。
(通式(4)所示的化合物)
对通式(4)所示的化合物进行说明。
【化学式102】
(上述通式(4)中,
Z各自独立地为CRa或氮原子,
A1环和A2环各自独立地为
取代或未取代的成环碳数6~50的芳香族烃环、或者
取代或未取代的成环原子数5~50的杂环,
Ra存在有多个的情况下,多个Ra之中的相邻的2个以上所组成的组中的1组以上
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
n21和n22各自独立地为0、1、2、3或4,
Rb存在有多个的情况下,多个Rb之中的相邻的2个以上所组成的组中的1组以上
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
Rc存在有多个的情况下,多个Rc之中的相邻的2个以上所组成的组中的1组以上
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述单环且不形成上述稠环的Ra、Rb和Rc各自独立地为
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
在第一掺杂剂材料和第二掺杂剂材料中,R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
为取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数6~50的芳基,
在R
在R
在R
在R
在R
在R
在R
A1环和A2环的“芳香族烃环”是与向上述的“芳基”导入氢原子而成的化合物相同的结构。
A1环和A2环的“芳香族烃环”包含上述通式(4)中央的稠合2环结构上的2个碳原子作为成环原子。
作为“取代或未取代的成环碳数6~50的芳香族烃环”的具体例,可以举出向在具体例组G1中记载的“芳基”导入氢原子而成的化合物等。
A1环和A2环的“杂环”是与向上述的“杂环基”导入氢原子而成的化合物相同的结构。
A1环和A2环的“杂环”包含上述通式(4)中央的稠合2环结构上的2个碳原子作为成环原子。
作为“取代或未取代的成环原子数5~50的杂环”的具体例,可以举出向在具体例组G2中记载的“杂环基”导入氢原子而成的化合物等。
Rb键合于形成作为A1环的芳香族烃环的碳原子中的任一个、或者形成作为A1环的杂环的原子中的任一个。
Rc键合于形成作为A2环的芳香族烃环的碳原子中的任一个、或者形成作为A2环的杂环的原子中的任一个。
Ra、Rb和Rc之中,优选至少1个为下述通式(4a)所示的基团,更优选至少2个为下述通式(4a)所示的基团。
【化学式103】
*-L
(上述通式(4a)中,
L
单键、
取代或未取代的成环碳数6~30的亚芳基、或者
取代或未取代的成环原子数5~30的二价杂环基,
Ar
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
下述通式(4b)所示的基团。)
【化学式104】
(上述通式(4b)中,
L
单键、
取代或未取代的成环碳数6~30的亚芳基、或者
取代或未取代的成环原子数5~30的二价杂环基,
Ar
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述单环且不形成上述稠环的Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
在一个实施方式中,上述通式(4)所示的化合物由下述通式(42)表示。
【化学式105】
(上述通式(42)中,
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述单环且不形成上述稠环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
R
R
在一个实施方式中,上述通式(4)所示的化合物为在A1环上键合下述通式(4-1)或通式(4-2)所示的结构而成的化合物。
另外,在一个实施方式中,上述通式(42)所示的化合物为在R
【化学式106】
(上述通式(4-1)中,2个*各自独立地与上述通式(4)的作为A1环的芳香族烃环的成环碳原子或杂环的成环原子键合、或者与上述通式(42)的R
上述通式(4-2)的3个*各自独立地与上述通式(4)的作为A1环的芳香族烃环的成环碳原子或杂环的成环原子键合、或者与上述通式(42)的R
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述单环且不形成上述稠环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
在一个实施方式中,上述通式(4)所示的化合物为下述通式(41-3)、通式(41-4)或通式(41-5)所示的化合物。
【化学式107】
【化学式108】
【化学式109】
(上述通式(41-3)、式(41-4)和式(41-5)中,
A1环与上述通式(4)中的定义相同,
R
R
在一个实施方式中,上述通式(41-5)的作为A1环的取代或未取代的成环碳数6~50的芳香族烃环为
取代或未取代的萘环或者
取代或未取代的芴环。
在一个实施方式中,上述通式(41-5)的作为A1环的取代或未取代的成环原子数5~50的杂环为
取代或未取代的二苯并呋喃环、
取代或未取代的咔唑环或者
取代或未取代的二苯并噻吩环。
在一个实施方式中,上述通式(4)或上述通式(42)所示的化合物选自由下述通式(461)~通式(467)所示的化合物组成的组。
【化学式110】
【化学式111】
【化学式112】
【化学式113】
【化学式114】
(上述通式(461)、通式(462)、通式(463)、通式(464)、通式(465)、通式(466)和通式(467)中,
R
R
R
X
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数6~50的芳基,
R
R
R
在一个实施方式中,上述通式(42)所示的化合物中,R
(通式(45)所示的化合物)
对于通式(45)所示的化合物进行说明。
【化学式115】
(上述通式(45)中,
选自由R
其中,
R
R
R
R
R
R
不形成上述单环且不形成上述稠环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
上述通式(45)中,R
上述通式(45)所示的化合物中的上述的环结构的数量例如为2个、3个或4个。2个以上的环结构各自可以存在于上述通式(45)的母骨架上的同一苯环上,也可以存在于不同苯环上。例如,在具有3个环结构的情况下,可以在上述通式(45)的3个苯环的每个上各存在1个环结构。
作为上述通式(45)所示的化合物中的上述的环结构,例如可以举出下述通式(451)~(460)所示的结构等。
【化学式116】
(上述通式(451)~(457)中,
*1与*2、*3与*4、*5与*6、*7与*8、*9与*10、*11与*12和*13与*14分别表示R
R
X
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述单环且不形成上述稠环的R
【化学式117】
(上述通式(458)~(460)中,
*1与*2以及*3与*4分别表示R
R
X
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述单环且不形成上述稠环的R
上述通式(45)中,优选的是,R
(i)上述通式(45)中,由R
(ii)上述通式(45)中,不形成环结构的R
(iii)式(451)~(460)中的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-N(R
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
下述通式(461)~通式(464)所示的基团组成的组中的任一基团。
【化学式118】
(上述通式(461)~(464)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
X
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数6~50的芳基,
R
R
R
p1为5,
p2为4,
p3为3,
p4为7,
上述通式(461)~(464)中的*各自独立地表示与环结构的键合位置。)
在第一掺杂剂材料和第二掺杂剂材料中,R
在一个实施方式中,上述通式(45)所示的化合物由下述通式(45-1)~(45-6)中任一式表示。
【化学式119】
【化学式120】
(上述通式(45-1)~(45-6)中,
环d~i各自独立地为取代或未取代的单环或者取代或未取代的稠环,
R
在一个实施方式中,上述通式(45)所示的化合物由下述通式(45-7)~(45-12)中任一式表示。
【化学式121】
【化学式122】
(上述通式(45-7)~(45-12)中,
环d~f、k、j各自独立地为取代或未取代的单环或者取代或未取代的稠环,
R
在一个实施方式中,上述通式(45)所示的化合物由下述通式(45-13)~(45-21)中任一式表示。
【化学式123】
【化学式124】
【化学式125】
(上述通式(45-13)~(45-21)中,
环d~k各自独立地为取代或未取代的单环或者取代或未取代的稠环,
R
作为上述环g或上述环h进一步具有取代基时的取代基,例如可以举出
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数6~50的芳基、
上述通式(461)所示的基团、
上述通式(463)所示的基团或者
上述通式(464)所示的基团。
在一个实施方式中,上述通式(45)所示的化合物由下述通式(45-22)~(45-25)中任一式表示。
【化学式126】
(上述通式(45-22)~(45-25)中,
X
R
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数6~50的芳基,
R
R
R
在一个实施方式中,上述通式(45)所示的化合物由下述通式(45-26)表示。
【化学式127】
(上述通式(45-26)中,
X
R
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数6~50的芳基,
R
R
R
作为上述通式(4)所示的化合物,例如可以举出以下所示的化合物作为具体例。下述具体例中,Ph表示苯基,D表示氘原子。
【化学式128】
【化学式129】
【化学式130】
【化学式131】
【化学式132】
【化学式133】
【化学式134】
【化学式135】
【化学式136】
【化学式137】
(通式(5)所示的化合物)
对通式(5)所示的化合物进行说明。通式(5)所示的化合物为与上述的通式(41-3)所示的化合物对应的化合物。
【化学式138】
(上述通式(5)中,
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述单环且不形成上述稠环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
“R
在一个实施方式中,R
在一个实施方式中,R
氢原子、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在一个实施方式中,上述通式(5)所示的化合物为下述通式(52)所示的化合物。
【化学式139】
(上述通式(52)中,
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述单环且不形成上述稠环的R
氢原子、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
R
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
在一个实施方式中,上述通式(5)所示的化合物为下述通式(53)所示的化合物。
【化学式140】
(上述通式(53)中,R
在一个实施方式中,上述通式(52)和通式(53)中的R
在一个实施方式中,上述通式(5)中的R
在一个实施方式中,上述通式(5)、通式(52)和通式(53)中的表述为“取代或未取代的”时的取代基为
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
作为上述通式(5)所示的化合物,例如可以举出以下所示的化合物作为具体例。
【化学式141】
【化学式142】
【化学式143】
【化学式144】
【化学式145】
【化学式146】
【化学式147】
【化学式148】
【化学式149】
【化学式150】
【化学式151】
【化学式152】
【化学式153】
【化学式154】
(式中,Ph为苯基)【化学式155】
【化学式156】
(通式(6)所示的化合物)
对于通式(6)所示的化合物进行说明。
【化学式157】
(上述通式(6)中,
a环、b环和c环各自独立地为
取代或未取代的成环碳数6~50的芳香族烃环、或者
取代或未取代的成环原子数5~50的杂环,
R
不形成上述取代或未取代的杂环的R
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
a环、b环和c环是与由硼原子和2个氮原子构成的上述通式(6)中央的稠合2环结构稠合的环(取代或未取代的成环碳数6~50的芳香族烃环、或者取代或未取代的成环原子数5~50的杂环)。
a环、b环和c环的“芳香族烃环”是与向上述的“芳基”导入氢原子而成的化合物相同的结构。
a环的“芳香族烃环”包含上述通式(6)中央的稠合2环结构上的3个碳原子作为成环原子。
b环和c环的“芳香族烃环”包含上述通式(6)中央的稠合2环结构上的2个碳原子作为成环原子。
作为“取代或未取代的成环碳数6~50的芳香族烃环”的具体例,可以举出向在具体例组G1中记载的“芳基”导入氢原子而成的化合物等。
a环、b环和c环的“杂环”是与向上述的“杂环基”导入氢原子而成的化合物相同的结构。
a环的“杂环”包含上述通式(6)中央的稠合2环结构上的3个碳原子作为成环原子。b环和c环的“杂环”包含上述通式(6)中央的稠合2环结构上的2个碳原子作为成环原子。作为“取代或未取代的成环原子数5~50的杂环”的具体例,可以举出向在具体例组G2中记载的“杂环基”导入氢原子而成的化合物等。
R
R
在一个实施方式中,上述通式(6)中的a环、b环和c环各自独立地为取代或未取代的成环碳数6~50的芳香族烃环。
在一个实施方式中,上述通式(6)中的a环、b环和c环各自独立地为取代或未取代的苯环或萘环。
在一个实施方式中,上述通式(6)中的R
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
优选为取代或未取代的成环碳数6~50的芳基。
在一个实施方式中,上述通式(6)所示的化合物为下述通式(62)所示的化合物。
【化学式158】
(上述通式(62)中,
R
R
不形成上述取代或未取代的杂环的R
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述取代或未取代的杂环、不形成上述单环且不形成上述稠环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
上述通式(62)的R
例如,也可以是R
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环。
例如,可以R
在一个实施方式中,不参与形成环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在一个实施方式中,不参与形成环的R
氢原子、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在一个实施方式中,不参与形成环的R
氢原子或者
取代或未取代的碳数1~50的烷基。
在一个实施方式中,不参与形成环的R
氢原子或者
取代或未取代的碳数1~50的烷基,
R
在一个实施方式中,上述通式(62)所示的化合物为下述通式(63)所示的化合物。
【化学式159】
(上述通式(63)中,
R
R
R
R
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述取代或未取代的杂环、不形成上述单环且不形成上述稠环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
R
在一个实施方式中,不参与形成环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在一个实施方式中,不参与形成环的R
氢原子、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在一个实施方式中,不参与形成环的R
氢原子或者
取代或未取代的碳数1~50的烷基。
在一个实施方式中,不参与形成环的R
氢原子或者
取代或未取代的碳数1~50的烷基,
R
在一个实施方式中,上述通式(63)所示的化合物为下述通式(63A)所示的化合物。
【化学式160】
(上述通式(63A)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、或者
取代或未取代的成环碳数6~50的芳基,
R
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、或者
取代或未取代的成环碳数6~50的芳基。)
在一个实施方式中,R
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数6~50的芳基。
在一个实施方式中,R
在一个实施方式中,上述通式(63)所示的化合物为下述通式(63B)所示的化合物。
【化学式161】
(上述通式(63B)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-N(R
取代或未取代的成环碳数6~50的芳基,
R
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-N(R
取代或未取代的成环碳数6~50的芳基。)
在一个实施方式中,上述通式(63)所示的化合物为下述通式(63B’)所示的化合物。
【化学式162】
(上述通式(63B’)中,R
在一个实施方式中,R
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-N(R
取代或未取代的成环碳数6~50的芳基。
在一个实施方式中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
-N(R
取代或未取代的成环碳数6~50的芳基,
R
取代或未取代的碳数1~50的烷基、
-N(R
取代或未取代的成环碳数6~50的芳基。
在一个实施方式中,上述通式(63)所示的化合物为下述通式(63C)所示的化合物。
【化学式163】
(上述通式(63C)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、或者
取代或未取代的成环碳数6~50的芳基。
R
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、或者
取代或未取代的成环碳数6~50的芳基。)
在一个实施方式中,上述通式(63)所示的化合物为下述通式(63C’)所示的化合物。
【化学式164】
(上述通式(63C’)中,R
在一个实施方式中,R
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数6~50的芳基。
在一个实施方式中,R
对于上述通式(6)所示的化合物而言,可以首先将a环、b环和c环利用连接基团(包含N-R
以下虽然记载上述通式(6)所示的化合物的具体例,但是这些仅为例示,上述通式(6)所示的化合物不限定于下述具体例。
【化学式165】
【化学式166】
【化学式167】
【化学式168】
【化学式169】
【化学式170】
【化学式171】
【化学式172】
【化学式173】
【化学式174】
【化学式175】
【化学式176】
(通式(7)所示的化合物)
对于通式(7)所示的化合物进行说明。
【化学式177】
【化学式178】
(上述通式(7)中,
r环为在相邻环的任意的位置稠合的上述通式(72)或通式(73)所示的环,
q环和s环各自独立地为在相邻环的任意的位置稠合的上述通式(74)所示的环,
p环和t环各自独立地为在相邻环的任意的位置稠合的上述通式(75)或通式(76)所示的结构,
X
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述单环且不形成上述稠环的R
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
Ar
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
L
取代或未取代的碳数1~50的亚烷基、
取代或未取代的碳数2~50的亚烯基、
取代或未取代的碳数2~50的亚炔基、
取代或未取代的成环碳数3~50的亚环烷基、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
m1为0、1或2,
m2为0、1、2、3或4,
m3各自独立地为0、1、2或3,
m4各自独立地为0、1、2、3、4或5,
R
X
R
Ar
Ar
L
上述通式(7)中,p环、q环、r环、s环和t环的各环与相邻环共有2个碳原子地稠合。稠合的位置和方向没有限定,能够在任意的位置和方向进行稠合。
在一个实施方式中,在作为r环的上述通式(72)或通式(73)中,m1=0或m2=0。
在一个实施方式中,上述通式(7)所示的化合物由下述通式(71-1)~(71-6)中任一式表示。
【化学式179】
【化学式180】
【化学式181】
【化学式182】
【化学式183】
【化学式184】
(上述通式(71-1)~通式(71-6)中,R
在一个实施方式中,上述通式(7)所示的化合物由下述通式(71-11)~通式(71-13)中任一式表示。
【化学式185】
【化学式186】
【化学式187】
(上述通式(71-11)~通式(71-13)中,R
在一个实施方式中,上述通式(7)所示的化合物由下述通式(71-21)~(71-25)中任一式表示。
【化学式188】
【化学式189】
【化学式190】
【化学式191】
【化学式192】
(上述通式(71-21)~通式(71-25)中,R
在一个实施方式中,上述通式(7)所示的化合物由下述通式(71-31)~通式(71-33)中任一式表示。
【化学式193】
【化学式194】
【化学式195】
(上述通式(71-31)~通式(71-33)中,R
在一个实施方式中,Ar
在一个实施方式中,Ar
作为上述通式(7)所示的化合物,例如可以举出以下所示的化合物作为具体例。
【化学式196】
【化学式197】
【化学式198】
【化学式199】
【化学式200】
【化学式201】
(通式(8)所示的化合物)
对通式(8)所示的化合物进行说明。
【化学式202】
(上述通式(8)中,
R
R
【化学式203】
(不形成上述通式(82)所示的二价基团的R
不形成上述通式(83)所示的二价基团的R
X
不形成上述通式(82)和通式(83)所示的二价基团且并非上述通式(84)所示的一价基团的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
【化学式204】
(上述通式(84)中,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
L
单键、
取代或未取代的成环碳数6~30的亚芳基、
取代或未取代的成环原子数5~30的二价杂环基、或者
选自由取代或未取代的成环碳数6~30的亚芳基和取代或未取代的成环原子数5~30的二价杂环基组成的组中的2~4个基团键合而形成的二价连接基团,
上述通式(84)中的*表示与上述通式(8)所示的环结构、通式(82)或通式(83)所示的基团的键合位置。)
上述通式(8)中,形成上述通式(82)所示的二价基团和通式(83)所示的二价基团的位置没有特别限定,能够在R
在一个实施方式中,上述通式(8)所示的化合物由下述通式(81-1)~(81-6)中任一式表示。
【化学式205】
【化学式206】
【化学式207】
(上述通式(81-1)~通式(81-6)中,
X
R
并非上述通式(84)所示的一价基团的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
在一个实施方式中,上述通式(8)所示的化合物由下述通式(81-7)~(81-18)中任一式表示。
【化学式208】
【化学式209】
【化学式210】
【化学式211】
【化学式212】
【化学式213】
(上述通式(81-7)~通式(81-18)中,
X
*为与上述通式(84)所示的一价基团键合的单键,
R
不形成上述通式(82)和通式(83)所示的二价基团且并非上述通式(84)所示的一价基团的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
上述通式(84)所示的一价基团优选由下述通式(85)或通式(86)表示。
【化学式214】
(上述通式(85)中,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
上述通式(85)中的*与上述通式(84)中的*含义相同。)
【化学式215】
(上述通式(86)中,
Ar
HAr
【化学式216】
(上述通式(87)中,
X
R
并非单键的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
作为上述通式(8)所示的化合物,可以举出国际公开第2014/104144号记载的化合物、以及例如以下所示的化合物作为具体例。
【化学式217】
【化学式218】
【化学式219】
【化学式220】
【化学式221】
【化学式222】
(通式(9)所示的化合物)
对通式(9)所示的化合物进行说明。
【化学式223】
(上述通式(9)中,
A
取代或未取代的成环碳数6~50的芳香族烃环、或者、
取代或未取代的成环原子数5~50的杂环,
选自A
【化学式224】
(上述通式(92)中,
A
取代或未取代的成环碳数6~50的芳香族烃环、或者、
取代或未取代的成环原子数5~50的杂环,
X
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述单环且不形成上述稠环的R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
选自A
在一个实施方式中,下述通式(93)所示的基团键合于A
【化学式225】
(上述通式(93)中,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
L
单键、
取代或未取代的成环碳数6~30的亚芳基、
取代或未取代的成环原子数5~30的二价杂环基、或者
选自由取代或未取代的成环碳数6~30的亚芳基和取代或未取代的成环原子数5~30的二价杂环基组成的组中的2~4个键合而形成的二价连接基团,
上述通式(93)中的*表示与A
在一个实施方式中,除了A
在一个实施方式中,R
在一个实施方式中,R
在一个实施方式中,环A
在一个实施方式中,环A
在一个实施方式中,X
作为上述通式(9)所示的化合物,例如可以举出以下所示的化合物作为具体例。
【化学式226】
【化学式227】
【化学式228】
【化学式229】
(通式(10)所示的化合物)
对于通式(10)所示的化合物进行说明。
【化学式230】
【化学式231】
(上述通式(10)中,
Ax
Ax
上述通式(10b)中的2个*与Ax
X
Ax
取代或未取代的成环碳数6~50的芳香族烃环、或者
取代或未取代的成环原子数5~50的杂环,
Ar
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
mx1为3,mx2为2,
多个R
多个R
ax为0、1或2,
在ax为0或1的情况下,“3-ax”所示的括弧内的结构相互相同或不同,
在ax为2的情况下,多个Ar
在一个实施方式中,Ar
在一个实施方式中,Ax
在一个实施方式中,R
在一个实施方式中,ax为1。
作为上述通式(10)所示的化合物,例如可以举出以下所示的化合物作为具体例。
【化学式232】
在一个实施方式中,第一发光层的第一掺杂剂材料和第二发光层的第二掺杂剂材料各自独立地为选自由上述通式(4)所示的化合物、上述通式(5)所示的化合物、上述通式(7)所示的化合物、上述通式(8)所示的化合物、上述通式(9)所示的化合物和下述通式(63a)所示的化合物组成的组中的化合物。
【化学式233】
(上述通式(63a)中,
R
R
R
R
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
不形成上述取代或未取代的杂环、不形成上述单环且不形成上述稠环的R
氢原子、
卤素原子、
氰基、
硝基、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
需要说明的是,不形成上述取代或未取代的杂环、不形成上述单环且不形成上述稠环的R
卤素原子、
氰基、
硝基、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。)
在一个实施方式中,上述通式(4)所示的化合物为上述通式(41-3)、通式(41-4)或通式(41-5)所示的化合物,上述通式(41-5)中的A1环为取代或未取代的成环碳数10~50的稠合芳香族烃环或者取代或未取代的成环原子数8~50的稠合杂环。
在一个实施方式中,上述通式(41-3)、通式(41-4)以及通式(41-5)中的上述取代或未取代的成环碳数10~50的稠合芳香族烃环为
取代或未取代的萘环、
取代或未取代的蒽环或
取代或未取代的芴环,
上述取代或未取代的成环原子数8~50的稠合杂环为
取代或未取代的二苯并呋喃环、
取代或未取代的咔唑环或者
取代或未取代的二苯并噻吩环。
在一个实施方式中,上述通式(41-3)、通式(41-4)或通式(41-5)中的上述取代或未取代的成环碳数10~50的稠合芳香族烃环为
取代或未取代的萘环或者
取代或未取代的芴环,
上述取代或未取代的成环原子数8~50的稠合杂环为
取代或未取代的二苯并呋喃环、
取代或未取代的咔唑环或者
取代或未取代的二苯并噻吩环。
在一个实施方式中,上述通式(4)所示的化合物选自由
下述通式(461)所示的化合物、
下述通式(462)所示的化合物、
下述通式(463)所示的化合物、
下述通式(464)所示的化合物、
下述通式(465)所示的化合物、
下述通式(466)所示的化合物以及
下述通式(467)所示的化合物组成的组。
【化学式234】
【化学式235】
【化学式236】
【化学式237】
【化学式238】
(上述通式(461)~(467)中,
R
相互键合而形成取代或未取代的单环、或者
相互键合而形成取代或未取代的稠环、或者
不相互键合,
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的碳数2~50的烯基、
取代或未取代的碳数2~50的炔基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
X
R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
取代或未取代的碳数1~50的烷基、或者
取代或未取代的成环碳数6~50的芳基,
在R
在R
在R
在一个实施方式中,R
氢原子、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基。
在一个实施方式中,R
氢原子、
取代或未取代的成环碳数6~18的芳基以及
取代或未取代的成环原子数5~18的杂环基组成的组。
在一个实施方式中,上述通式(41-3)所示的化合物为下述通式(41-3-1)所示的化合物。
【化学式239】
(上述通式(41-3-1)中,R
在一个实施方式中,上述通式(41-3)所示的化合物为下述通式(41-3-2)所示的化合物。
【化学式240】
(上述通式(41-3-2)中,R
需要说明的是,R
在一个实施方式中,上述式(41-3-2)中的R
在一个实施方式中,上述式(41-3-2)所示的化合物为下述式(41-3-3)所示的化合物。
【化学式241】
(上述通式(41-3-3)中,R
R
取代或未取代的成环碳数6~18的芳基、或者
取代或未取代的成环原子数5~18的杂环基。)
在一个实施方式中,上述式(41-3-3)所示的化合物为下述式(41-3-4)所示的化合物。
【化学式242】
(上述通式(41-3-4)中,R
在一个实施方式中,R
在一个实施方式中,R
在一个实施方式中,R
在一个实施方式中,上述各式中的表述为“取代或未取代的”时的取代基为
未取代的碳数1~50的烷基、
未取代的碳数2~50的烯基、
未取代的碳数2~50的炔基、
未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
-S-(R
-N(R
卤素原子、
氰基、
硝基、
未取代的成环碳数6~50的芳基、或者
未取代的成环原子数5~50的杂环基,
R
氢原子、
未取代的碳数1~50的烷基、
未取代的成环碳数6~50的芳基、或者
未取代的成环原子数5~50的杂环基,
在R
在R
在R
在R
在R
在R
在R
在一个实施方式中,上述各式中的表述为“取代或未取代的”时的取代基为
未取代的碳数1~50的烷基、
未取代的成环碳数6~50的芳基、或者
未取代的成环原子数5~50的杂环基。
在一个实施方式中,上述各式中的表述为“取代或未取代的”时的取代基为
未取代的碳数1~18的烷基、
未取代的成环碳数6~18的芳基、或者
未取代的成环原子数5~18的杂环基。
[第二实施方式]
对于第二实施方式涉及的有机电致发光元件进行说明。在第二实施方式的说明中,对与第一实施方式相同的构成要素赋予相同符号、名称等而省略或简化说明。另外,在第二实施方式中,对于没有特别提及的材料、化合物,可以使用与在第一实施方式中说明的材料、化合物同样的材料、化合物。
第二实施方式涉及的有机EL元件在第一发光层和第二发光层之中的配置于阳极侧的发光层与阳极之间配置有第一有机层。第二实施方式的有机EL元件在限定了具有规定的第一有机层的这一点上与第一实施方式涉及的有机EL元件不同,而在其他点上与第一实施方式涉及的有机EL元件同样。
(第一有机层)
第一有机层为配置于阳极与发光层之间的层。
在本实施方式涉及的有机EL元件中,第一发光层配置于阳极与第二发光层之间的情况下,第一有机层配置于第一发光层与阳极之间。
在本实施方式涉及的有机EL元件中,第二发光层配置于阳极与第一发光层之间的情况下,第一有机层配置于第二发光层与阳极之间。
第一有机层优选为配置于阳极与第一发光层之间的层。
第一有机层优选与发光层直接相接。
在本实施方式涉及的有机EL元件中,第一发光层配置于阳极与第二发光层之间的情况下,第一有机层优选与第一发光层直接相接。
在本实施方式涉及的有机EL元件中,第二发光层配置于阳极与第一发光层之间的情况下,第一有机层优选与第二发光层直接相接。
(空穴传输区域材料)
第一有机层含有空穴传输区域材料。
空穴传输区域材料优选为选自由下述通式(A300)和通式(A400)所示的化合物组成的组中的至少任一化合物。下述通式(A300)所示的化合物为在其分子中仅具有1个取代氨基的化合物。
·通式(A300)所示的化合物
【化学式243】
(上述通式(A300)中,
L
单键、
取代或未取代的成环碳数6~18的亚芳基、或者
取代或未取代的成环原子数5~13的二价杂环基,
A
取代或未取代的成环碳数6~30的芳基、
取代或未取代的成环原子数5~30的杂环基、或者
-Si(R
其中,A
R
在R
在R
在R
上述通式(A301)中,
n3为3,3个R
3个R
相互键合而形成取代或未取代的单环、
相互键合而形成取代或未取代的稠环、或者
不相互键合,
R
相互键合而形成取代或未取代的单环、
相互键合而形成取代或未取代的稠环、或者
不相互键合,
R
相互键合而形成取代或未取代的单环、
相互键合而形成取代或未取代的稠环、或者
不相互键合,
上述通式(A302)中,
R
相互键合而形成取代或未取代的单环、
相互键合而形成取代或未取代的稠环、或者
不相互键合,
R
相互键合而形成取代或未取代的单环、
相互键合而形成取代或未取代的稠环、或者
不相互键合,
上述通式(A303)中,
R
相互键合而形成取代或未取代的单环、
相互键合而形成取代或未取代的稠环、或者
不相互键合,
R
相互键合而形成取代或未取代的单环、
相互键合而形成取代或未取代的稠环、或者
不相互键合,
上述通式(A301)、通式(A302)和通式(A303)中,R
氢原子、
氰基、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
-Si(R
-O-(R
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
上述通式(A301)、通式(A302)和通式(A303)中的*为与L
上述通式(A300)所示的化合物为在其分子中仅具有1个取代氨基的化合物,有时称为单胺化合物。
上述通式(A300)所示的化合物中,L
上述通式(A300)所示的化合物中,在C
【化学式244】
上述通式(A300)所示的化合物中,在C
【化学式245】
上述通式(A300)所示的化合物中,在C
【化学式246】
(上述通式(301A)、(302A)和(303A)中,L
在本实施方式涉及的有机EL元件中,空穴传输区域材料优选为上述通式(A300)所示的化合物。
在本实施方式涉及的有机EL元件中,优选的是,A
在本实施方式涉及的有机EL元件中,优选的是,A
·通式(A400)所示的化合物
【化学式247】
(上述通式(A400)中,L
单键、
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
n4为1、2、3或4,
在n4为1的情况下,L
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
在n4为2、3或4的情况下,多个L
在n4为2、3或4的情况下,多个L
相互键合而形成取代或未取代的单环
相互键合而形成取代或未取代的稠环、或者
不相互键合,
未形成上述单环且未形成上述稠环的L
取代或未取代的成环碳数6~50的亚芳基、或者
取代或未取代的成环原子数5~50的二价杂环基,
A
取代或未取代的成环碳数6~50的芳基、
取代或未取代的成环原子数5~50的杂环基、或者
-Si(R
R
在R
在R
在R
在空穴传输区域材料中,R
氢原子、
取代或未取代的碳数1~50的烷基、
取代或未取代的成环碳数3~50的环烷基、
取代或未取代的成环碳数6~50的芳基、或者
取代或未取代的成环原子数5~50的杂环基,
在R
在R
在R
在R
上述通式(A400)所示的化合物也优选为在其分子中具有2个取代氨基的化合物。有时将具有2个取代氨基的化合物称为二胺化合物。
上述通式(A400)所示的化合物中,L
本实施方式涉及的空穴传输区域材料中,记载有“取代或未取代”的基团均优选为“未取代”的基团。
(空穴传输区域材料的制造方法)
空穴传输区域材料可以通过公知的方法进行制造。另外,空穴传输区域材料也可以仿效公知的方法,使用与目标物质相应的已知的替代反应和原料进行制造。
(空穴传输区域材料的具体例)
作为空穴传输区域材料的具体例,例如可以举出以下的化合物。其中,本发明不限定于这些空穴传输区域材料的具体例。
【化学式248】
在本实施方式中,空穴传输区域材料的含量例如为第一有机层的总质量的60质量%以上、第一有机层的总质量的70质量%以上、第一有机层的总质量的80质量%以上、第一有机层的总质量的90质量%以上、或者第一有机层的总质量的95质量%以上。在本实施方式中,空穴传输区域材料的含量例如为第一有机层的总质量的100质量%以下。
在本实施方式涉及的有机电致发光元件中,优选的是,空穴传输区域材料与第一主体材料彼此为结构不同的化合物。
在本实施方式涉及的有机电致发光元件中,优选的是,空穴传输区域材料与第一有机材料彼此为结构不同的化合物。
在本实施方式涉及的有机EL元件中,第一有机层的膜厚优选为20nm以上。在本实施方式涉及的有机EL元件中,第一有机层的膜厚例如为30nm以上,第一有机层的膜厚例如为40nm以上。
在本实施方式涉及的有机EL元件的一个方案中,例如具有配置于阳极与第一有机层之间且与第一有机层直接相接的第二有机层。第二有机层例如与阳极直接相接。在本实施方式涉及的有机EL元件具有第二有机层的情况下,优选第一有机层的膜厚大于第二有机层的膜厚。
在本实施方式涉及的有机电致发光元件中,优选第一主体材料与空穴传输区域材料满足下述数学式(数学式20)的关系。
Ip(H1)-Ip(HT1)>0.3eV…(数学式20)
在本实施方式涉及的有机电致发光元件中,优选第一主体材料与空穴传输区域材料满足下述数学式(数学式20A)或(数学式20B)的关系。
Ip(H1)-Ip(HT1)>0.4eV…(数学式20A)
Ip(H1)-Ip(HT1)>0.5eV…(数学式20B)
(上述数学式(数学式20)、(数学式20A)和(数学式20B)中,Ip(H1)为上述第一主体材料的电离势(单位:eV),Ip(HT1)为上述空穴传输区域材料的电离势(单位:eV)。
在本说明书中,电离势在空气中使用光电子分光装置进行测定。具体而言,可以通过实施例记载的方法测定电离势。
(有机EL元件的其他层)
本实施方式涉及的有机EL元件可以在第一有机层、第一发光层和第二发光层以外还具有1个以上的有机层。作为有机层,例如可以举出选自由空穴注入层、空穴传输层、发光层、电子注入层、电子传输层、空穴阻挡层和电子阻挡层组成的组中的至少任一个层。
本实施方式涉及的有机EL元件的有机层可以仅由第一有机层、第一发光层和第二发光层构成,也可以进一步具有例如选自由空穴注入层、空穴传输层、电子注入层、电子传输层、空穴阻挡层和电子阻挡层等组成的组中的至少任一个层。
在本实施方式涉及的有机EL元件中,优选在阳极与第一发光层之间包含空穴传输层。在本实施方式涉及的有机EL元件中,也优选第一有机层为空穴传输层。例如,在图1所示的有机EL元件1中,空穴传输层7相当于第一有机层。
在本实施方式涉及的有机EL元件中,也优选第一有机层为电子阻挡层。电子阻挡层优选与发光层的阳极侧直接相接。电子阻挡层例如为传输空穴且阻止电子到达比该阻挡层更靠阳极侧的层(例如空穴传输层或空穴注入层)的层。另外,电子阻挡层可以为阻止激发能量从发光层漏出至其周边层的层。这种情况下,电子阻挡层阻止在发光层中生成的激子移动至比该阻挡层更靠阳极侧的层(例如空穴传输层或空穴注入层)。
作为本实施方式涉及的有机EL元件的一个方案,可以举出一种有机EL元件,其具有阳极、阴极、配置于阳极与阴极之间的第一发光层、配置于第一发光层与阴极之间的第二发光层、配置于阳极与第一发光层之间的第一有机层,第一发光层与第一有机层直接相接,第一有机层含有空穴传输区域材料,第一发光层含有第一主体材料、第一有机材料和第一掺杂剂材料,第二发光层含有第二主体材料和第二掺杂剂材料,第一主体材料、第一有机材料、第二主体材料、第一掺杂剂材料和第二掺杂剂材料满足上述数学式(数学式1)、(数学式2)、(数学式3)、(数学式5)和(数学式6)的关系,第一主体材料、第一有机材料和第二主体材料彼此为结构不同的化合物,空穴传输区域材料为选自由上述通式(A300)和通式(A400)所示的化合物组成的组中的至少任一个化合物,通式(A300)所示的化合物在其分子中仅具有1个取代氨基,第一有机材料为上述通式(21)或上述通式(22)所示的化合物,第一掺杂剂材料与第二掺杂剂材料彼此为结构相同的化合物、或者结构不同的化合物。根据该方案的有机EL元件,提供维持元件性能(例如维持高的发光效率)并且能够减少有机层的数量的有机EL元件。在本实施方式涉及的有机EL元件中,通过2个发光层(第一发光层和第二发光层)满足数学式(数学式1)、数学式(数学式3)和数学式(数学式5)的关系,元件性能提高。具备2个发光层的有机EL元件相较于具备1个发光层的有机EL元件,配置于阳极与阴极之间的有机层的数量增加,因此在有机EL元件的制造时形成的有机层的数量增加。通过本实施方式涉及的有机EL元件的第一发光层含有满足数学式(数学式2)和数学式(数学式6)的有机物,第一有机层和第一发光层分别含有规定结构的化合物,由此即便减少配置于阳极与第一发光层之间的有机层的数量(例如即便省略在以往的有机EL元件中配置于空穴传输层与发光层之间的电子阻挡层)也能够维持元件性能。
[第三实施方式]
(电子设备)
本实施方式涉及的电子设备搭载了上述的实施方式中的任一个有机EL元件。作为电子设备,例如可以举出显示装置和发光装置等。作为显示装置,例如可以举出显示部件(例如有机EL平板模块等)、电视、移动电话、平板电脑以及个人电脑等。作为发光装置,例如可以举出照明和车辆用灯具等。
[实施方式的变形]
需要说明的是,本发明不限定于上述的实施方式,在能够达成本发明的目的的范围内的变更、改良等包括在本发明中。
例如,发光层不限于2层,可以层叠有超过2个的多个发光层。在有机EL元件具有超过2个的多个发光层的情况下,只要至少2个发光层满足在上述实施方式中说明过的条件即可。例如,其他发光层可以为荧光发光型的发光层,也可以为利用了基于从三重激发态直接向基态的电子跃迁的发光的磷光发光型的发光层。
另外,有机EL元件具有多个发光层的情况下,可以是这些发光层相互相邻地设置,也可以是隔着中间层层叠多个发光单元而成的所谓串联型的有机EL元件。
另外,例如可以在发光层的阳极侧以及阴极侧的至少一侧相邻地设置阻挡层。阻挡层优选与发光层相接地配置,阻止空穴、电子以及激子中的至少任一种。
例如在发光层的阴极侧相接地配置有阻挡层的情况下,该阻挡层传输电子,并且阻止空穴到达比该阻挡层更靠阴极侧的层(例如电子传输层)。有机EL元件在包含电子传输层的情况下,优选在发光层与电子传输层之间包含该阻挡层。
另外,在发光层的阳极侧相接地配置有阻挡层的情况下,该阻挡层传输空穴,并且阻止电子到达比该阻挡层更靠阳极侧的层(例如空穴传输层)。有机EL元件在包含空穴传输层的情况下,优选在发光层与空穴传输层之间包含该阻挡层。
另外,为了激发能量不从发光层漏出至其周边层,可以将阻挡层与发光层相邻地设置。阻止在发光层中生成的激子向比该阻挡层更靠电极侧的层(例如电子传输层和空穴传输层等)移动。
优选发光层与阻挡层接合。
此外,本发明的实施中的具体结构以及形状等在能够达成本发明的目的的范围内可以设为其他结构等。
实施例
以下,举出实施例对本发明进行进一步的详细说明。本发明不受这些实施例的任何限定。
<化合物>
以下示出实施例1~8以及实施例2-1~2-3涉及的有机EL元件的制造中所使用的作为第一主体材料的化合物的结构。
【化学式249】
以下示出实施例1~8以及实施例2-1~2-3涉及的有机EL元件的制造中所使用的作为第一有机材料的化合物的结构。
【化学式250】
【化学式251】
【化学式252】
【化学式253】
以下示出实施例1~8以及实施例2-1~2-3涉及的有机EL元件的制造中所使用的作为第二主体材料的化合物的结构。
【化学式254】
【化学式255】
以下示出实施例1~8、参考例1~2、比较例1~2、实施例2-1~2-3以及比较例2-1~2-3涉及的有机EL元件的制造中所使用的其他化合物的结构。
【化学式256】
【化学式257】
【化学式258】
【化学式259】
【化学式260】
<有机EL元件的制作1>
如下制作、评价有机EL元件。
(实施例1)
将25mm×75mm×1.1mm厚的带有ITO(Indium Tin Oxide,铟锡氧化物)透明电极(阳极)的玻璃基板(Geomatec株式会社制)在异丙醇中进行超声波清洗5分钟后,进行UV臭氧清洗30分钟。ITO透明电极的膜厚设为130nm。
将清洗后的带有透明电极线的玻璃基板安装于真空蒸镀装置的基板架,首先在形成有透明电极线的一侧的面上以覆盖透明电极的方式蒸镀化合物HA1,形成了膜厚10nm的空穴注入层(HI)。
继空穴注入层的形成之后蒸镀化合物HT1,形成了膜厚80nm的第一空穴传输层(HT)。
继第一空穴传输层的形成之后蒸镀化合物BH2-7,形成了膜厚5nm的第二空穴传输层(也称为电子阻挡层)(EBL)。
在第二空穴传输层上共蒸镀化合物BH1-1(第一主体材料(BH))、化合物BH2-1(第一有机材料(BH))和化合物BD1(第一掺杂剂材料(BD)),形成了膜厚5nm的第一发光层。将第一发光层中的化合物BH1-1的浓度设为75质量%,将化合物BH2-1的浓度设为23质量%,将化合物BD1的浓度设为2质量%。
在第一发光层上共蒸镀化合物BH3-1(第二主体材料(BH))和化合物BD1(第二掺杂剂材料(BD)),形成了膜厚20nm的第二发光层。将第二发光层中的化合物BH3-1的浓度设为98质量%,将化合物BD1的浓度设为2质量%。
在第二发光层上蒸镀化合物ET1,形成了膜厚3nm的第1电子传输层(也称为空穴阻挡层)(HBL)。
在第1电子传输层上蒸镀化合物ET2,形成了膜厚20nm的第2电子传输层(ET)。
在第2电子传输层上蒸镀LiF而形成了膜厚1nm的电子注入层。
在电子注入层上蒸镀金属Al而形成了膜厚80nm的阴极。
实施例1的元件构成若简略示出,则如下所示。
ITO(130)/HA1(10)/HT1(80)/BH2-7(5)/BH1-1:BH2-1:BD1(5,75%:23%:2%)/BH3-1:BD1(20,98%:2%)/ET1(3)/ET2(20)/LiF(1)/A1(80)
需要说明的是,括弧内的数字表示膜厚(单位:nm)。
同样地在括弧内,以百分比显示的数字(75%:23%:2%)表示第一发光层中的第一主体材料(化合物BH1-1)、第一有机材料(化合物BH2-1)和第一掺杂剂材料(化合物BD1)的比例(质量%),以百分比显示的数字(98%:2%)表示第二发光层中的第二主体材料(化合物BH3-1)和第二掺杂剂材料(化合物BD1)的比例(质量%)。以下设为同样的标记。
(实施例2~4)
实施例2~4涉及的有机EL元件除了分别将第一发光层中的第一有机材料变更为表1记载的化合物以外,与实施例1涉及的有机EL元件同样地进行制作。
(参考例1)
参考例1涉及的有机EL元件除了第一发光层的形成中不使用第一有机材料、使用第一主体材料和第一掺杂剂材料形成第一发光层以外,与实施例1涉及的有机EL元件同样地进行制作。在参考例1中,第一发光层中的化合物BH1-1的浓度设为98质量%,化合物BD1的浓度设为2质量%。
(比较例1)
比较例1涉及的有机EL元件除了将第一主体材料变更为表1所示的化合物而形成了膜厚25nm的第一发光层、不形成第二发光层而在第一发光层上形成第一电子传输层以外,与参考例1涉及的有机EL元件同样地进行制作。
<有机EL元件的评价>
对于实施例1~8、参考例1~2、比较例1~2、实施例2-1~2-3以及比较例2-1~2-3中所制作的有机EL元件,进行了以下的评价。评价结果示于表1、表2或表3。
·外部量子效率EQE
对于对元件施加电压使得电流密度达到10mA/cm
表1中示出通过将实施例1~4、参考例1和比较例1各自的有机EL元件的EQE除以比较例1的有机EL元件的EQE而计算的相对值。
表2中示出通过将实施例5~8、参考例2和比较例2各自的有机EL元件的EQE除以比较例2的有机EL元件的EQE而计算的相对值。
表3中示出外部量子效率EQE的测量值。
·CIE1931色度
对于对元件施加电压使得电流密度达到10mA/cm
表1中的ΔCIEy是将实施例1、2、3、4、参考例1或比较例1的有机EL元件的CIEy除以比较例1的有机EL元件的CIEy而算出的值。
表2中的ΔCIEy是将实施例5、6、7、8、参考例2或比较例2的有机EL元件的CIEy除以比较例2的有机EL元件的CIEy而算出的值。
·驱动电压
对于在阳极与阴极之间通电使得电流密度达到10mA/cm
【表1】
实施例1~4涉及的有机EL元件具备满足上述数学式(数学式1)、(数学式2)、(数学式3)、(数学式5)和(数学式6)的关系的第一发光层和第二发光层。根据实施例1~4涉及的有机EL元件,相比于比较例1和参考例1涉及的有机EL元件,抑制了色度的下降,并且元件性能提高。
(实施例5)
实施例5涉及的有机EL元件除了将第一发光层中的第一主体材料和第一有机材料、以及第二发光层的第二主体材料变更为表2记载的化合物以外,与实施例1涉及的有机EL元件同样地进行制作。
(实施例6~8)
实施例6~8涉及的有机EL元件除了分别将第一发光层中的第一有机材料变更为表2记载的化合物以外,与实施例5涉及的有机EL元件同样地进行制作。
(参考例2)
参考例2涉及的有机EL元件除了第一发光层的形成中不使用第一有机材料、使用第一主体材料和第一掺杂剂材料形成第一发光层以外,与实施例5涉及的有机EL元件同样地进行制作。在参考例2中,第一发光层中的化合物BH1-2的浓度设为98质量%,化合物BD1的浓度设为2质量%。
(比较例2)
比较例2涉及的有机EL元件除了将第一主体材料变更为表2所示的化合物而形成膜厚25nm的第一发光层、不形成第二发光层而在第一发光层上形成第一电子传输层以外,与参考例2涉及的有机EL元件同样地进行制作。
【表2】
实施例5~8涉及的有机EL元件具备满足上述数学式(数学式1)、(数学式2)、(数学式3)、(数学式5)和(数学式6)的关系的第一发光层和第二发光层。根据实施例5~8涉及的有机EL元件,相比于比较例2和参考例2涉及的有机EL元件,抑制了色度的下降,并且元件性能提高。
<有机EL元件的制作2>
如下制作、评价有机EL元件。
(实施例2-1)
将25mm×75mm×1.1mm厚的带有ITO(Indium Tin Oxide)透明电极(阳极)的玻璃基板(Geomatec株式会社制)在异丙醇中进行超声波清洗5分钟后,进行UV臭氧清洗30分钟。ITO透明电极的膜厚设为130nm。
将清洗后的带有透明电极线的玻璃基板安装于真空蒸镀装置的基板架,首先在形成有透明电极线的一侧的面上以覆盖透明电极的方式共蒸镀化合物HT2和化合物HA2,形成了膜厚10nm的空穴注入层(HI)。该空穴注入层中的化合物HT2的比例设为90质量%,化合物HA2的比例设为10质量%。
继空穴注入层的形成之后蒸镀化合物HT2(空穴传输区域材料),形成了膜厚90nm的作为第一有机层的空穴传输层(HT)。
在空穴传输层上共蒸镀化合物BH1-2(第一主体材料(BH))、化合物HT3(第一有机材料)和化合物BD2(第一掺杂剂材料(BD)),形成了膜厚5nm的第一发光层。第一发光层中的化合物BH1-2的浓度设为92质量%,化合物HT3的浓度设为6质量%,化合物BD2的浓度设为2质量%。
在第一发光层上共蒸镀化合物BH3-3(第二主体材料(BH))和化合物BD2(第二掺杂剂材料(BD)),形成了膜厚15nm的第二发光层。第二发光层中的化合物BH3-3的浓度设为98质量%,化合物BD2的浓度设为2质量%。
在第二发光层上蒸镀化合物ET3,形成了膜厚5nm的第1电子传输层(也称为空穴阻挡层)(HBL)。
在第1电子传输层(HBL)上共蒸镀化合物ET4和化合物Liq,形成了膜厚25nm的电子传输层(ET)。该电子传输层(ET)的化合物ET4的比例设为50质量%,化合物Liq的比例设为50质量%。需要说明的是,Liq为(8-羟基喹啉)锂((8-Quinolinolato)lithium)的简称。
在第2电子传输层上蒸镀Liq而形成了膜厚1nm的电子注入层。
在电子注入层上蒸镀金属Al而形成了膜厚80nm的阴极。
实施例2-1的元件构成若简略示出,则如下所示。
ITO(130)/HT2:HA2(10,90%:10%)/HT2(90)/BH1-2:HT3:BD2(5,92%:6%:2%)/BH3-3:BD2(15,98%:2%)/ET3(5)/ET4:Liq(25,50%:50%)/Liq(1)/Al(80)
需要说明的是,括弧内的数字表示膜厚(单位:nm)。
同样地在括弧内,以百分比显示的数字(90%:10%)表示空穴注入层中的化合物HT2和化合物HA2的比例(质量%),以百分比显示的数字(92%:6%:2%)表示第一发光层中的第一主体材料(化合物BH1-2)、第一有机材料(化合物HT3)和第一掺杂剂材料(化合物BD2)的比例(质量%),以百分比显示的数字(98%:2%)表示第二发光层中的第二主体材料(化合物BH3-3)和第二掺杂剂材料(化合物BD2)的比例(质量%),以百分比显示的数字(50%:50%)表示电子传输层(ET)中的化合物ET4和化合物Liq的比例(质量%)。
(实施例2-2~2-3)
实施例2-2~2-3的有机EL元件除了分别将第一发光层中的第一主体材料(化合物BH1-2)、第一有机材料(化合物HT3)和第一掺杂剂材料(化合物BD2)的比例(质量%)变更为表3所示的比例以外,与实施例2-1同样地进行制作。
(比较例2-1)
将25mm×75mm×1.1mm厚的带有ITO(Indium Tin Oxide)透明电极(阳极)的玻璃基板(Geomatec株式会社制)在异丙醇中进行超声波清洗5分钟后,进行UV臭氧清洗30分钟。ITO透明电极的膜厚设为130nm。
将清洗后的带有透明电极线的玻璃基板安装于真空蒸镀装置的基板架,首先在形成有透明电极线的一侧的面上以覆盖透明电极的方式共蒸镀化合物HT2和化合物HA2,形成了膜厚10nm的空穴注入层(HI)。该空穴注入层中的化合物HT2的比例设为90质量%,化合物HA2的比例设为10质量%。
继空穴注入层的形成之后蒸镀化合物HT2,形成了膜厚85nm的空穴传输层(第二有机层)。
继空穴传输层的形成之后蒸镀化合物HT3,形成了膜厚5nm的电子阻挡层(第一有机层)。
在电子阻挡层上共蒸镀化合物BH3-3和化合物BD2,形成了膜厚20nm的第二发光层。第二发光层中的化合物BH3-3的浓度设为98质量%,化合物BD2的浓度设为2质量%。
在第二发光层上蒸镀化合物ET3,形成了膜厚5nm的第1电子传输层(也称为空穴阻挡层)(HBL)。
在第1电子传输层(HBL)上共蒸镀化合物ET4和化合物Liq,形成了膜厚25nm的电子传输层(ET)。该电子传输层(ET)的化合物ET4的比例设为50质量%,化合物Liq的比例设为50质量%。
在第2电子传输层上蒸镀Liq而形成了膜厚1nm的电子注入层。
在电子注入层上蒸镀金属Al而形成了膜厚80nm的阴极。
比较例2-1的元件构成若简略示出,则如下所示。
ITO(130)/HT2:HA2(10,90%10%)/HT2(85)/HT3(5)/BH3-3:BD2(20,98%:2%)/ET3(5)/ET4:Liq(25,50%:50%)/Liq(1)/Al(80)
(比较例2-2)
比较例2-2的有机EL元件如表3所示除了在电子阻挡层上形成膜厚5nm的第一发光层、在第一发光层上形成膜厚15nm的第二发光层以外,与比较例2-1涉及的有机EL元件同样地进行制作。比较例2-2的有机EL元件中的第一发光层是共蒸镀化合物BH1-2和化合物BD2而形成,第一发光层中的化合物BH1-2的浓度设为98质量%,化合物BD2的浓度设为2质量%。
(比较例2-3)
比较例2-3的有机EL元件如表3所示除了继空穴注入层的形成之后蒸镀化合物HT2而形成膜厚90nm的作为第一有机层的空穴传输层(HT)、不形成电子阻挡层而在空穴传输层上形成第一发光层以外,与比较例2-2涉及的有机EL元件同样地进行制作。
【表3】
实施例2-1~2-3涉及的有机EL元件相比于比较例2-1和比较例2-3涉及的有机EL元件,以高的发光效率进行发光。而且,实施例2-1~2-3涉及的有机EL元件相较于比较例2-2涉及的有机EL元件,虽然有机层的数量少1层,但是显示了同等的元件性能。
<化合物的评价方法>(三重态能量T
将成为测定对象的化合物在EPA(二乙醚∶异戊烷∶乙醇=5∶5∶2(体积比))中溶解使得浓度达到10μmol/L,将该溶液加入石英比色池中作为测定试样。对于该测定试样,在低温(77[K])测定磷光光谱(设定纵轴为磷光发光强度、横轴为波长。),对于该磷光光谱的短波长侧的升起引切线,将基于该切线与横轴的交点的波长值λ
换算式(F1):T
对于磷光光谱的短波长侧的升起的切线如下引出。从磷光光谱的短波长侧起至光谱的极大值之中最短波长侧的极大值为止在光谱曲线上移动时,朝向长波长侧考量曲线上的各点处的切线。该切线随着曲线升起(即随着纵轴增加),斜率随之增加。在该斜率的值达到极大值的点处所引的切线(即拐点处的切线)作为对于该磷光光谱的短波长侧的升起的切线。
需要说明的是,具有光谱的最大峰强度的15%以下的峰强度的极大点不包括在上述的最短波长侧的极大值中,将在与最短波长侧的极大值最接近的、斜率的值达到极大值的点处所引的切线作为对于该磷光光谱的短波长侧的升起的切线。
磷光的测定使用株式会社日立高新技术制的F-4500型分光荧光光度计主体。
(单重态能量S
制备作为测定对象的化合物的10μmol/L甲苯溶液并加入石英比色池,在常温(300K)测定该试样的吸收光谱(设定纵轴为吸收强度、横轴为波长。)。对于该吸收光谱的长波长侧的下坠引切线,将该切线与横轴的交点的波长值λedge[nm]代入以下所示的换算式(F2)而算出单重态能量。
换算式(F2):S
作为吸收光谱测定装置,使用日立公司制的分光光度计(装置名:U3310)。
对于吸收光谱的长波长侧的下坠的切线如下引出。从吸收光谱的极大值之中的最长波长侧的极大值起在光谱曲线上向长波长方向移动时,考量曲线上的各点处的切线。该切线随着曲线下坠(即随着纵轴的值减少),斜率随之重复地先减少而后增加。将在斜率的值在最长波长侧(其中排除吸光度为0.1以下的情况)取极小值的点处所引的切线作为对于该吸收光谱的长波长侧的下坠的切线。
需要说明的是,吸光度的值为0.2以下的极大点不包括在上述最长波长侧的极大值中。
·溶液的半峰宽(HWS)
化合物的溶液的半峰宽FWHM的测定方法如下所述。(需要说明的是,在本说明书中,有时将“化合物在溶液中的半峰宽FWHM”记为HWS。)
将成为测定对象的化合物以5.0×10
通过对于所测定的荧光光谱的达到峰值波长的强度的一半强度的波长的宽度进行测量,从而算出HWS(单位:nm)。
·膜的半峰宽(HWF)
化合物的膜的半峰宽FWHM的测定方法如下所述。(需要说明的是,在本说明书中,有时将“化合物的膜的半峰宽FWHM”记为HWF。)
将20mm×10mm×1mm厚的石英基板在异丙醇中进行5分钟的超声波清洗后,进行30分钟的UV臭氧清洗。
将UV臭氧清洗后的石英基板安装于真空蒸镀装置的基板架,使用测定对象的化合物,形成了膜厚50nm的膜。如此进行,制作半峰宽测定用样品,对该半峰宽测定用样品的膜的荧光光谱进行了测定。荧光光谱测定使用了日立高新技术科学公司的分光荧光光度计F-7000型。
通过对于所测定的荧光光谱的达到峰值波长的强度的一半强度的波长的宽度进行测量,从而算出HWF(单位:nm)。
·ΔFWHM
化合物的ΔFWHM(单位:nm)是从HWF的值减去HWS的值而算出的。
·电离势Ip
化合物的电离势Ip(单位:eV)在空气中使用光电子分光装置(理研计量仪器株式会社制、“AC-3”)进行测定。具体而言,通过对材料照射光,测定此时因电荷分离而产生的电子量,由此测定了化合物的电离势。表中的Ip为电离势的简称。
·空穴迁移率和电子迁移率(空穴迁移率)
使用阻抗谱法测定空穴迁移率μ
在成为元件制作用基板的玻璃基板(25mm×75mm×0.7mm厚)上,通过溅射法形成膜厚130nm的氧化铟-氧化锡(ITO:Indium Tin Oxide)膜从而形成了阳极。在阳极上使用真空蒸镀法依次层叠膜厚5nm的由化合物A-1形成的层、膜厚10nm的由化合物A-2形成的层、膜厚200nm的由测定对象化合物形成的层(测定对象层)和膜厚80nm的Al膜(阴极)从而制作了空穴迁移率测定用的元件。
接下来,对空穴迁移率测定用的元件施加加载有100mV的交流电压的DC电压而测定了复数模量。将模量的虚部达到最大的频率设为f
空穴迁移率μ
换算式:μ
d:测定对象层的膜厚[cm]
V:电压[V]
t
(电子迁移率)
在25mm×75mm×1.1mm厚的成为元件制作用基板的玻璃基板(25mm×75mm×1.1mm厚)上,使用真空蒸镀法依次层叠膜厚80nm的Al膜(阳极)、膜厚200nm的由测定对象化合物形成的层(测定对象层)、膜厚10nm的由化合物B-1形成的层、膜厚1nm的LiF膜和膜厚80nm的Al膜(阴极),从而制作了电子迁移率测定用的元件。对于电子迁移率测定用的元件,与空穴迁移率μ
以下示出在空穴迁移率和电子迁移率的测定中所使用的化合物。
【化学式261】
(甲苯溶液的制备)
将化合物BD1以4.9×10
(荧光发光最大峰值波长(FL-peak)的测定)
使用荧光光谱测定装置(分光荧光光度计F-7000(株式会社日立高新技术科学制)),对于将化合物BD1的甲苯溶液在390nm进行激发时的荧光发光最大峰值波长进行了测定。对于化合物BD2,也与化合物BD1同样地测定了荧光发光最大峰值波长。
化合物BD1的荧光发光最大峰值波长为451nm。
化合物BD2的荧光发光最大峰值波长为455nm。
【表4】
符号说明
1…有机EL元件、2…基板、3…阳极、4...阴极、51…第一发光层、52…第二发光层、6…空穴注入层、7…空穴传输层、8…电子传输层、9…电子注入层。
