交叉协同自组装体
文献发布时间:2023-06-19 19:27:02
本申请是分案申请,其对应的母案申请的申请号是201780060902.6,申请日是2017年8月2日,发明名称为“交叉协同自组装体”。
技术领域
本申请根据35 U.S.C.§119(e)要求于2016年8月2日提交的美国临时申请号62/370,098的权益,该美国临时申请号62/370,098的全部内容通过引用合并于本文中。
联邦资助的研究
本发明是在政府的支持下在由海军研究所提供的基金1435964的资助下完成的。政府对本发明拥有一些权利。
背景技术
实际上,生物分子要通过分子间相互作用组装成层级结构。在合成生物学中,有可能合理地利用层级结构设计生物合成结构单元,所述层级结构来自于固有功能性,在分子水平控制分子间相互作用。这样的生物合成自组装结构例如在纳米技术领域中具有有用的应用。
发明内容
在一些实施方案中,本文提供了用于控制分子结构的成核和层级组装(可编程自组装)的技术(包括,例如,方法、组合物和试剂盒),所述分子结构诸如核酸(例如,DNA)和/或蛋白质纳米结构、微观结构和宏观结构。此技术在本文中称为“交叉协同组装”,其可以用来编程和迅速地组装仅来源于所提供的大分子“种子”的结构,由此可以被认为是“0背景”组装方法。通过设计单个生物分子亚单位(所述生物分子亚单位要求同时与大量的其他亚单位接合从而实现稳定的附着)上的协同结合位点,该体系对结构的自发成核施加了固有的高能垒,甚至在高浓度的各个单一成分的存在下也施加。成核作用可以仅通过提供大分子“种子”来触发,所述大分子“种子”类似于预先存在的结构界面(呈现用于稳定地俘获下一个亚单位的多个弱结合位点)。添加可以稳定地俘获单个亚单位的种子有效地绕过了对抗自发成核的活化能垒,从而驱动微尺度结构的高阶组装。多种组分可以持续地添加到所述结构,使得它们在一维、二维或三维上的生长潜在地与用于其他聚合或结晶过程的生长一样大。
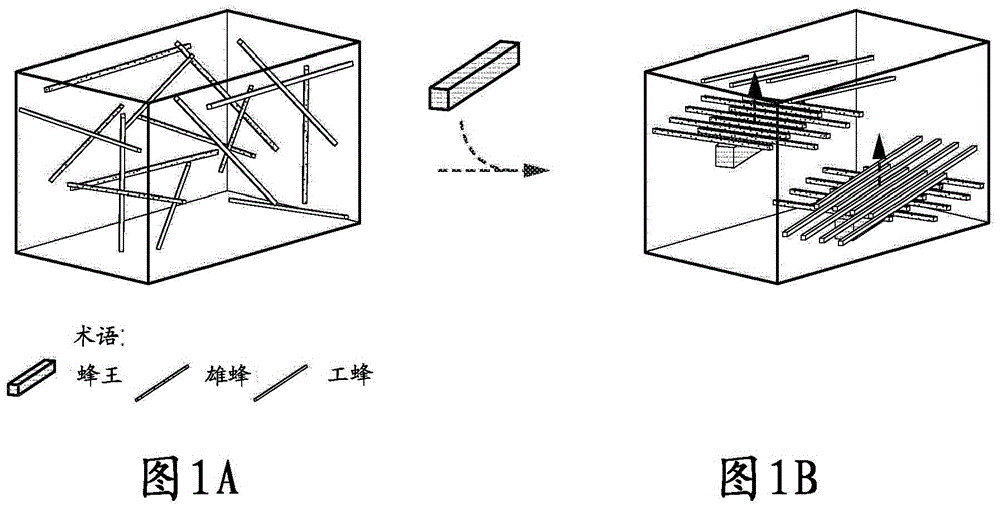
如本文所提供的交叉协同组装使用分子(例如,核酸或蛋白质)结构单元(图1A),所述结构单元被编程从而自组装成交叉层(图1B)。在一些实施方案中,结构单元可以是由可编程的核酸杂交相互作用组装而来的棒状结构。如上所示,此交叉协同组装技术使用“种子”结构,可编程的核酸自组装从所述“种子”结构开始。此种子结构通过成核结构(图1A;“蜂王”)和一个亚组的结构单元(图1A;“雄蜂”)之间的不可逆相互作用而形成,所述亚组的结构单元排列成行以沿成核结构形成初始种子层。在种子结构的存在下,向已存在的种子层(图1B)添加另一组结构单元(图1A;‘工蜂’)。足够数量的结构单元(雄蜂)和成核结构(蜂王)之间的结合形成种子可以触发许多额外的结构单元(工蜂)层的加入,每个层相对于邻近的(上面的和/或下面的)层旋转一定的度数(例如,90°)。
成核结构和结构单元被构造成基于如下的一组动力学/成核能量参数彼此相互作用(例如,结合)。初始亚组的结构单元(雄蜂)应当强力(不可逆转地/稳定地)结合并且形成沿成核结构(蜂王)的取向层。初始亚组的结构单元(雄蜂)应当彼此不相互作用(结合)。同样,后续亚组的结构单元(工蜂)应当彼此不相互作用(结合)。此外,在缺少成核结构(蜂王)的情况下,来自初始亚组的任何结构单元(雄蜂)应当与来自另一亚组的结构单元(工蜂)仅具有一种弱(可逆的)相互作用。在成核结构(蜂王)的存在下,来自初始亚组的单一结构单元(雄蜂)可以与来自后续亚组的多于一个的结构单元(工蜂)相互作用,并且来自后续亚组的单一结构单元(工蜂)可以与来自初始亚组的多于一个的结构单元(雄蜂)或另一亚组的多于一个的结构单元(另一亚组的‘工蜂’)相互作用。例如,参照图1B,单一结构单元(例如,DNA纳米棒)可以与8个其他的结构单元(例如,DNA纳米棒)结合,尽管该单一结构单元与8个结构单元中的每一个仅结合一次从而形成具有“交叉”图案的两个层。
来自初始亚组的结构单元(雄蜂)和来自后续亚组的结构单元(工蜂)之间的单一相互作用应当足够弱,使得在缺少种子结构的情况下(大量的单个工蜂将不得不同时聚拢到一起)存在对成核作用的任意大的熵惩罚。利用这些参数,可以实现零背景和最小缺陷,甚至在高浓度的相互作用的结构单元下也可以实现,由此能够使核酸纳米结构快速地成核和组装。
因此,本文提供了组合物,所述组合物包含:(a)成核的核酸纳米结构;(b)第一层平行的细长核酸纳米结构,所述第一层平行的细长核酸纳米结构稳定地结合于(a)的成核的纳米结构;和(c)第二层平行的细长核酸纳米结构,所述第二层平行的细长核酸纳米结构稳定地结合于(b)的细长纳米结构并且相对于(b)的平行的细长纳米结构成角度地旋转,其中(b)的单个细长纳米结构与(c)的多个细长纳米结构各自通过单个协同结合位点结合。在一些实施方案中,(c)的单个细长纳米结构与(b)的多个细长纳米结构各自通过单个协同结合位点结合。
本文在一些方面还提供了组合物,所述组合物包括:(a)成核的纳米结构;(b)第一亚组的细长纳米结构,其中少于10%的(b)的纳米结构彼此结合,并且其中(b)的纳米结构可逆地结合于(a)的成核纳米结构;和(c)第二亚组的细长纳米结构,其中少于10%的(c)的纳米结构彼此结合,其中在缺少成核的纳米结构的情况下,(b)的纳米结构可以仅在(a)的纳米结构上的单个位置处可逆地结合于(a)的纳米结构,并且其中,在缺少成核的纳米结构的情况下,(a)的纳米结构可以仅在(b)的纳米结构上的单个位置处可逆地结合于(b)的纳米结构。参见,例如,图1A-1B。
在一些实施方案中,本文还提供了交叉核酸纳米结构,所述交叉核酸纳米结构包括:第一纳米棒,所述第一纳米棒包括第一插头链和第二插头链;第二纳米棒,所述第二纳米棒包括第三插头链和第四插头链,其中所述第二纳米棒平行于所述第一纳米棒;第三纳米棒,所述第三纳米棒包括与所述第一插头链互补并结合的第五插头链和与所述第二插头链互补并结合的第六插头链;第四纳米棒,所述第四纳米棒包括与所述第三插头链互补并结合的第七插头链和与所述第四插头链互补并结合的第八插头链,其中所述第三纳米棒平行于所述第四纳米棒。参见,例如,图18。交叉纳米结构不限于4个纳米棒,并且在许多实施方案中,包括以如本文所述的交叉图案配置的至少4个(例如,至少5、10、15、20、25、50、100或更多个)纳米棒。
因此,在一些实施方案中,交叉核酸纳米结构包括彼此平行的第一多个纳米棒,和彼此平行的第二多个纳米棒,其中所述第一多个的纳米棒与所述第二多个的纳米棒结合并垂直(或不平行)。参见,例如,图18。
在一些实施方案中,每个纳米棒由DNA组成。例如,纳米棒可以由6-螺旋DNA束组成(参见,例如,Douglas SM1,Chou JJ,Shih WM.DNA-nanotube-induced alignment ofmembrane proteins for NMR structure determination(DNA-纳米管诱发的膜蛋白对齐用于确定NMR结构).Proc Natl Acad Sci U S A.104,6644–6648,2007,通过引用并入本文)。
在一些方面本文还提供了交叉核酸板条,所述交叉核酸板条包括:第一多个的彼此平行的至少四条核酸链,所述第一多个的每条链的长度为20-100个核苷酸(例如,20-30、20-40或20-50个核苷酸);和第二多个的彼此平行的至少四条核酸链,所述第二多个的每条链的长度为20-100个核苷酸(例如,20-30、20-40或20-50个核苷酸),其中所述第一多个的至少四条核酸链与所述第二多个的至少四条核酸链结合并垂直。参见,例如,图21A-21B。
在一些方面本文中还提供了交叉核酸板条,所述交叉核酸板条包括:第一多个的彼此平行的至少四条核酸链,所述第一多个的每条链的长度为至少21个核苷酸;和第二多个的彼此平行的至少四条核酸链,所述第二多个的每条链的长度为至少21个核苷酸,其中所述第一多个的至少四条核酸链与所述第二多个的至少四条核酸链结合并垂直。参见,例如,图21A-21B。
在一些方面,本文进一步提供了核酸纳米结构,所述核酸纳米结构包括折叠成由较短的核酸订书钉链(staple strand)固定的重复的环状形状(例如,5-15个环,或5、6、7、8、9或10个环)的核酸支架链(例如,M13或M13-衍生的),其中所述重复的环结构与至少一个(例如,至少2、3、4、5、10、20、25、30、35、40、45、50、60、70、80、90、100或更多个)交叉核酸板条结合。参见,例如,图22,24A,25和27B。
在一些方面,本文进一步又提供了核酸纳米结构,所述核酸纳米结构包括折叠成由至少两个交叉核酸板条固定的重复的环状形状的核酸支架链。参见,例如,图27B和28B。
本公开在一些方面还提供了制备交叉核酸纳米结构的方法,该方法包括:在反应混合物中混合(a)第一纳米棒,所述第一纳米棒包括第一插头链和第二插头链,(b)第二纳米棒,所述第二纳米棒包括第三插头链和第四插头链,其中所述第二纳米棒平行于所述第一纳米棒;(c)第三纳米棒,所述第三纳米棒包括与所述第一插头链互补并结合的第五插头链和与所述第二插头链互补并结合的第六插头链;和(d)第四纳米棒,所述第四纳米棒包括与所述第三插头链互补并结合的第七插头链和与所述第四插头链互补并结合的第八插头链,其中所述第三纳米棒平行于所述第四纳米棒;以及在产生交叉核酸纳米结构的组装体的条件(例如,核酸杂交条件)下孵育所述反应混合物。参见,例如,图22。
在一些方面,本文还提供了生物分子(分析物)检测方法。在一些实施方案中,一种方法,其包括(a)在反应混合物中混合:(i)包含生物分子的样品;(ii)能够自组装成包含垂直堆叠的平行链的纳米结构的核酸链;(iii)比(ii)的核酸链短的多个寡核苷酸,其中(iii)的寡核苷酸与(ii)的链结合以组装所述垂直堆叠的平行链;(iv)两个交叉核酸板条,其中所述两个板条与(ii)的链结合,并且其中每个板条与生物分子结合伴侣连接,所述生物分子结合伴侣特异性地结合样品中的生物分子;(b)在允许所述生物分子结合伴侣与生物分子结合和所述纳米结构组装成垂直堆叠的平行链的条件下孵育所述反应混合物;(c)将(iii)的多个寡核苷酸从(b)的反应混合物中移除;(d)在多个权利要求27所述的交叉核酸板条的存在下孵育(c)的反应混合物,其中所述交叉核酸板条与所述垂直堆叠的平行链结合以形成三维圆筒结构。在一些实施方案中,所述方法进一步包括对所述三维圆筒结构成像。参见,例如,图28A-28B。
在一些实施方案中,所述方法可以包括在反应混合物(例如,利用杂交缓冲液)中混合:(a)包含生物分子的样品和(b)核酸纳米结构,所述核酸纳米结构包括:(i)能够折叠成重复的环状形状(例如,2-15个垂直堆叠的环)的核酸支架链和(ii)两个交叉核酸板条,其中特异性地结合所述生物分子的生物分子结合伴侣(例如,抗体)与每个所述交叉核酸板条连接,使得在所述相关生物分子的存在下,所述生物分子结合伴侣与所述生物分子结合,并且所述核酸纳米结构折叠成重复的环状形状。参见,例如,图28A-28B。
在一些实施方案中,所述方法进一步包括将所述反应混合物与多个(例如,2-50个或2-100个)交叉核酸板条混合以形成三维圆筒样结构。参见,例如,图24B。
应当理解的是如本文所述的核酸纳米结构(例如,纳米棒、板条、圆筒,等等)及其变体,如本文所提供的,可以例如使用下列的公共可获得的工具来设计,所述工具由Douglas SM,Marblestone AH,Teerapittayanon S,Vazquez A,Church GM,Shih WM.Rapidprototyping of 3D DNA-origami shapes with caDNAno(利用caDNAno对3D DNA-折纸形状进行快速原型制造).Nucleic Acids Res.37,5001–5006,2009(通过引用并入本文)所述。还参见,Douglas等人,Nature,459(7245):414-418,2009,该文通过引用并入本文。例如,并且如本文其他地方所述,在本领域中已知可以使用长“支架”链作为模板将几百条寡核苷酸“订书钉”链的组装体形成为交联螺旋的平面逆平行阵列来产生定制形状(例如,兆道尔顿尺度)DNA纳米结构。这种“支架DNA折纸术”方法也已经被适应性地改动以产生成形为被约束成蜂窝晶格的双螺旋的折叠层的3D形状。caDNAno(一种具有图形用户界面的开源软件包)可以用来辅助设计用于折叠3D DNA(或其他核酸)纳米结构的DNA序列。caDNAno软件与实例设计和证明其构造的视频辅导材料可获自cadnano.org。
附图说明
图1A-1B示出了交叉协同组装体系统的实例的抽象形式。图1A显示没有成核位点且无自组装体的系统。图1B显示了在添加成核位点后的系统和触发的自发自组装体。生长方向由灰色箭头指示,且在此实例中显示了一维(1D)生长。各个成分被称为“蜂王(queen)”、“雄蜂(drone)”和“工蜂(worker)”。
图2示出了描绘成核位点(蜂王)结构通过降低组装体的活化能而引发具有雄蜂和工蜂的高级结构的原理的图。
图3A-3C示出了DNA-折纸交叉组装体的实例。图3A示出了蜂王(Q)和雄蜂/工蜂(D/W)架构,所述架构以横截面(从cadnano.org下载的caDNAno软件)和以3D图形表示的方式显示。每个单一圆柱体表示双链DNA螺旋。图3B是利用DNA-折纸协同组装体的1D和2D生长的图形表示。3D生长可以通过建立合并1D和2D生长的设计来实现。图3C示出了用于2D生长的不同路径。
图4示出了单链DNA交叉协同组装体的实例。包括所述系统(显示为圆柱体)的工蜂和雄蜂的寡核苷酸通过添加具有成核位点的立方体DNA-折纸蜂王结构而成核。在图示的放大部分中显示逐步组装。
图5示出了可用于超灵敏检测的索烃交叉协同组装体蜂王(索烃蜂王)的实例。包括该系统(显示为圆柱体)的工蜂和雄蜂的寡核苷酸通过添加具有成核位点的单链索烃蜂王结构而成核。显示为图示放大部分的左侧的结构上的结合位点指示工蜂/雄蜂的成核。每个主体环圈具有多个结合位点,共同地作为协同结合位点起作用。
图6示出了来自图5的索烃蜂王,该索烃蜂王已经被修改以充当生物传感器。大的DNA环已经被分开以加入生物分子俘获位点以结合生物样品中的生物分子(例如,大分子)。在一些实施方案中,生物分子的存在可以如下述在混合物中检测到:(1)生物样品与高浓度的索烃蜂王混合,感兴趣的生物分子与生物分子俘获位点结合。(2)使用化学反应来可逆地裂解所述生物分子俘获位点。(3)不与靶生物分子结合的索烃蜂王与被靶生物分子聚拢在一起的那些索烃蜂王相比更快地分解。(4)在测试混合物中剩余的索烃蜂王在所述生物分子俘获位点处重新连接在一起。(5)将雄蜂和工蜂加入至测试混合物中,以使用可容易观察到的微米尺度的DNA结构来扩增剩余的蜂王。此系统是模块化的,因为生物分子俘获位点可以被定制以结合疾病标志物,包括蛋白或核酸序列。
图7示出了6螺旋束工蜂和6螺旋雄蜂与蜂王之间的碱基配对连接的实例的CAD示意图。也可以使用插头插座连接设计,如图18-20中所示。使用下列的CAD工具来设计所述结构:Douglas SM,Marblestone AH,Teerapittayanon S,Vazquez A,Church GM,ShihWM.Rapid prototyping of 3D DNA-origami shapes with caDNAno(利用caDNAno对3DDNA-折纸形状进行快速原型制造).Nucleic Acids Res.37,5001–5006,2009。
图8A-8D是描绘不同的示例性“种子”设计(与成核的纳米结构结合的6-螺旋束纳米棒)的示意图,所述“种子”设计具有不同的协同结合位点构造。另外的示例性“种子”设计显示在图16A-16C中。
图9A-9B示出了利用在不同的温度(A:65-60℃;B:60-55℃;C:65-55℃;D:60-50℃)在6mM的MgCl
图10A-10B利用在不同的温度(A:70-60℃;B:65-55℃;C:65-60℃;D:60-55℃)在6mM的MgCl
图11示出了描绘示例性种子结构(蜂王+雄蜂)的组装体的示意图。还显示了该结构的图像。纳米结构组装还可以如图19A-19D中所示进行。
图12A-12G示出了由单链DNA和另外的纳米结构(雄蜂)的组装体形成的种子结构。
图13A-13B示出了利用单链成核的纳米结构(蜂王)在不同温度和梯度下的跷跷板实验获得的结果。
图14A-14C示出了证明在成核的纳米结构(蜂王)的存在下而不是在缺少成核的纳米结构的情况下纳米结构(工蜂)组装的结果。
图15A-15B示出了在缺少成核的纳米结构(蜂王)的情况下不组装的纳米结构实例的结果。
图16A示出了格状蜂王的二维视图,所述格状蜂王可以在跨越所述蜂王的水平面(在图16B中的坐标χ)上同时结合16个雄蜂。显示了将支架折叠成蜂王所需要的订书钉,且订书钉的3’末端可以添加用来结合雄蜂的伸出的单链序列。三维视图(图16B)示出了在每个雄蜂-对接格中具有结合位点的蜂王。蜂王的透射电镜(TEM)图像显示在图16C中。所述结构的横向尺寸大约为72nm x 240nm。
图17A-17B描绘了雄蜂和工蜂亚组件。图17A示出了雄蜂和工蜂亚组件,所述亚组件由6-螺旋束支架DNA折纸构造以形成长度上可定制的棒。订书钉的3’末端含有伸出的单链DNA序列,所述伸出的单链DNA序列充当插头结合柄从而与其他组件相互作用。类似地,最下方的螺旋含有插座序列(即,没有被折叠订书钉互补的单链DNA支架),所述插座序列接受来自其他组件的插头序列。插头和插座各自是周期性的,并且可以例如沿组件的长度每42bp(~14nm)定位。图17B示出了由两个不同的支架序列折叠成的测试雄蜂的TEM图像。上部图像中的雄蜂长度为~250nm,相比而言,下部图像中的雄蜂的长度为~440nm。
图18示出了插头-插座结合系统的详细视图。在上图面中显示的例子显示了从在6-螺旋束雄蜂中具有匹配的插座位点的蜂王(小箭头)延伸出来的一整组5个单链插头序列。在下面的图面中,结合序列画作一系列“X”以表示插头和插座的长度和序列两者可以发生变化。支架序列以黑色绘制。要注意的是该设计(显示用于雄蜂-蜂王组装)还可以用来使雄蜂与工蜂结合。格状蜂王序列从上至下对应于SEQ ID NO:685和SEQ ID NO:686。6螺旋束(hb)雄蜂序列从左至右对应于SEQ ID NO:687和SEQ ID NO:688。
图19A-19D示出了插头-插座结合系统可以如何用来编程雄蜂以结合至蜂王上的所需位点。图19A示出了放置在中间两个蜂王格中的两个440nm雄蜂,图19B示出了放置在中间蜂王格中的一个250nm雄蜂,图19C示出了位于蜂王的每个格中的250nm雄蜂。所需的设计显示于左侧,相比组装结构的TEM图像显示于右侧。图19D示出了使用琼脂糖凝胶电泳对来自图19A的设计的总分析,一个设计使用7bp插头-插座,另一个具有10bp插头-插座。
图20示出了当蜂王结合于单个440nm雄蜂时游离蜂王的剩余程度随时间的变化。
图21A-21B示出了基于交叉DNA板条的架构的实例。图21A是交叉DNA板条基序(右)的抽象形式。浅色链和深色链交织并且在每个接头处彼此互补。每个结合位点的长度显示在右侧。每行和每列总计21个碱基对(bp)。矩阵显示了在抽象形式和3D渲染的每个位置处每个结合位点的碱基对(bp)数目。图21B是DNA板条的3D渲染。在左边,自上向下视图示出了每条链的交织。在右边显示了横截面(A-A)。
图22示出了DNA板条组装的步骤。步骤1示出了任意DNA-折纸蜂王(显示作为实例的圆筒蜂王)的DNA-折纸折叠。步骤2是粗DNA-折纸蜂王反应物(来自步骤1)与DNA板条在各种盐浓度、温度和DNA板条浓度下的混合。
图23A示出了不添加任何DNA板条的扁平DNA-折纸蜂王。图23B示出了通过用DNA板条覆盖蜂王的ssDNA支架,添加了DNA板条的扁平DNA-折纸蜂王以及片层的正确形成。DNA板条覆盖区以浅灰色指示。图像上的比例尺为600nm,在放大视图上为100nm。
图24A示出了不添加任何DNA板条的圆筒DNA-折纸蜂王。图像上的比例尺为400nm,放大视图上的比例尺为100nm。图24B示出了通过用DNA板条覆盖蜂王的ssDNA支架,添加了DNA板条的圆筒DNA-折纸蜂王以及圆筒的正确形成。比例尺为50nm。DNA板条覆盖区以浅灰色指示。
图25描绘了在蜂王结构上接种的DNA板条的生长机制。DNA-折纸蜂王与DNA板条混合从而覆盖蜂王的ssDNA支架,然后后者延伸并聚合仅仅穿过DNA板条(在相同的平面内,DNA板条可以通过邻近板条的核苷酸碱基配对首尾连接)的微米级结构的生长。上面的设计显示了扁平DNA-折纸蜂王,其中三个线性片层在水平方向上生长。下面的设计显示了圆筒DNA-折纸蜂王,其中在垂直方向上管状生长。
图26A-26E示出了与扁平DNA-折纸蜂王结合的第一代DNA板条的三个延伸体。图26A示出了用短的第二代DNA板条覆盖的第一代延伸体,在蜂王上产生了三个齿状的延伸体。图26B示出了用长的第二代DNA板条覆盖的第一代延伸体,其尾部用短的第三代DNA板条覆盖。图26C-26E示出了第一代、第二代和第三代DNA板条,它们彼此互补,产生线性片层结构的延伸体。图26C含有一个延伸的第一代,图26D含有两个延伸的第一代,图26E含有三个延伸的第一代。图26A-26C的比例尺为100nm,图26D-26E的比例尺为200nm。
图27A-27E示出了在一锅反应中利用DNA板条形成多主体环圈索烃系统。(图27A)8个环的形成,其中M13支架穿过订书钉链。订书钉(“褐色”)链折叠稳定的DNA-折纸碱基并且DNA板条连接所述8个环。(图27B)圆筒蜂王的3D视图,所述圆筒蜂王额外地充当多主体环圈索烃系统,该系统典型地对DNA-折纸具有高产率。(图27C)DNA板条的抽象形式和3D视图,所述DNA板条交织穿过圆筒蜂王上的ssDNA M13支架环。通过一侧的连接,单个DNA板条连接所有8个环。(图27D)DNA板条的3D渲染,所述DNA板条交织并且连接8个单独的ssDNA环。顶部显示了倾斜的仰视图,底部是侧视图。(图27E)以低产率实现最多4主体环圈索烃系统的先前技术。
图28A-28B示出了用于超灵敏检测的圆筒蜂王。图28A示出了存在的生物分子连接到将8个环聚拢在一起的DNA板条(黑色)。在没有生物分子的情况下,蜂王分开并且不能发生生长,甚至在溶液中存在DNA板条的情况下也如此。图28B示出了存在于反应物中的生物分子将DNA板条(黑色)聚拢在一起并且为管状结构提供了ssDNA的支架紧密接近,从而成核和生长。
图29示出了每个板条具有6个结合位点的蜂王的示意图(上面的图面)以及该蜂王的透射电镜(TEM)图像(下面的图面)。
图30A-30B示出了将错列的DNA板条带成核的扁平DNA-折纸蜂王。图30A描绘了不具有图23A中所示的底部右边的片层的扁平DNA-折纸蜂王。图30B是解释DNA板条(在对角线方向上移动)如何在扁平蜂王上的ssDNA支架上组装的示意图。
图31示出了在DNA-折纸圆筒蜂王上生物分子传感和校验机制的实例。顶部:存在的生物分子。(1)生物分子与抗体桥键结合。(2)中灰色链经由立足点介导的链置换被置换。(3)浅灰色链与深灰色链(密封桥键)结合。底部:不存在生物分子。(1)没有生物分子与抗体桥键结合。(2)中灰色链经由立足点介导的链置换被置换,导致没有一个桥键是完整的,并且随后圆筒蜂王分开(显示于图28A中)。
具体实施方式
自然界实现了细胞骨架微丝诸如肌动蛋白和微管的快速、成核限制的生长。这通过将每个额外的亚单位通过弱相互作用固定于在微丝的生长末端的2-3个已经附着的亚单位来实现。这意味着如果任何两个单体在溶液中彼此结合,它们将快速地(例如,在几毫秒内)彼此解离,因为单一的相互作为很弱。这仅在4个亚单位同时聚在一起之后(这是很少见的事件),才会形成稳定的核。因此,未经触发的自发成核作用很少见。相反,可以通过提供大分子“种子”来触发成核作用,所述“种子”模拟完全形成的微丝末端。
对于可编程自组装体,快速、成核限制的生长是非常有用的特征,然而天然微丝诸如肌动蛋白或微管的技术改造现在具有许多缺点:(1)对如何调整亚单位之间的相互作用强度的理解有限;(2)协同的水平相当低(在结合时的弱相互作用仅延续2-3个亚单位),因此对自发成核的抑制不如其可能具有的那样强;以及(3)生长限为一维(微丝形成)。
如本文所提供的快速、可逆、零背景、触发的成核和生长可以在纳米技术和生物技术(诸如超灵敏检测和用于小型化材料的模板)中具有有用的应用。
交叉协同组装
如本文所提供的交叉协同组装技术基于这样的概念:所述概念可以应用于许多自组装分子,包括核酸和蛋白质。然而,为了简便和便于理解,本文提到时主要是指在核酸的情况下的交叉协同组装,所述核酸诸如脱氧核糖核酸(DNA)。交叉协同组装系统使用三个基本组件:成核的纳米结构、被编程以结合所述成核的纳米结构的初始(第一)亚组的纳米结构,和被编程以结合所述初始的纳米结构的另一(第二)亚组的纳米结构。在图1A-1B中提供了交叉协同组装的实例,其中成核的结构被称作“蜂王”,第一亚组的纳米结构被称作“雄蜂”,第二(和任意后续)亚组的纳米结构被称作“工蜂”。在此实例中,最后的结构包括多层对齐的分子棒,其中每层相对于下面和上面的层旋转一定程度(例如,90度)。例如,一层可以垂直于另一邻接(紧邻的上方或下方)层。在一些实施方案中,一层相对于邻接的层旋转20、30、40、50、60、70、80或90度(例如,沿雄蜂和/或工蜂纳米棒的长度测量)。邻接层上棒之间的每个交点增加少量结合能;任何给定的棒与下方和上方的大量棒相交,且净结合能可以被调整(例如,通过调整结合界面的设计,例如,碱基对的数目,或通过调节亚单位浓度、温度或盐浓度)为足够大以根据需要实现稳定的(不可逆)或稍有利的(可逆的)附着。在组装启动前,在溶液中两个棒之间的任何自发的交叉是短暂的,因为由于仅有一次相互作用,净能量是非常低的。因此,棒可以稳定地(或者另外稍有利地(可逆地))加入至已有的交叉结构(可以立即实现许多附着点),但在缺少已有交叉结构的情况下结构不会自发的组装。除非向溶液中加入已有交叉结构的结构模拟物(种子),否则不应当有生长存在。
交叉协同组装系统的示例性试验方案如下:(1)使用DNA CAD工具设计组成性结构单元(蜂王、雄蜂和工蜂)。参见,例如,Douglas SM,Marblestone AH,Teerapittayanon S,Vazquez A,Church GM,Shih WM.Rapid prototyping of 3D DNA-origami shapes withcaDNAno(利用caDNAno对3D DNA-折纸形状进行快速原型制造).Nucleic Acids Res.37,5001–5006,2009,该文的全部内容通过引用并入本文。
蜂王上的协同结合位点序列和位点数目被定制以根据需要调节成核作用的活化能。(2)使用DNA合成和DNA折纸术中的技术构建和纯化组成性结构单元和(3)将雄蜂和工蜂混合在溶液中,并加入蜂王以引发高次DNA结构的生长。
纳米结构通过协同结合位点彼此结合。“协同结合位点”是两个纳米结构相互作用(杂交/结合)的位置。例如,成核的纳米结构可以利用多个核苷酸碱基序列进行编程,每个核苷酸碱基序列与初始亚组的纳米结构中的一个纳米结构的核苷酸碱基序列互补。协同结合位点可以包括插头和插座位点,所述插头和插座位点包括插头链和插座链。插头链是附着于核酸纳米结构诸如纳米棒的核酸链(单链核酸)。插头链包含与相关插座链内的核苷酸序列互补(且结合)的核苷酸序列。因此,一对插头链和插座链包括彼此互补使得插头链和插座链彼此结合(杂交)从而将例如雄蜂与蜂王或工蜂与雄蜂锚定的核苷酸序列(参见,例如,图17B)。在一些实施方案中,蜂王包括多条插头链,所述插头链指引和锚定包括多个互补的(相关的)插座链的雄蜂。同样,雄蜂可以包括多条插头链,所述插头链指引和锚定包括多条互补的插座链的工蜂。
协同结合位点,例如,插头链和插座链,也可以以相似的方式用来将核酸(例如,DNA)板条组装到另一核酸支架结构上。例如,如图22中所示,DNA板条可以附接到核酸支架(蜂王)从而固定支架结构的二维或三维形状。在图22中所示的实例中,DNA板条用来固定(聚拢在一起)较大的支架纳米结构的圆筒形状。这些板条沿支架通过协同结合位点的“生长”产生了圆筒样形状,所述圆筒样形状例如可以通过显微镜显现。
协同结合位点(例如,插头和插座序列)在成核的纳米结构上以促进初始(例如,支架)纳米结构的结合和对齐的空间构型进行排列。协同结合位点的长度可以部分地根据具有互补位点的两个分子之间的预期相互作用的所需强度(强或弱)而变化。在一些实施方案中,协同结合位点具有5-50个核苷酸的长度。例如,协同结合位点可以具有5-40、5-30、5-20、5-10、5-15、10-50、10-40、10-30、10-20、30-50、30-40、或40-50个核苷酸的长度。在一些实施方案中,协同结合位点具有5、10、15、20、25、30、35、40、45或50个核苷酸的长度。单个插头链和/或插座链可以具有例如5-20(例如,5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20)个核苷酸的长度。
纳米结构上协同结合位点的数目也可以变化。在一些实施方案中,纳米结构上协同结合位点的数目为3-1000个。例如,纳米结构上协同结合位点的数目可以为3-900、3-800、3-700、3-600、3-500、3-400、3-300、3-200或3-100个。在一些实施方案中,纳米结构上协同结合位点的数目为3-10、3-15、3-20、3-25、3-30、3-35、3-40、3-45或3-50个。在一些实施方案中,纳米结构上协同结合位点的数目为3-15、3-20、3-25、3-30、3-35、3-40、3-45或3-50个。在一些实施方案中,纳米结构上协同结合位点的数目为3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100个。
协同结合位点之间的距离也可以变化。在一些实施方案中,在同一纳米结构上两个协同结合位点之间的距离为20-1000埃。例如,纳米结构上两个协同结合位点之间的距离可以为20-900、20-800、20-700、20-600、20-500、20-400、20-300、20-200、20-100、50-1000、50-900、50-800、50-700、50-600、50-500、50-400、50-300、50-200或50-100埃。在一些实施方案中,纳米结构上两个协同结合位点之间的距离为20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、250、300、350、400、450或500埃。
在一些实施方案中,协同结合位点之间的距离,例如,插头链之间(和/或插座链之间)的距离可以是5-100个核苷酸(或核苷酸碱基对(bp))。在一些实施方案中,插头链之间(和/或插座链之间)的距离为5-20、5-25、5-50或5-100个核苷酸。在一些实施方案中,插头链之间(和/或插座链之间)的距离为5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100个核苷酸。在一些实施方案中,插头链之间(和/或插座链之间)的距离为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21个核苷酸。在一些实施方案中,插头链之间(和/或插座链之间)的距离为42+/-21个核苷酸。例如,插头链之间(和/或插座链之间)的距离可以是21、42或63个核苷酸。在一些实施方案中,插头链之间(和/或插座链之间)的距离为42个核苷酸。
一个核苷酸单位的大小为0.33nm。因此,在一些实施方案中,协同结合位点之间的距离,例如,插头链之间(和/或插座链之间)的距离可以是5-35纳米(nm)。在一些实施方案中,插头链之间(和/或插座链之间)的距离为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34或35nm。在一些实施方案中,插头链之间(和/或插座链之间)的距离为14+/-7nm。例如,插头链之间(和/或插座链之间)的距离可以为7、14或21nm。在一些实施方案中,插头链之间(和/或插座链之间)的距离为14个核苷酸。
在一些实施方案中,纳米结构上两个协同结合位点之间的距离是等间隔的,而在其他实施方案中,所述距离可以变化。例如,第一协同结合位点和第二协同结合位点之间的距离可以是30埃,而第二协同结合位点和第三协同结合位点之间的距离可以是30埃、40埃或50埃。
如果两个或更多个纳米结构相对于彼此在相同的方向上定位,则它们被认为是“对齐的”。例如,纳米结构的5'端(或3'端)可以沿其y轴朝向相同的方向。图3B中所示的结构的顶层显示了与成核的纳米结构结合的对齐的纳米棒。在此实例中,纳米棒与成核的纳米结构垂直。
需要成核的纳米结构来引发第一(初始)和第二(以及,由此,后续的,例如,第三、第四、第五等)亚组的纳米结构的组装,以及需要第一亚组中的纳米结构与成核的结构的结合来引发第二亚组的纳米结构的组装。“成核的纳米结构”是利用结合位点编程的任意纳米结构,所述结合位点与初始亚组的雄蜂纳米结构的每个成员上的结合位点强烈地(不可逆地)相互作用,并且将它们对齐用于招募后续亚组的工蜂纳米结构。即,成核的纳米结构和初始亚组的纳米结构之间的结合位点应当足够强使得初始纳米结构结合于成核的纳米结构并沿所述成核的纳米结构对齐,并且不会在反应条件(例如,等温、生理条件)下从成核的纳米结构解离。例如,成核的纳米结构可以具有二维或三维形状。
其他亚组的纳米结构可以加入至交叉协同组装系统中,从而使最终结构(例如,纳米结构、微观结构或宏观结构)的生长扩散。例如,可以加入第三、第四和第五亚组的纳米结构。需要第二亚组与第一亚组的纳米结构的结合来引发第三亚组的纳米结构的组装;需要第三亚组和第二亚组的纳米结构的结合来引发第四亚组的纳米结构的组装;依此类推。用户确定的最终结构可以以一维、二维(参见,例如,图3B)或三维的方式来组装。
每个亚组的纳米结构(例如,纳米棒)应当遵循一组特定的结合能参数。更具体地,初始亚组的纳米结构(例如,纳米棒)应当强力地(不可逆地)结合并且沿成核的纳米结构形成对齐的一层(其中每个纳米结构相对于彼此在同一方向上定向)。初始亚组的纳米结构(例如,纳米棒)应当彼此不相互作用(结合)。同样地,后续亚组的纳米结构(例如,纳米棒)不应当彼此相互作用(结合)。此外,在缺少成核结构的情况下,来自初始亚组的任何纳米结构(例如,纳米棒)应当与来自后续亚组的任何其他纳米结构(例如,纳米棒)仅具有一次弱的(可逆的)相互作用。在成核结构的存在下,来自初始亚组的单一纳米结构(例如,纳米棒)可以与来自后续亚组的超过一个纳米结构(例如,纳米棒)相互作用,并且来自后续亚组的单一纳米结构(例如,纳米棒)可以与来自初始亚组的超过一个纳米结构(例如,纳米棒)相互作用。例如,参照图1B,单一纳米结构(例如,纳米棒)可以结合8个其他纳米结构(例如,纳米棒),尽管所述单一纳米结构(例如,纳米棒)与8个纳米结构(例如,纳米棒)中的每个仅结合一次以形成具有“交叉”图案的两个层。
“强相互作用”是指占用在反应中结合的纳米结构在一起的时间的超过50%(例如,超过60%、70%、80%或90%)的结合(解离常数远远小于种类/纳米结构的浓度)。
“弱相互作用”是指占用在反应中结合的纳米结构在一起的时间的小于1%的结合(解离常数比种类/纳米结构的浓度大至少100倍)。
成核的纳米结构可以结合两个或更多个其他纳米结构。在一些实施方案中,成核的纳米结构结合5-1000个纳米结构(例如,DNA纳米棒)。例如,成核的纳米结构可以结合3-900、3-800、3-700、3-600、3-500、3-400、3-300、3-200或3-100个纳米结构。在一些实施方案中,成核的纳米结构结合3-10、3-15、3-20、3-25、3-30、3-35、3-40、3-45或3-50个纳米结构。在一些实施方案中,成核的纳米结构结合10-15、10-20、10-25、10-30、10-35、10-40、10-45或10-50个纳米结构。在一些实施方案中,成核的纳米结构结合3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100个纳米结构(例如,DNA纳米棒)。
因此,单一亚组的纳米结构(被编程与单一成核的纳米结构相互作用的纳米结构)可以包括3-900、3-800、3-700、3-600、3-500、3-400、3-300、3-200或3-100个纳米结构。在一些实施方案中,单一亚组的纳米结构包括3-10、3-15、3-20、3-25、3-30、3-35、3-40、3-45或3-50个纳米结构。在一些实施方案中,单一亚组的纳米结构包括10-15、10-20、10-25、10-30、10-35、10-40、10-45或10-50个纳米结构。在一些实施方案中,单一亚组的纳米结构包括3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100个纳米结构(例如,DNA纳米棒)。
“亚组的纳米结构”是指特定的一组纳米结构,该组纳米结构在大小(具有类似的尺寸)和结构/形状上相似并且被编程以结合成核的纳米结构(初始亚组)或通过其他纳米结构的对齐和结合形成的已有的层,所述其他纳米结构已经对齐并且结合于成核的结构或另一已有层的纳米结构。
规定亚组内的纳米结构被编程不彼此结合。因此,在一些实施方案中,亚组内少于10%的纳米结构与同一亚组的另一纳米结构结合。在一些实施方案中,亚组内少于9%、少于8%、少于7%、少于6%、少于5%、少于4%、少于3%、少于2%、少于1%、少于0.5%、少于0.2%或少于0.1%的纳米结构与同一亚组的另一纳米结构结合。在一些实施方案中,亚组内纳米结构中没有一个与同一亚组的另一纳米结构结合。
利用交叉协同组装,纳米结构被对齐以形成多个层,每层相对于邻接的层(上方和下方)旋转一定程度。相对于彼此旋转的两个层的实例显示于图1B中。对齐的纳米棒的顶层相对于对齐的纳米棒的底层旋转90度。两个邻接的层之间的旋转度可以发生变化。在一些实施方案中,一个层相对于邻接的层旋转10-90度、20-90度、30-90度、40-90度、50-90度、60-90度、70-90度或80-90度。在一些实施方案中,一个层相对于邻接的层旋转10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85或90度。
核酸纳米结构
“核酸纳米结构”,包括“DNA纳米结构”,是指被合理地设计以自组装(被编程)成预先确定的规定形状的纳米结构(例如,在每个空间维度(例如,1D、2D或3D)中0.1nm-1μm(例如,0.1nm-100nm)的结构),所述纳米结构在自然界不能组装。使用核酸来构建纳米结构能够通过严格的核苷酸碱基配对规则(例如,A结合T,G结合C,A不结合G或C,T不结合G或C)来实现,这样导致具有互补碱基序列的多个链部分结合在一起以形成强力的、坚固的结构。这允许合理的设计将选择性地组装(自组装)以形成纳米结构的核苷酸碱基序列。
核酸(例如,DNA)纳米结构的实例包括,但不限于,DNA折纸结构,其中长的支架链(例如,长度为至少500个核苷酸)通过几百个(例如,100、200、200、400、500或更多个)短的(例如,长度少于200、少于100个核苷酸)辅助链折叠成复杂的形状(Rothemund,P.W.K.Nature 440,297–302(2006);Douglas,S.M.等人,Nature 459,414–418(2009);Andersen,E.S.等人,Nature 459,73–76(2009);Dietz,H.等人,Science325,725–730(2009);Han,D.等人,Science 332,342–346(2011);Liu,W等人,Angew.Chem.Int.Ed.50,264–267(2011);Zhao,Z.等人,Nano Lett.11,2997–3002(2011);Woo,S.&Rothemund,P.Nat.Chem.3,620–627(2011);
因此,交叉协同组装提结构单元(例如,成核的纳米结构和多个亚组的纳米结构)可以是多种核酸纳米结构形状中的一个,包括,但不限于,棒/管、片、条带、格子、立方体、球体、多面体或另一种二维或三维形状。在一些实施方案中,纳米结构具有(多个)接头、(多个)分支、交叉和/或通过两条或更多条核酸链的核苷酸碱基配对形成的双交叉(参见,例如,Mao,C.PLoS Biology,2(12),2036-2038,2004)。
在一些实施方案中,核酸纳米结构具有柄和圆筒形状,类似于图22中所绘。
DNA折纸的通用和稳定的性质使得能够构建各种独特的架构,所述架构可以以特定的方式设计以促进较大结构的协同组装。在一个实例中,每个组件是独立折叠的DNA-折纸结构。图3A示出了DNA-折纸蜂王、雄蜂和工蜂的实例,其中雄蜂和工蜂具有相同的架构(6螺旋束DNA纳米管)。蜂王、雄蜂和工蜂然后可以以协同的方式组装以形成更高级的1D、2D和3D结构(图3B)。通过合并1D和2D设计原理来考虑3D结构。例如,图22描绘了利用2D雄蜂/工蜂板条组装以形成圆筒形状的3D蜂王纳米结构。
核酸(例如,DNA)板条是成形为板条的纳米结构,所述成形为板条的纳米结构由DNA构成。板条可以是逆平行-交叉单链板条(AXSSS),其包括与配对的单链仅交叉一次的多条单链。本文还提供了平行交叉板条,其包括与另一对链交叉的一对链。
类似于较大规模的DNA-折纸交叉协同组装,单链DNA可以用来实现更高级结构的协同组装。为了实现此目的,雄蜂和工蜂被各种长度的寡核苷酸替换(取决于所推荐的架构),所述寡核苷酸可以组装到DNA-折纸蜂王成核位点上(图4中所示)或组装到图5、图22和图24A-24B中所示的单链DNA索烃结构上。图5中描绘的环结构由具有用于雄蜂和工蜂寡核苷酸的暴露结合位点的单链DNA组成。在另一个实例中,组件被折叠成DNA-折纸圆筒蜂王(图24A-24B)。支架可以被能够接种更多的DNA板条的延伸的DNA板条(多个板条)覆盖,引起结构的生长。通常,DNA板条以两个步骤工作:第一,折叠折纸蜂王位点(例如,混合M13支架和订书钉链),以及第二,将粗DNA折纸蜂王反应物与DNA板条混合,引起结构的生长。例如,改变盐浓度、温度和DNA板条浓度可以改变各种子组件的结合能,引起可逆的或不可逆的结合。
典型地,核酸纳米结构不包含编码序列(编码全长mRNA或蛋白质的序列),因此,核酸纳米结构不包含启动子或控制基因/蛋白质表达的其他遗传元件。各个单链核酸(例如,不具有二级结构的DNA链或RNA链),或各个双链核酸(例如,不具有二级结构),例如,自然界中存在的双螺旋或合成或重组(例如,诸如质粒或其他表达载体)产生的双螺旋,被专门地排除在核酸纳米结构的定义之外。
在一些实施方案中,纳米结构具有空隙体积,所述空隙体积是在形成纳米结构的核酸之间的空间的综合体积。应该理解的是,“空间”包括充以流体的空间。因此,溶液中的纳米结构具有25%的空隙体积,可以包括75%核酸和25%反应缓冲液(填充纳米结构的25%空隙体积)。在一些实施方案中,在溶液中,例如在反应缓冲液中的纳米结构可以具有至少10%(例如,10-90%、10-80%、10-70%、10-60%、10-50%、10-40%或10-30%)、至少20%(例如,20-90%、20-80%、20-70%、20-60%、20-50%、20-40%或20-30%)、至少30%、(例如,30-90%、30-80%、30-70%、30-60%、30-50%或30-40%)、至少40%(例如,40-90%、40-80%、40-70%、40-60%或40-50%)、至少50%(例如,50-90%、50-80%、50-70%或50-60%)、至少60%(例如,60-90%、60-80%或60-70%)、至少70%(例如,70-90%或70-80%),或至少80%(例如,80-90%)的空隙体积。在一些实施方案中,纳米结构具有10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%或90%的空隙体积。
“核酸纳米棒”,包括“DNA纳米棒”,是棒状的核酸(例如,DNA)纳米结构。纳米棒是长度大于其直径的三维圆柱体形状。纳米棒的实例描绘于图1A-1B和图3A-3B中。在一些实施方案中,核酸纳米棒包括6个螺旋束。例如,6个DNA双螺旋可以在两个交叉位点处彼此连接。当交叉点被7个或14个核苷酸对分隔时,每圈具有10.5个核苷酸对的DNA双螺旋有助于DNA双交叉分子编程以形成六角形对称排列(参见,例如,Mathieu F.等人,Nano Lett.5(4),661-664(2005))。可以使用组装核酸纳米棒(也称作纳米管)的其他方法(参见,例如,Feldkamp,U.等人,Angew.Chem.Int.Ed.45(12),1856–1876(2006);Hariri A.等人,NatureChemistry,7,295-300(2015))。
纳米棒(或其他纳米结构)的长度和直径可以发生变化。在一些实施方案中,纳米棒(或其他纳米结构)的长度为10-100nm或10-500nm。例如,纳米棒可以具有10-500nm、10-400nm、10-300nm、10-200nm、10-100nm、10-90nm、10-80nm、10-70nm、10-60nm、10-50nm、10-30nm,或10-20nm的长度。在一些实施方案中,纳米棒具有100-500nm、200-500nm或300-500nm的长度。在一些实施方案中,纳米棒具有100nm、150nm、200nm、250nm、300nm、350nm、400nm、450nm或500nm的长度。在一些实施方案中,纳米棒具有10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100nm的长度。在一些实施方案中,纳米棒(或其他纳米结构)的长度大于100nm(例如,100-1000nm),或小于10nm(例如,1-10nm)。在一些实施方案中,纳米棒(或其他纳米结构)的直径为5-90nm。例如,纳米棒可以具有5-80nm、5-70nm、5-60nm、5-50nm、5-30nm、5-20或5-10nm的直径。在一些实施方案中,纳米棒具有5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85或90nm的直径。在一些实施方案中,纳米棒的直径大于9nm,或小于5nm。因此,在一些实施方案中,纳米棒(或其他纳米结构)具有15-300nm的周长(C≈3.14x d)。
如果纳米结构的长度大于宽度/直径(例如,超过至少10%、20%、25%、50%、100%或200%),则核酸纳米结构,诸如纳米棒,被认为是“细长的”。
核酸纳米结构典型地是纳米尺度的结构(例如,具有1-1000纳米的长度)。然而,在一些实施方案中,本文中的术语“纳米结构”可以包括微米尺度的结构(例如,由超过一个纳米尺度或微米尺度的结构组装的结构)。在一些实施方案中,纳米结构的尺寸(例如,长度或宽度/直径)大于500nm或大于1000nm。在一些实施方案中,纳米结构的尺寸为1微米至2微米。在一些实施方案中,纳米结构的尺寸为10-500nm、10-450nm、10-400nm、10-350nm、10-300nm、10-250nm、10-200nm、10-150nm、10-100nm、10-50nm,或10-25nm。在一些实施方案中,纳米结构的尺寸为500-450nm、500-400nm、500-350nm、500-300nm、500-250nm、500-200nm、500-150nm、500-100nm、500-50nm或500-25nm。在一些实施方案中,纳米结构的尺寸为10、25、50、75、100、150、200、250、300、350、400、450或500nm。
核酸纳米结构被认为是“可自组装的”。自下而上而言,自组装是指在不需要来自外部来源的指导或管理的条件下,分子呈现规定的排列方式的过程。尽管如此,应当理解的是,利用如本文所提供的合成的核酸自组装体,指导核酸的组装的核苷酸碱基序列是人工设计的,并且对应的核酸相应地通过外部来源(诸如本领域技术人员(使用,例如,标准的核酸合成技术))合成。即,本领域普通技术人员可以基于严格的核苷酸碱基配对规则(例如,A结合T,G结合C,A不结合G或C,T不结合G或C)设置,“编程”在单个核酸链内或在两个不同的核酸链之间的核苷酸碱基序列,以选择性地使其在溶液中彼此结合。自组装可以是分子内(折叠)或分子间的。
纳米结构以及因此由较小的纳米结构组装而成的纳米结构、微观结构和宏观结构均是“合理设计的”。如上所讨论的纳米结构在自然界中不能组装。用于交叉协同组装中的核酸链是“被编程的”,使得在特定群体的链中,同一条链内或两条不同链之间的互补核苷酸碱基序列选择性地彼此结合以形成复杂的、用户规定的结构,诸如棒/管、条带、格子、片、多面体、立方体、球体或其他二维或三维形状。纳米结构可以具有规则的形状(全部相同的侧面和全部相等的内角)或不规则的形状(任何长度和度数的侧面和角)。
交叉协同组装的方法
在一些实施方案中,成核的纳米结构和多个亚组的纳米结构的自组装在“一锅”反应中发生,其中交叉协同组装系统的所有核酸纳米结构在反应缓冲液中混合,然后在导致所有核酸纳米结构自组装的条件下孵育。
导致交叉协同组装反应的核酸纳米结构的自组装的条件可以根据特定反应中核酸纳米结构的尺寸、形状、组成和数目而变化。这样的条件可以由本领域普通技术人员来确定,例如,合理地设计/编程所述纳米结构从而进行自组装的人员。
交叉协同组装方法可以在多种温度下进行。在一些实施方案中,交叉协同组装方法在室温(~25℃)或37℃下进行。交叉协同组装方法可以在低于25℃或高于37℃的温度下进行。
执行交叉协同组装反应的反应缓冲液的盐浓度也可以发生变化。在一些实施方案中,反应缓冲液包含浓度为1mM-10mM(例如,1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM或10mM)的MgCl
在任何指定的反应中,初始纳米结构(雄蜂)的数目超过成核的纳米结构(蜂王)的数目。因此,在一些实施方案中,成核的纳米结构与非成核的纳米结构(例如,来自初始亚组的雄蜂,或来自后续亚组的工蜂)的比率为1:10–1:10
在一些实施方案中,交叉协同组装反应物孵育持续2-96小时。例如,交叉协同组装反应物可以孵育持续2-24小时、2-30小时、2-36小时、2-42小时、2-48小时、2-54小时、2-60小时、2-66小时、2-72小时、2-78小时、2-84小时、2-90小时或2-96小时。在一些实施方案中,交叉协同组装反应物孵育持续3、6、9、12、15、18、21、24、27、30、33、36、39、42、45、48、51、54、57、60、63、66、69或72小时。在一些实施方案中,交叉协同组装反应物孵育持续2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70或72小时。
生物传感器
在一些实施方案中,交叉组装产物可以用作生物传感器,所述生物传感器能够使用多种不同的机制和本文所述的系统检测所选择的生物分子(分析物)。例如,在这样的系统中,生物分子的存在可以用来触发交叉组装,然后可以检测(显现)所述交叉组装,从而指示所述生物分子的存在。
生物分子可以使用环系统检测。如图6中所绘,大的DNA环(“主体环圈”),即单链DNA可以被分开以掺入生物分子俘获位点(分析物测试位点),从而结合生物样品中的大分子。DNA环通过多个分离的、独立的“客体”环圈成环并且包绕多个分离的、独立的“客体”环圈,所述“客体”环圈是单链DNA并且作为索烃蜂王起作用,使得客体环圈连接在主体环圈上,类似于手镯上的各个珠子。在一些实施方案中,客体环圈单独地由独立的单链核酸形成(参见,例如,图5和6),而在其他实施方案中,客体环圈由组装成多个(例如,垂直堆叠的)环的长的单一核酸链形成(参见,例如,图27A和27B)。客体环圈的数目可以是2、3、4或5个或更多个。在实施方案中,每个客体环圈(索烃蜂王)包括雄峰和工蜂寡核苷酸的结合位点,并且因此能够交叉组装。在实施方案中,所述多个连接的客体环圈当紧密靠近时形成包括用于雄蜂和工蜂核酸和/或结构的结合位点(例如,插头链)的索烃蜂王,并且因此能够进行交叉组装。每个客体环圈的结合位点数目可以发生变化,并且可以是3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100个。也可以形成位于生物分子俘获位点附近的生物分子测试位点。
在一些实施方案中,生物分子的存在可以在混合物中检测,所述混合物诸如生物样品,见下。首先,生物样品与高浓度的索烃蜂王混合,允许感兴趣的大分子结合生物分子俘获位点。然后,使用化学反应来可逆地裂解所述生物分子俘获位点。与被靶生物分子聚集在一起的那些相比,不结合靶生物分子的索烃蜂王将更快速地分开。在测试混合物中的剩余索烃蜂王在生物分子测试位点处重新连接。随后,向测试混合物中添加雄蜂和工蜂,从而使用很容易观察到的微米尺度的DNA结构扩增剩余的完整蜂王。此系统是模块化的,并且生物分子俘获位点可以被定制化以结合疾病标志物,包括蛋白质或核酸序列。
还可以通过向具有DNA板条的多个客体环圈(例如,客体环)索烃系统(如图27-28中所绘)添加生物分子检测系统来建立高特异性生物传感器。在此实例中,使用圆筒蜂王;然而,其他三维形状也是可能的(例如,片、块和树枝状聚合物)。上面描述了制备圆筒蜂王(卷绕的片材)的实例。
DNA板条的实例描绘于图21A和21B中。
使用用于DNA折纸的支架(例如M13支架)和订书钉链,可以形成多个客体环圈索烃系统。例如,在图27中,在一锅反应中形成8-环系统。环(环圈)的数目可以发生变化,这取决于系统的设计,并且可以为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个环。可以使用附加的环。不像上面所述的系统,柄(细长的结构)和环(环圈)都是同一单链DNA(例如,M13 DNA)的一部分;柄结构被编程从而通过特定的订书钉链(板条)连接在一起。该系统被设计为围绕特定的订书钉链/板条;在生物分子的存在下,它们将所述结构聚拢在一起,并且,当添加雄蜂和工蜂时,可以从平行的环发生生长(图28B)。在缺少生物分子的情况下,订书钉链/板条释放所述结构,并且即使在雄蜂和工蜂的存在下,当蜂王分开并且结合位点的接近度不足以成核和生长时不能发生生长(图28A)。可以使用上述的任一种方法或本领域已知的任何方法检测所述结构的存在。
生物传感器的DNA板条或其他核酸可以利用一个或多个可切换桥键来修饰。“可切换桥键”是在特定试剂(例如,反应试剂或解离剂)的存在下形成或断裂的功能基团之间的连接。可切换桥键的实例包括经由“点击化学”反应(例如,叠氮化物和炔烃之间)形成的键、蛋白质-蛋白质结合(例如,一种或多种抗体与靶蛋白/抗原结合)、二硫键(两个巯基之间)。
因此,本公开的一些方面提供了一种生物传感器,所述生物传感器包括:(i)第一DNA板条,所述第一DNA板条包括第一官能团(例如,叠氮化物或炔烃)、第一结合伴侣(例如,抗体,适配体或纳米抗体)和第二官能团(例如,巯基或核酸),和(ii)第二DNA板条,所述第二DNA板条包括第三官能团(例如,巯基或核酸)、第二结合伴侣(例如,抗体,适配体或纳米抗体)和第四官能团(例如,叠氮化物或炔烃),其中所述第一和第四官能团在反应试剂的存在下反应以形成连接(例如,共价键),其中所述第一和第四结合伴侣特异性地结合感兴趣的生物分子以形成连接(例如,非共价键),并且其中所述第二和第三官能团形成连接(例如,共价键),所述连接在解离试剂的存在下断裂。
在一些实施方案中,生物传感器包括第一DNA板条和第二DNA板条,所述第一DNA板条包括叠氮化物、抗体和巯基,所述第二DNA板条包括炔烃、抗体和巯基,其中(i)的抗体和(ii)的抗体特异性地与感兴趣的生物分子结合。
“第一生物分子结合伴侣”和“第二生物分子结合伴侣”是结合相同的靶生物分子从而形成将DNA板条连接到彼此(通过非共价键)的可切换桥键的任何分子。在一些实施方案中,所述第一和第二生物分子结合伴侣是蛋白质或肽。例如,所述第一和第二生物分子结合伴侣可以是与同一抗原的不同表位结合的抗体。因此,在一些实施方案中,所述第一和第二生物分子结合伴侣是抗体(例如,单克隆的、多克隆的、人的、人源化的或嵌合的)。在一些实施方案中,所述第一和第二生物分子结合伴侣是抗体片段(例如,Fab、F(ab')
“第一官能团”和“第四官能团”是彼此反应从而形成连接(键,诸如共价键或非共价键)的官能团,所述连接形成将DNA板条连接到彼此的可切换桥键。在一些实施方案中,该桥键通过点击化学(叠氮化物-炔烃环加成)反应形成(例如,V.V.Rostovtsev,等人,Angew.Chem.Int.Ed.,2002,41,2596-2599;和F.Himo,等人,J.Am.Chem.Soc.,2005,127,210-216,每一篇均通过引用并入本文)。因此,在一些实施方案中,第一或第四官能团中的一个是叠氮化物,而第一或第四官能团中的另一个是炔烃。例如,第一官能团可以是叠氮化物,且第四官能团可以是反式-环辛烯(TCO)。可以使用其他点击化学官能团。
“第二官能团”和“第三官能团”是彼此反应以形成连接(键,诸如共价键或非共价键)的官能团,所述连接也形成将DNA板条连接到彼此的另一个可切换桥键。该桥键在解离试剂的存在下断裂(解离)。“解离试剂”是断开第二和第三官能团之间的键(例如,共价键)的试剂(例如,化学物质)。在一些实施方案中,第二和第三官能团是彼此反应以形成二硫键的巯基。因此,在一些实施方案中,解离试剂是二硫苏糖醇(DTT)。在一些实施方案中,DTT的浓度为50mM-200mM。例如,DTT的浓度可以是100mM。可以使用其他官能团。
另外的实施方案
1.一种组合物,其包括:
(a)成核的纳米结构;
(b)第一亚组的细长纳米结构,其中少于10%的(b)的纳米结构彼此结合,并且其中(b)的纳米结构与(a)的成核的纳米结构不可逆地结合;和
(c)第二亚组的细长纳米结构,其中少于10%的(c)的纳米结构彼此结合,
其中,在缺少成核的纳米结构的情况下,(b)的纳米结构可以仅在(a)的纳米结构上的单一位置处可逆地结合(a)的纳米结构,和
其中,在缺少成核的纳米结构的情况下,(a)的纳米结构可以仅在(b)的纳米结构上的单一位置处可逆地结合(b)的纳米结构。
2.实施方案1所述的组合物,其进一步包括(d)第三亚组的细长纳米结构,其中少于10%的(d)的纳米结构彼此结合。
3.实施方案1或2所述的组合物,其中(b)的纳米结构在一个方向上对齐并且与(a)的成核的纳米结构不可逆地结合以形成第一层。
4.实施方案3所述的组合物,其中(c)的纳米结构在一个方向上对齐并且与所述第一层的纳米结构结合以形成第二层,其中第一层相对于所述第二层旋转10度-170度。
5.实施方案4所述的组合物,其中所述第一层相对于所述第二层旋转90度。
6.实施方案4或5所述的组合物,其中(d)的纳米结构在一个方向上对齐并且与所述第二层的纳米结构结合以形成第三层,其中第二层相对于所述第三层旋转10度-170度。
7.实施方案6所述的组合物,其中所述第一层相对于所述第二层旋转90度。
8.实施方案1-7中任一项所述的组合物,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构是核酸纳米结构。
9.实施方案8所述的组合物,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构是DNA纳米结构。
10.实施方案8或9所述的组合物,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构包括长核酸链,所述长核酸链与比所述长核酸链短的多条核酸链结合。
11.实施方案8或9所述的组合物,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构包括多条核酸链,每条链的长度小于200nm。
12.实施方案1-6中任一项所述的组合物,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构是蛋白质纳米结构。
13.实施方案1-12中任一项所述的组合物,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构是棒状的。
14.一种方法,其包括:
在反应缓冲液中混合
(a)成核的纳米结构;
(b)第一亚组的细长纳米结构,其中少于10%的(b)的纳米结构彼此结合,并且其中(b)的纳米结构与(a)的成核的纳米结构不可逆地结合;和
(c)第二亚组的细长纳米结构,其中少于10%的(c)的纳米结构彼此结合,
其中,在缺少成核的纳米结构的情况下,(b)的纳米结构可以仅在(a)的纳米结构上的单一位置处可逆地结合(a)的纳米结构,和
其中,在缺少成核的纳米结构的情况下,(a)的纳米结构可以仅在(b)的纳米结构上的单一位置处可逆地结合(b)的纳米结构;以及
在导致(b)的纳米结构与(a)的成核的纳米结构结合以及导致(c)的纳米结构与(b)的纳米结构结合从而形成层级结构的条件下孵育包含(a)、(b)和(c)的所述反应缓冲液。
15.实施方案14所述的方法,其中所述反应缓冲液进一步包含(d)第三亚组的细长纳米结构,其中少于10%的(d)的纳米结构彼此结合。
16.实施方案14或15所述的方法,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构是核酸纳米结构。
17.实施方案16所述的方法,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构是DNA纳米结构。
18.实施方案16或17所述的方法,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构包括长核酸链,所述长核酸链与比所述长核酸链短的多条核酸链结合。
19.实施方案16或17所述的方法,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构包括多条核酸链,每条链的长度小于200nm。
20.实施方案14-16中任一项所述的方法,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构是蛋白质纳米结构。
21.实施方案14-20中任一项所述的方法,其中(a)的成核的纳米结构、(b)的纳米结构、(c)的纳米结构和/或(d)的纳米结构是棒状的。
22.一种组合物,其包括:
(a)成核的DNA纳米结构;
(b)第一亚组的细长DNA纳米棒,其中少于10%的(b)的纳米结构彼此结合,并且其中(b)的DNA纳米棒与(a)的成核的DNA纳米结构不可逆地结合;和
(c)第二亚组的细长DNA纳米棒,其中少于10%的(c)的DNA纳米棒彼此结合,
其中,在缺少成核的DNA纳米结构的情况下,(b)的DNA纳米棒可以仅在(a)的DNA纳米棒上的单一位置处可逆地结合(a)的DNA纳米棒,和
其中,在缺少成核的DNA纳米结构的情况下,(a)的DNA纳米棒仅在(b)的DNA纳米棒上的单一位置处可逆地结合(b)的DNA纳米棒。
实施例
实施例1
这些实施例证明了成核的纳米结构(蜂王)的组装。选择来自核酸自组装反应的筛选试验的最明显条带,并使其在90℃孵育2分钟进行变性,然后进行18小时的梯度(ramp)。凝胶(图9A)为2%琼脂糖(10μL溴化乙锭,c=10mg/mL),并在0.5x TBE和11mM MgCl
利用用作“雄蜂”的不同的纳米结构重复实验。选择来自大规模筛选的最明显条带,并使其在90℃孵育2分钟进行变性,然后进行18小时的梯度。凝胶(图10A)为2%琼脂糖(10μL溴化乙锭,c=10mg/mL),并在0.5x TBE和11mM MgCl
下一步,验证蜂王与雄蜂一起的组装(图11)。测试下列的条件(以1:1:1的比率):蜂王–所有位点闭合和两个雄蜂;蜂王–位点0暴露和两个雄蜂;蜂王–位点1暴露和两个雄蜂;蜂王–位点0/1暴露和两个雄蜂;以及蜂王–所有位点暴露和两个雄蜂。通过在25℃孵育72小时的时期实现组装,并且通过切下凝胶的条带,接着在16k x gFreezeNSqueeze 15分钟,然后用2%UF染色来纯化结构。样品在2%琼脂糖凝胶(10μL溴化乙锭,c=10mg/mL)上泳动,并在0.5x TBE和11mM MgCl
实施例2
使用单链DNA代替6螺旋束构建相似的系统。成核的纳米结构架构的示意图显示在图12A中。每条单链包含结合区和接头区,包括5bp结合区以及3和5个核苷酸的接头(polyT)区。示例性的5bp、2个核苷酸的接头显示如下:
TGCAA
工蜂堆叠在层中雄蜂的顶部(图12B-12G)。显示蜂王以5C或10C两个梯度折叠(图12A)。在2分钟90℃变性期以及之后18小时的梯度后发生折叠。样品在2%琼脂糖凝胶(10μL溴化乙锭,c=10mg/mL)上泳动,并在0.5x TBE和11mM MgCl
实施例3
检验没有蜂王且仅有工蜂(短和长接头两者)的组装。在此实施例中,在具有高盐浓度(1M NaCl,多至15mM MgCl
然后,使双链体长度增加至8bp,并测试2nt(v0.1)和3nt(v0.2)的接头区。将交织引入至结构中,并加入订书钉链以约束支架环的端部(图15A)。如图16B所见,在任一组中以及在任一盐浓度条件下,在没有蜂王的条件下没有组装存在。
实施例4
本实施例证明了6-螺旋束DNA纳米棒雄蜂通过成核作用被格状蜂王组装成交叉结构(图19A-19D)。格状蜂王具有16个格子,每个格子可以使用5个协同的插头-插座结合位点结合雄蜂。在此显示的是两个440nm长雄蜂(图19A)、一个250nm长雄蜂(图19B)和16个250nm长雄蜂(图19C)的位点特异性结合。本实施例显示了使用10bp插头-插座的雄蜂与格状蜂王的结合。当存在化学计算过量的雄蜂时,图19D中的琼脂糖凝胶图像显示反应中的蜂王完全被雄蜂结合。另外,插头-插座结合系统(图18)的功能性与这些组装体的TEM显微照片和动力学数据(图19A-D和图20)一起显示。
格状蜂王和6-螺旋束雄蜂被概念化,然后使用caDNAno设计工具进行设计(对于蜂王,参见图16A-16C(数据未显示),对于雄蜂参见图17A-17B(数据未显示))。在caDNAno中设计的订书钉序列从市场上订购,并利用M13噬菌体支架DNA在下列的条件下折叠:雄蜂在6mMMgCl
使用琼脂糖凝胶电泳将折叠的结构从过量的折叠订书钉中分离,并从琼脂糖凝胶基质中纯化含有感兴趣的结构的条带。将纯化的结构放置在碳网格上,用2%甲酸双氧铀染色,并通过TEM分析以验证具有正确结构的组装体(蜂王参见图16C,雄蜂参见图17B)。
使用下列的条件将纯化的子组件组装成交叉构造:0.1或0.01nM蜂王、1nM雄蜂、30mM MgCl
实施例5
使用单链DNA(ssDNA)代替6螺旋束构建类似的系统,称为“交叉DNA板条”(简称:“DNA板条”)。基本单元的示意图显示在图21A-21B中。图21A-21B中所示的每个DNA板条21个核苷酸(nt)长的寡核苷酸允许形成4×4DNA板条阵列以保持正确的10.5个碱基/圈。DNA板条的长度可以通过21nt的重复而延伸,例如,获得较大的结构。图21A显示了DNA板条架构的抽象形式以及矩阵,所述矩阵在每个位置处具有每个结合位点的碱基对(bp)的数目。6bp和5bp的交替用来保持每个DNA板条的正确螺旋性和大致相同的结合能。示例性的具有16个结合位点(84nt)的DNA板条链显示如下:
TGGTTCTGGAGTTTTACTCGGGACACTTCAGCGTAATATCGGAAGCAGGCACTTTGAAACCTATAAGTCCTGACTATTAATAAC(SEQ ID NO:684)。
图21B示出了来自DNA板条架构的正面和横截面的3D渲染。多条链在彼此的上方和下方交织行进。DNA板条可以可靠地覆盖不同DNA-折纸蜂王的ssDNA突出端(来自M13支架)。图23A-24B均显示了在添加DNA板条后被覆盖的ssDNA支架的实例。图23A中所示的扁平DNA-折纸蜂王利用6mM MgCl
实施例6
本实施例示出了如何延伸DNA板条以创建更多的结合位点从而促进在蜂王上接种的聚合。图25示出了首先被覆盖的扁平蜂王和圆筒蜂王两者(如图23A-23B和图24A-24B中所示),其中接种下一代DNA板条的延伸DNA板条结合并最终生长成微米尺寸的结构。蜂王成核位点决定了后续生长的结构的形状。图26A和26B示出了以两种类型的末端延伸体组装的扁平蜂王。图26C-26E示出了具有一个、两个和三个结构域延伸体的扁平蜂王。使用粗制扁平蜂王反应物(~1nM)、DNA板条(1000nM/链)、和15mM MgCl
实施例7
通过使用圆筒DNA-折纸蜂王,可以在一锅反应中产生多客体环圈索烃系统。图27A-27C显示通过折叠圆筒蜂王,可以通过添加DNA板条获得多客体环圈索烃系统。为了连接多个环,需要两个DNA板条。交织行进并连接ssDNA M13支架环的DNA板条的特写图显示在图27C中。通过将两个DNA板条连接在一端,创建了俘获所有8个环的单个DNA板条。俘获8个环的紫色DNA板条的3D渲染显示在图27D中。图24示出了加入64个板条,可以仅仅减少所述板条,这取决于客体环圈的尺寸和数目。将圆筒蜂王与DNA板条一起使用在一锅反应中实现了高产率。圆筒蜂王可以后续通过将生物分子检测系统偶联到DNA板条而转化成超灵敏生物传感器(参见,例如,图31)。通过对校验步骤的整合,分析物的存在可以转换成紫色DNA板条的开放或闭合状态。图28A-28B显示了在没有生物分子存在的情况下,蜂王分开(开放的DNA板条),且没有发生DNA板条的成核介导的生长。然而,生物分子的存在却保持DNA板条完整,并将蜂王结构聚拢在一起,然后可以触发微米尺寸的管的生长,例如,随后可以使用低成本的光学仪器来检测所述管的生长。
表1.示例性的格状蜂王订书钉序列
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
表2.示例性的250nm 6-螺旋束序列
/>
/>
/>
/>
/>
/>
/>
表3.示例性的440nm 6-螺旋束
/>
/>
/>
/>
/>
/>
/>
/>
本文中公开的所有参考文献、专利和专利申请均关于引用每一件的主题而通过引用并入,在一些情况下可以涵盖所述文件的全部内容。
不定冠词“a”和“an”当在此在说明书中和在权利要求中使用时,除非明确指示相反意思,否则应当理解为意指“至少一个”。
还应当理解的是,除非明确指示相反意思,否则在本文中要求保护的包括多于一个步骤或动作的任何方法中,所述方法的步骤或动作的顺序不一定限于所述及的方法的步骤或动作的顺序。
在权利要求以及上面的说明书中,所有过渡短语诸如“包含”、“包括”、“携带”、“具有”、“含有”、“涉及”、“拥有”、“由…构成”等等要理解为是开放式的,即,意在包括但不限于。仅过渡短语“由…组成”和“基本上由…组成”应当分别是封闭式或半封闭式的过渡短语,如美国专利局专利审查程序指南第2111.03章节中所指出的那样。
综上所述,本发明提供以下实施方案:
1.一种组合物,其包括:
(a)成核的核酸纳米结构;
(b)第一层平行的细长核酸纳米结构,所述第一层平行的细长核酸纳米结构稳定地结合于(a)的成核的纳米结构;和
(c)第二层平行的细长核酸纳米结构,所述第二层平行的细长核酸纳米结构稳定地结合于(b)的细长纳米结构并且相对于(b)的平行的细长纳米结构成角度地旋转,其中(b)的单个细长纳米结构与(c)的多个细长纳米结构各自通过单个协同结合位点结合。
2.实施方案1所述的组合物,其进一步包括(d)第三层平行的细长纳米结构,所述第三层平行的细长纳米结构稳定地结合于(c)的细长纳米结构并且相对于(c)的平行的细长纳米结构成角度地旋转。
3.实施方案1或2所述的组合物,其中所述第二层相对于所述第一层旋转10°-170°。
4.实施方案3所述的组合物,其中所述第二层相对于所述第一层旋转90°。
5.实施方案1-4中任一项所述的组合物,其中所述第三层相对于所述第二层旋转10°-170°。
6.实施方案5所述的组合物,其中所述第三层旋转90°。
7.实施方案1-6中任一项所述的组合物,其中所述第三层与所述第一层平行。
8.实施方案1-7中任一项所述的组合物,其中(a)的核酸是DNA。
9.实施方案1-8中任一项所述的组合物,其中(b)和/或(c)的核酸是DNA。
10.实施方案8或9所述的组合物,其中(a)、(b)和/或(c)的纳米结构包括核酸支架链,所述核酸支架链与多条比所述核酸支架链短的核酸订书钉链结合。
11.实施方案10所述的组合物,其中所述核酸支架链的长度大于1000个碱基,并且每条所述核酸订书钉链的长度小于200个核苷酸。
12.实施方案8-11中任一项所述的组合物,其中(b)和/或(c)的成核的纳米结构包括DNA纳米棒。
13.实施方案8-12中任一项所述的组合物,其中(b)和/或(c)的成核的纳米结构包括DNA板条。
14.一种方法,其包括:
在反应缓冲液中混合下述:
(a)成核的核酸纳米结构;
(b)第一亚组的细长核酸纳米结构,所述第一亚组的细长核酸纳米结构稳定地结合于(a)的成核的纳米结构;和
(c)第二亚组的细长核酸纳米结构,所述第二亚组的细长核酸纳米结构稳定地结合于(b)的细长纳米结构;以及
将包含(a)、(b)和(c)的所述反应缓冲液在产生下列结果的条件下孵育:(i)(b)的细长纳米结构与(a)的成核的纳米结构稳定结合以形成第一层平行的细长纳米结构,和(ii)(c)的细长纳米结构与所述第一层的细长纳米结构结合以形成第二层平行的细长纳米结构,所述第二层平行的细长纳米结构相对于所述第一层成角度地旋转,其中(b)的单个细长纳米结构与(c)的多个细长纳米结构各自通过单个协同结合位点结合。
15.实施方案14所述的方法,其中所述第二层相对于所述第一层旋转10°-170°。
16.实施方案15所述的方法,其中所述第二层相对于所述第一层旋转90°。
17.实施方案14-16中任一项所述的方法,其中(a)的核酸是DNA。
18.实施方案14-17中任一项所述的方法,其中(b)和/或(c)的核酸是DNA。
19.实施方案17或18所述的方法,其中(a)、(b)和/或(c)的纳米结构包括核酸支架链,所述核酸支架链与多条比所述核酸支架链短的核酸订书钉链结合。
20.实施方案19所述的方法,其中所述核酸支架链的长度大于1000个碱基,并且每条所述核酸订书钉链的长度小于200个核苷酸。
21.实施方案17-20中任一项所述的方法,其中(b)和/或(c)的成核的纳米结构包括DNA纳米棒。
22.实施方案17-21中任一项所述的方法,其中(b)和/或(c)的成核的纳米结构包括DNA板条。
23.一种交叉核酸纳米结构,其包括:
第一纳米棒,所述第一纳米棒包括第一插头链和第二插头链;
第二纳米棒,所述第二纳米棒包括第三插头链和第四插头链,其中所述第二纳米棒平行于所述第一纳米棒;
第三纳米棒,所述第三纳米棒包括与所述第一插头链互补并结合的第五插头链和与所述第二插头链互补并结合的第六插头链;
第四纳米棒,所述第四纳米棒包括与所述第三插头链互补并结合的第七插头链和与所述第四插头链互补并结合的第八插头链,其中所述第三纳米棒平行于所述第四纳米棒。
24.一种交叉核酸纳米结构,其包括:
(a)彼此平行排列的第一多个纳米棒;和
(b)彼此平行排列的第二多个纳米棒,其中第一多个纳米棒结合并垂直于所述第二多个纳米棒,(b)的单个纳米棒与(a)的多个纳米棒各自通过单个协同结合位点结合。
25.实施方案23或24所述的交叉核酸纳米结构,其中每个纳米棒包含DNA。
26.实施方案25所述的交叉核酸纳米结构,其中每个纳米棒包含6-螺旋DNA束。
27.一种交叉核酸板条,其包括:
(a)彼此平行排列的第一多个的至少四条核酸链,所述第一多个的每条链具有15-30个核苷酸的长度;和
(b)彼此平行排列的第二多个的至少四条核酸链,所述第二多个的每条链具有15-30个核苷酸的长度,其中所述第一多个的至少四条核酸链结合并垂直于所述第二多个的至少四条核酸链,(b)的单条核酸链与(a)的多条核酸链各自通过单个协同结合位点结合,且(a)的单条核酸链与(b)的多条核酸链各自通过单个协同结合位点结合。
28.一种核酸纳米结构,其包括折叠成多个堆叠平行环的核酸支架链,所述多个堆叠平行环与至少一个实施方案27所述的交叉核酸板条结合。
29.一种核酸纳米结构,其包括与多个实施方案27所述的核酸板条结合的一堆平行的核酸环。
30.一种制备交叉核酸纳米结构的方法,其包括:
在反应混合物中混合下述:
(a)第一纳米棒,所述第一纳米棒包括第一插头链和第二插头链,
(b)第二纳米棒,所述第二纳米棒包括第三插头链和第四插头链,其中所述第二纳米棒平行于所述第一纳米棒;
(c)第三纳米棒,所述第三纳米棒包括与所述第一插头链互补并结合的第五插头链和与所述第二插头链互补并结合的第六插头链;和
(d)第四纳米棒,所述第四纳米棒包括与所述第三插头链互补并结合的第七插头链和与所述第四插头链互补并结合的第八插头链,其中所述第三纳米棒平行于所述第四纳米棒;以及
在产生交叉核酸纳米结构的组装体的条件下孵育所述反应混合物。
31.一种生物分子检测方法,其包括:
(a)在反应混合物中混合下述:
(i)包含生物分子的样品;
(ii)能够自组装成包含堆叠的平行链的纳米结构的核酸链;
(iii)至少两个实施方案27所述的交叉核酸板条,其中两个板条结合于(ii)的堆叠的平行链,并且其中所述板条中的至少两个与生物分子结合伴侣相连,所述生物分子结合伴侣特异性地结合所述样品中的所述生物分子;
(b)在允许所述生物分子伴侣与所述生物分子结合以及所述纳米结构组装成堆叠的平行链的条件下孵育所述反应混合物;以及
(c)在多个实施方案27所述的交叉核酸板条的存在下孵育(b)的反应混合物,其中所述交叉核酸板条与堆叠的平行链结合以形成稳定的三维纳米结构。
32.实施方案31所述的方法,其进一步包括将所述三维纳米结构成像。
33.一种生物分子检测方法,其包括:
在反应混合物中混合下述:
(a)包含生物分子的样品,和
(b)核酸纳米结构,所述核酸纳米结构包括:(i)能够组装成多个堆叠平行环的核酸支架链和核酸订书钉链和(ii)被编程以结合于(i)的环的两个实施方案27所述的交叉核酸板条,
其中特异性地结合所述生物分子的生物分子结合伴侣与每个所述交叉核酸板条连接,使得在所述生物分子的存在下,所述生物分子结合伴侣与所述生物分子结合并且所述核酸纳米结构折叠成多个堆叠平行环;以及
孵育所述反应混合物以组装多个堆叠平行环。
34.实施方案33所述的方法,其进一步包括将所述反应混合物与多个实施方案27所述的交叉核酸板条混合以形成三维纳米结构。
- 转子组装体、具有该转子组装体的马达以及转子组装体的制造方法
- 转子组装体以及具有该转子组装体的马达
- 交叉协同自组装体
- 交叉协同自组装体
