人源化SIRPα-IL15敲入小鼠及其使用方法
文献发布时间:2023-06-19 19:27:02
本申请是申请日为2016年04月12日、中国申请号为202110697073.0、发明名称为“人源化SIRPα-IL15敲入小鼠及其使用方法”的分案申请的再分案申请(原申请号为201680028455.1)。
交叉引用
本申请要求2015年4月13日提交的美国临时申请号62/146,938;2015年4月16日提交的美国临时申请号62/148,667;和2016年1月27日提交的美国临时申请号62/287,842的权益,所述美国临时申请各自的公开内容以引用的方式整体并入本文。
发明领域
本发明涉及经遗传修饰的非人动物的领域。
引言
经遗传修饰的非人动物诸如人源化小鼠持有用于转化研究的极大前景,因为它们允许在体内对人疾病进行建模和研究。在过去10年内,在通过在小鼠中遗传插入为人免疫细胞的适当发育和功能所必需的人基因来开发人源化小鼠方面已取得可观进展。然而,一些限制仍然使人源化小鼠在转化研究中的效用受限。特别是,人T细胞的发育和存活未达到最优。
尽管已显示骨髓-肝-胸腺(BLT)模型会改进NS/NSG-BLT小鼠中的肠T细胞重建(Denton PW,Nochi T,Lim A等Mucosal Immunol2012;5:555-566,Nochi T,Denton PW,Wahl A等Cell Rep 2013;3:1874-1884),但已显示那些小鼠会显现移植物抗宿主疾病,从而导致多个组织中的大量免疫细胞浸润(Greenblatt MB,Vrbanac V,Tivey T等PLoS One2012;7:e44664)。因此,当前人源化小鼠模型仍然缺乏人T细胞的适当发育和功能。特别是,不存在人组织驻留记忆T细胞阻止人源化小鼠用作开发和测试更高效免疫策略的临床前工具,所述更高效免疫策略目的在于诱导针对诸如HIV的病原体的持久粘膜免疫。
为更充分了解人组织驻留T细胞的发育和存活以及提供用以测试用于诱导持久T细胞依赖性粘膜免疫的新型免疫策略的模型,将适用的是具有产生人组织驻留T细胞的经遗传修饰的非人动物。这种小鼠模型也可用于研究人组织驻留免疫细胞与肠道微生物群的相互作用,例如微生物群可如何决定小肠和结肠中人免疫细胞的发育和存活。
此外,本领域中对人自然杀伤(NK)细胞发育和功能的非人动物模型存在需要。
概述
提供了从非人动物基因组表达人SIRPα和人IL-15的经遗传修饰的非人动物。还提供了用于制备从非人动物基因组表达人SIRPα和人IL-15的非人动物的方法,以及使用从非人动物基因组表达人SIRPα和人IL-15的非人动物的方法。这些动物和方法在本领域中具有许多用途,包括例如对人T细胞和/或自然杀伤(NK)细胞发育和功能进行建模;对人T细胞和/或NK细胞的人病原体感染进行建模;体内筛选抑制由激活、诱导和/或靶向T细胞和/或NK细胞的病原体引起的感染的药剂;体内筛选例如在健康或患病状态下调节人T细胞和/或NK细胞的发育和/或功能的药剂;体内筛选对人T细胞和/或NK细胞有毒的药剂;体内筛选防止、缓和或逆转毒性药剂对人T细胞和/或NK细胞的毒性作用的药剂;体内筛选候选T细胞诱导疫苗;以及体内和体外筛选通过激活NK细胞介导的抗体依赖性细胞性细胞毒性(ADCC)过程来抑制肿瘤生长和/或感染的药剂。
在第一方面,本公开提供一种经遗传修饰的非人动物,其包括:并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子;和并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白。
SIRPα基因启动子可为内源性非人SIRPα基因启动子。例如,SIRPα基因启动子可为在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。当SIRPα基因启动子是在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子时,经遗传修饰的非人动物可包括在非人动物SIRPα基因座处非人SIRPα基因中的无效突变。在一个这样的实施方案中,经遗传修饰的非人动物是小鼠,并且无效突变是至少小鼠SIRPα外显子2-4的缺失。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人SIRPα蛋白的核酸序列的等位基因而言是杂合的。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人SIRPα蛋白的核酸序列的等位基因而言是纯合的。
在所述第一方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人SIRPα蛋白的核酸序列包括人SIRPα基因组编码序列和非编码序列。
在所述第一方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人SIRPα蛋白是全长人SIRPα蛋白的功能性片段。在一个这样的实施方案中,功能性片段包括人SIRPα的细胞外结构域,例如包括SEQ ID NO:12的至少氨基酸28-362的细胞外结构域。
在所述第一方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,IL-15基因启动子是内源性非人IL-15基因启动子。在一个这样的实施方案中,IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子。在一个实施方案中,当IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子时,经遗传修饰的非人动物包括在非人动物IL-15基因座处非人IL-15基因中的无效突变。在一个这样的实施方案中,经遗传修饰的非人动物是小鼠,并且无效突变是至少小鼠IL-15外显子5-8的缺失。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人IL-15蛋白的核酸序列的等位基因而言是杂合的。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人IL-15蛋白的核酸序列的等位基因而言是纯合的。
在所述第一方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人IL-15蛋白的核酸序列包括人IL-15基因组编码序列和非编码序列。
在所述第一方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人IL-15蛋白是全长人IL-15蛋白的功能性片段。
在所述第一方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物是免疫缺陷的。例如,在一个实施方案中,经遗传修饰的非人动物包括Rag2基因敲除。在另一实施方案中,经遗传修饰的非人动物包括IL2rg基因敲除,或Rag2基因敲除和IL2rg基因敲除两者。
在所述第一方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,非人动物是哺乳动物。在一个这样的实施方案中,哺乳动物是啮齿动物,例如小鼠。
在所述第一方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物包括人造血细胞的植入物。在一个这样的实施方案中,经遗传修饰的非人动物包括被人病原体的感染。在一个实施方案中,当经遗传修饰的非人动物包括被人病原体的感染时,所述人病原体激活、诱导和/或靶向T细胞和/或自然杀伤(NK)细胞。在另一实施方案中,当经遗传修饰的非人动物包括被人病原体的感染时,所述人病原体是影响(例如通过感染)人肠的病原体。在一个这样的实施方案中,人病原体是人轮状病毒。在另一实施方案中,当经遗传修饰的非人动物包括被人病原体的感染时,所述病原体影响(例如通过感染)人肺。在一个这样的实施方案中,人病原体是流感病毒。在另一实施方案中,当经遗传修饰的非人动物包括被人病原体的感染时,所述病原体影响(例如通过感染)人肝。在另一实施方案中,经遗传修饰的非人动物包括人造血细胞的植入物和肿瘤,例如人肿瘤,例如移植的人肿瘤。
在第二方面,本公开提供一种体内模型,包括经遗传修饰的非人动物,所述经遗传修饰的非人动物包括:并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子;并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子;和人造血细胞的植入物,其中所述经遗传修饰的非人动物(i)表达所述人SIRPα蛋白和所述人IL-15蛋白,并且(ii)包括在所述经遗传修饰的非人动物的小肠和派尔集合淋巴结(Peyer’spatch)中的人上皮内淋巴细胞(IEL)。
在所述第二方面的一个实施方案中,经遗传修饰的非人动物包括被人病原体例如肠病原体的感染。在一个这样的实施方案中,肠病原体选自:空肠弯曲杆菌(Campylobacterjejuni)、艰难梭菌(Clostridium difficile)、粪肠球菌(Enterococcus faecalis)、屎肠球菌(Enterococcus faecium)、大肠杆菌(Escherichia coli)、人轮状病毒、单核细胞增多性李斯特菌(Listeria monocytogenes)、诺瓦克病毒(Norwalk Virus)、肠道沙门氏菌(Salmonella enterica)、福氏志贺氏菌(Shigella flexneri)、宋内氏志贺氏菌(Shigellasonnei)、痢疾志贺氏菌(Shigella dysenteriae)、鼠疫耶尔森氏菌(Yersinia pestis)、小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)和幽门螺杆菌(Helicobacter pylori)。
在所述第二方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,SIRPα基因启动子是内源性非人SIRPα基因启动子。在一个这样的实施方案中,SIRPα基因启动子是在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。在一个实施方案中,当SIRPα基因启动子是在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子时,经遗传修饰的非人动物包括在非人动物SIRPα基因座处非人SIRPα基因中的无效突变。在一个这样的实施方案中,经遗传修饰的非人动物是小鼠,并且无效突变是至少小鼠SIRPα外显子2-4的缺失。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人SIRPα蛋白的核酸序列的等位基因而言是杂合的。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人SIRPα蛋白的核酸序列的等位基因而言是纯合的。
在所述第二方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人SIRPα蛋白的核酸序列包括人SIRPα基因组编码序列和非编码序列。
在所述第二方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人SIRPα蛋白是全长人SIRPα蛋白的功能性片段。在一个这样的实施方案中,功能性片段包括人SIRPα的细胞外结构域,例如包括SEQ ID NO:12的氨基酸28-362的细胞外结构域。
在所述第二方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,IL-15基因启动子是内源性非人IL-15基因启动子。在一个这样的实施方案中,IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子。在一个实施方案中,当IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子时,经遗传修饰的非人动物包括在非人动物IL-15基因座处非人IL-15基因中的无效突变。在一个这样的实施方案中,经遗传修饰的非人动物是小鼠,并且无效突变是至少小鼠IL-15外显子5-8的缺失。在一个这样的实施方案中,经遗传修饰的非人动物就包括编码人IL-15蛋白的核酸序列的等位基因而言是杂合的。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人IL-15蛋白的核酸序列的等位基因而言是纯合的。
在所述第二方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人IL-15蛋白的核酸序列包括人IL-15基因组编码序列和非编码序列。
在所述第二方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人IL-15蛋白是全长人IL-15蛋白的功能性片段。
在所述第二方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物是免疫缺陷的。例如,在一个实施方案中,经遗传修饰的非人动物包括Rag2基因敲除。在另一实施方案中,经遗传修饰的非人动物包括IL2rg基因敲除,或Rag2基因敲除和IL2rg基因敲除两者。
在所述第二方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,非人动物是哺乳动物。在一个这样的实施方案中,哺乳动物是啮齿动物,例如小鼠。
在第三方面,本公开提供一种体内模型,包括经遗传修饰的非人动物,所述经遗传修饰的非人动物包括:并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子;并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子;和人造血细胞的植入物,其中所述经遗传修饰的非人动物(i)表达所述人SIRPα蛋白和所述人IL-15蛋白,并且(ii)包括在所述经遗传修饰的非人动物的肺中的人上皮内淋巴细胞(IEL)。
在所述第三方面的一个实施方案中,经遗传修饰的非人动物包括被人病原体例如肺病原体的感染。在一个这样的实施方案中,肺病原体选自:化脓性链球菌(Streptococcuspyogenes)、流感嗜血杆菌(Haemophilus influenza)、白喉棒杆菌(Corynebacteriumdiphtheria)、SARS冠状病毒(SARS coronavirus)、百日咳博德特氏菌(Bordetellapertussis)、卡它莫拉氏菌(Moraxella catarrhalis)、流感病毒(Influenza virus)(A、B、C)、冠状病毒、腺病毒(Adenovirus)、呼吸道合胞病毒(Respiratory Syncytial Virus)、副流感病毒(Parainfluenza virus)、腮腺炎病毒(Mumps virus)、肺炎链球菌(Streptococcus pneumoniae)、金黄色葡萄球菌(Staphylococcus aureus)、嗜肺军团菌(Legionella pneumophila)、肺炎克雷伯氏菌(Klebsiella pneumoniae)、绿脓假单胞菌(Pseudomonas aeruginosa)、肺炎支原体(Mycoplasma pneumonia)、结核分枝杆菌(Mycobacterium tuberculosis)、肺炎衣原体(Chlamydia Pneumoniae)、皮炎芽生菌(Blastomyces dermatitidis)、新型隐球菌(Cryptococcus neoformans)和烟曲霉(Aspergillus fumigatus)。
在所述第三方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,SIRPα基因启动子是内源性非人SIRPα基因启动子。在一个这样的实施方案中,SIRPα基因启动子是在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。在一个实施方案中,当SIRPα基因启动子是在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子时,经遗传修饰的非人动物包括在非人动物SIRPα基因座处非人SIRPα基因中的无效突变。在一个这样的实施方案中,经遗传修饰的非人动物是小鼠,并且无效突变是至少小鼠SIRPα外显子2-4的缺失。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人SIRPα蛋白的核酸序列的等位基因而言是杂合的。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人SIRPα蛋白的核酸序列的等位基因而言是纯合的。
在所述第三方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人SIRPα蛋白的核酸序列包括人SIRPα基因组编码序列和非编码序列。
在所述第三方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人SIRPα蛋白是全长人SIRPα蛋白的功能性片段。在一个这样的实施方案中,功能性片段包括人SIRPα的细胞外结构域,例如包括SEQ ID NO:12的至少氨基酸28-362的细胞外结构域。
在所述第三方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,IL-15基因启动子是内源性非人IL-15基因启动子。在一个这样的实施方案中,IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子。
在一个实施方案中,当IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子时,经遗传修饰的非人动物包括在非人动物IL-15基因座处非人IL-15基因中的无效突变。在一个这样的实施方案中,经遗传修饰的非人动物是小鼠,并且无效突变是至少小鼠IL-15外显子5-8的缺失。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人IL-15蛋白的核酸序列的等位基因而言是杂合的。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人IL-15蛋白的核酸序列的等位基因而言是纯合的。
在所述第三方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人IL-15蛋白的核酸序列包括人IL-15基因组编码序列和非编码序列。
在所述第三方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人IL-15蛋白是全长人IL-15蛋白的功能性片段。
在所述第三方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物是免疫缺陷的。例如,在一个实施方案中,经遗传修饰的非人动物包括Rag2基因敲除。在另一实施方案中,经遗传修饰的非人动物包括IL2rg基因敲除,或Rag2基因敲除和IL2rg基因敲除两者。
在所述第三方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,非人动物是哺乳动物。在一个这样的实施方案中,哺乳动物是啮齿动物,例如小鼠。
在第四方面,本公开提供一种确定候选T细胞诱导疫苗的功效的方法,所述方法包括:向经遗传修饰的非人动物施用候选T细胞诱导疫苗,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包括:(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,和(iii)人造血细胞的植入物,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;用人病原体激发所述经遗传修饰的非人动物;以及确定所述候选T细胞诱导疫苗是否在所述经遗传修饰的非人动物中诱导T细胞介导的免疫应答。
在所述第四方面的一个实施方案中,SIRPα基因启动子是内源性非人SIRPα基因启动子。在一个这样的实施方案中,SIRPα基因启动子是在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。在一个实施方案中,当SIRPα基因启动子是在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子时,经遗传修饰的非人动物包括在非人动物SIRPα基因座处非人SIRPα基因中的无效突变。在一个这样的实施方案中,经遗传修饰的非人动物是小鼠,并且无效突变是至少小鼠SIRPα外显子2-4的缺失。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人SIRPα蛋白的核酸序列的等位基因而言是杂合的。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人SIRPα蛋白的核酸序列的等位基因而言是纯合的。
在所述第四方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人SIRPα蛋白的核酸序列包括人SIRPα基因组编码序列和非编码序列。
在所述第四方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人SIRPα蛋白是全长人SIRPα蛋白的功能性片段。在一个这样的实施方案中,功能性片段包括人SIRPα的细胞外结构域,例如包括SEQ ID NO:12的至少氨基酸28-362的细胞外结构域。
在所述第四方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,IL-15基因启动子是内源性非人IL-15基因启动子。在一个这样的实施方案中,IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子。在一个实施方案中,当IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子时,经遗传修饰的非人动物包括在非人动物IL-15基因座处非人IL-15基因中的无效突变。在一个这样的实施方案中,经遗传修饰的非人动物是小鼠,并且无效突变是至少小鼠IL-15外显子5-8的缺失。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人IL-15蛋白的核酸序列的等位基因而言是杂合的。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人IL-15蛋白的核酸序列的等位基因而言是纯合的。
在所述第四方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人IL-15蛋白的核酸序列包括人IL-15基因组编码序列和非编码序列。
在所述第四方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人IL-15蛋白是全长人IL-15蛋白的功能性片段。
在所述第四方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物包括Rag2基因敲除。
在所述第四方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物包括IL2rg基因敲除。
在所述第四方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物是哺乳动物,诸如啮齿动物,例如小鼠。
在第五方面,本公开提供一种鉴定抑制由激活、诱导和/或靶向人T细胞和/或自然杀伤(NK)细胞的病原体的感染的药剂的方法,所述方法包括:向经遗传修饰的非人动物施用药剂,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包括:(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,(iii)人造血细胞的植入物,和(iv)由激活、诱导和/或靶向人T细胞和/或自然杀伤细胞的病原体的感染,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;以及确定所述药剂是否使所述病原体感染的非人动物中所述病原体的量降低。
在所述第五方面的一个实施方案中,SIRPα基因启动子是内源性非人SIRPα基因启动子。在一个这样的实施方案中,SIRPα基因启动子是在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。在一个实施方案中,当SIRPα基因启动子是在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子时,经遗传修饰的非人动物包括在非人动物SIRPα基因座处非人SIRPα基因中的无效突变。在一个这样的实施方案中,经遗传修饰的非人动物是小鼠,并且无效突变是至少小鼠SIRPα外显子2-4的缺失。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人SIRPα蛋白的核酸序列的等位基因而言是杂合的。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人SIRPα蛋白的核酸序列的等位基因而言是纯合的。
在所述第五方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人SIRPα蛋白的核酸序列包括人SIRPα基因组编码序列和非编码序列。
在所述第五方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人SIRPα蛋白是全长人SIRPα蛋白的功能性片段。在一个这样的实施方案中,功能性片段包括人SIRPα的细胞外结构域,例如包括SEQ ID NO:12的氨基酸28-362的细胞外结构域。
在所述第五方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,IL-15基因启动子是内源性非人IL-15基因启动子。在一个这样的实施方案中,IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子。在一个实施方案中,当IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子时,经遗传修饰的非人动物包括在非人动物IL-15基因座处非人IL-15基因中的无效突变。在一个这样的实施方案中,经遗传修饰的非人动物是小鼠,并且无效突变是至少小鼠IL-15外显子5-8的缺失。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人IL-15蛋白的核酸序列的等位基因而言是杂合的。在另一个这样的实施方案中,经遗传修饰的非人动物就包括编码人IL-15蛋白的核酸序列的等位基因而言是纯合的。
在所述第五方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人IL-15蛋白的核酸序列包括人IL-15基因组编码序列和非编码序列。
在所述第五方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人IL-15蛋白是全长人IL-15蛋白的功能性片段。
在所述第五方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物包括Rag2基因敲除。
在所述第五方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物包括IL2rg基因敲除。
在所述第五方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物是哺乳动物,诸如啮齿动物,例如小鼠。
在第六方面,本公开提供一种制备表达人IL-15蛋白和人SIRPα蛋白的非人动物的方法,所述方法包括:向第一非人动物的基因组中引入编码人IL-15蛋白的核酸序列,其中所述编码所述人IL-15蛋白的序列可操作地连接至IL-15基因启动子序列;向第二非人动物的基因组中引入编码人SIPRα蛋白的核酸序列,其中所述编码所述人SIRPα蛋白的序列可操作地连接至SIRPα启动子序列;以及制备包括编码所述人IL-15蛋白的所述核酸序列和编码所述人SIRPα蛋白的所述核酸序列的第三非人动物,其中所述第三非人动物表达所述人IL-15蛋白和所述人SIPRα蛋白。
在所述第六方面的一个实施方案中,引入步骤包括由包括编码人IL-15或人SIRPα的核酸的多能干细胞产生非人动物。
在所述第六方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,第一动物是与第二动物不同的动物,并且制备第三动物的步骤包括使第一动物和第二动物交配。
在所述第六方面的另一实施方案中,第一动物和第二动物相同,向第一动物的基因组中进行引入的步骤包括使第一多能干细胞与编码人IL-15蛋白的核酸序列接触以获得第二多能干细胞,向第二动物的基因组中进行引入的步骤包括使所述第二多能干细胞与编码人SIRPα蛋白的核酸序列接触以获得第三多能干细胞,并且所述第三非人动物由所述第三多能干细胞制备。
在所述第六方面的一替代形式中,本公开提供一种制备表达人IL-15蛋白和人SIRPα蛋白的非人动物的方法,所述方法包括:向第一非人动物的基因组中引入编码人SIPRα蛋白的核酸序列,其中所述编码所述人SIPRα蛋白的序列可操作地连接至SIPRα基因启动子序列;向第二非人动物的基因组中引入编码人IL-15蛋白的核酸序列,其中所述编码所述人IL-15蛋白的序列可操作地连接至IL-15启动子序列;以及制备包括编码所述人IL-15蛋白的所述核酸序列和编码所述人SIRPα蛋白的所述核酸序列的第三非人动物,其中所述第三非人动物表达所述人IL-15蛋白和所述人SIPRα蛋白。
在所述第六方面的另一实施方案中,第一动物和第二动物相同,向第一动物的基因组中进行引入的步骤包括使第一多能干细胞与编码人SIRPα蛋白的核酸序列接触以获得第二多能干细胞,向第二动物的基因组中进行引入的步骤包括使所述第二多能干细胞与编码人IL-15蛋白的核酸序列接触以获得第三多能干细胞,并且所述第三非人动物由所述第三多能干细胞制备。
在所述第六方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,多能干细胞是ES细胞或iPS细胞。
在所述第六方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,多能干细胞就Rag2而言是缺陷的。
在所述第六方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,多能干细胞就IL2rg而言是缺陷的。
在所述第六方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,第三非人动物就Rag2和IL2rg之一或两者而言是缺陷的。
在所述第六方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,IL-15启动子序列是人IL-15启动子的序列。
在所述第六方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,IL-15启动子序列是内源性非人动物IL-15启动子的序列。
在所述第六方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,整合导致在非人IL-15基因座处非人IL-15基因的替换。
在所述第六方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,编码人IL-15蛋白的核酸序列包括人IL-15基因组编码序列和非编码序列。
在第七方面,本公开提供一种对表达人IL-15蛋白的经遗传修饰的非人动物进行植入的方法,包括:将包括人造血细胞的细胞群体移植入通过根据第六方面或其任何实施方案的方法制备的所述经遗传修饰的非人动物中。在一个这样的实施方案中,移植包括尾部静脉注射、胎肝注射或眶后注射。
在所述第七方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,经遗传修饰的非人动物在移植之前经亚致死性辐射。
在所述第七方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人造血细胞是CD34+细胞。
在所述第七方面的另一实施方案中,或在其任何以上实施方案的进一步实施方案中,人造血细胞来自胎肝、成人骨髓或脐带血。
在第八方面,本公开提供一种确定候选治疗性抗体或抗原结合蛋白在杀伤靶细胞方面的功效的方法,所述方法包括:向经遗传修饰的非人动物施用所述候选治疗性抗体或抗原结合蛋白,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包括:(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,和(iii)人造血细胞的植入物,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;以及确定所述候选治疗性抗体或抗原结合蛋白是否在所述经遗传修饰的非人动物中调节NK细胞介导的针对所述靶细胞的抗体依赖性细胞性细胞毒性。
在第九方面,本公开提供一种确定候选治疗性抗体或抗原结合蛋白在杀伤靶细胞方面的功效的方法,包括:从经遗传修饰的非人动物分离NK细胞,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包括:(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,和(iii)人造血细胞的植入物,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;使所述经分离的NK细胞与所述候选治疗性抗体或抗原结合蛋白和所述靶细胞接触;以及测定所述经分离的NK细胞针对所述靶细胞的抗体或抗原结合蛋白依赖性细胞溶解活性。
在第十方面,本公开提供一种针对杀伤靶细胞改进的功效来筛选候选治疗性抗体或抗原结合蛋白的方法,包括:向经遗传修饰的非人动物施用所述候选治疗性抗体或抗原结合蛋白,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包括:(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,和(iii)人造血细胞的植入物,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;以及确定所述候选治疗性抗体或抗原结合蛋白是否在所述经遗传修饰的非人动物中在杀伤所述靶细胞方面显示改进的功效。
在第八、第九和第十方面中的任一者的一个实施方案中,靶细胞是肿瘤细胞、受病毒感染细胞、受细菌感染细胞、细菌细胞、真菌细胞和寄生物细胞中的一者或多者。
附图简述
本专利或申请文件含有至少一个以彩色制作的附图。具有彩色附图的本专利或专利申请公布的复本将在请求以及支付必要费用后由专利局提供。
图1提供用人SIRPα序列替换小鼠SIRPα基因的图示。图1(顶部)显示指示外显子1-8的相对位置的小鼠Sirpα基因座。图1(底部)提供显示具有人外显子2-4的最终所靶向等位基因的图示。所编码嵌合蛋白具有对应于野生型人SIRPα蛋白的氨基酸28-362的细胞外区域融合于小鼠SIRPα蛋白的细胞内部分。斜条纹形状代表所插入的人序列。
图2提供说明如对于小鼠2实现的对小鼠IL-15基因的靶向基因组替换的图示。空心形状代表所插入的人序列。
图3A提供显示非经植入SRG(人SIRPα、Rag KO、IL-2rg KO)和SRG-15(人SIRPα、RagKO、IL-2rg KO、人IL-15(小鼠1))小鼠的各种组织中的hIL-15基因表达的图解。Y轴显示相对于持家基因Hprt的hIL-15mRNA水平。
图3B提供显示非经植入RG(Rag KO、IL-2rg KO)和非经植入SRG-15(人SIRPα、RagKO、IL-2rg KO、人IL-15)小鼠(如所指示小鼠#1和小鼠#2)的各种组织中的人hIL-15基因表达的图解。
图4提供在用聚(I:C)激发之后,SRG、SRG IL-15
图5A提供显示在植入后12-14周,NSG、SRG和SRG-15(小鼠2)小鼠的血液中的高效人造血细胞植入的图解。所有数据都显示为平均值±s.e.m。使用未配对双尾曼-惠特尼(Mann-Whitney)U检验进行统计分析(*P<0.05,**P<0.01,****P<0.0001)。
图5B提供显示在植入后14周,SRG和SRG-15(小鼠2)的BM、脾、LN、肝和肺中的人CD45+细胞数目的图解。
图6A提供显示SRG和SRG-15小鼠(小鼠1)中的骨髓(BM)、肝和肺中的人T细胞和NK细胞频率的图。
图6B提供显示SRG和SRG-15小鼠(小鼠1)中的各种组织中的人NK细胞频率的图解。
图6C提供说明SRG和SRG-15小鼠(小鼠1)的肝中的人NK细胞成熟的图和图解。
图6D提供显示在SRG-15小鼠的脾中人CD56
图7A提供显示在植入后10-12周,NSG、SRG和SRG-15(小鼠2)小鼠的血液中的人NK细胞的频率的图解。所有数据都显示为平均值±s.e.m。使用未配对双尾曼-惠特尼U检验进行统计分析(*P<0.05,**P<0.01,****P<0.0001)。
图7B提供显示在植入后14周,SRG、SRG-15
图7C提供显示在植入后14周,SRG和SRG-15(小鼠2)小鼠的血液、脾(SP)、肝和肺中的人NK细胞的频率的图。所有数据都显示为平均值±s.e.m。使用未配对双尾曼-惠特尼U检验进行统计分析(*P<0.05,**P<0.01,****P<0.0001)。
图7D提供显示在植入后14周,SRG和SRG-15(小鼠2)小鼠的脾(SP)、肝和肺中的人NK细胞的频率的图解。所有数据都显示为平均值±s.e.m。使用未配对双尾曼-惠特尼U检验进行统计分析(*P<0.05,**P<0.01,****P<0.0001)。
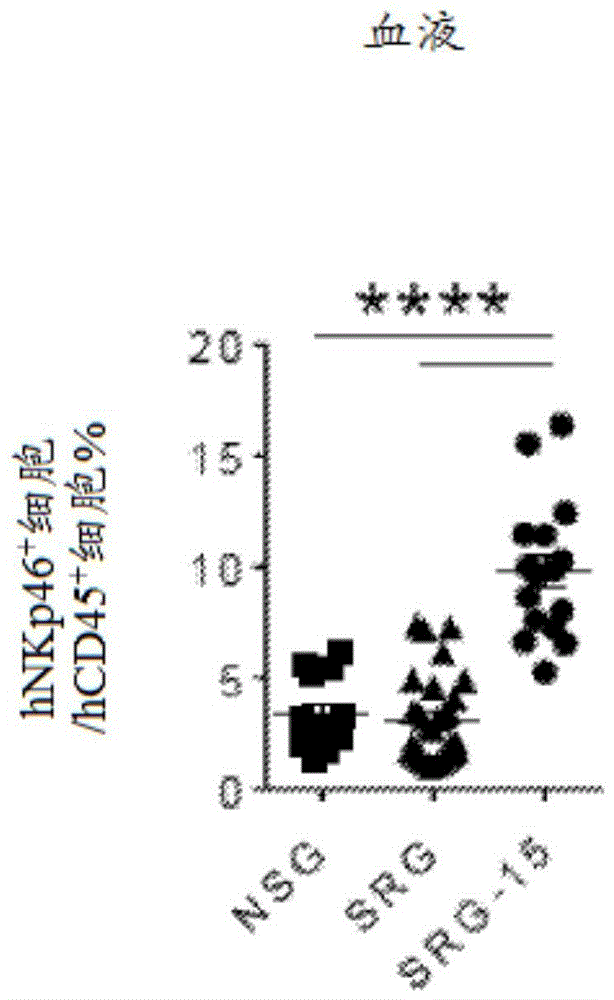
图8提供显示SRG和SRG-15(小鼠2)小鼠中的血液中的人T细胞和NK细胞分布的图(左侧)(关于人CD45+细胞(造血细胞)和NKp46+细胞(NK细胞)设门);和显示经植入SRG-15小鼠的血液中的是NKp46+细胞的hCD45+细胞的百分比的图解(右侧)。
图9A提供显示相对于用CD34+huHSC植入的SRG小鼠,用CD34+huHSC植入的SRG-15小鼠(小鼠2)的脾中的NK细胞和T细胞的分布的图和显示脾中的NKp46+细胞的百分比和数目的图解。
图9B提供显示在植入后10-12周,NSG(n=5)、SRG(n=19)和SRG-15(小鼠2)小鼠(n=39)的血液中的人免疫细胞组成的图解。
图9C提供在植入后14周,SRG和SRG-15(小鼠2)小鼠的胸腺中的人CD45+细胞数目。
图9D提供SRG和SRG-15(小鼠2)小鼠的胸腺中的hCD45+细胞的代表性流式细胞术图。
图9E提供显示在植入后14周,SRG(n=8)和SRG-15(小鼠2)小鼠(n=4)的胸腺中的hCD45+细胞的组成的图解。
图10A提供显示在植入后7周,SRG和SRG-15(小鼠2)小鼠的血液和脾中的CD56
图10B提供显示在植入后7周,SRG和SRG-15(小鼠2)小鼠的血液和脾中的CD56
图10C提供显示人和SRG-15小鼠(小鼠2)中的NK细胞子组上的杀伤抑制性受体(KIR)的表达的图和图解。
图11提供显示相对于PBMC样品,CD16
图12提供显示在植入后7周,SRG和SRG-15(小鼠2)小鼠的骨髓中的人NK细胞发育的图解。所有数据都显示为平均值±s.e.m。使用未配对双尾曼-惠特尼U检验进行统计分析(*P<0.05,**P<0.01,****P<0.0001)。
图13A提供显示SRG和SRG-15小鼠(小鼠1)中的各种组织中的人T细胞频率的图解。(K/μl=每μl的千细胞数)。
图13B提供显示SRG和SRG-15小鼠(小鼠1)的血液和肝中的人CD8
图14A提供显示SRG和SRG-15(小鼠1)小鼠的肺CD8
图14B提供显示SRG和SRG-15(小鼠1)小鼠的肝CD8
图15A提供显示在植入后16周,SRG和SRG-15(小鼠2)小鼠的脾、肺和肝中的hCD3
图15B提供显示在植入后16周,SRG和SRG-15(小鼠2)小鼠的脾、肺和肝中的CD4/CD8比率的图解。
图16A提供说明SRG和SRG-15(小鼠1)小鼠的结肠中的人固有层淋巴细胞(LPL)频率的图。
图16B提供说明SRG和SRG-15(小鼠1)小鼠的结肠中的人固有层淋巴细胞(LPL)频率的图解。
图17A连同图17B-17C一起说明16周龄SRG-15小鼠(小鼠1)的小肠中的高效人上皮内淋巴细胞(IEL)植入。图17A提供显示SRG和SRG-15(小鼠1)小鼠的IEL部分内的人CD45
图17B提供对16周龄SRG和SRG-15(小鼠1)小鼠的小肠中的hCD45的免疫组织化学染色的图像。
图17C提供显示SRG-15小鼠(小鼠1)的脾和小肠中的人CD8
图18A提供显示在植入后16周,SRG和SRG-15(小鼠2)小鼠的IEL部分内的小鼠和人CD45+细胞的代表性FACS图。
图18B提供显示相对于SRG-15(小鼠2)小鼠,SRG的小肠中的人IEL的数目,以及相对于SRG-15(小鼠2)小鼠,SRG大肠中的人LPL的数目的图解。所有数据都显示为平均值±s.e.m。使用未配对双尾曼-惠特尼U检验进行统计分析(***P<0.001)。
图18C提供显示SRG-15小鼠(小鼠2)的小肠中的hCD3+细胞的组成的图。8只SRG-15小鼠(小鼠2)的一个代表性FACS图。
图18D提供显示SRG-15小鼠(小鼠2)的脾和小肠中的hCD3+hCD8+T细胞的表型特征的图解。
图18E提供对SRG和SRG-15(小鼠2)小鼠的小肠中的hCD8的免疫组织化学染色的图像。箭号指示hCD8
图19A提供显示SRG和SRG-15小鼠的上皮内淋巴细胞群体中的hCD45+细胞的分布和数目,以及SRG和SRG-15(小鼠2)小鼠的上皮内淋巴细胞群体中的hCD45+细胞群体中的NK细胞和T细胞的相对百分比的图和图解。
图19B提供显示相较于血液和脾,SRG-15小鼠(小鼠2)的上皮内淋巴细胞中的CD16+和CD16-NK细胞的分布和百分比的图和图解。
图19C提供显示SRG和SRG-15(小鼠2)小鼠中的人IEL和人固有层淋巴细胞(LPL)的分布和数目的图和图解。
图20A和20B提供证明在SRG-15小鼠(小鼠2)中存在主要含有hCD45+细胞的可辨别派尔集合淋巴结的图和图解。
图21A提供共同舍饲(cohousing)和粪便样品收集以进行肠微生物群测序的时间轴。
图21B提供显示非经植入和经植入SRG和SRG-15(小鼠1)小鼠的肠中的小鼠细菌的相对丰度的简图。
图22说明SRG-15小鼠中的人组织驻留T细胞的功能相关性。更具体来说,图22提供证明人IEL在清除急性轮状病毒感染方面的功能相关性的图解。
图23A提供ViSNE图,其显示基于CyTOF的对人(n=20)和SRG-15小鼠(小鼠2)(n=9)中的CD56
图23B提供ViSNE图,其显示8种所选标志物在人(n=20)和SRG-15小鼠(小鼠2)(n=9)中的CD56
图23C提供ViSNE图,其显示8种所选标志物在人(n=20)和SRG-15小鼠(n=9)中的CD56
图24A提供显示在注射聚IC之前和之后,相对于SRG-15(小鼠2)小鼠,SRG中的呈CD69+的血液NK细胞的百分比的图解。
图24B提供显示在用聚I:C或人IL-12p70体外刺激之后,由SRG和SRG-15(小鼠2)源性NK细胞达成的IFNγ产生的图解。将来自小鼠的NK细胞与源于健康人PBMC的NK细胞进行比较。所有样品都关于NK数目加以标准化。
图24C提供显示在不存在(顶部右侧)或存在(底部右侧)抗CD20抗体下,来自SRG和SRG-15(小鼠2)小鼠的脾NK细胞针对I类HLA缺陷K562细胞(左侧)或针对Raji细胞的细胞溶解能力的图解。SRG-15#1和SRG-15#2代表两种由SRG-15(小鼠2)同窝仔畜获得的不同NK细胞制备物。
图25A提供显示在用利妥昔单抗(RTX)治疗之后,SRG-15小鼠(小鼠2)中的人NK细胞抑制肿瘤生长的图解。所有数据都显示为平均值±s.e.m。使用未配对双尾曼-惠特尼U检验进行统计分析(***P<0.001)。
图25B提供显示未治疗(n=5)和RTX治疗SRG-15小鼠(n=1)的人肿瘤异种移植物中的人NK细胞和T细胞的频率的图和图解。所有数据都显示为平均值±s.e.m。使用未配对双尾曼-惠特尼U检验进行统计分析(***P<0.001)。
图25C提供显示未治疗(n=2)和RTX治疗SRG-15小鼠(n=1)的血液和肿瘤中的人NK细胞子组的图和图解。所有数据都显示为平均值±s.e.m。使用未配对双尾曼-惠特尼U检验进行统计分析(***P<0.001)。
详述
在描述本发明方法和组合物之前,应了解本发明不限于描述的特定方法或组合物,因为所述方法或组合物可变化。也应了解本文所用的术语仅出于描述特定实施方案的目的,并且不意图具有限制性,因为本发明的范围将仅受限于随附权利要求。
除非另外定义,否则本文所用的所有技术和科学术语都具有与由本发明所属领域中的普通技术人员通常理解相同的含义。尽管与本文所述的那些方法和材料类似或等效的任何方法和材料都可用于实施或测试本发明,但现时描述特定方法和材料。本文提及的所有出版物都以引用的方式并入本文以公开和描述与引用所述出版物有关的方法和/或材料。应了解就存在矛盾来说,本公开替代所并入出版物的任何公开内容。
如将为本领域技术人员在阅读本公开后显而易知,本文描述和说明的各个别实施方案都具有离散组成部分和特征,其可在不脱离本发明的范围或精神下易于与任何其它若干实施方案的特征分开或组合。任何叙述的方法都可以叙述的事件的顺序或以在逻辑上可能的任何其它顺序执行。
必须注意,除非上下文另外明确规定,否则如本文以及随附权利要求中所用,单数形式“一个(种)(a/an)”和“这个(种)”包括复数个(种)指示物。因此,例如,提及“一个(种)细胞”包括复数个(种)所述细胞,并且提及“这个(种)蛋白质”包括提及一个(种)或多个(种)蛋白质及其为本领域技术人员所知的等效物,依此类推。
本文讨论的出版物仅由于它们的公开内容在本申请的提交日期之前而加以提供。本文中没有内容应解释为承认本发明无权先于所述出版物。
提供从非人动物基因组表达人SIRPα和人IL-15的经遗传修饰的非人动物。也提供用于制备从非人动物基因组表达人SIRPα和人IL-15的非人动物的方法,以及使用从非人动物基因组表达人SIRPα和人IL-15的非人动物的方法。这些动物和方法在本领域中具有许多用途,包括例如对人T细胞和/或自然杀伤(NK)细胞发育和功能进行建模;对人病原体感染,例如特定组织的人病原体感染,例如人肠道、肺或肝病原体感染进行建模;对人T细胞和/或NK细胞的人病原体感染进行建模;体内筛选抑制由激活、诱导和/或靶向T细胞和/或NK细胞的病原体的感染的药剂;体内筛选例如在健康或患病状态下调节人T细胞和/或NK细胞的发育和/或功能的药剂;体内筛选对人T细胞和/或NK细胞有毒的药剂;体内筛选防止、缓和或逆转毒性剂对人T细胞和/或NK细胞的毒性作用的药剂;体内筛选候选T细胞诱导疫苗;以及体内和体外筛选通过激活NK细胞介导的抗体依赖性细胞性细胞毒性(ADCC)过程来抑制肿瘤生长和/或感染的药剂。
人源化SIRPα非人动物
在本公开的一些方面,提供一种人源化SIRPα非人动物。就人源化SIRPα非人动物或“SIRPα非人动物”来说,其意指包括编码人SIRPα蛋白的核酸序列的非人动物。如本文所用,“人SIRPα蛋白”意指是野生型(或天然)人SIRPα蛋白或野生型(或天然)人SIRPα蛋白的保留野生型人SIRPα蛋白的一种或多种信号传导和/或受体功能的变体的蛋白质。如本文所用,术语“变体”定义人多肽或核酸序列的分离的天然存在的遗传突变体或人多肽或核酸序列的重组制备变化形式,其各自相较于相应野生型人核酸或多肽序列含有一个或多个突变。例如,所述突变可为一个或多个氨基酸取代、添加和/或缺失。术语“变体”也包括人同源物和直系同源物。在一些实施方案中,本发明的变体多肽具有与野生型人多肽的70%或更大同一性,例如75%、80%或85%或更大同一性,例如与野生型人多肽的90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
两个序列之间的同一性百分比可使用本领域中的任何便利的技术来确定,例如使用例如可公开获得的软件进行序列比对。可使用标准分子生物学技术引入突变,所述技术诸如定点诱变、PCR介导的诱变、定向进化等。本领域技术人员将认识到可引入一个或多个核酸取代而不改变氨基酸序列,并且可引入一个或多个氨基酸突变而不改变人蛋白质的功能性质。
可在人蛋白质中进行保守性氨基酸取代以产生人蛋白质变体。就保守性氨基酸取代来说,它意指本领域公知的用具有类似特征的另一氨基酸取代一个氨基酸。例如,各氨基酸可被描述为具有一种或多种以下特征:电正性、电负性、脂族、芳族、极性、疏水性和亲水性。保守性取代是一个具有指定结构或功能特征的氨基酸被具有相同特征的另一氨基酸取代。酸性氨基酸包括天冬氨酸、谷氨酸;碱性氨基酸包括组氨酸、赖氨酸、精氨酸;脂族氨基酸包括异亮氨酸、亮氨酸和缬氨酸;芳族氨基酸包括苯丙氨酸、甘氨酸、酪氨酸和色氨酸;极性氨基酸包括天冬氨酸、谷氨酸、组氨酸、赖氨酸、天冬酰胺、谷氨酰胺、精氨酸、丝氨酸、苏氨酸和酪氨酸;并且疏水性氨基酸包括丙氨酸、半胱氨酸、苯丙氨酸、甘氨酸、异亮氨酸、亮氨酸、甲硫氨酸、脯氨酸、缬氨酸和色氨酸;并且保守性取代包括在各组内的氨基酸之间进行的取代。氨基酸也可以相对尺寸加以描述,丙氨酸、半胱氨酸、天冬氨酸、甘氨酸、天冬酰胺、脯氨酸、苏氨酸、丝氨酸、缬氨酸全都通常被视为小氨基酸。
人变体可包括合成氨基酸类似物、氨基酸衍生物和/或非标准氨基酸,说明性地包括不限于α-氨基丁酸、瓜氨酸、刀豆氨酸(canavanine)、氰丙氨酸(cyanoalanine)、二氨基丁酸、二氨基庚二酸、二羟基-苯丙氨酸、黎豆氨酸(djenkolic acid)、高精氨酸、羟基脯氨酸、正亮氨酸、正缬氨酸、3-磷酸丝氨酸、高丝氨酸、5-羟基色氨酸、1-甲基组氨酸、甲基组氨酸和鸟氨酸。
人变体将通常由与编码野生型人蛋白质的核酸具有高度同一性的核酸编码。编码人变体的核酸的互补序列在高严格性条件下与编码野生型人的核酸特异性杂交。编码人变体的核酸可使用熟知方法分离或以重组或合成方式产生。也被术语“人SIRPα蛋白”涵盖的是野生型人SIRPα蛋白(或其变体)的保留野生型人SIRPα蛋白的一种或多种信号传导和/或受体功能的片段,例如人SIRPα蛋白的细胞外结构域。
术语“人SIRPα蛋白”也涵盖包括野生型人SIRPα蛋白(或其变体)的一个或多个片段,并且保留野生型人SIRPα蛋白的一种或多种信号传导和/或受体功能的融合蛋白,即嵌合蛋白。包括野生型人SIRPα蛋白(或其变体)的一个或多个片段例如与一个或多个非人肽或多肽组合的融合蛋白也可在本文中称为人源化SIRPα蛋白。因此,例如,包括野生型人SIRPα蛋白的细胞外结构域与野生型小鼠SIRPα蛋白的信号传导结构域融合的氨基酸序列的蛋白质被术语“人SIRPα蛋白”涵盖。
在一些情况下,本公开的人SIRPα蛋白包括与SEQ ID NO:12的氨基酸28-362具有至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、至少约99%或100%氨基酸序列同一性的氨基酸序列。
因此,编码人SIRPα蛋白的核酸序列是包括人SIRPα蛋白的编码序列的多核苷酸,所述人SIRPα蛋白例如野生型人SIRPα蛋白、野生型人SIRPα蛋白的变体、野生型人SIRPα蛋白(或其变体)的保留野生型人SIRPα蛋白的一种或多种信号传导和/或受体功能的片段、或包括野生型人SIRPα蛋白(或其变体)的一个或多个片段,并且保留野生型人SIRPα蛋白的一种或多种信号传导和/或受体功能的融合蛋白,即嵌合蛋白。
SIRPα(在人中也称为“信号调控蛋白α”和“CD172A”)是信号调控蛋白(SIRP)家族的成员,并且也属于免疫球蛋白超家族。已显示SIRPα会改进免疫缺陷小鼠中的细胞植入(Strowig等Proc Natl Acad Sci USA 2011;108:13218-13223)。野生型人SIRPα的多肽序列和编码野生型人SIRPα的核酸序列可以Genbank登录号NM_001040022.1(变体1)、NM_001040023.1(变体2)和NM_080792.2(变体3)得到。SIRPα基因在至少黑猩猩、恒河猴、狗、母牛、小鼠、大鼠和鸡中是保守的。编码野生型人SIRPα蛋白的基因组基因座可见于人基因组中染色体20;NC_000020.11(1894117-1939896)处。蛋白质序列由在这个基因座处的外显子1至8编码。因此,在一些实施方案中,包括人SIRPα的编码序列的核酸序列包括人SIRPα基因的外显子1-8中的一者或多者。在一些情况下,核酸序列也包括人SIRPα的基因组基因座的各个方面,例如内含子、3’和/或5’非翻译序列(UTR)。在一些情况下,核酸序列包括人SIRPα基因组基因座的整个区域。在一些情况下,核酸序列包括人SIRPα基因组基因座的外显子2-4。
在本申请的人源化SIRPα非人动物中,编码人SIRPα蛋白的核酸序列可操作地连接至SIRPα基因的一种或多种调控序列,例如非人动物的SIRPα基因的调控序列。非人动物(例如小鼠)SIRPα调控序列是非人动物SIRPα基因组基因座的调控非人动物SIRPα表达的那些序列,例如5’调控序列,例如SIRPα启动子、SIRPα5’非翻译区(UTR)等;3’调控序列,例如3’UTR;和增强子等。
“启动子”或“启动子序列”是指能够结合细胞中的RNA聚合酶并引发下游(3'方向)编码序列的转录的DNA调控区。启动子序列在它的3'末端由转录起始位点分界,并且在上游(5'方向)延伸以包括为引发在高于背景可加以检测的水平下转录所必需的最小数目的碱基或元件。在启动子序列内将发现转录起始位点,以及负责结合RNA聚合酶的蛋白质结合结构域。真核启动子将常常但不始终含有“TATA”框和“CAT”框。为本公开所特别关注的是促进人蛋白质以与将对于相应内源性蛋白质所观察相同的空间和时间表达样式(即在相同细胞和组织中以及在同时)转录的DNA调控元件,例如启动子。
小鼠SIRPα位于染色体2;NC_000068.7(129592606-129632228)上,并且小鼠SIRPα编码序列可以Genbank登录号NM_007547.4(亚型1)、NM_001177647.2(亚型2)、NM_001291019.1(亚型3)、NM_001291020.1(亚型3)、NM_001291021.1(亚型4)、NM_001291022.1(亚型5)得到。小鼠SIRPα的调控序列在本领域中被充分确定,并且可易于使用电子方法加以鉴定,例如通过在万维网上在UCSC基因组浏览器上查阅以上Genbank登录号,或通过如本领域中所述的实验方法。在一些情况下,例如当编码人SIRPα蛋白的核酸序列位于小鼠SIRPα基因组基因座处时,可操作地连接至人SIRPα编码序列的调控序列是小鼠基因组内源性或天然的,即它们在人核酸序列整合之前就存在于小鼠基因组中。
在一些情况下,通过将编码人SIRPα蛋白(包括如上所述的片段)的人核酸序列即“人SIRPα核酸序列”或“人SIRPα序列”随机整合至或插入基因组中来产生人源化SIRPα非人动物,例如小鼠。通常,在此类实施方案中,编码人SIRPα蛋白的核酸序列在基因组中的位置是未知的。在其它情况下,通过例如同源性重组将人SIRPα核酸序列靶向整合至或插入基因组中来产生人源化SIRPα非人动物。在同源性重组中,将多核苷酸插入宿主基因组中靶标基因座处,同时从所述靶标基因座移除宿主基因组物质,例如50个碱基对(bp)或更多、100bp或更多、200bp或更多、500bp或更多、1kB或更多、2kB或更多、5kB或更多、10kB或更多、15kB或更多、20kB或更多、或50kB或更多的基因组物质。因此,例如,在通过使人SIRPα核酸序列靶向小鼠SIRPα基因座来产生的包括编码人SIRPα蛋白的核酸序列的人源化SIRPα小鼠中,人SIRPα核酸序列可替换在SIRPα基因座处的一些或全部小鼠序列例如外显子和/或内含子。在一些所述情况下,将人SIRPα核酸序列整合至小鼠SIRPα基因座中以使人SIRPα序列的表达由小鼠SIRPα基因座处的天然或内源性调控序列调控。换句话说,编码人SIRPα蛋白的核酸序列所可操作地连接的调控序列是在小鼠SIRPα基因座处的天然SIRPα调控序列。
在一些情况下,人SIRPα序列的整合不影响所述人SIRPα序列已整合至其中的基因的转录。例如,如果人SIRPα序列作为内含肽(intein)整合至编码序列中,或人SIRPα序列包括2A肽,那么人SIRPα序列将与人SIRPα序列已整合至其中的基因同时转录和翻译。在其它情况下,人SIRPα序列的整合打断人SIRPα序列已整合至其中的基因的转录。例如,在通过同源性重组来整合人SIRPα序列后,在整合基因座处的一些或全部编码序列可被移除,以致改为人SIRPα序列被转录。在一些所述情况下,人SIRPα序列的整合产生无效突变,因此产生无效等位基因。无效等位基因是基因的完全缺乏那个基因的正常功能的突变拷贝。这可为在分子水平上完全不存在基因产物(蛋白质、RNA),或表达非功能性基因产物的结果。在表型水平上,无效等位基因不可与缺失整个基因座相区分。
在一些情况下,人源化SIRPα非人动物例如小鼠包括编码人SIRPα蛋白的核酸序列的一个拷贝。例如,非人动物就所述核酸序列而言可为杂合的。换句话说,在基因座处的一个等位基因将包括所述核酸序列,而另一等位基因将为内源性等位基因。例如,如上所讨论,在一些情况下,将人SIRPα核酸序列整合至非人动物(例如小鼠)SIRPα基因座中以使它产生非人动物SIRPα的无效等位基因。在一些所述实施方案中,人源化SIRPα非人动物就编码人SIRPα的核酸序列而言可为杂合的,即人源化SIRPα非人动物包括非人动物SIRPα的一个无效等位基因(包括所述核酸序列的等位基因)和一个内源性SIRPα等位基因(野生型或另外等位基因)。换句话说,非人动物是SIRPα
在一些实施方案中,人源化SIRPα非人动物例如小鼠包括其它遗传修饰。在一些实施方案中,人源化SIRPα非人动物是免疫受损动物。例如,人源化SIRPα非人动物可包括Rag2基因(“重组激活基因2”,其中小鼠基因的编码序列可以Genbank登录号NM_009020.3得到)的至少一个无效等位基因。在一些实施方案中,人源化SIRPα非人动物包括Rag2的两个无效等位基因。换句话说,人源化SIRPα非人动物就Rag2而言是纯合的。作为另一实例,人源化SIRPα非人动物包括IL2rg基因(“白介素2受体γ”,也称为共同γ链或γC,其中小鼠基因的编码序列可以Genbank登录号NM_013563.3得到)的至少一个无效等位基因。在一些实施方案中,人源化SIRPα非人动物包括IL2rg的两个无效等位基因。换句话说,人源化SIRPα非人动物就IL2rg而言是纯合无效的,即它为IL2rg
人源化IL-15非人动物
在本公开的一些方面,提供一种人源化IL-15非人动物。就人源化IL-15非人动物或“IL-15非人动物”来说,其意指包括编码人IL-15蛋白的核酸序列的非人动物。如本文所用,“人IL-15蛋白”意指是野生型(或天然)人IL-15蛋白或野生型(或天然)人IL-15蛋白的变体的蛋白质,所述变体保留野生型(或天然)人IL-15蛋白的一种或多种信号传导功能,例如其允许刺激人IL-15受体(或通过人IL-15受体进行信号传导),和/或其能够结合人IL-15受体的人IL-15受体α亚单位,和/或其能够结合IL-2Rβ/IL-15Rβ和共同γ链(γc)。也被术语“人IL-15蛋白”涵盖的是野生型人IL-15蛋白(或其变体)的保留野生型人IL-15蛋白的一种或多种信号传导功能的片段,例如人IL-15蛋白的片段,其允许刺激人IL-15受体(或通过人IL-15受体进行信号传导),和/或其能够结合人IL-15受体的人IL-15受体α亚单位,和/或其能够结合IL-2Rβ/IL-15Rβ和共同γ链(γc)。
术语“人IL-15蛋白”也涵盖包括野生型人IL-15蛋白(或其变体)的一个或多个片段,并且保留野生型人IL-15蛋白的一种或多种例如如上所述的信号传导功能的融合蛋白,即嵌合蛋白。包括野生型人IL-15蛋白(或其变体)的一个或多个片段的融合蛋白也可在本文中称为人源化IL-15蛋白。
因此,编码人IL-15蛋白的核酸序列是包括人IL-15蛋白的编码序列的多核苷酸,所述人IL-15蛋白即野生型人IL-15蛋白、野生型人IL-15蛋白的变体、野生型人IL-15蛋白(或其变体)的保留野生型人IL-15蛋白的一种或多种信号传导功能的片段、或包括野生型人IL-15蛋白(或其变体)的一个或多个片段,并且保留野生型人IL-15蛋白的一种或多种例如如上所述的信号传导功能的融合蛋白,即嵌合蛋白。
IL-15(也称为“白介素15”)是刺激T淋巴细胞的增殖的细胞因子。野生型人IL-15的多肽序列和编码野生型人IL-15的核酸序列可以Genbank登录号NM_000585.4;NP_000576.1(亚型1)、NM_172175.2;NP_751915.1(亚型2)得到。编码野生型人IL-15蛋白的基因组基因座可见于人基因组中染色体4;NC_000004.12(141636596-141733987)处。人IL-15基因座包括8个外显子,其中外显子3-8是编码外显子。因此,在一些实施方案中,包括人IL-15的编码序列的核酸序列包括人IL-15基因的外显子3-8中的一者或多者(即编码外显子1-6,参见图2)。例如,已鉴定通过以下外显子使用组合所产生的各种IL-15mRNA亚型:外显子1-2-3-4-5-6-7-8;外显子1-3-4-5-6-7-8或外显子1-3-4-(选择性外显子5)-5-6-7-8)。在一些情况下,核酸序列也包括人IL-15的基因组基因座的各个方面,例如内含子、3’和/或5’非翻译序列(UTR)。在一些情况下,核酸序列包括人IL-15基因组基因座的整个区域。在一些情况下,核酸序列包括人IL-15基因组基因座的外显子5-8(即编码外显子3-6)。
在一些情况下,根据本公开的人IL-15蛋白包括与SEQ ID NO:31具有至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、至少约99%或100%氨基酸序列同一性的氨基酸序列。
在本申请的人源化IL-15非人动物中,编码人IL-15蛋白的核酸序列可操作地连接至IL-15基因的一种或多种调控序列,例如非人动物的IL-15基因的调控序列。非人动物(例如小鼠)IL-15调控序列是非人动物IL-15基因组基因座的调控非人动物IL-15表达的那些序列,例如5’调控序列,例如IL-15启动子、IL-15 5’非翻译区(UTR)等;3’调控序列,例如3’UTR;和增强子等。小鼠IL-15位于染色体8,NC_000074.6(82331624-82403227,互补链)上,并且小鼠IL-15编码序列可以Genbank登录号NM_008357.2(变体1);NM_001254747.1(变体2)得到。小鼠IL-15的调控序列在本领域中被充分确定,并且可易于使用电子方法加以鉴定,例如通过在万维网上在genome.ucsc.edu处在UCSC基因组浏览器上查阅以上Genbank登录号,或通过如本领域中所述的实验方法。在一些情况下,例如当编码人IL-15蛋白的核酸序列位于小鼠IL-15基因组基因座时,可操作地连接至人IL-15编码序列的调控序列是小鼠基因组内源性或天然的,即它们在人核酸序列整合之前就存在于小鼠基因组中。
在一些情况下,通过将编码人IL-15蛋白(包括如上所述的片段)的人核酸序列即“人IL-15核酸序列”或“人IL-15序列”随机整合至或插入基因组中来产生人源化IL-15非人动物,例如小鼠。通常,在此类实施方案中,编码人IL-15蛋白的核酸序列在基因组中的位置是未知的。在其它情况下,通过例如同源性重组将人IL-15核酸序列靶向整合至或插入基因组中来产生人源化IL-15非人动物。在同源性重组中,将多核苷酸插入宿主基因组中靶标基因座处,同时从所述靶标基因座移除宿主基因组物质,例如50个碱基对(bp)或更多、100bp或更多、200bp或更多、500bp或更多、1kB或更多、2kB或更多、5kB或更多、10kB或更多、15kB或更多、20kB或更多、或50kB或更多的基因组物质。因此,例如,在通过使人IL-15核酸序列靶向小鼠IL-15基因座来产生的包括编码人IL-15蛋白的核酸序列的人源化IL-15小鼠中,人IL-15核酸序列可替换在IL-15基因座处的一些或全部小鼠序列例如外显子和/或内含子。在一些此类情况下,将人IL-15核酸序列整合至小鼠IL-15基因座中以使人IL-15序列的表达由小鼠IL-15基因座处的天然或内源性调控序列调控。换句话说,编码人IL-15蛋白的核酸序列所可操作地连接的调控序列是在小鼠IL-15基因座处的天然IL-15调控序列。
在一些情况下,人IL-15序列的整合不影响所述人IL-15序列已整合至其中的基因的转录。例如,如果人IL-15序列作为内含肽整合至编码序列中,或人IL-15序列包括2A肽,那么人IL-15序列将与人IL-15序列已整合至其中的基因同时转录和翻译。在其它情况下,人IL-15序列的整合打断人IL-15序列已整合至其中的基因的转录。例如,在通过同源性重组来整合人IL-15序列后,在整合基因座处的一些或全部编码序列可被移除,以致改为人IL-15序列被转录。在一些此类情况下,人IL-15序列的整合产生无效突变,因此产生无效等位基因。无效等位基因是基因的完全缺乏那个基因的正常功能的突变拷贝。这可为在分子水平上完全不存在基因产物(蛋白质、RNA),或表达非功能性基因产物的结果。在表型水平上,无效等位基因不可与缺失整个基因座相区分。
在一些情况下,人源化IL-15非人动物例如小鼠包括编码人IL-15蛋白的核酸序列的一个拷贝。例如,非人动物就所述核酸序列而言可为杂合的。换句话说,在基因座处的一个等位基因将包括所述核酸序列,而另一等位基因将为内源性等位基因。例如,如上所讨论,在一些情况下,将人IL-15核酸序列整合至非人动物(例如小鼠)IL-15基因座中以使它产生非人动物IL-15的无效等位基因。在一些所述实施方案中,人源化IL-15非人动物就编码人IL-15的核酸序列而言可为杂合的,即人源化IL-15非人动物包括非人动物IL-15的一个无效等位基因(包括所述核酸序列的等位基因)和一个内源性IL-15等位基因(野生型或另外等位基因)。换句话说,非人动物是IL-15
人源化SIRPα-IL-15非人动物
通过使如上所述的人源化IL-15非人动物与如上所述的相同物种的人源化SIRPα非人动物杂交,可产生表达人SIRPα与人IL-15两者的经遗传修饰的非人动物。在一些实施方案中,所述经遗传修饰的非人动物例如由于具有Rag2和IL2rg中的一者或两者的无效等位基因而就内源性免疫系统而言是缺陷的,例如免疫受损动物。例如,在一些实施方案中,根据本公开的非人动物为Rag2
在一些实施方案中,提供一种经遗传修饰的非人动物例如小鼠,其包括并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子;和并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白。
在一些实施方案中,SIRPα基因启动子是内源性非人SIRPα基因启动子。在一些所述实施方案中,SIRPα基因启动子是在非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。在另一实施方案中,SIRPα基因启动子是人SIRPα启动子。
在一些实施方案中,IL-15基因启动子是内源性非人IL-15基因启动子。在一些所述实施方案中,IL-15基因启动子是在非人动物IL-15基因座处的内源性非人IL-15基因启动子。在另一实施方案中,IL-15启动子是人IL-15启动子。
在一些实施方案中,如本文所述的经遗传修饰的非人动物在肝、肺、骨髓(BM)、小肠(SI)和结肠中表达人IL-15mRNA。
在一些实施方案中,在用人造血细胞例如CD45+细胞植入之后,相比于仅表达人SIRPα的经遗传修饰的非人动物例如小鼠,如本文所述的表达人SIRPα与人IL-15两者的经遗传修饰的非人动物例如小鼠展现更高百分比和数目的人T细胞和NK细胞。在一些实施方案中,如本文所述的表达人SIRPα与人IL-15两者的经遗传修饰的非人动物例如小鼠在血液和脾中展现更高百分比和数目的NK细胞。在一些实施方案中,在用人造血细胞例如CD45+细胞植入之后,如本文所述的表达人SIRPα与人IL-15两者的经遗传修饰的非人动物例如小鼠在血液、脾和肝中包括两个人NK细胞子组,即CD56
在一些实施方案中,在用人造血细胞例如CD45+细胞植入之后,相对于仅表达人SIRPα的经遗传修饰的非人动物例如小鼠,如本文所述的表达人SIRPα与人IL-15两者的经遗传修饰的非人动物例如小鼠在所述经遗传修饰的非人动物的肝中包括展现较高CD16和CD56表达水平的NK细胞,从而指示NK细胞成熟得以增加。
在一些实施方案中,如本文所述的表达人SIRPα与人IL-15两者,并且用人造血细胞例如CD45+细胞植入的经遗传修饰的非人动物例如小鼠在脾中包括NK细胞,所述NK细胞展现杀伤抑制性受体的不同表达水平,其中CD56
在一些实施方案中,相对于仅表达人SIRPα的经遗传修饰的非人动物例如小鼠,如本文所述的表达人SIRPα与人IL-15两者,并且用人造血细胞例如CD45+细胞植入的经遗传修饰的非人动物例如小鼠在上皮内淋巴细胞群体中展现较高频率的人CD45+和CD8+T细胞。在一些实施方案中,如本文所述的表达人SIRPα与人IL-15两者,并且用人造血细胞植入的经遗传修饰的非人动物例如小鼠展现CD16+NK细胞相对于CD16-NK细胞在IEL中的分布相当,以及相比于CD16-NK细胞,较多CD16+NK细胞处于血液和脾中,此反映正常人生理情况。
在一些实施方案中,相对于仅表达人SIRPα的经遗传修饰的非人动物例如小鼠,如本文所述的表达人SIRPα与人IL-15两者,并且用人造血细胞例如CD45+细胞植入的经遗传修饰的非人动物例如小鼠在肺中展现增加数目的人T细胞。在一些此类实施方案中,相对于仅表达人SIRPα的经遗传修饰的非人动物例如小鼠,这种经遗传修饰的非人动物例如小鼠在肺中在人CD8+T细胞上展现较高CD69表达水平。
在一些实施方案中,相对于仅表达人SIRPα的经遗传修饰的非人动物例如小鼠,如本文所述的表达人SIRPα与人IL-15两者,并且用人造血细胞例如CD45+细胞植入的经遗传修饰的非人动物例如小鼠在肝中在人CD8+T细胞上展现增加的CD69表达水平。
在一些实施方案中,如本文所述的表达人SIRPα与人IL-15两者,并且用人造血细胞植入的经遗传修饰的非人动物例如小鼠展现主要为人CD45+的可辨别派尔集合淋巴结。
任何非人哺乳动物都可根据本公开加以遗传修饰。非限制性实例包括实验室动物、家养动物、家畜等,例如诸如鼠科动物、啮齿动物、犬科动物、猫科动物、猪科动物、马科动物、牛科动物、羊科动物、非人灵长类动物等的物种;例如小鼠、大鼠、兔、仓鼠、豚鼠、牛、猪、绵羊、山羊和其它转基因动物物种,特别是哺乳动物物种,如本领域中所知。在其它实施方案中,非人动物可为例如鸡形目(Galliformes order)的鸟,诸如鸡、火鸡、鹌鹑、野鸡或鹧鸪;例如雁形目(Anseriformes order)的鸟,诸如鸭、鹅或天鹅;例如鸽形目(Columbiformes order)的鸟,诸如鸽或鸠。在各个实施方案中,主题经遗传修饰的动物是小鼠、大鼠或兔。
在一些实施方案中,非人动物是哺乳动物。在一些此类实施方案中,非人动物是例如跳鼠总科(Dipodoidea)或鼠总科(Muroidea)的小哺乳动物。在一个实施方案中,经遗传修饰的动物是啮齿动物。在一个实施方案中,啮齿动物选自小鼠、大鼠和仓鼠。在一个实施方案中,啮齿动物选自鼠总科。在一个实施方案中,经遗传修饰的动物来自选自以下的科:丽仓鼠科(Calomyscidae)(例如小鼠样仓鼠)、仓鼠科(Cricetidae)(例如仓鼠、新世界大鼠和小鼠、田鼠)、鼠科(真实小鼠和大鼠、沙鼠、有刺小鼠、冠毛大鼠(crested rat))、马岛鼠科(Nesomyidae)(攀登小鼠(climbing mice)、岩石小鼠(rock mice)、白尾大鼠、马达加斯加(Malagasy)大鼠和小鼠)、刺睡鼠科(Platacanthomyidae)(例如有刺睡鼠)和鼹形鼠科(Spalacidae)(例如鼹大鼠(mole rat)、竹大鼠(bamboo rat)和鼢鼠(zokor))。在一特定实施方案中,经遗传修饰的啮齿动物选自真实小鼠或大鼠(鼠科)、沙鼠、有刺小鼠和冠毛大鼠。
在一个实施方案中,主题经遗传修饰的非人动物是大鼠。在一个这样的实施方案中,大鼠选自Wistar大鼠、LEA品系、Sprague Dawley品系、Fischer品系、F344、F6和DarkAgouti。在另一实施方案中,大鼠品系是两个或更多个选自由以下组成的组的品系的混合:Wistar、LEA、Sprague Dawley、Fischer、F344、F6和Dark Agouti。
在另一实施方案中,主题经遗传修饰的非人动物是小鼠,例如C57BL品系的小鼠(例如C57BL/A、C57BL/An、C57BL/GrFa、C57BL/KaLwN、C57BL/6、C57BL/6J、C57BL/6ByJ、C57BL/6NJ、C57BL/10、C57BL/10ScSn、C57BL/10Cr、C57BL/Ola等);129品系的小鼠(例如129P1、129P2、129P3、129X1、129S1(例如129S1/SV、129S1/SvIm)、129S2、129S4、129S5、129S9/SvEvH、129S6(129/SvEvTac)、129S7、129S8、129T1、129T2);BALB品系的小鼠例如BALB/c;等。参见例如Festing等(1999)Mammalian Genome10:836,也参见Auerbach等(2000)Establishment and Chimera Analysis of 129/SvEv-and C57BL/6-DerivedMouse Embryonic Stem Cell Lines。在另一实施方案中,小鼠是以上提及的品系的混合。
在一些实施方案中,主题经遗传修饰的非人动物也是免疫缺陷的。“免疫缺陷”包括在动物的天然或内源性免疫系统的一个或多个方面具有缺陷,例如所述动物就一种或多种类型的功能性宿主免疫细胞而言是缺陷的,例如就非人B细胞数目和/或功能、非人T细胞数目和/或功能、非人NK细胞数目和/或功能等而言是缺陷的。
一种用以在主题动物中实现免疫缺陷的方法是亚致死性辐射。例如,新生经遗传修饰的小鼠幼仔可经亚致死性辐射,例如以4小时间隔采用2x 200cGy。或者,免疫缺陷可通过本领域中已知的许多基因突变中的任一者来实现,任何所述基因突变都可被单独或组合育种至本公开的主题经遗传修饰的非人动物中或可用作可将本公开的遗传修饰引入其中的干细胞的来源。非限制性实例包括与IL2rg基因突变相关,并且特征在于伴有淋巴细胞表型T(-)B(+)NK(-)的X染色体连锁的SCID;与Jak3基因突变相关,并且特征在于伴有淋巴细胞表型T(-)B(+)NK(-)的常染色体隐性SCID;特征在于伴有淋巴细胞表型T(-)B(-)NK(-)的ADA基因突变;特征在于伴有淋巴细胞表型T(-)B(+)NK(+)的IL-7Rα链突变;特征在于伴有淋巴细胞表型T(-)B(+)NK(+)的CD3δ或ε突变;特征在于伴有淋巴细胞表型T(-)B(-)NK(+)的RAG1和RAG2突变;特征在于伴有淋巴细胞表型T(-)B(-)NK(+)的Artemis基因突变、特征在于伴有淋巴细胞表型T(-)B(+)NK(+)的CD45基因突变;和特征在于伴有淋巴细胞表型T(-)、B(-)的Prkdcscid突变。因此,在一些实施方案中,经遗传修饰的免疫缺陷非人动物具有一个或多个选自IL2受体γ链(Il2rg
在一些实施方案中,根据本发明的经遗传修饰的非人动物适用作人造血细胞的接受者,其能够由植入的人造血细胞产生人免疫细胞。因此,在本发明的一些方面,主题经遗传修饰的动物是用人造血细胞植入的经遗传修饰的免疫缺陷非人动物。
对人源化SIRPα-IL-15非人动物的植入
如上所讨论,在本发明的一些方面,人源化SIRPα-IL-15非人动物,例如小鼠,例如Rag2
如本领域中所知或本文所述的任何人造血细胞、人造血干细胞(HSC)和/或造血干祖细胞(HSPC)的来源都可被移植入本公开的经遗传修饰的免疫缺陷非人动物中。本领域中已知的一种适合的人造血细胞来源是人脐带血细胞,特别是CD34阳性(CD34
细胞可来自任何哺乳动物物种例如鼠科动物、啮齿动物、犬科动物、猫科动物、马科动物、牛科动物、羊科动物、灵长类动物、人等。细胞可来自确定细胞系,或它们可为原代细胞,其中“原代细胞”、“原代细胞系”和“原代培养物”在本文中可互换用于指代已由受试者获得,并且使其在体外持续有限培养传代(即分裂)次数进行生长的细胞和细胞培养物。例如,原代培养物是可已传代0次、1次、2次、4次、5次、10次或15次,但非足以经历危机阶段的次数的培养物。通常,在体外持续少于10代维持本发明的原代细胞系。
如果细胞是原代细胞,那么它们可通过任何适宜方法从个体收集。例如,可通过分离方法(apheresis)、白细胞分离方法(leukocytapheresis)、密度梯度分离等来收集细胞,例如血细胞,例如白细胞。作为另一实例,可通过活检来收集细胞,例如皮肤、肌肉、骨髓、脾、肝、胰腺、肺、肠、胃组织等。适当溶液可用于分散或混悬所收集细胞。所述溶液将通常是与处于通常是5-25mM的低浓度下的可接受的缓冲剂联合,适宜地补充有胎牛血清或其它天然存在的因子的平衡盐溶液,例如标准盐水、PBS、汉克氏平衡盐溶液(Hank’sbalancedsalt solution)等。适宜缓冲剂包括HEPES、磷酸盐缓冲剂、乳酸盐缓冲剂等。
在一些情况下,异质细胞群体将被移植入人源化非人动物例如小鼠中。在其它情况下,富集特定类型的细胞例如祖细胞例如造血祖细胞的细胞群体将被植入人源化非人动物例如小鼠中。可通过任何适宜分离技术来富集目标细胞群体。例如,可通过培养方法来富集目标细胞。在此类培养方法中,通常向促进一个细胞群体超过其它细胞群体进行存活和/或增殖的培养基中添加特定生长因子和营养物。影响存活和/或增殖的其它培养条件包括在粘附或非粘附基质上生长,持续特定时长进行培养等。所述培养条件在本领域中是熟知的。作为另一实例,可通过亲和分离技术从初始群体分离目标细胞来富集目标细胞。亲和分离技术可包括使用涂布有亲和试剂的磁珠进行磁性分离、亲和色谱法、用连接于固体基质例如板的亲和试剂进行“淘选”、使用接合于亲和试剂或与亲和试剂联合使用的细胞毒性剂例如补体和细胞毒素,或其它适宜技术。提供准确分离的技术包括荧光激活细胞分选仪,其可具有不同精密化程度,诸如多色通道、低角度和钝角光散射检测通道、阻抗通道等。可通过采用与死细胞相关的染料(例如碘化丙锭)来相对于死细胞选择细胞。可采用不对目标细胞的活力过度有害的任何技术。
例如,使用亲和分离技术,不是供移植的目标细胞的细胞可通过使群体与亲和试剂接触来从群体消减,所述亲核试剂特异性识别和选择性结合不在目标细胞上表达的标志物。例如,为富集造血祖细胞的群体,可消减表达成熟造血细胞标志物的细胞。另外或替代地,可通过使群体与特异性识别和选择性结合与造血祖细胞相关的标志物例如CD34、CD133等的亲和试剂接触来进行正性选择和分离。就“选择性结合”来说,其意指分子优先结合目标靶标或结合靶标的亲和力大于结合其它分子的亲和力。例如,抗体将结合包括它对其具有特异性的表位的分子,而不结合无关表位。在一些实施方案中,亲和试剂可为抗体,即对CD34、CD133等具有特异性的抗体。在一些实施方案中,亲和试剂可为CD34、CD133等的特异性受体或配体,例如肽配体和受体;效应物和受体分子、对CD34、CD133等具有特异性的T细胞受体等。在一些实施方案中,可使用对目标标志物具有特异性的多种亲和试剂。
适用作亲和试剂的抗体和T细胞受体可为单克隆或多克隆的,并且可由转基因动物、经免疫动物、永生化人或动物B细胞、用编码抗体或T细胞受体的DNA载体转染的细胞等来产生。抗体制备和它们用作特异性结合成员的适合性的细节为本领域技术人员所熟知。特别关注的是使用经标记的抗体作为亲和试剂。适宜地,使这些抗体与供在分离中使用的标记缀合。标记包括允许达成直接分离的磁珠;可用结合于载体的亲和素或链霉亲和素移除的生物素;可与荧光激活细胞分选仪一起使用的荧光染料等以使对特定细胞类型的分离简易。适用的荧光染料包括藻胆蛋白(phycobiliprotein)例如藻红素(phycoerythrin)和别藻蓝蛋白(allophycocyanin)、荧光素(fluorescein)和德克萨斯红(Texas red)。各抗体经常用不同荧光染料标记以容许针对各标志物进行独立分选。
使初始细胞群体与亲和试剂接触,并且孵育一段足以结合可用细胞表面抗原的时期。孵育将通常是至少约5分钟,并且通常小于约60分钟。可合乎需要的是在反应混合物中具有足够抗体浓度,以使分离效率不受限于缺乏抗体。适当浓度通过滴定来确定,但将通常是抗体于细胞混悬液体积中的稀释度是约1:50(即1份抗体至50份反应体积中)、约1:100、约1:150、约1:200、约1:250、约1:500、约1:1000、约1:2000或约1:5000。细胞混悬于其中的介质将为维持细胞的活力的任何介质。一种优选介质是含有0.1至0.5% BSA或1-4%山羊血清的磷酸盐缓冲盐水。各种介质可商购获得,并且可根据细胞的性质加以使用,包括杜贝卡氏改良依格培养基(Dulbecco’s Modified Eagle Medium,dMEM)、汉克氏基础盐溶液(HBSS)、杜贝卡氏磷酸盐缓冲盐水(dPBS)、RPMI、伊斯科夫氏培养基(Iscove’smedium)、具有5mM EDTA的PBS等,经常补充有胎牛血清、BSA、HSA、山羊血清等。
通过例如如上所述或如本领域中所知的任何适宜亲和分离技术来选择经接触群体中变得由亲和试剂标记的细胞。在分离之后,可将经分离细胞收集在维持细胞的活力的任何适当介质中,通常在收集管的底部具有血清缓冲垫层。各种介质可商购获得,并且可根据细胞的性质加以使用,包括dMEM、HBSS、dPBS、RPMI、伊斯科夫氏培养基等,经常补充有胎牛血清。
以这个方式获得高度富含目标细胞类型例如造血细胞的组合物。细胞将占细胞组合物的约70%、约75%、约80%、约85%、约90%或更多、经富集细胞组合物的约95%或更多,并且将优选占经富集细胞组合物的约95%或更多。换句话说,组合物将为目标细胞的大致上纯净组合物。
待移植入人源化SIRPα-IL-15非人动物例如小鼠中的细胞无论它们是异质细胞群体抑或经富集细胞群体都可被立刻移植。或者,细胞可在液氮温度下冷冻,并且储存长久时期,被解冻并能够再次使用。在此类情况下,细胞将通常冷冻在10% DMSO、50%血清、40%缓冲介质或如本领域中通常用于在所述冷冻温度下保存细胞的一些其它此类溶液中,并且以如本领域中通常已知用于使冷冻培养细胞解冻的方式解冻。另外或替代地,细胞可在各种培养条件下体外培养。培养基可为液体或半固体,例如含有琼脂、甲基纤维素等。可将细胞群体适宜地混悬于适当营养培养基诸如伊斯科夫氏改良DMEM或RPMI-1640中,通常补充有胎牛血清(约5-10%)、L-谷氨酰胺、硫醇特别是2-巯基乙醇、以及抗生素例如青霉素和链霉素。培养物可含有细胞对其具有应答性的生长因子。如本文定义的生长因子是能够在培养中或在完整组织中通过对跨膜受体的特定作用来促进细胞的存活、生长和/或分化的分子。生长因子包括多肽和非多肽因子。
细胞在移植入SIRPα-IL-15非人动物例如小鼠中之前可被遗传修饰例如以提供可选择或可追踪标记,以在细胞中诱导遗传缺陷(例如用于疾病建模),在细胞中修复遗传缺陷或异位表达基因(例如用以确定所述修饰是否将影响疾病的过程)等。细胞可通过用适合载体转染或转导、同源性重组、或其它适当技术来遗传修饰,以使它们表达目标基因,或用反义mRNA、siRNA或核酶遗传修饰以阻断非所需基因的表达。本领域中已知用于将核酸引入靶细胞中的各种技术。为证明已对细胞进行遗传修饰,可采用各种技术。细胞的基因组可加以限定并在进行或不进行扩增下使用。聚合酶链式反应;凝胶电泳;限制分析;Southern、Northern和Western印迹;测序等全都可被采用。分子和细胞生物化学中用于本申请中公开的这些和其它目的的一般性方法可见于诸如以下的标准教科书中:Molecular Cloning:ALaboratory Manual,第3版(Sambrook等,Cold Spring Harbor Laboratory Press2001);Short Protocols in Molecular Biology,第4版(Ausubel等编,John Wiley&Sons1999);Protein Methods(Bollag等,John Wiley&Sons 1996);Nonviral Vectors forGene Therapy(Wagner等编,Academic Press 1999);Viral Vectors(Kaplift和Loewy编,Academic Press 1995);Immunology Methods Manual(I.Lefkovits编,Academic Press1997);以及Cell and Tissue Culture:Laboratory Procedures in Biotechnology(Doyle和Griffiths,John Wiley&Sons 1998),所述教科书的公开内容以引用的方式并入本文。本公开中提及的用于遗传操作的试剂、克隆载体和试剂盒可从商业供应商诸如BioRad、Stratagene、Invitrogen、Sigma-Aldrich和ClonTech获得。
可通过包括例如肝内注射、尾部静脉注射、眶后注射等的任何适宜方法将细胞移植于人源化SIRPα-IL-15非人动物例如小鼠中。通常,移植约0.5x 10
人源化SIRPα-IL-15非人动物例如小鼠和用人造血细胞植入,并且任选具有其它遗传修饰的人源化SIRPα-IL-15非人动物例如小鼠例如经植入Rag2
本公开提供出乎意料的结果证明用人造血细胞植入的人源化SIRPα-IL-15非人动物例如小鼠,例如经植入Rag2
因此,在一些实施方案中,本公开提供一种体内模型,包括经遗传修饰的非人动物,所述经遗传修饰的非人动物包括并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子。经遗传修饰的非人动物也包括并入经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子。最后,经遗传修饰的非人动物包括人造血细胞的植入物,其中经遗传修饰的非人动物(i)表达人SIRPα蛋白和人IL-15蛋白,并且(ii)在经遗传修饰的非人的肠中包括人组织驻留淋巴细胞例如上皮内淋巴细胞(IEL)。在一些此类实施方案中,经遗传修饰的非人动物被人病原体例如影响(例如通过感染)肠的人病原体感染。
可影响(例如通过感染)肠的人病原体包括但不限于空肠弯曲杆菌、艰难梭菌、粪肠球菌、屎肠球菌、大肠杆菌、人轮状病毒、单核细胞增多性李斯特菌、诺瓦克病毒、肠道沙门氏菌、福氏志贺氏菌、宋内氏志贺氏菌、痢疾志贺氏菌、鼠疫耶尔森氏菌、小肠结肠炎耶尔森氏菌和幽门螺杆菌。
在其它实施方案中,本公开提供一种体内模型,包括经遗传修饰的非人动物,所述经遗传修饰的非人动物包括并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子。经遗传修饰的非人动物也包括并入经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子。最后,经遗传修饰的非人动物包括人造血细胞的植入物,其中经遗传修饰的非人动物(i)表达人SIRPα蛋白和人IL-15蛋白,并且(ii)在经遗传修饰的非人的肺中包括人组织驻留淋巴细胞例如上皮内淋巴细胞(IEL)。在一些此类实施方案中,经遗传修饰的非人动物被人病原体例如影响(例如通过感染)肺的人病原体感染。
可影响(例如通过感染)肺的人病原体包括但不限于化脓性链球菌、流感嗜血杆菌、白喉棒杆菌、SARS冠状病毒、百日咳博德特氏菌、卡它莫拉氏菌、流感病毒(A、B、C)、冠状病毒、腺病毒、呼吸道合胞病毒、副流感病毒、腮腺炎病毒、肺炎链球菌、金黄色葡萄球菌、嗜肺军团菌、肺炎克雷伯氏菌、绿脓假单胞菌、肺炎支原体、结核分枝杆菌、肺炎衣原体、皮炎芽生菌、新型隐球菌和烟曲霉。
需要新治疗剂、新疫苗和测试治疗剂和疫苗的功效的新方式。支持高效人T细胞和NK细胞植入的非人动物例如小鼠例如将适用于鉴定特别针对感染人T细胞和/或NK细胞的人病原体的新治疗剂和新疫苗。可通过以下方式来在这种非人动物例如小鼠中测试新治疗剂和新疫苗:例如测定所述非人动物中(血液或给定组织中)响应于用推定抗病毒剂治疗所获得的人病原体例如病毒的量,或用推定疫苗接种所述小鼠,随后暴露于感染性施用的人病原体例如HIV,以及相较于未用所述疫苗接种,但被HIV感染的对照来观察归因于用所述推定疫苗接种的任何感染性变化。
病原体感染的所述非人动物(例如小鼠)模型适用于研究中,例如以更充分了解人感染的进展。感染的所述小鼠模型也适用于药物发现中,例如以鉴定针对感染进行保护或治疗感染的候选药剂。
本公开的经植入经遗传修饰的动物适用于筛选候选药剂以鉴定将治疗由人病原体例如靶向人T细胞和/或NK细胞的人病原体的感染的那些。术语“治疗(treat/treatment/treating)”等在本文中用于一般性包括获得所需药理和/或生理作用。作用就完全或部分预防疾病或其症状而言可为防治性的,和/或就部分或完全治愈疾病和/或可归因于疾病的不利影响而言可为治疗性的。如本文所用的“治疗”包括对哺乳动物的疾病的任何治疗,并且包括:(a)预防所述疾病在可易患所述疾病,但尚未被诊断为患有它的受试者中出现;(b)抑制所述疾病,即遏止它的发展;或(c)缓解所述疾病,即导致所述疾病的消退。
术语“个体”、“受试者”、“宿主”和“患者”在本文中可互换使用,并且包括需要诊断、治疗或疗法的任何哺乳动物受试者,特别是人。
用人造血细胞植入的人源化SIRPα-IL-15非人动物例如小鼠提供一种也适用于在体内针对其它所需活性筛选候选药剂的系统,例如筛选能够例如在健康或患病状态下调节(即促进或抑制)人T细胞和NK细胞的发育和/或活性的药剂,例如以鉴定新型治疗剂和/或产生对免疫系统的发育和功能的分子基础的更充分了解;对T细胞和/或NK细胞及其祖细胞有毒的药剂;以及防止、缓和或逆转毒性剂对T细胞、NK细胞及其祖细胞的毒性作用的药剂;介导NK细胞依赖性ADCC过程的抗体或抗原结合蛋白等。作为另一实例,本文所述的经遗传修饰的小鼠提供一种适用于预测个体对疾病疗法的响应性的系统,例如通过提供用于筛选个体的免疫系统对药剂例如治疗剂的响应性的体内平台以预测个体对那种药剂的响应性。
在生物活性剂的筛选测定中,使已用人造血细胞植入,并且在一些情况下被人病原体或待植入人源化SIRPα-IL-15非人动物例如小鼠中的细胞感染的人源化SIRPα-IL-15非人动物例如小鼠,例如经植入Rag2
参数是细胞的可定量组分,特别是可合乎需要地在高通量系统中被准确测量的组分。参数可为任何细胞组分或细胞产物,包括细胞表面决定簇、受体、蛋白质或其构象或翻译后修饰、脂质、碳水化合物、有机或无机分子、核酸例如mRNA、DNA等、或源于这种细胞组分的部分或其组合。尽管大多数参数将提供定量读数,但在一些情况下,半定量或定性结果将是可接受的。读数可包括单一测定值,或可包括平均值、中值或方差等。作为特征,将由许多相同测定获得各参数的一定范围的参数读数值。预期具有可变性,并且使用标准统计方法将获得一组测试参数中的各者的一定范围的值,其中常用统计方法用于提供单一值。
供筛选的候选目标药剂包括涵盖众多化学类别的已知和未知化合物,主要是可包括有机金属分子的有机分子、无机分子、基因序列、疫苗、抗生素或被怀疑具有抗生素性质的其它药剂、肽、多肽、抗体、抗原结合蛋白、已被核准供在人中进行药物使用的药剂等。本发明的一重要方面在于评估候选药物,包括毒性测试;等。
候选药剂包括有机分子,所述有机分子包括为结构相互作用特别是氢键合所必需的官能团,并且通常包括至少胺、羰基、羟基或羧基,经常包括至少两个官能性化学基团。候选药剂常常包括被一个或多个以上官能团取代的环状碳或杂环结构和/或芳族或多芳族结构。候选药剂也见于生物分子之中,包括肽、多核苷酸、糖、脂肪酸、类固醇、嘌呤、嘧啶、其衍生物、结构类似物或组合。包括药理活性药物、遗传活性分子等。目标化合物包括化学治疗剂、激素或激素拮抗剂等。适于本发明的药物制剂的实例是描述于"The PharmacologicalBasis of Therapeutics,"Goodman和Gilman,McGraw-Hill,New York,N.Y.,(1996),第9版中的那些。也包括毒素以及生物和化学战剂,例如参见Somani,S.M.(编),"ChemicalWarfare Agents,"Academic Press,New York,1992。
供筛选的候选目标药剂也包括核酸,例如编码siRNA、shRNA、反义分子或miRNA的核酸或编码多肽的核酸。适用于将核酸转移至靶细胞中的许多载体是可用的。载体可以游离体形式维持,例如呈质粒、小环DNA、病毒源性载体诸如巨细胞病毒、腺病毒等形式,或它们可通过同源性重组或随机整合被整合至靶细胞基因组中,例如逆转录病毒源性载体诸如MMLV、HIV-1、ALV等。可直接向主题细胞提供载体。换句话说,使多能细胞与包括目标核酸的载体接触以使载体由细胞摄取。
本领域中熟知用于使细胞例如培养的细胞或非人动物例如小鼠中的细胞与核酸载体接触的方法,诸如电穿孔、氯化钙转染和脂质体转染。或者,可通过病毒向细胞提供目标核酸。换句话说,使细胞与包括目标核酸的病毒粒子接触。逆转录病毒例如慢病毒特别适于本发明方法。通常使用的逆转录病毒载体是“缺陷的”,即不能产生为增殖性感染所需的病毒蛋白质。更确切来说,载体的复制需要在包装细胞系中生长。为产生包括目标核酸的病毒粒子,包括核酸的逆转录病毒核酸由包装细胞系包装至病毒衣壳中。不同包装细胞系提供待并入衣壳中的不同包膜蛋白,这种包膜蛋白决定病毒粒子对细胞的特异性。包膜蛋白具有至少三种类型,即亲嗜性、双嗜性和异嗜性。用亲嗜性包膜蛋白包装的逆转录病毒例如MMLV能够感染大多数鼠和大鼠细胞类型,并且通过使用亲嗜性包装细胞系诸如BOSC23(Pear等(1993)P.N.A.S.90:8392-8396)来产生。携带双嗜性包膜蛋白的逆转录病毒例如4070A(Danos等,上文)能够感染大多数哺乳动物细胞类型,包括人、狗和小鼠,并且通过使用双嗜性包装细胞系诸如PA12(Miller等(1985)Mol.Cell.Biol.5:431-437)、PA317(Miller等(1986)Mol.Cell.Biol.6:2895-2902);GRIP(Danos等(1988)PNAS 85:6460-6464)来产生。用异嗜性包膜蛋白例如AKR env包装的逆转录病毒能够感染除鼠细胞之外的大多数哺乳动物细胞类型。适当包装细胞系可用于确保目标细胞(在一些情况下是植入的细胞,在一些情况下是宿主即人源化SIRPα-IL-15宿主的细胞)由包装的病毒粒子所靶向。
用于向主题细胞提供目标核酸的载体将通常包括适于驱动目标核酸的表达(即转录激活)的启动子。这可包括遍在作用性启动子例如CMV-b-肌动蛋白启动子,或诱导性启动子诸如在特定细胞群体中具有活性或对药物诸如四环素的存在起响应的启动子。通过转录激活,意图靶细胞中转录将超过基础水平增加至少约10倍,至少约100倍,更通常至少约1000倍。此外,用于向主题细胞提供重新编程因子的载体可包括必须随后例如使用重组酶系统诸如Cre/Lox加以移除的基因,或表达它们的细胞例如通过包括允许达成选择性毒性的基因诸如疱疹病毒TK、bcl-xs等来破坏。
供筛选的候选目标药剂也包括多肽。此类多肽可任选融合于使产物的溶解性增加的多肽结构域。结构域可通过确定的蛋白酶裂解位点例如由TEV蛋白酶裂解的TEV序列来连接于多肽。接头也可包括一个或多个柔性序列,例如1至10个甘氨酸残基。在一些实施方案中,在维持产物的溶解性的缓冲液中,例如在0.5至2M尿素存在下,在使溶解性增加的多肽和/或多核苷酸存在下以及在类似条件下对融合蛋白进行裂解。目标结构域包括内体溶解性结构域例如流感HA结构域;和其它有助于产生的多肽例如IF2结构域、GST结构域、GRPE结构域等。另外或替代地,可配制所述多肽以达成稳定性改进。例如,可使肽聚乙二醇化,其中聚亚乙基氧基提供在血流中的寿命增加。可使多肽融合于另一多肽以提供附加功能性,例如以增加体内稳定性。通常,此类融合配偶体是稳定血浆蛋白,其可例如使多肽在以融合物形式存在时的体内血浆半衰期延长,特别是其中这种稳定血浆蛋白是免疫球蛋白恒定结构域。在大多数情况下,当稳定血浆蛋白通常以其中相同或不同多肽链通常以二硫键结合和/或非共价结合以形成装配多链多肽的多聚形式例如免疫球蛋白或脂蛋白存在时,含有多肽的本文融合物也将以与稳定血浆蛋白前体具有大致上相同结构的多聚体形式产生和采用。这些多聚体关于它们包括的多肽药剂将为同质的,或它们可含有超过一种多肽药剂。
候选多肽药剂可由真核细胞产生,或可由原核细胞产生。它可通过解折叠例如热变性、DTT还原等来进一步加工,并且可使用本领域中已知的方法来进一步再折叠。不改变一级序列的目标修饰包括对多肽的化学衍生化,例如酰化、乙酰化、羧化、酰胺化等。也包括糖基化修饰,例如通过在多肽合成和加工期间或在其它加工步骤中改变它的糖基化样式所达成的那些;例如通过使所述多肽暴露于影响糖基化的酶诸如哺乳动物糖基化酶或脱糖基化酶所达成的那些。也包括具有磷酸化氨基酸残基例如磷酸酪氨酸、磷酸丝氨酸或磷酸苏氨酸的序列。多肽可已使用普通分子生物学技术和合成化学来修饰以便改进它们对蛋白水解降解的抗性,或使溶解性质最优化,或致使它们更适合作为治疗剂。此类多肽的类似物包括含有除天然存在的L-氨基酸以外的残基例如D-氨基酸或非天然存在的合成氨基酸的那些。D-氨基酸可取代一些或全部氨基酸残基。
候选多肽药剂可使用如本领域中已知的常规方法通过体外合成制备。各种商业合成装置是可用的,例如Applied Biosystems,Inc.、Beckman等的自动合成仪。通过使用合成仪,天然存在的氨基酸可用非天然氨基酸取代。特定序列和制备方式将由便利性、经济因素、所需纯度等决定。或者,候选多肽药剂可根据常规重组合成方法分离和纯化。可制备表达宿主的溶解产物,并且使用HPLC、排阻色谱法、凝胶电泳、亲和色谱法或其它纯化技术纯化所述溶解产物。在很大程度上,相对于与产物的制备和它的纯化的方法相关的污染物,使用的组合物将包括至少20重量%的所需产物,更通常至少约75重量%,优选至少约95重量%,并且出于治疗目的,通常至少约99.5重量%。通常,百分比将基于总蛋白质。
在一些情况下,待筛选的候选多肽药剂是抗体或抗原结合蛋白。术语“抗体”或“抗体部分”意图包括具有与表位相配合并识别表位的特定形状的任何含有多肽链的分子结构,其中一种或多种非共价结合相互作用使分子结构与表位之间的复合物稳定。给定结构和它的特定表位的特异性或选择性配合有时被称为“锁和钥匙”配合。原型抗体分子是免疫球蛋白,并且来自所有来源例如人、啮齿动物、兔、母牛、绵羊、猪、狗、其它哺乳动物、鸡、其它鸟类等的所有类型的免疫球蛋白(IgG、IgM、IgA、IgE、IgD等)都被视为“抗体”。用于本发明中的抗体可为多克隆抗体或单克隆抗体。抗体通常被提供于在其中培养细胞的培养基中。除抗体之外,抗原结合蛋白涵盖也被设计以结合目标抗原,并且引发应答例如免疫反应的多肽。本领域中已知的抗原结合片段(包括例如Fab、Fab'、F(ab')2、Fabc和scFv)也被术语“抗原结合蛋白”涵盖。术语“抗体”和“抗原结合蛋白”也包括一种或多种可化学缀合于其它蛋白质或以与其它蛋白质的融合蛋白形式表达的免疫球蛋白链或片段、单链抗体和双特异性抗体。
候选药剂可从包括合成或天然化合物的文库的广泛多种来源获得。例如,众多手段可用于随机和定向合成包括生物分子的广泛多种有机化合物,所述手段包括使随机化寡核苷酸和寡肽表达。或者,呈细菌、真菌、植物和动物提取物形式的天然化合物的文库是可用的或易于产生。另外,天然或合成产生的文库和化合物易于通过常规化学、物理和生物化学手段来修饰,并且可用于产生组合文库。已知药理学药剂可经受定向或随机化学修饰,诸如酰化、烷基化、酯化、酰胺化等以产生结构类似物。
通过向至少一个并且通常多个样品施用药剂,有时与缺乏药剂的样品联合来针对生物活性筛选候选药剂。测量响应于药剂的参数变化,并且通过与参照培养物比较来评估结果,所述参照培养物例如存在和不存在药剂,用其它药剂获得,等。在其中进行筛选以鉴定将防止、缓和或逆转毒性剂的作用的候选药剂的情况下,通常在所述毒性剂存在下进行所述筛选,其中在最适合于待确定的结果的时间添加所述毒性剂。例如,在测试候选药剂的保护性/预防性能力的情况下,候选药剂可在毒性剂之前,与候选药剂同时,或在用候选药剂处理之后添加。作为另一实例,在其中测试候选药剂逆转毒性剂的作用的能力的情况下,候选药剂可在用候选药剂处理之后添加。如上所提及,在一些情况下,样品是已用细胞植入的人源化SIRPα-IL-15非人动物例如小鼠,即向已用细胞植入的人源化SIRPα-IL-15非人动物例如小鼠提供候选药剂。在一些情况下,样品是待植入的细胞,即在移植之前向细胞提供候选药剂。
如果候选药剂将直接向非人动物例如小鼠施用,那么药剂可通过本领域中用于施用肽、小分子和核酸的许多熟知方法中的任一者来施用。例如,药剂可口服、经粘膜、经表面、真皮内或通过注射(例如腹膜内、皮下、肌肉内、静脉内或颅内注射)等来施用。药剂可于缓冲液中加以施用,或它可例如通过与适当药学上可接受的媒介物组合来并入多种制剂中的任一者中。“药学上可接受的媒介物”可为由联邦政府或州政府的管理机构核准或列于美国药典或其它通常认可的药典中供在哺乳动物诸如人中使用的媒介物。术语“媒介物”是指本发明化合物与其一起配制来向哺乳动物施用的稀释剂、佐剂、赋形剂或载体。此类药物媒介物可为脂质,例如脂质体,例如脂质体树枝状聚合物;液体,诸如水和油,包括石油、动物、植物或合成来源的那些,诸如花生油、大豆油、矿物油、芝麻油等,盐水;阿拉伯胶、明胶、淀粉糊、滑石、角蛋白(keratin)、胶体二氧化硅、脲等。此外,可使用助剂、稳定剂、增稠剂、润滑剂和着色剂。可将药物组合物配制成呈固体、半固体、液体或气体形式的制剂,诸如片剂、胶囊、粉剂、颗粒剂、软膏剂、溶液、栓剂、注射液、吸入剂、凝胶剂、微球体和气雾剂。药剂在施用之后可为全身性的,或可通过使用区域性施用、器官壁内施用,或使用起在植入部位处维持活性剂量的作用的植入物而加以局部化。活性剂可被配制以达成立刻活性,或它可被配制以达成持续释放。对于一些病状,特别是中枢神经系统病状,可必要的是配制用以跨越血脑屏障(BBB)的药剂。一种用于穿过血脑屏障(BBB)递送药物的策略需要通过渗透手段诸如甘露糖醇或白三烯,或通过使用血管活性物质诸如舒缓激肽(bradykinin)以生物化学方式来破坏BBB。BBB破坏剂可在通过血管内注射来施用组合物时与药剂共同施用。其它用以穿过BBB的策略可需要使用内源性转运系统,包括窖蛋白-1(Caveolin-1)介导的胞吞转运、载体介导的转运体诸如葡萄糖和氨基酸载体、受体介导的胰岛素或转铁蛋白胞吞转运、以及主动流出转运体诸如p-糖蛋白。也可使主动转运部分缀合于治疗性化合物以在本发明中用于促进跨越血管的内皮壁进行转运。或者,对药剂进行药物递送以到达BBB背后可为通过局部递送,例如通过例如穿过奥马耶储囊(Ommaya reservoir)进行鞘内递送(参见例如美国专利号5,222,982和5,385,582,以引用的方式并入本文);通过团式注射,例如通过注射器,例如在玻璃体内或在颅内;通过连续输注,例如通过套管插入,例如采用对流(参见例如美国申请号20070254842,以引用的方式并入本文);或通过植入其上已可逆地固定有药剂的装置(参见例如美国申请号20080081064和20090196903,以引用的方式并入本文)达成的递送。
如果药剂在移植之前向细胞提供,那么药剂适宜地以溶液或可易于溶解形式添加至培养的细胞的培养基中。药剂可以间歇或连续液流形式添加在流通系统中,或者,向另外静态溶液中单一或递增添加化合物的团块。在流通系统中,使用两种流体,其中一种是生理中性溶液,并且另一种是添加有测试化合物的相同溶液。依次使第一流体和第二流体穿过细胞。在单溶液方法中,将测试化合物的团块添加至细胞周围的培养基的体积中。培养基的组分的总浓度不应随着添加团块,或在流通方法中在两种溶液之间显著变化。
多个测定可以不同药剂浓度并行操作以获得对各种浓度的差异性响应。如本领域中所知,确定药剂的有效浓度通常使用由1:10或其它对数标度稀释所产生的一定范围的浓度。必要时,浓度可用第二系列的稀释液进一步细化。通常,这些浓度中的一者充当阴性对照,即处于零浓度,或低于药剂的检测水平,或处于或低于药剂的不产生可检测表型变化的浓度。
可在用药剂治疗之后的任何时间对人源化SIRPα-IL-15非人动物例如小鼠中细胞对候选药剂的响应进行分析。例如,可在与候选药剂接触之后1、2或3天,有时4、5或6天,有时8、9或10天,有时14天,有时21天,有时28天,有时1个月或更久,例如2个月、4个月、6个月或更久分析细胞。在一些实施方案中,分析包括在多个时间点进行分析。对分析时间点的选择将基于待进行的分析的类型,如将易于由普通技术人员所了解的。
分析可包括测量本文所述或本领域中已知的用于度量细胞活力、细胞增殖、细胞身份、细胞形态和细胞功能的任何参数,特别是当它们可能涉及免疫系统的细胞例如T细胞和/或NK细胞时。例如,流式细胞术可用于测定造血细胞的总数或特定造血细胞类型的细胞的数目。可进行用以确定细胞的凋亡状态的组织化学或免疫组织化学分析,例如用以测量DNA片段化的末端脱氧核苷酰基转移酶dUTP切口末端标记(TUNEL),或用以检测膜联蛋白V与细胞表面上的磷脂酰丝氨酸的结合的免疫组织化学分析。流式细胞术也可用于评估分化的细胞和分化的细胞类型的比例,例如以确定在药剂存在下造血细胞进行分化的能力。可进行ELISA、Western和Northern印迹以测定在经植入人源化SIRPα-IL-15非人动物例如小鼠中表达的细胞因子、趋化因子、免疫球蛋白等的水平例如以评估植入的细胞的功能。也可进行用以测试免疫细胞的功能的体内测定,以及与特定目标疾病或病症诸如糖尿病、自体免疫疾病、移植物抗宿主疾病、AMD等相关的测定。参见例如Current Protocols inImmunology(Richard Coico编John Wiley&Sons,Inc.2012)以及Immunology MethodsManual(I.Lefkovits编,Academic Press 1997),其公开内容以引用的方式并入本文。
因此,例如,提供一种用于确定药剂对人病原体的作用的方法,包括使经植入人源化SIRPα-IL-15非人动物例如小鼠例如经植入Rag
作为另一实例,提供一种用于确定目标病原体分离株或株系是否具有药物抗性例如多药物抗性的方法。在这些方法中,使经植入人源化SIRPα-IL-15非人动物例如小鼠例如经植入Rag2
此外,人源化SIRPα-IL-15非人动物(例如小鼠)和用人造血细胞植入,并且任选具有其它遗传修饰的人源化SIRPα-IL-15非人动物(例如小鼠),例如经植入Rag2
广泛已知的是单克隆抗体疗法背后的一种机理是它通过结合NK细胞Fc受体CD16(Fcγ受体IIIA)来激活NK细胞。已试图使各种已知单克隆候选物(例如利妥昔单抗(rituximab))对FcγRIIIA的亲和力增加以改进ADCC(例如Bowles等Blood 2006;108:2648-2654;Garff-Tavernier等Leukemia 2011;25:202-209)。如本文所证明,人源化SIRPα-IL-15经植入非人动物产生能够介导ADCC的人NK细胞;因此,这些动物呈现一种适用于研究ADCC机理以及筛选各种治疗性候选物的体内模型。
因此,经植入人源化SIRPα-IL-15非人动物和由其分离的细胞例如人NK细胞可用于筛选方法中,所述筛选方法被设计来鉴定使人源化非人动物中植入的细胞类型或细胞例如人NK细胞的抗体依赖性细胞性细胞毒性(ADCC)活性改进的药剂。例如,适合方法可包括向经植入人源化SIRPα-IL-15非人动物施用药剂,以及确定所述药剂对人源化非人动物中植入的细胞类型的抗体依赖性细胞性细胞毒性(ADCC)活性的体内影响。在一个实施方案中,所述影响导致例如对移植肿瘤,例如对人肿瘤的肿瘤杀伤改进。在另一实施方案中,所述影响导致对受感染细胞例如受病毒感染细胞或受细菌感染细胞的杀伤改进。在另一实施方案中,所述影响导致对细菌、真菌或寄生虫的杀伤改进。在各个实施方案中,药剂是抗体或抗原结合蛋白。在一些实施方案中,抗体或抗原结合蛋白被设计以靶向在人肿瘤细胞上表达的抗原。在一些实施方案中,抗体或抗原结合蛋白被设计以靶向在受病毒感染细胞或受细菌感染细胞上表达的抗原。在一些实施方案中,抗体或抗原结合蛋白被设计以靶向细菌、真菌或寄生物抗原。在一些实施方案中,提供一种体外方法,其中从经植入人源化SIRPα-IL-15非人动物分离人细胞例如人NK细胞,并且在体外与药剂诸如抗体或抗原结合蛋白和靶细胞(例如肿瘤细胞)接触以确定所述药剂在介导对所述靶细胞的杀伤方面的功效。可接着确定药剂对人细胞例如人NK细胞的细胞溶解活性的影响。
在本文中其它地方提供主题小鼠的用途的其它实例。本公开中描述的经遗传修饰和经植入小鼠的额外应用将为本领域技术人员在阅读本公开后显而易知。
制备主题经遗传修饰的非人动物的方法
在本发明的一些方面,提供用于制备本公开的主题非人动物的方法。在实施主题方法时,产生一种非人动物,其包括并入经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子例如内源性非人SIRPα基因启动子;和并入经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子例如内源性非人IL-15基因启动子。
可使用例如如本领域中所知或如本文所述的用于制备经遗传修饰的动物的任何适宜方法实现非人动物的产生,所述非人动物包括编码人SIRPα蛋白并且可操作地连接至SIRPα启动子的核酸序列,和/或编码人IL-15蛋白并且可操作地连接至IL-15基因启动子的核酸序列。
例如,可将编码人SIRPα蛋白或人IL-15蛋白的核酸并入重组载体中,所述重组载体呈适于插入宿主细胞的基因组中,并且在非人宿主细胞中表达人蛋白质的形式。在各个实施方案中,重组载体包括一种或多种如上所述的调控序列,所述调控序列以允许核酸转录成mRNA以及mRNA翻译成人蛋白质的方式操作性地连接于编码人蛋白质的核酸。应了解对载体的设计可取决于诸如对待转染的宿主细胞的选择和/或待表达的人蛋白质的量的因素。
各种方法中的任一者可接着用于将人核酸序列引入动物细胞中以产生表达人基因的经遗传修饰的动物。此类技术在本领域中是熟知的,并且包括但不限于原核显微注射、胚胎干细胞转化、同源性重组和敲入技术。用于产生可使用的经遗传修饰的动物的方法包括但不限于Sundberg和Ichiki(2006,Genetically Engineered Mice Handbook,CRCPress)、Hofker和van Deursen(2002,Genetically modified Mouse Methods andProtocols,Humana Press)、Joyner(2000,Gene Targeting:A Practical Approach,Oxford University Press)、Turksen(2002,Embryonic stem cells:Methods andProtocols in Methods Mol Biol.,Humana Press)、Meyer等(2010,Proc.Nat.Acad.Sci.USA107:15022-15026)以及Gibson(2004,A Primer of GenomeScience第2版Sunderland,Massachusetts:Sinauer)、美国专利号6,586,251、Rathinam等(2011,Blood 118:3119-28)、Willinger等(2011,Proc Natl Acad Sci USA,108:2390-2395)、Rongvaux等(2011,Proc Natl Acad Sci USA,108:2378-83)和Valenzuela等(2003,Nat Biot 21:652-659)中描述的那些。
例如,可例如通过显微注射将编码人蛋白质的核酸引入卵母细胞中,以及使所述卵母细胞在雌性养育动物中发育来产生主题经遗传修饰的动物。在优选实施方案中,将核酸注射至受精卵母细胞中。受精卵母细胞可在交配次日从超排卵雌性收集,并且注射表达构建体。将经注射卵母细胞培养过夜或直接转移至性交后(p.c.)0.5天假妊娠雌性的输卵管中。用于超排卵、收集卵母细胞、表达构建体注射和胚胎转移的方法在本领域中是已知的,并且描述于Manipulating the Mouse Embryo(2002,A Laboratory Manual,第3版,Cold Spring Harbor Laboratory Press)中。可通过DNA分析(例如PCR、Southern印迹、DNA测序等)或通过蛋白质分析(例如ELISA、Western印迹等)来评估后代中所引入核酸的存在性。
作为另一实例,可使用熟知方法诸如电穿孔、磷酸钙沉淀、脂质体转染等将包括编码人蛋白质的核酸序列的构建体转染至干细胞(例如ES细胞或iPS细胞)中。可通过DNA分析(例如PCR、Southern印迹、DNA测序等)或通过蛋白质分析(例如ELISA、Western印迹等)来评估细胞中所引入核酸的存在性。可接着将被确定已并有表达构建体的细胞引入植入前胚胎中。对于本领域中已知的适用于本发明的组合物和方法的方法的详细描述,参见Nagy等(2002,Manipulating the Mouse Embryo:A Laboratory Manual,第3版,Cold SpringHarbor Laboratory Press)、Nagy等(1990,Development 110:815-821)、美国专利号7,576,259、美国专利号7,659,442、美国专利号7,294,754以及Kraus等(2010,Genesis 48:394-399)。
在一个优选实施方案中,一种产生本文所述的经遗传修饰的动物的方法利用使用
可使经遗传修饰的首建动物(founder)与携带遗传修饰的额外动物交配。例如,可使人源化SIRPα非人动物与相同物种的人源化IL-15非人动物交配以产生本文所述的hSIRPα-hIL-15非人动物。可进一步使携带编码本公开的人蛋白质的核酸的经遗传修饰的动物与敲除动物交配,所述敲除动物例如就一种或多种蛋白质而言是缺陷的,例如不表达它的一种或多种基因的非人动物,例如Rag2缺陷动物和/或Il2rg缺陷动物。
如上所讨论,在一些实施方案中,主题经遗传修饰的非人动物是免疫缺陷动物。可使用例如如本领域中所知或如本文所述的用于产生经遗传修饰的动物的任何适宜方法产生具有免疫缺陷,并且包括一种或多种人蛋白质例如hSIRPα和/或hIL-15的经遗传修饰的非人动物。例如,可通过以下方式来实现经遗传修饰的免疫缺陷动物的产生:将编码人蛋白质的核酸引入包括在纯合时将导致免疫缺陷的突变SCID基因等位基因的卵母细胞或干细胞中,如以上以及本文工作实施例中更详细所述。接着使用例如本文所述和本领域中已知的方法,用经修饰卵母细胞或ES细胞产生小鼠,并且交配以产生包括所需遗传修饰的免疫缺陷小鼠。作为另一实例,可在免疫活性背景下产生经遗传修饰的非人动物,并且与包括在半合或纯合时将导致免疫缺陷的突变基因等位基因的动物杂交,并且使子代交配以产生表达至少一种目标人蛋白质的免疫缺陷动物。
在一些实施方案中,处理经遗传修饰的非人动物以便消除可存在于经遗传修饰的非人动物中的内源性造血细胞。在一个实施方案中,处理包括对经遗传修饰的非人动物进行照射。在一特定实施方案中,新生经遗传修饰的小鼠幼仔经亚致死性辐射。在一特定实施方案中,新生幼仔以4小时间隔用2x 200cGy照射。
本发明的各个实施方案提供在它们的大致上全部细胞中包括人核酸的经遗传修饰的动物,以及在它们的一些而非全部细胞中包括人核酸的经遗传修饰的动物。在一些情况下,例如在靶向重组的情况下,人核酸的一个拷贝将被整合至经遗传修饰的动物的基因组中。在其它情况下,例如在随机整合的情况下,人核酸的彼此邻近或疏远的多个拷贝可被整合至经遗传修饰的动物的基因组中。
因此,在一些实施方案中,主题经遗传修饰的非人动物可为包括以下基因组的免疫缺陷动物:所述基因组包括编码人多肽的可操作地连接至相应非人动物启动子的核酸,其中所述动物表达所编码的人多肽。换句话说,主题经遗传修饰的免疫缺陷非人动物包括以下基因组:所述基因组包括编码至少一种人多肽的核酸,其中所述核酸可操作地连接至相应非人启动子和多聚腺苷酸化信号,并且其中所述动物表达所编码的人多肽。
试剂、装置和试剂盒
也提供用于实施一种或多种上述方法的试剂、装置及其试剂盒。主题试剂、装置及其试剂盒可极大变化。
在一些实施方案中,试剂或试剂盒将包括一种或多种用于本文所述的方法中的试剂。例如,试剂盒可包括人源化SIRPα-IL-15非人动物,例如小鼠,例如Rag2
除以上组成部分之外,主题试剂盒将进一步包括用于实施主题方法的说明书。这些说明书可以多种形式存在于主题试剂盒中,所述形式中的一者或多者可存在于试剂盒中。这些说明书可存在所采用的一种形式是呈在适合介质或基底(例如一张或多张其上印刷有信息的纸)上,在试剂盒的包装中,在包装插页中等等的印刷信息形式。另一手段将为其上已记录信息的计算机可读介质,例如磁盘、CD等。可存在的另一手段是可通过因特网用于在远地获取信息的网站地址。任何适宜手段都可存在于试剂盒中。
本公开的示例性非限制性方面
上述本发明主题的包括各个实施方案的各个方面可在单独或与一个或多个其它方面或实施方案组合的情况下是有益的。在不限制先前描述的情况下,以下提供本公开的编号为1-167的某些非限制性方面。如将为本领域技术人员在阅读本公开后显而易知,各个别编号的方面可与任何之前或之后个别编号的方面一起使用或组合。这意图为各个方面的所有此类组合提供支持,并且不限于以下明确提供的方面的组合:
1.一种经遗传修饰的非人动物,其包含:
并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子;和
并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白。
2.根据1的经遗传修饰的非人动物,其中所述SIRPα基因启动子是内源性非人SIRPα基因启动子。
3.根据2的经遗传修饰的非人动物,其中所述SIRPα基因启动子是在所述非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。
4.根据3的经遗传修饰的非人动物,其包含在所述非人动物SIRPα基因座处非人SIRPα基因中的无效突变。
5.根据4的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物是小鼠,并且所述无效突变是至少小鼠SIRPα外显子2-4的缺失。
6.根据4的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物就包含编码所述人SIRPα蛋白的所述核酸序列的等位基因而言是杂合的。
7.根据4的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物就包含编码所述人SIRPα蛋白的所述核酸序列的等位基因而言是纯合的。
8.根据1-7中任一项的经遗传修饰的非人动物,其中编码所述人SIRPα蛋白的所述核酸序列包含人SIRPα基因组编码序列和非编码序列。
9.根据1-8中任一项的经遗传修饰的非人动物,其中所述人SIRPα蛋白是全长人SIRPα蛋白的功能性片段。
10.根据9的经遗传修饰的非人动物,其中所述功能性片段包括人SIRPα的细胞外结构域。
11.根据10的经遗传修饰的非人动物,其中所述细胞外结构域包含SEQ ID NO:12的氨基酸28-362。
12.根据1-11中任一项的经遗传修饰的非人动物,其中所述IL-15基因启动子是内源性非人IL-15基因启动子。
13.根据12的经遗传修饰的非人动物,其中所述IL-15基因启动子是在所述非人动物IL-15基因座处的内源性非人IL-15基因启动子。
14.根据13的经遗传修饰的非人动物,其包含在所述非人动物IL-15基因座处非人IL-15基因中的无效突变。
15.根据14的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物是小鼠,并且所述无效突变是至少小鼠IL-15外显子5-8的缺失。
16.根据14的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物就包含编码所述人IL-15蛋白的所述核酸序列的等位基因而言是杂合的。
17.根据14的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物就包含编码所述人IL-15蛋白的所述核酸序列的等位基因而言是纯合的。
18.根据1-17中任一项的经遗传修饰的非人动物,其中编码所述人IL-15蛋白的所述核酸序列包含人IL-15基因组编码序列和非编码序列。
19.根据1-18中任一项的经遗传修饰的非人动物,其中所述人IL-15蛋白是全长人IL-15蛋白的功能性片段。
20.根据1-19中任一项的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物是免疫缺陷的。
21.根据20的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物包含Rag2基因敲除。
22.根据20或21的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物包含IL2rg基因敲除。
23.根据1-22中任一项的经遗传修饰的非人动物,其中所述非人动物是哺乳动物。
24.根据23的经遗传修饰的非人动物,其中所述哺乳动物是啮齿动物。
25.根据24的经遗传修饰的非人动物,其中所述啮齿动物是小鼠。
26.根据1-25中任一项的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物包含人造血细胞的植入物。
27.根据26的经遗传修饰的非人动物,其中所述经遗传修饰的非人动物包含被人病原体的感染。
28.根据27的经遗传修饰的非人动物,其中所述人病原体激活、诱导和/或靶向T细胞和/或自然杀伤(NK)细胞。
29.根据27的经遗传修饰的非人动物,其中所述人病原体是感染人肠的病原体。
30.根据29的经遗传修饰的非人动物,其中所述人病原体是人轮状病毒。
31.根据27的经遗传修饰的非人动物,其中所述病原体感染人肺。
32.根据31的经遗传修饰的非人动物,其中所述人病原体是流感病毒。
33.一种动物植入模型,其包括经遗传修饰的非人动物,所述经遗传修饰的非人动物包含:
并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子;
并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子;和
人造血细胞的植入物,其中所述经遗传修饰的非人动物(i)表达所述人SIRPα蛋白和所述人IL-15蛋白,并且(ii)包含在所述经遗传修饰的非人动物的小肠和派尔集合淋巴结中的人上皮内淋巴细胞(IEL)。
34.根据33的模型,其中所述经遗传修饰的非人动物包含被人病原体的感染。
35.根据34的模型,其中所述人病原体是肠病原体。
36.根据35的模型,其中所述肠病原体选自:空肠弯曲杆菌、艰难梭菌、粪肠球菌、屎肠球菌、大肠杆菌、人轮状病毒、单核细胞增多性李斯特菌、诺瓦克病毒、肠道沙门氏菌、福氏志贺氏菌、宋内氏志贺氏菌、痢疾志贺氏菌、鼠疫耶尔森氏菌、小肠结肠炎耶尔森氏菌和幽门螺杆菌。
37.根据33-36中任一项的模型,其中所述SIRPα基因启动子是内源性非人SIRPα基因启动子。
38.根据37的模型,其中所述SIRPα基因启动子是在所述非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。
39.根据38的模型,其中所述经遗传修饰的非人动物在所述非人动物SIRPα基因座处在非人SIRPα基因中包含无效突变。
40.根据39的模型,其中所述经遗传修饰的非人动物是小鼠,并且所述无效突变是至少小鼠SIRPα外显子2-4的缺失。
41.根据39的模型,其中所述经遗传修饰的非人动物就包含编码所述人SIRPα蛋白的所述核酸序列的等位基因而言是杂合的。
42.根据39的模型,其中所述经遗传修饰的非人动物就包含编码所述人SIRPα蛋白的所述核酸序列的等位基因而言是纯合的。
43.根据33-42中任一项的模型,其中编码所述人SIRPα蛋白的所述核酸序列包含人SIRPα基因组编码序列和非编码序列。
44.根据33-43中任一项的模型,其中所述人SIRPα蛋白是全长人SIRPα蛋白的功能性片段。
45.根据44的模型,其中所述功能性片段包括人SIRPα的细胞外结构域。
46.根据45的模型,其中所述细胞外结构域包含SEQ ID NO:12的氨基酸28-362。
47.根据33-46中任一项的模型,其中所述IL-15基因启动子是内源性非人IL-15基因启动子。
48.根据47的模型,其中所述IL-15基因启动子是在所述非人动物IL-15基因座处的内源性非人IL-15基因启动子。
49.根据48的模型,其中所述经遗传修饰的非人动物在所述非人动物IL-15基因座处在非人IL-15基因中包含无效突变。
50.根据49的模型,其中所述经遗传修饰的非人动物是小鼠,并且所述无效突变是至少小鼠IL-15外显子5-8的缺失。
51.根据48的模型,其中所述经遗传修饰的非人动物就包含编码所述人IL-15蛋白的所述核酸序列的等位基因而言是杂合的。
52.根据48的模型,其中所述经遗传修饰的非人动物就包含编码所述人IL-15蛋白的所述核酸序列的等位基因而言是纯合的。
53.根据33-52中任一项的模型,其中编码所述人IL-15蛋白的所述核酸序列包含人IL-15基因组编码序列和非编码序列。
54.根据33-53中任一项的模型,其中所述人IL-15蛋白是全长人IL-15蛋白的功能性片段。
55.根据33-54中任一项的模型,其中所述经遗传修饰的非人动物是免疫缺陷的。
56.根据55的模型,其中所述经遗传修饰的非人动物包含Rag2基因敲除。
57.根据55或56的模型,其中所述经遗传修饰的非人动物包含IL2rg基因敲除。
58.根据33-57中任一项的模型,其中所述非人动物是哺乳动物。
59.根据58的模型,其中所述哺乳动物是啮齿动物。
60.根据59的模型,其中所述啮齿动物是小鼠。
61.一种动物植入模型,其包括经遗传修饰的非人动物,所述经遗传修饰的非人动物包含:
并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子;
并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子;和
人造血细胞的植入物,其中所述经遗传修饰的非人动物(i)表达所述人SIRPα蛋白和所述人IL-15蛋白,并且(ii)包含在所述经遗传修饰的非人动物的肺中的人上皮内淋巴细胞(IEL)。
62.根据61的模型,其中所述经遗传修饰的非人动物包含被人病原体的感染。
63.根据62的模型,其中所述人病原体是肺病原体。
64.根据63的模型,其中所述肺病原体选自:化脓性链球菌、流感嗜血杆菌、白喉棒杆菌、SARS冠状病毒、百日咳博德特氏菌、卡它莫拉氏菌、流感病毒(A、B、C)、冠状病毒、腺病毒、呼吸道合胞病毒、副流感病毒、腮腺炎病毒、肺炎链球菌、金黄色葡萄球菌、嗜肺军团菌、肺炎克雷伯氏菌、绿脓假单胞菌、肺炎支原体、结核分枝杆菌、肺炎衣原体、皮炎芽生菌、新型隐球菌和烟曲霉。
65.根据61-64中任一项的模型,其中所述SIRPα基因启动子是内源性非人SIRPα基因启动子。
66.根据65的模型,其中所述SIRPα基因启动子是在所述非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。
67.根据66的模型,其中所述经遗传修饰的非人动物在所述非人动物SIRPα基因座处在非人SIRPα基因中包含无效突变。
68.根据67的模型,其中所述经遗传修饰的非人动物是小鼠,并且所述无效突变是至少小鼠SIRPα外显子2-4的缺失。
69.根据67的模型,其中所述经遗传修饰的非人动物就包含编码所述人SIRPα蛋白的所述核酸序列的等位基因而言是杂合的。
70.根据67的模型,其中所述经遗传修饰的非人动物就包含编码所述人SIRPα蛋白的所述核酸序列的等位基因而言是纯合的。
71.根据61-70中任一项的模型,其中编码所述人SIRPα蛋白的所述核酸序列包含人SIRPα基因组编码序列和非编码序列。
72.根据61-71中任一项的模型,其中所述人SIRPα蛋白是全长人SIRPα蛋白的功能性片段。
73.根据72的模型,其中所述功能性片段包括人SIRPα的细胞外结构域。
74.根据73的模型,其中所述细胞外结构域包含SEQ ID NO:12的氨基酸28-362。
75.根据61-74中任一项的模型,其中所述IL-15基因启动子是内源性非人IL-15基因启动子。
76.根据75的模型,其中所述IL-15基因启动子是在所述非人动物IL-15基因座处的内源性非人IL-15基因启动子。
77.根据76的模型,其中所述经遗传修饰的非人动物在所述非人动物IL-15基因座处在非人IL-15基因中包含无效突变。
78.根据77的模型,其中所述经遗传修饰的非人动物是小鼠,并且所述无效突变是至少小鼠IL-15外显子5-8的缺失。
79.根据77的模型,其中所述经遗传修饰的非人动物就包含编码所述人IL-15蛋白的所述核酸序列的等位基因而言是杂合的。
80.根据77的模型,其中所述经遗传修饰的非人动物就包含编码所述人IL-15蛋白的所述核酸序列的等位基因而言是纯合的。
81.根据61-80中任一项的模型,其中编码所述人IL-15蛋白的所述核酸序列包含人IL-15基因组编码序列和非编码序列。
82.根据61-80中任一项的模型,其中所述人IL-15蛋白是全长人IL-15蛋白的功能性片段。
83.根据61-82中任一项的模型,其中所述经遗传修饰的非人动物是免疫缺陷的。
84.根据83的模型,其中所述经遗传修饰的非人动物包含Rag2基因敲除。
85.根据83或84的模型,其中所述经遗传修饰的非人动物包含IL2rg基因敲除。
86.根据61-85中任一项的模型,其中所述非人动物是哺乳动物。
87.根据86的模型,其中所述哺乳动物是啮齿动物。
88.根据87的模型,其中所述啮齿动物是小鼠。
89.一种确定候选T细胞诱导疫苗的功效的方法,所述方法包括:
向经遗传修饰的非人动物施用候选T细胞诱导疫苗,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包含:
(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,
(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,和
(iii)人造血细胞的植入物,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;
用人病原体激发所述经遗传修饰的非人动物;以及
确定所述候选T细胞诱导疫苗是否在所述经遗传修饰的非人动物中诱导T细胞介导的免疫应答。
90.根据89的方法,其中所述SIRPα基因启动子是内源性非人SIRPα基因启动子。
91.根据90的方法,其中所述SIRPα基因启动子是在所述非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。
92.根据91的方法,其中所述经遗传修饰的非人动物在所述非人动物SIRPα基因座处在非人SIRPα基因中包含无效突变。
93.根据92的方法,其中所述经遗传修饰的非人动物是小鼠,并且所述无效突变是至少小鼠SIRPα外显子2-4的缺失。
94.根据92的方法,其中所述经遗传修饰的非人动物就包含编码所述人SIRPα蛋白的所述核酸序列的等位基因而言是杂合的。
95.根据92的方法,其中所述经遗传修饰的非人动物就包含编码所述人SIRPα蛋白的所述核酸序列的等位基因而言是纯合的。
96.根据89-95中任一项的方法,其中编码所述人SIRPα蛋白的所述核酸序列包含人SIRPα基因组编码序列和非编码序列。
97.根据89-96中任一项的方法,其中所述人SIRPα蛋白是全长人SIRPα蛋白的功能性片段。
98.根据97的方法,其中所述功能性片段包括人SIRPα的细胞外结构域。
99.根据98的方法,其中所述细胞外结构域包含SEQ ID NO:12的氨基酸28-362。
100.根据89-99中任一项的方法,其中所述IL-15基因启动子是内源性非人IL-15基因启动子。
101.根据100的方法,其中所述IL-15基因启动子是在所述非人动物IL-15基因座处的内源性非人IL-15基因启动子。
102.根据101的方法,其中所述经遗传修饰的非人动物在所述非人动物IL-15基因座处在非人IL-15基因中包含无效突变。
103.根据102的方法,其中所述经遗传修饰的非人动物是小鼠,并且所述无效突变是至少小鼠IL-15外显子5-8的缺失。
104.根据101的方法,其中所述经遗传修饰的非人动物就包含编码所述人IL-15蛋白的所述核酸序列的等位基因而言是杂合的。
105.根据101的方法,其中所述经遗传修饰的非人动物就包含编码所述人IL-15蛋白的所述核酸序列的等位基因而言是纯合的。
106.根据89-105中任一项的方法,其中编码所述人IL-15蛋白的所述核酸序列包含人IL-15基因组编码序列和非编码序列。
107.根据89-106中任一项的方法,其中所述人IL-15蛋白是全长人IL-15蛋白的功能性片段。
108.根据89-107中任一项的方法,其中所述经遗传修饰的非人动物包含Rag2基因敲除。
109.根据89-108中任一项的方法,其中所述经遗传修饰的非人动物包含IL2rg基因敲除。
110.根据89-109中任一项的方法,其中所述经遗传修饰的非人动物是哺乳动物。
111.根据110的方法,其中所述哺乳动物是啮齿动物。
112.根据111的方法,其中所述啮齿动物是小鼠。
113.一种鉴定抑制由激活、诱导和/或靶向人T细胞和/或自然杀伤(NK)细胞的病原体的感染的药剂的方法,所述方法包括:
向经遗传修饰的非人动物施用药剂,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包含:
(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,
(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,
(iii)人造血细胞的植入物,和
(iv)由激活、诱导和/或靶向人T细胞和/或自然杀伤细胞的病原体的感染,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;以及
确定所述药剂是否使所述病原体感染的非人动物中所述病原体的量降低。
114.根据113的方法,其中所述SIRPα基因启动子是内源性非人SIRPα基因启动子。
115.根据114的方法,其中所述SIRPα基因启动子是在所述非人动物SIRPα基因座处的内源性非人SIRPα基因启动子。
116.根据115的方法,其中所述经遗传修饰的非人动物在所述非人动物SIRPα基因座处在非人SIRPα基因中包含无效突变。
117.根据116的方法,其中所述经遗传修饰的非人动物是小鼠,并且所述无效突变是至少小鼠SIRPα外显子2-4的缺失。
118.根据116的方法,其中所述经遗传修饰的非人动物就包含编码所述人SIRPα蛋白的所述核酸序列的等位基因而言是杂合的。
119.根据116的方法,其中所述经遗传修饰的非人动物就包含编码所述人SIRPα蛋白的所述核酸序列的等位基因而言是纯合的。
120.根据113-119中任一项的方法,其中编码所述人SIRPα蛋白的所述核酸序列包含人SIRPα基因组编码序列和非编码序列。
121.根据113-120中任一项的方法,其中所述人SIRPα蛋白是全长人SIRPα蛋白的功能性片段。
122.根据121的方法,其中所述功能性片段包括人SIRPα的细胞外结构域。
123.根据122的方法,其中所述细胞外结构域包含SEQ IDNO:12的氨基酸28-362。
124.根据113-123中任一项的方法,其中所述IL-15基因启动子是内源性非人IL-15基因启动子。
125.根据124的方法,其中所述IL-15基因启动子是在所述非人动物IL-15基因座处的内源性非人IL-15基因启动子。
126.根据125的方法,所述经遗传修饰的非人动物在所述非人动物IL-15基因座处在非人IL-15基因中包含无效突变。
127.根据126的方法,其中所述经遗传修饰的非人动物是小鼠,并且所述无效突变是至少小鼠IL-15外显子5-8的缺失。
128.根据125的方法,其中所述经遗传修饰的非人动物就包含编码所述人IL-15蛋白的所述核酸序列的等位基因而言是杂合的。
129.根据125的方法,其中所述经遗传修饰的非人动物就包含编码所述人IL-15蛋白的所述核酸序列的等位基因而言是纯合的。
130.根据113-129中任一项的方法,其中编码所述人IL-15蛋白的所述核酸序列包含人IL-15基因组编码序列和非编码序列。
131.根据113-130中任一项的方法,其中所述人IL-15蛋白是全长人IL-15蛋白的功能性片段。
132.根据113-131中任一项的方法,其中所述经遗传修饰的非人动物包含Rag2基因敲除。
133.根据113-132中任一项的方法,其中所述经遗传修饰的非人动物包含IL2rg基因敲除。
134.根据113-133中任一项的方法,其中所述经遗传修饰的非人动物是哺乳动物。
135.根据134的方法,其中所述哺乳动物是啮齿动物。
136.根据135的方法,其中所述啮齿动物是小鼠。
137.一种制备表达人IL-15蛋白和人SIRPα蛋白的非人动物的方法,其包括:
向第一非人动物的基因组中引入编码人SIRPα蛋白的核酸序列,其中所述编码所述人SIRPα蛋白的序列可操作地连接至SIRPα基因启动子序列;
向第二非人动物的基因组中引入编码人IL-15蛋白的核酸序列,其中所述编码所述人IL-15蛋白的序列可操作地连接至IL-15启动子序列;以及
制备包含编码所述人IL-15蛋白的所述核酸序列和编码所述人SIRPα蛋白的所述核酸序列的第三非人动物,其中所述第三非人动物表达所述人IL-15蛋白和所述人SIPRα蛋白。
138.如137的方法,其中引入步骤包括由包含编码人IL-15或人SIRPα的所述核酸的多能干细胞产生非人动物。
139.如137或138的方法,其中所述第一动物是与所述第二动物不同的动物,并且制备所述第三动物的步骤包括使所述第一动物和所述第二动物交配。
140.如137的方法,其中所述第一动物和所述第二动物相同,向所述第一动物的基因组中进行引入的步骤包括使第一多能干细胞与编码所述人SIRPα蛋白的所述核酸序列接触以获得第二多能干细胞,向所述第二动物的基因组中进行引入的步骤包括使所述第二多能干细胞与编码所述人SIRPα蛋白的所述核酸序列接触以获得第三多能干细胞,并且所述第三非人动物由所述第三多能干细胞制备。
141.根据137-140中任一项的方法,其中所述多能干细胞是ES细胞或iPS细胞。
142.根据137-140中任一项的方法,其中所述多能干细胞就Rag2而言是缺陷的。
143.根据137-142中任一项的方法,其中所述多能干细胞就IL2rg而言是缺陷的。
144.根据137-143中任一项的方法,其中所述第三非人动物就Rag2和IL2rg之一或两者而言是缺陷的。
145.根据137-144中任一项的方法,其中所述IL-15启动子序列是人IL-15启动子序列。
146.根据137-144中任一项的方法,其中所述IL-15启动子序列是内源性非人动物IL-15启动子序列。
147.根据137-144中任一项的方法,其中整合导致在非人IL-15基因座处非人IL-15基因的替换。
148.根据137-147中任一项的方法,其中编码所述人IL-15蛋白的所述核酸序列包含人IL-15基因组编码序列和非编码序列。
149.一种对表达人IL-15蛋白的经遗传修饰的非人动物进行植入的方法,其包括:
将包含人造血细胞的细胞群体移植入通过根据137-148中任一项的方法制备的所述经遗传修饰的非人动物中。
150.根据149的方法,其中所述移植包括尾部静脉注射、胎肝注射或眶后注射。
151.根据149或150的方法,其中所述经遗传修饰的非人动物在移植之前经亚致死性辐射。
152.根据149-151中任一项的方法,其中所述人造血细胞是CD34+细胞。
153.根据149-151中任一项的方法,其中所述人造血细胞来自胎肝、成人骨髓或脐带血。
154.一种确定候选治疗性抗体或抗原结合蛋白在杀伤靶细胞方面的功效的方法,所述方法包括:
向经遗传修饰的非人动物施用所述候选治疗性抗体或抗原结合蛋白,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包含:
(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,
(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,和
(iii)人造血细胞的植入物,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;以及
确定所述候选治疗性抗体或抗原结合蛋白是否在所述经遗传修饰的非人动物中调节NK细胞介导的针对所述靶细胞的抗体依赖性细胞性细胞毒性。
155.一种确定候选治疗性抗体或抗原结合蛋白在杀伤靶细胞方面的功效的方法,所述方法包括:
从经遗传修饰的非人动物分离NK细胞,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包含:
(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,
(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,和
(iii)人造血细胞的植入物,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;
使所述经分离的NK细胞与所述候选治疗性抗体或抗原结合蛋白和所述靶细胞接触;以及
测定所述经分离的NK细胞针对所述靶细胞的抗体或抗原结合蛋白依赖性细胞溶解活性。
156.一种针对杀伤靶细胞改进的功效来筛选候选治疗性抗体或抗原结合蛋白的方法,其包括:
向经遗传修饰的非人动物施用所述候选治疗性抗体或抗原结合蛋白,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包含:
(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,
(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,和
(iii)人造血细胞的植入物,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;以及
确定所述候选治疗性抗体或抗原结合蛋白是否在所述经遗传修饰的非人动物中在杀伤所述靶细胞方面显示改进的功效。
157.如154-156中任一项的方法,其中所述靶细胞选自由肿瘤细胞、受病毒感染细胞、受细菌感染细胞、细菌细胞、真菌细胞和寄生物细胞组成的组。
158.一种确定候选治疗性抗体或抗原结合蛋白在NK细胞介导的对靶细胞的杀伤方面的功效的方法,其包括:
向经遗传修饰的非人动物施用所述候选治疗性抗体或抗原结合蛋白,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包含:
(i)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子,
(ii)并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子,和
(iii)人造血细胞的植入物,其中所述经遗传修饰的非人动物表达所述人SIRPα蛋白和所述人IL-15蛋白;以及
确定所述候选治疗性抗体或抗原结合蛋白是否在所述经遗传修饰的非人动物中调节(例如激活)针对所述靶细胞的NK细胞抗体依赖性细胞性细胞毒性。
159.如158的方法,其中所述靶细胞选自由肿瘤细胞、受病毒感染细胞、受细菌感染细胞、细菌细胞、真菌细胞和寄生物细胞组成的组。
160.根据159所述的方法,其中所述靶细胞是肿瘤细胞。
161.根据160所述的方法,其中所述肿瘤细胞是B细胞淋巴瘤细胞。
162.一种NK细胞介导的抗体依赖性细胞性细胞毒性的模型,其包括经遗传修饰的非人动物,其中所述经遗传修饰的非人动物就内源性免疫系统而言是缺陷的,并且包含:
并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人SIRPα蛋白并且可操作地连接至SIRPα基因启动子;
并入所述经遗传修饰的非人动物的基因组中的核酸序列,所述序列编码人IL-15蛋白并且可操作地连接至IL-15基因启动子;和
人造血细胞的植入物,其中所述经遗传修饰的非人动物(i)表达所述人SIRPα蛋白和所述人IL-15蛋白,(ii)包含人淋巴细胞,并且(iii)包含选自由肿瘤细胞、受病毒感染细胞、受细菌感染细胞、细菌细胞、真菌细胞和寄生物细胞组成的组的靶细胞。
163.根据162所述的模型,其中所述靶细胞是肿瘤细胞。
164.根据163所述的模型,其中所述肿瘤细胞是B细胞淋巴瘤细胞。
165.根据163或164所述的模型,其中所述模型包含外源性候选治疗性抗体或抗原结合蛋白。
166.根据162-165中任一项所述的模型,其中所述经遗传修饰的非人动物包含在所述经遗传修饰的非人动物的小肠和派尔集合淋巴结中的人上皮内淋巴细胞(IEL)。
167.根据162-166中任一项所述的模型,其中所述经遗传修饰的非人动物包含在所述经遗传修饰的非人动物的肺中的人上皮内淋巴细胞(IEL)。
实施例
提出以下实施例以便向本领域普通技术人员提供如何进行和使用本发明的完整公开和描述,并且不意图限制发明者所视为的他们的发明的范围,它们也不意图表示以下实验是进行的所有或仅有实验。已努力确保关于所用数值(例如量、温度等)的准确性,但应考虑一些实验误差和偏差。除非另外指示,否则份是重量份,分子量是重量平均分子量,温度以摄氏度计,并且压力处于或接近大气压。
实施例1:产生人源化SIRPα(SRG)敲入小鼠
产生人SIRPα敲入小鼠,其表达人SIRPα的可操作地连接至小鼠SIRPα启动子的细胞外结构域(参见图1)。已知人SIRPα以至少10种等位基因形式存在。在这个特定实施例中,人SIRPα变体1用于使小鼠的内源性SIRPα基因人源化。
材料和方法
如以下更详细所述,使用
使用
简要来说,对小鼠细菌人工染色体(BAC)克隆bMQ-261H14进行修饰以缺失内源性SIRPα基因的含有外显子2至4的序列,并且使用人BAC克隆CTD-3035H21插入人SIRPα基因的外显子2至4。BAC克隆bMQ-261H14中对应于内源性SIRPα基因的外显子2至4的基因组DNA(约8555bp)被含有来自BAC克隆CTD-3035H21的人SIRPα基因的外显子2至4的约8581bp DNA片段替换。对含于BAC克隆CTD-3035H21中的人SIRPα等位基因的序列分析揭示该等位基因对应于人变体1。将由loxP位点侧接的新霉素盒添加至含有人SIRPα基因的外显子2至4的约8581bp人DNA片段的末端(图1(底部))。
从小鼠BAC DNA分别在外显子2和4的位置5'和3'处获得上游和下游同源臂,并且将添加至约8581bp人片段-新霉素盒中以产生用于使内源性SIRPα基因人源化的最终靶向载体,其从5'至3'含有5'同源臂(其含有在内源性SIRPα基因的外显子2的5'的19kb小鼠DNA)、含有人SIRPα基因的外显子2至4的约8581bp DNA片段、由loxP位点侧接的新霉素盒、以及3'同源臂(其含有在内源性SIRPα基因的外显子4的3'的21kb小鼠DNA)。靶向载体的靶向插入使新霉素盒位于小鼠SIRPα基因的在外显子4与5之间的第五内含子中。通过用SwaI消化来使靶向载体线性化,接着在细菌细胞中在同源性重组中用于实现小鼠SIRPα基因的外显子2至4被人SIRPα基因的外显子2至4靶向替换(图1(底部))。
所靶向BAC DNA(上述)用于电穿孔Rag2
(SEQ ID NO:1)。跨越在新霉素盒的5'末端的下游插入点的核苷酸序列包括以下序列,其指示人SIRPα基因组序列与在插入点下游的盒序列(含于以下括号内,其中loxP序列用斜体表示)邻接:
(SEQ ID NO:2)。跨越在新霉素盒的3'末端的下游插入点的核苷酸序列包括以下序列,其指示盒序列与在内源性SIRPα基因的外显子4的3'的小鼠基因组序列(含于以下括号内)邻接:
(SEQ ID NO:3)。阳性ES细胞克隆接着用于使用
上述所靶向ES细胞用作供体ES细胞,并且通过
可使携带人源化SIRPα基因构建体的小鼠(即在小鼠SIRPα基因中含有人SIRPα外显子2至4)与Cre缺失小鼠品系(参见例如国际专利申请公布号WO2009/114400)交配以移除由靶向载体引入的例如在ES细胞阶段或在胚胎中未移除的任何lox化新霉素盒。任选地,使新霉素盒保留在小鼠中。为获得纯合Sirpα小鼠,使杂合子交配。
结果
如上所述的包括编码小鼠SIRPα基因的人源化形式的核酸的小鼠(SRG小鼠)展现人源化SIRPα蛋白的生理性表达(数据未显示)。这些小鼠也在脾、外周淋巴结(LN)和胸腺中展现与NOD scidγ(NSG)小鼠类似的人免疫细胞植入(数据未显示)。
实施例2:产生人源化SRG IL-15
已显示细胞因子IL-15对于小鼠NK细胞发育和记忆CD8
材料和方法
使用
具体来说,使用标准BHR技术(参见例如Valenzuela等(2003),上文)和缺口修复BHR进行细菌同源性重组(BHR)以构建含有用于靶向小鼠IL-15基因座的人IL-15基因的序列的大型靶向载体(LTVEC)。通过使PCR产生的同源框连接于经克隆盒来产生线性片段,随后对连接产物进行凝胶分离,并且电穿孔至具有靶标细菌人工染色体(BAC)的BHR感受态细菌中。小鼠BAC PRCI23-203P7用作小鼠序列的来源;人BAC RP11-103B12用作人IL-15基因序列的来源。在选择步骤之后,通过跨越新型接合处进行PCR,并且通过限制分析来鉴定正确重组的克隆。制得含有同源臂和人IL-15基因序列的LTVEC。
通过使用关于缺失的基因组坐标GRCM38:ch 8:82331173-82343471(负链);关于替换的基因组坐标GRCh37:ch4:142642924-142655819(正链)来修饰小鼠IL-15基因(小鼠GeneID:103014;RefSeq转录物:NM_008357.2;ensemble eID:16168)。小鼠序列的12299个核苷酸被人序列的12896个核苷酸替换。如上所述对小鼠IL-15序列的替换图解呈现于图2中。
包括人源化IL-15基因的LTVEC具有在上游侧接有MluI位点的约13kb上游小鼠靶向臂,以及在下游侧接有AscI位点的27kb下游小鼠靶向臂。用MluI和AscI使LTVEC线性化以便进行电穿孔。
在构建LTVEC之后,LTVEC的跨越小鼠/人5’接合处和人/小鼠3’接合处的核苷酸序列如下表1中所示。SEQ ID NO:4描绘小鼠序列与人序列之间的上游(相对于IL-15基因的转录方向)接合处;所示序列以呈大写形式的小鼠序列开始,继之以呈小写形式的AsisI限制位点,随后是呈大写形式的人IL-15核酸序列。SEQ ID NO:5指示呈大写形式的下游人IL-15编码序列和非编码序列(人3’UTR用粗斜体表示),继之以呈小写形式的XhoI位点,随后是lox位点(大写,用粗斜体表示),继之以下游neo选择盒的序列(大写),其在下游延伸2.6kb(未显示)。SEQ ID NO:6是描绘neo选择盒的下游部分(大写)的接合处的核酸序列,所述neo选择盒伴有lox位点(大写且用粗斜体表示),随后是NheI位点(小写),其继之以在人源化的下游的小鼠序列(大写);选择盒向更上游延伸2.6kb。
表1:人源化IL-15基因座的接合序列
/>
用LTVEC构建体对小鼠ES细胞进行电穿孔,使所述小鼠ES细胞在选择培养基上生长,并且用作供体ES细胞以制备包括如图2中所描绘在内源性小鼠IL-15基因座处被人序列替换的人源化IL-15小鼠。在电穿孔ES细胞之后,进行天然等位基因丧失测定(参见例如Valenzuela等(2003),上文)以检测归因于靶向作用的内源性IL-15序列丧失。
进一步用瞬时Cre表达性载体对正确靶向的ES细胞进行电穿孔以移除Neo药物选择盒。
通过
如下测定人IL-15mRNA水平。使用7500快速实时PCR系统(Applied Biosystems)和
通过以下方式来产生SRG-15小鼠:(1)使包含人SIRPα替换的小鼠与包含人IL-15替换的小鼠交配,两者均基于Rag2
结果
如图3A和3B中所说明,高表达水平的人IL-15mRNA见于非经植入SRG-15小鼠1的肝、肺、骨髓(BM)、小肠(SI)和结肠中。类似高水平的人IL-15mRNA见于非经植入SRG-15小鼠2的肝、肺和小肠中(图3B)。如图4中所示,在用聚(I:C)刺激后,也可在其中人外显子5-8替换内源性小鼠外显子的SRG-15小鼠2的血清中检测到高水平的人IL-15蛋白。
实施例3:对SRG-15小鼠的植入
材料和方法
如下所述对SRG和SRG-15小鼠进行植入。新生小鼠在出生后3-5天在不麻醉下用160cGy进行亚致死性辐射,并且被送回母亲身边休息。在辐射后4-12小时,使用30G针,用含CD34+huHSC的25μl PBS对这些新生体进行肝内(i.h.)移植。
结果
为评估人IL-15对免疫细胞发育的影响,将NSG、SRG和SRG-15小鼠中的人CD45
在小鼠1中,尽管人CD45
对于SRG-15小鼠2,观察到淋巴和非淋巴组织中的高效人NK细胞植入,如图7A-7D中所示。图7A和7B分别显示血液和脾中的NK细胞的百分比。图7C和7D显示在植入后14周SRG和SRG-15(小鼠2)小鼠的血液、脾(SP)、肝和肺中的人NK细胞的频率。来自不同实验的显示SRG和SRG-15(小鼠2)小鼠的血液和脾中的NK细胞分布和百分比的额外数据分别提供于图8和9A中。图9B中显示SRG-15小鼠(小鼠2)的血液中的hCD45+细胞的hNKp46片段增加。图9C-9E显示SRG和SRG-15(小鼠2)小鼠的胸腺中的hCD45+细胞的相对数目、分布和组成。
表征人和SRG-15小鼠(小鼠2)中的NK细胞子组。如图10A和10B中所示,相对于SRG小鼠,观察到SRG-15小鼠的血液和脾中hCD-56
将SRG-15小鼠的血液中的人NK细胞分布与从两个健康人供体获得的血液的NK细胞分布进行比较。经Ficoll-Paque从两个个别供体的白细胞层(从BioreclamationlVT,Westbury,NY获得)分离外周血液单核细胞(PBMC);尽管相比于来自人供体的PBMC中的百分比,观察到经植入SRG-15小鼠中的血液NK细胞的百分比更大,但观察到细胞毒性(CD16+)NK细胞相对于产生IFN-g的(CD16-)NK细胞的生理类似分布(图11)。
最后,对SRG和SRG-15(小鼠2)的骨髓的分析显示相对于SRG小鼠,SRG-15小鼠中的人NK细胞发育得以增加(图12)。
还评估了人IL-15对SRG-15小鼠中人T细胞发育的影响。SRG-15(小鼠1)小鼠相对于SRG小鼠的比较显示人IL-15对T细胞的百分比、数目和/或比率的影响视组织而变化(图13A)。在SRG小鼠与SRG-15小鼠之间,在植入后第16周淋巴结的尺寸和数目并无不同,从而确认SRG和SRG-15(小鼠1)小鼠的淋巴结中的人T细胞的数目是类似的结果(图13A)。图13B显示SRG和SRG-15小鼠(小鼠1)的血液和肝中的人CD8+T细胞表型,其中相对于SRG小鼠,对于血液与肝两者,SRG-15小鼠(小鼠1)中的hCD62L
对于小鼠2,在植入后16周评估相对于SRG小鼠,脾、肺和肝中的hCD3
实施例4:SRG-15小鼠中人组织驻留淋巴细胞的发育
因为已显示IL-15由肠和肺中的上皮细胞产生,并且可对于人组织驻留T细胞和NK细胞的发育和存活起重要作用,所以分析SRG和SRG-15小鼠中的人组织驻留T细胞和NK细胞。
材料和方法
新生小鼠在出生后3-5天在不麻醉下用160cGy进行亚致死性辐射,并且被送回母亲身边休息。在辐射后4-12小时,使用30G针,用含CD34+huHSC的25μl PBS对这些新生体进行肝内(i.h.)移植。
结果
如图17A中所示,在小鼠1的稳态条件期间从小肠分离上皮内淋巴细胞群体揭示相较于SRG小鼠,SRG-15小鼠中的人CD45
与SRG-15经植入小鼠1类似,在SRG-15经植入小鼠2中,FACS分析揭示相较于SRG小鼠,SRG-15小鼠的IEL部分中的人CD45
如上关于图18A和18B所讨论,观察到相较于SRG小鼠,在SRG-15经植入小鼠2中,肠相关的淋巴组织(GALT)驻留上皮内人淋巴细胞重建(IEL)更大(图19A和19C)。引起关注的是,观察到的大多数人淋巴细胞是人NK细胞。如对于正常人GALT生理情况所预期,SRG-15小鼠2中在血液与脾两者中的大多数NK细胞是细胞毒性NK细胞(CD16+),而在IEL中,存在CD16+NK细胞相对于CD16-NK细胞的类似分布(图19B)。在经植入SRG小鼠与SRG-15小鼠之间,在固有层淋巴细胞的数目方面不存在变化(图19C)。不同于经植入SRG-15小鼠1,在经植入SRG-15小鼠2中,更大比例的人CD3+CD8+IEL表达人CD103标志物。在SRG小鼠中完全不存在派尔集合淋巴结,但它们存在于SRG-15小鼠2中,并且为人淋巴细胞所填充,如图20A和20B中所示。
实施例5:确定在病毒性感染期间SRG-15小鼠中的人组织驻留T细胞的功能作用
为测试SRG-15小鼠中的组织驻留T细胞是否在体内平衡期间具有功能相关性,确定SRG-15小鼠中的人CD8
材料和方法
新生小鼠在出生后3-5天在不麻醉下用160cGy进行亚致死性辐射,并且被送回母亲身边休息。在照射后4-12小时,使用30G针,用含CD34+huHSC的25μl PBS对这些新生体进行肝内(i.h.)移植。
在植入后4周,使SRG-15小鼠与SRG和供体Balb/c小鼠共同舍饲4周以在不同品系之间平衡肠道微生物群。接着将小鼠分开,并且收集粪便样品并通过16S rRNA测序来分析。图21A提供共同舍饲和粪便样品收集以进行肠道微生物群测序的时间轴。
结果
如21B中所说明,对于小鼠1,结果显示在共同舍饲之后在经植入SRG-15小鼠与SRG小鼠之间不存在显著变化,从而指示产生的人CD8
实施例6:对SRG-15小鼠(小鼠2)和人中的NK细胞子组的分析
表征SRG-15(小鼠2)小鼠中的NK细胞子组的各种表型标志物,并且与人进行比较。
材料和方法
如大体上于Yao等J.of Immunological Methods 415(2014)1-5中所述,通过飞行时间细胞计量术(CyTOF)检测NK细胞子组,并且使用ViSNE(el-AD等Nat.Biotechnol.2013年6月;31(6):545-52doi:10.1038/nbt.2594.2013年5月19日电子出版)加以分析。
结果
图23A提供ViSNE图,其显示基于CyTOF的对人(n=20)和SRG-15小鼠(小鼠2)(n=9)中的CD56
图23B提供ViSNE图,其显示8种所选标志物在人(n=20)和SRG-15小鼠(小鼠2)(n=9)中的CD56
图23C ViSNE图,其显示8种所选标志物在人(n=20)和SRG-15小鼠(n=9)中的CD56
实施例7:来自SRG-15小鼠的NK细胞的细胞毒性能力
材料和方法
对于体外NK细胞毒性研究,用人IL-2对从经人HSC植入的SRG和SRG-15小鼠(小鼠2)分离的脾NK细胞处理过夜。次日,使NK细胞与CFSE标记的NK易感性K562靶细胞一起在不同效应物与靶标比率(E:T)下培养。在5小时共培养之后,通过对由K562细胞摄取活力染料Topro3的FACS分析(关于CFSE+细胞设门以区分K562,接着分析Topro3阳性百分比)来测量对K562细胞的杀伤。
另外,对于体外抗体依赖性细胞性细胞毒性(ADCC)研究,用人IL-2对从经人HSC植入的SRG和SRG-15小鼠分离的脾NK细胞处理过夜。次日,使NK细胞与CFSE标记的Raji靶细胞一起在不同效应物与靶标比率(E:T)下培养。Raji细胞用CD20抗体(利妥昔单抗)或对照IgG预处理。在5小时共培养之后,通过对由Raji细胞摄取活力染料Topro3的FACS分析(关于CFSE+细胞设门,接着分析Topro3阳性百分比)来测量对Raji细胞的杀伤。
对于体内NK细胞激活研究,用50μg聚IC腹膜内注射经人HSC植入的SRG和SRG-15小鼠(小鼠2)。将小鼠预先放血(在注射聚IC之前),并且在注射聚IC之后18小时放血。通过在施用聚IC之前和之后进行FACS来分析人CD45+NKp46+(NK细胞)的激活标志物CD69表达。
结果
在经典NK细胞毒性研究中,经典NK靶标I类HLA缺陷K562细胞经受由来自SRG或SRG-15小鼠(小鼠2)的激活的NK细胞杀伤。如图24C(左侧)中所示,当关于数目加以标准化时,来自SRG和SRG-15小鼠的脾NK细胞相对于K562细胞显示类似细胞溶解能力。
NK细胞通常负责抗CD20抗体介导的针对B细胞白血病和淋巴瘤的ADCC(参见例如J.Golay等Haematologica 2003;88:1002-12)。为证明来自SRG-15经植入小鼠的NK细胞能够促进CD20抗体介导的ADCC,测试来自SRG小鼠与SRG-15小鼠两者的脾NK细胞,并且当关于细胞数目加以标准化时,显示所述脾NK细胞展现相对于经抗CD20处理的Raji细胞的类似的抗体依赖性细胞性细胞毒性(ADCC)活性(图24C(右侧))。
如例如在图8和9A-9E中所描绘,在SRG-15动物的脾与血液两者中均存在NK细胞显著上调。通过在注射聚IC之后测量CD69标志物激活来测试在SRG-15小鼠中使NK细胞激活的能力。如图24A中所示,相对于SRG小鼠,SRG-15小鼠中的激活标志物CD69阳性NK细胞的百分比得以增加。因为显示在标准化条件下在体外SRG-15NK细胞介导与SRG NK细胞类似的ADCC,所以SRG-15NK细胞能够在体内展现更大激活表型以及SRG-15小鼠中具有更大NK细胞数目表明SRG-15小鼠可为适于研究人NK细胞ADCC的体内模型。
实施例8:由SRG和SRG-15源性NK细胞达成的IFNγ产生
材料和方法
从SRG或SRG-15小鼠的汇合脾细胞(每组3个脾)分离NK细胞,并且使用EasySep人NK富集试剂盒(StemCell Technologies;目录号19055)分离NK细胞。
也从健康人PBMC分离NK细胞。用10ng/mL人IL-2将NK细胞处理过夜。次日,用10ng/mL人IL-12p70或2mg/mL聚I:C将细胞刺激过夜,或保持未处理。次日,收集上清液,并且使用人IFNg Quantikine ELISA试剂盒(R&D systems;目录号DIF50)评估IFNg水平。通过FACS来分析NK细胞纯度,并且将IFNg水平标准化成由个别NK细胞产生的皮克数(pg)。使用ANOVA检验进行统计分析。
结果
如图24B中所示,在IL-12p70处理后,SRG和SRG-15源性NK细胞具有类似IFNγ分泌,但小于人PBMC源性NK细胞。
实施例9:人NK细胞抑制SRG-15小鼠中的肿瘤生长
测试人NK细胞在SRG-15小鼠(小鼠2)中浸润人肿瘤异种移植物以及抑制肿瘤生长的能力。
材料和方法
每隔一天腹膜内注射利妥昔单抗(在皮下注射500万个Raji细胞后第14天开始)。通过测径规测量来评估肿瘤生长,并且使用下式计算体积:肿瘤体积=0.5×(长度×宽度^2)。从2个独立实验汇合数据。使用比较经植入未治疗SRG-15小鼠和经植入RTX治疗SRG-15小鼠的未配对双尾曼-惠特尼U检验进行统计分析(*P<0.05)。
将皮下肿瘤压碎,并且使用胶原酶D(1小时,37℃)消化。通过LSRII流式细胞仪来分析包括肿瘤和免疫细胞的回收细胞。
结果
如图25A中所示,在用利妥昔单抗(RTX)治疗之后,SRG-15小鼠中的人NK细胞抑制肿瘤生长。图25B显示未治疗(n=5)和RTX治疗SRG-15小鼠(n=1)的人肿瘤异种移植物中的人NK细胞和T细胞的频率。图25C显示未治疗(n=2)和RTX治疗SRG-15小鼠(n=1)的血液和肿瘤中的人NK细胞子组。
实施例10:与以上实施例关联利用的额外材料和方法
人CD34
对人细胞群体的流式细胞术分析。如Strowig T,Rongvaux A,Rathinam C等ProcNatl Acad Sci USA 2011;108:13218-13223中以及Rongvaux A,Willinger T,Martinek J等Nat Biotechnol 2014;32:364-372中所述对人细胞群体进行流式细胞术分析。
组织学。将组织于4%多聚甲醛中固定过夜,转移至70%乙醇中,并且包埋在石蜡中。
定量RT-PCR。如Rongvaux A,Willinger T,Martinek J等Nat Biotechnol 2014;32:364-372中所述进行定量RT-PCR。
16S rRNA测序。如Palm NW,de Zoete MR,Cullen TW等Cell2014;158:1000-1010中所述进行16S rRNA测序。
病毒性感染。获得轮状病毒和流感病毒,并且应用于主题方法中。
统计分析。用Prism 6软件(GraphPad),使用双尾未配对Student t检验进行统计显著性分析。
FACS抗体从BD Biosciences和BioLegend获得。
先前所述仅说明本发明的原理。应了解本领域技术人员将能够设计尽管未在本文中明确描述或显示,但体现本发明的原理,并且包括在本发明的精神和范围内的各种布置。此外,本文叙述的所有实例和条件性措辞都主要意图帮助读者理解本发明的原理和由发明者为增进本领域所贡献的构思,并且应被解释为不限于所述明确叙述的实例和条件。此外,叙述本发明的原理、方面和实施方案以及其特定实例的本文所有陈述都意图涵盖其结构等效物与功能等效物两者。另外,意图所述等效物包括当前已知的等效物与未来开发的等效物(即开发的执行相同功能,与结构无关的任何要素)两者。因此,本发明的范围不意图限于本文所示和所述的示例性实施方案。更确切来说,本发明的范围和精神由随附权利要求体现。
额外序列信息
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
