一种抗肿瘤mRNA疫苗及其制备方法和应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及生物医药技术领域,具体涉及一种新型抗肿瘤mRNA疫苗及其制备方法和应用。
背景技术
肿瘤疫苗是促使机体形成保护性免疫应答并实现肿瘤组织特异性清除的重要工具,其活性成分包括四个关键组分:肿瘤抗原、制剂、免疫佐剂和递送载体。肿瘤治疗性疫苗产生抗肿瘤免疫反应需要通过抗原呈递细胞(Antigen-presenting cells,APC)摄取、加工处理抗原并呈递至T、B淋巴细胞。随着对肿瘤免疫的深入研究发现肿瘤宿主中存在抗原加工和呈递水平上的各类缺陷(Sellars,2022;Lin,2022)。
肿瘤细胞自身可通过多种修饰与变化机制增强逃避免疫监视及攻击的能力。其中,肿瘤细胞能够通过抗原快速突变或丢失实现直接逃脱免疫系统的识别和破坏,从而造成抗原特异性免疫攻击脱靶(Beatty,2015)。尽管目前利用基因测序等手段获得肿瘤新抗原多肽表位在提高疫苗疗效中展现出巨大潜力,但多肽抗原表位的特异性及免疫原性极大限制了疫苗疗效(Chu,2018)。因此亟需开发新的组合疫苗策略以应对肿瘤免疫过程中由于低新抗原负荷导致的免疫逃逸、快速抗原表位丢失、以及难以诱导肿瘤特异性T细胞反应等挑战。
mRNA作为一种可代替DNA与重组蛋白的全新治疗模式,在癌症免疫治疗领域受到越来越多的关注(Beck,2021)。由于其蛋白表达速率高,并且没有插入宿主细胞基因组的潜在风险。自身又兼具抗原呈递与自佐剂的双重作用,更易激活先天免疫通路,因此在抗肿瘤疫苗方面具有广阔应用价值。目前脂质纳米颗粒(Lipid Nanoparticle,LNP)作为主流的mRNA递送系统,可有效封装并保护核酸进入胞内,并被释放与翻译为有功能的蛋白质(Hou,2021)。
目前的抗肿瘤mRNA疫苗多编码肿瘤特异性或肿瘤相关抗原或肿瘤新生抗原,肿瘤相关抗原多为正常细胞的一部分,存在免疫原性较弱,或难以刺激机体产生强大有效的抗肿瘤免疫应答等问题;而编码肿瘤新生抗原的疫苗,在前期新生抗原分析鉴定与后期个性化疫苗生产过程存在诸多技术壁垒,治疗经济与时间成本都非常高昂。因此,如何有效增强mRNA疫苗的抗肿瘤免疫应答并缩短时间成本是本领域技术人员需要解决的技术问题。
发明内容
本发明的目的在于提供一种新型的抗肿瘤药物,将免疫抗原以mRNA药物的形式瘤内或瘤旁局部给药实现对肿瘤细胞的抗原标记,借助机体前期因疫苗接种产生的广泛且强大的特异性抗体识别抗原诱导机体特异性攻击最终达到清除肿瘤组织的目的。
为实现上述目的,本发明采用如下技术方案:
本发明提供了一种抗肿瘤mRNA疫苗,包含第一组合物和第二组合物,
所述第一组合物包括免疫佐剂和第一活性成分,所述第一活性成分包含诱发机体免疫产生抗体的第一抗原;
所述第二组合物包括药用载体和第二活性成分,所述第二活性成分包含编码用于被所述抗体识别的膜锚定型抗原的mRNA分子,所述mRNA分子从5’端到3’端依次包括信号肽编码序列、第二抗原编码序列和膜锚定蛋白编码序列;所述第二组合物为瘤内或瘤旁局部给药剂型。
本发明提供的抗肿瘤mRNA疫苗由第一组合物和第二组合物两部分组成,第一组合物用于诱发机体免疫应答产生特异性抗体;第二组合物中的mRNA分子编码膜锚定型抗原,该抗原能够被第一组合物诱导产生的抗体特异性识别,利用该抗原对肿瘤细胞进行标记,抗体在识别结合抗原过程中免疫系统攻击肿瘤细胞最终达到清除肿瘤组织的作用。
本发明中第一组合物可采用目前市面上被广泛应用的能够诱导机体产生强有效特异性抗体应答的疫苗,例如乙肝疫苗、新冠病毒疫苗等,但本发明并不局限于此。
利用大多数个体中已经存在的具有广泛性的特异性抗体应答来实现抗肿瘤目的,可以缩短时间成本,为肿瘤手术治疗争取窗口期。乙肝疫苗和新冠病毒疫苗为目前较成熟的疫苗,具有接种人群广泛,体内抗体应答持久且有效的优势。
作为优选,所述第一抗原和第二抗原为乙肝病毒S蛋白,所述第二抗原编码序列如SEQ ID NO.1所示。
作为优选,所述第一抗原和第二抗原为新型冠状病毒S蛋白受体结合区域RBD,所述第二抗原编码序列如SEQ ID NO.2所示。
所述mRNA分子包括三个部分,分别为信号肽编码序列、第二抗原编码序列和膜锚定蛋白编码序列。第二抗原为所述抗体特异性结合区域,为保证第二抗原表达于肿瘤细胞膜上以利于免疫系统识别,本发明在第二抗原的N端修饰信号肽,引导第二抗原跨膜转移到胞外;在第二抗原的C端修饰膜锚定蛋白,辅助将第二抗原锚定在细胞膜上。
作为优选,所述信号肽编码序列如SEQ ID NO.3所示。
作为优选,所述膜锚定蛋白编码序列如SEQ ID NO.4所示。
作为优选,所述mRNA分子具有加帽修饰。所述mRNA分子5’端具有一个m7G-PPPNm结构。
本发明中第二组合物为瘤内局部给药或瘤旁局部给药剂型,通过瘤内或瘤旁局部给药的方式,所述mRNA分子被肿瘤细胞摄取并得以表达,实现对肿瘤细胞的标记。研究表明,该给药方式具备生物安全性。相较于于分泌型抗原,本发明提供的mRNA分子编码膜锚定型抗原,其不易进入全身循环,大幅降低毒性。
作为优选,所述第二组合物中药用载体为脂质纳米颗粒(LNP),所述mRNA分子封装于所述脂质纳米颗粒中。研究表明,利用脂质纳米颗粒作为mRNA分子递送载体有助于提高mRNA分子在肿瘤细胞中的表达效率。
作为优选,所述第一组合物和所述第二组合物各自独立地存在,互不混合。本发明提供的抗肿瘤mRNA疫苗应用时,应先进行第一组合物给药,再进行第二组合物给药。如果给药对象前期接种过与第一抗原相同成分的疫苗,可直接进行第二组合物给药。第一组合物的给药方式可以为肌肉注射,第二组合物的给药方式为瘤内或瘤旁局部给药。作为优选,第一组合物和第二组合物给药间隔时间为4天以上。
本发明还提供了一种所述抗肿瘤mRNA疫苗的制备方法,包括以下步骤:
(1)将免疫佐剂与第一活性成分混合制得第一组合物;
(2)利用聚合酶链式反应扩增分别获得编码信号肽、第二抗原、膜锚定蛋白的DNA片段,以此为模板,利用聚合酶链式反应添加同源臂进行链延伸反应,获得融合基因;再将融合基因连入mRNA体外转录载体中得到重组质粒,酶切后获得体外转录线性化模板;然后经体外转录、修饰及纯化制得所述mRNA分子;最后将mRNA分子装载于药用载体上制得第二组合物。
所述第一组合物和第二组合物均为独立包装。
作为优选,步骤(2)中,利用脂质纳米颗粒LNP封装mRNA分子,其制备过程包括:将mRNA分子稀释于pH为4.5的柠檬酸-柠檬酸钠缓冲液中,加入脂质乙醇溶液混匀,反复吹打,透析制得负载mRNA的脂质纳米颗粒;所述脂质乙醇溶液中含有SM102、DSPC、CHO-HP和PEG2000,摩尔比为50:10:38.5:1.5。
本发明还提供了所述的抗肿瘤mRNA疫苗在制备肿瘤治疗药物中的应用。
所述肿瘤为实体瘤,包括但不限于:黑色素瘤、结肠癌、乳腺癌、肝癌等。
本发明动物试验结果显示,应用mRNA-LNP疫苗能够在相应蛋白疫苗免疫模型中提供强大的抗肿瘤免疫应答,对黑色素瘤及结肠癌模型小鼠肿瘤生长均有明显抑制作用。
本发明具备的有益效果:
本发明提供了一种借助机体特异性抗体进行抗肿瘤攻击的疫苗策略,将乙肝或新冠抗原疫苗等“老药新用”,利用mRNA药物的形式瘤内或瘤旁局部给药实现对肿瘤细胞的抗原标记,抗原锚定于肿瘤细胞表面更易诱导机体免疫系统的识别,依赖机体广泛且强大的特异性抗体诱导机体特异性攻击最终达到清除肿瘤细胞的作用。本发明提供的新型mRNA疫苗在多个实体瘤模型中展现出强有效的抑瘤作用,其普适性强,免疫原性高,应用范围广,可作为新辅助治疗手段,结合临床手术及其他抗肿瘤药物提高疗效。
附图说明
图1为体外转录模板质粒T7-HBsAg-S的图谱。
图2为体外转录模板质粒T7-SARS-CoV-2 SRBD的图谱。
图3为mRNA-LNP在肿瘤细胞B16F10中的表达图。
图4为结肠癌模型中蛋白疫苗诱导乙肝特异性抗体水平。
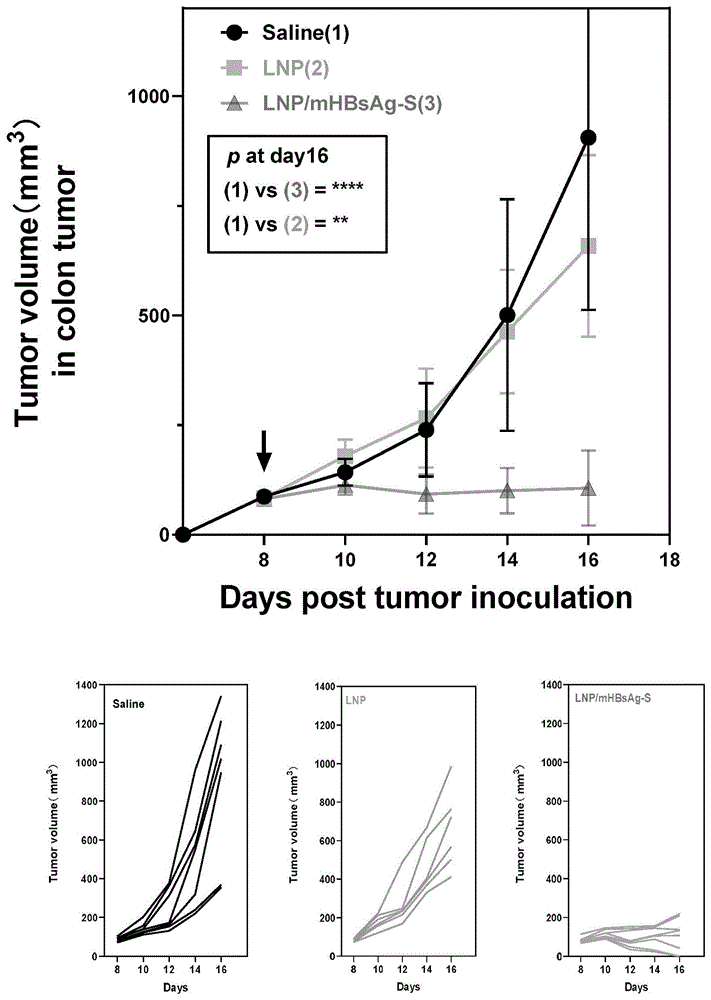
图5为局部应用编码乙肝S蛋白的mRNA疫苗在结肠癌模型中小鼠的平均和个体肿瘤生长曲线,其中第一行图片为平均肿瘤生长曲线,第二行图片分别为对照组、LNP组和mRNA-LNP组的个体肿瘤生长曲线。
图6为局部应用编码新冠S RBD的mRNA疫苗在结肠癌模型中小鼠的平均和个体肿瘤生长曲线,其中第一行图片为平均肿瘤生长曲线以及个体肿瘤体重,第二行图片分别为对照组、LNP组和mRNA-LNP组中个体肿瘤生长曲线。
图7为结肠癌模型中小鼠抗肿瘤免疫应答水平流式分析结果。
图8为结肠癌模型中LNP、LNP/mRNA给药的生物安全性评估,其中A为各组织切片,B为血清中ALT结果,C为血清中AST结果。
具体实施方式
下面结合具体实施例对本发明做进一步说明。以下实施例仅用于说明本发明,不用来限制本发明的适用范围。在不背离本发明精神和本质的情况下,对本发明方法、步骤或条件所做的修改或替换,均属于本发明的范围。
下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1、HBsAg-S mRNA和SARS-CoV-2 SRBD mRNA体外转录线性载体构建
该mRNA疫苗编码乙肝病毒S蛋白或新型冠状病毒S蛋白受体结合区域RBD,其重组质粒使用常规分子生物学技术通过以下步骤获得。
(1)目的抗原片段获取
通过NCBI获取HBsAg-S及SARS-CoV-2 SRBD核苷酸序列,设计F/R引物,分别以HBV1.3-mer WT replicon质粒和puc57-SARS-CoV-2 S质粒为模板进行聚合酶链式扩增,分别获得目的片段HBsAg-S,SARS-CoV-2 SRBD;
HBsAg-S:
上游引物F1:5′-ATGGAGAACATCACATCAGGA-3′;
下游引物R1:5′-AATGTATACCCAAAGACAAA-3′;
SARS-CoV-2 SRBD:
上游引物F2:5′-AGAGTCCAACCAACAGAATC-3′;
下游引物R2:5′-′GAAATTGACACATTTGTTTT-3;
反应条件为:94℃预变性5min,扩增时94℃30s,58℃退火30s,72℃延伸30s,反应35个循环,最后72℃延伸10min;
分别获得HBsAg-S,SARS-CoV-2 SRBD目的抗原片段,长度分别为678bp和669bp,核苷酸序列分别如SEQ ID NO.5、SEQ ID NO.8所示。
(2)融合基因获取
通过NCBI获取膜锚定蛋白GPI及其跨膜信号肽SP核苷酸序列,在信号肽SP后加入Myc标签蛋白用于后续免疫荧光,在膜锚定GPI序列末端加入终止密码子TAA,交由北京擎科生物科技有限公司进行基因合成,核苷酸序列分别如SEQ ID NO.11、SEQ ID NO.12所示。将信号肽SP,目的抗原HBsAg-S或SARS-CoV-2 SRBD以及膜锚定GPI通过同源臂进行链延伸反应,获取融合基因SP-HBsAg-S-GPI与SP-SARS-CoV-2SRBD-GPI,以下分别简称为H1以及S1,融合基因长度分别为915bp和906bp,核苷酸序列分别如SEQ ID NO.13、SEQ ID NO.14所示。
(3)重组质粒构建
将获得的目的抗原与膜锚定序列串联得到的融合基因H1与S1片段分别与线性化模板载体Cloning Kit for mRNA Template(Takara,Cat:6143)通过同源重组连接,并转化至DH5α感受态细胞中。挑取正确的单克隆菌落得到体外转录模板质粒T7-HBsAg-S,T7-SARS-CoV-2 SRBD。质粒图谱分别如图1和图2所示,经测序序列正确。其编码的氨基酸序列分别如SEQ ID NO.15和SEQ ID NO.16所示。
(4)线性化模板获取
将得到的重组质粒用限制性内切酶HindIII 37℃消化过夜。随后,通过1.5%凝胶电泳分离线性片段,并用DNA回收试剂盒对酶切产物进行胶回收,最后用Nanodrop测定DNA浓度,即得到线性化模板用于后续mRNA体外转录。
实施例2、mRNA体外转录、修饰及纯化
使用T7 High Yield RNA Transcription Kit(N1-Me-Pseudo UTP)(Vazyme,Cat:DD4202-01),Vaccinia Capping Enzyme(Vazyme,Cat:DD4109-PC-01),mRNA Cap 2′-O-Methyltransferase(Vazyme,Cat:DD4110-PC-01),E.coli Poly(A)Polymerase(Vazyme,Cat:DD4111-PC-01),通过以下步骤分别产生体外转录的HBsAg-S mRNA和SARS-CoV-2 SRBDmRNA。
(1)在冰上按照表1将下列试剂分别加入到200uL微量离心管中。
表1
充分混匀离心后,将上述反应管在37℃下反应3小时。随后为去除模板DNA,向上述反应管中加入2μL DNase I和2μL DNase buffer(10×)(Vazyme,Cat:DD4104),在37℃下温育30分钟。
(2)使用
取体外转录产物,用无核酸酶水补足至体积100μL,并转移至1.5mL离心管中。加入350μL的BB12(含有1%β-巯基乙醇)后涡旋混匀。加入900μL无水乙醇后再次涡旋混匀。将上述混合物分两次加入离心柱中,12000×g离心1分钟,弃掉流出液。再加入500μL WB12于12000×g离心1分钟,弃掉流出液。重复上述步骤。12000×g离心2分钟彻底去除残留的乙醇。将离心柱转移至新的1.5mL无核酸酶离心管中,并向离心柱中加入30μL无核酸酶水,室温静置2分钟,12000×g离心1分钟。应用Nanodrop测定纯化后的体外转录mRNA产物浓度和纯度,并通过1.5%琼脂糖凝胶电泳检测其质量。
(3)将纯化后的mRNA产物进行一步酶法加帽。首先将mRNA产物置于65℃条件下10分钟以完全打开其5’端二级结构。随后在冰上按照表2将下列试剂分别加入到1.5mL离心管中。
表2
充分混匀离心后,将上述反应管在37℃反应1.5小时。随后用上述柱纯化法纯化加帽mRNA产物,应用Nanodrop测定加帽纯化后mRNA的浓度和纯度,并通过1.5%琼脂糖凝胶电泳检测其质量。
实施例3、制备负载编码抗原mRNA的脂质纳米颗粒
(1)配置脂质乙醇溶液。将购买自艾伟拓(上海)医药科技有限公司的SM102(Cat:O02010),二硬脂酰基磷脂酰胆碱DSPC(Cat:S01005),高纯胆固醇CHO-HP(Cat:57-88-5),DMG-PEG2000(Cat:O02005)用无水乙醇溶解后,按表3的摩尔百分比配置成脂质乙醇溶液备用。
表3
(2)取纯化后mRNA用柠檬酸-柠檬酸钠缓冲液(pH=4.5)稀释后备用。取上述脂质乙醇溶液与mRNA稀释液充分混匀,反复吹打。
(3)将上述混合液120μL置于Slide-A-Lyzer
(4)在6孔板中提前一夜铺2×10
实施例4、实体瘤模型中瘤周注射mRNA-LNP对相应疫苗免疫小鼠的抑瘤效果评估
(1)实验动物及实体瘤植瘤模型:
购自杭州派思奥生物科技有有限公司的6周龄雌性C57小鼠和Balb/c小鼠分别用于构建黑色素瘤和结肠癌模型。实验前一周购入,自由饮水和摄食。小鼠黑色素瘤细胞B16F10在含有10%胎牛血清,1%双抗的DMEM培养基中培养,小鼠结肠癌细胞CT26在含有10%胎牛血清,1%双抗的RPMI1640培养基中培养。培养条件为37℃,5%CO
(2)蛋白免疫:
植瘤后6天左右,对小鼠进行相应蛋白疫苗免疫。将重组乙肝病毒表面抗原(Sangon Biotech,Cat:D111147-0001)和SARS-CoV-2 S-RBD原核蛋白(Sangon Biotech,Cat:C500304-0001)分别溶于ddH
(3)mRNA-LNP给药:
植瘤后8-10天,当小鼠肿瘤体积生长至50-100mm
(4)蛋白免疫小鼠体内抗体水平检测:
用间接法Elisa测定小鼠体内抗体效价。使用Elisa套盒(Solarbio,Cat:SEKF105)。用500ng/mL的乙肝病毒表面抗原HBsAg提前4℃包被高结合ELISA板过夜。用洗涤液润洗板三次,并用封闭液封闭2h。将小鼠血清以1:20、1:50、1:100、1:500、1:1000、1:2000、1:5000、1:10000、1:50000的比例进行梯度稀释。将稀释后的血清加入Elisa板中37℃孵育2小时。用洗涤液洗涤3次后,用1:5000稀释的HRP抗IgG(H+L)抗体于37℃孵育1小时,再次洗涤平板三次,然后与100μL显色液孵育30分钟。最后用0.16M硫酸溶液停止反应。酶标仪测定450nm处吸光度。抗体效价定义为血清识别抗原的最大稀释倍数。
(5)抗肿瘤免疫应答水平检测:
处死小鼠后取各实验组小鼠肿瘤,用剪刀剪碎后用组织消化液消化后裂红得到肿瘤单细胞悬液。使用小鼠PE-Cy7抗CD3和Pacific blue-抗CD8a抗体标记细胞,测定其中CD3
另取各组小鼠腹股沟淋巴结,经组织消化液消化后离心得到单细胞悬液。使用小鼠PE-抗CD11c,FITC-抗CD80,APC-抗CD86抗体进行表面标志物标记,使用流式细胞仪分析其中CD11c
另提取各组小鼠脾脏进行体外培养,取1×10
(6)结果分析
Elisa测定抗体水平结果表明(图4),蛋白免疫后3天已产生高水平抗体,免疫后15天抗体效价可达到50000。表明蛋白疫苗在小鼠体内诱导产生有效的特定抗体。
分析各组小鼠的肿瘤生长曲线结果,表明乙肝或新冠疫苗免疫后,瘤周或瘤内皮下注射编码抗原的mRNA-LNP在结肠癌模型中显著抑制小鼠肿瘤生长(图5,图6)。
流式分析数据表明mRNA-LNP提升瘤内CD3
小鼠主要脏器的HE病理切片以及血清ALT/AST评估了该策略的生物安全性(图8)。
由此可见,这种新型的mRNA-LNP瘤旁或瘤内给药策略可通过抗原标记肿瘤细胞,在特定疫苗免疫模型中依靠机体特异性抗体实现对实体瘤的有效抑制。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求的保护范围为准。
- 一种抗肿瘤疫苗复合物及制备方法、注射剂及应用
- 一种高效抗肿瘤铌酸钾钠基压电材料及其制备方法与应用
- 一种用于抗肿瘤药物递送的聚二硫苏糖醇纳米体系及其制备方法和应用
- 一种马铃薯X病毒弱毒疫苗及其制备方法与应用
- 一种气单胞菌多价DNA疫苗的制备方法及其应用
- 一种阳离子脂质体-鱼精蛋白-mRNA肿瘤疫苗及其制备方法和应用方法
- 一种新型冠状病毒mRNA疫苗及其制备方法与应用
