具有分链的多聚寡核苷酸
文献发布时间:2023-06-19 19:30:30
任何优先权申请的引用并入
在与本申请一起提交的PCT请求中确定了外国和国内优先权要求的任何和所有申请通过引用并入本文。
技术领域
本公开涉及多聚寡核苷酸。更具体地,本公开涉及具有分链的多聚寡核苷酸,使用分链合成多聚寡核苷酸的方法,和使用所得寡核苷酸的方法。
背景技术
寡核苷酸是当前公认的一类治疗剂,具有多种应用和正在进行的临床试验。然而,许多因素仍然限制寡核苷酸治疗剂的开发和用途,例如寡核苷酸至靶细胞的递送以及随后将足以实现期望的治疗效果的量的寡核苷酸内化到靶细胞中。
为了解决这一问题,研究了缀合至靶向特定细胞表面受体的配体的寡核苷酸。一种此类配体N-乙酰半乳糖胺(GalNAc)的使用已经成为了寡核苷酸至肝细胞的递送的选择方法,因为其对在这些细胞表面上大量表达的脱唾液酸糖蛋白受体的高度特异性和有效结合。
然而即便使用GalNAc缀合的寡核苷酸,很大比例的化合物也经由通过肾脏的排泄而丢失。为了克服这个问题,已经制备了寡核苷酸多聚体,其中单独的寡核苷酸亚基已经由共价键合的中间体或“接头”连接在一起。这些接头已在合成器上引入或已在寡核苷酸的合成、去保护和纯化之后的水性溶液中引入。
已经采用了多种接头,包括在体内条件下稳定的接头以及其他在靶细胞内裂解从而释放单独的寡核苷酸亚基的接头。最常使用的可裂解接头类型是被细胞内核酸酶裂解的单链无保护核苷酸的短序列如dTdTdTdT和dCdA,以及由细胞内的还原性环境裂解的基于二硫化物的接头。
已经成功用于多聚寡核苷酸的合成的另一种技术是不对称退火,其中经由接头结合至另一个寡核苷酸的单链寡核苷酸退火至互补的单链寡核苷酸,任选地还经由接头结合至另一个寡核苷酸,重复这些步骤直到获得期望长度的多聚体。
同多聚体和异多聚体均已经由这些方法制备,并且4聚体至8聚体范围内的多聚体显示出显著增强的血清半衰期和生物活性。
然而,这些方法存在限制。核酸酶可裂解接头仅可以经由合成器引入。二硫化物连接可以在合成器上引入以及在前体纯化后的水性溶液中引入。然而,在将末端二硫化物还原为硫醇用于随后的连接反应的同时保留多聚体内部的二硫化物基团是不可能的。最后,由于可能发生随机聚合作用,难以将不对称退火方法应用至同多聚体。
因此,需要额外的方法和材料用于多聚寡核苷酸的组装和合成。
发明概述
本公开涉及包含通过共价接头连接在一起的寡核苷酸亚基的多聚寡核苷酸,其中至少一个亚基包含“部分寡核苷酸”。
部分寡核苷酸是完整或全长寡核苷酸的缩短形式。在本公开的部分中,完整或全长单链寡核苷酸表示为
在双链siRNA的上下文中,siRNA的全长或完整正义链可以是21个碱基,而部分正义链可以是10个碱基(例如,来自全长正义链5’末端的前10个碱基)或至全长链3’末端的后11个碱基。在本公开的部分及其附图中,寡核苷酸的全长或完整正义链表示为
本公开还涉及新的合成中间体和合成本文公开的多聚寡核苷酸的方法。
本公开还涉及使用多聚寡核苷酸的方法,例如用于调节基因表达、生物学研究、治疗或预防医学病症和/或产生新的或改变的表型。
本公开提供了包含亚基的多聚寡核苷酸,其中:
每个亚基独立地包含单链或双链寡核苷酸;
每个亚基通过共价接头连接至另一个亚基;并且
至少一个亚基包含至少一个部分单链寡核苷酸。
在多聚寡核苷酸的一个实施方案中,至少一个亚基包含退火至互补链以形成双链亚基的两个部分单链寡核苷酸。
在一个实施方案中,多聚寡核苷酸包含结构1:
其中:
是单链寡核苷酸;
是部分单链寡核苷酸;并且
·是共价接头。
在一个实施方案中,多聚寡核苷酸包含结构2:
其中:
是单链寡核苷酸;
是部分单链寡核苷酸;并且
·是共价接头。
在一个实施方案中,多聚寡核苷酸包含结构3:
其中:
每个
·是共价接头。
在一个实施方案中,结构3是同二聚体。在另一个实施方案中,结构3是异二聚体。
在一个实施方案中,多聚寡核苷酸包含至少一个包含结构4的亚基:
其中:
每个
·是连接至部分单链寡核苷酸和邻近的寡核苷酸亚基的共价接头;并且
...............是互补链。
在一个实施方案中,多聚寡核苷酸包含结构5:
其中:
每个
每个
每个·是将单链寡核苷酸连接至部分单链寡核苷酸的共价接头;并且
............是互补链。
在一个实施方案中,多聚寡核苷酸包含结构6:
其中:
每个
每个
每个·是连接邻近寡核苷酸的共价接头;
每个………是互补链;和
a、b、c、d、e、f、g、h、i、j和k各自独立地是大于或等于零的整数,条件是c、e、h和j中的至少一个大于或等于1。在一个实施方案中,a、b、c、d、e、f、g、h、i、j和k各自独立地是0至10范围内的整数,条件是c、e、h和j中的至少一个大于或等于1。
在一个实施方案中,多聚寡核苷酸包含结构7:
其中:
各自是单链寡核苷酸;
..........各自是互补链;
各自是部分单链寡核苷酸;
·各自是共价接头;
m和n各自独立地是大于或等于1的整数;并且o是大于或等于零的整数。在一个实施方案中,m和n各自独立地是1至10范围内的整数并且o是0至10范围内的整数。
在一个实施方案中,多聚寡核苷酸包含结构8:
其中:
各自是单链寡核苷酸;
...............各自是互补链;
各自是部分单链寡核苷酸;
·各自是共价接头;并且
p和q各自独立地是大于或等于零的整数。在一个实施方案中,p和q各自独立地是0至10范围内的整数。在一个实施方案中,p和q各自独立地是0至3范围内的整数。
在一个实施方案中,多聚寡核苷酸包含结构9:
其中:
各自是单链寡核苷酸;
...............各自是互补链;
各自是部分单链寡核苷酸;
·各自是共价接头;
r是大于或等于1的整数;并且
s是大于或等于零的整数。在一个实施方案中,r是1至10范围内的整数并且s是0至10范围内的整数。在一个实施方案中,r是1至3范围内的整数并且s是0或1。
在一个实施方案中,多聚寡核苷酸包含结构10:
其中:
每个
每个
每个·是连接邻近寡核苷酸的共价接头;并且
每个...............是互补链。
在一个实施方案中,多聚寡核苷酸包含结构11:
其中:
每个
每个
每个·是连接邻近寡核苷酸的共价接头;并且
每个...............是互补链。
在一个实施方案中,多聚寡核苷酸包含结构12:
其中:
每个
每个
每个·是连接邻近寡核苷酸的共价接头;并且
每个...............是互补链。
在一个实施方案中,多聚寡核苷酸包含结构13:
其中:
每个
每个
每个·是连接邻近寡核苷酸的共价接头;并且
每个...............是互补链。
在一个实施方案中,多聚寡核苷酸包含结构14:
其中:
每个
每个
每个·是连接邻近寡核苷酸的共价接头;并且
每个……………是互补链。
在实施方案中,多聚寡核苷酸包含结构15:
其中:
每个
每个
每个·是连接邻近寡核苷酸的共价接头;并且
每个……………是互补链。
在一个实施方案中,多聚寡核苷酸包含结构16:
其中每个
每个...............是互补链;
每个
t和u各自独立地是大于或等于0的整数,条件是t和u中的至少一个是大于或等于1的整数。在一个实施方案中,t和u各自独立地是0至10范围内的整数,条件是t和u中的至少一个是大于或等于1的整数。在一个实施方案中,t和u各自独立地是0至3范围内的整数,条件是t和u中的至少一个是大于或等于1的整数。
在多聚寡核苷酸的一个实施方案中,每个部分单链寡核苷酸的长度是5-14个核苷酸。
在多聚寡核苷酸的一个实施方案中,至少两个亚基针对不同的细胞靶标具有活性。在一个实施方案中,所有亚基针对不同的细胞靶标具有活性。
在多聚寡核苷酸的一个实施方案中,至少两个亚基针对相同的细胞靶标具有活性。在一个实施方案中,所有亚基针对相同的细胞靶标具有活性。
在一个实施方案中,多聚寡核苷酸中的每个核酸是RNA、DNA或者人工或非天然核酸类似物。
在一个实施方案中,多聚寡核苷酸中的每个核酸是RNA、DNA或者人工或非天然核酸类似物。
在多聚寡核苷酸的一个实施方案中,至少一个亚基是siRNA、saRNA或miRNA。
在多聚寡核苷酸的一个实施方案中,所有亚基都是siRNA。
在多聚寡核苷酸的一个实施方案中,所有亚基都是saRNA。
在多聚寡核苷酸的一个实施方案中,所有亚基都是miRNA。
在多聚寡核苷酸的一个实施方案中,至少一个亚基是单链亚基。
在多聚寡核苷酸的一个实施方案中,至少一个单链亚基是反义寡核苷酸。
在多聚寡核苷酸的一个实施方案中,至少一个共价接头包含可裂解的共价接头。
在一个实施方案中,至少一个可裂解共价接头中的一个或多个含有酸可裂解键、还原剂可裂解键、生物可裂解键或酶可裂解键。
在一个实施方案中,共价接头在细胞内条件下是可裂解的。
在一个实施方案中,共价接头各自独立地是二硫键或结构25的化合物:
其中:
S通过共价键或通过接头附接至寡核苷酸亚基;
每个R
R
每个X独立地选自:
后者的结构是表示两种可能的“开环”位置异构体的复合结构,其是琥珀酰胺酸的衍生物。
在一个实施方案中,结构25的化合物是
其中每个末端S通过共价键或通过接头附接至寡核苷酸亚基。
在一个实施方案中,结构25的化合物是根据结构26的化合物:
其中每个末端S通过共价键或通过接头附接至寡核苷酸亚基;并且其中结构26中的开环是表示两种可能的开环位置异构体的复合结构,其是琥珀酰胺酸的衍生物。
在一个实施方案中,结构25的化合物是根据结构27的化合物:
其中每个末端S通过共价键或通过接头附接至寡核苷酸亚基;并且其中结构27中的开环是表示两种可能的开环位置异构体的复合结构,其是琥珀酰胺酸的衍生物。
在一个实施方案中,结构25的化合物是根据结构28的化合物:
其中每个末端S通过共价键或通过接头附接至寡核苷酸亚基;并且其中结构式28中的开环结构是复合结构,其中每个代表两种可能的开环位置异构体,其是琥珀酰胺酸的衍生物。
在一个实施方案中,结构25的共价接头从结构29的共价接头前体形成:
其中每个R1独立地是C
在一个实施方案中,多聚寡核苷酸中的至少一个共价接头附接至寡核苷酸亚基的3’或5’端。在一个实施方案中,化合物或多聚寡核苷酸中的所有共价接头附接至寡核苷酸亚基的3’或5’端。
在一个实施方案中,至少一个共价接头附接至寡核苷酸亚基的内部核苷酸。
在一个实施方案中,至少一个共价接头·包含核苷酸接头。在一个实施方案中,核苷酸接头的长度在2-6个核苷酸之间。在一个实施方案中,核苷酸接头是UpUpUp,其中“U”是尿苷并且“p”是磷酸。在一个实施方案中,核苷酸接头是dTpdTpdTpdTp,其中“dT”是胸苷并且“p”是磷酸。
在多聚寡核苷酸的一个实施方案中,每个共价接头·是相同的。在多聚寡核苷酸的一个实施方案中,每个共价接头·是不同的。
在一个实施方案中,至少两个亚基通过第一亚基的3’末端和第二亚基的3’末端之间的共价接头·连接。在一个实施方案中,至少两个亚基通过第一亚基的5’末端和第二亚基的3’末端之间的共价接头·连接。在一个实施方案中,至少两个亚基通过第一亚基的5’末端和第二亚基的5’末端之间的共价接头·连接。
在一个实施方案中,多聚寡核苷酸进一步包含不是寡核苷酸的化学或生物化合物。
在一个实施方案中,化合物或多聚寡核苷酸至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%纯。
本公开提供了合成包含结构16的多聚寡核苷酸的方法:
其中每个
所述方法包括使结构17
和结构18
以及互补链...............退火,从而形成结构16。在一个实施方案中,t和u各自独立地是1至10范围内的整数。在一个实施方案中,t和u各自独立地是1至3范围内的整数。
在一个实施方案中,本公开提供了合成包含结构8的多聚寡核苷酸的方法:
其中每个
所述方法包括使结构19,
结构20,
和一个或多个结构21,
以及互补链..............退火,从而形成结构8。在一个实施方案中,p和q各自独立地是1至10范围内的整数。在一个实施方案中,p和q各自独立地是1至3范围内的整数。
在一个实施方案中,本公开提供了合成包含结构9A的多聚寡核苷酸的方法:
其中每个
所述方法包括使结构22,
结构23,
和一个或多个结构24
以及互补链...............退火,从而形成结构9A。在一个实施方案中,r和s各自独立地是1至10范围内的整数。在一个实施方案中,r和s各自独立地是1至3范围内的整数。
在一个实施方案中,本公开提供了合成包含结构9B的多聚寡核苷酸的方法:
其中每个
所述方法包括使结构22,
一个或多个结构24
和部分单链寡核苷酸
本公开提供了包含多聚寡核苷酸和药学上可接受的赋形剂的组合物。
本公开了提供了多聚寡核苷酸在制备药物中的用途。
本公开提供了包括向受试者施用有效量的多聚寡核苷酸的对受试者的治疗。
下文更详细描述了这些和其他实施方案。
附图说明
图1示出了多种合成结构模块和用于制备根据本公开的多聚寡核苷酸的用于衍生结构模块的方案。在图示实施方案中,完整的正义链、5’-分裂正义链和3’-分裂正义链各自衍生以含有能够与硫醇基团反应的马来酰亚胺(Mal)末端基团。
图2示出了用于合成双链寡核苷酸亚基的三聚体的方案,其中中间亚基包含分裂正义链。
图3示出了用于合成双链寡核苷酸亚基的四聚体的方案,其中中间两个亚基各自包含分裂正义链。任选地细胞或组织靶向配体(Lig)缀合至一个或两个末端亚基。符号-CL-表示可裂解接头。
图4示出了用于合成双链寡核苷酸亚基的三聚体的方案,其中中间亚基包含分裂正义链。符号-SH表示硫醇基团;并且-Mal表示马来酰亚胺基团。(Lig)表示细胞或组织靶向配体,其可以存在或不存在。符号-CL-表示可裂解接头。“至五聚体”意味着可以分离所示合成中间体并用于如图6所示的双链寡核苷酸亚基的五聚体的合成。
图5示出了用于合成双链寡核苷酸亚基的四聚体的方案,其中中间两个亚基各自包含分裂正义链。符号-SH表示硫醇基团;并且-Mal表示马来酰亚胺基团。(Lig)表示细胞或组织靶向配体,其可以存在或不存在。符号-CL-表示可裂解接头。“至五聚体”意味着可以分离所示合成中间体并用于如图6所示的双链寡核苷酸亚基的五聚体的合成。
图6示出了用于合成双链寡核苷酸亚基的五聚体的方案,其中中间三个亚基各自包含分裂正义链。符号-SH表示硫醇基团;并且-Mal表示马来酰亚胺基团。(Lig)表示细胞或组织靶向配体,其可以存在或不存在。符号-CL-表示可裂解接头。“Ex三聚体”意指所示起始材料出自图4中所示的合成方案。“Ex四聚体”意指所示起始材料出自图5中所示的合成方案。
图7示出了用于合成双链寡核苷酸亚基的六聚体的方案,其中中间四个亚基各自包含分裂正义链。符号-SH表示硫醇基团;并且-Mal表示马来酰亚胺基团。(Lig)表示细胞或组织靶向配体,其可以存在或不存在。符号-CL-表示可裂解接头。“至七聚体”意味着可以分离所示合成中间体并用于如图8所示的双链寡核苷酸亚基的七聚体的合成。“至八聚体”意味着可以分离所示合成中间体并用于如图9所示的双链寡核苷酸亚基的八聚体的合成。
图8示出了用于合成双链寡核苷酸亚基的七聚体的方案,其中中间五个亚基各自包含分裂正义链。符号-SH表示硫醇基团;并且-Mal表示马来酰亚胺基团。(Lig)表示细胞或组织靶向配体,其可以存在或不存在。符号-CL-表示可裂解接头。“Ex六聚体”意指所示起始材料或合成中间体出自图7中所示的合成方案。“至八聚体”意指可以分离所示合成中间体并用于如图9所示的双链寡核苷酸亚基的八聚体的合成。
图9示出了用于合成双链寡核苷酸亚基的八聚体的方案,其中中间六个亚基各自包含分裂正义链。符号-SH表示硫醇基团;并且-Mal表示马来酰亚胺基团。(Lig)表示细胞或组织靶向配体,其可以存在或不存在。符号-CL-表示可裂解接头。“Ex六聚体”意指所示起始材料出自图7中所示的合成方案。“Ex七聚体”意指所示合成中间体出自图8中所示的合成方案。
图10示出了用于合成双链寡核苷酸亚基的异五聚体的方案,其中中间三个亚基各自包含分裂正义链。异五聚体包含第一寡核苷酸的4个亚基;其中的一个包含完整正义链(命名为5’-Sense-3’)并且其中的其它三个各自包含由命名为5’-Se和nse-3’的两条部分链组成的分裂正义链。5’-OTHER-3’表示不同于5’-Sense-3’的寡核苷酸序列。正如将容易理解的,5’-OTHER-3’的互补链不同于5’-Sense-3’的互补链。符号-SH表示硫醇基团;并且-Mal表示马来酰亚胺基团。(Lig)表示细胞或组织靶向配体,其可以存在或不存在。符号-CL-表示可裂解接头。“Ex三聚体”意味着所示起始材料出自图4中所示的合成方案。
图11示出了用于合成靶向人DMPK mRNA的siRNA的三聚体的方案。符号-SH表示硫醇基团;并且-Mal表示马来酰亚胺基团。(Lig)表示细胞或组织靶向配体,其可以存在或不存在。符号-CL-表示可裂解接头。
图12示出了用于合成靶向人亨廷顿蛋白(Huntingtin)mRNA的siRNA的三聚体的方案。符号-SH表示硫醇基团;并且-Mal表示马来酰亚胺基团。(Lig)表示细胞或组织靶向配体,其可以存在或不存在。符号-CL-表示可裂解接头。
发明详述
寡核苷酸亚基
本文所述的多聚寡核苷酸由通过一个或多个共价接头连接的两个或更多个寡核苷酸亚基组成。寡核苷酸亚基包括但不限于RNA、DNA、其组合,或可以包含人工或非天然核酸类似物。在多种实施方案中,寡核苷酸是单链的。在多种实施方案中,寡核苷酸是双链的(例如,反向平行双链)。
双链寡核苷酸亚基从互补链形成。在该公开中,双链寡核苷酸亚基可以包含两条完整或全长互补链;或双链寡核苷酸亚基可以包含退火至全长互补链的两条部分链。互补性可以是100%互补,或小于100%互补,其中反义寡核苷酸在相关条件下(例如,生理学相关条件)仍然杂交并保持双链。例如,双链寡核苷酸可以是至少约80%、85%、90%或95%互补。在一些实施方案中,双链寡核苷酸是平末端的(对称寡核苷酸)。在一些实施方案中,双链寡核苷酸在一条链上具有末端悬垂(例如,2-5个悬垂核苷酸)或在其每条链上具有末端悬垂(在每种情况下,是不对称寡核苷酸)。
在其中结构或实施方案含有退火至全长互补链的两个部分单链寡核苷酸的每种情况下,其可以是以下情况:(A)全长互补链中的每个核苷酸与一条或另一条部分寡核苷酸链中的核苷酸配对,在这种情况下部分寡核苷酸共同表示互补链的“切口”形式;或(B)全长互补链中的一些核苷酸不与一条或另一条部分寡核苷酸中的核苷酸配对,在这种情况下部分寡核苷酸共同表示互补链的“缺口”形式。在(A)情况或(B)情况中,互补链将与与其配对以形成双链结构的部分单链寡核苷酸具有充分的互补性。关于多种内部片段化siRNA单体结构的细节公开于US 8,329,888 B2,其通过整体引用并入本文。
除非另有说明,否则在本公开全文描述的所有结构中,每个寡核苷酸(无论全长或部分)不限于单一方向并且可以理解为具有5’至3’取向或3’至5’取向并且可以经由其5’或3’末端连接至另一个寡核苷酸(无论全长或部分)。
本公开适用于所有类型的双链的和单链的寡核苷酸,包括例如小干扰RNA(siRNA)、小激活RNA(saRNA)、miRNA、piwi相互作用RNA(piRNA)、所有变体的反义寡核苷酸、适体和核酶。
在各种实施方案中,寡核苷酸是RNA、例如反义RNA(aRNA)、CRISPR RNA(crRNA)、长非编码RNA(lncRNA)、微小RNA(miRNA)、piwi相互作用RNA(piRNA)、小干扰RNA(siRNA)、信使RNA (mRNA)、短发夹RNA(shRNA)、小激活RNA(saRNA)或核酶。
在各种实施方案中,寡核苷酸是DNA或RNA适体。
在一些实施方案中,寡核苷酸是CRISPR向导RNA,或与Cas核酸酶在体内、体外或离体形成核糖核复合物(RNP)相关或必要的其它RNA,或与使用Cas核酸酶进行基因组编辑或工程化功能相关或必要的其它RNA,所述Cas核酸酶包括例如野生型Cas核酸酶,或野生型Cas的任何已知修饰,如切口酶或死亡Cas(dCas)。CRISPR-Cas系统描述于例如美国专利号8,771,945;Jinek等人,Science,337(6096):816-821(2012),和国际专利申请公开号WO2013/176772中。
在一些实施方案中,寡核苷酸是DNA,例如反义DNA(aDNA)(例如,antagomir)或反义gapmer。aDNA的实例包括gapmer和multimer,描述于例如Subramanian等人,NucleicAcids Res,43(19):9123–9132(2015)和国际专利申请公开号WO 2013/040429中。antagomir的实例描述于例如美国专利号7,232,806中。
在各种实施方案中,根据本公开的寡核苷酸进一步包含化学修饰。化学修饰可以包含修饰的核苷、修饰的骨架、修饰的糖和/或修饰的末端。
修饰可以包括含磷连接,其包括但不限于硫代磷酸酯、富含对映异构体的硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基和其他烷基膦酸酯,其包含3’亚烷基膦酸酯和富含对映异构体的膦酸酯,次膦酸酯、氨基磷酸酯,其包含3’-氨基氨基磷酸酯和氨基烷基氨基磷酸酯、硫代氨基磷酸酯、硫代烷基膦酸酯、硫代烷基磷酸三酯和具有正常3’-5’连接的硼酸磷酸酯、这些的2’-5’连接类似物,以及具有反转极性的那些,其中相邻的核苷单元对3’-5’至5’-3’或由2’-5’至5’-2’连接。
在各种实施方案中,寡核苷酸可以包含一个或多个硫代磷酸酯基团。寡核苷酸可以在5’末端包含一至三个硫代磷酸酯基团。寡核苷酸可以在3’末端包含一至三个硫代磷酸酯基团。寡核苷酸可以在5’末端和3’末端包含一至三个硫代磷酸酯基团。在各种实施方案中,多缀合物中含有的每个寡核苷酸可以总共包含1-10个硫代磷酸酯基团。在某些实施方案中,每个寡核苷酸可以总共包含少于10个、少于9个、少于8个、少于7个、少于6个、少于5个、少于4个、或少于3个硫代磷酸酯基团。在某些实施方案中,相较于具有更多硫代磷酸酯基团的单体形式的相同寡核苷酸,多缀合物中含有的寡核苷酸可以在具有更少的硫代磷酸酯基团的情况下具有增加的体内活性。
反义寡聚体可以使用本领域已知的多种策略修饰以产生多种效应,包括例如提高在体外和体内的效力和稳定性。这些策略包括:人工核酸,例如2’-O-甲基取代的RNA;2’-氟-2’脱氧RNA,肽核酸(PNA);吗啉代;锁核酸(LNA);解锁核酸(UNA);桥接核酸(BNA);乙二醇核酸(GNA);和苏糖核酸(TNA);或更通常地,核酸类似物,例如双环和三环核苷类似物,其与天然存在的RNA和DNA在结构上相似但在天然存在的分子的磷酸骨架、糖、或碱基部分的一个或多个中具有改变。典型地,类似物核碱基赋予相较于其它不同的碱基配对和碱基堆叠特性。实例包括可以与所有四种标准碱基配对的通用碱基。磷酸糖骨架类似物的实例包括但不限于PNA。基于吗啡代的寡聚化合物描述于Braasch等人,Biochemistry,41(14):4503-4510(2002)和美国专利号5,539,082;5,714,331;5,719,262;和5,034,506中。
在本文所述的制备方法中,一些寡核苷酸通过化学官能团取代在末端修饰。取代可以在寡核苷酸的3’或5’末端进行,并且可以在单体的正义链和反义链两者的3’末端进行,但不总是局限于此。化学官能团可以包括例如,巯基(-SH)、羧基(-COOH)、胺基(-NH2)、羟基(-OH)、甲酰基(-CHO)、羰基(-CO-)、醚基(-O-)、酯基(-COO-)、硝基(-NO2)、叠氮基(-N3)或磺酸基(-SO3H)。
寡核苷酸可以额外地或替代性地修饰以包括核碱基(在本领域中简称为“碱基”)修饰或取代。修饰的核碱基包括在天然核酸中很少或短暂发现的核碱基,例如,次黄嘌呤、6-甲基腺嘌呤、5-Me嘧啶、5-甲基胞嘧啶(也称为5-甲基-2’脱氧胞嘧啶并且在本领域中通常称为5-Me-C)、5-羟甲基胞嘧啶(HMC)、糖基HMC和龙胆二糖基HMC,以及合成核碱基,例如,2-氨基腺嘌呤、2-(甲基氨基)腺嘌呤、2-(咪唑基烷基)腺嘌呤、2-(氨基烷基氨基)腺嘌呤或其他杂取代的烷基腺嘌呤、2-硫尿嘧啶、2-硫嘧啶、5-溴尿嘧啶、5-羟甲基尿嘧啶、8-氮鸟嘌呤、7-脱氮鸟嘌呤、N6(6-氨基己基)腺嘌呤和2,6-二氨基嘌呤。Kornberg,A.,DNAReplication,W.H.Freeman&Co.,San Francisco,pp 75-77(1980);Gebeyehu等人,Nucl.Acids Res,15:4513(1997)。还可以包括本领域已知的“通用”碱基,例如肌苷或假尿苷。5-Me-C取代可将核酸双链体稳定性提高0.6-1.2℃(Sanghvi,Y.S.,in Crooke,S.T.andLebleu,B.,eds.,Antisense Research and Applications,CRC Press,Boca Raton,pp276-278(1993))并且是碱基取代的方面。修饰的核碱基可以包括其他合成的和天然的核碱基,如5-甲基胞嘧啶(5-me-C)、5-羟甲基胞嘧啶、黄嘌呤、次黄嘌呤、2-氨基腺嘌呤、腺嘌呤和鸟嘌呤的6-甲基和其他烷基衍生物、腺嘌呤和鸟嘌呤的2-丙基和其他烷基衍生物、2-硫脲嘧啶、2-硫嘧啶和2-硫胞嘧啶、5-卤尿嘧啶和胞嘧啶、5-丙炔基尿嘧啶和胞嘧啶、6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶、5-尿嘧啶(假尿嘧啶)、4-硫尿嘧啶、8-卤代、8-氨基、8-硫醇、8-硫代烷基、8-羟基和其他8-取代的腺嘌呤和鸟嘌呤、5-卤代,如5-溴、5-三氟甲基和其他5-取代的尿嘧啶和胞嘧啶、7-甲基鸟嘌呤和7-甲基腺嘌呤、8-氮杂鸟嘌呤和8-氮杂腺嘌呤、7-脱氮鸟嘌呤(7-deazaguanine)和7-脱氮腺嘌呤(7-deazaadenine)以及3-脱氮鸟嘌呤(3-deazaguanine)和3-脱氮腺嘌呤(3-deazaadenine)。核酸末端的羟基(-OH)可以由官能团如巯基(-SH)、羧基(-COOH)或胺基(-NH2)取代。取代可以在3’末端或5’末端进行。
共价接头
存在于多聚寡核苷酸中并用于多聚寡核苷酸的合成中的共价接头可以是可裂解的或不可裂解的。可裂解的接头可以经选择或设计以在施用时保持稳定性,同时在递送时或在细胞内条件下裂解,以促进多聚寡核苷酸的单独寡核苷酸亚基的功能递送。除了本文提供的共价接头的实例之外,普通技术人员还将认识到广泛种类的共价接头,包括它们的组成、合成和用途是本领域已知的并且可以适用于与本公开一致的用途。
核苷酸接头是一类共价接头的一个实例,包括例如核酸序列如尿苷-尿苷-尿苷(UUU)、核酸内切酶可裂解接头dCdA和dTdTdTdT。核苷酸接头含有一个或多个经选择的核苷酸使得序列不执行任何其它指定功能。在本公开的各个方面,共价接头可以包含长度为2-6个核苷酸的核苷酸接头。
在本公开的各个方面,共价接头包含亲核基团和亲电基团的反应产物。例如,共价接头可以包含硫醇和马来酰亚胺、硫醇和乙烯砜、硫醇和吡啶基二硫化物、硫醇和碘乙酰胺、硫醇和丙烯酸酯、叠氮化物和炔烃、或胺基和羧基的反应产物。如本文所述,这些基团中的一个连接至例如多缀合物的取代基(例如,取代基上的硫醇(-SH)官能化)并且另一个基团存在于最终连接两个寡核苷酸(例如,DTME中的马来酰亚胺)的第二分子(例如,连接剂)上。
包含硫醇和马来酰亚胺的反应产物的共价接头包括但不限于DTME(二硫代双马来酰亚胺乙烷)、BM(PEG)2(1,8-双(马来酰亚胺)二乙二醇)、BM(PEG)3(1,11-双马来酰亚胺-三乙二醇)、BMOE(双马来酰亚胺乙烷)、BMH(双马来酰亚胺己烷)或BMB(1,4-双马来酰亚胺丁烷)。DTME是有利的,因为其含有在细胞溶质的还原环境中可以细胞内裂解的内部二硫化物。
在本公开的各个方面,共价接头可以包含非离子亲水性聚合物如聚乙二醇(PEG)、聚乙烯吡咯烷酮和聚恶唑啉,或疏水聚合物如PLGA和PLA。
用作共价键介体的聚合物连接剂包括但不限于非离子亲水性聚合物,包括聚乙二醇(PEG)、Pluronic、聚乙烯吡咯烷酮、聚恶唑啉或其共聚物;或一种或多种可生物裂解的聚酯聚合物,包括聚-L-乳酸、聚-D-乳酸、聚-D,L-乳酸、聚-乙醇酸、聚-D-乳酸-乙醇酸共聚物、聚-L-乳酸-乙醇酸共聚物、聚-D,L-乳酸-乙醇酸共聚物、聚己内酯、聚戊内酯、聚羟基丁酸酯、聚羟基戊酸酯或其共聚物。
连接剂可以具有约100-10000道尔顿的分子量。此类连接剂的实例包括二硫双马来酰亚胺乙烷(DTME)、1,8-双马来酰亚胺二乙二醇(BM(PEG)2)、三-(2-马来酰亚胺乙基)-胺(TMEA)、三琥珀酰亚胺基氨基三乙酸酯(TSAT)、3-臂-聚(乙二醇)(3-臂PEG)、马来酰亚胺、N-羟基琥珀酰亚胺(NHS)、乙烯砜、碘代乙酰基、硝基苯基叠氮化物、异氰酸酯、吡啶基二硫化物、酰肼和羟苯基叠氮化物。
包含可裂解键或不可裂解键的连接剂可用于本文,并且实际上在一些情况下,可以在相同的多缀合物中一起使用。包含不可裂解键的连接剂包括但不限于包含酰胺键或氨基甲酸酯键的那些。包含可裂解键的连接剂包括但不限于包含酸可裂解键(例如,酯、腙、或乙缩醛的共价键)、还原剂可裂解键(例如,二硫键)、生物可裂解键、或酶可裂解键(例如,基于核酸的接头或基于寡肽的接头)的那些。在一些情况下,可裂解共价接头在细胞内条件下是可裂解的。另外地,可用于药物缀合的任何连接剂可以不受限制的用于本发明的前述方面。
此外,官能团和连接剂的组合可以包括:(a)当官能团是氨基或硫醇时,连接剂可以是琥珀酰亚胺基3-(2-吡啶基二硫代)丙酸酯,或琥珀酰亚胺基6-([3(2-吡啶基二硫)丙酰氨基]己酸酯;(b)当官能团是氨基时,连接剂可以是3,3’二硫代二丙酸二-(N-琥珀酰亚胺酯)、二硫代-双(1H-咪唑-1-羧酸乙酯)或二硫代-双(1H-咪唑-1-羧酸乙酯);(c)当官能团是氨基或炔烃时,连接剂可以是磺基-N-琥珀酰亚胺基3-[[2-(对-叠氮基水杨基氨基)乙基]-1,3’-二硫代]丙酸酯;(d)当官能团是硫醇时,连接剂可以是二硫代-双-马来酰亚胺乙烷(DTME)、1,8-双-马来酰亚胺基二乙二醇(BM(PEG)2),或二硫代双(磺基琥珀酰亚胺基丙酸酯)(DTSSP)。
在制备和合成本文提供的合成中间体和多聚寡核苷酸的各种方法中,可以存在涉及官能团的活化的步骤。可以用于官能团活化的化合物包括但不限于1-乙基-3,3-二甲基氨基丙基碳二亚胺、咪唑、N-羟基琥珀酰亚胺、二氯己基碳二亚胺、N-β-马来酰亚胺丙酸、N-β-马来酰亚胺丙基琥珀酰亚胺酯或N-琥珀酰亚胺3-(2-吡啶基二硫代)丙酸酯。
共价接头的进一步实例以及制备和使用它们的方法描述于WO2016/205410、WO2018/145086和WO 2020/180897中,其中每个通过引用并入本文。
化学或生物化合物
任何多聚寡核苷酸可以包含不是寡核苷酸的化学或生物化合物。此类化学或生物化合物包括但不限于氨基酸、肽、蛋白质、脂质、碳水化合物、羧酸、维生素、类固醇、木质素、小分子(例如,小分子治疗剂或药物小分子)、有机金属化合物或任何前述的衍生物。
在本发明的一些方面,化学或生物化合物可以包含靶向细胞或组织的部分,例如但不限于对给定的细胞表面受体特异的配体。靶向细胞或组织的部分的实例包括但不限于亲脂部分,如磷脂;(DNA或RNA,或其衍生物的)适体;肽和蛋白质,如抗原结合肽或蛋白质;小分子;维生素,如生育酚和叶酸;其他叶酸受体结合配体;碳水化合物,如N-乙酰半乳糖胺(GalNAc)和甘露糖;其他甘露糖受体结合配体;胆固醇;羧酸,如2-[3-(1,3-二羧丙基)-脲基]戊二酸(DUPA);和苯甲酰胺的衍生物,如茴香酰胺。
靶向细胞或组织的亲脂部分可以包含阳离子基团。在本公开的一些方面,亲脂部分包含胆固醇、维生素E、维生素K、维生素A、叶酸或阳离子染料(例如,Cy3)。其他亲脂部分包括但不限于胆酸、金刚烷乙酸、1-芘丁酸、二氢睾酮、1,3-双-O(十六烷基)甘油、香叶基氧基己基、十六烷基甘油、龙脑莰醇、薄荷醇、1,3-丙二醇、十七烷基、棕榈酸、肉豆蔻酸、O3-(油酰)石胆酸、O3-(油酰)胆酸、二甲氧基三苯甲基或吩噁嗪。
抗原结合蛋白的实例包括但不限于单克隆抗体、单链可变片段(ScFv)或VHH抗原结合蛋白。
基于GalNAc的生物部分的实例包括但不限于单触角GalNAc、双触角GalNAc和三触角GalNAc。
其他生物部分的一些或全部可以具有靶向细胞或组织特性,包括但不限于脂肪酸,如胆固醇;石胆酸(LCA);二十碳五烯酸(EPA);二十二碳六烯酸(DHA);二十二烷酸(DCA);类固醇;开环甾类化合物;脂质;神经节苷脂;核苷类似物;内源性大麻素;维生素,如胆碱、维生素A、维生素E、视黄酸和生育酚;以及任何前述的衍生物。
其他基于肽的生物部分,其中的一些或全部可以具有靶向细胞或组织的特性,包括但不限于:APRPG、cNGR(CNGRCVSGCAGRC)、F3(KDEPQRRSARLSAKPAPPKPEPKPKKAPAKK)、CGKRK和/或iRGD(CRGDKGPDC)。
在多个方面,本公开提供了用于核定位信号或序列(NLS)的使用和并入以促进连接至或并入至细胞核的材料的输入。NLS通常是氨基酸序列,其实例为药物递送领域的技术人员所知。
在本公开的一些方面,化学或生物化合物可以包含内含体逃逸部分(EEM),经选择以帮助或使得与其一起递送的其它生物学活性部分破坏内含体膜或以其它方式逃逸内含体或生物部分在细胞内递送时内化其中(如通过内吞作用)的其它细胞器。内含体逃逸部分往往是基于脂质或基于氨基酸的,但可以包含破坏内含体以释放其货物的其它化学实体。EEM的实例包括但不限于氯喹、具有含有疏水氨基酸R基团的基序的肽和蛋白质、以及流感病毒血凝素(HA2)。其它EEM描述于Lonn等人,Scientific Reports,6:32301,2016。
在本公开范围内的其它化学或生物化合物可以包含可检测标记。如本文所用,“可检测标记”具有如本领域技术人员所理解的通常含义。它是指作为多缀合物的取代基并且可以通过成像技术如荧光光谱法检测的化学基团。例如,可检测标记可以是包含在吸收能量后以限定波长发射辐射的荧光团的染料。许多合适的荧光标记或染料是已知的。例如,Welch等人(Chem.Eur.J.5(3):951-960,1999)公开了丹磺酰官能化荧光部分并且Zhu等人(Cytometry 28:206-211,1997)描述了荧光标记Cy3和Cy5的使用。其它标记描述于Prober等人(Science 238:336-341,1987);Connell等人(BioTechniques5(4):342-384,1987),Ansorge等人(Nucl.Acids Res.15(11):4593-4602,1987)以及Smith等人(Nature 321:674,1986)。可商用荧光标记的实例包括但不限于荧光素、罗丹明(如TMR、德克萨斯红或Rox)、alexa、bodipy、吖啶、香豆素、芘、苯并蒽和花青(如Cy2或Cy4)。其它形式的可检测标记包括微粒,包括量子点(Empodocles等人,Nature 399:126-130,1999)、金纳米粒子(Reichert等人,Anal.Chem.72:6025-6029,2000)、微珠(Lacoste等人,Proc.Natl.Acad.Sci USA97(17):9461-9466,2000),以及通过质谱法可检测的标签。可检测标记可以是依赖于与用于检测的另一种化合物的相互作用的多组分标记,如生物素-链霉亲和素系统。
用于治疗疾病和用于调节基因表达的方法
本公开提供了使用公开的多聚寡核苷酸用于可以通过调节基因表达(例如通过上调、或下调或沉默基因表达,或通过影响mRNA剪接)解决的疾病或病症的治疗的方法。本公开的教导将用于使技术人员能够设计和开发多聚寡核苷酸用于此类病症的医学或兽医学治疗,或用于在其它领域如基础研究、农业、诊断学或畜牧业调节基因表达。当期望影响多个基因时,本公开的多聚寡核苷酸能够使用单个化学实体实现多重靶向。
在一个方面,本公开提供了用于治疗患有将受益于调节基因表达的疾病或病症的受试者的方法,该方法包括向受试者施用有效量的根据本公开的多聚寡核苷酸。
在一个方面,本公开提供了用于调节靶基因的基因表达的方法,该方法包括向受试者施用有效量的根据本发明的多聚寡核苷酸。在此类治疗性实施方案中,多聚寡核苷酸将包含至少一个调节基因表达的亚基,例如但不限于siRNA、miRNA、saRNA、或反义寡核苷酸、CRISPR核酸酶、crRNA、以及任何前述的衍生物。
类似地,本公开提供了用于调节两个或更多个靶基因的表达的方法,该方法包括向受试者施用有效量的根据本发明的多聚寡核苷酸,其中多聚寡核苷酸包含在两个或更多个靶基因或基因产物中调节基因表达的亚基。
在本公开的所有前述方面,除修饰基因表达的一个或多个亚基之外,多聚寡核苷酸可以包括产生其它治疗性效果的其它取代基,治疗性效果包括但不限于免疫刺激或抑制、检查点抑制和炎症减少。包含提供多重治疗性效果的取代基的多缀合物将用于复杂疾病和病症如癌症、自身免疫和神经性病症的后期治疗。
受试者
本文公开的可以受益于公开的治疗方法和施用方法的受试者包括但不限于哺乳动物,如灵长类动物、啮齿动物和农业动物。灵长类动物受试者的实例包括但不限于人、黑猩猩和猕猴。啮齿动物受试者的实例包括但不限于小鼠和大鼠。农业动物受试者的实例包括但不限于奶牛、绵羊、羊、鸡和猪。
在这个和其它实施方案中,本公开的多缀合物可以以药物组合物的形式、在递送载体中的形式、或偶联至靶向细胞或组织的配体的形式施用于受试者。
药物组合物
在各个方面,本公开提供了包含本文描述的多聚寡核苷酸的药物组合物。如本文所用,药物组合物包括可以用于预防、诊断、减轻、治疗或治愈疾病的除食物之外的活性剂。类似地,根据本公开的各种多聚寡核苷酸应当理解为包括用作药物和/或用于药物制备的实施方案。
药物组合物可以包括根据本公开的多聚寡核苷酸和药学上可接受的赋形剂。如本文所用,赋形剂可以是与活性成分共同配制的天然的或合成的物质。可以包括赋形剂以用于长期稳定化、增加体积(例如,膨胀剂、填充剂或稀释剂)、或赋予最终剂型中的活性成分的治疗性增强(如促进药物吸收、减少黏度、或增强溶解度)的目的。赋形剂也可以用于制备和分配,例如以帮助处理活性成分和/或延长保存期稳定性(例如,通过预防变性或聚集)。如本领域技术人员将理解的,合适的赋形剂选择可以取决于多种因素,包括施用途径、剂型和活性成分。
多聚寡核苷酸可以以多种方式施用,包括但不限于局部施用或全身施用,并且因此本公开的药物组合物可以相应地变化。施用不限于任何特定的递送途径、系统、或技术并且可以包括而不限于肠胃外(包括皮下、静脉内、髓内、关节内、肌肉内、腹膜内、眼内或CNS注射)、直肠、局部、透皮、口服或吸入(鼻内或通过例如雾化器吸入肺部)。对个体的施用可以如下发生:以单剂量或以重复施用,和以多种生理学上可接受的盐形式的任一种,和/或与作为药物组合物的部分的可接受的药物载剂和/或添加剂一起。生理学上可接受的配制剂以及标准药学配制剂技术、剂量和赋形剂是本领域技术人员众所周知的(参见例如,Physicians’Desk Reference
药物组合物包括有效量的多聚寡核苷酸。如本文所用,“有效量”可以是导致实现特定目的的浓度或数量,例如,例如与安慰剂相比足以引起生物学效应的数量。当有效量是“治疗有效量”时,其可以是足以用于治疗性用途的数量,例如足以预防、诊断、减轻、治疗、或治愈疾病的数量。有效量可以通过本领域已知的方法确定。例如,治疗有效量可以经验性确定,例如通过人体临床试验确定。有效量可以使用本领域已知的转换系数从一种动物(例如,小鼠、大鼠、猴、猪、狗)推测用于另一种动物(例如,人)。参见例如,Freireich等人,Cancer Chemother Reports 50(4):219-244(1966)。
递送构建体和配制剂
如本领域技术人员将理解的,无论何种生物靶标或作用机制,治疗性寡核苷酸必须克服一系列生理障碍以进入生物体(例如,需要治疗的动物,如需要治疗的人)中的靶细胞或组织。治疗性寡核苷酸通常必须避免血流中的清除,进入靶细胞类型,并进入细胞质,并且有时进入细胞核,而在所有情况下都不引发不期望的免疫应答。在各个方面,本公开提供了用于直接递送至细胞和组织靶标的多聚寡核苷酸。
在直接递送策略中,多聚寡核苷酸将需要通常以取代基的化学修饰形式的稳定化,以使得它们能够耐受血清核酸酶和其它因素的降解,并且避免引发先天免疫应答。化学稳定化策略为本领域技术人员所知并且可以容易地与本文公开的多聚寡核苷酸共同使用或适用。
在本公开的一些方面,多聚寡核苷酸配备靶向部分如靶向细胞或组织的配体用于至靶细胞或组织的直接递送,而不需要配制在递送载体中。适合与本公开共同使用的靶向部分的实例包括但不限于亲脂部分(例如,磷脂);适体;肽或蛋白质(例如,精氨酸-甘氨酸-天冬氨酸[RGD]、转铁蛋白、单克隆抗体或其片段,如单链可变片段(ScFv)或VHH抗原结合蛋白);细胞生长因子、小分子、维生素(例如,叶酸、生育酚)、碳水化合物(例如,单糖和多糖、N-乙酰半乳糖胺[GalNAc]、半乳糖、甘露糖);胆固醇;谷氨酸脲(例如,2-[3-(1,3-二羧丙基)-脲基]戊二酸[DUPA])、苯甲酰胺衍生物(例如,茴香酰胺);以及任何前述的衍生物。在一些实施方案中,GalNac靶向部分可以是单触角GalNAc、双触角GalNAc或三触角GalNAc。
亲脂部分可以是包括阳离子基团的配体。在某些实施方案中,亲脂部分是胆固醇、维生素E、维生素K、维生素A、叶酸或阳离子染料(例如,Cy3)。其他亲脂部分包括胆酸、金刚烷乙酸、1-芘丁酸、二氢睾酮、1,3-双-O(十六烷基)甘油、香叶基氧基己基、十六烷基甘油、龙脑莰醇、薄荷醇、1,3-丙二醇、十七烷基、棕榈酸、肉豆蔻酸、O3-(油酰)石胆酸、O3-(油酰)胆酸、二甲氧基三苯甲基或吩噁嗪。
靶向部分可以是脂肪酸,如胆固醇、石胆酸(LCA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)、和二十二酸(DCA)、类固醇、开环甾类化合物、脂质、神经节苷脂或核苷类似物、内源性大麻素、和/或维生素如胆碱、维生素A、维生素E及其衍生物或代谢物,或维生素如视黄酸和α-生育酚琥珀酸酯。
可以使用本公开的教导以及本领域已知的其他技术将靶向部分并入多聚寡核苷酸,包括但不限于共价键、酰胺键或酯键,或经由非共价键如生物素-链霉亲和素或金属-配体络合物。
靶向部分可以与多聚寡核苷酸在末端位置结合,或者在一些情况下,在内部位置结合。在一些实施方案中,将两个靶向部分并入多聚寡核苷酸中,例如,当靶向部分缀合在多聚寡核苷酸的每个末端时。如果期望,可以将多于两个靶向部分在内部和末端的多个位置引入到多聚寡核苷酸中。
在各个方面,本公开提供了内含体逃逸部分(EEM)的使用和并入以促进已由细胞内吞的多聚寡核苷酸的内含体逃逸。内含体逃逸部分通常是基于脂质或基于氨基酸的,但可以包含破坏内含体以释放多聚寡核苷酸或其代谢物的其它化学实体(例如,通过接头的裂解释放的多聚寡核苷酸的亚基)。EEM的实例包括但不限于氯喹、具有含有疏水氨基酸R基团的基序的肽和蛋白质、以及流感病毒血凝素(HA2)。进一步的EEM描述于Lonn等人,Scientific Reports,6:32301,2016。
在各个方面,本公开提供了用于核定位信号或序列(NLS)的使用和并入以促进多聚寡核苷酸或代谢物并入至多聚寡核苷酸递送的细胞的细胞核。NLS通常是氨基酸序列,其实例为药物递送领域的技术人员所知。
本领域技术人员将理解已知递送配制剂、载体和靶向部分通常可以适用于根据本公开的用途。相关的教导和实例公开于美国专利9,644,209和10,597,659;WO 2016/205410A2;WO 2018/145086 A1;和WO 2020/180897,其中每个通过其整体引用并入本文。
以下实施例是说明性的而非限制性的。在审阅本公开后,本技术的多种变体将对本领域技术人员显而易见。本技术的范围因此不应当参照实施例来确定,而应参照所附权利要求及其等同物的全部范围来确定。
实施例
实施例1:单链寡核苷酸合成
使用亚磷酰胺化学将寡核苷酸以10μmol的规模装配在ABI 394和3900合成器(Applied Biosystems)上,或以28μmol的规模装配在Oligopilot 10合成器上。固体支持物是负载有2’-脱氧胸腺嘧啶核苷的聚苯乙烯(Glen Research,Sterling,Virginia,USA)或受控孔玻璃(CPG,
随后,将粗提寡聚体使用填充有Source Q15(GE Healthcare)的柱和AKTAExplorer系统(GE Healthcare)通过阴离子交换HPLC进行纯化。缓冲液A是pH 7.4的10mM高氯酸钠、20mM Tris、1mM EDTA(Fluka,Buchs,Switzerland)的20%乙腈水溶液,并且缓冲液B与缓冲液A相同但具有500mM高氯酸钠。使用32个柱体积(CV)内的22%B至42%B的梯度。记录280nm处的UV迹线。汇集合适的级分并使用pH=5.2的3M NaOAc和70%乙醇沉淀。通过离心收集沉淀。替代性地,根据制造商的建议使用Sephadex HiPrep柱(GEHealthcare)进行脱盐。
在水中复溶寡核苷酸并通过电喷雾电离质谱(ESI-MS)确认寡核苷酸的身份。通过分析型阴离子交换HPLC评估纯度。
实施例2:硫醇终止的siRNA的生成
必要时,经由1-O-二甲氧基三苯甲基-己基-二硫化物,1’-[(2-氰乙基)-(N,N-二异丙基)]-亚磷酰胺接头(NucleoSyn,Olivet Cedex,France)引入3’或5’末端硫醇基团。在完成固相合成和DMT基团的最终去除(“去DMT合成”)后,将寡核苷酸从固体支持物上裂解并使用由甲胺水溶液(41%)和浓氨水(32%)组成的1:1混合物在10℃下脱保护6小时。随后,将粗寡聚体通过AKTAExplorer系统(GE Healthcare)上的阴离子交换高效液相色谱(HPLC)进行纯化。纯化的(C
然后使用100nM的DL-二硫苏糖醇溶液还原每个含有二硫化物的寡聚体。1.0M DTT储存液(Sigma-Aldrich Chemie GmbH,Munich,Germany,#646563,)使用三乙基碳酸氢铵缓冲液(TEABc,1M,pH 8.5,Sigma,#90360)和水稀释以提供各100mM的DTT和TEABc溶液。将寡核苷酸在TEABc缓冲液(100mM,pH 8.5)中溶解以产生1mM溶液。为了实现二硫化物还原,将50-100倍摩尔过量的DTT添加到寡核苷酸溶液中。通过获自Thermo Fisher的DionexDNAPac 200柱(4x 250mm)上的分析型AEX HPLC监测还原过程。还原物质,即相应的硫醇(C6SH),先于起始物质洗脱。在反应完成后,使用来自GE Healthcare的HiPrep柱以及水作为洗脱剂通过尺寸排阻色谱去除过量的试剂。随后,寡核苷酸使用3M NaOAc(pH 5.2)和乙醇沉淀并在-20℃储存。
实施例3:单-DTME寡聚体的制备
将硫醇修饰的寡核苷酸溶解在含有25%乙腈的300mM NaOAc(pH 5.2)中以提供20OD/mL的溶液。将40当量的二硫代双马来酰亚胺乙烷(DTME,Thermo Fisher,#22335)溶解在乙腈中以提供15.6mM的溶液。将DTME溶液添加到含有寡核苷酸的溶液中并在25℃在Thermomixer(Eppendorf,Hamburg,Germany)上搅拌。使用Dionex DNA Pac200柱(4x250mm)通过分析型AEX HPLC监测反应过程。取决于所需的纯度水平,使用HiPrep柱(GEHealthcare)通过尺寸排阻HPLC去除过量的DTME或者使用填充有GE Healthcare市售的Source 15Q树脂的柱通过制备型AEX HPLC纯化粗反应混合物。
实施例4:经由DTME功能制备二聚体
根据实施例2中的程序制备的DTME修饰的寡核苷酸与配备硫醇接头的另一个寡核苷酸反应。该反应可以在单链序列上进行或者在反应配偶体之一的互补寡核苷酸的预先退火之后进行。因此,如果期望,将DTME修饰的寡核苷酸与硫醇修饰的寡核苷酸直接反应,或与其互补链退火并将所得双链体与硫醇修饰的寡核苷酸反应。替代性地,将硫醇修饰的寡核苷酸与其互补链退火并将该双链体与DTME修饰的单链反应。在所有情况下,反应在300mMNaOAc(pH 5.2)存在下的水性溶液中进行。
实施例5:单链RNA(ssRNA)退火以形成双链RNA(dsRNA)
通过混合等摩尔量的互补正义和反义链并在20mM NaCl/4mM磷酸钠pH 6.8缓冲液中退火,从RNA单链生成dsRNA。使用来自GE Healthcare的Superdex 75柱(10x 300mm)通过天然尺寸排阻HPLC确认成功的双链体形成。样品冷冻储存直至使用。
实施例6:3’或5’-NH
使用
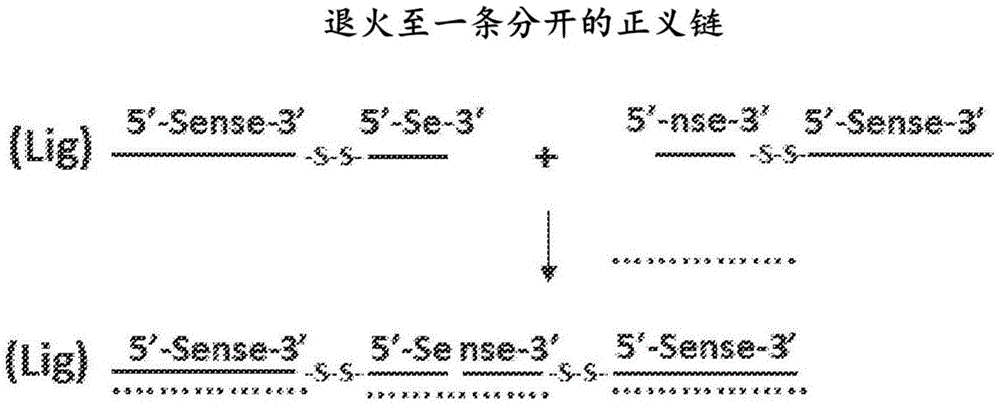
实施例7:经由退火至一条分开的正义链合成分裂链多聚寡核苷酸
根据图2所示的方法合成siRNA的同三聚体。在合成器上制备经由二硫化物接头(在图3中表示为-S-S-)连接至全长siRNA正义链(5’-Sense-3’)的siRNA正义链的部分序列(5’-Se-3’)。同样合成第二序列,其中siRNA正义链的剩余部分(5’-nse-3’)经由二硫化物接头连接至全长siRNA链。任选地配体附接至全长正义链的一个或两个末端。然后将两个部分二聚体与三当量的互补反义链在实施例5中所述的条件下退火以形成靶标同三聚体siRNA。
实施例8:经由退火至两条分开的正义链合成分裂链多聚寡核苷酸
根据图3所示的方法合成siRNA的同四聚体。在合成器上制备经由二硫化物接头(在图3中表示为-S-S-)连接至全长siRNA正义链的siRNA正义链的部分序列(5’-Se-3’)以产生化合物5’-Sense-3’-S-S-5’Se-3’。任选地,配体附接至全长序列的末端。单独地,在合成器上制备对应于siRNA序列的剩余部分并在一个末端带有受保护的硫醇的寡聚体(5’-nse-3’-SSR)。纯化后,将硫醇在实施例2中所述的条件下脱保护并且如实施例3和4中所述经由DTME衍生物(5’-nse-3’-Mal)制备部分siRNA的同二聚体(5’-nse-3’S-CL-S3’-esn-5’)。一当量的5’-nse-3’-同二聚体(5’-nse-3’S-CL-S3’-esn-5’)和两当量的化合物5’-Sense-3’S-S5’Se-3’(任选的具有或不具有配体)在实施例5所述的条件下退火至4当量的反义链以产生含有三个可裂解连接的期望的同四聚体siRNA。
实施例9:经由顺序硫醇-马来酰亚胺反应和不对称退火合成分列链多聚寡核苷酸。结构模块的制备。
使用图1所示的结构模块根据图1和图4-9所述的方法合成siRNA的同多聚体(三聚体至八聚体)。
在合成器上制备具有5’氨基和3’二硫化物的全长siRNA正义链(NH
单独地,在合成器上制备对应于全长链的5’区域的siRNA链的部分序列(5’-Se-3’),其在5’末端具有二硫化物(RSS-5’-Se-3’),该二硫化物经由实施例2中所述的程序如图1所示转化为相应硫醇。将硫醇化产物的部分通过实施例3中所述的程序如图1所示进一步转化为相应的5’-单-DTME衍生物(Mal-5’-Se-3’)。
平行地,在合成器上制备对应于全长链的3’区域的siRNA链的部分序列(5’-nse-3’),其在3’末端具有二硫化物(5’-nse-3’-SSR),该二硫化物经由实施例2中所述的程序如图1所示转化为相应硫醇。将硫醇化产物的部分经由实施例3中所述的程序如图1所示进一步转化为相应的3’-单-DTME衍生物(5’-nse-3’-Mal)。
平行地,在合成器上制备全长siRNA反义链,并且解块并纯化。
实施例10:经由顺序硫醇-马来酰亚胺反应和不对称退火合成分裂链同三聚体。
根据图4所示的方案通过硫醇化全长正义链和部分siRNA序列马来酰亚胺衍生物Mal-5’-Se-3’经由实施例3中的程序反应,然后与两当量的反义链(…………)退火,制备siRNA的同三聚体。将产物与一当量的部分siRNA序列马来酰亚胺衍生物5’-nse-3’-Mal退火,然后通过与一当量的全长双链硫醇化siRNA反应产生期望的同三聚体。
实施例11:经由顺序硫醇-马来酰亚胺反应和不对称退火合成分裂链同四聚体。
根据图5所述的方案制备siRNA的同四聚体。如实施例10中制备具有末端马来酰亚胺的全长和分裂链siRNA的二聚体。单独地,如图5所示通过硫醇化siRNA正义链和分裂链马来酰亚胺衍生物Mal-5’-Se-3’反应,然后通过与2当量的反义链…………和一当量的硫醇化分裂链5’-nse-3’-SH的顺序退火制备具有末端硫醇的全长和分裂链siRNA的第二二聚体。马来酰亚胺官能化双链全长/分裂链二聚体与硫醇官能化双链全长/分裂链二聚体的反应产生具有3个可裂解二硫键的期望的同四聚体。
实施例12:经由顺序硫醇-马来酰亚胺反应合成分裂链同五聚体。
根据图6所示的方案制备siRNA的同五聚体。经由实施例5中所述的条件下顺序添加退火至反义链(…………)的HS-5’-Se-3’,然后添加5’-nse-3’-Mal来延长实施例10中制备的具有末端马来酰亚胺的全长和分裂链siRNA的二聚体,以产生中间体全长/分裂链/分裂链三聚体马来酰亚胺衍生物。在实施例4中所述的条件下使该材料与在实施例11中制备的全长/分裂链硫醇二聚体反应产生期望的同五聚体。
实施例13:经由顺序硫醇-马来酰亚胺反应合成分裂链同六聚体。
根据实施例10中制备的中间体的链延伸的图7所示方案通过在实施例5中所述的条件下如图7所示顺序添加5’-nse-3’-Mal、退火至反义链(………)的HS-5’-Se-3’以及5’-nse-3’-SH制备siRNA的同六聚体。两条三聚体链然后在实施例4中所述的条件下通过硫醇/马来酰亚胺反应连接。
实施例14:经由顺序硫醇-马来酰亚胺反应合成分裂链同七聚体。
siRNA的同七聚体根据图8所示方案通过实施例13中制备的马来酰亚胺衍生的三聚体的链延伸制备,链延伸通过在实施例5中所述的条件下顺序添加退火至反义链(………)的HS-5’-Se-3’以及5’-nse-3’-Mal和5’-nse-3’-SH,然后通过在实施例4中所述的条件下通过硫醇/马来酰亚胺反应连接所得马来酰亚胺衍生的四聚体和来自实施例13的硫醇衍生的三聚体制备。
实施例15:经由顺序硫醇-马来酰亚胺反应合成分裂链同八聚体。
siRNA的同八聚体根据图9所示的方案通过来自实施例13的部分三聚体中间体的链延伸制备,链延伸通过在实施例5中所述的条件下顺序添加5’-nse-3’-Mal、退火至反义链(………)的HS-5’-Se-3’、以及5’-nse-3’-SH。所得硫醇化四聚体然后通过在实施例4中所述的条件下硫醇和马来酰亚胺部分的反应连接至实施例14中获得的马来酰亚胺官能化的四聚体。
实施例16:经由顺序硫醇-马来酰亚胺反应和不对称退火合成siDMPK的分裂链同三聚体
根据图11中的方案制备靶向强直性肌营养不良蛋白激酶mRNA(DMPK)的siRNA的同三聚体。使用实施例2所述的方法在合成器上制备具有3’-硫醇残基的全长DMPK正义链。具有5’硫醇的DMPK正义链的部分序列(5’-DM-3’)(HS-5’-DM-3’)也在合成器上制备并通过实施例2和3中所述的方法转化为相应的单-DTME衍生物(Mal-5’-DM-3’)。然后硫醇化全长链和DTME衍生的部分-长度DMPK链一起反应以形成相应的单链部分二聚体,其然后根据实施例5中的条件与两当量的全长DMPK反义链(………)退火。
还合成包含衍生有3’硫醇的siRNA正义序列的剩余部分(5’-PK-3’)(5’-PK-3’-SH)的第二序列,根据实施例3中的程序转化为相应的单-DTME衍生物并与双链部分二聚体退火以产生具有3’末端马来酰亚胺基团的DMPK的双链全长/分裂链二聚体。该材料然后与3’-硫醇化双链全长DMPK siRNA反应以形成DMPK siRNA的期望同三聚体。
实施例17:经由顺序硫醇-马来酰亚胺反应和不对称退火合成siHTT的分裂链同三聚体
根据图12所示的方案制备靶向亨廷顿蛋白mRNA (DMPK)的siRNA的同三聚体。使用实施例2所述的方法在合成器上制备具有3’-硫醇残基的全长HTT正义链(HTTs)。也在合成器上制备具有5’硫醇的HTT正义链的部分序列(5’-HT-3’)(HS-5’-HT-3’)并通过实施例2和3中所述的方法转化为相应的单-DTME衍生物(Mal-5’-HT-3’)。然后硫醇化全长(HTTs)链和DTME部分-长度(HT)链一起反应以形成相应的单链部分二聚体,其然后根据实施例5中的条件与两当量的全长HTTs反义链(………)退火。
还合成第二序列,其中siRNA正义序列的剩余部分(5’-Ts-3’)衍生有3’硫醇(5’-Ts-3’-SH),根据实施例3中的程序转化为相应的单-DTME衍生物并与双链部分二聚体退火以产生具有3’末端马来酰亚胺基团的HTT的双链全长/分裂链二聚体。该材料然后与3’-硫醇化双链全长HTT siRNA反应以形成HTT siRNA的期望同三聚体。
实施例18:经由顺序硫醇-马来酰亚胺反应合成分裂链异五聚体
根据图10所示的方案制备siRNA的异五聚体。具有完整亚基和有末端马来酰亚胺的分裂链亚基(如实施例10中制备)的第一siRNA的二聚体经由在实施例5所述的条件下顺序添加退火至反义链(………)的HS-5’-Se-3’,然后添加5’-nse-3’-Mal来延长,以产生中间体完整/分裂链/分裂链三聚体马来酰亚胺衍生物。
单独地,具有3’硫醇的完整双链第二siRNA(具有不同于第一siRNA的序列)与第一siRNA的正义链的5’部分序列的5’马来酰亚胺衍生物(Mal-5’-Se-3’)反应,并且产物随后与第一siRNA的全长反义链(………)退火,然后添加第一siRNA的正义链的3’部分序列的3’硫醇化衍生物(5’-nse-3’-SH),以产生硫醇化异三聚体中间体。
硫醇化异三聚体中间体与同三聚体马来酰亚胺衍生物的反应生成具有第一siRNA的四个亚基和第二siRNA的一个亚基的期望的异五聚体。
- 双链寡核苷酸、含双链寡核苷酸的组合物与缀合物及制备方法和用途
- 双链寡核苷酸、含双链寡核苷酸的组合物与缀合物及制备方法和用途
