凝血酶生成能力质控品及其制备方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及凝血检验项目质量控制领域,具体为凝血酶生成能力质控品及其制备方法。
背景技术
凝血酶(thrombin)是机体凝血系统中一类非常重要的丝氨酸蛋白酶,它由308个氨基酸残基组成,分子量为37kD;凝血酶由A链和B链残基组成,通过残基C1和C122之间的二硫键共价连接。B链是酶的活性位点和所有已知的活性表位的入口。位于分子后部的A链被认为是凝血酶原激活过程的附属物。然而,包括A链在内的凝血酶原分子的自然变异与严重出血有关。凝血酶在凝血系统中具有促凝和抗凝双重功能,在抗凝上,可使纤维蛋白原转化为不溶性纤维蛋白凝块,这对于血小板在伤口(病变)部位的固定和愈合过程的启动至关重要;在促凝上,凝血酶通过与完整内皮细胞的凝血调节蛋白结合,进而激活蛋白C发挥抗凝血作用。凝血酶-血栓调节蛋白相互作用降低了凝血酶裂解纤维蛋白原的能力,但增强了酶对活化蛋白C的亲和力。活化蛋白C使活化因子V(FVa)和VIII(FVIIIa)的活性形式失活,这是活化因子X(FXa)和IX(FIXa)的两个基本辅因子,从而降低凝血酶的生成。凝血酶是血液凝血级联反应中的主要效应蛋白酶,血栓与止血过程中发挥着重要的作用。所有血栓风险增加或出血风险增加的机理皆可引起凝血酶生成的增加或减少。凝血酶生成实验能够实时检测样本中凝血酶的生成过程及生产量,检测结果对临床疾病的早期诊断、病程发展、疗效的监测和机体出血凝血状况评估等都具有非常重要的意义。
凝血酶生成能力检测的基本原理是在血浆/血液样本中加入促凝试剂和荧光底物,凝血过程中生成的凝血酶裂解荧光底物,产生荧光基团(7-amino-4-methylcoumarin,AMC),测量变化的荧光信号来反映凝血酶生成的变化。荧光信号由专用计算机软件记录,并与标准曲线进行比对,描绘出凝血酶的产生、增殖和衰减随着时间的推移而生成的曲线,并计算出相关参数。凝血酶生成曲线可以得到以下参数:
1)延迟时间(lagtime,tLag):即从反应开始到凝血酶生成达到阈值所经历的时间;
2)达峰时间(time to peak,tPeak):即从反应开始到凝血酶生成最大量所经历的时间;
3)峰值(Peak Hight,Peak):即凝血酶生成达到的最大量;
4)曲线下面积(Area under the cure,AUC):凝血酶生成曲线下的积分面积,是衡量凝血酶生成功能的综合指标。
常规凝血检测已广泛应用于凝血功能评估,即除了血小板以外出血和凝血是否正常,但也有一些内在的问题:非生理的单独观察凝血级联反应;与临床表型的相关性较差,不能很好地预测出血及血栓形成;只反映了部分凝血酶的生成等。相较于常规凝血检测,凝血酶生成能力能实时监测凝血酶生成反应过程,对产生凝血酶能力进行综合评估。两种方法检测原理不同,可以相互补充,更全面的掌握凝血过程。
随着凝血酶生成能力检测项目不断拓展到疾病诊断和治疗的各个领域,对检测仪器进行检验室内的质量控制也显得尤为重要。
因此,本发明提供一种凝血酶生成能力质控品及其制备方法。
发明内容
本发明的目的在于提供凝血酶生成能力质控品及其制备方法,以解决上述背景技术中提出的问题。
为了解决上述技术问题,本发明提供如下技术方案:
凝血酶生成能力质控品的制备方法,包括以下步骤:
S1:采集新鲜猪全血,将抗凝剂和猪全血混合均匀,离心,收集上层血浆,得到猪血浆;
S2:采集新鲜羊全血,将抗凝剂和羊全血混合均匀,离心,收集上层血浆,得到羊血浆;
S3:将猪血浆和羊血浆混合均匀,得到混合血浆;
S4:将混合血浆分成2部分,第1部分混合血浆用于提取凝血因子;第2部分混合血浆和稀释液混合配制基质血浆;
S5:将凝血因子溶液加入基质血浆中混合均匀,调节凝血酶生成时间参数(tLag和tPeak值)和凝血酶生成量参数(Peak和AUC值),得到质控品母液LI;将质控品母液LI和稀释液混合,调节凝血酶生成时间参数(tLag和tPeak值)和凝血酶生成量参数(Peak和AUC值),得到质控品母液LII。
S6:将质控品母液LI和质控品母液LII分别进行分装,冻干,得到凝血酶生成能力质控品。
进一步的,所述稀释液为3.2%的柠檬酸钠溶液和0.85%氯化钠溶液的混合溶液,柠檬酸钠溶液:氯化钠溶液的体积比为1:9。
进一步的,所述混合血浆:稀释液体积比为1:(0.5-1);基质血浆的tLag参数值为2.0-5.0min,最佳tLag参数值为3.0-4.0min。
进一步的,所述质控品母液LI的tLag值为2.0-5.0min、tPeak值为4.5-9.5min、Peak值为300.0-550.0nM、AUC值为2500.0-3500.0nM。
进一步的,所述质控品母液LI:稀释液体积比的2:(0.5-1);质控品母液LII的tLag值为4.5-8.5min、tPeak值为8.0-15.0min、Peak值为160.0-350.0nM、AUC值为1600.0-2850.0nM。
进一步的,所述凝血因子溶液浓度为0.2-0.5g/mL,凝血因子溶液加入量为基质血浆体积的1±0.1%。
进一步的,所述抗凝剂为3.2%的柠檬酸钠溶液;抗凝剂:猪全血的体积比为1:9;抗凝剂:羊全血的体积比为1:9。
进一步的,所述猪血浆:羊血浆的体积比为1:1。
进一步的,所述提取凝血因子具体步骤为:
将混合血浆在-20±5℃环境中冷冻24-36h,然后置于2-8℃环境中解冻12-18h,过滤,离心,收集下层沉淀,得到凝血因子。
与现有技术相比,本发明所达到的有益效果是:
1、本发明以常用食用动物为原料制备凝血酶生成能力质控品,主原料猪血和羊血为动物产品副产品,来源充足且成本很低。本发明制备工艺简单,所需设备不多,添加剂和调制物少,便于规模化生产;
2、制备的质控品有LI和LII两种规格,可模拟正常和异常凝血两种状态,对tLag、tPeak、Peak、AUC四个参数均能进行质控监测;
3、质控品中的凝血主物料都来自于统一血浆体系,产品相容性好,采取冻干品保存,复溶稳定性好,长期储存稳定性高;
4、原料为动物血浆,基本可以排除以人血为基质的可能存在HIV、HBV、HCV生物危害风险。本发明采取具有动物检疫合格的生猪血浆,因此其他潜在的生物危害风险也非常小。
本发明方法制备的质控品的tLag、tPeak、Peak、AUC四项凝血参数定值区间范围窄,对检测仪器变化敏感,可用于凝血酶生成能力的检验室监控,方便临床使用,能明显降低检测成本。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
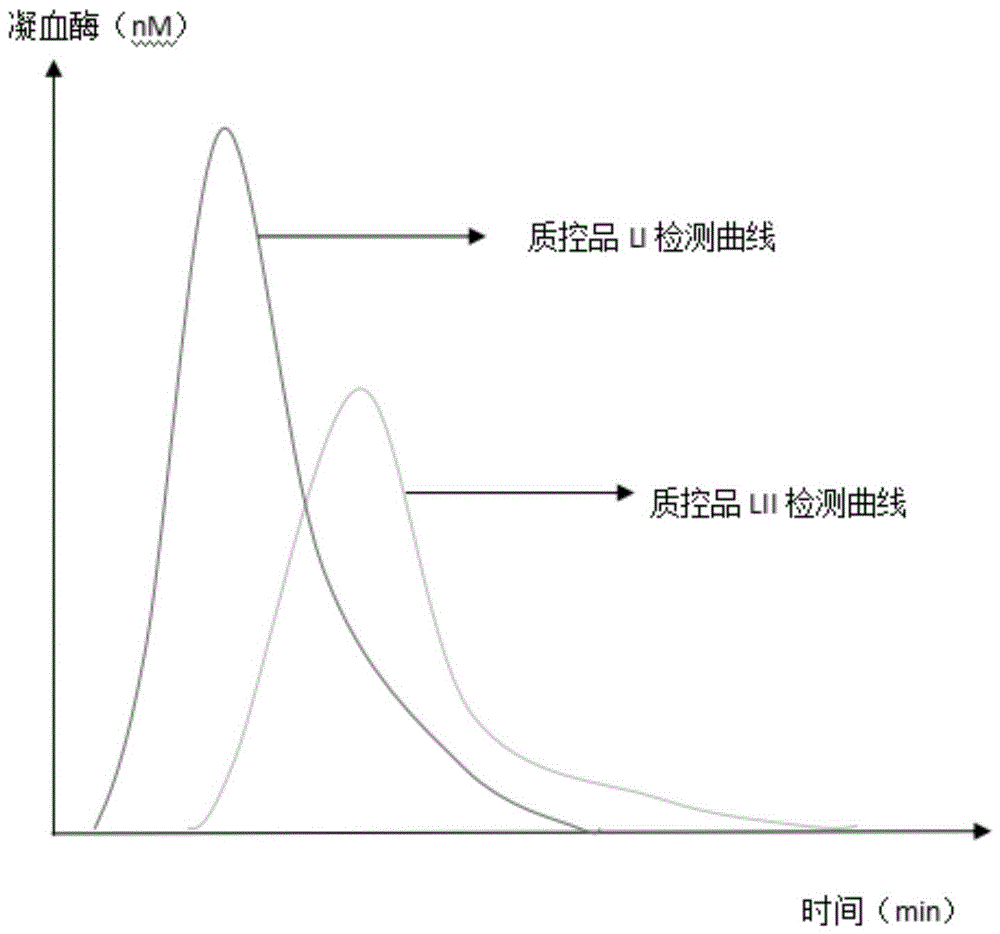
图1是本发明实施例凝血酶生成能力质控品LI、质控品LII检测曲线图。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
以下实施例中,使用的原料及试剂均可市场购得;凝血酶生成能力检测仪,型号:
注意事项:
1.从取得猪全血和羊全血与抗凝剂混和的时间要尽可能的短,因为猪血在见到空气后会快速凝固。混匀时按同一方向缓慢搅拌,动作要轻柔,否则导致红细胞破裂,后续取得的血浆会带明显的红色。
2.如果所得的血浆颜色偏红,可用少量活性炭混合后过滤,去除残留在血浆中的少量破碎红细胞。
实施例1
S1:在生猪屠宰时,割破动脉取得混合猪全血2L,将0.22L 3.2%柠檬酸钠和2L猪全血混合均匀,混匀后的全血在2-8℃保存条件下4小时内进行3000rpm,10min离心,小心吸取上层血浆,下层血细胞舍去,得总血浆体积约0.9L猪血浆;
S2:在生羊屠宰时,割破动脉取得混合羊全血2L,将0.22L 3.2%柠檬酸钠和2L羊全血混合均匀,混匀后的全血在2-8℃保存条件下4小时内进行3000rpm,10min离心,小心吸取上层血浆,下层血细胞舍去,得总血浆体积约0.9L羊血浆;
S3:将猪血浆和羊血浆按体积比1:1混合均匀,得到混合血浆;混合容器使用纯化水清洗干净且烘干的玻璃烧杯。猪血浆和羊血浆不同比例混合对凝血酶生成能力的影响,采用SPSS 22.0统计学软件对数据进行统计分析,计量资料用
表1
由测试结果可以看出,从时间参数(tLag和tPeak)看:猪血浆与猪血浆:羊血浆=1:1缩短(P<0.05),羊血浆与猪血浆:羊血浆=1:1比较延长(P<0.05),猪血浆与羊血浆不同比例混合之间无统计学意义(P≥0.05);从凝血酶生成量参数(Peak和AUC)看:猪血浆与猪血浆:羊血浆=1:1增加(P<0.05),羊血浆与猪血浆:羊血浆=1:1比较降低(P<0.05),猪血浆与羊血浆不同比例混合之间无统计学意义(P≥0.05)。猪血浆与羊血浆不同比例混合时间参数(tLag和tPeak)变化不大,凝血酶生成量参数(Peak和AUC)变化也在可控范围;
因此,本发明例优先猪血浆与羊血浆按1:1进行混合使用。
S4:取混合血浆1L,置于-20±5℃环境中冷冻24h,然后置于2℃环境中解冻18h,用100目丝网将纤维蛋白原过滤分离,将丝网过滤液在4℃冷冻离心机中,以10000r/min速率离心10min,收集下层沉淀,得到凝血因子;将凝血因子溶解于纯化水中,配制成浓度为0.3g/mL的凝血因子溶液;
S5:取混合血浆进行凝血酶生成能力测试,tLag、tPeak、Peak、AUC四项参数基础值,结果如表2所示;
表2
S6:将5mL凝血因子溶液加入500mL基质血浆中调配,得到质控品母液;取样,进行凝血酶生成能力测试,结果如表3所示;
表3
由测试结果可知,溶液的tLag、tPeak、Peak、AUC四项参数值在预定的范围内;该质控品母液可作为凝血酶生成能力质控品母液LI;
S7:取0.5L凝血酶生成能力质控品母液LI,将凝血酶生成能力质控品母液LI和稀释液以体积比2:1混合均匀,得到质控品溶液;取样,进行凝血酶生成能力测试,结果如表4所示;
表4
由测试结果可知,上述所得的质控品溶液tLag、tPeak、Peak、AUC四项参数值均在凝血酶生成能力质控品LII要求的范围内,质控品溶液即为凝血酶生成能力质控品母液LII;
S8:将质控品母液分装LI和LII分别分装在5mL安瓿瓶中,每瓶1mL,丁基塞半盖安瓿瓶,冻干机冻干,真空状态下压紧丁基瓶塞,得到凝血酶生成能力质控品LI和LII;取出后盖上塑料外盖,并贴上标签,2-8℃冷藏保存。
凝血酶生成能力质控品的性能检测
外观检测:产品为黄白色至淡黄色疏松固体。复溶后为均一的溶液,无不溶物。
准确度检测:分别取质控品LI和质控品LII冻干产品各1瓶,纯化水复溶后上机测试,重复测试两次,结果符合表5的范围。
表5
测试结果如表6所示;
表6
精密度检测:分别取质控品LI和质控品LII冻干产品各10瓶,纯化水复溶后。上机重复测试10次,要求tLag、tPeak、Peak、AUC四项参数的CV值≤10%。测试结果如表7和表8所示;
表7LI精密度测试结果
表8LII精密度测试结果
由上述测试结果可知:质控品LI和质控品LII的批间差CV值均在规定的范围内。均值±2倍标准差的范围区间范围已经非常狭窄了,可以认为达到“标准品”的范畴了。
凝血酶生成能力质控品的稳定性检测
开瓶稳定性检测
将实施例中制得的质控品LI和LII用1ml纯化水准确复溶在室温(15-25℃)条件下保存,定时取样一次,检测四项凝血参数,结果见表9和表10。
表9 LI的开瓶稳定性测试数据
表10 LII的开瓶稳定性测试数据
由上表可知,产品在开瓶9h以内,产品质量还是较稳定的。24h以内虽有降解,但还在质控品有效的范围内。因此产品的开瓶稳定性完全符合临床正常检验时限(8小时)的预期要求。
长期稳定性检测
将实施例中制备的质控品LI和LII冻干品在2-8℃条件下储存,分别于0.3、6、9、12、15、18、21、24个月时取出复溶测试,检测结果见表11和表12。
表11LI长期稳定性测试数据
表12 LII长期稳定性测试数据
统计结果表明:本发明制备的质控品冻干品在2-8℃条件下,保存24个月内稳定。长期稳定性好。
本发明制备的血栓弹力图质控品满足临床检验仪器质量控制要求,产品稳定性好,制备工艺相对简单,成本低廉,同时生物危害风险低。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种稳定的地高辛质控品及制备方法
- 一种稳定的尿总蛋白质控品及其制备方法和应用
- 免疫荧光项目混合质控品及其制备方法和应用
- 一种液态糖化血红蛋白质控品的制备方法
- 凝血酶时间质控品及其制备方法与应用
- 用于制备循环肿瘤细胞质控品的试剂盒及循环肿瘤细胞质控品的制备方法
