Aβ42-hIAPP共寡聚化物诱导的AD非人灵长类动物模型方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及非人灵长类实验动物AD疾病造模技术领域,具体涉及Aβ42-hIAPP共寡聚化物诱导的AD非人灵长类动物模型方法。
背景技术
阿尔茨海默病(Alzheimer’s Disease,AD),是一种渐进性发展、与衰老相关的神经退行性疾病。由于年龄、遗传和代谢等各种生物变化及环境的影响,人类极易罹患AD,且很难在其他物种中复制。由于目前AD病因不明且发病机制复杂,导致缺乏早期诊断方法和有效治疗手段,并且长期照顾AD患者需消耗大量人力、财力和专业设施,也给患者、家庭和社会带来了极大的精神和经济负担。自2003年以来,除2021年6月FDA加速审批了一个颇具争议又缺乏有效性证据的单抗药物Aducanumab外,基本没有用于治疗AD的新药获批,亦没有缓解AD疾病疗法的获批。这主要是因为AD发病机制、新药研发和早期诊断等研究均需要建立在“拟临床”动物模型上,但到目前为止,在动物整体水平内仍缺乏可以真实模拟AD病程发展、临床表征和病理特征的动物模型。因此,动物模型研究的滞后是AD机制研究及其新药研发转化效率低下的瓶颈。虽然此前以啮齿类动物(小鼠和大鼠)为模型对AD相关研究做出了一些贡献,但最终将其研究成果应用于临床转化试验时几乎均以失败告终。因此,目前得出的结论是:以家族性AD小鼠模型作为临床前药物转化和评价的研究结果无法直接应用于人类临床试验。由此可见,更高进化程度的大脑对于表现出AD的全谱特征是至关重要的。
目前的研究表明,非人灵长类(Nonhuman Primate,NHP)是构建AD模型最理想的动物来源。虽然当前对非人灵长类的AD模型也有一些研究,比如目前公开有单独使用Aβ寡聚物(AβOligomers,AβO)诱导AD模型的方法,但采用上述方法目前为止尚未在非人灵长类中发现较为完整的AD临床病理。
发明内容
本发明针对上述技术问题提供一种能够获得更接近阿尔茨海默病病理表征的Aβ42-hIAPP共寡聚化物诱导的AD非人灵长类动物模型方法。
为实现上述目的,本发明采用如下技术方案:
Aβ42-hIAPP共寡聚化物诱导的AD非人灵长类动物模型方法,使用Aβ42-hIAPP共寡聚化物注射到非人灵长类动物的双侧脑实质内诱导阿尔茨海默病模型。
优选的,所述Aβ42-hIAPP共寡聚化物由可溶性β-淀粉样蛋白42寡聚体与人胰岛淀粉样蛋白多肽合成。
优选的,所述双侧脑实质为所述双侧脑实质的白质区域。
优选的,所述双侧脑实质的白质区域包括基底节、海马、颞叶之间的双侧海马上方的皮层下脑实质内。
优选的,包括注射方法,所述注射方法是先对非人灵长类动物进行头MRI定位相扫描,之后确定注射位点后,用立体定向手术方法进行脑内注射Aβ42-hIAPP共寡聚化物。
优选的,所述Aβ42-hIAPP共寡聚化物的合成方法如下:
(1)Aβ42以及hIAPP冻干肽分别溶于100%1,1,1,3,3,3-六氟-2-丙醇中,浓度1mM,室温孵育1h后,将含hIAPP肽溶液于温和的氮气流下蒸发1,1,1,3,3,3-六氟-2-丙醇得到干燥hIAPP肽膜;
(2)Aβ42与hIAPP肽膜分别在二甲亚砜中重悬,然后在浓度10mM HEPES缓冲液中进一步稀释,最终浓度为皆为110μM;
(3)快速取两体系1:1混匀,4℃共同孵育24h即得Aβ42-hIAPP共寡聚化物。
本发明与现有技术相比的有益效果:
通过采用本方法,相比现有方法能够诱导出更接近于阿尔茨海默病的非人灵长类动物病理表征。
附图说明
图1是非人灵长类实验动物进行DMTS的测试图;
图2是透射电镜观察下AβO的形态图;
图3是透射电镜观察下hIAPP的形态图;
图4是透射电镜观察下Aβ42-hIAPP共寡聚化物的形态图;
图5是Westernblot验证AβO、hIAPP、Aβ42-hIAPP共寡物和Aβ42-hIAPP共寡物光交联后的产物;
图6是在SH-SY5Y细胞中与不同浓度的AβO、hIAPP和Aβ42-hIAPP共寡聚物孵育下细胞形态图;
图7是通过MTT试剂盒对不同浓度的AβO、hIAPP、Aβ42-hIAPP进行细胞活性测定图;
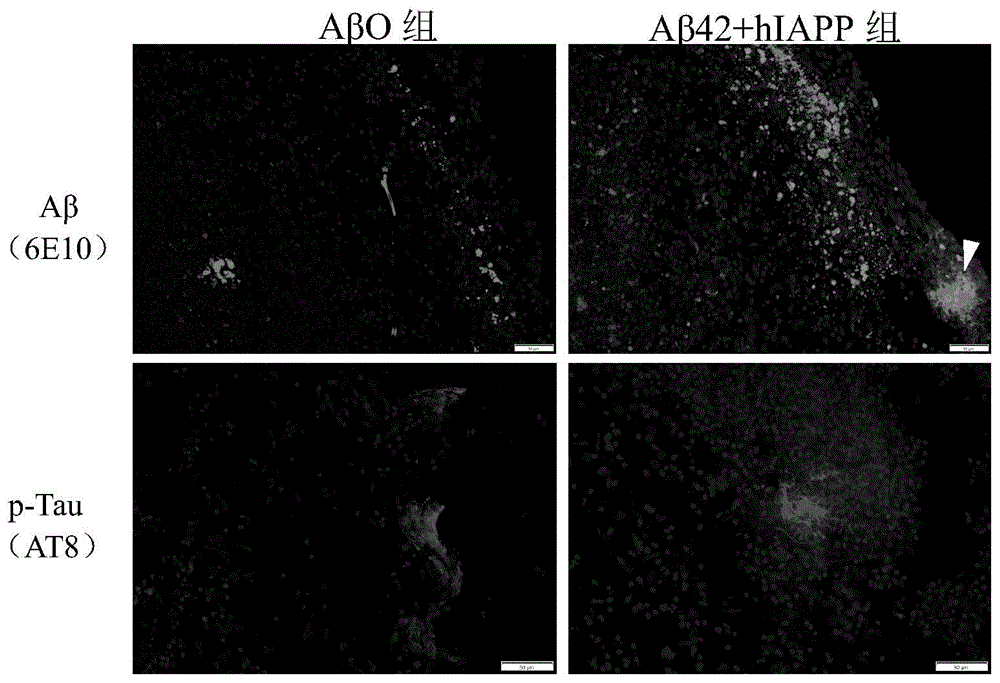
图8是通过免疫荧光染色方法对分别注射AβO,Aβ42-hIAPP共寡聚物的脑类器官切片进行AD病理评估图。
具体实施方式
Aβ42-hIAPP共寡聚化物诱导的AD非人灵长类动物模型方法,使用Aβ42-hIAPP共寡聚化物注射到非人灵长类动物(本实施例优选老年食蟹猴)的双侧脑实质内(本实施例的具体位置为基底节、海马、颞叶之间的双侧海马上方的皮层下脑实质内)诱导阿尔茨海默病模型。所述Aβ42-hIAPP共寡聚化物由可溶性β-淀粉样蛋白42寡聚体(Solubleβ-amyloid 1-42Oligomer,AβO)与人胰岛淀粉样蛋白多肽(Human islet amyloid polypeptide,hIAPP)合成(本实施例在合成Aβ42-hIAPP共寡聚化物后还进行鉴定)。
优选的,包括注射方法,所述注射方法是先对非人灵长类动物进行头MRI定位相扫描,之后确定注射位点后,用立体定向手术方法进行脑内注射Aβ42-hIAPP共寡聚化物。比如本步骤可优选通过MRI导引的对流增强给药(Convection Enhanced Delivery,CED)技术立体定向注射到老年食蟹猴所述双侧脑实质内,并进行至少6个月以上的观察(作为实验组)并与现有技术中AβO诱导方法(作为对照组)的结果进行对比。
对比实验具体操作如下:
(一)AβO、IAPP原纤维和Aβ42-hIAPP共寡聚体合成
按照现有方法制备AβO、IAPP原纤维;按照如下方法合成Aβ42-hIAPP共寡聚体:
(1)Aβ42以及hIAPP冻干肽分别溶于100%1,1,1,3,3,3-六氟-2-丙醇中,浓度1mM,室温孵育1h后,将含hIAPP肽溶液于温和的氮气流下蒸发1,1,1,3,3,3-六氟-2-丙醇得到干燥hIAPP肽膜;
(2)Aβ42与hIAPP肽膜分别在二甲亚砜中重悬,然后在浓度10mM HEPES缓冲液中进一步稀释,最终浓度为皆为110μM;
(3)快速取两体系1:1混匀,4℃共同孵育24h即得Aβ42-hIAPP共寡聚化物。
(二)立体定向食蟹猴双侧脑实质注射
采用核磁共振扫描,并在核磁共振图像上标记需要注射的靶部位(海马上方外侧)。动物麻醉后,使用对流增强给药技术分别向脑内立体定向注射AβO和Aβ42-hIAPP共寡聚物。
(三)认知行为学测试及评价
通过延迟匹配样本比对任务(Delayed Matching-to-Sample,DMTS)测试非人灵长类动物空间和物体工作记忆。
DMTS测试:通过造模前进行的训练,使动物掌握规则,正式测试时,将食饵放在动物可以看到但却拿不到的位置,并在其注视下用目标测试杯将食饵盖住,给动物短暂时间(1-3s)观察目标测试杯(图1-①);上升黑色挡板,引入与目标测试杯形状和颜色均不同的干扰杯,根据随机表设定的位置进行摆放,且同一位置出现食物的次数不超过3次,维持特定的延迟时间,计时(图1-②);延迟时间过后,将黑色挡板下降,并将目标测试杯与干扰杯同时推至动物可以操作的距离,让动物选择,选择目标测试杯将会得到食物奖励,反之,则不会得到食物奖励(图1-③)。
通过比较实验组(6只食蟹猴)与对照组(6只食蟹猴)在随机延迟时间(0s、30s、60s、90s、120s)下对物体识别的记忆能力,以此判断动物的认知记忆功能是否减退及记忆功能减退的程度。每只猴子每天测试30次,周期为5天,共测试150次,记录动物在延迟时间随机的情况下,30次测试的正确率。
(四)组织病理相关分析
当动态检测到体液生物标记物和/或测评其认知行为学结果发生显著变化时,对动物安乐死并进行尸体解剖,收集脑组织,一部分经固定、沉糖后,使用平推切片机将脑组织切成40μm的脑片,置于防冻液中,标记后,保存至-20℃冰箱,用于组织病理学检测。一部分直接速冻在-80℃冰箱,用于Western免疫印迹验证。
(五)对比实验结果
1、体外合成的AβO、hIAPP和Aβ42-hIAPP共寡物结果比对
通过透射电镜观察体外合成的AβO、hIAPP和Aβ42-hIAPP共寡物形态。其中如图2所示,AβO呈典型的斑点状;如图3所示hIAPP呈纤维状;而如图4所示,Aβ42-hIAPP共寡物则缠结在一起,并采用PICUP方法分析形成Aβ42-hIAPP共寡聚物的亚稳态或中间形态的聚合物,使用SDS-PAGE和Western免疫印迹分析,以鉴定所合成寡聚物的质量状况,结果如图5所示。通过硫磺素T实验测定两种蛋白在不同时间和不同浓度条件下共同孵育的动力学特征。
2、DMTS测试结果比对:
造模前测试是指:造模前需要对筛选出的食蟹猴先进行长期的常规训练直至测试的正确率达到要求的分值后才能用于行为学试验;
表1
通过开展DMTS的记忆能力行为学试验对比,由上可知:与单独应用可溶性β-淀粉样蛋白42寡聚体(AβO)相比,采用Aβ42-hIAPP共寡聚化物诱导的实验组造模后其记忆力明显衰退,表明采用Aβ42-hIAPP共寡聚化物诱导的AD动物模型相比传统造模具有显著的进步。
3、病理表征结果如下表:
表2
由上可知:与单独应用可溶性β-淀粉样蛋白42寡聚体(AβO)相比,Aβ42-hIAPP共寡聚化物诱导的食蟹猴AD模型会出现显著的老年斑和β淀粉样蛋白阳性神经元,同时发现更多的磷酸化tau和神经纤维缠结,突触密度显著降低,胶质细胞激活并产生炎症小体,最为重要的是发现神经元发生变性和死亡,更接近AD脑病理表征。
(六)为了提供Aβ42-hIAPP共寡聚物更直观的效果证明1、对Aβ42-hIAPP共寡聚物在细胞中的毒性进行测定
为了评估AβO、hIAPP和Aβ42-hIAPP共寡聚物的神经毒性,在SH-SY5Y细胞中与不同浓度的AβO、hIAPP和Aβ42-hIAPP共寡聚物孵育,观察了不同培养时间和不同浓度下细胞形态变化,在明场下观察,随着IAPP-Aβ(IAPP-Aβ)浓度增高及对细胞作用时间增加,细胞损伤越严重,与对照组相比细胞完整性受到破坏,细胞轮廓不清晰,以至最后成为细胞碎片(如图6)。还通过MTT试剂盒对其进行细胞活性测定,随着AβO(Aβ)、hIAPP(IAPP)、Aβ42-hIAPP(Aβ-IAPP)的浓度升高,细胞活力越低,并且加Aβ42-hIAPP的组与加单独的AβO、hIAPP的组相比细胞活力显著下降,进一步验证了Aβ42-hIAPP对细胞的损伤(如图7)。
2、使用Aβ42-hIAPP共寡聚物在人源全脑类器官中诱导出AD病理
通过免疫荧光染色方法对注射Aβ42-hIAPP共寡聚物的脑类器官切片进行AD病理评估,如图8所示,注射Aβ42-hIAPP共寡聚物组的脑类器官相较于注射AβO组,产生的Aβ病理更密集,并且有大面积Aβ斑块产生;而对于p-Tau病理,Aβ42-hIAPP共寡聚物组的脑类器官产生了与AD病人类似的神经纤维缠结,而这在注射AβO组的脑类器官中暂时还未发现。表明通过合成的Aβ42-hIAPP共寡聚物注射到人源脑类器官实质中的方法,成功构建AD脑类器官病理模型,并且通过注射Aβ42-hIAPP共寡聚物诱导脑类器官产生的AD病理比注射AβO的脑类器官产生的病理更严重。因此,通过对构建的实质注射Aβ42-hIAPP共寡聚化物诱导AD脑类器官病理模型的方法,可以有效获得一种相比传统方法更好的AD病理模型。
以上内容是结合具体实施方式对本专利所作的详细说明,不能认定本专利的具体实施方式只局限于上述说明。对于本专利所属技术领域的普通技术人员来说,在不脱离本专利构思的前提下,对上述已描述的实施方式做出的若干替代或变型,都应视为属于本专利的保护范围。在本说明书的描述中,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。在不相互矛盾的情况下,本领域技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管已经详细描述了本发明的实施例及其优点,但应当理解,在不脱离专利申请的保护范围的情况下,可以在本文中进行各种改变、替换和变更。
