具有增强的结合和检测特征的亲和试剂
文献发布时间:2024-04-18 19:58:21
交叉引用
本申请要求2020年11月11日提交的美国临时申请第63/112,607号、2020年12月30日提交的美国临时申请第63/132,170号和2021年7月29日提交的美国临时申请第63/227,080号的优先权的权益,上述申请通过引用并入本文。
背景技术
亲和试剂包括与其他分子形成可检测的相互作用的广义类的化学试剂。亲和试剂可包括与其他分子形成临时或可逆结合对的结合试剂。亲和试剂可用于表征生物分子诸如多肽、核酸和多糖的结构和特性。亲和试剂可包括用于可视化所述亲和试剂的目的的可检测标记。通常这些可检测标记是荧光标记。需要会产生强且可靠的信号的经标记的亲和试剂,所述信号包括例如对于单分子检测足够强的信号和对于准确定量足够可靠的信号。还需要例如以足够的亲合力与靶分子亲合结合以支持以单分子分辨率检测靶分子的亲和试剂。
发明内容
本公开提供一种亲和试剂,其具有:(a)保留组分;以及(b)以下中的一者或两者:(i)一个或多个标记组分,和(ii)一个或多个结合组分。任选地,所述标记组分中的一个或多个附接于所述保留组分。作为替代或另外的选项,所述结合组分中的一个或多个附接于所述保留组分。所述保留组分可包括结构化核酸,诸如核酸折纸。
亲和试剂可包括:(a)保留组分;(b)一个或多个标记组分,和(ii)多个结合组分。任选地,对于结合配偶体,亲和试剂的平衡解离常数小于所述多个结合组分中的任一个的平衡解离常数,或者其中对于结合配偶体,可检测探针的解离速率常数小于所述多个结合组分中的任一个的解离速率常数。
亲和试剂可包括:(a)保留组分;(b)多个标记组分,和(ii)一个或多个结合组分。
本公开的亲和试剂可以被配置为可检测探针。可检测探针可包括:(a)保留组分;(b)一个或多个标记组分;和(c)附接于所述保留组分的两个或更多个结合组分,其中所述可检测探针对于结合配偶体的平衡解离常数小于所述两个或更多个结合组分中的任一个对于所述结合配偶体的平衡解离常数,或者其中所述可检测探针对于结合配偶体的解离速率常数小于所述两个或更多个结合组分中的任一个对于所述结合配偶体的解离速率常数。
本公开进一步提供检测分析物的方法,包括如下步骤:(a)使分析物与可检测探针接触,其中所述可检测探针包含(i)保留组分;(ii)一个或多个标记组分,和(iii)一个或多个结合组分;和(b)获取来自所述一个或多个标记组分的信号,从而检测所述分析物。
还提供了检测分析物的方法,包括如下步骤:(a)使分析物与第一可检测探针接触,所述第一可检测探针包括:(i)第一保留组分,(ii)一个或多个标记组分,和(iii)第一组附接于所述保留组分的两个或更多个结合组分,其中所述第一组中的所述结合组分中的至少一种与所述分析物中的第一表位结合;(b)获取来自所述第一可检测探针的所述一个或多个标记组分的信号;(c)使所述分析物与第二可检测探针接触,所述第二可检测探针包括:(i)第二保留组分,(ii)一个或多个标记组分,和(iii)第二组附接于所述保留组分的两个或更多个结合组分,其中所述第二组中的所述结合组分中的至少一种与所述分析物中的第二表位结合,所述第二表位与所述第一表位相比具有不同的化学组成;和(d)获取来自所述第二可检测探针的所述一个或多个标记组分的信号,从而检测所述分析物。任选地,所述第二保留组分具有与所述第一保留组分基本上相同的结构。
本公开还提供了一种组合物,其包括:(a)具有附接于结合组分的第一结构化核酸颗粒的探针;和(b)具有附接于所述结合组分的表位的第二结构化核酸颗粒的分析物,其中所述探针经由所述结合组分与所述表位的结合而附接于所述分析物。在特定的配置中,所述结构化核酸颗粒中的一者或两者包括核酸折纸。
还提供了一种组合物,其包括:(a)多种不同的探针,所述不同探针中的每一种具有附接于结合组分的第一结构化核酸颗粒,所述不同探针中的每一种具有不同的结合组分;和(b)多种不同的分析物,所述不同分析物中的每一种具有附接于不同结合组分的表位的第二结构化核酸颗粒,其中所述不同的探针经由所述多种不同探针的不同结合组分与所述多种不同分析物的表位的结合而附接于所述不同的分析物。任选地,对于所述不同的探针,所述第一结构化核酸颗粒是基本上相同的。作为进一步的选项,对于所述不同的分析物,所述第二结构化核酸颗粒可以是基本上相同的。在特定的配置中,所述结构化核酸颗粒中的一者或两者包括核酸折纸。所述不同探针的核酸折纸可任选包括相同的支架核酸结构,无论对于所述不同探针来说,订书钉结构是否是相同的或不同的。可替代地或另外地,所述不同分析物的核酸折纸可任选包括相同的支架核酸结构,无论对于所述不同分析物来说,订书钉结构是否是相同的或不同的。
本文描述了一种可检测探针,其包含包括一个或多个标记组分(例如可检测标记)的保留组分和与所述保留组分偶联的两个或更多个结合组分,其中所述可检测探针对于结合配偶体的解离常数小于所述两个或更多个结合组分中的任一个对于所述结合配偶体的解离常数。
在一些配置中,可检测探针的一个或多个标记组分与所述可检测探针的所述保留组分偶联。在一些实施方案中,所述保留组分包括具有闭合单链核酸的支架和与所述支架杂交的多个寡核苷酸。
在一些配置中,可检测探针或亲和试剂中的保留组分包括支架核酸。支架可包括来自噬菌体基因组或质粒的链,例如来自M13噬菌体基因组。任选地,保留组分可进一步包括多个寡核苷酸。所述寡核苷酸可以被退火到所述支架上,例如以形成折纸结构中的订书钉。在一些配置中,所述多个寡核苷酸中的寡核苷酸可包括至少一个非天然核苷酸。任选地,寡核苷酸中的非天然核苷酸可具有官能团,如用于生物正交或点击反应的官能团。在一些配置中,一个、两个或更多个结合组分附接于所述多个寡核苷酸中的一个或多个寡核苷酸。在一些配置中,一个、两个或更多个标记组分附接于所述多个寡核苷酸中的一个或多个寡核苷酸。在一些配置中,支架可包括至少一个非天然核苷酸。任选地,支架中的非天然核苷酸可具有官能团,如用于生物正交或点击反应的官能团。在一些配置中,一个、两个或更多个结合组分附接于支架。在一些配置中,一个、两个或更多个标记组分附接于支架。
在一些配置中,具有两个或更多个结合组分的可检测探针或亲和试剂对于结合配偶体的解离常数小于所述两个或更多个结合组分中的任一个对于所述结合配偶体的解离常数。例如,所述可检测探针或亲和试剂对于结合配偶体的解离常数可小于或等于所述两个或更多个结合组分中的任一个对于所述结合配偶体的解离常数的50%、25%、10%或更小。在一些配置中,可检测探针或亲和试剂在与结合配偶体结合时的解离率(off-rate)低于所述两个或更多个结合组分中的任一个在与结合配偶体结合时的单独解离率。在一些配置中,可检测探针或亲和试剂对于结合配偶体的结合率(on-rate)高于所述两个或更多个结合组分中的任一个对于所述结合配偶体的单独结合率。
在一些配置中,可检测探针或亲和试剂具有对于第一类型的表位为非零的结合亲和力和对于第二类型的表位为非零的结合亲和力。例如,所述可检测探针或亲和试剂可具有与第一类型的表位的第一非零结合概率和与第二类型的表位的第二非零结合概率。在一些配置中,所述可检测探针或亲和试剂的两个或更多个结合组分中的第一结合组分具有与第一类型的表位的第一非零结合概率,并且还具有与第二类型的靶部分的第二非零结合概率。在其他配置中,所述两个或更多个结合组分中的第一结合组分包括与第一类型的靶部分的第一非零结合概率,且所述两个或更多个结合组分中的第二结合组分包括与第二类型的靶部分的第二非零结合概率。
在一些配置中,可检测探针或亲和试剂中的所述结合组分中的至少一种包括抗体或其功能片段,其中所述可检测探针或亲和试剂的结合配偶体具有所述抗体或其功能片段的表位。在一些配置中,可检测探针或亲和试剂中的所述结合组分中的至少一种包括适体,其中所述可检测探针或亲和试剂的结合配偶体具有所述适体的表位。
在一些配置中,可检测探针或亲和试剂经由至少一个结合组分与结合配偶体结合。任选地,所述结合配偶体可经由两个或更多个结合组分与所述可检测探针或亲和试剂结合。所述结合配偶体可以是多肽。所述结合组分中的至少一种可以被配置为识别多肽中的二聚体、三聚体或四聚体氨基酸序列。任选地,所述多肽可包括翻译后修饰,例如存在于由结合组分识别的表位以内或所述表位之外。在一些实施方案中,所述结合配偶体包括非多肽物质,如多糖、聚合物、金属、陶瓷或其组合。在一些实施方案中,所述非多肽物质包括多糖、聚合物、金属或陶瓷的纳米颗粒。可检测探针或亲和试剂可与结合配偶体非共价结合或与结合配偶体共价结合。与可检测探针或亲和试剂结合的结合配偶体可以在溶液相中或附接于固体支持物。任选地,所述结合配偶体可附接于作为其结合的可检测探针或亲和试剂的组分的结构化核酸颗粒以外的结构化核酸颗粒。结构化核酸颗粒可任选介导结合配偶体与固体支持物例如在阵列的位点处的附接。
具有两个或更多个结合组分的可检测探针或亲和试剂的保留组分可以被配置为限制所述两个或更多个结合组分中的第一结合组分为不接触所述两个或更多个结合组分中的第二结合组分。具有两个或更多个标记组分的可检测探针或亲和试剂的保留组分可以被配置为限制所述两个或更多个标记组分中的第一标记组分为不接触所述两个或更多个标记组分中的第二标记组分。具有标记组分和结合组分的可检测探针或亲和试剂的保留组分可以被配置为限制所述标记组分为不接触所述结合组分。任选地,保留组分可限制两种或更多种组分中的第一组分进入两种或更多种组分中的第二组分的指定距离内,例如不大于1nm、5nm、10nm、20nm或更长的距离。在一些配置中,限制是由于角度偏移。例如,角度偏移可以为至少约90°或180°。在一些配置中,限制是由于阻挡部分,例如附接于所述保留组分的阻挡部分。示例性的阻挡部分包括但不限于聚乙二醇(PEG)、聚环氧乙烷(PEO)、直链或支链的烷烃链或葡聚糖。
可检测探针或亲和试剂的保留组分可包括具有从第二侧偏移的第一侧的三维结构。例如,第一侧从第二侧偏移的量可以为至少约90°或180°的角度偏移。任选地,可检测探针或亲和试剂的一种、一些或所有结合组分被限制在第一侧,并且被限制不在第二侧。在一些配置中,第一侧和第二侧可各自包括一个或多个结合组分。作为进一步的选择,可检测探针或亲和试剂的一种、一些或所有标记组分可以被限制在保留组分的第一侧,并且被限制不在所述保留组分的第二侧。在一些配置中,第一侧和第二侧可各自包括一个或多个标记组分。因此,可检测探针或亲和试剂可以被配置为将结合组分保留在保留组分的第一侧,同时将标记组分保留在所述保留组分的另一侧。可检测探针或亲和试剂可以被配置为限制一种、一些或所有结合组分不在一种、一些或所有标记组分所在的保留组分的那一侧。此外,可检测探针或亲和试剂可以被配置为限制一种、一些或所有标记组分不在一种、一些或所有结合组分所在的保留组分的那一侧。可检测探针或亲和试剂的保留组分可包括结构化核酸颗粒(SNAP),如核酸纳米球或核酸折纸。
可检测探针或亲和试剂的一个或多个标记组分可包括多种标记中的任一种,包括例如光学标记(例如荧光团、发光团)、放射性标记或基于核酸的标记(例如序列标签)。在一些配置中,可检测探针或亲和试剂的两个或更多个标记组分可产生重叠或不可区分的信号。例如,两个或更多个标记组分可以是被配置为以相同波长发射的荧光团。在一些配置中,可检测探针或亲和试剂的两个或更多个标记组分产生彼此分辨的信号。例如,两个或更多个标记组分可以是被配置为以彼此不同的波长发射的荧光团。
在一些配置中,可检测探针或亲和试剂的两个或更多个标记组分包括Forster共振能量转移机制中的供体和受体。可替代地,可检测探针或亲和试剂的两个或更多个标记组分可以彼此分开排除了猝灭或Forster共振能量转移的一定距离。可检测探针或亲和试剂的两个或更多个标记组分可具有排除了猝灭或Forster共振能量转移的相对取向。对于包括SNAP的配置,第一荧光标记可以在SNAP中的第一核苷酸位置附接,并且第二荧光标记在SNAP中的第二核苷酸位置附接,其中所述第一核苷酸位置与所述第二核苷酸位置在所述结构化核酸颗粒的一级序列中分开至少3、4、5、6、7、8或9个核苷酸位置。可替代地或另外地,所述第一核苷酸位置可与所述第二核苷酸位置在所述结构化核酸颗粒的一级序列中分开最多9、8、7、6、5、4、3、2或1个核苷酸位置。
结合组分或标记组分可通过接头附接于可检测探针或亲和试剂。所述接头可以是刚性接头或柔性接头。示例性柔性接头包括但不限于PEG、PEO、烷烃链、单链核酸或其组合。双链核酸或支链烷烃链可用作刚性接头。
在一些配置中,可检测探针或亲和试剂的大直径大于其结合的结合配偶体的大直径。任选地,可检测探针或亲和试剂的体积大于其结合的结合配偶体的体积。
在特定的配置中,可检测探针或亲和试剂可包括可光学检测的保留组分。例如,一个、两个或更多个结合组分可附接于所述可光学检测的保留组分。在这样的配置中,所述可检测探针或亲和试剂不需要包括标记组分,并且可基于观察由所述可光学检测的保留组分产生的信号来进行检测。特别有用的可光学检测的保留组分包括但不限于荧光纳米颗粒、FluoSpheres
在另一方面,本文描述了可检测探针或亲和试剂,其包括可光学检测的保留组分和与所述可光学检测的保留组分偶联的两个或更多个结合组分,其中所述可检测探针或亲和试剂对于结合配偶体的解离常数小于所述两个或更多个结合组分中的任一个对于所述结合配偶体的解离常数。
在另一方面,本文描述了可检测探针或亲和试剂,其包括可光学检测的保留组分和与所述可光学检测的保留组分偶联的两个或更多个结合组分,其中所述可检测探针或亲和试剂对于结合配偶体的结合的结合率高于所述两个或更多个结合组分中的任一个对于所述结合配偶体的结合的结合率。
在另一方面,本文描述了可检测探针或亲和试剂,其包括可光学检测的保留组分和与所述可光学检测的保留组分偶联的两个或更多个结合组分,其中所述可检测探针或亲和试剂对于结合配偶体的结合的解离率低于所述两个或更多个结合组分中的任一个对于所述结合配偶体的结合的解离率。
在另一方面,本文描述了一种方法,包括使分析物与可检测探针接触,其中所述分析物是所述可检测探针的结合配偶体,并获取来自所述可检测探针的信号,从而检测所述分析物。所述方法可进一步包括由所获取的信号确认所述分析物,或者由所获取的信号确定所述分析物的化学组成。在一些实施方案中,所述分析物包括多肽,并且所确定的化学组成包括所述多肽的至少一部分的氨基酸序列的存在或不存在,或所述多肽中的翻译后修饰的氨基酸的存在或不存在。在一些实施方案中,所述方法进一步包括由所获取的信号定量所述分析物。在一些实施方案中,所述方法进一步包括由所获取的信号确定所述分析物在固体支持物上的位置,例如确认阵列中所述分析物所在的位点。在一些实施方案中,由所述可检测探针的可光学检测的保留组分获取信号。在一些实施方案中,由所述可检测探针的一个或多个标记组分获取信号。
在另一方面,本文描述了一种方法,包括(a)使多种不同分析物与第一多个可检测探针接触,其中来自所述第一多个可检测探针的可检测探针与来自所述多种不同分析物的第一亚组的不同分析物结合,(b)获取来自所述第一多个可检测探针的信号,(c)使所述多种不同分析物与第二多个可检测探针接触,其中来自所述第二多个可检测探针的可检测探针与来自所述多种不同分析物的第二亚组的不同分析物结合,其中所述第一亚组的不同分析物不同于所述第二亚组的分析物,(d)获取来自所述第二多个可检测探针的信号,和(e)基于在步骤(b)和步骤(d)中获取的信号确认分析物。任选地,所述第一多个可检测探针包括与所述第二多个可检测探针基本上相同的两个或更多个结合组分。可替代地,所述第一多个可检测探针可包括两个或更多个结合组分,它们不同于所述第二多个可检测探针的两个或更多个结合组分。作为进一步的选项,所述第一多个中的一个、一些或所有可检测探针可包括保留组分。任选地,对于所述第一多个中的一些或所有可检测探针,所述保留组分可具有共同的结构。例如,一些或所有可检测探针的保留组分可包括相同的折纸结构,如支架折叠结构。类似地,所述第一多个中的一个、一些或所有可检测探针的保留组分可具有与所述第二多个中的一个、一些或所有可检测探针的保留组分一样的结构。例如,所述第一和第二多个中的一些或所有可检测探针的保留组分可包括相同的折纸结构,如支架折叠结构。
在一些配置中,上述方法可进一步包括在步骤(c)之前将所述第一多个可检测探针移离所述多种不同分析物的步骤。在上述方法的一些配置中,所述第一多个可检测探针产生与所述第二多个可检测探针的一个或多个标记组分产生的信号相同的信号。例如,所述第一多个可检测探针可包括与所述第二多个可检测探针相同的一个或多个标记组分。在上述方法的一些配置中,所述第一多个可检测探针包括一个或多个标记组分,它们不同于所述第二多个可检测探针的一个或多个标记组分。在上述方法的一些配置中,所述第一多个可检测探针包括与所述第二多个可检测探针相同的可光学检测的保留组分。在上述方法的一些配置中,所述第一多个可检测探针包括与所述第二多个可检测探针的可光学检测的保留组分不同的可光学检测的保留组分。
可以将与亲和剂结合或通过本文阐述的方法中的可检测探针检测的一种或多种不同分析物附接于固体支持物。例如,可以将多种不同分析物中的单个分析物附接在固体支持物上的相应位点,由此所述固体支持物包括分析物的阵列。
本公开进一步提供定位结合配偶体的方法,包括(a)提供材料(例如固体支持物),其在所述材料中的离散位置处包括结合配偶体;(b)使所述材料与可检测探针接触,其中所述可检测探针包括(i)保留组分,(ii)一个或多个标记组分,它们被配置为产生可检测的信号,和(iii)与所述保留组分偶联的两个或更多个结合组分,其中所述保留组分和两个或更多个结合组分形成可检测探针;(c)检测来自所述一个或多个标记组分的所述可检测的信号;和(d)确认所述可检测的信号的离散位置,从而定位所述物质中的所述结合配偶体。任选地,所述可检测探针结合所述结合配偶体的解离常数小于或等于所述结合配偶体与所述结合组分中的任一种单独结合的解离常数的一半。
还提供了形成可检测探针或亲和试剂的方法,包括(a)提供包括多个偶联基团的保留组分,和(b)将所述多个偶联基团中的偶联基团附接于多个结合组分。任选地,所述方法进一步包括(c)将所述多个偶联基团中的偶联基团附接于多个标记组分。
可检测探针或亲和试剂的组分之间的附接可以是共价的或非共价的。核酸提供了特别有用的偶联基团。例如,上述方法中的偶联基团可包括单链核酸部分,其退火到附接于所述结合组分和/或标记组分的互补核酸上。所述保留组分可包括核酸折纸,其被工程化以将所述单链核酸部分定位在已知位置。例如,所述单链核酸部分可包括在被退火到支架链上的订书钉链(staple strand)或寡核苷酸中。其他有用的非共价附接包括例如由受体-配体对诸如链霉亲和素-生物素、SpyCatcher-SpyTag、SdyCatcher-SdyTag和SnoopCatcher-SnoopTag介导的那些。
多种官能团中的任一种可用于共价附接可检测探针或亲和试剂的组分。生物正交反应和点击反应是特别有用的。
用于制备可检测探针或亲和试剂的方法可包括在保留组分上形成钝化层的步骤。可以例如在将官能团(例如偶联基团)、标记组分或结合组分附接于所述保留组分之前进行保留组分的钝化。任选地,钝化层可包括金属、金属氧化物、有机官能团或聚合物。例如,所述金属可包括金、银、铜、钛或铁。任选地,所述金属氧化物包括氧化钛、氧化铝、二氧化硅或氧化镁。任选地,所述有机官能团包括磷酸酯、膦酸酯、羧酸酯、环氧化物或硅烷。在一些实施方案中,所述聚合物包括烃聚合物或生物聚合物。在一些实施方案中,所述烃聚合物包括聚乙二醇(PEG)、聚环氧乙烷(PEO)或烷烃链。在一些实施方案中,所述生物聚合物包括多糖、多核苷酸或多肽。
本公开的可检测探针可包括双链区和适体;其中所述双链区包括两个或更多个标记组分。例如,所述标记组分可以是一条或两条链中的荧光标记的核苷酸。任选地,所述荧光标记的核苷酸可以彼此分开例如至少5、6、7、8、9、10、15、20、25、30、35、40、45、50或更多个核苷酸。任选地,所述双链区可包括至少3、4、5、6、7、8、9、10或更多个荧光团或其他标记组分。可检测探针的两个或更多个标记组分可彼此相同或彼此不同。
任选包括在可检测探针或亲和试剂中的适体或其他结合组分可识别形式αXβ的一些或全部序列或与之结合,其中X是所需的表位,且α和β是任何氨基酸残基。任选地,所述适体可识别形式αXβ的至少10%、20%、30%、50%、80%或90%的序列或与之结合。
在一些配置中,包括在可检测探针或亲和试剂中的适体或其他结合组分可识别所需的三个氨基酸表位或与之结合,而不特异性结合任何其他三个氨基酸序列,并且以基本上类似的亲和力结合所需的三个氨基酸表位,而不管所需表位周围的侧翼序列如何。
在另一方面,本文描述了可切换的适体,其与人蛋白质组中5%与10%之间的所有蛋白质结合;且其中所述可切换的适体包括两个或更多个荧光部分。
本公开进一步提供制备荧光标记的适体的方法,所述方法包括合成在3’端具有引物序列的适体,将模板DNA链与所述引物序列杂交,其中所述模板DNA链包括与所述引物互补的区段和模板区,并使用聚合酶沿着所述模板延伸所述适体分子的3’端。任选地,用包括标记核苷酸的核苷酸混合物进行聚合酶反应。例如,一种或多种类的核苷酸可包括标记,而其他种类的核苷酸缺乏标记。例如,聚合酶反应可以用四个核苷酸(腺嘌呤、胞嘧啶、鸟嘌呤和胸腺嘧啶或尿嘧啶)进行,其中的三个核苷酸是未标记的,且第四个核苷酸是荧光标记的,并且其中设计模板,使得与荧光标记的核苷酸互补的碱基以预定模式出现。任选地,与荧光标记的核苷酸互补的碱基可出现在沿着模板的每第2、第3、第4、第5、第6、第7、第8、第9、第10、第15、第20、第25、第30、第35、第40、第45或第50位。
在另一方面,本文描述了制备上述荧光标记的适体的方法,所述方法包括将适体与荧光标记的寡核苷酸连接。在另一种配置中,制备荧光标记的适体的方法可包括合成在3’端具有延伸序列的适体,将夹板核酸链与所述延伸序列杂交,并将标记的寡核苷酸与所述夹板核酸链杂交,使得所述标记的寡核苷酸的端部与所述延伸序列的端部相邻,并使用连接酶经由所述延伸序列将所述标记的寡核苷酸与所述适体连接。
通过引用并入
本说明书中提到的所有出版物、专利和专利申请均通过引用并入本文,其程度如同明确且单独地指出将每个单独的出版物、专利或专利申请通过引用并入一样。
附图说明
图1A显示了在实体的两个面之间具有角度偏移的实体。
图1B显示了在实体的两个面之间具有角度偏移的实体。
图2A显示了方形保留组分的近似二维投影。
图2B显示了圆形保留组分的近似二维投影。
图3A显示了两个结合组分之间的相对分隔。
图3B显示了两个结合组分之间的相对分隔。
图3C显示了两个结合组分之间的相对分隔。
图4A显示了用于分开两个结合组分的配置。
图4B显示了用于分开两个结合组分的配置。
图4C显示了用于分开两个结合组分的配置。
图4D显示了用于分开两个结合组分的配置。
图5A显示了用于在保留组分上间隔标记组分的配置。
图5B显示了用于在保留组分上间隔标记组分的配置。
图6A显示了结合组分和标记组分在保留组分上的配置。
图6B显示了结合组分和标记组分在保留组分上的配置。
图6C显示了结合组分和标记组分在保留组分上的配置。
图6D显示了结合组分和标记组分在保留组分上的配置。
图6E显示了结合组分和标记组分在保留组分上的配置。
图6F显示了结合组分和标记组分在保留组分上的配置。
图7A显示了包括用于结合组分的接头的可检测探针的配置。
图7B显示了包括用于结合组分的接头的可检测探针的配置。
图8显示了具有另外的亲合组分的可检测探针的配置。
图9A显示了用于产生可检测探针的弱结合相互作用的系统的配置。
图9B显示了用于产生可检测探针的弱结合相互作用的系统的配置。
图10A显示了产生可检测探针的弱结合相互作用的方法。
图10B显示了产生可检测探针的弱结合相互作用的方法。
图10C显示了产生可检测探针的弱结合相互作用的方法。
图11A显示了与两个可检测探针产生弱结合相互作用的方法。
图11B显示了与两个可检测探针产生弱结合相互作用的方法。
图11C显示了与两个可检测探针产生弱结合相互作用的方法。
图11D显示了与两个可检测探针产生弱结合相互作用的方法。
图11E显示了与两个可检测探针产生弱结合相互作用的方法。
图12A显示了低强度荧光标记的一组传感器像素的荧光强度测量值。
图12B显示了高强度荧光标记的一组传感器像素的荧光强度测量值。
图13显示了与结合配偶体结合的高度可观察的可检测探针的截面视图。
图14A显示了用于在保留组分上产生荧光共振能量转移(FRET)对的配置。
图14B显示了用于在可检测探针上产生荧光共振能量转移(FRET)对的配置。
图15A显示了利用核酸条形码和弱二级相互作用检测结合相互作用的方法的第一步。
图15B显示了利用核酸条形码和弱二级相互作用检测结合相互作用的方法的第二步。
图15C显示了利用核酸条形码和弱二级相互作用检测结合相互作用的方法的第三步。
图15D显示了利用核酸条形码和弱二级相互作用检测结合相互作用的方法的第四步。
图16A显示了包括结合竞争物的可检测探针组合物。
图16B显示了包括结合竞争物的可检测探针组合物。
图17A显示了利用可检测探针或亲和试剂作为捕获剂的方法。
图17B显示了利用可检测探针或亲和试剂作为捕获剂的方法。
图17C显示了利用可检测探针或亲和试剂作为用于多肽测定的捕获剂的方法。
图18A显示了检测多于一个可检测探针与结合配偶体的结合的方法的第一步。
图18B显示了检测多于一个可检测探针与结合配偶体的结合的方法的第二步。
图18C显示了检测多于一个可检测探针与结合配偶体的结合的方法的第三步。
图19A显示了利用可检测探针来确定肽序列的方法。
图19B显示了利用可检测探针来确定肽序列的方法。
图19C显示了利用可检测探针来确定肽序列的方法。
图19D显示了利用可检测探针来确定肽序列的方法。
图20A显示了利用结合竞争物改变结合相互作用的方法。
图20B显示了利用结合竞争物改变结合相互作用的方法。
图21A显示了制作可检测探针的方法。
图21B显示了制作可检测探针的方法。
图22显示了使用可检测探针来表征多个结合配偶体。
图23显示了包括DNA折纸保留组分的可检测探针或亲和试剂的简化示意图。
图24A显示了基于量子点的可检测探针的结合特征数据。
图24B显示了基于量子点的可检测探针的结合特征数据。
图25显示了包括DNA折纸保留组分的可检测探针或亲和试剂的简化示意图。
图26显示了经由点击反应将基于抗体的结合组分附接于折纸保留组分的方案。
图27显示了含有抗体-寡核苷酸缀合物的SDS-Page凝胶的图像。
图28A显示了可检测探针针对多肽靶标的结合数据。
图28B显示了可检测探针针对多肽靶标的结合数据。
图28C显示了可检测探针针对多肽靶标的结合数据。
图28D显示了可检测探针针对多肽靶标的结合数据。
图29A显示了可检测探针对阴性对照多肽阵列结合的荧光显微镜图像。
图29B显示了可检测探针对阴性对照多肽阵列结合的荧光显微镜图像。
图29C显示了可检测探针对多肽阵列结合的荧光显微镜图像。
图30显示了可检测探针对多肽靶标的结合数据。
图31A显示了非核酸保留组分的配置。
图31B显示了非核酸保留组分的配置。
图31C显示了非核酸保留组分的配置。
图31D显示了非核酸保留组分的配置。
图32A显示了形成非核酸保留组分的方法的第一步。
图32B显示了形成非核酸保留组分的方法的第二步。
图32C显示了形成非核酸保留组分的方法的第一步。
图32D显示了形成非核酸保留组分的方法的第二步。
图32E显示了形成非核酸保留组分的方法的第三步。
图33显示了形成非核酸保留组分的方法。
图34A显示了包括非核酸保留组分的可检测探针的配置。
图34B显示了包括非核酸保留组分的可检测探针的配置。
图34C显示了包括非核酸保留组分的可检测探针的配置。
图35A显示了由多个可检测探针形成的多探针复合物。
图35B显示了由多个可检测探针形成的多探针复合物。
图35C显示了由多个可检测探针形成的多探针复合物。
图36A显示了具有受控构象的多探针复合物。
图36B显示了具有受控构象的多探针复合物。
图37A显示了从非核酸保留组分形成可检测探针的方法的第一步。
图37B显示了从非核酸保留组分形成可检测探针的方法的第二步。
图37C显示了从非核酸保留组分形成可检测探针的方法的第三步。
图38A显示了利用可检测探针或亲和试剂复合物进行药物递送的第一步。
图38B显示了利用可检测探针或亲和试剂复合物进行药物递送的第二步。
图38C显示了利用可检测探针或亲和试剂复合物进行药物递送的第三步。
图38D显示了利用可检测探针或亲和试剂复合物进行药物递送的第四步。
图39A显示了与二级保留组分形成的多探针复合物。
图39B显示了与二级保留组分形成的多探针复合物。
图40显示了利用可检测探针或亲和试剂作为捕获剂的亲和色谱系统。
图41显示了制备基于FluoSphere
图42A显示了基于FluoSphere
图42B显示了基于FluoSphere
图42C显示了基于FluoSphere
图42D显示了基于FluoSphere
图42E显示了基于FluoSphere
图42F显示了基于FluoSphere
图43A显示了基于FluoSphere
图43B显示了基于FluoSphere
图43C显示了基于FluoSphere
图43D显示了基于FluoSphere
图44A显示了基于FluoSphere
图44B显示了基于FluoSphere
图44C显示了基于FluoSphere
图45A显示了基于FluoSphere
图45B显示了基于Alexa-
图45C显示了基于APC的适体的结合特征数据。
图45D显示了基于SureLight
图46显示了具有不同数量的可用亲和试剂附接位点的基于FluoSphere
图47显示了采用直接附接或采用预退火方案制作的荧光纳米颗粒B1探针与his-标记的Her2(靶上)和肌红蛋白(脱靶)的结合数据。
图48显示了用于选择亲和试剂的固定化靶标以及包括所述靶标的肽的示例性列表。
图49A提供如本文所述的标记的亲和试剂的示意图。
图49B显示了通过酶促延伸将标记组分附接于核酸探针的方法。
图50图示了对亲和试剂进行荧光标记的一些示例性方式。图50A显示了具有附接的单个荧光团的适体。图50B显示了具有双链核酸标记区的适体,所述标记区具有两个附接的荧光团。图50C显示了使用模板将多个规则间隔的荧光团附接于适体。
图51显示了包括核酸单链的标记探针,其包括与包括荧光团的核酸单链杂交的适体。
图52显示了在488nm下显现以显示双链DNA且在647nm下显现以显示掺入的荧光团的凝胶。这些标记的亲和试剂经由酶促延伸和掺入荧光团修饰的核苷酸产生。
图53A显示了在488nm下显现以显示双链DNA的凝胶。
图53B显示了在647nm下显现以显示掺入的荧光团的凝胶。这些标记的亲和试剂经由酶促延伸和掺入化学修饰的核苷酸产生。随后,根据一些实施方案,化学缀合用于掺入荧光团
图54显示了经标记的适体浓度。
图55A显示了图54的经标记的适体中的荧光团浓度。
图55B显示了用于确定图8A中的荧光团浓度的dUTP-647标准曲线。
图56显示了由图54和55计算的荧光团:DNA比率。
图57A显示了与固定化肽结合的标记适体。
图57B显示了标记适体与固定化靶肽的结合。
图57C显示了标记适体与固定化非靶肽的结合。
图57D显示了在胺包被的盖玻片上有限稀释的标记适体的显微术。
图58A显示了可检测探针与SNAP附接的多肽之间的结合反应。
图58B显示了多个可检测探针与SNAP附接的多肽阵列之间的结合反应。
具体实施方式
检测亲和试剂与结合靶标之间的相互作用可用于提供物理系统的空间和/或时间表征和/或定量。例如,基于亲和试剂的方法如酶联免疫吸附测定(ELISA)可用于确定生化样品内的生物标志物的存在和潜在数量。亲和试剂可表现出复杂的行为,如与非预期或不太可能的靶标相互作用,或者无法与预期靶标相互作用。在批量或大规模表征中,亲和试剂可以被改造到足够的程度,使得它们的行为的复杂方面落在实验误差内,从而产生可用的相互作用数据。然而,对于利用亲和试剂的单分子测定,复杂的亲和试剂行为可能会产生使单分子亲和试剂相互作用数据的解释复杂化的异常结果(例如,假阴性、假阳性)。
由于影响亲和试剂与结合配偶体之间的结合相互作用的多种因素的原因,结合可能是短暂的。在一些情况下,亲和试剂可以与结合配偶体自由缔合和解离。在其他情况下,亲和试剂可以与结合配偶体以足够的强度相互作用以产生稳定或准稳定的复合物。此外,在一些情况下,亲和试剂可能与非预期或不太可能的结合配偶体缔合。
由于亲和试剂与结合配偶体之间相互作用的复杂性质的原因,一些亲和试剂相互作用可能不适合常规的二元相互作用框架(即,单结合配偶体,结合或不结合)。例如,由于各种原因,可能不会观察到亲和试剂与可用的结合配偶体的相互作用,包括1)亲和试剂无法与结合配偶体充分接近;2)在进行缔合观察时的时间间隔期间,亲和试剂无法保持与结合配偶体缔合;或3)中断或削弱亲和相互作用的环境变化(例如,结合配偶体或亲和试剂的构象变化)。同样,由于各种原因,如1)加强亲和相互作用的环境变化;或2)在进行缔合观察时的时间间隔期间发生的短暂缔合,可能观察到亲和试剂与非预期或不太可能的靶标结合。
因此,可能最好在概率或随机框架内描述一些亲和试剂相互作用(例如,多个结合配偶体、与每个靶标结合的非零概率)。对于其中单一相互作用测量可能不一定会提供确定表征的单分子测定,亲和试剂结合的概率或随机模型可能是特别有用的。在这样的情形下,多轮或多周期测量可增加测量置信度。
虽然亲和试剂在特定条件下可能不总是表现最佳,但可以改造亲和试剂以增加或改善它们用于某些目的的行为。可以修改的亲和试剂行为的两个方面包括亲合力和可观察性。
亲合力可以被理解为由于亲和试剂与结合配偶体之间存在多种通常为协同的结合相互作用而使亲和试剂保持与结合配偶体结合的倾向。多种结合相互作用的发生可能是例如由于结合配偶体具有由亲和试剂识别的多个不同表位,和/或由于探针具有识别结合配偶体中的表位的多个结合组分。这种现象的一个常见实例是抗体的亲合力,其中亲合力通常是通过如下方式实现的,单个抗体上的多个结合位点与特定的靶标弱结合以产生大于所述结合配偶体与所述抗体上的任何单独的结合位点之间的结合强度的表观结合强度。
可观察性可以被理解为检测亲和试剂与其结合配偶体之间的结合相互作用的能力。例如,可观察性可以指亲和试剂在所述亲和试剂与其结合配偶体之间的相互作用期间被检测到的趋势。在一些配置中,可观察性可以指亲和试剂产生在所述亲和试剂与其结合配偶体之间的相互作用后可以被检测到的信号或产生信号的标签(例如核酸标签)的趋势。可观察性可能受亲和试剂在检测期间持续足够的时间间隔维持相互作用的能力以及亲和力对可能会减弱相互作用的可检测信号的机制的抵抗力(例如,光漂白、标记组分的裂解)两者的影响。
本文描述了包括对结合配偶体具有增强的亲合力的探针的组合物。在一些配置中,所述探针是可检测的,并且任选具有增强的可观察性。本文所述的组合物如亲和试剂和可检测探针可特别用于单分子表征测定,包括例如在其中测量多轮或多周期亲和试剂相互作用的配置中。所述组合物任选具有对一个或多个结合配偶体增强的亲合力的性质,同时还被配置用于可逆结合,例如以允许移离结合配偶体,从而允许进行多周期或多轮结合测量。所述组合物可任选具有可调的检测标记,其允许以充分超过其中测量亲和剂相互作用的系统的背景信号的信号水平观察和测量所述标记。
在一些配置中,本文所述的可检测探针或亲和试剂可以被表征为包括与多个结合组分和多个标记组分(例如检测标记)中的一者或两者缔合的保留组分。所述多个结合组分可以以允许增强可检测探针或亲和试剂与特定结合配偶体结合的亲合力的配置展示在保留组分上。可检测探针或亲和试剂的亲和力可超过单独的结合组分中的任一者对该特定结合配偶体的亲和力。在一些配置中,所述可检测探针或亲和试剂对所述结合配偶体的亲和力可超过所述多个结合组分对所述结合配偶体的亲和力之和。此外,多个标记组分可以以增强由所述检测标记产生的可检测的信号的方式展示在可检测探针或亲和试剂的保留组分上。例如,可以在强度、持续时间或特异性方面增强信号。在特定的配置中,可检测探针或亲和试剂可进一步具有在化学物质(例如,表面活性剂、变性剂)的存在下稳定的性质,否则所述化学物质会破坏亲和试剂与其结合配偶体之间的相互作用,从而允许将所述可检测探针或亲和试剂移离所述结合配偶体,而不损坏或破坏所述可检测探针或亲和试剂的结构。
在一些配置中,所述的可检测探针或亲和试剂采用核酸折纸作为与多个结合组分(例如抗体、抗体片段、微型蛋白、DARPin、DNA适体、RNA适体等)和/或多个标记组分(例如,荧光团、核酸标签、量子点、荧光纳米颗粒、荧光蛋白)偶联的保留组分。在一些配置中,基于核酸折纸的保留组分可具有允许在预定位置附接多个结合组分和/或多个标记组分的规则或对称形状。例如,所述组分可彼此分开预定的距离,可以定向所述组分以实现协同功能,或者可以定向所述组分以减少或防止彼此活性的抑制。调节间距和取向的能力可产生所需的检测特性,如荧光团标记之间减少的猝灭或荧光团标记之间增强的Forster共振能量转移(FRET)。可替代地或另外地,可以调节间距和取向以调整所述亲和试剂对一个或多个结合配偶体的亲和力。
在特定的配置中,可检测探针可采用可光学检测的颗粒。所述颗粒可具有多个结合组分可附接于其上的可修饰的表面。所述可光学检测的颗粒可包括荧光或发光纳米颗粒(例如,FluoSphere
在进一步的配置中,可以组合两个或更多个可检测探针以形成可检测探针的复合物。可以在两个亲和试剂之间或亲和试剂与可检测探针之间制备类似的复合物。探针和/或试剂的复合物可具有相似亲和力(例如,单价探针或试剂)或不同亲和力(例如,多价探针)的结合组分。
在一些配置中,可检测探针或亲和试剂与竞争亲和试剂组合或偶联。所述竞争亲和试剂可以被配置为游离分子,或为附接于所述可检测探针或亲和试剂的结合组分。竞争亲和试剂在一些情况下具有对所关注的结合配偶体降低的亲和力或特异性,导致比非竞争亲和试剂更高水平的混杂。竞争亲和试剂的存在可增强可检测探针或亲和试剂对特定结合配偶体的亲合力。
本公开提供了使用组合物检测分析物的方法,所述组合物包括具有对结合配偶体增强的亲合力和增强的可观察性的可检测探针或亲和试剂。本文例示了用于检测多肽的方法。将要理解的是,可以使用多种分析物中的任一种,如由分析化学测定、生物化学测定、分子诊断测定、分子法医测定、品质控制测定等所靶向的那些。
异质多肽样品的表征和定量往往受数量差异很大的蛋白质和/或肽共存的阻碍。例如,在定量表征测定中,来自低拷贝数蛋白质的信号可以被来自高拷贝数蛋白质的信号淹没。在蛋白质组水平(例如数以万计的独特蛋白质种类)上进行的多肽表征测定的准确性可受益于高灵敏度分析技术和高置信度预测技术的组合。
生物分析可极大地受益于可用于检查生物系统的分子操作的工具的进步。基因组学技术、单细胞分析平台和高灵敏度化学分析系统的进展可极大地提高研究人员和临床医生对生物系统如何运作的看法,并进而改进对疾病及其他人体健康状况的理解、治疗和预防。
这些先进工具中的许多得益于使用能够结合不同生物分子或以其他方式与不同生物分子缔合的可检测试剂,其中所述结合允许确认给定系统中的这类分子的存在和/或对其进行定量,其中的存在和/或数量提供了对所述系统的功能的深入了解。作为实例,这些工具中的许多提供将来自生物系统的不同分子种类(如蛋白质、核酸等)固定在支持结构(如固定底物或珠粒)上。然后可以使用对不同分子种类具有一定水平的结合亲和力的分子(也称为亲和试剂),通过使两者一起接触来审视结合的分子,以观察亲和试剂是否结合、在哪里结合和/或结合多长时间,表明特定分子在生物样品中的可能存在。
通常可以通过检测所述亲和试剂的标记组分来完成结合的检测。虽然所述标记组分可以是所述亲和试剂的固有部分,但在许多情况下,所述标记组分可以是附接于所述亲和试剂的外源性化学或结构部分。具有标记组分的亲和试剂可充当可检测探针。
很多种外源性可检测标记通常可用于这样的目的,包括例如可光学检测的标记,如荧光染料标记、酶(例如催化与着色试剂或产物反应的酶)、电化学标记,如高度带电的标记基团,或甚至通过后续处理检测的基团,如可后续通过核酸扩增方法、测序方法或杂交测定确认的核酸条形码标记。荧光标记可用于显现亲和试剂与其他分子如蛋白质或肽之间的结合相互作用。
根据将使用亲和试剂或可检测探针的应用,可能期望或甚至需要不同程度的信号强度。举例来说,在许多应用中,可通过结合许多亲和试剂或可检测探针来实现结合信号的放大。例如,可以分离样品,使得单个可检测部分的多个分子聚集在单个位置,因此更容易观察或检测。可替代地或另外地,二级结合系统可用于呈现单独的标记组分可后续结合并被检测的多个另外的结合位点。
然而在一些情况下,可能有用的是以定量方式显现亲和试剂或可检测探针的单个分子与样品中的单个分子的结合。如将理解的那样,在检测方面,个别分子的检测存在许多挑战。一个这样的挑战是呈现来自试剂或探针的单个分子与单个分子结合的可检测的信号的能力,所述可检测的信号具有足够的信号强度(例如信号强度和持续时间),以被可用的分析系统检测到,无论是在原始信号强度方面还是在相对于系统的背景噪声的强度的信号强度方面。
可通过多种方法单独或组合来解决信号强度挑战。例如,采用高度灵敏的显微术技术可增强检测极低水平信号的能力,包括具有低强度和/或短持续时间的单分子信号。另外,可以通过掺入多个标记组分(例如,单个分子如亲和试剂分子或可检测探针分子上的多个标记组分)来增加信号强度,以显著增加与该单个分子相关的信号,从而提高其可检测性。同样,举例来说,对于荧光标记,可以通过在单个亲和试剂或可检测探针中附接若干荧光部分来实现增加信号强度。然而,简单地加载具有荧光染料标记的探针或试剂可能会带来其自身的一系列挑战。可以小心地配置探针或试剂,使得所述探针或试剂上的一个荧光部分不会猝灭所述探针或试剂上的另一个荧光部分,可以控制探针或试剂上的荧光部分的数目,并且将这些标记基团附接于所述探针或试剂的化学过程不干扰所述探针本身的结合亲和力。
特别有用的亲和试剂和可检测探针能够与特定的蛋白质、代谢物、细胞或细胞界面结合。这类亲和试剂和可检测探针的实例可包括由天然存在的氨基酸组成的基于蛋白质的探针、小分子探针、由天然存在的碱基组成的基于核酸的探针以及由非天然核苷酸和氨基酸组成的探针。所述试剂可以被配置为专门与给定的表位或其他靶标结合。
结合的排他性通常被认为是亲和试剂或可检测探针中的期望特性。已经做出了大量的努力以确保亲和试剂或探针仅与一种靶物质结合,而与其他靶标的结合最小。例如,所述靶物质可以是氨基酸的特定序列。如果该序列对于生物样品中存在的蛋白质是独特的,则对所述序列是特异性的试剂或探针将对所述样品的环境中的蛋白质是特异性的。因此,所述试剂或探针可用于确认或甚至定量样品中的蛋白质。如本文进一步详细阐述的那样,存在特定的使用情况,其中可能有用的是具有与样品中的一种或多种不同蛋白质结合的亲和试剂或可检测探针。例如,有用的亲和试剂或可检测探针可与两种或更多种不同蛋白质共有的表位结合。可替代地或另外地,所述探针或试剂可与两个或更多个不同表位结合,所述表位存在于不同的蛋白质或同一蛋白质的不同区域中。与样品中的多个靶标结合的亲和探针和可检测探针可用于在本文阐述的组合物和方法中产生有用的效果。
除另有说明外,否则本文使用的术语将被理解为具有其在相关领域中的普通含义。本文使用的若干术语及其含义阐述如下。
如本文所用,术语“亲和试剂”是指能够特异性地、可重复地或以高概率与结合配偶体结合的分子或其他物质。特异性结合可以按照结合常数来表征,如小于10
如本文所用,术语“抗体”是指特异性结合结合配偶体的免疫球蛋白分子或其功能片段。抗体可以对结合配偶体内的一个或多个表位具有特异性。抗体可以是天然存在的、改造的或进化的。抗体可包括互补决定区(CDR)片段、单链抗体(scFv)、单结构域抗体、嵌合抗体、双抗体和含有免疫球蛋白的至少一部分的多肽,所述部分足以赋予与所述多肽结合的特异性表位。出于本文所述的目的,线性抗体也包括在内。示例性抗体包括免疫球蛋白同种型,诸如IgM、IgA、IgG、IgD和IgE。示例性抗体片段包括F(ab’)2片段、Fab’片段、Fab片段、Fv片段、scFV片段、rlgG片段和Fc片段。
如本文所用,术语“大致”当结合形状使用时可意指参考所述形状的两个或更多个量度在理想形状的20%以内的形状。例如,图2A-2B分别显示了大致方形和大致圆形的二维体210和215,方形220或圆形225的理想边界以虚线显示。如本文所用,术语“大约”当结合长度、面积或体积使用时可意指在给定测量值的10%以内的长度、面积或体积。例如,10毫米(mm)的长度可指9mm与11mm之间的任意长度。
如本文所用,术语“阵列”是指与独特标识物相关联的分析物(例如蛋白质)的群体,使得所述分析物可彼此区分。独特标识物可以是固体支持物(例如颗粒或珠粒)、结构化核酸颗粒、保留组分、固体支持物上的位点(例如空间地址)、标签、标记(例如发光团)或条形码(例如核酸条形码),其与分析物相关联,并且与所述阵列中的其他标识物不同。分析物可通过附接与独特标识物相关联,例如经由共价或非共价(例如离子键、氢键、范德华力、静电等)键。阵列可包括各自附接于不同的独特标识物的不同分析物。阵列可包括附接于相同或相似分析物的不同的独特标识物。阵列可包括各自带有不同分析物的单独的固体支持物或单独的地址,其中所述不同分析物可根据所述固体支持物或地址的位置来确认。可包括在阵列中的分析物或其他分子可以是例如核酸如SNAP、多肽、酶、亲和试剂、结合配偶体、配体或受体。
如本文所用,术语“附接”是指两个事物彼此接合、紧固、粘附、连接或结合的状态。例如,结合组分可通过共价或非共价键附接于保留组分。共价键的特征在于原子之间共享电子对。非共价键是不涉及共享电子对的化学键,并且可包括例如氢键、离子键、范德华力、亲水性相互作用和疏水性相互作用。
如本文所用,术语“结合亲和力”或“亲和力”是指亲和试剂与结合配偶体、表位或靶部分之间结合的强度或程度。在一些情况下,亲和试剂对结合配偶体、表位或靶部分的结合亲和力可趋零地很小或实际上为零。亲和试剂对结合配偶体、表位或靶部分的结合亲和力可以被限定为“高亲和力”、“中等亲和力”或“低亲和力”。如果相互作用的平衡解离常数(K
如本文所用,术语“结合组分”是指亲和试剂的一部分,所述部分能够特异性地、可重复地或以高概率与结合配偶体结合。示例性结合组分包括但不限于抗体或其功能片段(例如,Fab’片段、F(ab’)
如本文所用,术语“结合背景”是指观察到亲和试剂-结合配偶体相互作用的环境条件。环境条件可包括可影响亲和试剂与结合配偶体之间的相互作用的任何因素,诸如温度、流体特性(例如,离子强度、pH)、相对浓度、绝对浓度、流体组成、结合配偶体构象、亲和试剂构象及其组合。环境条件可包括结合配偶体的结构特征,结合配偶体虽然在表位之外,但其影响表位与结合试剂的相互作用。结构特征可包括例如多肽的氨基酸或区域,其靠近所述多肽的一级、二级、三级或四级结构中的表位。
如本文所用,术语“结合配偶体”是指由亲和试剂或结合组分识别的分子或其他物质。相对于样品中的其他分子或物质,亲和试剂可特异性地或可重复地识别特定的结合配偶体。可替代地,亲和试剂可识别样品中的多个不同的结合配偶体,例如与较大组的不同多肽当中的不同多肽序列亚组混杂地结合。结合配偶体可以能够与亲和试剂形成相互作用,而不管这种相互作用是否发生。结合配偶体可包括一个或多个表位。结合配偶体可具有刚性结构,如纳米颗粒或微颗粒。结合配偶体可具有熔融或动态结构(例如,球状蛋白质、球状聚合物)。结合配偶体可以是溶液相或固相。例如,结合配偶体在含有亲和试剂的溶液内可以是游离的,或者可定位在亲和试剂可及的表面或界面处。结合配偶体可附接于结构化核酸颗粒(例如核酸折纸)或保留组分。
如本文所用,术语“结合概率”是指例如在固定的结合背景以内可以观察到亲和试剂与结合配偶体和/或表位相互作用的概率。结合概率可以被表示为离散数(例如,0.4或40%)、离散数的矩阵或表示为数学模型(例如,理论或经验模型)。结合概率可包括一个或多个因素,包括结合特异性、定位靶表位的可能性或结合持续足够的时间量以检测结合相互作用的可能性。总结合概率可包括当所有因素都已相对于结合背景加权时的结合概率。
如本文所用,术语“结合特异性”是指亲和试剂相对于其他结合配偶体或表位优先与结合配偶体或表位相互作用的趋势。亲和试剂可以对任何可能的结合配偶体或表位具有计算的、观察的、已知的或预测的结合特异性。结合特异性可以指对样品中的单个结合配偶体、表位或靶部分相较于所述样品中的所有、一些或至少一种其他分析物的选择性。此外,结合特异性可以指对样品中的结合配偶体、表位或靶部分的亚组相较于所述样品中的至少一种其他分析物的选择性。
如本文所用,术语“生物正交反应”是指可以在生物系统内(体外和/或体内)发生而不干扰所述生物系统的一些或所有天然生物学过程、功能或活性的化学反应。生物正交反应可以被进一步表征为对生物系统中的不是被所述生物正交反应所靶向的那些的组分是惰性的。生物正交反应可包括点击反应。生物正交或点击反应可包括施陶丁格连接、无铜点击反应、硝酮偶极环加成、降冰片烯环加成、氧杂降冰片二烯环加成、四嗪连接、[4+1]环加成、四唑光点击反应或四环烷连接。生物正交反应可利用酶促方法,诸如通过酶诸如分选酶、连接酶或枯草连接酶(subtiligase)在第一分子与第二分子之间进行附接。生物正交反应可利用不可逆肽捕获系统,如SpyCatcher/SpyTag、SnoopCatcher/SnoopTag或SdyCatcher/SdyTag。
如本文所用,术语“点击反应”是指利用生物相容性试剂的单步热力学有利的缀合反应。点击反应可以被配置为不利用有毒或生物不相容的试剂(例如,酸、碱、重金属)或不产生有毒或生物不相容的副产物。点击反应可利用水性溶剂或缓冲液(例如,磷酸盐缓冲溶液、Tris缓冲液、盐水缓冲液、MOPS等)。如果点击反应具有负的吉布斯反应自由能,例如小于约-5千焦/摩尔(kJ/mol)、-10kJ/mol、-25kJ/mol、-50kJ/mol、-100kJ/mol、-200kJ/mol、-300kJ/mol、-400kJ/mol或小于-500kJ/mol的吉布斯反应自由能,则其可为热力学有利的。WO2019/195633A1中详细描述了示例性生物正交和点击反应,上述专利文献通过引用并入本文。
术语“包含”在本文中旨在为开放式的,不仅包括所列举的要素,而且还涵盖任何另外的要素。
如本文所用,术语“每个”当用于指代项目的集合时旨在确认集合中的单个项目,但不一定指代所述集合中的每个项目。如果有明确公开或上下文明确另有规定,则可有例外情况。
如本文所用,术语“表位”是指由亲和试剂识别或与亲和试剂特异性结合的分子或分子的一部分。表位可包括在多肽的一级结构中顺序相邻的氨基酸序列或在多肽的二级、三级或四级结构中结构相邻的氨基酸。表位可任选由抗体识别或与抗体结合。然而,然而,表位不需要一定由任何抗体识别,例如而是由适体、微型蛋白或其他亲和剂识别。表位可任选结合抗体以引发免疫反应。表位不需要一定参与、也不需要能够引发免疫反应。术语“亲和靶”在本文中与术语“表位”同义使用。
如本文所用,术语“外源的”当用于指代分子的部分时意指在所述分子的天然类似物中不存在的部分。例如,氨基酸的外源标记是天然存在的氨基酸上不存在的标记。类似地,存在于抗体上的外源标记在天然环境中的所述抗体上不存在。
如本文所用,术语“官能团”是指在分子中对所述分子赋予化学特性如反应性、极性、疏水性、亲水性、溶解性、结合亲和力等的部分或原子团。官能团可包括有机部分,或者可包括无机原子。示例性官能团可包括生物正交反应物、点击反应物、烷基、烯基、炔基、苯基、卤化物、羟基、羰基、醛、酰卤、酯、羧酸酯、羧基、碳烷氧基(carboalkoxy)、甲氧基、氢过氧基、醚、半缩醛、半缩酮、缩醛、缩酮、原酸酯、环氧化物、羧酸酐、羧酰胺、胺、酮亚胺、醛亚胺、酰亚胺、叠氮化物、偶氮、氰酸酯、异氰酸酯、硝酸酯、腈、异腈、亚硝氧基、硝基、亚硝基、肟、吡啶基、氨基甲酸酯、巯基、硫化物、二硫化物、亚磺酰基、磺酰基、锍(sulfinom)、磺基、硫氰酸酯、异硫氰酸酯、硫代羰基(carbonothioyl)、硫酯、硫单酯(thionoester)、膦基、膦酰基、膦酸酯、磷酸酯、二羟硼基、硼酸酯和二烃基硼酸酯(borinate)官能团。
如本文所用,术语“标记”是指提供可检测的特征的分子或其部分。所述可检测的特征可以是例如光信号,如辐射的吸收、发光发射、发光寿命、发光偏振、荧光发射、荧光寿命、荧光偏振等;瑞利和/或米氏散射;对配体或受体的结合亲和力;磁特性;电气特性;电荷;质量;放射性等。示例性的标记包括但不限于荧光团、发光团、发色团、纳米颗粒(例如,金、银、碳纳米管)、重原子、放射性同位素、质量标记、电荷标记、自旋标记、受体、配体等。标记可产生被实时检测的信号(例如,荧光、发光、放射性)。标记组分可产生被离线(例如,核酸条形码)或以时间分辨的方式(例如,时间分辨的荧光)检测的信号。标记组分可产生具有特征频率、强度、极性、持续时间、波长、序列或指纹的信号。
如本文所用,术语“标记组分”是指提供可检测的特征的亲和试剂或其他物质的部分。可检测的特征可以是例如本文在标记的上下文中阐述的那些中的任一者。标记组分可附接于或能够附接于另一分子或物质。可附接于标记组分的示例性分子包括亲和试剂或结合配偶体。
如本文所用,术语“核酸纳米球”是指球状或球形核酸结构。核酸纳米球可包括以球状结构排列的序列区域的串联体。核酸纳米球可包括DNA、RNA、PNA、修饰或非天然的核酸或其组合。
如本文所用,术语“核酸折纸”是指核酸构建体,其除了核酸的天然存在的螺旋结构之外还包括改造的三级或四级结构。核酸折纸可包括DNA、RNA、PNA、修饰或非天然的核酸或其组合。核酸折纸可包括多个寡核苷酸,它们经由序列互补性杂交以产生折纸颗粒的改造结构化。核酸折纸可包括单链或双链核酸的区段或其组合。示例性核酸折纸结构可包括纳米管、纳米线、笼、瓦片、纳米球、块及其组合。核酸折纸可任选包括相对长的支架核酸,多个较小的核酸与之杂交,从而在所述支架中产生折叠和弯曲,从而产生改造的结构。所述支架核酸可以是环形的或线性的。所述支架核酸可以是单链的,但用于与较小的核酸杂交。较小的核酸(有时称为“订书钉”)可以与所述支架的两个区域杂交,其中所述支架的所述两个区域由不与所述较小核酸杂交的居间区域分开。
如本文所用,术语“寡核苷酸”是指包括通过磷酸二酯键连接的两个或更多个核苷酸的分子。寡核苷酸可包括DNA、RNA、PNA、修饰的核苷酸、非天然核苷酸或其组合。寡核苷酸可包括有限数目的核苷酸亚基,举例如少于约200、190、180、170、160、150、140、130、120、110、100、90、80、70、60、50、40、30、25、20、15、10个或少于5个核苷酸。
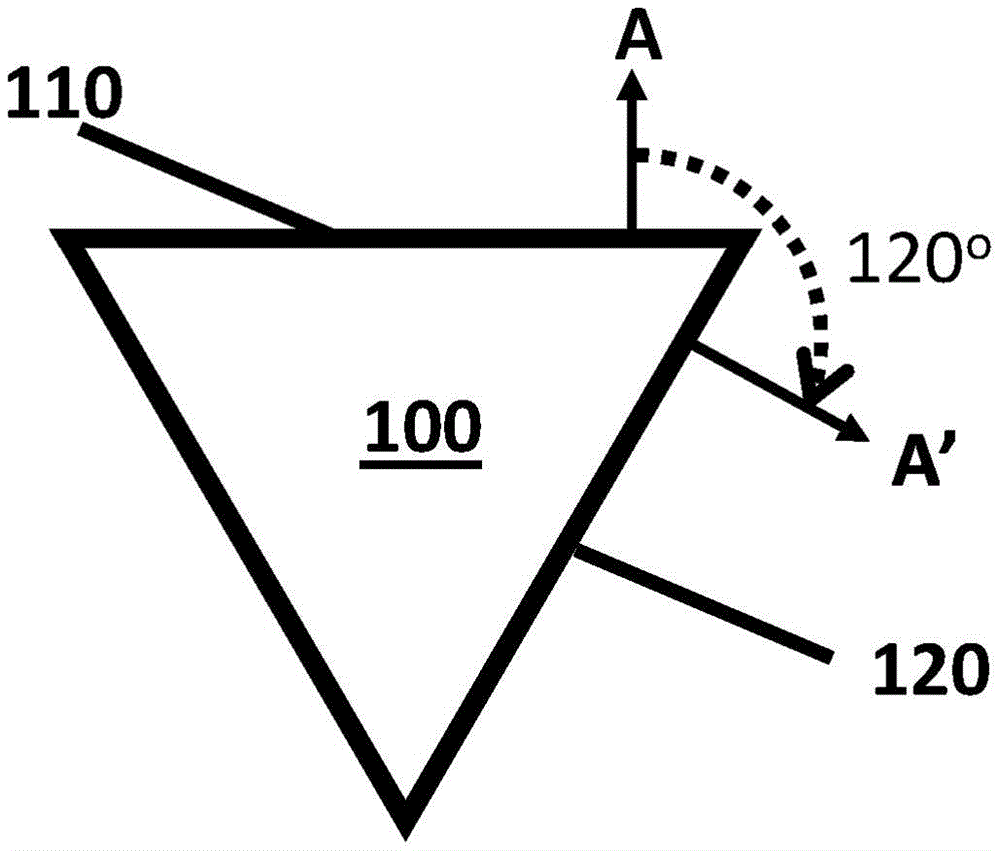
如本文所用,术语“偏移”当用于指代分子结构时是指两条线(2维)或两个平面(三维)之间的取向的空间差异。所述平面可近似于分子结构的表面,如折纸瓦片的面。偏移可包括距离偏移和/或角度偏移。图1A和1B描绘了不同二维形状(其可以是三维结构的二维投影)的角度偏移的实例。图1A的等腰三角形100在相对取向由正交向量A和A’描绘的第一面110与第二面120之间具有120°的角度偏移。图1B的三角形130在相对取向由正交向量A和A’描绘的第一面110与第二面120之间具有180°的角度偏移。
如本文所用,术语“多肽”是指包括通过肽键连接的两个或更多个氨基酸的分子。多肽也可以被称为蛋白质、寡肽或肽。虽然术语“蛋白质”、“多肽”、“寡肽”和“肽”可任选用于指具有不同特征如氨基酸序列组成或长度、分子量、分子来源等的分子,但所述术语并不旨在在所有的上下文中固有地包括这类区别。多肽可以是天然存在的分子或合成的分子。多肽可包括一个或多个非天然氨基酸、修饰的氨基酸或非氨基酸接头。多肽可含有D-氨基酸对映异构体、L-氨基酸对映异构体或两者。多肽的氨基酸可以被天然或合成修饰,如通过翻译后修饰。
如本文所用,术语“混杂”当用于指代亲和试剂时是指与两个或更多个不同结合配偶体结合或具有与两个或更多个不同结合配偶体结合的能力的结合剂。例如,混杂的结合剂可:1)由于在不同结合配偶体的结构内存在共同表位而与多个不同结合配偶体结合,或2)与多个不同的表位结合;或3)两种特性的组合。由于特定表位或靶部分的存在,混杂的结合剂可与多个结合配偶体结合,而不管所述表位或靶部分的结合背景如何。所述结合背景可包括例如表位或靶部分周围的局部化学环境,如侧翼、邻近或相邻的化学实体(例如,对于多肽表位,相对于所述表位的侧翼氨基酸序列或邻近或相邻的非连续氨基酸序列)。由混杂的亲和试剂结合的多个不同表位可包括结构上或化学上相关的表位,尽管这些表位具有不同的氨基酸含量。例如,如果亲和试剂对具有形式WXK的三聚体肽序列具有结合亲和力,其中X是任何可能的氨基酸,则其可以被认为是混杂的。WO2020/106889A1中讨论了与结合混杂有关的另外的概念,该专利文献通过引用并入本文。
如本文所用,术语“保留组分”是指亲和试剂、可检测探针或其他物质的连接至少两个其他组分的部分。保留组分可以将两个其他组分彼此保持在特定距离以内。例如,两个其他组分可以被保持距离为至多1000nm、500nm、100nm、50nm、10nm、5nm、1nm或更小。可替代地或另外地,保留组分可以将两个其他部分以彼此最小的距离分开。例如,两个其他组分可以被保持距离为至少1nm、5nm、10nm、50nm、100nm、500nm、1000nm或更大。保留组分可包括例如结构化核酸颗粒、核酸纳米球、核酸折纸、蛋白质核酸、多肽、合成聚合物、多糖、有机颗粒、无机颗粒、凝胶、水凝胶、包被颗粒等。保留组分可任选具有聚合结构。可替代地,保持组分不需要具有聚合结构。在一些实施方案中,保留组分具有同与其附接的其他组分类似的组成。例如,可以将由多肽物质组成的多个结合组分附接于多肽保留组分。可替代地,保留组分可具有同与其附接的其他组分的组成相当不同的组成。例如,可以将由多肽物质组成的多个结合组分附接于部分或完全由多肽以外的物质组成的保留组分,所述多肽以外的物质如核酸物质或有机或无机纳米颗粒(例如,碳纳米球、二氧化硅纳米球等)。保留组分可包括一个或多个附接位点,其允许另一组分如标记组分或结合组分附接于所述保留组分。附接位点可包括官能团、活性位点、结合配体、结合受体、核酸序列或能够与结合组分、标记组分或其他可检测探针组分形成共价或非共价附接的任何其他实体。保留组分可包括有机或无机颗粒或纳米颗粒。支架可包括允许附接另一组分的涂层或表面层,例如,如在聚合物包被的FluoSphere
如本文所用,术语“位点”当用于指代阵列时意指阵列中由或被配置为由特定分子或分析物如多肽、核酸、结构化核酸或官能团占据的位置。位点可仅含有单个分子,或者其可含有相同种类的若干分子的群体(即分子的集合体)。可替代地,位点可包括不同种类的分子的群体。阵列的位点通常是离散的。所述离散位点可以是连续的,或者它们彼此之间可具有间隙空间。本文有用的阵列可具有例如分开不到100微米、10微米、1微米或0.5微米、0.1微米、0.01微米或更小的位点。可替代地或另外地,阵列可具有分开至少0.01微米、0.1微米、0.5微米、1微米、10微米、100微米或更大的位点。所述位点可各自具有小于1平方毫米、500平方微米、100平方微米、25平方微米、1平方微米或更小的面积。阵列可包括至少约1x10
如本文所用,术语“固体支持物”是指不溶于水性液体的刚性底物。所述底物可以是无孔的或多孔的。所述底物可任选能够吸收液体(例如由于多孔性),但通常具有足够的刚性,使得所述底物在吸收所述液体时基本上不溶胀,并且在通过干燥移除所述液体时基本上不收缩。无孔固体支持物通常不透液体或气体。示例性固体支持物包括但不限于玻璃和修饰或功能化玻璃、塑料(包括丙烯酸树脂、聚苯乙烯和苯乙烯与其他材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯、Teflon
如本文所用,术语“种类”用于确认共享相同化学结构的分子或部分。具有相同氨基酸序列的单独表位部分是相同种类的表位,而具有不同序列的表位部分是不同种类的表位。由同一基因表达的蛋白质是同一种类的基因产物,由同一基因表达并具有相同的翻译后修饰的蛋白质是同一蛋白质形式或同种型。两种蛋白质可以由同一基因表达,但具有不同的蛋白质修饰,在这种情况下,所述两种蛋白质是同一种类的基因产物,但蛋白质形式或同种型不同。
如本文所用,术语“结构化核酸颗粒”(或“SNAP”)是指具有压缩的三维结构的单链或多链多核苷酸分子。对于具有与SNAP相同序列长度的核酸,可任选根据SNAP相对于无规卷曲或其他非结构化状态的流体动力学半径或斯托克半径来表征压缩的三维结构。可任选关于三级结构来表征压缩的三维结构。例如,与呈无规卷曲或其他非结构化状态的相同核酸分子相比,SNAP可以被配置为在多核苷酸链的区域之间具有增加数量的内部结合相互作用,在所述区域之间具有较小的距离,在所述链中具有增加数量的弯曲,和/或在所述链中具有更尖锐的弯曲。可替代地或另外地,可任选关于四级结构来表征压缩的三维结构。例如,与呈无规卷曲或其他非结构化状态的相同核酸分子相比,SNAP可以被配置为在多核苷酸链具有增加数量的相互作用,或在所述链之间具有较小的距离。在一些配置中,SNAP的二级结构(即多核苷酸链的螺旋扭曲或方向)可以被配置为比呈无规卷曲或其他非结构化状态的相同核酸分子更致密。可任选修饰SNAP以允许另外的分子附接于所述SNAP。SNAP可包含DNA、RNA、PNA、修饰或非天然的核酸或其组合。SNAP可包括多个寡核苷酸,它们杂交以形成SNAP结构。SNAP中的所述多个寡核苷酸可包括附接于其他分子(例如,亲和试剂、结合配偶体、官能团或可检测标记)或被配置为附接于其他分子(例如,通过官能团)的寡核苷酸。SNAP可包括改造的或合理设计的结构,如核酸折纸。
如本文所用,术语“基本上相同”当用于指代两个或更多个结构时是指以基本上相同的方式执行或能够执行基本上相同的功能以获得相同结果的结构。例如,基本上相同的两个结构化核酸颗粒可具有相同的一级结构。任选地,它们可以在一级结构上不同,只要它们在三级或四级结构上没有不同即可。任选地,它们可以在一级、二级、三级或四级结构中的一者或多者上不同,只要它们以基本上相同的方式执行基本上相同的功能以按照本文阐述的方法获得相同的结果即可。
如本文所用,术语“靶部分”是指表位内介导或促进结合相互作用的特定化学结构。靶部分可包括官能团、侧链、活性位点或具有可表征结构的其他化学实体。例如,靶部分可以是形成多肽表位的一部分的一个或多个氨基酸或其侧链。靶部分可以与亲和试剂的结合位点特异性地相互作用以促进或介导导致所述亲和试剂与所述结合配偶体结合的相互作用。
如本文所用,术语“可调”是指保留组分、支架或分子的结构中的组分或附接位点的具体、精确和/或合理位置的可调节性。可调保留组分可以指在保留组分结构的特定位点或特定区域内附接其他组分或者产生用于在保留组分结构的特定位点或特定区域附接其他组分的附接位点的能力。如本文所用,“可调性”是指具有可调结构或架构的探针或保留组分的特性。
除了在操作实例中,或者在另外指明的情况下,本文所用的表示成分的量或反应条件的所有数字应被理解为在所有情况下均由术语“约”修饰。如本文所用,术语“约”当与百分比结合使用时可意指所指值的±5%。例如,约90%意指85%至95%。
如本文所用,术语“二维投影”是指在没有显著几何或空间失真的情况下将由三维结构在平面二维表面上的投影所占据的区域或形状。例如,球体在平面二维表面上的二维投影将在所述表面上产生直径等于所述球体的直径的圆形区域。二维投影可由任何参考系形成,包括与三维结构的任何表面正交的参考系。
可检测探针和亲和试剂的结构和功能
本文描述了具有对结合配偶体增加的结合亲和力、增加的可观察性或这两者的可检测探针或亲和试剂。本文对于可检测探针例示的结构和功能特征可存在于其他亲和试剂中。反过来,本文对于亲和试剂例示的结构和功能特征可存在于可检测探针中。因此,本文在可检测探针的背景下阐述的组合物、结构和方法可应用于其他亲和试剂,反之亦然。
可检测探针或亲和试剂可包括多个结合组分,这些结合组分与所述可检测探针或亲和试剂结构内所含有的所述多个结合组分中的任何单独的结合组分相比共同地增加所述探针对结合配偶体的总结合亲和力。本领域中已知或本文阐述的多个亲和试剂中的任一者当附接于本公开的可检测探针或亲和试剂时可充当结合组分。本公开的可检测探针或亲和试剂可进一步包括一个或多个标记组分,其允许观察所述可检测探针(或亲和试剂)与结合配偶体之间的结合相互作用。本领域中已知或本文阐述的多个可检测标记中的任一者当附接于本公开的可检测探针或亲和试剂时可充当标记组分。
本公开的可检测探针或亲和试剂可包括(a)保留组分;(b)标记组分,和(c)附接于所述保留组分的一个、两个或更多个结合组分。特别受关注的是在空间上和/或取向上可调的保留组分,以提供附接于其上的其他组分的精确、预定和/或合理的展示。例如,结合组分可以以增加所述可检测探针或亲和试剂的结合亲合力和/或可观察性的配置附接。可检测探针或亲和试剂可包括提供足够的位点以附接至少一个结合组分和/或至少一个标记组分的保留组分。在一些配置中,所述保留组分可以是天然的、人工的或合成的颗粒,其包括多个官能团、反应位点、核酸或允许其他分子附接于所述保留组分的官能团。保留组分可具有无定形、球状或不规则结构(例如,DNA纳米球、荧光纳米颗粒如FluoSphere
在一些情况下,保留组分可包括部分或基本上完全双链的核酸。双链核酸可以对所述保留组分赋予另外的结构刚性,以便在标记组分之间提供更好的间距。在这样的情况下,标记组分可与双链核酸的一条或两条链偶联。保留组分可包括结构化颗粒或合理设计的颗粒。保留组分可包括配置为附接一个或多个结合组分和/或一个或多个标记组分的结构化核酸颗粒(SNAP)。在一些配置中,SNAP可包括DNA折纸颗粒或DNA纳米球。
保留组分可包括用于附接其他组分(例如结合组分、标记组分或另一保留组分)的多个位点。保留组分可包括用于偶联结合组分和/或标记组分的独特或专用位点。例如,保留组分可包括具有同与结合组分偶联的核酸互补的第一序列的核酸,并且可进一步包括具有同与标记组分偶联的核酸互补的第二序列的核酸。所述第一序列可以不同于所述第二序列,使得不同类型的组分被适当地导向偶联位点的亚组。可替代地,所述第一和第二序列可以是相同的。任选地,保留组分可包括一个或多个第一官能团,它们被配置为与同结合组分偶联的官能团形成共价键,并且可进一步包括一个或多个第二官能团,它们被配置为与同标记组分偶联的官能团形成共价键。所述第一官能团可以不同于所述第二官能团,使得不同类型的组分被适当地导向偶联位点的亚组。例如,所述第一多个官能团可参与与所述第二多个官能团参与的成键反应正交的成键反应。可替代地,所述第一和第二官能团可以是相同的。在一些配置中,保留组分可包括附接位点类型如核酸和官能团的混合物,其中每种类型的附接位点被配置为附接不同类型的组分。
保留组分可包括附接于所述保留组分的一个或多个其他组分(例如结合组分、标记组分或另一保留组分)。保留组分可通过共价键(例如,经由点击反应)、配位键(例如,硅纳米颗粒的硅烷接头)或非共价键(例如,核酸杂交)附接于另一组分。保留组分可通过在所述保留组分上的官能团与其他组分上的官能团之间形成共价键的化学反应附接于另一组分。所述反应可通过任意合适的方法进行,包括亲核取代、亲电取代和消除反应。在一些配置中,可以通过生物正交或点击反应形成保留组分与另一组分之间的共价键。可以修饰保留组分和/或其他组分以包括被配置为参与生物正交或点击反应的官能团。本文进一步详细阐述了可用于将保留组分附接于一个或多个其他组分的示例性官能团和键接,例如在制备可检测探针或亲和试剂的上下文中。
在一些配置中,保留组分可包括核酸结构,如SNAP。在一些情况下,所述核酸结构可包括单链核酸的区域,其提供用于将其他组分(例如结合组分、标记组分或另一保留组分)附接于所述保留组分的靶向的位点特异性杂交位点。在这样的配置中,附接于互补寡核苷酸的其他组分可以被退火到保留组分上的单链序列上,以在所述保留组分上的靶向位点处形成附接。在其他配置中,包括官能团的寡核苷酸可以被退火到保留组分上,从而允许后续经由所述寡核苷酸上的官能团与其他组分上的官能团之间的化学反应(例如,点击反应)附接另一组分。
可检测探针或亲和试剂可包括附接于多个结合组分的保留组分。可以选择附接于所述保留组分的所述多个结合组分以增加所述可检测探针或亲和试剂的亲合力。在一些配置中,可检测探针或亲和试剂可含有多个结合组分,它们在种类方面是同质的(例如,仅抗体、仅适体、仅纳米抗体、仅微型肽结合剂、仅DARPin等)。在其他配置中,可检测探针或亲和试剂可含有多个结合组分,它们在种类方面是异质的(例如,抗体、纳米抗体、微型蛋白结合剂、DARPin和/或适体的混合物)。在一些配置中,可检测探针或亲和试剂可含有多个结合组分,它们对特定的结合配偶体、表位或靶部分具有基本上相同的结合特异性。在其他配置中,可检测探针或亲和试剂可含有多个结合组分,它们对特定的结合配偶体、表位或靶部分具有混合的结合特异性。
可以选择附接于可检测探针或亲和试剂的结合组分的量和/或种类以增加可检测探针或亲和试剂的亲合力。可检测探针或亲和试剂可具有总共至少约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、55、60、65、70、75、80、85、90、95、100个或更多,无论彼此不同(例如结合组分的异质混合物)还是相同(例如结合组分的同质组)。可替代地或另外地,可检测探针或亲和试剂可具有总共不大于约100、95、90、85、80、75、70、65、60、55、50、49、48、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3个或更少,无论彼此不同还是相同。
可检测探针或亲和试剂可包括结合组分以选定比率的异质混合物,异质性是基于结合组分种类和/或结合特异性。例如,特定表位的可检测探针或亲和试剂可包括以摩尔计约3:1比率的高特异性结合组分和中等特异性结合组分。可检测探针或亲和试剂可包括第一结合组分和不同的第二结合组分,两者的比率为至少约1:1、1.5:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、25:1、50:1、100:1、250:1、500:1、1000:1、2500:1、5000:1、10000:1、25000:1、50000:1、100000:1、250000:1、500000:1、1000000:1或更大。可替代地或另外地,可检测探针或亲和试剂可包括第一结合组分和不同的第二结合组分,两者的比率不大于约1000000:1、500000:1、250000:1、100000:1、50000:1、25000:1、10000:1、5000:1、2500:1、1000:1、500:1、250:1、100:1、50:1、25:1、10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1.5:1或更小。
对于结合配偶体、表位或靶部分,本公开的亲和试剂、探针或结合组分可具有特征化结合概率。例如,已知亲和试剂、探针或结合组分可与某一多肽表位结合,并且已知可显示出高结合概率(例如,每100次观察中有1次未能显示出结合的证据)。在另一个实例中,亲和试剂、探针或结合组分可以被表征为以低但非零的结合概率(例如,对于给定的观察,结合的机会为0.00001%)与某一表位结合。概率表征可包括关于结合概率的两个方面:1)与结合配偶体、表位或靶部分结合的结构依赖性可能性;和2)与结合配偶体、表位或靶部分结合的环境依赖性可能性。
亲和试剂、探针或结合组分对结合配偶体、表位或靶部分的结合概率可扩展到多肽以外,以包括非多肽或异质系统(例如,粪便、粗细胞裂解物、体液)。例如,亲和试剂、探针或结合组分可对复合物的组分(例如,嵌入聚合物基质中的金属纳米颗粒)具有特征化结合概率,或者可优先与多糖内的结构亚基(例如,糖基化、半纤维素、纤维素、木质素、果胶等)结合。技术人员根据本公开将会认识到,旨在用于非多肽或异质系统的亲和试剂、探针或结合组分可显示出具有与非多肽结合配偶体、表位或靶部分的非零结合概率的类似特性,对于所述非多肽结合配偶体、表位或靶部分,所述亲和试剂、探针或结合组分具有低结合亲和力。
亲和试剂、探针或结合组分的结合亲和力或结合混杂性可能与多肽一级、二级、三级或四级结构(即氨基酸序列)对结合的影响有关。例如,亲和试剂、探针或结合组分可以被表征为以对特定的多肽表位序列(例如,氨基酸三聚体、四聚体、五聚体等)增加或减少的优先性结合。亲和试剂、探针或结合组分与表位结合的结构依赖性可能性也可能受序列背景的影响(例如,侧接肽表位的氨基末端和/或羰基末端的氨基酸;多肽的二级或三级结构中接近肽表位的氨基酸残基,肽表位中或肽表位周围是否存在翻译后修饰等)。本公开的亲和试剂、探针或结合组分可以对氨基酸表位家族(例如AXA,其中A代表丙氨酸,且X代表20种天然存在的氨基酸中的任一种)具有显著的亲和力或混杂性。可针对用于多肽表征的每一亲和试剂、探针或结合组分计算结合的结构依赖性可能性,如通过经验结合模型或结合概率的数据库。亲和试剂、探针或结合组分与结合配偶体、表位或靶部分结合的序列特异性可能性可以为至少约0.000001%、0.00001%、0.0001%、0.001%、0.01%、0.1%、0.5%、1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.5%、99.9%、99.99%、99.999%、99.9999%、99.99999%、99.999999%或更大。可替代地或另外地,亲和试剂、探针或结合组分与结合配偶体、表位或靶部分结合的序列特异性可能性可不大于约99.999999%、99.99999%、99.9999%、99.999%、99.99%、99.9%、99.5%、99%、98%、97%、96%、95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、4%、3%、2%、1%、0.5%、0.1%、0.01%、0.001%、0.0001%、0.00001%、0.000001%或更小。
亲和试剂、探针或结合组分与多肽中的表位结合的环境依赖性可能性可能与所述表位和/或所述多肽的结构以外的变量对结合的影响有关。例如,亲和试剂、探针或结合组分与特定表位的结合可根据溶剂化学组成(例如,溶剂特质、溶剂极性、溶剂的离子强度、缓冲液浓度、pH、表面活性剂或变性剂的存在等)而变化。其他非多肽变量可包括结合的持续时间;亲和试剂、探针或结合组分的浓度;结合配偶体、表位或靶部分的浓度;以及外部施加的场的存在,如热、电场、磁场和流体速度场。亲和试剂、探针或结合组分与结合配偶体、表位或靶部分结合的环境依赖性可能性可以为至少约0.000001%、0.00001%、0.0001%、0.001%、0.01%、0.1%、0.5%、1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.5%、99.9%、99.99%、99.999%、99.9999%、99.99999%、99.999999%或更大。可替代地或另外地,亲和试剂、探针或结合组分与结合配偶体、表位或靶部分结合的环境依赖性可能性可不大于约99.999999%、99.99999%、99.9999%、99.999%、99.99%、99.9%、99.5%、99%、98%、97%、96%、95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、4%、3%、2%、1%、0.5%、0.1%、0.01%、0.001%、0.0001%、0.00001%、0.000001%或更小。
在一些配置中,可以将结构依赖性结合可能性和环境依赖性结合可能性组合以确定亲和试剂、探针或结合组分与结合配偶体、表位或靶部分结合的总可能性或概率。可以汇集一些或所有已知的结合配偶体、表位或靶部分的总可能性或概率,以创建亲和试剂、探针或结合组分的概率结合概况。在一些配置中,亲和剂、探针或结合组分可以被表征为以至少约20%的总结合概率与一组N个结合配偶体、表位或靶部分结合,并且以不大于0.1%的总结合概率与一组M个结合配偶体、表位或靶部分结合,其中N≥1,M≥1,且M≥10N。亲和试剂、探针或结合组分与结合配偶体、表位或靶部分结合的总可能性或概率可以为至少约0.000001%、0.00001%、0.0001%、0.001%、0.01%、0.1%、0.5%、1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.5%、99.9%、99.99%、99.999%、99.9999%、99.99999%、99.999999%或更大。可替代地或另外地,亲和试剂、探针或结合组分与结合配偶体、表位或靶部分结合的总可能性或概率可不大于约99.999999%、99.99999%、99.9999%、99.999%、99.99%、99.9%、99.5%、99%、98%、97%、96%、95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、4%、3%、2%、1%、0.5%、0.1%、0.01%、0.001%、0.0001%、0.00001%、0.000001%或更小。
保留组分可包括与所述保留组分缔合的一个或多个标记组分。在一些配置中,所述一个或多个标记组分可附接于所述可检测探针或亲和试剂的保留组分。在一些配置中,所述一个或多个标记组分可以与所述可检测探针(例如,核酸嵌入染料)或亲和试剂非共价缔合。在一些配置中,保留组分可围绕或包围标记组分(例如,FluoSphere
保留组分可包括为其他组分(例如结合组分、标记组分或另一保留组分)提供一个或多个附接位点的颗粒(例如微颗粒或纳米颗粒)。在一些配置中,颗粒可包括被官能化、可以被官能化或者可以以其他方式修饰以为其他组分提供附接位点的表面。在一些配置中,颗粒可以为壳或包衣(例如,聚合物或水凝胶包衣)提供模板,其含有或可以被修饰以含有用于组分的附接位点。在一些配置中,保留组分可有效地充当标记组分(例如,FluoSphere
多个可检测部分中的任一者可用作本文所述的亲和试剂或可检测探针的标记组分。例如,在一些情况下,所述标记可以是电化学标记,并且可通过电化学检测来进行检测。这些可以是带电部分,例如大核酸、聚赖氨酸及其他高带电化学结构,并且检测区可以是ChemFET型传感器。可替代地或另外地,在一些情况下,可检测部分可以是可光学检测的部分,即可基于观察来自所述标记的差别光能量来检测。
可检测探针可包括附接于一个或多个标记组分的一个或多个保留组分。可以选择附接于所述保留组分的所述一个或多个标记组分以增加所述可检测探针的可观察性。在一些配置中,可检测探针可含有多个标记组分,它们在标记的种类方面是同质的(例如,单一类型的荧光团、同质核酸条形码等)。在其他配置中,可检测探针可含有异质的多个标记组分种类(例如,具有不同发射波长的荧光团的混合物、荧光团和核酸条形码的混合物)。任选地,可检测探针可含有多个标记组分,它们产生重叠信号或当以本文阐述的方法或装置检测时不可区分的信号。例如,存在于可检测探针中的多个荧光团可以以共同的波长发射荧光,无论所述荧光团是在彼此相同的波长下激发还是在彼此不同的波长下激发。可替代地,可检测探针可含有多个标记组分,它们产生彼此不同的信号,例如当以本文阐述的方法或装置检测时可区分或区分的信号。
可检测标记或标记组分可产生允许确认亲和试剂(例如可检测探针)与结合配偶体、表位或靶部分之间的相互作用的可检测的信号。可检测标记或标记组分可以被配置为提供空间信息,如在空间分辨的位置提供可检测的信号。可检测标记或标记组分可以被配置为提供时间信息,如提供瞬逝或衰减的信号,任选在空间分辨的位置。可检测标记或标记组分可在激发源(例如辐射、热、化学底物)的存在下发射可检测的信号。可检测标记或标记组分可在没有激发源(例如,放射性标记或化学发光标记)的情况下发射可检测的信号。可检测标记或标记组分可含有编码的信号,如核酸或多肽条形码。
在一些配置中,标记组分可包括附接的酶、蛋白质或产生可检测的化学信号的酶的序列。示例性的酶可包括辣根过氧化物酶(HRP)或碱性磷酸酶。可以选择将底物分子转化为可检测的分子(例如,荧光化合物)或结合基质分子的酶或蛋白质,所述底物分子进而在酶或蛋白质中产生荧光或发光效应。例如,HRP可以将底物分子如ABTS、OPD、AmplexRed、DAB、AEC、
可由适于所选标记种类的信号检测源来检测可检测标记或标记组分。光学标记和光学检测器是特别有用的。可在本文中使用的光学检测装置及其组件的实例包括商业化用于核酸测序的那些,如由Illumina
可用于本文阐述的方法的其他检测技术包括例如可用于感知质量的质谱法;可用于感知与表面结合的表面等离子体共振;可用于感知标记吸收的能量的波长的吸光度;可用于感知由于标记的存在而引起的温度变化的量热法;可用于感知标记的电气特性的电导率或阻抗,或其他已知的分析技术。例如,带电标记可使用电子检测器进行检测,如用于检测质子或焦磷酸盐的chemFET检测器(参见例如美国专利申请公布第2009/0026082 A1;2009/0127589 A1;2010/0137143 A1;或2010/0282617 A1号,上述专利文献中的每一者通过引用整体并入本文,或在可商购自ThermoFisher,Waltham,Mass.的Ion Torrent
标记组分可包括发光的部分或分子(例如发光团或荧光团)。响应于被另一波长的光激发而发射一种波长的光的发光团作为可光学检测的标记是特别有用的,因为它们能够提供易于检测的光信号,并且它们能够适应多种不同的激发和发射光谱,为其部署和使用提供了很大的灵活性。
本文可以使用多种发光团中的任一种。在一些情况下,发光团可以是小分子。在一些情况下,发光团可以是蛋白质。发光团可包括在紫外光谱、可见光谱或红外光谱中发射的标记。在一些情况下,发光团可选自FITC、Alexa
具体的荧光标记或其他发光团可根据所需的用途选择,并且在一些情况下基于它们的吸收/发射光谱来选择,例如以优化多重检测。同样,在一些情况下,发光团可包括相互作用以提供有利的荧光特性的荧光染料对。例如,成对染料可充当Forster共振能量转移(FRET)对,其中所述对的一个成员(即“供体”)的激发导致激发或转移至另一个成员(即“受体”)的能量转移。然后所述受体以偏移单独由所述供体进行发射的波长发光。
在一些情况下,可光学检测的标记可包括其他类型的可检测部分。例如,在一些情况下,可包括发光颗粒(例如微颗粒或纳米颗粒)如半导体纳米颗粒、“量子点”或FluoSphere
发光团的特征可在于特征激发或吸收波长。激发源可包括调至发光团的特征激发或吸收波长的光源。发光团可吸收一定波长范围内的光,其中光的最大吸收出现在峰值波长处。发光团可在峰值激发处或附近被激发。在本文阐述的方法的特定配置中,发光团可以被光谱的紫外(UV)、可见光(VIS)或红外(IR)区中的辐射激发。VIS区中的激发可发生在光谱的红色、橙色、黄色、绿色、蓝色或紫色区中的一者或多者中。发光团的特征可在于特征发射波长。发光团可发射一定波长范围内的光,其中光的最大发射出现在峰值波长处。可以在峰值发射处或附近检测发光团。在本文阐述的方法的特定配置中,可以在光谱的紫外(UV)、可见光(VIS)或红外(IR)区中检测来自发光团的发射。VIS区中的检测可在光谱的红色、橙色、黄色、绿色、蓝色或紫色区中的一者或多者中进行。
多个标记组分在可检测探针中的存在可例如通过如下方式增加可检测探针的可观察性,1)增加检测的可能性;2)在标记丢失(例如,光漂白、化学损伤、标记切割等)的情况下提供冗余;和/或3)增加由可检测探针产生的信号强度。与可检测探针缔合的标记组分量可由多种因素决定,包括探针大小、所需标记间距、信号强度、测量长度、测量环境和标记大小。
可检测探针可具有选定数目的缔合标记组分。可检测探针可具有至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、55、60、65、70、75、80、85、90、95、100个或更多,无论彼此不同(例如,在本文阐述的方法或装置中产生可彼此区分的信号的标记的异质混合物)还是相同(例如,在本文阐述的方法或装置中产生不可区分的信号的标记的混合物)。可替代地或另外地,可检测探针可具有不大于约100、95、90、85、80、75、70、65、60、55、50、49、48、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3个或更少,无论彼此不同(例如,在本文阐述的方法或装置中产生可彼此区分的信号的标记的异质混合物)还是相同(例如,在本文阐述的方法或装置中产生不可区分的信号的标记的混合物)。
可检测探针上所选择的标记组分的种类或数量可提供超过背景信号的信号。例如,通过荧光检测的探针可产生超过来自诸如自发荧光、信号串扰和撞击外部源的源的现有背景的荧光信号。可检测探针可包括多个或一定量的标记组分,它们被配置为产生超过信号背景强度(例如,最大、最小或平均值)至少2x、5x、10x、25x、50x、100x或更多的可检测信号强度。另外或替代地,可检测探针可包括一定量的标记组分,它们被配置为产生超过信号背景强度(例如,最大、最小或平均值)不多于约100x、50x、25x、10x、5x、2x或更少的可检测信号强度。
可检测探针可包括多于一种类型和/或种类的标记组分。例如,可检测探针可包括至少一个发光团和至少一个核酸条形码序列。在另一个实例中,可检测探针可包括两个或更多个不同的发光团(例如,
基于标记类型和/或种类,可检测探针可包括标记组分的异质混合物。可检测探针可具有至少约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、55、60、65、70、75、80、85、90、95、100或更多个标记组分,无论彼此相同还是彼此不同。可替代地或另外地,可检测探针可具有不大于约100、95、90、85、80、75、70、65、60、55、50、49、48、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3个或更少的标记组分,无论彼此相同还是彼此不同。
基于可检测标记种类,可检测探针可包括选定比率的标记组分的异质混合物。例如,用于特定表位的可检测探针可分别包括摩尔比为约3:1的
图49A提供了可检测探针的示意图。每个可检测探针由两部分组成:标记的亲和探针(200)和模板(201)。如图所示,标记的亲和探针200包括结合组分200a、提供保留组分的退火区200b和酶促延伸的标记组分200c。模板201包括退火区200b的互补序列201a和用于200c的酶促延伸的模板201b。图49B显示了酶促延伸适体探针以形成标记组分的逐步展示。
在一些情况下,标记组分可包括或附接于保留组分(例如美国临时申请第63/112,607号中阐述的支架)。多个标记组分可沿着所述保留组分随机间隔设置,或者在一些情况下可沿着所述保留组分的长度以规则或半规则的间隔定位。在其他情况下,单个标记组分可例如在核酸的5’末端附接于保留组分,参见图50A。又在其他情况下,保留组分的核酸可以被设计为包括退火区,并且可以在所述退火区的端部具有单个标记组分(例如荧光团)。具有另外的单个荧光团的核酸的第二链可退火到此区域,参见图50B。
将要理解的是,本公开的亲和试剂不需要包括任何标记组分。因此,亲和试剂可以被配置为省略或没有本文阐述的一个或多个标记组分或标记组分种类。此外,本文阐述为具有一个或多个标记组分的示例性亲和试剂或可检测探针可以被重新配置为省略一个或多个例示的标记组分。还将要理解的是,本公开的亲和试剂或可检测探针可以被配置为省略或没有本文阐述的一个或多个结合组分或结合组分种类。
保留组分可形成可检测探针或亲和试剂的中心结构元件。在一些配置中,保留组分可以被结构化以提供对其他组分如结合组分、标记组分或其他保留组分的物理定位的限制或控制。例如,可检测探针或亲和试剂可包括结合组分,其附接在保留组分上充分间隔的位置处以防止结合组分之间的接触或交叉反应。在另一个实例中,可检测探针可包括发光团,其附接在保留组分上充分间隔的位置处以减少或防止相邻发光团之间的猝灭。在第三实例中,可检测探针可包括发光团,其附接在保留组分上间隔且定向的位置处以促进FRET。可以改造或合理设计保留组分以控制附接于其上的组分的位置和/或定位。可能影响保留组分的设计的因素包括:1)相邻组分之间可能的相互作用的性质;2)相邻组分之间的相互作用的可能性;3)相邻组分之间可能的相互作用的临界尺度(例如,距离、体积、时间);4)保留组分的物理特性(例如,形状、构象、大小、刚性等);5)附接的探针组分的物理特性(形状、构象、大小、流体动力学半径等);6)将组分与保留组分结合的任选接头的性质和特性;和7)可检测探针或亲和试剂与结合配偶体之间可能的相互作用的性质。
在一些配置中,可检测探针或亲和试剂可包括保留组分,所述保留组分包括一个或多个核酸。例如,形成保留组分的一个或多个核酸可采取核酸折纸结构、核酸纳米球结构或其他结构化核酸颗粒的形式。核酸保留组分可含有单个核酸链或多个核酸链,如多个寡核苷酸链。包括多个核酸链的保留组分可通过所述多个链之间的杂交形成,以形成具有超出天然螺旋结构的增加的结构复杂性的核酸结构。核酸可包括诸如DNA、RNA、PNA或其组合的核酸。核酸可包括非天然核苷酸,如发光修饰的核苷酸。核酸可在其结构内包括非核苷酸残基,如可光切割的接头(例如,基于硝基苄基、羰基或苄基的可光切割的接头)。包括核酸的保留组分可以被结构化成在某些条件下分解或去稳定。保留组分可以被分解或去稳定化,以例如促进可检测探针或亲和试剂移离结合配偶体。包括核酸的保留组分可包括可以被限制酶切割的多个限制位点,从而促进所述核酸保留组分的分解或去稳定化。包括核酸的保留组分可包括多个可光切割的、可化学切割的或以其他方式为反应性的键,从而促进所述保留组分的分解或去稳定化。
保留组分可包括核酸纳米球。所述纳米球可含有核酸的单链,其自身折叠形成压缩结构。任选地,所述纳米球可以被交联以将所述纳米球限制为相对压缩结构。示例性交联包括化学交联,如与所述单链的不同区域杂交的补骨脂素或寡核苷酸。核酸纳米球可通过环形模板的滚环扩增以产生多联体扩增产物来产生,其中所述多联体中的序列的每个单元具有与所述环形模板互补的序列。可掺入到核酸纳米球中的示例性序列元件包括提供关于所述纳米球的信息如其来源或使用历史的标签序列、与用作链内交联剂的寡核苷酸互补的序列、与附接于官能团或组分如结合组分或标记组分的寡核苷酸互补的序列等。美国专利第8,445,194号中阐述了示例性核酸纳米球及其制备和使用方法,该专利文献通过引用并入本文。
可通过诸如滚环扩增(RCA)或连接重复多联体单元的方法形成核酸纳米球。核酸纳米球可包括特定数目的重复多联体单元。核酸纳米球可包括至少约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、200、250、300、350、400、450、500、600、700、800、900、1000个或更多的多联体单元。可替代地或另外地,核酸纳米球可包括不大于约1000、900、800、700、600、500、450、400、350、300、250、200、190、180、170、160、150、140、130、120、110、100、95、90、85、80、75、70、65、60、55、50、45、40、35、30、25、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3个或更少的多联体单元。核酸纳米球中的多联体单元的核苷酸序列长度可以为至少约20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、200个或更多的核苷酸。可替代地或另外地,核酸纳米球中的多联体单元的核苷酸序列长度可以不大于约200、190、180、170、160、150、140、130、120、110、100、95、90、85、80、75、70、65、60、55、50、45、40、35、30、25、20个或更少的核苷酸。
保留组分可包括核酸折纸。因此,保留组分可包括一个或多个具有三级或四级结构的核酸,所述三级或四级结构如球体、笼、小管、盒、瓦片、块、树、锥体、轮、其组合以及任何其他可能的结构。Zhao等人,Nano Lett.11,2997-3002(2011)阐述了用DNA折纸形成的这类结构的实例,该文献通过引用并入本文。在一些配置中,核酸折纸可包括支架和多个订书钉,其中所述支架是单个连续的核酸链,且所述订书钉是被配置为与所述支架核酸完全或部分杂交的寡核苷酸。Rothemund Nature 440:297-302(2006)或美国专利第8,501,923或9,340,416号中阐述了使用连续支架链和若干订书钉链形成的核酸折纸结构的实例,上述文献中的每一者通过引用并入本文。包括一个或多个核酸的保留组分(例如见于折纸或纳米球结构中)可包括单链核酸区、双链核酸区或其组合。
在一些实施方案中,核酸折纸包括具有闭合核酸链的支架和与所述支架杂交的多个寡核苷酸。核酸支架可包括连续的核酸链,在没有互补寡核苷酸的情况下,其是环形的或连接的链(即,没有5’或3’末端)。在一些配置中,核酸支架源自天然来源,如病毒基因组或细菌质粒。在其他配置中,核酸支架可以是改造的、合理设计的或合成的。支架可包括一个或多个修饰的核苷酸。修饰的核苷酸可提供官能团或附接位点,用于在组装可检测探针或亲和试剂之前、期间或之后附接另外的组分(例如结合组分、标记组分或另一保留组分)。修饰的核苷酸可包括连接基团或官能团(例如,配置成进行点击反应的官能团)。在一些配置中,核酸支架可包括M13病毒基因组的单链。核酸支架的大小可根据所述保留组分的所需大小而变化。核酸支架可包括至少约1000、2000、3000、4000、5000、6000、7000、8000、9000、10000个或更多的核苷酸。可替代地或另外地,核酸支架可包括至多约10000、9000、8000、7000、6000、5000、4000、3000、2000、1000个或更少的核苷酸。
保留组分如核酸折纸可包括多个寡核苷酸(例如订书钉)。订书钉可包括配置为与核酸支架、其他订书钉或其组合杂交的寡核苷酸。订书钉可包括一个或多个修饰的核苷酸。订书钉可以被修改以包括另外的化学实体,如结合组分、标记组分、化学反应性基团(例如官能团或柄)或其他基团(例如,聚乙二醇(PEG)部分)。订书钉可包括线性或环形核酸。订书钉可包括单链核酸、双链核酸或其组合的区域。订书钉可以被配置为通过互补碱基对杂交或连接与其他核酸结合。订书钉可以被配置为充当互补核酸链的引物,并且引发订书钉可通过酶(例如,聚合酶,如模板导向聚合酶或非模板导向聚合酶,如末端转移酶)延伸以形成双链核酸的延长区。
订书钉可以是任意长度的,这取决于所述保留组分的设计。订书钉可通过软件包,诸如CADNANO、ATHENA或DAEDALUS设计。订书钉的长度可以为至少约10、25、50、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2500、3000、3500、4000、4500、5000个或更多的核苷酸。可替代地或另外地,订书钉的长度可不大于约5000、4500、4000、3500、3000、2500、2000、1900、1800、1700、1600、1500、1400、1300、1200、1100、1000、950、900、850、800、750、700、650、600、550、500、450、400、350、300、250、200、150、100、50、25、10个或更少的核苷酸。
订书钉可包括一个或多个修饰的核苷酸。修饰的核苷酸可提供用于附接另外的组分如结合组分或标记组分的附接位点。修饰的核苷酸可以在组装可检测探针或亲和试剂之前、期间或之后用作另外组分的附接位点。订书钉可包括至少约1、2、3、4、5、6、7、8、9、10、20、30、40、50、75、100个或更多修饰的核苷酸。可替代地或另外地,订书钉可包括不大于约100、75、50、40、30、20、10、9、8、7、6、5、4、3、2或1个修饰的核苷酸。
可以设计或修饰订书钉以实现可检测探针、亲和试剂或核酸折纸的所需稳定性。稳定性可能受单个寡核苷酸从组装的折纸上解离的影响。寡核苷酸的丢失可能具有各种去稳定效应,包括可检测探针或亲和试剂的功能丢失(例如,组分附接位点丢失、结合组分丢失、标记组分丢失等)或二级或三级结构的去稳定,从而促进其他寡核苷酸的进一步去稳定。核酸保留组分中的支架或订书钉可包括一个或多个修饰的核苷酸,其被配置为形成促进所述核酸保留组分的稳定性的共价或非共价键。例如,寡核苷酸可包括一个或多个修饰的核苷酸,其与其他寡核苷酸或支架链中的修饰核苷酸形成共价键或交联。可替代地或另外地,可以将寡核苷酸设计为具有最小杂交长度或最低解链温度以降低解离的可能性。
可检测探针或亲和试剂中的寡核苷酸可与另一寡核苷酸或支架链杂交,形成特定数目的碱基对。寡核苷酸可形成至少约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50个或更多连续或总碱基对的杂交区。可替代地或另外地,寡核苷酸可形成不大于约50、49、48、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5个或更少连续或总碱基对的杂交区。
可检测探针、亲和试剂或核酸折纸中的寡核苷酸可具有特征化解链温度。解链温度可以指核苷酸碱基对结合相互作用被中断、从而导致寡核苷酸解离的温度。核酸保留组分中的寡核苷酸可具有至少约50℃、51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃、66℃、67℃、68℃、69℃、70℃、71℃、72℃、73℃、74℃、75℃、76℃、77℃、78℃、79℃、80℃、81℃、82℃、83℃、84℃、85℃、86℃、87℃、88℃、89℃、90℃或更高的特征化解链温度。可替代地或另外地,核酸保留组分中的寡核苷酸可具有不大于约90℃、89℃、88℃、87℃、86℃、85℃、84℃、83℃、82℃、81℃、80℃、79℃、78℃、77℃、76℃、75℃、74℃、73℃、72℃、71℃、70℃、69℃、68℃、67℃、66℃、65℃、64℃、63℃、62℃、61℃、60℃、59℃、58℃、57℃、56℃、55℃、54℃、53℃、52℃、51℃、50℃或更低的特征化解链温度。
可检测探针或亲和试剂可包括保留组分,其被配置为将多个结合组分定位在所述保留组分上的特定位置。相对定位可部分地由相邻结合组分之间的正或负相互作用的可能性来确定。例如,一些相邻的结合组分(例如,适体、肽适体)在与特定种类的结合组分极为接近时可能容易发生错误折叠或构象变化。这类结合组分可受益于充分的分隔,以使这类负相互作用的可能性最小化。在另一个实例中,当多个结合组分极为接近时,一些结合组分可经历亲合力的增加。在一些配置中,结合组分在保留组分上的特定位置的定位可通过优化正亲合力效应与负亲和试剂间相互作用之间的平衡来确定。
结合组分在可检测探针或亲和试剂上的定位可完全或部分地通过保留组分的结构特性来确定。在一些配置中,保留组分可包括固有刚性、非弹性或不可变形的材料(例如,碳或金属纳米颗粒),其在用于特定组合物或方法时不易变形,例如在溶液中或在固体支持物上。在其他配置中,保留组分可包括柔性或可变形材料(例如,聚合物、核酸等),其易于发生一定程度的变形,如拉伸、压缩或弯曲(例如,扭转或侧向弯曲)。保留组分的自然变形可产生增加或减少附接于所述保留组分的相邻结合组分的相对接近度的构象变化。
结合组分可定位在保留组分上,相对于其他结合组分充分分隔,使得亲和试剂不具有重叠的有效占据体积。图3A描绘了附接于保留组分300的第一结合组分310和第二结合组分320的示意图。第一结合组分310具有有效占据体积315,且第二结合组分320具有有效占据体积325。第一结合组分310和第二结合组分320以分隔距离Δs附接于保留组分300,该分隔距离是确保有效占据体积315和325不重叠所需的最小距离。
在一些配置中,结合组分可定位在保留组分上,相对于其他结合组分充分分隔,使得结合组分具有分隔间隙。图3B描绘了以分隔间隙Δs附接于保留组分300的第一结合组分310和第二结合组分320的示意图。第一结合组分310具有有效占据体积315,且第二结合组分320具有有效占据体积325。第一结合组分310和第二结合组分320以分隔距离Δs附接于保留组分300,该分隔距离是确保有效占据体积315和325具有长度Δg的分隔间隙所需的最小距离。
在一些配置中,结合组分可以以相对于其他结合组分分隔的方式定位在保留组分上,使得结合组分具有重叠的有效占据体积。图3C描绘了附接于保留组分300的第一结合组分310和第二结合组分320的示意图。第一结合组分310具有有效占据体积315,且第二结合组分320具有有效占据体积325。第一结合组分310和第二结合组分320以导致有效占据体积315和325重叠的分隔距离Δs附接于保留组分300,从而产生重叠体积ΔV。
结合组分在可检测探针或亲和试剂上的定位可完全或部分地通过将结合组分连接于保留组分的任选接头的结构特性来确定。接头可用于各种目的,如提供保留组分与结合组分之间的分隔、定位结合组分、为其他化学实体提供附接位点、使不需要的保留组分-结合组分相互作用的可能性最小化或在保留组分与结合组分之间产生所需的化学特性(例如,疏水性)。接头可包括刚性的或构象受限制的化学基团(例如,烯烃、炔烃、环状化合物)。接头可包括柔性的、动态的或可移动的化学基团(例如,聚乙二醇(PEG)、聚环氧乙烷(PEO)或烷烃链)。接头可包括多核苷酸,所述多核苷酸不被配置为与其存在的方法或装置中存在的其他核酸结合。包括核酸(例如,RNA、DNA、PNA)的接头可包括与其自身形成二级结构的区域(例如,发夹、茎和/或环结构)的多核苷酸。接头可以为附接于保留组分的结合组分的移动提供另外的自由度。
图4A-4D描绘了控制结合组分在通过接头附接于保留组分时可能占据的体积的示例性方法。图4A描绘了分别通过接头420和422附接于基本上平坦的保留组分表面400的第一结合组分410和第二结合组分412的示意图。第一结合组分410和第二结合组分412分别具有静态有效占据体积415和417(其中所述静态有效占据体积是在没有由所述接头引起的移动的情况下由所述结合组分占据的最大体积)。接头420和422为第一结合组分410和第二结合组分412移动提供另外的自由度,从而分别产生动态有效占据体积425和427。第一结合组分410和第二结合组分412通过接头420和422附接在平坦的保留组分表面400上由距离Δs
图4C描绘了通过改变保留组分的构象使结合组分相互作用最小化的示意图。图4C描绘了分别通过接头420和422附接于非平坦保留组分表面450的第一结合组分410和第二结合组分412的示意图。第一结合组分410和第二结合组分412分别具有静态有效占据体积415和417(其中所述静态有效占据体积是在没有由所述接头引起的移动的情况下由所述结合组分占据的最大体积)。接头420和422为第一结合组分410和第二结合组分412移动提供另外的自由度,从而分别产生动态有效占据体积425和427。第一结合组分410和第二结合组分412通过接头420和422附接于非平坦保留组分表面450上由距离Δs
图5A和5B展示了用于控制标记组分在包括核酸的保留组分上的相对位置和/或取向的替代配置。图5A显示了通过连续支架链510与较短的订书钉寡核苷酸(例如,寡核苷酸520和522)之间的杂交形成的螺旋核酸的短区域。寡核苷酸偶尔被短链断裂525中断。订书钉寡核苷酸520和522分别进一步包括荧光团530和532。由于寡核苷酸520和522上附接荧光团530和532的位置原因,荧光团530和532以分隔距离Δs
本公开的可检测探针或亲和试剂可以被配置成为展示结合组分和/或标记组分提供高度可调的平台。可检测探针或亲和试剂的可调性可表现为定制和/或优化探针的亲合力和/或所产生的可检测信号的强度的能力。可调性可源于可定制的保留组分,这些组分可在所述探针上的特定位置处附接于一个或多个结合组分和/或附接于一个或多个标记组分。
本公开的可检测探针或亲和试剂可以被表征为具有显著增加的亲合力。不希望受理论束缚,可检测探针或亲和试剂增加的亲合力可源于多个结合组分的存在,它们共同地增加可检测探针或亲和试剂与结合配偶体的结合率(例如,如通过增加的解离速率常数k
可检测探针或亲和试剂的可调性质可部分地源于定制将结合组分附接于探针的保留组分的能力。若干因素可影响亲合效应的强度,包括:1)结合组分的总数;2)结合组分的位置和/或取向;3)结合组分的面积密度或体积密度;4)多个结合组分的亲和力;5)保留组分的结构;和6)可检测探针或亲和试剂的总体大小。此外,所描述的探针结构的设计灵活性允许包含可增加亲合力的另外的组分,如可以与其他相邻实体弱相互作用以暂时将所述可检测探针或亲和试剂定位在结合配偶体附近的悬垂尾。
可检测探针或亲和试剂的亲合力和/或可观察性可通过利用其中的保留组分的设计灵活性来调整。可以选择保留组分,如果其提供:1)提供用于结合组分展示的广泛潜在位置和取向的三维结构;和2)以高特异性将结合组分在所需位置附接于三维结构的能力。特别受关注的是包括核酸的保留组分,其利用核酸杂交的特异性产生具有用于结合组分(和标记组分)的精确定位的结合位置的复杂三维结构。
在一些配置中,可利用核酸结构(例如,DNA纳米球或核酸折纸)作为保留组分。核酸结构可具有对向保留组分添加的组分的位置和取向提供高度的空间控制的优点。核酸结构通常可在螺旋结构的每一圈具有约10至11个碱基对,这意味着双链核酸内的每个独特的物理位置都具有相关的取向角。核酸的这种特性通过提供丰富的位置和取向变化来定制探针组分如结合组分和/或标记组分之间的分隔量而有利于基于核酸的保留组分结构的可调性。
在其他配置中,通过合理控制或修饰保留组分结构和/或化学性质,保留组分可具有受控的探针组分的空间和/或取向控制。可以操纵或修饰非核酸保留组分以产生具有受控或变化的探针组分位置和/或取向的保留组分。在一些情况下,可以通过非核酸颗粒、纳米颗粒或主体的形状或构象来控制探针组分的位置或取向。例如,壳状结构或板状结构可提供具有变化特性的多个表面,其允许结合组分相对于标记组分有不同位置。此外,非核酸保留组分可设置有包衣或以空间受控的方式形成为复合物,从而允许增加对附接位置和取向的控制。
图6A-6F描绘了可检测探针组合物的各种简化配置,以展示由三维保留组分结构(例如,DNA折纸、碳纳米颗粒、硅纳米颗粒等)产生的排列的灵活性。图6A描绘了矩形或瓦片形状的可检测探针的俯视图。所述探针含有保留组分610,其具有宽度和高度以及深度(未示出),形成了顶面(示出)加上侧部和底面(未示出)。多个结合组分620附接于保留组分610,所述结合组分位于沿所述保留组分的侧部的特定位置。标记组分630位于所述可检测探针的顶面(和任选底面)上的特定位置。图6B描绘了矩形或瓦片形状的探针的俯视图,其具有与图6A中所示的探针反向的附接方案。所述探针含有保留组分610,其具有宽度和高度以及深度(未示出),形成了顶面(示出)加上侧部和底面(未示出)。多个结合组分620在所述可检测探针的顶面(和任选底面)上的特定位置处附接于保留组分610。标记组分630位于沿所述保留组分的侧部的特定位置。图6A中描绘的探针配置对于需要强检测信号或分布在较大面积或体积上的检测信号的系统可能是优选的,因为用于在大面积顶面上标记的位置增加。图6B中描绘的探针配置对于增加可检测探针或亲和试剂的探针亲合力可能是优选的,因为可能增加大面积顶表面上的结合组分的密度。
图6C和6D描绘了矩形或瓦片形状的可检测探针的侧视配置,展示了探针组分相对于所述探针的较薄深度尺寸的取向。图6C显示了含有保留组分610的可检测探针,所述保留组分具有宽度和高度(未示出)以及深度,形成了侧部及顶面和底面(未示出)。多个结合组分620附接于保留组分610,所述结合组分在所述可检测探针的顶面上的特定位置附接。标记组分630位于所述可检测探针的底面上的特定位置处。图6D显示了含有保留组分610的可检测探针,所述保留组分具有宽度和高度(未示出)以及深度,形成了侧部及顶面和底面(未示出)。多个结合组分620和标记组分630附接于保留组分610,所述结合组分在所述可检测探针的顶面和底面上的特定位置附接。图6C中的探针配置对于荧光检测系统可能是有利的,因为大探针可屏蔽一些或所有结合配偶体,使其不与标记组分相互作用,从而可能减少或减轻所述结合配偶体或其直接环境对所述标记的任何猝灭。图6D中的探针配置可通过增大可检测探针与结合配偶体接触的可能性而有利于使对于可检测探针或亲和试剂存在的结合组分的量最大化。
图6E和6F描绘了替代的保留组分几何形状。图6E描绘了包括圆形或球形配置的可检测探针。所述探针含有保留组分610,其任选包括提供用于附接探针组分的另外位置的内部结构。多个结合组分620附接于保留组分610的外周或表面。保留组分610的内部区域含有多个标记组分630。图6E中所示的配置由于结合组分620在保留组分610上的高覆盖率而可以增大探针定位结合配偶体的可能性,并且由于可能将多个标记组分630集中在保留组分610的内部空间中而可以进一步提供高可检测的信号。图6F描绘了具有以一个或多个面上的角度偏移为特征的保留组分610的探针的侧视图或截面视图。保留组分610的一侧含有附接的结合组分620。保留组分610的相反侧含有附接的标记组分630。图6F中所示的配置可有利于增加亲合力,因为附接于保留组分610的底面的结合组分620的体积密度增加。更复杂的形状可增加结合组分620与结合配偶体的接触,并增加探针远离结合配偶体扩散的阻力。本领域技术人员将认识到,考虑到保留组分的许多可能的设计,图6A-6F中描述的几何形状可存在难以计数的变型。
保留组分可包括主要不是由核酸组成的主体(例如颗粒、纳米颗粒或微颗粒)。可以利用作为制成或合成的主体如硅或二氧化硅纳米颗粒、碳纳米颗粒、纤维素纳米珠、PEG纳米珠、聚合物纳米颗粒(例如,聚丙烯酸酯颗粒、基于聚苯乙烯的颗粒、FluoSpheres
图31A-31D示出了用于由颗粒或纳米颗粒形成保留组分的各种配置。图31A描绘了具有用多个附接位点3120直接官能化的表面的实心球形颗粒3110。所述附接位点可以被配置为与可检测探针组分如结合组分和/或标记组分形成共价或非共价附接。图31B描绘了包括异质的多个第一附接位点3120和第二附接位点3125的实心球形颗粒3110。在一些配置中,可以有相等数目的第一附接位点3120和第二附接位点3125。在其他配置中,可以有不同数目的第一附接位点3120和第二附接位点3125。第一附接位点3120和/或第二附接位点3125可以被配置为与可检测探针组分如结合组分和/或标记组分形成共价或非共价附接。图31A和31B的实心球形颗粒可以很容易地用中空颗粒代替。中空颗粒可以在内表面上设置有附接位点3120或3125。在一些配置中,中空颗粒可包括外表面上的第一多个附接位点3120和内表面上的第二多个附接位点3125,以允许将可检测探针组分隔离到不同表面上。
图31C和31D示出由包括表面包衣、壳或层(例如,聚合物、水凝胶包衣或单层官能团)的实心球形颗粒形成的保留组分。图31C显示了包括表面包衣或层3130的实心球形颗粒3110。包衣或层3130设置有多个附接位点3120。所述附接位点可以被配置为与可检测探针组分如结合组分和/或标记组分形成共价或非共价附接。图31D显示了包括表面包衣3130的球形可检测颗粒3115(例如,FluoSphere
图34A-34C示出具有空间受控或隔离的探针组分的非核酸保留组分的各种配置。图34A显示了具有空间隔离的结合组分3420和标记组分3430的球形颗粒、纳米颗粒或主体3410。图34B显示了中空或壳状颗粒或主体3412,其利用所述颗粒或主体3412的中空内部区域来将标记组分3430与外部附接的结合组分3420隔离。图34C显示了具有两个不同表面的板状颗粒或主体3414,所述两个不同表面具有大约180°角度偏移。上表面可用于附接多个标记组分3430,而底表面可用于附接多个结合组分3420。
两个结合组分可以以这样的方式附接于保留组分,使得它们就其相对位置而言具有角度偏移。例如,附接于保留组分的平坦面的两个结合组分将具有约0度(°)的角度偏移。在另一个实例中,附接于立方体状保留组分的相反侧的两个结合组分将具有约180°的角度偏移。可以利用角度偏移来限制相邻结合组分之间的接触或其他相互作用。两个结合组分可具有至少约0°、5°、10°、15°、20°、25°、30°、35°、40°、45°、50°、55°、60°、65°、70°、75°、80°、85°、90°、95°、100°、105°、110°、115°、120°、125°、130°、135°、140°、145°、150°、155°、160°、165°、170°、175°或更大的相对角度偏移。可替代地或另外地,两个结合组分可具有不大于约180°、175°、170°、165°、160°、155°、150°、145°、140°、135°、130°、125°、120°、115°、110°、105°、100°、95°、90°、85°、80°、75°、70°、65°、60°、55°、50°、45°、40°、35°、30°、25°、20°、15°、10°、5°或更小的相对角度偏移。
可以进一步修饰可检测探针或亲和试剂以增加所述探针的总亲合力。图7A和7B描绘了使用接头来增加展示结合组分的空间自由度。图7A描绘了包括具有多个附接的结合组分720和多个标记组分730的保留组分710的可检测探针。多个结合组分720的亚组通过接头740(例如,PEG、PEO、烷烃链等)附接于保留组分710,所述接头允许结合组分720的亚组远离保留组分710延伸。图7B描绘了与图7A类似的探针配置,然而所述探针包括两个不同种类的结合组分。所述探针含有具有多个附接的标记组分730的保留组分710。所述探针进一步包括通过接头740附接于保留组分710的第一多个附接的结合组分720(例如,抗体或抗体片段)和第二多个附接的结合组分722(例如,适体)。接头可有利于通过促进每单位时间在较大的体积区域上增加对结合配偶体、表位或靶部分的感测来增加探针亲合力。此外,接头可提供灵活性或组分的分隔,这可加速探针与结合配偶体、表位或靶部分的结合,并减慢探针可能远离所述结合配偶体、表位或靶部分的扩散。
可以配置可检测探针或亲和试剂的大小以适合预期的使用模式。使用模式(例如,多肽表征、非多肽表征、治疗学、诊断学)可指示可检测探针或亲和试剂的亲合力和/或可观察性水平。可以充分地调整可检测探针或亲和试剂的大小以允许附接足够数目的结合组分和/或标记组分用于预期的使用模式。在一些配置中,可检测探针或亲和试剂的大小可指保留组分的近似长度、面积或体积。附接于保留组分的组分(例如,结合组分、标记组分、接头、阻断基团)可具有增加的空间自由度,这使得更加难以表征它们的长度、面积大小或体积大小。保留组分可以被配置为大小更规则或变化更小,使得所述保留组分的大小成为可检测探针或亲和试剂大小的可行代表。
可检测探针、亲和试剂或其保留组分可具有特征长度。对于宽度、高度、半径、直径、周长或其他尺寸,特征长度可包括最大、平均或最小长度。可检测探针、亲和试剂或其保留组分可具有至少约5nm、10nm、15nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm、75nm、80nm、85nm、90nm、95nm、100nm、120nm、140nm、160nm、180nm、200nm、250nm、300nm、350nm、400nm、450nm、500nm、600nm、700nm、800nm、900nm、1000nm或更大的特征长度。可替代地或另外地,可检测探针、亲和试剂或其保留组分可具有不大于约1000nm、900nm、800nm、700nm、600nm、500nm、450nm、400nm、350nm、300nm、250nm、200nm、180nm、160nm、140nm、120nm、100nm、95nm、90nm、85nm、80nm、75nm、70nm、65nm、60nm、55nm、50nm、45nm、40nm、35nm、30nm、25nm、20nm、15nm、10nm、5nm或更小的特征长度。
可检测探针、亲和试剂或其保留组分可具有特征印迹(例如表面上占据的区域)。印迹可构成可检测探针、亲和试剂或其保留组分的二维投影将在平面表面上产生的区域。二维投影可具有规则形状或近似规则形状,如三角形、正方形、矩形、圆形、五边形、六边形、八边形或椭圆形。图2A-2B展示具有近似形状的保留组分210或215的2维投影的实例,其中理想形状显示为虚线(分别为220和225)。可检测探针、亲和试剂或其保留组分可具有至少约25nm
保留组分可以被配置为具有以所需或最佳间距附接的其他组分(例如结合组分、标记组分或其他保留组分)。结合组分的间距可基于最小间距以减少或消除不需要的或不利的相互作用(例如,适体错误折叠;荧光团自猝灭)。结合组分的间距可基于最大间距以获得所需特征,诸如亲合力或可检测的信号强度。对于通过接头或其他灵活的附接方法与保留组分连接的组分(即,具有另外的移动自由度的组分),附接组分的间距可以被测量为所述保留组分上的附接位点之间的间距。两个相邻的附接组分(例如,结合组分、标记组分、阻断基团)可具有至少约0.1nm、0.2nm、0.3nm、0.4nm、0.5nm、0.6nm、0.7nm、0.8nm、0.9nm、1.0nm、1.1nm、1.2nm、1.3nm、1.4nm、1.5nm、1.6nm、1.7nm、1.8nm、1.9nm、2nm、3nm、4nm、5nm、6nm、7nm、8nm、9nm、10nm、11nm、12nm、13nm、14nm、15nm、16nm、17nm、18nm、19nm、20nm、21nm、22nm、23nm、24nm、25nm、26nm、27nm、28nm、29nm、30nm、35nm、40nm或更大的特征间距。可替代地或另外地,两个相邻的附接组分可具有不大于约40nm、35nm、30nm、29nm、28nm、27nm、26nm、25nm、24nm、23nm、22nm、21nm、20nm、19nm、18nm、17nm、16nm、15nm、14nm、13nm、12nm、11nm、10nm、9nm、8nm、7nm、6nm、5nm、4nm、3nm、2nm、1.9nm、1.8nm、1.7nm、1.6nm、1.5nm、1.4nm、1.3nm、1.2nm、1.1nm、1.0nm、0.9nm、0.8nm、0.7nm、0.6nm、0.5nm、0.4nm、0.3nm、0.2nm、0.1nm或更小的特征间距。
可检测探针或亲和试剂可包括多个附接于保留组分的表面或面的结合组分。可以配置展示在可检测探针或亲和试剂的表面上的结合组分的数目以增加亲合力或充分间隔结合组分,从而避免不需要的相互作用。可检测探针或亲和试剂的表面上的结合组分的数目可以被表征为平均数密度(每个表面的数目)或面密度(单位面积的数目)。可检测探针或亲和试剂的两个不同表面或面可具有不同的结合组分的数密度或面密度。可检测探针或亲和试剂的平均结合组分数密度可以为每个表面至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50个或更多。可替代地或另外地,可检测探针或亲和试剂的平均结合组分数密度可以不大于约50、49、48、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2个或更少。可检测探针或亲和试剂的平均结合组分面密度可以为至少约0.00001、0.0001、0.001、0.002、0.003、0.004、0.005、0.006、0.007、0.008、0.009、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1/nm
可检测探针或亲和试剂可包括多个附接于保留组分的表面或面的标记组分。可以优化展示在可检测探针或亲和试剂的表面上的标记组分的数目以增加可观察性或充分间隔标记组分,从而避免不需要的相互作用。可检测探针或亲和试剂的表面上的标记组分的数目可以被表征为平均数密度(每个表面的数目)或面密度(单位面积的数目)。可检测探针或亲和试剂的两个不同表面或面可具有不同的标记组分的数密度或面密度。可检测探针或亲和试剂的平均标记组分数密度可以为每个表面至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50个或更多。可替代地或另外地,可检测探针或亲和试剂的平均标记组分数密度可以不大于每个表面约50、49、48、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2个或少于2个。可检测探针或亲和试剂的平均标记组分面密度可以为至少约0.00001、0.0001、0.001、0.002、0.003、0.004、0.005、0.006、0.007、0.008、0.009、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1/nm
可检测探针或亲和试剂可包括结合组分的异质混合物。结合组分的异质混合物可包括不同类型和/或种类的结合组分的混合物。例如,可检测探针或亲和试剂可包括对结合配偶体具有不同亲和力的抗体的混合物。在另一个实例中,可检测探针或亲和试剂可包括对同一结合配偶体具有亲和力的抗体和适体的混合物。在另一个实例中,可检测探针或亲和试剂可包括对同一结合配偶体具有亲和力的抗体和抗体片段的混合物。结合组分的异质混合物可有利于控制可检测探针或亲和试剂的亲合力。具有不同结合亲和力的结合组分的混合物可促进优化可检测探针或亲和试剂相对于特定结合配偶体、表位或靶部分结合的结合率和/或结合的解离率。
在一些配置中,可检测探针或亲和试剂可包括多个对结合配偶体、表位或靶部分具有亲和力的第一结合组分以及第二多个竞争结合组分。竞争结合组分可以被表征为具有降低的亲和力(例如,具有增加的结合混杂性,例如结合多个不同的结合配偶体、表位或靶部分)与增加的解离速率(例如,与许多靶标结合但容易自所述靶标解离的结合组分)。不希望受理论束缚,竞争结合组分可以被确认为这样的结合组分,其被另一结合组分置换在能量和/或熵方面是有利的。例如,多个小的低亲和力适体或微型肽结合物可以很容易被大的高亲和力抗体置换,从而由于置换多个结合组分的熵增加而有利于抗体结合。竞争结合组分可通过与靶部分形成短暂的弱相互作用来进一步增加可检测探针或亲和试剂的亲合力,第一多个结合组分对所述靶部分缺乏亲和力。这类短暂的弱相互作用可促进可检测探针或亲和试剂与结合配偶体、表位或靶部分之间缔合的持续时间增加。
可检测探针或亲和试剂在某些环境条件下可以是结构稳定的。特别受关注的是这样的可检测探针或亲和试剂,它们在旨在使结合的探针移离结合配偶体的条件下是结构稳定的。例如,可检测探针或亲和试剂在热或干扰分子间相互作用的化学组合物(例如表面活性剂或变性剂)的存在下可以是稳定的。结构稳定性可以指可检测探针或亲和试剂保持其完整的组成及任选其形状或构象,即没有结合组分、标记组分或其他组分的损失;没有组分的损失或降解(例如,核酸自DNA折纸保留组分的去杂交)。
可检测探针或亲和试剂在给定的温度下可以是结构稳定的。在利用可检测探针或亲和试剂的过程期间,温度可以发生变化。例如,结合、观察和移除可检测探针或亲和试剂的每个步骤可以在独特和/或最佳的温度下进行。此外,可检测探针或亲和试剂在给定的储存温度下可以是结构稳定的。可检测探针或亲和试剂在至少约-100℃、-90℃、-80℃、-70℃、-60℃、-50℃、-40℃、-30℃、-20℃、-10℃、-5℃、0℃、4℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、90℃或更高的温度下可以是结构稳定的。可替代地或另外地,可检测探针或亲和试剂在不大于约90℃、80℃、75℃、70℃、65℃、60℃、55℃、50℃、45℃、40℃、35℃、30℃、25℃、20℃、15℃、10℃、4℃、0℃、-10℃、-20℃、-30℃、-40℃、-50℃、-60℃、-70℃、-80℃、-90℃、100℃或更低的温度下可以是结构稳定的。
可检测探针或亲和试剂在特定溶液或溶剂的存在下可以是结构稳定的。可以使可检测探针或亲和试剂与一种或多种溶液或溶剂接触,这取决于所述可检测探针或亲和试剂的使用模式。溶液或溶剂可具有不同的组成,这取决于可检测探针或亲和试剂的使用模式。溶液或溶剂可用于诸如探针配制、探针储存、探针-配偶体结合、洗涤、漂洗、相互作用检测、探针-配偶体分隔、探针捕获(例如,利用后回收探针)和探针分析(例如,核酸条形码的处理后测序)的过程。溶液或溶剂可以被配制成维持可检测探针或亲和试剂结构的稳定性。可以根据化学组成、pH和离子强度配制溶液或溶剂,以确保可检测探针或亲和试剂的稳定性。包括核酸的可检测探针或亲和试剂可存在于包括镁盐的溶液或溶剂中以稳定所述核酸。
与可检测探针或亲和试剂接触的溶液或溶剂可包括在溶液或悬浮液中的一种或多种可检测探针或亲和试剂。可以将与可检测探针或亲和试剂接触的溶液或溶剂配制为均质液体介质。可以将与可检测探针或亲和试剂接触的溶液或溶剂配制为单相液体介质。可以将与可检测探针或亲和试剂接触的溶液或溶剂配制为多相液体介质,如水包油乳液或油包水乳液。
与可检测探针或亲和试剂接触的溶液或溶剂可包括溶剂物质、pH缓冲物质、阳离子物质、阴离子物质、表面活性剂物质、变性物质或其组合。溶剂物质可包括水、乙酸、甲醇、乙醇、正丙醇、异丙醇、正丁醇、甲酸、氨、碳酸亚丙酯、硝基甲烷、二甲基亚砜、乙腈、二甲基甲酰胺、丙酮、乙酸乙酯、四氢呋喃、二氯甲烷、氯仿、四氯化碳、二甲醚、二乙醚、1,4-二噁烷、甲苯、苯、环己烷、己烷、环戊烷、戊烷或其组合。溶剂或溶液可包括缓冲物质,包括但不限于MES、Tris、Bis-tris、Bis-tris丙烷、ADA、ACES、PIPES、MOPSO、MOPS、BES、TES、HEPES、HEPBS、HEPPSO、DIPSO、MOBS、TAPSO、TAPS、TABS、POPSO、TEA、EPPS、三甲基甘氨酸(Tricine)、Gly-Gly、二羟乙甘胺酸(Bicine)、AMPD、AMPSO、AMP、CHES、CAPSO、CAPS和CABS。溶剂或溶液可包括阳离子物质,如Na
pH缓冲物质可以以任何量配制在溶剂或溶液中。pH缓冲物质可以以至少约0.0001M、0.001M、0.01M、0.02M、0.03M、0.04M、0.05M、0.06M、0.07M、0.08M、0.09M、0.1M、0.2M、0.3M、0.4M、0.5M、0.6M、0.7M、0.8M、0.9M、1M、1.1M、1.2M、1.3M、1.4M、1.5M、1.6M、1.7M、1.8M、1.9M、2M、2.1M、2.2M、2.3M、2.4M、2.5M、2.6M、2.7M、2.8M、2.9M、3M、3.1M、3.2M、3.3M、3.4M、3.5M、3.6M、3.7M、3.8M、3.9M、4M、4.1M、4.2M、4.3M、4.4M、4.5M、4.6M、4.7M、4.8M、4.9M、5M、5.1M、5.2M、5.3M、5.4M、5.5M、5.6M、5.7M、5.8M、5.9M、6M、7M、8M、9M或更高的浓度存在于可检测探针或亲和试剂溶剂组合物中。可替代地或另外地,pH缓冲物质可以以不大于约10M、9M、8M、7M、6M、5.9M、5.8M、5.7M、5.6M、5.5M、5.4M、5.3M、5.2M、5.1M、5.0M、4.9M、4.8M、4.7M、4.6M、4.5M、4.4M、4.3M、4.2M、4.1M、4.0M、3.9M、3.8M、3.7M、3.6M、3.5M、3.4M、3.3M、3.2M、3.1M、3.0M、2.9M、2.8M、2.7M、2.6M、2.5M、2.4M、2.3M、2.2M、2.1M、2.0M、1.9M、1.8M、1.7M、1.6M、1.5M、1.4M、1.3M、1.2M、1.1M、1.0M、0.9M、0.8M、0.7M、0.6M、0.5M、0.4M、0.3M、0.2M、0.1M、0.09M、0.08M、0.07M、0.06M、0.05M、0.04M、0.03M、0.02M、0.01M、0.001M、0.001M或更低的浓度存在于溶剂或溶液中。
阳离子物质可以以任何量配制在溶剂或溶液中。阳离子物质可以以至少约0.0001M、0.001M、0.01M、0.02M、0.03M、0.04M、0.05M、0.06M、0.07M、0.08M、0.09M、0.1M、0.2M、0.3M、0.4M、0.5M、0.6M、0.7M、0.8M、0.9M、1M、1.1M、1.2M、1.3M、1.4M、1.5M、1.6M、1.7M、1.8M、1.9M、2M、2.1M、2.2M、2.3M、2.4M、2.5M、2.6M、2.7M、2.8M、2.9M、3M、3.1M、3.2M、3.3M、3.4M、3.5M、3.6M、3.7M、3.8M、3.9M、4M、4.1M、4.2M、4.3M、4.4M、4.5M、4.6M、4.7M、4.8M、4.9M、5M、5.1M、5.2M、5.3M、5.4M、5.5M、5.6M、5.7M、5.8M、5.9M、6M、7M、8M、9M或更高的浓度存在于可检测探针或亲和试剂溶剂组合物中。可替代地或另外地,阳离子物质可以以不大于约10M、9M、8M、7M、6M、5.9M、5.8M、5.7M、5.6M、5.5M、5.4M、5.3M、5.2M、5.1M、5.0M、4.9M、4.8M、4.7M、4.6M、4.5M、4.4M、4.3M、4.2M、4.1M、4.0M、3.9M、3.8M、3.7M、3.6M、3.5M、3.4M、3.3M、3.2M、3.1M、3.0M、2.9M、2.8M、2.7M、2.6M、2.5M、2.4M、2.3M、2.2M、2.1M、2.0M、1.9M、1.8M、1.7M、1.6M、1.5M、1.4M、1.3M、1.2M、1.1M、1.0M、0.9M、0.8M、0.7M、0.6M、0.5M、0.4M、0.3M、0.2M、0.1M、0.09M、0.08M、0.07M、0.06M、0.05M、0.04M、0.03M、0.02M、0.01M、0.001M、0.001M或更低的浓度存在于溶剂或溶液中。
阴离子物质可以以任何量配制在溶剂或溶液中。阴离子物质可以以至少约0.0001M、0.001M、0.01M、0.02M、0.03M、0.04M、0.05M、0.06M、0.07M、0.08M、0.09M、0.1M、0.2M、0.3M、0.4M、0.5M、0.6M、0.7M、0.8M、0.9M、1M、1.1M、1.2M、1.3M、1.4M、1.5M、1.6M、1.7M、1.8M、1.9M、2M、2.1M、2.2M、2.3M、2.4M、2.5M、2.6M、2.7M、2.8M、2.9M、3M、3.1M、3.2M、3.3M、3.4M、3.5M、3.6M、3.7M、3.8M、3.9M、4M、4.1M、4.2M、4.3M、4.4M、4.5M、4.6M、4.7M、4.8M、4.9M、5M、5.1M、5.2M、5.3M、5.4M、5.5M、5.6M、5.7M、5.8M、5.9M、6M、7M、8M、9M或更高的浓度存在于溶剂或溶液中。可替代地或另外地,阴离子物质可以以不大于约10M、9M、8M、7M、6M、5.9M、5.8M、5.7M、5.6M、5.5M、5.4M、5.3M、5.2M、5.1M、5.0M、4.9M、4.8M、4.7M、4.6M、4.5M、4.4M、4.3M、4.2M、4.1M、4.0M、3.9M、3.8M、3.7M、3.6M、3.5M、3.4M、3.3M、3.2M、3.1M、3.0M、2.9M、2.8M、2.7M、2.6M、2.5M、2.4M、2.3M、2.2M、2.1M、2.0M、1.9M、1.8M、1.7M、1.6M、1.5M、1.4M、1.3M、1.2M、1.1M、1.0M、0.9M、0.8M、0.7M、0.6M、0.5M、0.4M、0.3M、0.2M、0.1M、0.09M、0.08M、0.07M、0.06M、0.05M、0.04M、0.03M、0.02M、0.01M、0.001M、0.001M或更低的浓度存在于溶剂或溶液中。
表面活性剂物质可以以任何量配制在溶剂或溶液中。表面活性剂物质可以以至少约0.0001M、0.001M、0.01M、0.02M、0.03M、0.04M、0.05M、0.06M、0.07M、0.08M、0.09M、0.1M、0.2M、0.3M、0.4M、0.5M、0.6M、0.7M、0.8M、0.9M、1M、1.1M、1.2M、1.3M、1.4M、1.5M、1.6M、1.7M、1.8M、1.9M、2M、2.1M、2.2M、2.3M、2.4M、2.5M、2.6M、2.7M、2.8M、2.9M、3M、3.1M、3.2M、3.3M、3.4M、3.5M、3.6M、3.7M、3.8M、3.9M、4M、4.1M、4.2M、4.3M、4.4M、4.5M、4.6M、4.7M、4.8M、4.9M、5M、5.1M、5.2M、5.3M、5.4M、5.5M、5.6M、5.7M、5.8M、5.9M、6M、7M、8M、9M或更高的浓度存在于溶剂或溶液中。可替代地或另外地,表面活性剂物质可以以不大于约10M、9M、8M、7M、6M、5.9M、5.8M、5.7M、5.6M、5.5M、5.4M、5.3M、5.2M、5.1M、5.0M、4.9M、4.8M、4.7M、4.6M、4.5M、4.4M、4.3M、4.2M、4.1M、4.0M、3.9M、3.8M、3.7M、3.6M、3.5M、3.4M、3.3M、3.2M、3.1M、3.0M、2.9M、2.8M、2.7M、2.6M、2.5M、2.4M、2.3M、2.2M、2.1M、2.0M、1.9M、1.8M、1.7M、1.6M、1.5M、1.4M、1.3M、1.2M、1.1M、1.0M、0.9M、0.8M、0.7M、0.6M、0.5M、0.4M、0.3M、0.2M、0.1M、0.09M、0.08M、0.07M、0.06M、0.05M、0.04M、0.03M、0.02M、0.01M、0.001M、0.001M或更低的浓度存在于溶剂或溶液中。
变性物质可以以任何量配制在溶剂或溶液中。变性物质可以以至少约0.0001M、0.001M、0.01M、0.02M、0.03M、0.04M、0.05M、0.06M、0.07M、0.08M、0.09M、0.1M、0.2M、0.3M、0.4M、0.5M、0.6M、0.7M、0.8M、0.9M、1M、1.1M、1.2M、1.3M、1.4M、1.5M、1.6M、1.7M、1.8M、1.9M、2M、2.1M、2.2M、2.3M、2.4M、2.5M、2.6M、2.7M、2.8M、2.9M、3M、3.1M、3.2M、3.3M、3.4M、3.5M、3.6M、3.7M、3.8M、3.9M、4M、4.1M、4.2M、4.3M、4.4M、4.5M、4.6M、4.7M、4.8M、4.9M、5M、5.1M、5.2M、5.3M、5.4M、5.5M、5.6M、5.7M、5.8M、5.9M、6M、7M、8M、9M或更高的浓度存在于溶剂或溶液中。变性物质可以以不大于约10M、9M、8M、7M、6M、5.9M、5.8M、5.7M、5.6M、5.5M、5.4M、5.3M、5.2M、5.1M、5.0M、4.9M、4.8M、4.7M、4.6M、4.5M、4.4M、4.3M、4.2M、4.1M、4.0M、3.9M、3.8M、3.7M、3.6M、3.5M、3.4M、3.3M、3.2M、3.1M、3.0M、2.9M、2.8M、2.7M、2.6M、2.5M、2.4M、2.3M、2.2M、2.1M、2.0M、1.9M、1.8M、1.7M、1.6M、1.5M、1.4M、1.3M、1.2M、1.1M、1.0M、0.9M、0.8M、0.7M、0.6M、0.5M、0.4M、0.3M、0.2M、0.1M、0.09M、0.08M、0.07M、0.06M、0.05M、0.04M、0.03M、0.02M、0.01M、0.001M、0.001M或更低的浓度存在于溶剂或溶液中。
溶剂或溶液可以被配制为具有一定值或在一定值范围内的pH。溶剂或溶液可具有至少约0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10.0、10.1、10.2、10.3、10.4、10.5、10.6、10.7、10.8、10.9、11.0、11.1、11.2、11.3、11.4、11.5、11.6、11.7、11.8、11.9、12.0、12.1、12.2、12.3、12.4、12.5、12.6、12.7、12.8、12.9、13.0、13.1、13.2、13.3、13.4、13.5、13.6、13.7、13.8、13.9、14.0或更高的pH。可替代地或另外地,溶剂或溶液可具有不大于约14.0、13.9、13.8、13.7、13.6、13.5、13.4、13.3、13.2、13.1、13.0、12.9、12.8、12.7、12.6、12.5、12.4、12.3、12.2、12.1、12.0、11.9、11.8、11.7、11.6、11.5、11.4、11.3、11.2、11.1、11.0、10.9、10.8、10.7、10.6、10.5、10.4、10.3、10.2、10.1、10.0、9.9、9.8、9.7、9.6、9.5、9.4、9.3、9.2、9.1、9.0、8.9、8.8、8.7、8.6、8.5、8.4、8.3、8.2、8.1、8.0、7.9、7.8、7.7、7.6、7.5、7.4、7.3、7.2、7.1、7.0、6.9、6.8、6.7、6.6、6.5、6.4、6.3、6.2、6.1、6.0、5.9、5.8、5.7、5.6、5.5、5.4、5.3、5.2、5.1、5.0、4.9、4.8、4.7、4.6、4.5、4.4、4.3、4.2、4.1、4.0、3.9、3.8、3.7、3.6、3.5、3.4、3.3、3.2、3.1、3.0、2.9、2.8、2.7、2.6、2.5、2.4、2.3、2.2、2.1、2.0、1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0或更低的pH。
可检测探针或亲和试剂可包括一个或多个另外的修饰基团。可以包括修饰基团以改变可检测探针或亲和试剂的化学或物理特性。修饰基团可包括在可检测探针或亲和试剂上以改变诸如疏水性、亲水性、两亲性、电荷、磁化率的特性或任何其他物理特性。在一些情况下,修饰基团可用于增加、减少或改变可检测探针或亲和试剂的溶解度或溶液稳定性。在一些情况下,修饰基团可用于通过诸如电排斥或空间阻塞的机制保持可检测探针或亲和试剂的分隔。在一些情况下,修饰基团可用于增加颗粒之间的吸引力。例如,修饰基团可以在可检测探针和/或亲和试剂之间形成短暂的引力相互作用以产生多探针复合物而不会导致探针聚集或沉积。
保留组分的表面可包括一个或多个修饰基团。可以将修饰基团添加到表面上以改变所述表面的特征,同时介导可检测探针或亲和试剂与表面或界面之间的缔合。例如,可以将疏水性修饰基团添加到可检测探针或亲和试剂,以使探针与水包油乳液中的油滴相互作用。可以共价或非共价附接修饰基团。修饰基团可以在保留组分组装之前、期间或之后偶联至保留组分。表面修饰基团可包括带电部分、磁性部分、空间部分、两亲性部分、疏水性部分和亲水性部分。带电部分可包括可携带固有正电荷或负电荷或可在解离条件下携带电荷的官能团(例如,羧酸、硝酸根、砜、磷酸根、膦酸根等)。磁性部分可包括顺磁性、反磁性和铁磁性颗粒,诸如纳米颗粒(例如,钆、锰、氧化铁、铋、金、银、钴纳米颗粒等)。空间部分可包括聚合物和生物聚合物(例如,PEG、PEO、烷烃链、葡聚糖、剪切核酸)。两亲性部分可包括磷脂(例如,磷脂酸、磷脂酰乙醇胺、磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰肌醇、磷脂酰肌醇磷酸盐、磷脂酰肌醇二磷酸盐、磷脂酰肌醇三磷酸盐、神经酰胺磷酰胆碱、神经酰胺磷酰乙醇胺、神经酰胺磷酰脂)、糖脂(例如,甘油糖脂、神经鞘糖脂、鼠李糖脂等)和甾醇(例如,胆甾醇、菜油甾醇、谷甾醇、豆甾醇、麦角甾醇等)。疏水性部分可包括类甾醇(例如,胆甾醇)、饱和脂肪酸(例如,辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸、山萮酸、木蜡酸、蜡酸等)和不饱和脂肪酸(例如,肉豆蔻脑酸、棕榈油酸、皂角酸、油酸、反油酸、异油酸、亚油酸、花生四烯酸、二十碳五烯酸、芥酸、二十二碳己烯酸等)。亲水性化合物可包括带电分子和极性分子(例如,二醇、环糊精、纤维素、聚丙烯酰胺等)。
可检测探针或亲和试剂的表面可包括一个或多个修饰基团。可检测探针或亲和试剂的表面可包括至少约10、50、100、500、1000、5000、10000、50000、100000、50000、1000000个或更多的修饰基团。可替代地或另外地,可检测探针或亲和试剂的表面可包括不大于约1000000、500000、100000、50000、10000、5000、1000、500、100、50、10个或更少的修饰基团。
多个可检测探针、亲和试剂或两者可以被组装成多探针复合物。多探针复合物可包括例如多个可检测探针、多个亲和试剂、亲和试剂和可检测探针、亲和试剂和多个可检测探针或多个亲和试剂和可检测探针。可以制备多探针复合物以进一步增强可检测探针或亲和试剂的期望特性,如增强的亲合力和/或增强的可观察性。在一些配置中,多探针复合物可包括形成为单一复合物的具有相似或相同配置的多个可检测探针、亲和试剂或两者。可以形成包括多个相似或相同探针的多探针复合物,以在与结合配偶体相互作用时增加探针的总体亮度,或者可以提供增加数目的亲和试剂,以将亲合力增加到超过由单独的可检测探针或亲和试剂观察到的亲合力。在其他配置中,多探针复合物可包括附接到单一复合物中的具有不同或不相似配置的多个可检测探针、亲和试剂或两者。多探针复合物可包括具有不同或不相似配置的多个可检测探针、亲和试剂或两者,可以被形成为同时与多个结合配偶体、表位或靶部分结合,或通过增加可检测探针或亲和试剂可识别的结合配偶体、表位或靶部分的数目来增加形成结合相互作用的可能性。多探针复合物可表现为单价复合物(例如,配置为仅结合单一种类的结合配偶体、表位或靶部分)或多价复合物(例如,配置为与多种不同的结合配偶体、表位或靶部分结合)。多探针复合物可通过共价或非共价相互作用附接。两个可检测探针之间、两个亲和试剂之间或探针与试剂之间的共价键可通过例如点击反应形成。探针和/或试剂之间的非共价相互作用可通过例如核酸杂交或链霉亲和素-生物素偶联形成。
多探针复合物可通过将两个或更多个可检测探针、亲和试剂或两者偶联在一起形成。多探针复合物可通过直接附接可检测探针和/或亲和试剂形成(例如,通过核酸杂交、交联等)。在一些配置中,多探针复合物可通过一种或多种次要保留组分如结构化核酸颗粒或纳米颗粒之间的附接形成。如果次要保留组分提供可检测探针或亲和试剂的可调位置和/或取向,则它们可以是特别受关注的。在一些在配置中,次要保留组分可包括另外的组分,如修饰基团、结合组分或标记组分。图39A-39B显示了包括次要保留组分的多探针复合物的示例性配置。图39A显示了次要保留组分3910(例如,结构化核酸颗粒、纳米颗粒),其包括两个或更多个附接的可检测探针3920,它们以向内取向附接。次要保留组分3910进一步包括附接的标记组分3930。图39B显示了包括两个或更多个分隔的颗粒3910(例如,SNAP、纳米颗粒)的次要保留组分,所述分隔的颗粒包括多个可检测探针3920,这些探针被偶联以形成取向向内的结合组分的多个袋。包括两个或更多个颗粒3910的次要保留组分进一步包括附接于所述次要保留组分的多个标记组分3930。在其他配置中,可通过多个可检测探针或亲和试剂与非结构化材料或基团如聚合物、金属、陶瓷、半导体、玻璃、纤维、树脂或其组合偶联或附接来形成多探针复合物。非结构化材料可以是无定形的、球状的、多孔的或它们的一些组合。非结构化材料可包括允许附接多个可检测探针或亲和试剂的多个附接位点。
图35A-35C描绘了多探针复合物的各种配置。图35A描绘了通过连接基团3520(例如,共价或非共价连接基团)连接的两个相同或相似的瓦片形状的核酸可检测探针3510。可检测探针3510可以对单个靶标或一组靶标(例如,结合配偶体、表位或靶部分)具有亲和力。图35B描绘了通过连接基团3520(例如,共价或非共价连接基团)与具有适体结合组分3515的第二瓦片形状的可检测探针连接的具有抗体结合组分3510的第一瓦片形状的核酸可检测探针。可检测探针3510和3515可具有不同的亲和力,从而允许所述可检测探针同时结合多于一个结合配偶体、表位或靶部分。图35C描绘了一对非基于核酸的可检测探针3530(例如,颗粒、纳米颗粒等),它们通过非共价吸引相互作用如静电或磁相互作用连接。非基于核酸的可检测探针3530可包括具有相似或不相似的结合配偶体、表位或靶部分的结合组分。
在一些配置中,多探针复合物可以被配置为形成具有受控的几何形状的复合物。可以采用受控的几何形状来更有利地定向结合组分以增加亲合力。多探针复合物可以被配置为在与结合配偶体、表位或靶部分形成结合相互作用时改变形状或构象。多探针复合物可以被配置为抵抗形状或构象的变化以增加结合组分与结合配偶体、表位或靶部分的接触或接近。包括在多探针复合物中的个别探针或试剂可具有与所述多探针复合物中的其他探针或试剂形成相互作用的修饰基团,所述相互作用影响探针在所述复合物内的相对取向。图36A-36B描绘了具有设计的或结构化的几何形状的可检测探针的配置。图36A描绘了通过接头3620连接的两个瓦片形状的核酸可检测探针3610。每个探针3610包括对接头3620的自由移动产生排斥或阻碍的一个或多个修饰基团3630(例如,相同电荷、相同磁极性、空间基团等)。修饰基团3630使所述探针的取向向内,增加了所述探针复合物的结合组分密度。图36B描绘了通过接头3620连接的两个瓦片形状的核酸可检测探针3610。每个探针3610包括一个或多个修饰基团3640(例如,疏水性基团、亲水性基团等),其在探针之间产生吸引力,所述吸引力产生探针3610的向内取向,增加了所述探针复合物的结合组分密度。这些配置可以在与结合配偶体的结合相互作用期间抵抗所述复合物的变形。
多重复合物可包括附接到单一复合物中的两个或更多个可检测探针和/或亲和试剂。多探针复合物可包括至少约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100个或更多的可检测探针和/或亲和试剂。可替代地或另外地,多探针复合物可包括不大于约100、95、90、85、80、75、70、65、60、55、50、45、40、35、30、25、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3个或更少的可检测探针和/或亲和试剂。
本文所述的亲和试剂或可检测探针可包括结合组分(也称为结合组分或探针组分),其能够与多肽或其他分析物结合或缔合,结合或缔合的方式允许对这种结合进行解释,以便于确认与其缔合(或不缔合)的多肽或其他分析物。亲和试剂或可检测探针还可以包括标记组分,其允许观察或检测所述亲和试剂或可检测探针与靶分析物如多肽或其他分析物的结合或缔合。标记组分可以与探针组分分隔,例如当所述标记组分是经由合成接头或附接部分附接的外源标记时。可替代地,标记组分可以是探针的固有特征,如可检测的质量、电荷或光学特征。通过确认哪些亲和试剂或可检测探针与样品内的不同多肽或其他分析物结合,可以确认该样品内的这类蛋白质或多肽的存在和潜在量。
在一些实施方案中,旨在确认靶氨基酸序列的亲和试剂或可检测探针实际上可包括一组不同的组分,它们在本文所述的方法中使用时彼此不可区分或区别。特别地,可用于确认同一靶氨基酸序列的不同组分可使用相同的标记部分来确认同一靶氨基酸序列。例如,无论侧翼序列如何都结合三聚体氨基酸序列(AAA)的亲和试剂或可检测探针可包括结合三聚体AAA序列而不受侧翼序列的任何影响的单一结合组分,或一组结合组分(例如400个结合组分),其每一者与αAAAβ形式的不同的5个氨基酸表位结合,其中α和β可以是任何氨基酸。在第二种情况的实例中,结合组分可具有组合效果。
结合和亲合力
对于单个的单价亲和试剂,亲和试剂与结合靶标(例如,结合配偶体、表位或靶部分)之间的结合相互作用的强度可通过亲和力来表征。亲和力可以以解离常数或缔合常数的形式定量表达。不希望受理论束缚,解离常数K
r
其中k
r
其中k
/>
对于给定的亲和试剂,较小的K
可以为具有多个结合组分的可检测探针或亲和试剂确定表观解离常数。可类似于单价亲和试剂的解离常数来计算表观解离常数。不希望受理论束缚,表观解离常数K
r
其中k
r
其中k
对于多价可检测探针或多价亲和试剂,较小的K
可检测探针或亲和试剂的亲合力通常可以被描述为所述探针的表观解离常数相对于其组成结合组分的解离常数的降低。例如,对于包括N个结合组分的探针,每个单独的结合组分可具有如上面的等式1-3所描述的单独的解离常数,例如{K
如果本公开的可检测探针或亲和试剂展示的K
可检测探针、亲和试剂或其结合组分的解离常数可以为至少约0.1nM、0.5nM、1nM、5nM、10nM、15nM、20nM、25nM、30nM、35nM、40nM、45nM、50nM、55nM、60nM、65nM、70nM、75nM、80nM、85nM、90nM、95nM、100nM、150nM、200nM、250nM、300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、950nM、1μM、2μM、3μM、4μM、5μM、6μM、7μM、8μM、9μM、10μM或更大。可替代地或另外地,可检测探针、亲和试剂或其结合组分的解离常数可以不大于约10μM、9μM、8μM、7μM、6μM、5μM、4μM、3μM、2μM、1μM、950nM、900nM、850nM、800nM、750nM、700nM、650nM、600nM、550nM、500nM、450nM、400nM、350nM、300nM、250nM、200nM、150nM、100nM、95nM、90nM、85nM、80nM、75nM、70nM、65nM、60nM、55nM、50nM、45nM、40nM、35nM、30nM、25nM、20nM、15nM、10nM、5nM、1nM、0.5nM、0.1nM或更小。
可检测探针或亲和试剂可具有表观或测量的解离常数,其小于附接于所述可检测探针或亲和试剂的结合组分的解离常数。可检测探针或亲和试剂较低的解离常数可归因于结合的结合率增加、k
在一些情况下,定量描述亲合力可能是有用的。对于针对结合靶标的最强结合物具有解离常数K
其中K
亲合力可以指亲和试剂或可检测探针在所述试剂或探针具有与结合配偶体形成结合相互作用的多个途径时表现出对所述结合配偶体的表观亲和力改变的能力。例如,如果可检测探针或亲和试剂包括十个结合组分,并且每个结合组分对结合靶标X具有亲和力,则所述可检测探针或亲和试剂具有十个可能的途径与所述靶标X形成结合相互作用。亲合力可以是放大的效果,其中包括多个结合组分的可检测探针或亲和试剂对结合配偶体、表位或靶部分的表观亲和力可强于所述多个结合组分中的任何结合组分的亲和力。例如,具有10个结合组分的可检测探针或亲和试剂在附接于所述可检测探针或亲和试剂的最强结合组分具有仅800nM的解离常数时可具有50纳摩尔(nM)的测量的解离常数。
亲合性的出现可能是由于在多个结合组分的存在下,在之前的结合相互作用被破坏后不久即形成新的结合相互作用的倾向。因此,可以观察到可检测探针(或亲和试剂)与结合配偶体之间的结合相互作用比观察到的单个结合组分与所述结合配偶体之间的结合相互作用在更长的时间尺度上发生。不希望受理论束缚,可以通过改变探针设计来调整可检测探针或亲和试剂结合以改变探针的热力学、动力学和/或传质特征。可检测探针或亲和试剂的亲合力可受改变结合相互作用的可能性的因素的影响,包括:1)所述探针上的结合组分密度;2)所述探针上的结合组分的总数目;3)结合组分的类型和/或种类;4)结合组分结合热力学;6)结合组分结合动力学;5)探针大小和/或重量;6)探针形状和/或构象;和7)次级结合相互作用介体。
根据可检测探针或亲和试剂池的热力学和动力学结合行为,增加浓度的可检测探针或亲和试剂可促进可检测探针或亲和试剂与结合配偶体、表位或靶部分的结合。可以参考探针本身、参考探针上的结合组分的总数目或者在具有异质结合组分混合物的探针的情况下参考特定种类的结合组分的数目来计算在结合测定中利用的可检测探针或亲和试剂的有效或目标浓度。例如,以0.1摩尔/升(M)的可检测探针或亲和试剂提供的溶液将具有2M总浓度的结合组分或1M浓度的适体或抗体,所述可检测探针或亲和试剂被制成以1:1的抗体/适体比率含有总共20个结合组分/探针。可检测探针或亲和试剂的有效或目标浓度可以按质量或摩尔基础确定。可以针对预期目的以优选的浓度(例如,优化亲合力的浓度)提供可检测探针、亲和试剂或其结合组分。
可以以至少约1x10
探针的大小可能对可检测探针或亲和试剂的亲合特性有影响。不希望受理论束缚,可检测探针或亲和试剂的传质特性可受探针的大小和/或重量的影响。可检测探针或亲和试剂的传质物理特性(例如,扩散系数)可具有取决于探针的大小和/或重量的传质物理特性的缩放比例关系。例如,可检测探针或亲和试剂在水中可具有以幂律关系与探针分子量(即,D~MW
探针可具有至少约1kDa、10kDa、50kDa、100kDa、500kDa、1000kDa、1500kDa、2000kDa、2500kDa、3000kDa、3500kDa、4000kDa、4500kDa、5000kDa、5500kDa、6000kDa、6500kDa、7000kDa、7500kDa、8000kDa、8500kDa、9000kDa、9500kDa、10000kDa或更大的特征化分子量。可替代地或另外地,探针可具有不大于约10000kDa、9500kDa、9000kDa、8500kDa、8000kDa、7500kDa、7000kDa、6500kDa、6000kDa、5500kDa、5000kDa、4500kDa、4000kDa、3500kDa、3000kDa、2500kDa、2000kDa、1500kDa、1000kDa、500kDa、100kDa、50kDa、10kDa、1kDa或更小的特征化分子量。
在一些情况下,可检测探针或亲和试剂的亲合力可受次级结合相互作用的影响。次级结合相互作用可以是涉及已设计可检测探针或亲和试剂所具有的次级分子的弱或短期的相互作用。次级结合相互作用可包括涉及降低可检测探针或亲和试剂远离结合配偶体、表位或靶部分扩散的表观速率的次级分子的弱或短期的相互作用。次级结合相互作用可增加观察到可检测探针或亲和试剂与所述可检测探针或亲和试剂对之具有亲和力的结合配偶体缔合的可能性。在一些配置中,次级分子可包括一个或多个配体和/或部分,其可与可检测探针或亲和试剂上的互补配体和/或部分形成弱相互作用。例如,次级分子可具有与可检测探针或亲和试剂中的核酸序列至少部分互补的核酸序列。如此,所述次级分子和探针可以被配置为经由所述两个序列的杂交形成弱相互作用。例如,弱相互作用可由不完全或不连续的杂交产生,如由在所述可检测探针或亲和试剂或次级分子的序列中使用发夹或环结构产生的相互作用,在所述可检测探针(或亲和试剂)和次级分子的以其他方式互补的区域中错配的核苷酸,或在所述可检测探针(或亲和试剂)或次级分子中的产生较弱碱基对结合的修饰或非天然的核苷酸。在其他配置中,次级分子可包括一个或多个可与结合配偶体形成弱相互作用的配体和/或部分。在一些配置中,可检测探针(或亲和试剂)或次级分子可包括多个被配置为形成弱结合相互作用的分子。
在一些配置中,可将与可检测探针或亲和试剂相互作用的次级分子附接于固体支持物。例如,所述次级分子可以是附接于固体支持物的SNAP,如核酸折纸或核酸纳米球。所述SNAP可任选附接于可检测探针或亲和试剂的一个或多个结合组分的结合配偶体。因此,次级分子可经由一个或多个结合组分与结合配偶体的结合来介导可检测探针或亲和试剂与固体支持物的缔合,且可以通过所述次级分子与所述SNAP之间的弱相互作用来增强所述缔合。在一些配置中,多个SNAP以阵列的形式附接于固体支持物。所述阵列中的每个位点可具有附接于空间分辨的结合配偶体的SNAP,且所述结合配偶体中的每一者可以被一个或多个可检测探针或亲和试剂识别。可有效地应用于本公开的组合物或方法中的示例性SNAP和固体支持物阐述于系列号为17/062,405的美国专利申请(公开为美国专利申请公布第2021/0101930A1号)和2019/195633A1中,上述专利文献中的每一者通过引用并入本文。
图8描绘了可检测探针810,其被配置为与结合配偶体830或结合配偶体830内的表位或靶部分形成相互作用。所述可检测探针进一步包括悬垂配体820(例如,核酸),其被配置为在相互作用区域860与互补分子850形成弱相互作用。在一些配置中,次级分子850可与锚定基团840、结合配偶体830或固体支持物870结合或缔合。在一些配置中,在相互作用区域860的悬垂配体820与互补分子850之间的相互作用可以是天然不稳定的,从而促进可检测探针810自结合配偶体830最终解离。在其他配置中,在相互作用区域860的悬垂配体820与互补分子850之间的相互作用可以被配置为被破坏(例如,在变性剂的存在下)。
图9A-9B描绘了利用一对互补核酸在可检测探针与次级分子之间形成弱相互作用的可能配置。图9A显示了可与可检测探针或次级分子偶联的第一核酸910可与所述可检测探针-次级分子对的相反分子偶联的第二核酸920。第一核酸910被配置为以不完全或不连续的方式与第二核酸920杂交,从而形成弱相互作用区930。在一些配置中,所述不完全或不连续杂交可包括发夹或环结构、错配的核苷酸或产生较弱碱基对结合的修饰或非天然的核苷酸。图9B显示了可检测探针与通过短杂交区域在两个核酸之间形成的次级分子之间的弱相互作用。可检测探针940可包括被配置为与第二核酸920杂交的第一核酸910。第一核酸910和第二核酸920在弱相互作用区930杂交,该弱相互作用区含有有限数目的结合的碱基对,使得所述碱基对结合具有一定程度的可逆性或解离。所述弱相互作用区可包括有限数目的核苷酸,举例如不大于约15、14、13、12、11、10、9、8、7、6、5、4、3、2个或少于约2个核苷酸。弱碱基配对相互作用区可位于核酸的末端部分或所述核酸序列的内部部分中。
在一些实施方案中,所述可检测探针进一步包括具有单链区域的部分非杂交的核酸。在一些实施方案中,所述单链区域与同结合配偶体缔合的互补核酸结合。在一些实施方案中,所述单链区域包括引物序列,所述引物序列被配置为与互补引物序列结合。在一些实施方案中,所述引物序列被配置为引起立足点置换反应。在一些实施方案中,所述引物序列被配置为在与所述互补引物序列结合时形成发夹或环结构。
图10A-10C描绘了用于在次级分子与可检测探针之间形成弱结合相互作用的立足点置换策略。图10A显示了立足点置换反应的第一步。包括第一核酸1020的可检测探针1010接近与次级分子缔合的第二核酸1050。第一核酸分子1020包括含有立足点序列1030和引发序列1040的杂交序列。第二核酸1050包括互补杂交序列,所述互补杂交序列包括互补立足点序列1060和互补引发序列1070。第二核酸1050可与仅与所述杂交序列的互补立足点序列1060杂交的立足点引物1080杂交。第一核酸1020的引发序列1040可与第二核酸1050的互补引发序列1070杂交,从而在可检测探针1010与次级分子之间形成初始弱结合相互作用。可检测探针1010与次级分子之间的弱结合相互作用可具有一定程度的可逆性或解离。图10B显示了立足点置换反应的第二步。第一核酸1020的立足点序列1030置换立足点引物1080,从而允许所述立足点序列完成与第二核酸1050的互补立足点序列1060的杂交。立足点引物1080在溶液或溶剂中邻近所述弱结合相互作用的持续存在可通过立足点引物1080自第二核酸1050置换第一核酸1020而引起立足点置换反应的逆转。
图10C描绘了在可检测探针与次级分子之间形成弱结合相互作用的替代方法。可检测探针1010包括第一核酸链1020,其含有与第二核酸链1050上的互补引发序列1070结合的引发序列1040。第二核酸链1050还含有不与第一核酸1020的序列互补的互补立足点序列1060。可以使可检测探针-次级分子复合物与包括立足点引物的溶液或溶剂接触,所述立足点引物包括立足点序列1030和引发序列1040。立足点引物可以通过破坏引发序列1040与互补引发序列1070的碱基对结合来可逆地置换第一核酸链1020。在一些配置中,可检测探针的结合与置换之间的平衡可通过调节一种或多种立足点置换反应物(例如,立足点引物、可检测探针)的浓度来控制。
也可以通过利用具有不同亲和力的另一种结合分子来增加可检测探针或亲和试剂的亲合力。在一些配置中,亲和试剂可包括一个或多个结合组分,例如附接于多个结合组分的保留组分。在一些配置中,亲和试剂具有单一结合组分。在一些配置中,结合分子是可检测探针或亲和试剂。结合分子可以具有以比可检测探针或亲和试剂低的亲和力和/或亲合力与结合配偶体、表位或靶部分结合的特性。结合分子可以与可检测探针或亲和试剂偶联,使得所述可检测探针或亲和试剂与所述结合分子的同时结合使观察到的所述可检测探针或亲和试剂的亲合力或亲和力明显增加。
图11A-11C描绘了采用结合分子的次级结合相互作用来增加可检测探针的亲合力的系统。如图11A中所示,可检测探针1110通过接头1190(例如,共价异双官能接头、杂交的核酸等)与结合分子1130(例如,第二可检测探针)连接。所述接头可以是柔性的,例如允许可检测探针1110直接与结合分子1130相互作用。可替代地,接头可以是相对刚性的,例如,限制可检测探针1110为不与结合分子1130直接相互作用。可检测探针1110包括第一多个结合组分1120,且结合分子1130包括第二多个结合组分1140。使包括通过连接可检测探针1110和结合分子1130形成的复合物的组合物与含有表位或靶部分1160和次级结合位点1170的结合配偶体1150接触。如图11B中所示,结合相互作用可通过第一多个结合组分1120的结合组分与表位或靶部分1160的初始结合来启动。在初始结合之时,所述结合分子可能尚未与结合配偶体1150形成次级相互作用。如图11C中所示,当第二多个结合组分1140中的结合组分与次级结合位点1170形成次级结合相互作用时,结合过程可以完成,从而将可检测探针1110和结合分子1130与结合配偶体1150结合。结合分子1130与次级结合靶标1170之间的弱次级结合相互作用可增加可检测探针1110将被观察为与结合配偶体1150结合的可能性。技术人员将容易认识到结合复合物的结合顺序可以颠倒,例如结合分子1130首先结合次级结合位点1170,接着是可检测探针1110与表位或靶部分1160结合。
图11D-11E描绘了采用结合分子的次级结合相互作用来增加可检测探针的亲合力的替代系统。如图11D中所示,包括第一多个结合组分1120和包括连接区1192的第一连接基团1191的可检测探针1110与结合配偶体1150的表位或靶部分1160结合。使包括第二多个结合组分1140和包括互补连接区1194的第二连接基团1193的未结合的结合分子1130与结合配偶体1150接触。如图11E中所示,多个结合组分1140中的结合组分将结合分子1130与所述结合配偶体的次级结合位点1170结合,从而形成弱次级结合相互作用。在结合分子1130结合后,连接区1192和互补连接区1194可以连接,从而在可检测探针1110与结合分子1130之间形成接头。结合分子1130与次级结合靶标1170之间的弱次级结合相互作用可增加可检测探针1110将被观察为与结合配偶体1150结合的可能性。技术人员将容易认识到结合复合物的结合顺序可以颠倒,例如结合分子1130首先结合次级结合位点1170,接着是可检测探针1110与表位或靶部分1160结合。第一连接基团1191和第二连接基团1193可以被配置为形成共价或非共价相互作用。例如,第一连接基团1191可包括核酸连接区1192,且第二连接基团1193可包括互补核酸连接区1194,其被配置为与核酸连接区1192杂交。在另一个实例中,连接区1192可包括被配置为与互补连接区1194中的官能团化学结合(例如,通过点击反应)的官能团(例如,点击反应基团)。
在许多情况下,亲和试剂、可检测探针或其结合组分可具有与选定结合配偶体(例如多肽分子或较大多肽结构内的氨基酸表位)结合的非随机概率,这意味着其对给定的表位或表位组相比于其他表位或表位组表现出一定水平增高的亲和力,也称为“特异性”。在许多情况下,特异性可能不是二元的,这意味着亲和试剂或可检测探针有时可能似乎不与其对之表现出增高的特异性的给定表位结合,并且有时其可能似乎与其对之没有展示出特异性的表位结合。在许多情况下,给定的亲和试剂或可检测探针对于如上所述给定的表位或结合配偶体是否具有特异性将与亲和试剂或可检测探针在结合测定的条件下与给定的表位或结合配偶体结合的可能性相关联。例如,如果结合的概率大于概率阈值,则可以认为亲和试剂或可检测探针对特定的表位或结合配偶体具有特异性。在进行结合测定之前,概率阈值可以是已知的(即所述阈值是预先确定的),或其可由结合测定本身确定(即所述阈值是凭经验确定的)。在一些情况下,与特异性结合相关联的概率阈值可大于50%、60%、70%、80%、90%、95%、99%或更大。在一些情况下,与特异性结合相关联的概率阈值可大于1%、5%、10%、20%、30%或40%。相反,在一些情况下,给定亲和试剂或可检测探针在给定的一组情形下不结合给定的表位或结合配偶体(例如,提供假阴性结合结果)的概率可在小于1%至大于99%的范围内,这意味着可能存在亲和试剂或可检测探针不与其互补表位或多肽结合的显著可能性。而在一些情况下,与非特异性或非结合相关联的概率阈值将小于50%、40%、30%、20%、10%、5%或更低。在一些情况下,与非特异性或非结合相关联的概率阈值可小于60%、70%、80%、90%或95%。
在一些实施方案中,可检测探针或亲和试剂可具有以下特性中的一种或多种:可与特定氨基酸种类特异性结合,并且可以不与超过十九种其他氨基酸种类结合。例如,可检测探针或亲和试剂可与20种必需氨基酸中的一种结合,但不与其他19种必需氨基酸结合。可检测探针或亲和试剂可以结合至少10%的αXβ形式的序列,其中X是所需表位,且α和β是任何氨基酸残基。在一些情况下,可检测探针或亲和试剂可以结合至少0.25%、0.5%、0.75%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、20%、30%、40%、50%、75%或90%的αXβ形式的序列。在一些情况下,可检测探针或亲和试剂可以结合至少10%的αXβ形式的序列,其中K
在一些实施方案中,可检测探针或亲和试剂可具有以下特性中的一种或多种:可以特异性结合具有特定三个氨基酸序列的所需表位,可以不结合任何其他三个氨基酸序列,并且可以以基本上相似的亲和力结合所需表位,而不管所需表位周围的侧翼序列如何。在一些情况下,所述可检测探针或亲和试剂可具有一些、更多或所有的这些特性。在一些情况下,所述可检测探针或亲和试剂可以不结合所述表位的亚组。本公开的另一方面提供一种可检测探针或亲和试剂,其可优先结合已知的一组三个氨基酸表位,这些表位相对于其他表位的优先性以及受侧翼氨基酸残基的影响已经得到确定。
在一些情况下,可检测探针或亲和试剂可包括可切换的适体,其与5%与10%之间的人类蛋白质组中的所有蛋白质结合。在一些情况下,所述可切换的适体可包括两个或更多个荧光部分。可切换的适体可以是本公开的可检测探针或亲和试剂的结合组分。
在一些情况下,可检测探针或亲和试剂被配置为与给定序列结合,其中所述可检测探针或亲和试剂和所述给定序列的K
在一些情况下,可检测探针或亲和试剂可具有结合在一个或多个结构环境中的所需表位的能力。在一些实施方案中,当具有表位的多肽处于变性环境、天然环境或两者时,可检测探针或亲和试剂可结合所需的表位。在一些实施方案中,可检测探针或亲和试剂可具有结合折叠或未折叠环境内的多肽中的所需表位的能力。在一些实施方案中,已经变性的多肽可以在所述多肽内含有或产生一个或多个微折叠区域。可检测探针或亲和试剂可以被设计为结合多肽中已被允许在变性后折叠的所需表位。所得多肽可以被复性为其活性折叠状态、部分再折叠或折叠成不同状态。可检测探针或亲和试剂可以与已经变性和/或允许自变性状态折叠的多肽的折叠或未折叠区域中的表位结合。
在一些实施方案中,识别所需表位序列(例如AAA)的可检测探针或亲和试剂可同样良好地或几乎同样良好地与含有所述表位序列的所有多肽结合。在一些情况下,可检测探针或亲和试剂可根据所述表位的序列背景的差异以不同的亲和力与所需表位结合。在一些情况下,可检测探针或亲和试剂可结合若干不同的表位,而不管序列背景如何。在一些情况下,本公开的可检测探针或亲和试剂可根据序列背景以不同的亲和力结合若干不同的表位。具有这类特性的可检测探针或亲和试剂可通过筛选方法的组合来确认,以确定所述可检测探针或亲和试剂的结合特征。例如,可以筛选可检测探针或亲和试剂与除了共同核心序列(例如αAAAβ形式的氨基酸表位,其中AAA是所述共同核心序列,且α和β可以是任何氨基酸)以外彼此不同的一组多肽序列结合的能力。
在一些情况下,可检测探针或亲和试剂的所需表位可以是肽序列。在一些情况下,可能需要若干不同的表位。在这种情况下,可以选择结合多个所需表位的可检测探针或亲和试剂。在一些情况下,所需表位或多个表位可以被称为X。在一些情况下,所述表位包括非连续的氨基酸序列。例如,表位可包括多肽的一级序列的区域中每第二、第三或第四个氨基酸残基的指定氨基酸。表位可包括其中两个指定氨基酸由可变氨基酸(例如AαA,其中A是丙氨酸,且α是任何氨基酸)分隔的3个氨基酸的序列、其中两个指定的氨基酸由两个可变氨基酸(例如AαβA,其中A是丙氨酸,且α和β是任何氨基酸)分隔的4个氨基酸的序列、其中两个指定的氨基酸由三个可变氨基酸分隔的5个氨基酸的序列等。在一些实施方案中,表位可包括两个或更多个非连续表位的序列。在另一个实例中,表位可包括在蛋白质二级或三级结构中位置彼此邻近的若干氨基酸残基,即使所述残基在蛋白质序列中并不邻近(即在所述蛋白质的一级结构中不邻近)。在一些情况下,所述表位包括指定氨基酸的连续序列。在一些实施方案中,所需表位X是2、3、4、5、6或7个氨基酸的短氨基酸序列。在一些情况下,X包括若干不同的短氨基酸序列。在一些实施方案中,所需表位X是三个氨基酸序列X
所述靶标可包括多个多肽,其包括所需序列X。所述多个可具有多种配置中的任一种,如溶液相中的多肽池、固体支持物上、容器中、固体支持物上、各自含有所述多个中的一个或多个多肽的容器集合当中的多肽阵列等。在一些情况下,所述靶标是全为序列X的多个多肽。在一些实施方案中,所述靶标可包括序列αXβ的多个多肽,其中X是所需表位,且α和β可以是零个、一个或一个以上氨基酸的任何序列。例如,如果所需表位X是AAA,则可存在于靶多肽中的序列的实例可包括:AAAAA、AAAAC、CAAAA、CAAAC和CAAAD。在一些情况下,α和β可以各自是任何单个氨基酸。α的氨基酸可以与β的氨基酸相同或不同。在一些情况下,α和β中的至少一者可以是2、3、4、5、6、7、8、9、10个或更多的氨基酸。α的序列可以与β的序列相同或不同。在一些情况下,α和β中的至少一者可包括接头或间隔子。所述接头或间隔子可以是本文阐述或本领域中已知的任何接头或间隔子。在一些情况下,所述接头具有肽主链,例如是氨基酸接头。在一些情况下,所述接头是聚乙二醇(PEG)或PEG聚合物链。所述PEG链可由2、3、4、5、6、7、8、9、10、12、14、16、18、20、22、24、26、28、30、34、36、38、40、42、44、46、48、50个或更多的乙二醇单体组成。在一些情况下,所述接头可以是碳链。所述多肽还可以包括N末端或C末端修饰,例如加帽。在一些情况下,可以修饰所述多肽以移除电荷,例如末端酰胺化(C-末端)或乙酰化(N-末端)。在一些情况下,αXβ肽可含有非天然存在的氨基酸。在一些情况下,αXβ肽可以用接头和官能团进行修饰。例如,所述分子可具有结构F-L-αXβ,其中F是官能团,且L是接头。在其他情况下,所述分子可具有结构αXβ-L-F,其中F是官能团,且L是接头。官能团F可任选能够与反应性部分形成共价键或与受体结合。在一些情况下,α和β可以各自是甘氨酸,或者可以各自是一个或多个甘氨酸残基。在一些实施方案中,可以修饰氨基酸残基以改变其适体原性(aptagenicity)。例如,可以通过如下方式来改变残基:添加正电荷;添加负电荷;添加疏水性基团;修饰以便添加糖;或其他修饰以便增加化学多样性。
可采用本领域中已知的任何方法合成多肽。有若干用于多肽合成的商业平台,如MultiPep RSi合成仪(Intavis,德国)。可以采用液相或固相方法合成多肽。可以采用任何已知的多肽分析方法验证合成的多肽。例如,可以采用质谱法、基质辅助激光解吸/电离飞行时间质谱法(MALDI-TOF)、基质辅助激光解吸/电离、AMS(加速器质谱法)、气相色谱法-MS、液相色谱法-MS、电感耦合等离子体-质谱法(ICP-MS)、同位素比质谱法(IRMS)、离子迁移谱-MS、串联MS、热电离-质谱法(TIMS)或火花源质谱法(SSMS)来验证多肽。也可以通过光谱法来评估合成肽的浓度。
图48示出用于选择或表征可检测探针或亲和试剂的固定化靶标以及包括所述靶标的多肽的示例性列表。在图48的实例中,所需表位是AAA,且所述靶标的多肽包括序列αAAAβ,其中α和β各自为单个氨基酸。在此实例中,所述靶标包括400个不同的多肽,代表αAAAβ的每个可能的序列,其中α和β各自为单个氨基酸。
这样,对于任何给定的3聚体表位,包括5聚体池的靶标可含有400个不同的序列(α有20种可能性,且β有20种可能性,其中α和β中的每一者是单个氨基酸)。在一些情况下,所述靶标可包括比5个氨基酸长的多肽池,其中α和β中的每一者或两者可包括两个或更多个氨基酸。在一些情况下,α和β中的一者可包括零个氨基酸,且α或β另一者可包括一个或多个氨基酸。在一些情况下,所述靶标可包括没有另外的氨基酸的序列X的多肽。
在一些情况下,靶序列X可以嵌入更长的序列中。例如,靶序列X可以是少于15个氨基酸的核心序列,其嵌入15聚体多肽分子中。靶序列X可以在15聚体内的任何位置嵌入,例如在三个氨基酸靶序列X的情况下,靶序列X可以在所述15聚体的位置1、2、3、4、5、6、7、8、9、10、11、12或13开始。包括嵌入的靶序列的多肽可以在溶液中合成,或者可以在芯片上合成,如PEPperPRINT芯片或其他肽阵列。在一些实施方案中,包括嵌入的靶序列的多肽可以被结合或合成到单分子蛋白质阵列上。可以选择较长的序列以形成二级结构,或缺少二级结构。这类二级结构的实例包括α螺旋、β折叠、脯氨酸弯曲、转弯、环和半胱氨酸桥。在一些情况下,较长的序列可包括非天然存在的氨基酸或其他基团。
初始选择步骤可包括针对包括所需表位的靶标筛选亲和试剂或可检测探针的文库。所述亲和试剂或可检测探针或探针文库可包括具有随机序列或具有与已知蛋白质结合适体相似的序列的DNA、RNA或肽适体。
在一些情况下,所述文库可以是适体文库。在一些情况下,适体文库可以是商业文库。在一些情况下,适体文库可获自研究所、大学、学术中心或研究中心。在一些情况下,文库可包括附接于珠粒或其他颗粒的适体的文库。在一些情况下,适体文库可自已知序列的文库或随机序列产生。在一些情况下,适体文库可包括具有特定结构的适体,举例如茎环文库。在一些情况下,适体文库可包括可切换的适体-可以在两种构象之间切换的适体。例如,适体可在金属离子辅因子的存在下形成第一构象,且在所述辅因子不存在的情况下形成第二构象。因此,添加螯合剂如EDTA或EGTA会螯合金属离子,并使适体适应不同的构象。可用于诱导适体切换的其他因素包括光、pH、温度、磁场和电流。
可通过本领域中已知的任何方法进行针对靶标的适体文库的筛选。一方面,可以将靶标固定在固体支持物上,并且可以在允许以低特异性结合适体的条件下添加适体。未结合的适体可以用一系列增加严格性的洗涤从靶标上洗去。通过洗涤步骤仍然与靶标结合的适体可以被测序并扩增,用于进一步轮次的选择或用于设计具有高序列相似性的另外的适体。可以重复若干轮靶结合、洗涤、测序和扩增或设计新的适体,直到产生具有所需特异性和结合亲和力的适体。也可以采用基于珠粒的方法筛选适体文库,该方法利用各自包括多个拷贝的适体的珠粒。也可以采用基于阵列的方法筛选适体文库,例如通过将文库的每个适体的多个拷贝点样到阵列上,然后评估与靶标结合的点。也可以采用颗粒展示方法筛选适体文库。例如,可以将附接于适体的珠粒或其他颗粒排列在支持物上以形成阵列。在一些实施方案中,可使用单分子蛋白质阵列来筛选适体文库。
在一些情况下,可以测量与确认的可检测探针或亲和试剂结合的靶标的分数或百分比,例如通过比较探针的结合拷贝数与可用于结合的多肽的数目。在一些实施方案中,可检测探针或亲和试剂可与至少10%、20%、30%、40%、50%、60%、70%、80%或更多的包括靶标的多肽结合。另外,一旦确认和选择了特定的可检测探针或亲和试剂,则可以对其进行验证。在一些实施方案中,可以针对含有表位的多个序列验证选定的可检测探针或亲和试剂,所述可检测探针或亲和试剂被表征为与所述表位结合。在一些实施方案中,可以通过针对单分子蛋白质阵列上的多个蛋白质序列评估选定的可检测探针或亲和试剂来验证选定的可检测探针或亲和试剂。
所述可检测探针或亲和试剂可以在选择和表征步骤之前或之后附接于可检测标记。在一些情况下,所述可检测探针或亲和试剂可以在初始选择步骤之前附接于标记。在一些情况下,所述可检测探针或亲和试剂可以在初始选择步骤之后和表征步骤之前附接于标记。在一些情况下,所述可检测探针或亲和试剂可以在选择和表征步骤之后附接于标记。在一些情况下,所述可检测探针或亲和试剂可附接于用于选择步骤的第一标记,并且附接于用于表征步骤的第二标记。所述第二标记可以与所述第一标记一起添加,或者代替所述第一标记。在一些情况下,第一标记可用于选择和表征步骤,且第二标记用于产生最终的亲和试剂或可检测探针。
检测和可观察性
本公开的可检测探针可以被配置为提供对探针赋予可观察性的可检测的信号。可观察性可以指产生物理信号的特性,所述物理信号可以很容易地在超过检测系统的背景或噪声的水平上被检测装置感测。例如,如果荧光探针产生的荧光信号强度超过背景荧光信号强度达到阈值量,例如10%、50%、100%、2x、3x、4x、5x或更多,则其可以被认为是可观察的。在另一个实例中,如果核酸条形码信号在有或没有扩增的情况下产生阈值量的序列计数(例如,通过下一代测序或基于阵列的杂交),例如在10轮信号扩增后序列计数为1000或更多,则其可以被认为是可观察的。一般来说,可观察性可受若干因素的影响,包括:1)可检测探针结合靶标的可能性;2)背景信号的强度;和3)信号阻尼机制。可影响可检测探针结合靶标的可能性的因素可包括上面阐述的那些。
背景信号可以指与所需信号相比具有相同或相似特征的可检测的信号。例如,在荧光标记系统中,背景信号可包括与来自荧光标记的预期荧光信号相同波长或在辐射波长范围内检测到的辐射,例如当试图观察
背景辐射信号可以是空间均匀的或空间不均匀的。对于一些表征测定,可以在测定之前、期间或之后测量辐射背景信号。例如,可以通过对材料多周期施加一个或多个可检测探针来表征材料的空间组成。经过连续的周期,残余的可检测探针可以随机留在所述材料上,在连续检测周期期间产生不均匀的背景信号。残余的可检测探针可能最终会解离,这意味着背景信号可具有空间和时间不均匀性。在另一个实例中,相同的上述材料表征测定可以在未光学密封的检测系统中进行,从而允许在所述系统中检测到一些外部辐射。外部辐射在所述材料上不具有均匀的分布,导致在背景信号中检测到非均匀梯度或辐射的分布。外部辐射可以不随时间变化,从而导致空间上不均匀但时间上均匀的背景。
可检测探针可以被表征为产生超过背景信号阈值的可检测的信号。荧光标记的可检测探针可以被表征为具有超过背景荧光信号的荧光信号(或其他类型的发光信号)。可以例如通过固定时间段内的总光子计数来量化发光信号,以获得背景信号或检测的探针信号。可以在点、位置或地址处或在包括多个点、位置或地址的区域上测量量化的发光信号。可检测探针可以被配置为具有超过阈值背景信号水平的可检测的信号,如整个区域上的平均信号或区域内的最大信号。来自可检测探针的信号的总强度可以通过附接于所述可检测探针的信号传导标记(例如,荧光团)的总数目来控制。探针的空间强度(即,在特定位置的信号强度)可以通过附接于所述探针的信号传导标记(例如,荧光团)的密度来控制。
可检测探针可以被配置为产生超过预期或观察到的背景信号的可检测的信号。例如,被配置为与材料或所述材料上的结合配偶体结合的可检测探针可产生超过由所述材料产生的测量的背景信号的可检测的信号。可检测探针可产生超过背景信号特定量的可检测的信号。相反,可检测探针可产生小于可检测限度的可检测的信号,这取决于信号感测的模式。可检测探针可产生超过背景信号强度至少约1.5x、2x、3x、4x、5x、6x、7x、8x、9x、10x、11x、12x、13x、14x、15x、16x、17x、18x、19x、20x、25x、30x、40x、50x、75x、100x或更多的可检测的信号强度。可替代地或另外地,可检测探针可具有超过背景信号强度不多于约100x、75x、50x、40x、30x、25x、20x、19x、18x、17x、16x、15x、14x、13x、12x、11x、10x、9x、8x、7x、6x、5x、4x、3x、2x、1.5x或更少的可检测的信号强度。
对于辐射信号(例如,荧光),信号阻尼的产生可能是由于一种或多种消除或干扰辐射信号的机制。示例性信号阻尼机制可包括猝灭、自猝灭、光漂白和标记丢失。由于抑制发射或吸收发射的光子的化学物质的存在,可能会发生猝灭。表征系统中的一些物质可以固有地吸收发射的光子,导致辐射信号的减少或猝灭。在一些配置中,可以将抑制可猝灭辐射信号的物质形成的特定物质添加到检测系统中(例如,氧清除剂,如抗坏血酸盐)。一种特定形式的猝灭是自猝灭,其中来自发光团的发光信号可以被相同或相似种类的第二发光团猝灭。自猝灭可能与标记间配置有关,如相邻发光团之间的间距和发光团的相对取向。在一些配置中,发光信号可随着相邻发光团之间的间距减小而减小。在其他配置中,发光信号可随着相邻发光团之间的间距减小而增加(例如,Forster共振能量转移)。
猝灭、自猝灭和相关的光学现象可以通过有效量子产率来表征。个别荧光团可具有特征或测量的量子产率。包括多个荧光团的可检测探针组合物的有效量子产率可以是在测定条件下测量或表征的量子产率。可检测探针组合物可具有至少约0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.51、0.52、0.53、0.54、0.55、0.56、0.57、0.58、0.59、0.60、0.61、0.62、0.63、0.64、0.65、0.66、0.67、0.68、0.69、0.70、0.71、0.72、0.73、0.74、0.75、0.76、0.77、0.78、0.79、0.80、0.81、0.82、0.83、0.84、0.85、0.86、0.87、0.88、0.89、0.90、0.91、0.92、0.93、0.94、0.95、0.96、0.97、0.98、0.99或更大的有效量子产率。可替代地或另外地,可检测探针组合物可具有不大于约0.99、0.98、0.97、0.96、0.95、0.94、0.93、0.92、0.91、0.90、0.89、0.88、0.87、0.86、0.85、0.84、0.83、0.82、0.81、0.80、0.79、0.78、0.77、0.76、0.75、0.74、0.73、0.72、0.71、0.70、0.69、0.68、0.67、0.66、0.65、0.64、0.63、0.62、0.61、0.60、0.59、0.58、0.57、0.56、0.55、0.54、0.53、0.52、0.51、0.50、0.45、0.4、0.35、0.3、0.25、0.2、0.15、0.1或更小的有效量子产率。
辐射信号也可以通过化学机制如光漂白或标记丢失被阻尼或以其他方式减弱。不希望受理论束缚,光漂白可能是由于标记如荧光标记的不可逆化学变化而发生。光漂白可能是由于任何已知的机制,包括光子与荧光团的相互作用、光子与可能破坏荧光团的物质(例如,自由基,如三线态氧)的相互作用以及化学物质与荧光团之间改变或破坏荧光团的相互作用。光漂白及其他形式的信号阻尼可能是短暂的或与时间相关的现象。例如,由于照射引起的光漂白可以与总时间或总照射时间成比例地增加。同样,破坏性化学修饰物质的总量或浓度可影响光漂白的速率。例如,光漂白的严重程度可随光子计数或光子密度的增加而增加。由于光漂白或别的化学机制引起的信号丢失的速率可以是随时间恒定或可变的(例如,指数型、对数型)。
由于猝灭、自猝灭、光漂白、标记丢失或其他机制,可检测探针组合物可经历随时间的推移可变的或增加的信号丢失。可检测探针组合物可具有至少约0.001%/分钟、0.01%/分钟、0.1%/分钟、0.5%/分钟、1%/分钟、2%/分钟、3%/分钟、4%/分钟、5%/分钟、6%/分钟、7%/分钟、8%/分钟、9%/分钟、10%/分钟、15%/分钟、20%/分钟、25%/分钟、30%/分钟、35%/分钟、40%/分钟、45%/分钟、50%/分钟、55%/分钟、60%/分钟、65%/分钟、70%/分钟、75%/分钟、80%/分钟、85%/分钟、90%/分钟、95%/分钟或更大的信号丢失速率。可替代地或另外地,可检测探针组合物可具有不大于约95%/分钟、90%/分钟、85%/分钟、80%/分钟、75%/分钟、70%/分钟、65%/分钟、60%/分钟、55%/分钟、50%/分钟、45%/分钟、40%/分钟、35%/分钟、30%/分钟、25%/分钟、20%/分钟、15%/分钟、10%/分钟、9%/分钟、8%/分钟、7%/分钟、6%/分钟、5%/分钟、4%/分钟、3%/分钟、2%/分钟、1%/分钟、0.5%/分钟、0.1%/分钟、0.01%/分钟、0.001%/分钟或更小的信号丢失速率。
可检测探针可产生与背景可区别的可检测的信号,例如通过具有超过背景信号的强度或具有从背景信号中分辨出来的可检测的特征。可检测探针可以被表征为持续给定量的时间产生超过背景信号的信号强度,尽管存在诸如光漂白和标记丢失的信号降低机制。例如,荧光可检测探针可具有超过背景荧光信号至少10分钟的连续或非连续激发的荧光信号。可观察时间可以被定义为可检测探针产生与局部或平均背景信号可区别的可检测的信号的最短时间长度。在一些配置中,可通过增加可检测探针上的标记组分的总数目来增加可观察时间。可观察时间可以与附接于可检测探针的标记组分的数目成比例地缩放。可以增加或甚至最大化可检测探针的可观察时间以确保整个测定过程中的可检测性。可检测探针的可观察时间可限制在某个值内,以使得能够清除预期的信号,如通过光漂白。可检测探针可以被观察至少约1s、15s、30s、1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟、15分钟、20分钟、30分钟、45分钟、60分钟、90分钟、120分钟或更久,或具有上述可观察时间。可替代地或另外地,可检测探针可以被观察不大于约120分钟、90分钟、60分钟、45分钟、30分钟、20分钟、15分钟、10分钟、9分钟、8分钟、7分钟、6分钟、5分钟、4分钟、3分钟、2分钟、1分钟、30s、15s、1s或更短,或具有上述可观察时间。
可检测探针可通过产生远超过背景信号的可检测的信号来改善结合相互作用的可观测性。此外,可检测探针可通过提高可检测的信号的空间分辨率来增加结合相互作用的可观察性。可检测探针可以被配置为以若干方式提供可检测的信号的空间分辨率,包括:1)在保留组分的小区域内浓缩标记以产生光学密集的信号源;2)将标记分布在保留组分的大区域上以产生光学均匀的信号源;或3)将标记浓缩在全部或大部分保留组分上以产生光学密集且均匀的信号源。图12A-12B描绘了利用可检测探针的发光信号(例如荧光信号)空间分辨率的实例。图12A描绘了当包括多个荧光团的单个结合组分与区域中心的结合配偶体结合时所述区域(例如,材料的表面)上的荧光计数数据,包括背景荧光计数。所述区域可以被均匀地分成九个子区域,其中每个子区域可针对荧光单独量化(例如,每个子区域可对应于传感器像素)。由于亲和试剂的结构和亲和力原因,附接于亲和试剂的荧光团的数目可能是有限的。图12A中的荧光计数显示了中心子区域的荧光计数适度增加,这可能是由于亲和试剂与结合配偶体之间的结合相互作用,但信号强度可能不足以高于周围八个子区域的背景计数以得出发生了结合相互作用的结论。图12B描绘了与图12A类似的情况,但可检测探针包括比图12A描述的亲和试剂显著更多数目的荧光团。在中心子区域中观察到的显著增加的荧光信号以及来自周围子区域的信号的增加(可能是由于来自中心子区域的信号串扰)增加了观察到的信号是由于可检测探针与结合配偶体的结合相互作用的置信度。
可检测探针的大小可以被调节为在固体支持物、表面或视野的区域上提供可检测的信号。可检测探针在其上提供信号的区域的大小可由所述区域内的特征的大小来确定。例如,可检测探针的大小可以被调节为在大于结合配偶体(例如,多肽)所占据的区域的区域上提供信号。可以将可检测探针设计为大于结合配偶体以减少背景信号,例如通过减少来自所述结合配偶体或与所述结合配偶体相邻的材料的自发荧光。可替代地,可以将可检测探针设计为小于结合配偶体以增加来自所述可检测探针的可检测的信号的空间分辨率。
在一些配置中,可检测探针组合物可以被设计为在比所述可检测探针可与其结合或对其具有亲和力的结合配偶体大的固体支持物、表面或视野的区域上产生可检测的信号。可以通过增加标记组分在可检测探针的表面上的分布和/或浓度来改善探针在特定区域上的可观察性。通过包括增强由可检测探针提供的可检测的信号的另外的检测分子,探针可以在相对大的面积上产生可检测的信号。图13示出可检测探针组合物,其用于在相对于其识别的结合配偶体所占据的区域较大的区域上产生可检测的信号。可检测探针1310与任选通过锚定基团1340(例如核酸,如结构化核酸颗粒或官能团键接)锚定至表面或固体支持物1370的结合配偶体1330(例如,多肽)结合。通过将可检测探针1310与另外的检测分子1320连接来增加由可检测探针1310产生的可检测的信号的区域。检测分子1320可包括保留组分和多个标记组分(例如,荧光团)。检测分子1320的保留组分不需要附接于结合组分。然而,检测分子1320的保留组分可附接于可检测探针1310中存在的那些以外的结合组分。检测分子1320通过接头1325与可检测探针1310连接。接头1325可以是永久性接头(例如,异双官能接头、点击反应产物、链霉亲和素-生物素键接),或者可以是非永久性接头(例如,杂交的核酸)。接头可以是柔性的,例如允许检测分子1320与可检测探针1310之间的直接相互作用;或者接头可以是刚性的,例如限制检测分子1320为不与可检测探针1310相互作用。由可检测探针1310和检测分子1320形成的复合物可以在可检测探针1310与结合配偶体1330结合之前形成,或者可以通过结合所述可检测探针、接着使检测分子1320与可检测探针1310接触而形成。
被配置为与结合配偶体结合的可检测探针的大小相对于多肽的大小可以更小或更大。大小可以被测量为体积、分子量、最长尺寸、有效直径、回转半径、流体动力学半径、投影(例如印迹)等。可替代地,被配置为在位点(例如多肽阵列中的位点)与结合配偶体结合的可检测探针的大小相对于所述位点的大小可以更小或更大。与结合配偶体或位点的大小相比,可检测探针或包括可检测探针的复合物的大小可以被调节为至少约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、175%、200%、250%、300%、400%、500%、600%、700%、800%、900%、1000%或更大。可替代地或另外地,与结合配偶体或位点的大小相比,可检测探针或包括可检测探针的复合物的大小可以被调节为不大于约1000%、900%、800%、700%、600%、500%、400%、300%、250%、200%、175%、150%、140%、130%、120%、110%、100%、95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、1%或更小。
通过在可检测探针上包含一种以上类型或种类的标记组分,可检测探针的标记组分可以被配置成用于多重检测。将多个结合组分附接于可检测探针的能力增加了可检测探针用于多重使用的动态灵活性。可检测探针可具有标记组分的独特组合,其构成所述可检测探针的独特指纹或标志。结合池可由具有不同结合特异性的可检测探针的混合物产生,所述结合特异性由特异性探针标志或指纹指示,使得可以通过观察所述标志或指纹来确定观察到的特异性结合相互作用。可以通过改变结合组分的类型或种类的数目以及附接于可检测探针的标记组分的比率来产生标志或指纹。可检测探针可包括至少约2、3、4、5、6、7、8、9、10个或更多不同种类的标记组分。可替代地或另外地,用于多重使用的组合物的可检测探针可包括不大于约10、9、8、7、6、5、4、3或更少的不同种类的标记组分。第一种类的标记组分与第二种类的标记组分的比率可以为至少约1.5:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1或更大。可替代地或另外地,第一种类的标记组分与第二种类的标记组分的比率可以不大于约10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1.1:1或更小。
多重探针组合物可包括具有不同结合亲和力的多个可检测探针,其中任何给定的可检测探针的结合亲和力可通过所述可检测探针上的标记组分的独特指纹或标志来确定。多重探针组合物中的独特类型的可检测探针的数目可通过用于观察结合相互作用的检测系统的类型和检测系统区分探针标志或指纹的差异的灵敏度来确定。对于荧光标记,基于可检测探针上的荧光团的荧光波长,荧光检测系统可具有有限数目的检测通道。每个检测通道内的检测范围也可以限制添加到可检测探针中的每一荧光团的量。
多重探针组合物可包括至少约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50个或更多独特类型的可检测探针。可替代地或另外地,多重探针组合物可包括不大于约50、49、48、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3个或更少独特类型的可检测探针。独特性可表现为可检测探针中存在的组分的数目或多样性,如探针中存在的结合组分的数目或多样性、探针中存在的标记组分的数目或多样性、探针中存在的保留组分的数目或多样性和/或探针中存在的标签或条形码的数目或多样性。
可检测探针可以被配置为通过Forster共振能量转移(FRET)检测。在一些配置中,可检测探针可含有附接的荧光团对,其被配置为通过FRET机制检测。不希望受理论束缚,有效的FRET检测可利用位于足够距离内的吸收荧光团和发射荧光团,以允许能量在荧光团之间有效转移。在一些配置中,FRET可提供增加使用给定激发源可彼此区别的探针的数目的优点。例如,第一探针可包括当被激发源激发时以第一波长发射的荧光团组分D。第二探针可包括荧光团组分D和荧光团组分A,其中激发源对荧光团组分D的激发导致能量转移到荧光团组分A,其进而以第二波长发射。可以使用标准光学器件来分辨两个发射波长,以将两个探针彼此区别开来。
图14A-14B描绘了可通过FRET机制检测的可检测探针的各种配置。图14A描绘了用于利用核酸的螺旋结构将供体荧光团和受体荧光团以临界配对距离Δs
可检测探针组合物可包括偶联的供体和受体发光团对。可接受的供体/受体对可包括Cy2/Cy3、Cy3/Cy5、FITC/TRITC、PE/APC、Alexa-
FRET染料对可偶联至核酸,如形成结构化核酸颗粒的一部分的寡核苷酸或支架链。含有FRET染料对的核酸可具有修饰的核苷酸,所述染料足够间隔地附接于其上以允许FRET相互作用发生。适当的间距可由当寡核苷酸与支架链杂交时产生的自然产生的螺旋结构决定。FRET对中的两个相邻染料可间隔至少约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个或相隔更多的核苷酸。可替代地或另外地,FRET对中的两个相邻染料可间隔不大于约20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3个或相隔更少的核苷酸。
可以使用荧光团以外的标记组分观察涉及可检测探针的结合相互作用。可检测探针可包括条形码标记组分(例如,核酸条形码)。条形码标记组分可包括独特的序列(例如,DNA、RNA、氨基酸),其在被解码时提供确认可检测探针种类的信息。例如,多个相同的可检测探针可以各自用相同种类的条形码(即具有相同序列的条形码)标记,从而为该特定的可检测探针提供均匀且单一的结合相互作用信号。可以通过诸如下一代测序的方法检测和解码条形码信号以获得对可检测探针与结合配偶体、表位或靶部分之间的相互作用的观察。
图15A-15D描绘了利用核酸条形码记录可检测探针与结合配偶体、表位或靶部分之间的结合相互作用的系统。图15A描绘了含有可检测探针1510的系统,所述可检测探针包括通过接头1520与可检测探针1510连接的核酸条形码序列。所述核酸条形码序列包括两个引发序列1522和两个引发序列1522之间的识别序列1525。可检测探针1510结合任选与固体支持物1570结合的结合配偶体、表位或靶部分1530。结合配偶体、表位或靶部分1530可通过锚定基团1540(例如SNAP或化学接头)与固体支持物1570结合。结合配偶体、表位或靶部分1530可具有缔合的接头1550(例如,附接于固体支持物1570、锚定基团1540或结合配偶体、表位或靶部分1530)。缔合的接头1550可以以互补引发序列1552终止,所述互补引发序列与可检测探针1510核酸条形码的引发序列1522形成杂交键。使由可检测探针1510和结合配偶体、表位或靶部分1530形成的复合物与被配置为结合核酸的聚合酶1560接触。图15B显示了聚合酶1560与通过引发序列1522和互补引发序列1552的连接形成的杂交核酸序列结合以启动延伸反应。图15C描绘了所述延伸反应的最终步骤。已通过延伸将识别序列1525和引发序列1522添加到缔合接头1550的末端序列上,以添加互补识别序列1555和另外的互补引发序列1552。图15D描绘了多周期的可检测探针1510结合和引物延伸后的结合配偶体、表位或靶部分1530。每个探针向接头1550的端部的序列添加独特的识别序列(例如,1555、1556、1557)。在每个确认序列(1555、1556、1557)的端部添加互补引发序列1552允许接头1550与可检测探针的后续结合。可检测探针1510显示具有任选的多个标记组分(显示为6个尖星)。将要理解的是,可检测探针不需要包括标记,例如在其中确认序列被解码以确定靶部分1530的结合历史的配置中。因此,亲和试剂可以如图15A-15D中所例示的那样配置或使用。
在美国专利申请公布第2020/0348308A1、2020/0348307A1或2019/0145982A1号中阐述了可附接于本公开的亲和试剂的标签的其他实例以及例如在检测、测序或量化多肽的测定中使用和检测所述标签的方法,上述专利文献中的每一者通过引用并入本文。
制作可检测探针和亲和试剂的方法
可通过合适的方法制作如本公开中描述的可检测探针或亲和试剂。制作可检测探针或亲和试剂可包括一个或多个以下步骤:1)产生被配置为附接多个结合组分和/或多个标记组分的保留组分;2)将一个或多个结合组分附接于所述保留组分;3)将一个或多个标记组分附接于所述保留组分;和4)将另外的组分附接于所述保留组分。
可通过制作过程获得保留组分。可通过批量制作和/或纯化过程制作非核酸保留组分(例如,聚合物、金属、陶瓷、碳或半导体纳米颗粒)。在产生非核酸保留组分之后,可进行一个或多个加工步骤以将一个或多个表面官能团添加至保留组分。添加官能团的目的可以是为了改善保留组分溶剂溶解度特性或为结合组分和/或标记组分提供附接位点。表面官能团可包括被配置为附接结合组分和/或标记组分的官能团(例如,被配置为经历点击反应的官能团),或被配置为与含有附接的结合组分和/或标记组分的互补核酸杂交的核酸。例如,包括硅或二氧化硅纳米颗粒的保留组分可以用硅烷化的化合物官能化以将多个官能团共价添加至所述颗粒的含硅表面。在非核酸保留组分的官能化之后,亲和基团可通过任意合适的技术如点击反应或核酸杂交与保留组分连接。
核酸保留组分(例如,核酸折纸、核酸纳米球)的制作可通过常规技术形成。可通过诸如滚环扩增的方法制作核酸纳米球以产生支架链,所述支架链可以被进一步修饰以附接多个结合组分和/或标记组分。制备核酸纳米球的示例性方法描述于例如美国专利第8,445,194号中,该专利文献通过引用并入本文。可例如采用Rothemund,Nature440:297-302(2006)以及美国专利第8,501,923和9,340,416号中描述的技术制作包括核酸折纸的核酸保留组分,上述文献中的每一者通过引用并入本文。
图21A显示了形成具有核酸保留组分的可检测探针的第一途径。在组装保留组分之前制备具有附接的结合组分2120的寡核苷酸和具有附接的标记组分2130的寡核苷酸。使具有附接的结合组分2120的寡核苷酸和具有附接的标记组分2130的寡核苷酸与单链支架2110(例如,M13噬菌体DNA、质粒DNA)和另外的结构核酸2140接触。所述核酸在升高的温度(例如,至少约50℃、60℃、70℃、80℃或90℃)下在合适的DNA缓冲液中接触,然后冷却。寡核苷酸将在适当的序列依赖性位置与支架链2110杂交以形成可检测探针2150。
图21B显示了形成具有核酸保留组分的可检测探针的替代途径。在组装保留组分之前制备具有被配置为附接结合组分2125的柄的寡核苷酸和具有被配置为附接标记组分2135的柄的寡核苷酸。使具有被配置为附接结合组分2125的柄的寡核苷酸和具有被配置为附接标记组分2135的柄的寡核苷酸与单链支架2110(例如,M13噬菌体DNA或质粒DNA)和另外的结构核酸2140接触。所述核酸在升高的温度(例如,至少约50℃、60℃、70℃、80℃或90℃)下在合适的缓冲液中接触,然后冷却。冷却后,形成了被配置为结合多个结合组分和/或标记组分的保留组分2155。在合适的附接缓冲液中使保留组分2155与多个结合组分2128和/或标记组分2138接触,所述结合组分和/或标记组分具有与保留组分2155上的柄互补的柄。在附接多个结合组分2128和/或多个标记组分2138之后,可检测探针2150形成。
在一些配置中,可检测探针或亲和试剂可通过如下反应而附接结合组分和/或标记组分形成:被配置为与另一分子或基团形成键的官能团的反应,例如生物正交反应或单击化学(参见例如美国专利第6,737,236和7,427,678号,其各自通过引用整体并入本文);使用铜催化剂的叠氮化物炔烃Huisgen环加成反应(参见例如美国专利第7,375,234和7,763,736号,其各自通过引用整体并入本文);使用如下部分的无铜Huisgen反应(“无金属点击”):应变炔烃或三嗪-肼部分,其可连接于醛部分(参见例如美国专利第7,259,258号,其通过引用并入);三嗪氯化物部分,其可连接于胺部分;羧酸部分,其可使用偶联试剂如EDC连接于胺部分;硫醇部分,其可连接于硫醇部分;烯烃部分,其可连接于通过狄尔斯-阿尔德反应偶联的二烯烃部分;和乙酰溴部分,其可连接于硫代磷酸酯部分(参见例如WO 2005/065814,其通过引用并入)。官能团可以被配置为经由点击反应(例如,金属催化的叠氮化物-炔烃环加成、应变促进的叠氮化物-炔烃环加成、应变促进的叠氮化物-硝酮环加成、应变烯烃反应、硫醇-烯反应、狄尔斯-阿尔德反应、逆电子需求狄尔斯-阿尔德反应、[3+2]环加成、[4+1]环加成、亲核取代、二羟基化、硫醇-炔反应、光点击、硝酮偶极环加成、降冰片烯环加成、氧杂降冰片二烯环加成、四嗪连接、四唑光点击反应)。示例性硅烷衍生物CLICK反应物可包括烯烃、炔烃、叠氮化物、环氧化物、胺、硫醇、硝酮、异腈、异氰化物、氮丙啶、活化酯和四嗪(例如,二苯并环辛炔-叠氮化物、甲基四嗪-反式环辛烯、环氧化物-硫醇等)。点击反应可提供在温和条件(例如,室温、水性溶剂)下快速成键的有利方法。
在一些配置中,可检测探针或亲和试剂的保留组分或其他组分可包括不同种类的官能团。使用不同的官能团可以对将附接于可检测探针或亲和试剂的不同组分的数目和位置提供一定水平的控制。在特定配置中,不同的官能团表现出正交反应性,由此第一组分具有对探针上的第一官能团有反应性但基本上不与探针上的第二官能团反应的部分,且由此第二组分具有对第二官能团有反应性但对第一官能团没有反应性的部分。因此,可以通过在可检测探针或亲和试剂上适当使用正交官能团来调节不同结合组分的数目及其位置,或者可以通过在可检测探针或亲和试剂上适当使用正交官能团来调节不同标记组分的数目及其位置。此外,通过在可检测探针或亲和试剂上分别适当使用正交官能团,可以将结合组分与标记组分不同地定位在可检测探针或亲和试剂上。
可以通过适当的方法形成包括非核酸的保留组分。特别受关注的是这样的方法,其在探针组装期间允许在将结合组分、标记组分或其他组分附接于保留组分时有一定程度的空间控制。空间控制可包括分隔或隔离探针组分或改变探针组分的取向的能力。例如,空间控制可包括将结合组分和/或标记组分与相邻或邻近的结合组分和/或标记组分分隔开。在另一个实例中,空间控制可包括将附接的结合组分的区域与附接的标记组分的区域隔离。在又一实例中,空间控制可包括控制结合组分和/或标记组分的相对分散或分布,例如以10:1比率在保留组分的区域中提供结合组分和标记组分。
图32A-32B描绘了用于在组装包括非核酸保留组分的可检测探针或亲和试剂期间控制探针组分位置的方案。图32A描绘了被配置为与界面3220如多相边界(例如,空气/液体界面、油/水界面)缔合的多个颗粒3210(例如,纳米颗粒、纳米珠、纳米球等)。界面3220形成在第一流体介质3222与第二流体介质3224之间。多个颗粒3210中的每个颗粒的部分暴露于不同的修饰化学物质,这取决于暴露于第一液体介质3222还是第二液体介质3224。多个颗粒3210中的每个颗粒暴露于第一液体介质3222的部分在所述颗粒的表面上形成第一多个官能团3235。多个颗粒3210中的每个颗粒暴露于第二液体介质3224的部分在所述颗粒的表面上形成第二多个官能团3230。第一多个官能团3235可以为第一类型的探针组分(例如,结合组分)提供附接位点,且第二多个官能团3230可以为第二类型的探针组分(例如,标记组分)提供附接位点。
图32C-32E描绘了用于在组装包括非核酸保留组分的可检测探针或亲和试剂期间控制探针组分位置的方案。图32C描绘了部分嵌入或固定在介质3226内的多个颗粒3210(例如,纳米颗粒、纳米珠、纳米球等)。包衣或层3240(例如,金属、金属氧化物、聚合物或水凝胶)被施加至多个颗粒3210中的每个颗粒的暴露部分。如图32D中所示,在将包衣或层3240施加至多个颗粒3210之后,可以移除介质3226,从而提供具有部分包衣或层3240的多个颗粒3210。如图32E中所示,多个颗粒3210的未包衣和包衣部分的不同表面化学可用于用部分包衣或层3240差别地官能化多个颗粒3210。包衣或层3240可提供有第一多个官能团3235,其可为第一类型的探针组分(例如,结合组分)提供附接位点。每个颗粒的未包衣部分可提供有第二多个官能团3230,其可为第二类型的探针组分(例如,结合组分)提供附接位点。
也可以通过控制非核酸保留组分的表面上的附接位点的空间或表面密度来控制结合组分和/或标记组分在非核酸保留组分上的位置或定位。图33描绘了颗粒或纳米颗粒保留基团的制备过程。将颗粒或纳米颗粒3310与要附接于颗粒或纳米颗粒3310表面的部分(如结合组分附接位点3320、标记组分附接位点3330或修饰基团3340)的混合物合并。平衡部分的混合物内的组分的比率以确保成比例地修饰颗粒或纳米颗粒3310表面。最终结果是保留组分,基于部分的混合物中的组分浓度,每一组分在颗粒或纳米颗粒3310表面上均匀或接近均匀分布。可替代地,可以通过初始添加由第一类型的附接位点和阻断基团组成的双组分混合物来顺序添加组分。在表面官能化之后,可以完全或部分地移除阻断基团,以提供用于附接其他类型的附接位点的表面位点。
多个亲和试剂、多个可检测探针或至少一个亲和试剂和至少一个可检测探针的组合可缀合以形成多探针复合物。类似地,可检测探针或亲和试剂可配置有允许试剂或探针附接于一个或多个其他试剂或探针的一个或多个偶联基团。所述偶联基团可以被配置为形成共价相互作用、非共价相互作用、静电相互作用、磁相互作用或在可检测探针亲和试剂或两者之间形成缔合的任何其他相互作用。多探针复合物中的两个或更多个探针之间的缔合可以是微弱的、暂时的或可逆的。多探针复合物中的两个或更多个探针之间的缔合可以是强的、永久的或不可逆的。在一些情况下,可检测探针或亲和试剂可通过互补核酸链的杂交或链霉亲和素-生物素偶联基团偶联。在其他情况下,可检测探针或亲和试剂可通过例如点击反应或交联(例如,化学或光引发的交联)共价偶联。
多探针复合物可作为探针合成过程的一部分形成。探针或保留组分的形成可促进探针组分如结合组分和/或标记组分的定位、取向和附接。图37A-37C描绘了利用复合物来调整结合组分在非核酸保留组分上的位置的过程。图37A描绘了与形成于第一介质3722与第二介质3724之间的相边界3720缔合的两个颗粒保留组分3710(例如,纳米颗粒)。保留组分3710被配置为通过颗粒之间的吸引相互作用(例如,静电或磁吸引、可混合的表面官能团等)形成复合物。使保留组分3710与第二介质3724内的多个结合组分3730接触,所述多个结合组分被配置为附接于颗粒3710上的附接位点。图37B描绘了在多个结合组分3730已附接于第二介质3724内的颗粒表面之后的复合颗粒3710。由于排除了第一介质3722内的表面积并排除了颗粒间缔合区域附近的表面,因此结合组分3730限于颗粒3710表面的某些区域。图37C显示了一个任选的过程,其中颗粒之间的相互作用被破坏,释放出单独的可检测探针3740。在其他配置中,所述颗粒可作为多探针复合物被保留。
基于核酸的保留组分(例如,如美国临时申请第63/112,607号中阐述的支架)可通过标准核酸合成化学来合成,并提供有特定的标记基团,例如通过掺入预标记的核苷酸,或通过提供用于随后要添加的标记基团的附接位点,例如提供官能性侧基以及用于与结合组分偶联的一个或多个位点。同样,可以合成PEG支架,并用将允许附接结合组分或标记组分任一者或两者的官能团进行官能化。在另一个实例中,可以合成多肽支架,其包括将允许附接探针组分或标记组分任一者或两者的基团。在一些情况下,保留组分可以比与其附接的标记大得多。在其他情况下,保留组分可以同与其附接的标记组分大小相似。在其他情况下,标记组分可大于与其附接的保留组分。
在一些情况下,可以在结合组分之上直接合成保留组分,如核酸支架。用于合成保留组分的试剂可包括结合组分。可以在要附接于结合组分的接头分子上直接合成保留组分,如核酸支架。例如,用于合成保留组分的试剂可包括接头。在一些实施方案中,保留组分可通过使用核苷酸混合物的模板介导的聚合酶延伸反应来产生,在所述混合物中,要掺入的一些或所有核苷酸具有用于附接标记组分的官能部分。例如,聚合酶在延伸期间使用的三种核苷酸可以是未标记的(和/或可以缺少官能团),且第四种核苷酸可以用荧光部分或其他标记部分标记(或者第四核苷酸可具有官能团)。在此实例中,第四核苷酸的互补碱基可以以预定模式出现在模板中。例如,第四核苷酸的互补碱基可以以本文别处阐述的核苷酸间距出现。
如图49A中所示,在此示出为核酸适体的结合组分可在一个末端(例如,3’末端)包括引物序列。然后可以例如使如上所述包括与引物序列互补的序列区段的模板核酸与结合组分的引物区段杂交(参见图49B,步骤1)。如上所述,例如在未标记的和标记的核苷酸存在下,聚合酶介导的基于模板的引物序列在结合组分上的延伸然后产生亲和探针,其包括结合组分(例如,适体)以及包括具有掺入的标记的保留组分的核酸的标记组分(与标记的核苷酸的聚合酶反应的延伸产物(参见图49B,步骤2)。在一些情况下,所述模板可包括特定的核苷酸种类,例如以所需间隔或在所需位置的鸟苷核苷酸,而延伸反应在未标记的三磷酸腺苷、胸苷和鸟苷以及标记的三磷酸胞嘧啶的存在下进行。这导致标记的胞嘧啶核苷酸周期性地掺入到延伸产物支架中。例如,通过包括在模板中的每第3、第4、第5等位置具有鸟苷核苷酸的模板,可以允许在保留组分的每第3、第4、第5等位置掺入标记的胞嘧啶。将要了解的是,可以根据分析的特定需要来选择掺入的标记的具体标记的核苷酸或周期性。在一些情况下,在这种合成之后,模板核酸可留在原位以提供亲和探针的双链标记部分,例如如本文别处所阐述。
在一些情况下,用于支架的模板可包括环状核酸,其中引物序列的延伸例如通过滚环扩增产生具有重复序列区段的延伸多联体。在任选的形式中,可以提供与结合组分偶联的模板序列。引物可以与模板杂交,并在标记和未标记的核苷酸存在下通过聚合延伸,以便产生包括如上所述的标记基团的第二缔合链。
在一些情况下,可以采用允许更有针对性地调整最终产物标记的探针的模块化形式来构建亲和试剂或可检测探针。例如,在一些情况下,例如适体或抗体的结合组分可作为未标记的文库来产生和维持。在这样的情况下,根据给定实验的所需标记方案,这些结合组分可以与用于将标记组分与结合组分偶联的附接区一起维持。这类附接区可包括化学偶联部分,例如NHS酯、“点击”化学组分(参见例如H.C.Kolb;M.G.Finn;K.B.Sharpless(2001),"Click Chemistry:Diverse Chemical Function from a Few Good Reactions"Angewandte Chemie International Edition.40(11):2004-2021),以及其他常规的化学偶联方法,其中所述标记组分包括任何必要的互补偶联部分。这种模块化的优点是可以使用相同或相似的保留组分很容易地形成多种不同的可检测探针或亲和试剂。因此,多种不同的可检测探针或亲和试剂可以在标记组分的数目、标记组分的种类、结合组分的数目和结合组分的种类中的一种或多种方面不同,同时具有共享共同结构特征的保留组分。共同结构特征可以是例如保留组分的大小、保留组分的形状、保留组分的化学组成、保留组分的核酸序列、保留组分中的折纸的三维结构、保留组分中的折纸中的支架的三维结构等。在一些配置中,多个不同的可检测探针可在于折纸结构中退火的订书钉寡核苷酸的数目、一个或多个订书钉寡核苷酸被退火到折纸结构中的支架链上的位置、被退火到折纸结构中的支架链上的一个或多个订书钉寡核苷酸的长度、被退火到折纸结构中的支架链上的一个或多个订书钉寡核苷酸的序列或折纸结构中的官能团的数目、类型或位置方面不同。
在一些情况下,结合组分可包括结合或偶联对的一个成员(例如受体),而标记组分包括结合或偶联对的互补成员(例如所述受体的配体)。例如,在一些情况下,结合组分可以与单链核酸序列偶联,而标记组分与具有与所述单链互补的序列的第二链偶联。在这样的情况下,可以通过标记结合的核酸链与结合组分结合的核酸链的杂交来进行偶联。将要了解的是,在适体结合组分的情况下,适体和标记偶联组分的产生可以以如下方式产生,采用例如单链探针和标记偶联组分的PCR扩增,接着在标记组分的杂交之前移除互补链。
在任何上述背景中,标记组分和保留组分可以与结合组分分开合成,或者具有附接的标记基团,或者作为官能化的保留组分,标记组分随后可以在与所述结合组分偶联之前或之后附接于其上。在基于核酸的保留组分的情况下,这类结构通常可通过熟知的固相核酸合成技术来合成,其中连续添加已知的核苷酸以构建多核苷酸结构,或通过支架序列的聚合酶链反应扩增。如所指出,这类过程可以在合成期间采用标记核苷酸的周期性引入,以便以所需形式构建多标记的探针。可替代地,可以在合成期间掺入修饰的核苷酸,其允许在合成后很容易地添加标记组分。
将单独合成的保留组分共价附接于另一组分(例如结合组分、标记组分或另一保留组分)可经由化学或生物化学方法完成,例如通过核酸支架与结合组分的化学偶联,例如采用已知的化学偶联技术,如点击化学,或通过生物化学方法,如核酸支架与结合组分的核酸组分连接。可替代地,保留组分可以通过与已经与结合组分偶联的互补核酸组分杂交而非共价附接于结合组分。图51示意性地示出了这种附接的实例。如所示,结合组分400包括附接于其上的核酸探针序列400b。然后将具有与探针序列400b互补的序列的单独合成的标记的核酸保留组分401与结合组分杂交以提供标记的亲和探针。
多种共价或非共价化学物质中的任一种均可用于附接或连接本文阐述的可检测探针或亲和试剂的组分。本文在将保留组分附接于其他组分的上下文中阐述的化学物质和方法也可用于将可检测探针或亲和试剂附接于其他物质,如结合配偶体(例如多肽)、表面、固体支持物、阵列的位点或颗粒。此外,化学物质和方法可用于合成保留组分、结合组分或标记组分,或向这类组分添加官能团或接头。
在采用基于多肽的结合组分例如抗体或抗体片段的一些配置中,偶联方法可用于通过将单个偶联基团掺入到给定的多肽而将仅单个标记组分与单个结合组分偶联。特别地,结合组分如抗体或抗体片段可提供有第一偶联柄或官能团,而单独的标记组分(或可以很容易标记的组分)提供有第二偶联柄或官能团,其与第一偶联部分反应或结合以实现结合组分与标记组分之间的附接。
此类方法的一个实例是SpyTag/SpyCatcher标记方法(参见例如Zakeri B,FiererJO,Celik E,Chittock EC,Schwarz-Linek U,Moy VT,Howarth M(2012年3月)."Peptidetag forming a rapid covalent bond to aprotein,through engineering a bacterialadhesin".Proceedings of the National Academy of Sciences of the United Statesof America.109(12):E690-7)。在此方法中,13个氨基酸的标签多肽(SpyCatcher)形成第一偶联柄,且12.3kDa的蛋白质(Spy Tag)形成另一个偶联柄。举例来说,Spy Catcher可以作为重组融合蛋白整合到第一组分(例如结合组分或标记组分)中。Spy Catcher组分通过异肽键与Spy Tag不可逆地结合,所述异肽键可以被荧光标记或以其他方式被标记以用于检测。将要了解的是,Tag或Catcher可以与第一组分整合。
在一些情况下,不同的组分可采用点击化学彼此附接。在具有核酸部分的组分的情况下,这些可采用连接和/或杂交来附接。在一些情况下,接头用于附接。接头的实例包括双链DNA、单链DNA或不同分子量的聚乙二醇。接头还可以包括允许生物缀合的官能团。
在一些情况下,附接可采用化学缀合、生物缀合、酶促缀合、光缀合、热缀合或其组合。(Spicer,C.D.,Pashuck,E.T.,&Stevens,M.M.,Achieving Controlled Biomolecule-Biomaterial Conjugation.Chemical Reviews.,2018,118,第7702-7743页,和GregT.Hermanson,“Bioconjugate Techniques”,Academic Press;第3版,2013,用于本公开的内容通过引用并入本文)。例如,生物缀合可用于在两个分子之间形成共价键,其中的至少一个是生物分子。在一些情况下,可检测探针或亲和试剂的两个彼此附接的组分可以被官能化。官能化两个配偶体可提高附接(例如缀合)反应的效率或速度。例如,适体、生物或化学实体的化学活性位点的巯基(-SH)或胺(-NH
附接可部分地通过化学部分或接头分子与生物分子或其他物质上的化学活性位点的化学反应来完成。化学缀合可经由酰胺形成反应、还原胺化反应、N-末端修饰、硫醇迈克尔加成反应、二硫化物形成反应、铜(I)催化的炔烃-叠氮化物环加成(CuAAC)反应、应变促进的炔烃-叠氮化物环加成反应(SPAAC)、应变促进的炔烃-硝酮环加成(SPANC)、逆电子需求狄尔斯-阿尔德(IEDDA)反应、肟/腙形成反应、自由基聚合反应或其组合进行。酶介导的缀合可经由转谷氨酰胺酶、过氧化物酶、分选酶、SpyTag-SpyCatcher或其组合进行。光缀合和活化可经由光丙烯酸酯交联反应、光硫醇-烯反应、光硫醇-炔反应或其组合进行。在一些情况下,附接或缀合可经由非共价相互作用进行,这些可以是通过自组装肽、结合序列、主体-客体化学、核酸或其组合进行。
在一些情况下,位点选择性方法可用于修饰可检测探针、亲和试剂或其组分的反应部分以增加附接效率、易用性和/或再现性。三种常用的策略可用于位点选择性附接,(i)可以在众多基序中选择单一基序而不是靶向一般官能团或部分的修饰策略。这可通过周围序列、局部环境或反应性的微细差异来确定。酶修饰蛋白质序列内的特定氨基酸或单个位置的聚糖的能力特别突出。表现出精细化学选择性的反应也属于这一类别,如针对蛋白质N-末端或聚糖的异头位置的独特反应性的那些。(ii)可以利用通过劫持天然生物合成途径来位点特异性掺入非天然官能团。(iii)可以利用经由化学合成安装独特的反应性。多肽和寡核苷酸的完全或部分合成很普遍,特别是采用固相方法。这些技术允许可及多达100个氨基酸或200个核苷酸的序列,并且能够以精确的位置控制安装广泛多种的官能化单体。
在一些情况下,化学缀合技术可应用于产生附接的物质,如生物材料-生物分子缀合物。用于附接的官能团对于要被修饰的物质(例如要被修饰的生物分子)可以是天然的,或者可以是合成掺入的。在下面的图示中,R和R’可以是生物分子(例如但不限于:SNAP、蛋白质、核酸如核酸折纸或核酸纳米球、碳水化合物、脂质、代谢物、小分子、单体、低聚物、聚合物)、亲和试剂、可检测探针、结合组分、标记组分、保留组分和/或固体支持物。
在一些情况下,还原胺化可用于附接,如经由生物缀合附接。胺可以与醛发生可逆反应,形成瞬时亚胺部分,伴随水的消除。此反应在快速平衡下发生,由于水的高浓度,未缀合的原料在水性条件下非常有利。然而,在第二步中,不稳定的亚胺可经由用氰基硼氢化钠处理不可逆地还原成相应的胺。这种温和的还原剂即使在未反应的醛的存在下也能选择性地还原亚胺。结果,生物分子或其他物质可逐渐发生与第二物质如所关注的生物材料的不可逆缀合。相比之下,更强的还原剂如硼氢化钠也能够还原醛。这种两步还原胺化过程也可用于酮的修饰。例如,还原胺化因此主要用于修饰高碘酸钠处理的海藻酸盐和壳聚糖支架。通过利用以开链形式产生的末端醛/酮也可以颠倒附接还原糖的反应性顺序。此策略例如可用于分别经由麦芽糖和乳糖的还原胺化模拟ECM中的天然胶原的葡糖基化和半乳糖基化模式。
在一些情况下,异硫氰酸酯可用于将物质彼此附接。例如,生物分子或固体支持物的异硫氰酸酯可用于生物缀合。异硫氰酸酯部分可以与亲核试剂如胺、巯基、酪氨酸侧链的酚酸根离子或其他分子反应,以在两个分子之间形成稳定的键。
在一些情况下,异氰酸酯可用于附接两种物质。例如,生物分子或固体支持物的异氰酸酯可用于生物缀合。例如,异氰酸酯可以与含胺分子反应,形成稳定的异脲键接。
在一些情况下,酰基叠氮化物可用于附接两种物质。例如,生物分子或固体支持物的酰基叠氮化物可用于生物缀合。例如,酰基叠氮化物是可以与伯胺反应形成酰胺键的活化羧酸酯基团。
在一些情况下,酰胺可用于附接两种物质。例如,生物分子或固体支持物的酰胺可用于生物缀合。例如,反应性N-羟基琥珀酰亚胺(NHS)酯的使用特别广泛。虽然NHS-酯可以预先形成,但通常它们反而是通过使用N-(3-(二甲氨基)丙基)-N’-乙基碳二亚胺(EDC)偶联化学原位产生的,并且直接与所关注的物质偶联。虽然在温和的酸性条件(pH~5)下有利于形成活化NHS-酯,但随后的酰胺偶联在较高pH下加速,其中胺偶联配偶体未被质子化。在~6.5的中间pH下进行一步修饰是可能的。附接通常是通过如下方式进行的,首先在pH 5下形成活性NHS-酯,之后将pH提高到~8,并按两步程序添加胺偶联配偶体。在一些情况下,水溶性衍生物磺基-NHS可用作替代物。在一些情况下,生物分子或其他物质的NHS酯可以与酪氨酸、丝氨酸和苏氨酸-OH基团反应并偶联,这与N-末端α-胺和赖氨酸侧链ε-胺相反。
在一些情况下,磺酰氯可用于附接两种物质。例如,生物分子或固体支持物的磺酰氯可用于生物缀合。例如,磺酰氯化合物与含伯胺的分子进行的反应损失氯原子并形成磺酰胺键接。
在一些情况下,甲苯磺酸酯可用于附接两种物质。例如,生物分子或固体支持物的甲苯磺酸酯可用于生物缀合。例如,包括甲苯磺酸酯的官能团可由4-甲苯磺酰氯(也称为甲基苯磺酰氯或TsCl)与羟基反应产生磺酰酯衍生物而形成。磺酰酯可与亲核试剂偶联以产生共价键,并且可产生与伯胺的仲胺键接、与巯基的硫醚键接或与羟基的醚键。
在一些情况下,羰基可用于附接两种物质。例如,生物分子或固体支持物的羰基可用于生物缀合。例如,羰基如醛、酮和乙二醛可以与胺反应形成与其游离形式平衡的席夫碱中间体。在一些情况下,向含有醛化合物和含胺分子的反应介质中添加硼氢化钠或氰基硼氢化钠将导致席夫碱中间体的还原和共价键形成,从而在两个分子之间产生仲胺键接。
在一些情况下,环氧化物或环氧乙烷可用于附接两种物质。例如,生物分子或固体支持物的环氧化物或环氧乙烷可用于生物缀合。例如,环氧化物或环氧乙烷基团可以在开环过程中与亲核试剂反应。可以与伯胺、巯基或羟基发生反应,分别产生仲胺、硫醚或醚键。
在一些情况下,碳酸酯可用于附接两种物质。例如,生物分子或固体支持物的碳酸酯可用于生物缀合。例如,碳酸酯可以与亲核试剂反应形成氨基甲酸酯键接,碳酸二琥珀酰亚胺酯可用于活化含羟基的分子以形成胺反应性碳酸琥珀酰亚胺酯中间体。在一些情况下,此碳酸酯活化程序可用于将聚乙二醇(PEG)与蛋白质及其他含胺分子偶联。在一些情况下,亲核试剂如蛋白质的伯氨基可以与碳酸琥珀酰亚胺酯官能团反应,得到稳定的氨基甲酸酯(脂肪族脲烷)键
在一些情况下,芳基卤可用于附接两种物质。例如,生物分子或固体支持物的芳基卤可用于生物缀合。例如,芳基卤化合物如氟苯衍生物可用于与含胺分子如蛋白质形成共价键。其他亲核试剂如硫醇、咪唑基和酚酸根基团也能反应形成稳定的键。在一些情况下,氟苯类型的化合物已被用作同型双官能交联剂中的官能团。例如,它们与胺的反应涉及氟原子与胺衍生物的亲核置换,产生取代的芳基胺键。
在一些情况下,亚氨酸酯可用于附接两种物质。例如,生物分子或固体支持物的亚氨酸酯可用于生物缀合。例如,蛋白质的α-胺和ε-胺可通过与同型双官能亚氨酸酯反应而被靶向和交联。在一些情况下,在两个蛋白质与双官能亚氨酸酯交联剂缀合后,过量的亚氨酸酯官能团可以被乙醇胺阻断。
在一些情况下,碳二亚胺可用于附接两种物质。例如,碳二亚胺可用于生物缀合。一般地,碳二亚胺是零长度交联剂,其分别可用于介导羧酸酯基团与胺或磷酸酯与胺之间的酰胺或氨基磷酸酯键接的形成。碳二亚胺是零长度试剂,因为在形成这些键时,没有在缀合分子之间引入另外的化学结构。在一些情况下,N-取代的碳二亚胺可以与羧酸反应形成高反应性的O-酰基异脲衍生物。然后此活性物质可以与亲核试剂如伯胺反应形成酰胺键。在一些情况下,巯基可以攻击活性物质并形成硫酯键接。在一些情况下,含酰肼的化合物也可利用碳二亚胺介导的反应与羧酸酯基团偶联。使用双官能酰肼试剂,羧酸酯可以被修饰以具有能够与其他羰基化合物缀合的末端酰肼基团。
在一些情况下,磷酸酯可用于附接两种物质。例如,含有磷酸酯基团的生物分子如寡核苷酸的5′磷酸酯或多肽的磷酸化氨基酸也可以通过利用碳二亚胺介导的反应与含胺分子缀合。例如,生物分子的碳二亚胺可以将磷酸酯活化为类似于其与羧酸酯反应的中间磷酸酯。
在胺的存在下,酯反应形成稳定的氨基磷酸酯键。
在一些情况下,酸酐可用于附接两种物质。例如,生物分子或固体支持物的酸酐可用于生物缀合。酸酐对亲核试剂具有高度反应性,并且能够酰化蛋白质及其他分子的许多重要官能团。例如,能够与酸酐反应的蛋白质官能团包括但不限于N-末端的α-胺、赖氨酸侧链的ε-胺、半胱氨酸巯基、酪氨酸残基的酚酸根离子和组氨酸的咪唑基环。在一些情况下,蛋白质分子中的酸酐的反应性的位点是任何附接的碳水化合物链的修饰。在一些情况下,除了多肽链中的氨基修饰之外,糖蛋白也可以在其多糖羟基处被修饰以形成酯化的衍生物。
在一些情况下,氟苯基酯可用于附接两种物质。例如,生物分子或固体支持物的氟苯基酯可用于生物缀合。氟苯基酯可以是可与胺反应的另一种类型的羧酸衍生物,由氟苯酚化合物的酯组成,其产生能够与蛋白质及其他分子形成酰胺键的基团。在一些情况下,氟苯基酯可以是:五氟苯基(PFP)酯、四氟苯基(TFP)酯或磺基-四氟苯基(STP)酯。在一些情况下,氟苯基酯与含胺分子在略微碱性的pH值下反应,得到与NHS酯相同的酰胺键接。
在一些情况下,羟甲基膦可用于附接两种物质。例如,生物分子或固体支持物的羟甲基膦可用于生物缀合。具有羟甲基取代的膦衍生物可作为附接剂用于偶联或交联目的。例如,三(羟甲基)膦(THP)和β-[三(羟甲基)膦基]丙酸(THPP)是小的三官能化合物,其与亲核试剂如胺自发地反应形成共价键接。
在一些情况下,硫醇可用于附接两种物质。例如,生物分子或固体支持物的硫醇反应性可用于生物缀合。例如,半胱氨酸的硫醇基团是20种蛋白原氨基酸中发现的最亲核的官能团。通过小心地控制pH,可以很容易地实现对其他亲核氨基酸残基如赖氨酸的选择性修饰。另一实例,寡核苷酸的硫醇修饰可用于实现衍生化,然而可以安装具有增强的化学正交性的替代官能团的容易程度限制了用于生物材料缀合的用途。进一步地,也称为迈克尔加成的硫醇与α,β-不饱和羰基的共轭加成可用于在组织工程化、功能材料和蛋白质修饰领域中形成多肽缀合物。一般来说,反应速率和缀合效率主要由三个因素控制,并且可以根据需要进行修改:(i)硫醇的pK
在一些情况下,可以利用硫醇的独特亲核性与许多替代亲电试剂进行选择性反应,其允许实现有效和选择性的附接。例如,一个这样的基团包括α-卤代羰基,基于碘乙酰胺的试剂特别有用。使用亲电性较低的溴代甚至氯代衍生物可实现更高的硫醇选择性,尽管反应性也大为降低。最近,甲基磺酰基杂芳族衍生物已成为用于硫醇特异性缀合的有前途的试剂。在其他情况下,替代的硫醇官能团如二硫化物桥联的哒嗪二酮、羰基丙烯酸试剂和环丙烯基酮可用于生物缀合。
在一些情况下,巯基可用于附接两种物质。例如,生物分子或固体支持物的巯基可用于生物缀合。在一些情况下,三种形式的活化卤素衍生物可用于产生巯基反应性化合物:卤代乙酰基、苄基卤和烷基卤。在这些化合物中的每一者中,卤素基团可以很容易地被攻击性亲核物质置换,形成失去HX的烷基化衍生物(其中X是卤素,且氢来自亲核试剂)。卤代乙酰基化合物和苄基卤通常是碘或溴衍生物,而卤代芥主要呈氯和溴形式。碘乙酰基也已成功地用于将亲和配体与色谱载体偶联。
在一些情况下,马来酰亚胺可用于附接两种物质。例如,生物分子或固体支持物的马来酰亚胺可用于生物缀合。马来酰亚胺的双键可经历与巯基的烷基化反应,形成稳定的硫醚键。
在一些情况下,氮丙啶可用于附接两种物质。例如,生物分子或固体支持物的氮丙啶可用于生物缀合。这种杂环的高度受阻性质使其对亲核试剂反应性强。例如,巯基将在开环过程中与含氮丙啶的试剂反应,形成硫醚键。最简单的氮丙啶化合物乙烯亚胺可用于将可用的巯基转化为胺。在一些情况下,取代的氮丙啶可用于形成同型双官能和三官能交联剂。
在一些情况下,硫醇-马来酰亚胺反应对于在低浓度下或当由于生物分子底物的价值而需要极高效率时进行缀合是特别有用的。通过用双官能试剂琥珀酰亚胺基4-(N-马来酰亚胺甲基)环己烷-1-甲酸酯(通常简称为SMCC)对胺进行修饰,马来酰亚胺被引入到广泛材料中的容易程度进一步增强了它们用于附接的用途。例如,此试剂已广泛用于在选择的生物材料上引入马来酰亚胺官能团,然后使肽和生长因子两者能够附接以产生生物活性支架。
在一些情况下,丙烯酰可用于附接两种物质。例如,生物分子或固体支持物的丙烯酰可用于生物缀合。反应性双键能够与巯基经历另外的反应。在一些情况下,丙烯酰化合物与巯基发生反应,产生稳定的硫醚键。在一些情况下,丙烯酰可用于设计巯基反应性荧光探针6-丙烯酰基-2-二甲基氨基萘。
在一些情况下,芳基可用于附接两种物质。例如,生物分子或固体支持物的芳基可用于与巯基的生物缀合。虽然芳基卤常用于修饰含胺分子以形成芳基胺衍生物,但它们也可相当容易与巯基发生反应。例如,氟苯类型的化合物已被用作同型双官能交联剂中的官能团。它们与亲核试剂的反应涉及双分子亲核取代,导致氟原子被巯基衍生物置换,并产生取代的芳基键。与巯基形成的缀合物通过用过量的硫醇(如DTT)切割而是可逆的。
在一些情况下,二硫化物可用于附接两种物质。例如,生物分子或固体支持物的二硫化物基团可用于生物缀合。在一些情况下,含有二硫化物基团的化合物能够参与与另一种硫醇的二硫化物交换反应。二硫化物交换(也称为互换)过程涉及硫醇在二硫化物处的攻击,破坏了-S-S-键,随后形成包括一部分原始二硫化物化合物的新的混合二硫化物。使用含硫醇的还原剂将蛋白质中的二硫化物基团还原为巯基是通过混合二硫化物的中间形成进行的。在一些情况下,交联或修饰反应可利用二硫化物交换过程与含巯基的分子形成二硫键接。
在一些情况下,二硫键可用于附接,如生物缀合。例如,利用二硫化物交换反应可能有利于修饰所关注的多肽。组织工程化中最常用的试剂是基于反应性吡啶基硫代-二硫化物,其经历快速的硫醇-交换以释放亲核性及光谱活性差的2-巯基吡啶。另外,由于二硫键形成的可逆性,可以通过添加还原剂如二硫苏糖醇(DTT)或谷胱甘肽以时间精度控制切割。
在一些情况下,吡啶基二硫醇可用于附接两种物质。例如,吡啶基二硫醇官能团可用于构建用于生物缀合的交联剂或修饰试剂。吡啶基二硫化物可由分子上的可用伯胺通过2-亚氨基硫杂环戊烷与4,4′-联吡啶二硫化物串联的反应产生。例如,蛋白质或其他分子、2-亚氨基硫杂环戊烷和4,4′-联吡啶二硫化物之间的同时反应在单个步骤中产生含有反应性吡啶基二硫化物基团的修饰。吡啶基二硫化物将很容易经历与游离巯基的交换反应,产生单一的混合二硫化物产物。
在一些情况下,用离去基团5-硫代-2-硝基苯甲酸活化的巯基可用于通过如本文所述类似于吡啶基二硫化物的二硫化物交换偶联游离的硫醇。埃尔曼试剂的二硫化物容易经历与游离巯基的二硫化物交换,形成混合的二硫化物,同时释放一个分子的显色物质5-硫离子基-2-硝基苯甲酸盐,也称为5-硫代-2-硝基苯甲酸(TNB)。TNB-硫醇基团可再次经历与含巯基的靶分子的交换,产生二硫化物交联。在与巯基化合物偶联后,TNB基团被释放。
在一些情况下,二硫化物还原可使用含硫醇的化合物进行,如TCEP、DTT、2-巯基乙醇或2-巯基乙胺。
在一些情况下,乙烯基砜可用于附接两种物质。例如,生物分子或固体支持物的乙烯基砜基团可用于生物缀合。例如,硫醇与活化的乙烯基砜进行迈克尔加成以形成生物分子-材料缀合物已被用于证明半胱氨酸封端的肽可交联乙烯基-砜官能化的多臂PEG以形成蛋白酶反应性水凝胶,使得在组织生长期间细胞能够侵入。在一些情况下,除了硫醇之外,乙烯基砜基团也可在较高pH条件下与胺和羟基反应。硫醇与乙烯基砜反应的产物给出单一的立体异构体结构。此外,含有乙烯基砜的交联剂和修饰试剂可用于将表面或分子活化成含有硫醇反应性基团。
在一些情况下,含硫醇的分子可以与金属离子和金属表面相互作用以形成用于生物缀合的配价键。在一些情况下,含氧和含氮的有机或生物分子可用于螯合金属离子,如在各种镧系元素螯合物、双官能金属螯合化合物和FeBABE中。此外,蛋白质中的氨基酸侧链和假基团经常通过配位金属离子作为活性中心的一部分形成生物无机基序。
在一些情况下,硫醇有机化合物可常规地用于包衣金属表面或颗粒以形成生物相容层或产生用于进一步缀合诸如生物分子的物质的官能团。例如,含硫醇的脂族/PEG接头已被用于在平面金表面和颗粒上形成自组装的单层(SAM)。
在一些情况下,许多替代偶联系统可用于物质之间的附接或生物分子官能化。这些包括使用O-硝基苯基酯(其在水性条件下具有降低的稳定性)或1,1′-羰基二咪唑(CDI)以形成胺桥联的氨基甲酸酯键接而不是酰胺。在EDC/NHS介导的偶联期间,也可以使用肼代替胺。在pH 5-6下,肼官能化的肽可以在一个步骤中与生物材料偶联。这样做可以实现对存在的赖氨酸残基的一定程度的位点选择性。
在一些情况下,生物分子的N-末端修饰可用于生物缀合。例如,2-吡啶甲醛修饰的丙烯酰胺水凝胶可以与ECM蛋白质的N-末端特异性反应,与相邻的酰胺键形成环状咪唑烷酮产物,并实现这些关键生物指导性基序的定向展示。
在一些情况下,诸如生物分子或固体支持物的物质的丙烯酸酯、丙烯酰胺和甲基丙烯酸酯可用于附接。在一些情况下,诸如生物分子或固体支持物的物质的硫炔可用于生物缀合。
在一些情况下,硫醇反应性缀合如天然化学连接(NCL)可用于经由肽键形成附接物质,例如将肽和蛋白质附接于生物材料支架。例如,具有C-末端硫酯的肽与另一个肽中的N-末端半胱氨酸残基反应,以经历反式硫酯化反应,这导致与半胱氨酸硫醇形成中间硫酯。
在一些情况下,(链霉)亲合素与小分子生物素的强结合可用于附接。在一些情况下,(链霉)亲合素可附接于第一物质,且生物素可附接于第二物质,使得所述物质可经由(链霉)亲合素与生物素的结合而附接。在一些情况下,修饰试剂可以将官能性生物素基团添加至蛋白质、核酸及其他分子。在一些情况下,根据生物素化化合物上存在的官能团,可以修饰抗体或其他蛋白质上的特定官能团以产生(链霉)亲合素结合位点。通过适当选择生物素衍生物,可以使胺、羧酸酯、巯基和碳水化合物基团特异性靶向生物素化。在一些情况下,光反应性生物素化试剂用于将生物素基团非选择性地添加至不含用于修饰的方便官能团的分子。在一些情况下,生物素结合蛋白可以被固定在表面、色谱载体、微颗粒和纳米颗粒上,用于偶联生物素化的分子。在一些情况下,可以彼此建立起一系列(链霉)亲合素-生物素相互作用,以利用每个四聚体(链霉)亲合素分子的多价性质,并增强对靶标的检测能力。在一些情况下,可含有脱离生物素的戊酸侧链的官能团的胺反应性生物素化试剂能够与蛋白质及其他分子中的伯胺形成共价键。在一些情况下,NHS酯自发地与胺反应形成酰胺键接,而含羧酸酯的生物素化合物可使用EDC经由碳二亚胺介导的反应与胺偶联。在一些情况下,NHS-亚氨基生物素可用于用亚氨基生物素标签标记含胺分子,从而提供与亲合素或链霉亲和素的可逆结合潜力。在一些情况下,磺基-NHS-SS-生物素(也称为NHS-SS-生物素)是磺基琥珀酰亚胺基-2-(生物素酰氨基)乙基-1,3-二硫代丙酸酯,是可用于修饰含胺蛋白质及其他分子的长链可切割生物素化试剂。在一些情况下,1-生物素酰氨基-4-[4′-(马来酰亚胺甲基)环己烷-甲酰氨基]丁烷是在延伸的间隔臂端部含有马来酰亚胺基团的生物素化试剂,与蛋白质及其他分子中的巯基反应,形成稳定的硫醚键接。在一些情况下,N-[6-(生物素酰氨基)己基]-3′-(2′-吡啶基二硫代)丙酰胺,其中所述试剂含有附接于生物素的戊酸侧链的1,6-二氨基己烷间隔基团,间隔子的末端氨基可经由与SPDP的酸前体的酰胺键接被进一步修饰,以产生末端巯基反应性基团。生物素-HPDP的吡啶基二硫化物端部可与蛋白质及其他分子中的游离硫醇基团反应以形成二硫键,同时失去吡啶-2-硫酮。
在一些情况下,羧酸酯可用于附接两种物质。例如,生物分子或固体支持物的羧酸酯可用于生物缀合。在一些情况下,重氮甲烷及其他重氮烷基衍生物可用于标记羧酸酯基团。在一些情况下,N,N′-羰基二咪唑(CDI)可用于在非水条件下与羧酸反应,形成高反应性的N-酰基咪唑。活性羧酸酯可然后与胺反应形成酰胺键,或与羟基反应形成酯键接。此外,用CDI活化苯乙烯/4-乙烯基苯甲酸共聚物可用于将酶溶菌酶或其他分子通过其可用的氨基固定到基质上的羧基上。
在一些情况下,碳二亚胺充当零长度交联剂,其能够活化用于与含胺化合物偶联的羧酸酯基团以用于附接。在一些情况下,碳二亚胺用于介导羧酸酯与胺或磷酸酯与胺之间形成酰胺或氨基磷酸酯键接。
在一些情况下,N,N′-二琥珀酰亚胺碳酸酯或N-羟基琥珀酰亚胺氯甲酸酯可用于例如经由生物缀合附接物质。N,N′-二琥珀酰亚胺碳酸酯(DSC)由实质上含有两个NHS酯的羰基组成。该化合物对亲核试剂具有高反应性。在水溶液中,DSC将水解形成两个分子的N-羟基琥珀酰亚胺(NHS),同时释放一个分子的CO2。在非水环境中,该试剂可用于将羟基活化为琥珀酰亚胺碳酸酯衍生物。DSC活化的羟基化合物可用于与含胺分子缀合,形成稳定交联的产物。
在一些情况下,高碘酸钠可用于氧化相邻碳原子上的羟基,形成适用于与含胺或酰肼的分子偶联的反应性醛部分,以用于例如经由生物缀合进行附接。例如,这些反应可用于在碳水化合物或糖蛋白中产生交联位点,用于随后通过还原胺化缀合含胺分子。
在一些情况下,酶可用于氧化含羟基的碳水化合物,以产生用于生物缀合的醛基团。例如,末端半乳糖或N-乙酰基-d-半乳糖部分上的半乳糖氧化酶进行反应,在多糖链上形成C-6醛基团。这些基团可然后用于与含胺或酰肼的分子的缀合反应。
在一些情况下,反应性烷基卤素化合物可用于特异性地修饰用于附接的碳水化合物、聚合物及其他物质中的羟基。
在一些情况下,醛或酮可用于附接两种物质。例如,生物分子或固体支持物的醛或酮可用于生物缀合。例如,肼的衍生物,特别是由羧酸酯基团形成的酰肼化合物,可以与靶分子中的醛或酮官能团特异性反应。为了进一步稳定酰肼与醛之间的键,可以使腙与氰基硼氢化钠反应,以还原双键并形成稳固的共价键接。
在一些情况下,氨氧基可用于附接两种物质。例如,生物分子或固体支持物的氨氧基可用于生物缀合。例如,在醛基团与氨氧基之间发生的化学选择性连接反应产生肟键接(醛肟),其已经用于许多生物缀合反应,以及配体与包括表面的不溶性支持物的偶联。此反应对于酮来说也相当有效,形成称为酮肟的肟。
在一些情况下,环加成反应可用于附接,如经由生物缀合附接。在环加成反应中,两个或更多个不饱和分子聚集在一起形成不饱和度降低的环状产物,这些反应配偶体通常不存在于天然系统中,因此采用环加成进行缀合利用了在偶联配偶体内引入非天然官能团。
在一些情况下,铜催化的叠氮化物-炔烃环加成(CuAAC)可用于附接两种物质。例如,CuAAC可用于生物缀合。在一些情况下,叠氮化物与炔烃之间的(3+2)环加成在高温(>90℃)下自发进行,产生两种三唑异构体的混合物。在一些情况下,此反应在室温、环境、充氧和/或含水环境下进行。在一些情况下,例如使用炔烃封端的肽,通过CuAAC形成肽-物质缀合物,从而形成具有叠氮化物官能化的PEG的水凝胶。在一些情况下,为了经由CuAAC实现缀合,铜(I)催化剂可以直接添加,或者通过还原初始的铜(II)络合物原位产生,最通常是使用抗坏血酸。添加还原剂进一步降低了CuAAC连接对氧的敏感性。虽然三唑形成不需要另外的配体,但可以采用添加基于叔胺的配体。
在一些情况下,应变促进的叠氮化物-炔烃环加成(SPAAC)可用于附接两种物质。SPAAC可用于生物缀合。在一些情况下,高度应变的环辛炔在生理条件下很容易与叠氮化物反应形成三唑,而不需要添加任何催化剂。在一些情况下,除了使用SPAAC进行肽缀合之外,许多重要的报道还使用SPAAC,经由将非天然叠氮化物基序引入到蛋白质偶联配偶体中来将蛋白质底物附接于环辛炔官能化的生物材料。在一些情况下,例如这是经由酶介导的IFN-γ的N-末端修饰,或经由在许多蛋白质底物中用非天然氨基酸4-叠氮基苯丙氨酸进行密码子再分配,通过包括存在于骨形态发生蛋白-2(BMP-2)中的天然半胱氨酸的马来酰亚胺官能化来实现的。在一些情况下,超分子主体-客体相互作用也可用于促进叠氮化物-炔烃环加成。例如,通过使两个反应性配偶体在葫芦[6]脲主体的腔内紧密接近,可以在蛋白质的表面上实现有效的环加成,此策略可以扩展到其他适当的分子。
在一些情况下,逆电子需求狄尔斯-阿尔德反应(Diels-Alder reactions,IEDDA)可用于附接,如经由生物缀合附接。例如,可以采用1,2,4,5-四嗪与应变烯烃或炔烃之间的IEDDA反应。已经报道了用于进行分子缀合的广泛的合适衍生物,例如可以利用一系列应变越来越增加的(并且因此是反应性的)反式环辛烯。在一些情况下,官能化的降冰片烯衍生物可用于进行IEDDA反应。在一些情况下,可以利用三嗪。在一些情况下,可以利用螺己烯。这些策略可以扩展到其他适当的分子。在一些情况下,马来酰亚胺和呋喃的杂狄尔斯-阿尔德环加成可用于附接。例如,可以利用呋喃官能化的RGDS肽与马来酰亚胺官能化的PEG-水凝胶的偶联,此策略可以扩展到其他适当的分子。在一些情况下,呋喃官能化的透明质酸水凝胶可以经由狄尔斯-阿尔德环加成与二马来酰亚胺官能化的肽交联。
在一些情况下,肟和腙可用于附接两种物质。例如,肟和腙形成可用于生物缀合。在一些情况下,经由双官能交联可以实现经由腙形成将肽和DNA稳定地附接于生物材料,此策略可以扩展到其他适当的分子。例如,蛋白质交联的水凝胶可以通过蛋白质N-和C-末端的肟修饰来产生。
在一些情况下,狄尔斯-阿德尔反应由二烯与烯烃共价偶联以形成用于附接的六元环复合物组成。
在一些情况下,过渡金属络合物可用于附接,如经由生物缀合附接。后过渡金属的性质可以使过渡金属络合物非常适合处理不饱和且可极化的官能团(烯烃、炔烃、芳基碘、芳基硼酸等)。例如,Pd(0)-官能化的固体支持物可以介导细胞质中的氨基甲酸烯丙酯脱保护和铃木-宫浦交叉偶联。在其他实例中,钌催化剂可用于介导活细胞内部的笼状荧光团的氨基甲酸烯丙酯脱保护。在一些情况下,基于钯的应用在细胞培养中的应用包括无铜Sonagashira偶联、大肠杆菌细胞的表面上的细胞外铃木偶联和硫醇基团与烯丙基硒代硫酸盐的缀合。在一些情况下,烯烃复分解可用于生物缀合。例如,用钌络合物,S-烯丙基半胱氨酸可以通过多种方法很容易地被引入到蛋白质中,包括烯丙基硫醇与脱氢丙氨酸的共轭加成、半胱氨酸的直接烯丙基化、烯丙基二硫化物的脱硫或在甲硫氨酸营养缺陷型大肠杆菌中代谢掺入作为甲硫氨酸的替代物。
在一些情况下,与硼酸衍生物形成复合物可用于附接物质,例如经由生物缀合。例如,硼酸衍生物能够与具有由1,2-或1,3-二醇、1,2-或1,3-羟基酸、1,2-或1,3-羟胺、1-2-或1,3-羟基酰胺、1,2-或1,3-羟基肟组成的相邻官能团的其他分子以及含有这些物质的各种糖或生物分子形成环结构。
在一些情况下,酶介导的缀合可用于附接物质。例如,转谷氨酰胺酶家族催化赖氨酸侧链的伯胺与互补谷氨酰胺残基的酰胺键之间的异肽键的形成,此策略可以扩展到其他适当的分子。在其他情况下,过氧化物酶介导的缀合可用于缀合。例如,辣根过氧化物酶(HRP)可用于氧化广泛的有机底物如酪氨酸的酚基,以产生高度反应性自由基或醌中间体,其经历自发的二聚化,导致在两个酪氨酸残基之间形成邻位碳-碳键,此策略可以扩展到其他适当的分子。在一些情况下,短肽标签可用于生物缀合。这些肽标签的长度可以短至5个氨基酸,并且可以附着于允许对其进行后续修饰的多肽。
在一些情况下,低分子量单体的聚合可用于附接物质,例如经由生物缀合。聚合可以被归类为经由两种机制之一进行,即链增长或逐步增长。在链增长聚合期间,单体在增长聚合物链的“活性”端添加,导致即使在低转化率的情况下也形成高分子量物质。在逐步增长聚合期间,短的低聚物链偶联形成聚合物质,为了达到高分子量需要高转化率。这两种技术均可用于形成缀合物,如生物分子-聚合物缀合物。丙烯酸酯和甲基丙烯酸酯单体的聚合已被证明特别有成效。例如,丙烯酸酯和甲基丙烯酸酯修饰的蛋白质可以很容易地聚合。类似地,由于合成寡核苷酸亚磷酰胺构建块“Acrydite”的可用性,自由基聚合仍然是通过其形成DNA和RNA官能化物质的最常用的方法之一。通过在共聚单体的存在下进行聚合,可以很容易调整分子呈现的密度,从而允许克服空间位阻带来的潜在困难。聚合的引发可以通过多种方式触发,包括热、UV和可见光、氧化还原反应和电化学。丙烯酸酯修饰的蛋白质也可以经历聚合以产生官能性物质,同时保留生物活性。在一些情况下,活性自由基聚合(LRP)可用于生物缀合。例如,最常用于形成生物缀合物的LRP包括原子转移自由基聚合(ATRP)、可逆加成-断裂链转移(RAFT)聚合和氮氧介导的聚合(NMP)。
在一些情况下,光缀合可用于附接物质,例如经由生物缀合。在一些情况下,聚合由自由基物质的产生引发,自由基物质然后通过键形成传播以产生活性聚合物链。可以通过多种刺激来诱导引发步骤,其中最常见的是引发物质的热分解、氧化还原活化和电化学电离。可替代地,许多引发剂可经由光诱导的光解键断裂(I型)或自共引发剂光活化的提取质子(II型)来活化。光引发提供的益处是适用于很宽的温度范围、使用取决于所用引发剂的窄且可调的激活波长、快速产生自由基并且能够通过移除光源来控制聚合。重要的是,聚合对氧的耐受性大大增强,从而使得能够在细胞和组织的存在下进行聚合。在光聚合期间掺入丙烯酸酯官能化的肽和蛋白质可用作产生生物材料缀合物的方法。可替代地,也已经广泛报道了光引发的多肽附接于预先形成的物质上的悬垂乙烯基,并且最近用于经由双光子激发的3D图案化。广泛多种光引发剂可用于光缀合缀合。例如但不限于曙红Y、2,2-二甲氧基-2-苯基-苯乙酮、Igracure D2959、苯基-2,4,6-三甲基苯甲酰基亚膦酸锂和核黄素可用作光引发剂。光引发剂通常吸收光以引发光反应过程。在一些情况下,光缀合可利用光硫醇-烯反应。硫醇也可经由自由基机制与烯烃反应。硫醇自由基首先与烯烃反应,产生以碳为中心的自由基,其可然后自另一个硫醇提取质子,从而传播反应。富电子的烯烃可以加速光硫醇-烯反应,这产生能够快速提取硫醇-氢的不稳定的碳-自由基中间体。此规则的例外是降冰片烯衍生物,其中反应性反而是通过在硫醇加成后释放环张力驱动的。这导致反应性的总体趋势是降冰片烯>乙烯基醚>丙烯基>烯丙基醚>丙烯酸酯>马来酰亚胺。降冰片烯和烯丙氧基羰基(alloc基团)已经特别广泛地用于肽/蛋白质-生物材料官能化,这分别是由于链转移的贡献几乎可以忽略不计以及它们在肽合成期间引入的容易性。例如,通常在固相肽合成期间用作正交赖氨酸保护基团的alloc基团是有效的光硫醇-烯官能团。在其他实例中,降冰片烯光硫醇-烯反应可用于生物活性肽和生长因子蛋白的束缚和空间图案化。除了最常用的alloc和降冰片烯官能团之外,其他烯烃也已用于生物材料官能化。例如,密码子再分配已经用于位点特异性地将烯丙基-半胱氨酸残基掺入到蛋白质中,其可随后通过利用光硫醇-烯反应经历缀合。可替代地,丙烯酸酯可以在半胱氨酸封端肽的存在下经历混合模式光聚合,而烯丙基二硫化物结构最近被证明经历缀合硫醇的可逆和受控交换。
在一些情况下,芳基叠氮化物或卤化芳基叠氮化物可用于附接物质。
在一些情况下,光反应性基团如二苯甲酮可用于附接物质。
在一些情况下,光反应性基团蒽醌可用于附接物质,如经由生物缀合的附接。在一些情况下,光硫醇-炔反应可用于附接物质,如经由生物缀合的附接。大多数光硫醇-炔反应的实例都利用简单的炔丙基-醚或-胺官能团。
在一些情况下,反应性官能团的光笼化和活化可用于附接物质,如经由生物缀合的附接。一般地,形成瞬态反应性物质,无论其是丙烯酸酯还是硫醇衍生的自由基。在一些情况下,光笼化可用于掩蔽或保护官能团,直到期望将其暴露。在一些情况下,最广泛利用的笼是基于邻硝基苄基和香豆素发色团。例如,硝基苄基封端的半胱氨酸残基可通过325nmUV光辐照而脱笼,释放的硫醇可然后经由迈克尔加成与马来酰亚胺官能化的肽反应,产生能够引导细胞迁移的图案化水凝胶。在一些情况下,6-溴-羟基香豆素可用于硫醇笼化。在一些情况下,光亲和探针可用于生物缀合,其中高反应性的中间体经辐照,然后以高空间精度与最近可及的官能团快速反应。在一些情况下,最常用的是苯基叠氮化物、二苯甲酮和苯基-双吖丙啶。在一些情况下,可以采用光笼化环加成。例如,已证明四唑的UV辐照产生反应性腈-亚胺中间体,其可经历与缺电子烯烃如丙烯酸酯或丙烯酰胺的快速环加成。在一些情况下,腈-亚胺与硫醇的副反应性可用于含有半胱氨酸的蛋白质与四唑官能化表面的位点特异性缀合。
在一些情况下,非共价相互作用可用于附接物质,如经由生物缀合的附接。在一些情况下,对所关注的生物分子表现出结合亲和力的非共价序列允许制作后修饰或天然生物分子与生物样品内的环境简单隔绝。有用的结合序列是来自于多种来源的长度在7个与20个之间的氨基酸的短肽,包括体内存在或通过诸如噬菌体展示的技术确定的已知蛋白质结合结构域。在一些情况下,适体还可用于结合多种蛋白质底物,包括细胞因子血管内皮生长因子(VEGF)和血小板源性生长因子(PDGF)以及细胞表面蛋白如表皮生长因子受体(EGFR)。在一些情况下,还可以将结合序列引入到对天然生物聚合物如肝素具有亲和力的生物材料中。在一些情况下,通过首先诱导生物聚合物结合,然后可以控制添加的或内源性的生长因子或信号传导蛋白对生物材料支架的吸附。在一些情况下,也可以利用在氨基酸水平下的结合亲和力,以使得肽和蛋白质能够与某些生物材料底物缀合。例如,非天然的基于儿茶酚的氨基酸的结合可用于诱导与含有金属氧化物的生物玻璃和金属植入物的结合,使得能够增强这些重要技术的生物活性。
在一些情况下,自组装肽可用于附接物质,如经由生物缀合的附接。例如,天然肽和蛋白质采用一系列二级结构,包括β-折叠和α-螺旋,它们既可以稳定个别序列,又可以控制蛋白质间聚集。在一些情况下,自组装肽已被广泛用于组装水凝胶和纤维材料。在这些结构中的许多结构中,生物学表位或官能团可以在肽合成期间附着于一些或所有的肽构建块,以向系统中增加所需的生物活性。从简单的粘附基序到层粘连蛋白源性表位的肽-配体和生长因子模拟物都已经展示在自组装原纤维的表面上。可替代地,可以组装糖肽,以便募集细胞外信号传导蛋白和生长因子、模拟透明质酸内的糖基化模式或研究糖胺聚糖支架中的最佳磺化比率。在一些情况下,也可以将自组装结构域添加到全长蛋白质中,导致在水凝胶形成期间掺入悬垂官能团。在一些情况下,肽形成二级结构的倾向也已经在非自组装支架内得到利用。这可以通过将自组装肽混合到共价水凝胶中来实现,所述共价水凝胶由例如在带正电荷的肽与带负电荷的藻酸盐凝胶之间的非相互作用聚合物如PEG的互穿网络或其中另外的电荷相互作用进一步稳定最终构造的系统组成。作为替代方案,悬垂螺旋基团可附接于共价物质,并用于通过自组装成盘绕卷三螺旋来驱动生物活性基团如生长因子的非共价附接。
在一些情况下,主体-客体化学可用于附接物质,如经由生物缀合的附接。例如,β-环糊精修饰的藻酸盐支架的粘附特性可以通过添加客体萘基官能化的RGDS肽并通过随后引入具有较高主体结合常数的非细胞粘附金刚烷-RGES肽来原位控制,使得能够动态调节成纤维细胞附接。环糊精与萘基或金刚烷官能化的肽之间的主体-客体相互作用允许藻酸盐官能化,这可应用于其他适当的分子。
在一些情况下,核酸可用于附接物质,如经由生物缀合的附接。在一些情况下,以与自组装肽类似的方式,核酸本身也可以形成组装的物质,以产生用于分子展示的可调平台。在一些情况下,带DNA标签的多肽可以与适当官能化的物质缀合。
一般地,掺入官能团可用于附接物质。例如,将独特反应性基序引入到分子中提供了允许实现单位点选择性或特异性的化学“标签”。在一些情况下,可经由固相合成(SPS)产生多肽或核酸。有机合成的多功能性允许克服官能团掺入的困难,如本文所述可用广泛的适当官能化的氨基酸和核苷酸。在一些情况下,替代方法是引入带有所需官能团的非天然氨基酸(UAA)。这可经由用胺反应性衍生物修饰赖氨酸残基来实现。在一些情况下,使用无法生物合成特定氨基酸的营养缺陷型细菌菌株,因此需要自生长培养基摄取。通过使细菌缺乏天然氨基酸并补充结构相关的非天然类似物,可以诱导细菌细胞在翻译期间掺入UAA。此技术可用于安装甲硫氨酸的基于叠氮化物和炔烃的模拟物,从而导致引入用于进行CuAAC和SPAAC反应的官能团。在一些情况下,密码子再分配的采用使用正交tRNA和tRNA合成酶对,其在翻译期间选择性地识别并装载UAA。在一些情况下,这可通过将来自替代界的tRNA
组合物和试剂盒
可以形成组合物或试剂盒,包括如本公开中所述的可检测探针或亲和试剂。下面在组合物的背景下阐述若干配置。将要理解的是,可以类似地配置试剂盒。组合物可包括一个或多个可检测探针或亲和试剂连同溶液或溶剂及其他构成组分。可检测探针或亲和试剂组合物的具体配制可取决于所述可检测探针或亲和试剂的预期用途和所述组合物中的可检测探针或亲和试剂的具体组成。可基于若干因素配制组合物,包括:1)可检测探针或亲和试剂的稳定性和储存要求;2)所述可检测探针或亲和试剂的特性和/或特征;和3)所述可检测探针或亲和试剂的使用方式。稳定性和/或储存考虑因素可包括维持保留组分、结合组分和/或标记组分稳定性的条件。特性或特征考虑因素可包括亲和力和/或亲合力特征、探针解离和标记组分特征。使用方式考虑因素可包括检测方法、多重使用和次级结合相互作用。
一般来说,组合物可包括液体介质中的一个或多个可检测探针或亲和试剂。在一些配置中,所述液体介质可以是水性的或另外包括水。在一些配置中,所述液体介质可包括非水溶剂,如极性溶剂或非极性溶剂。液体介质可包括pH缓冲溶液。pH缓冲溶液可以被配制为将溶液pH维持在所需范围内,例如维持保留组分或结合组分的稳定性或调节结合组分结合相互作用的强度。液体介质可进一步包括一种或多种盐。可以添加在液体介质中的盐以改变所述液体介质的离子强度。可以调节离子强度以例如维持保留组分或结合组分的稳定性或调节结合组分结合相互作用的强度。探针组合物可包括乳液或胶体悬浮液,例如油包水乳液或水包油乳液。
包括核酸(例如,DNA折纸、DNA纳米球、适体)的可检测探针或亲和试剂可在组合物中提供,所述组合物被具体配制为维持核酸稳定性。在一些配置中,包括核酸的可检测探针或亲和试剂可以在包括镁盐(例如,MgCl
包括可检测探针或亲和试剂的液体介质可进一步包括清除剂物质。清除剂可包括旨在移除化学上不利的或有害的物质的任何化学物质,如自由基清除剂、氧清除剂和金属螯合剂。可检测探针或亲和试剂组合物中可能的清除剂可包括诸如肼、抗坏血酸、生育酚、柚皮素、谷胱甘肽、锡烯和EDTA的物质。清除剂可包括在液体介质中,所述液体介质旨在用于在测定或其他使用方式之前储存可检测探针或亲和试剂组合物。
在一些配置中,包括液体介质的可检测探针或亲和试剂组合物可以被配制为多相液体,如油包水乳液或水包油乳液。多相液体介质可允许在使用方式之前或期间定位和/或限制可检测探针或亲和试剂。例如,可检测探针或亲和试剂的释放可通过破乳来控制,从而释放限制在乳液内的探针。另外,多相制剂可增加具有混合化学特征(例如,疏水性和亲水性组分)的可检测探针或亲和试剂的稳定性或对水性化学物质的敏感性(例如,对水解的敏感性)。
在一些配置中,可检测探针或亲和试剂组合物可以被配制为包括竞争物质。竞争物质可包括亲和试剂或被配置为与结合配偶体、表位或靶部分结合的其他分子。竞争物质可以通过对结合配偶体、表位或靶部分的低亲和力来表征。在一些配置中,竞争物质可以通过对与可检测探针或亲和试剂的结合配偶体、表位或靶部分相同的结合配偶体、表位或靶部分的低亲和力来表征。在其他配置中,竞争物质可以通过对多个结合配偶体、表位或靶部分的低亲和力来表征(例如,降低的结合特异性)。不希望受理论束缚,竞争物质可包括自结合配偶体、表位或靶部分的置换由结合的吉布斯自由能的增加驱动的结合物质。例如,竞争物质可对结合配偶体比对可检测探针或亲和试剂具有更大的结合焓,因此在能量上有利于置换竞争物并结合探针。同样,竞争物质可通过自结合配偶体解离而有利于可检测探针或亲和试剂来增加系统的熵。竞争物质可有利于在可检测探针或亲和试剂组合物中产生可调的亲合力,因为:1)竞争物质可在热力学上促进可检测探针或亲和试剂与结合配偶体、表位或靶部分的结合,和2)竞争物质可通过对结合配偶体、表位或靶部分提供浓度依赖性竞争来影响探针结合的动力学。图20A-20B描绘了使用包括结合竞争物的可检测探针或亲和试剂竞争来促进结合。图20A显示了包括表位或靶部分2020的结合配偶体2010与可检测探针2040的接触。结合配偶体2010的表面可以与多个竞争亲和试剂2030结合,所述多个竞争亲和试剂与所述表面非特异性结合。图20B显示了通过可检测探针2040与表位或靶部分2020的结合被置换的游离竞争亲和试剂2035。竞争亲和试剂的置换可以在能量上或熵上促进所述可检测探针与结合配偶体2010的结合。
竞争物质可包括亲和试剂,如适体、肽适体、设计的锚蛋白重复序列蛋白(DARPin)、抗体或抗体片段。竞争物质可作为可检测探针或亲和试剂的组分或作为与任何可检测探针或亲和试剂分隔的物质提供。图16A-16B示出包括竞争物质的可检测探针组合物。图16A示出在游离溶液中包括竞争物质的可检测探针组合物。所述组合物包括可检测探针1610,其含有多个附接的结合组分1620(例如,抗体或抗体片段)。所述组合物进一步包括竞争亲和试剂1630(例如,适体),其由于与探针1610分隔而在溶液中是游离的。竞争物质1630能够自由地与结合配偶体、表位或靶部分缔合,但所述竞争物质是可分隔的,并且可以自所述结合配偶体、表位或靶部分解离。图16B示出包括附接于可检测探针的竞争组分的可检测探针组合物。可检测探针1610包括多个附接的结合组分1620(例如,抗体或抗体片段)和多个附接的竞争组分1630(例如,适体)。包括附接的竞争组分的可检测探针或亲和试剂组合物可有利于促进结合的亲和试剂以慢解离率解离,这是由于在任何给定的时间最强结合物与靶标结合的可能性净降低。
可替代地,竞争物质可包括与结合配偶体、表位或靶部分竞争结合可检测探针或亲和试剂的物质。例如,竞争物质可以是含有在溶液中游离的靶序列的短肽序列(例如,2-15个氨基酸残基)。所述游离肽可能够与可检测探针或亲和试剂竞争性地结合,从而以与竞争物类似的方式改变可检测探针或亲和试剂与结合配偶体、表位或靶部分的结合相互作用的表观亲合力。
当可检测探针或亲和试剂与结合配偶体、表位或靶部分接触时,竞争物质可能存在。可以在可检测探针或亲和试剂与结合配偶体、表位或靶部分接触之前或之后引入竞争物质。可以调节组合物中可检测探针或亲和试剂与竞争物质的比率以调整所述组合物的亲合特征。可以调节可检测探针或亲和试剂组合物以调整结合特征,如探针结合率或解离率,从而达到所需的亲合力水平。竞争物质相对于可检测探针或亲和试剂可以以至少约1:1000000、1:100000、1:10000、1:1000、1:100、1:10、1:5、1:2、1:1、2:1、5:1、10:1、100:1、1000:1、10000:1、100000:1、1000000:1或更大的质量或摩尔比存在。可替代地或另外地,竞争物质相对于可检测探针或亲和试剂可以以不大于约1000000:1、100000:1、10000:1、1000:1、100:1、10:1、5:1、2:1、1:1、1:2、1:5、1:10、1:100、1:1000、1:10000、1:100000、1:1000000或更小的质量或摩尔比存在。
例如竞争组分形式的竞争物质在可检测探针或亲和试剂组合物中的存在可影响可检测探针或亲和试剂的结合或亲和特征。例如竞争组分形式的竞争物质在可检测探针或亲和试剂组合物中的存在可影响可检测探针或亲和试剂的解离率、结合率、解离常数或亲合力。例如竞争组分形式的竞争物质在可检测探针或亲和试剂组合物中的存在可增加可检测探针或亲和试剂的解离率、结合率、解离常数或亲合力。例如竞争组分形式的竞争物质在可检测探针或亲和试剂组合物中的存在可降低可检测探针或亲和试剂的解离率、结合率、解离常数或亲合力。例如竞争组分形式的竞争物质的存在可将可检测探针或亲和试剂的解离率、结合率、解离常数或亲合力增加或降低至少约2、5、10、25、50、100、250、500、1000、5000、10000、50000、100000、500000、1000000或更大的因数。可替代地或另外地,例如竞争组分形式的竞争物质的存在可将可检测探针或亲和试剂的解离率、结合率、解离常数或亲合力增加或降低不大于约1000000、500000、100000、50000、10000、5000、1000、500、250、100、50、25、10、5、2或更小的因数。
可检测探针或亲和试剂组合物可包括一个或多个被配置为改变可检测探针或亲和试剂的结合特征的组分。可以将组分添加至可检测探针或亲和试剂组合物以增加可检测探针或亲和试剂组合物的结合率、解离率、解离常数和/或亲合力。可以将组分添加至可检测探针或亲和试剂组合物以降低可检测探针或亲和试剂组合物的结合率、解离率、解离常数和/或亲合力。组分可以通过化学改变可检测探针或亲和试剂与结合配偶体、表位或靶部分之间的结合相互作用(例如,改变结合组分的构象、弱化结合组分与结合配偶体之间的静电相互作用)来影响可检测探针或亲和试剂的亲和力或亲合力。组分可以通过与可检测探针或亲和试剂产生弱的次级结合相互作用来影响可检测探针或亲和试剂的亲和力或亲合力。
可以将组分添加至可检测探针或亲和试剂组合物以改变可检测探针或亲和试剂组合物与结合配偶体、表位或靶部分之间的结合相互作用。添加的组分可通过改变结合配偶体、表位或靶部分、改变可检测探针或亲和试剂或通过改变可检测探针或亲和试剂组合物与结合配偶体、表位或靶部分之间的结合相互作用来改变结合相互作用。添加的组分可引起可检测探针或亲和试剂、结合组分和/或结合配偶体、表位或靶部分的构象变化,其增加或降低了结合相互作用的可能性和/或强度。添加的组分可例如通过静电筛选结合相互作用或竞争以形成结合相互作用来改变结合相互作用。
可以将变性剂、表面活性剂或离液剂添加至可检测探针或亲和试剂组合物以改变可检测探针或亲和试剂与结合配偶体、表位或靶部分之间的结合相互作用。可以将变性剂、表面活性剂或离液剂添加至可检测探针或亲和试剂组合物以改变可检测探针或亲和试剂的结合特征,如结合率、解离率、解离常数或亲合力。变性剂、表面活性剂或离液剂可促进可检测探针或亲和试剂移离结合配偶体、表位或靶部分。可以在探针结合之后将变性剂、表面活性剂或离液剂引入至可检测探针或亲和试剂组合物以促进可检测探针或亲和试剂移离结合配偶体、表位或靶部分。可检测探针或亲和试剂在变性剂、表面活性剂或离液剂存在下的结合可降低所述可检测探针或亲和试剂在与结合配偶体、表位或靶部分结合时的结合率。可以调节变性剂、表面活性剂或离液剂在可检测探针或亲和试剂组合物中的浓度以调整可检测探针或亲和试剂的亲和特征。可以限制变性剂、表面活性剂或离液剂在可检测探针或亲和试剂组合物中的浓度以避免使可检测探针或亲和试剂或可检测探针或亲和试剂的组分(例如,DNA折纸组分)不稳定。可检测探针或亲和试剂组合物中的变性剂、表面活性剂或离液剂可以与热结合以促进可检测探针或亲和试剂移离结合配偶体、表位或靶部分。
可以将盐如金属盐添加到可检测探针或亲和试剂组合物中以改变可检测探针或亲和试剂与结合配偶体、表位或靶部分之间的结合相互作用。盐或包括盐的离子物质可以与可检测探针或亲和试剂或结合配偶体、表位或靶部分形成相互作用,所述相互作用改变可检测探针或亲和试剂与结合配偶体、表位或靶部分之间的结合相互作用的化学性质。盐或包括盐的离子物质可破坏可检测探针或亲和试剂与结合配偶体、表位或靶部分之间的结合相互作用的化学性质。盐或包括盐的离子物质可促进可检测探针或亲和试剂与结合配偶体、表位或靶部分之间的结合相互作用。在一些配置中,可以将盐添加到可检测探针或亲和试剂组合物中以促进可检测探针或亲和试剂移离结合配偶体、表位或靶部分。可检测探针或亲和试剂组合物中的盐可以与热结合以促进可检测探针或亲和试剂移离结合配偶体、表位或靶部分。可以在探针结合之后将盐引入到可检测探针或亲和试剂组合物中以改变可检测探针或亲和试剂与结合配偶体、表位或靶部分的结合相互作用(例如,移除可检测探针或亲和试剂)。
可检测探针或亲和试剂组合物可进一步包括改变所述可检测探针或亲和试剂的亲合力和/或可观察性的结合分子。结合分子可包括被配置为与可检测探针或亲和试剂形成可逆或不可逆结合相互作用的分子。结合分子可以与结合配偶体、表位、靶部分或可检测探针或亲和试剂形成弱结合相互作用,以保持可检测探针或亲和试剂接近可能的靶标,从而增加可发生结合相互作用的可能性。结合分子可包括另外的标记组分,其增加发生结合相互作用时产生的信号。示例性结合分子在本文别处描述。可以在可检测探针或亲和试剂已经与结合配偶体、表位或靶部分接触之前、期间或之后将结合分子提供给可检测探针或亲和试剂组合物。
本公开的可检测探针或亲和试剂组合物可以以试剂盒形式提供,如果需要的话,包括合适的包装材料。在一个实施方案中,例如可检测探针或亲和试剂组合物可包括多个可检测探针或亲和试剂,例如提供在溶液或悬浮液中。在另一实施方案中,可检测探针或亲和试剂组合物可包括多个可检测探针或亲和试剂,例如作为固体如晶体或冻干固体提供。因此,在本公开的方法中有用的试剂或组分的任意组合,如本文先前关于特定方法阐述的那些,可包括在本公开提供的试剂盒中。非限制性地,这些试剂或组分可包括缓冲液、盐、稳定剂、保留组分、结合组分、标记组分和竞争亲和试剂。例如,试剂盒可包括多个可检测探针或亲和试剂,其提供在含有稳定表面活性剂和氧清除剂的储存缓冲液中。
如本文所用,短语“包装材料”是指用于容纳试剂盒的内容物如可检测探针、亲和试剂等的一种或多种物理结构。可以通过熟知的方法构造包装材料,优选提供无菌、无污染的环境。本文采用的包装材料可包括例如惯常在亲和试剂系统中利用的那些。示例性包装材料包括但不限于玻璃、塑料、纸、箔等,其能够在固定的限度内容纳可用于本公开的方法的组分,如可检测探针或亲和试剂组合物。
包装材料可包括指示可检测探针或亲和试剂可用于特定方法的标签。例如,标签可指示试剂盒可用于检测特定的结合配偶体、表位或靶部分,从而在多肽测定期间提供表征。在另一个实例中,标签可指示试剂盒可用于治疗或诊断目的。
包装的试剂或组分的使用说明书通常也包括在本公开的试剂盒中。“使用说明书”通常包括描述试剂或组分浓度或至少一个测定方法参数的有形表述,如试剂盒组分和待混合样品的相对量、试剂/样品混合物的维持时间段、温度、缓冲条件等。
试剂盒或组合物可包括多个不同的可检测探针和/或不同的亲和试剂,它们在附接于其上的结合组分的数目或类型方面不同。可替代地或另外地,试剂盒或组合物可包括多个不同的可检测探针和/或不同的亲和试剂,它们分别附接于不同的标记组分。所述可检测探针或亲和试剂虽然在结合组分的数目或类型方面或在标记组分的数目或类型方面不同,但仍然可具有基本上相同类型的保留组分。例如,多个不同的可检测探针和/或不同的亲和试剂可含有基于核酸折纸的保留组分,其中所述折纸的结构或所述折纸中的支架的结构对于所有不同的探针和/或试剂是相同的。多个不同的可检测探针和/或不同的亲和试剂可包括至少约2、3、4、5、10、25、50、100、250、500、1000个或更多不同的可检测探针和/或不同的亲和试剂。可替代地或另外地,多个不同的可检测探针和/或不同的亲和试剂可包括至多约1000、500、250、100、50、25、10、5、4、3、2个或更少的可检测探针和/或不同的亲和试剂。
使用方法
本公开的可检测探针或亲和试剂可用于广泛的用途,包括结合测定。一般来说,可检测探针或亲和试剂组合物的利用可涉及以下步骤中的一步或多步:1)使可检测探针或亲和试剂与具有所述可检测探针或亲和试剂的结合配偶体的溶液和/或固体支持物接触;2)允许所述可检测探针或亲和试剂与所述溶液中或所述固体支持物上的所述结合配偶体结合;3)冲洗来自所述溶液和/或固体支持物的未结合的探针;4)观察所述溶液和/或固体支持物以检测来自一个或多个可检测探针或亲和试剂的信号;5)将一个或多个结合的探针或试剂移离所述结合配偶体;6)任选重复步骤1)-5)中的一步或多步;和7)利用来自一个或多个探针或试剂的信号的存在和/或不存在来预测所述溶液中和/或所述固体支持物上的所述结合配偶体的存在和/或不存在。
观察可检测探针或亲和试剂与结合配偶体之间的结合相互作用的方法可用于多种表征中的任一种。在一些情况下,可利用可检测探针或亲和试剂来促进多肽表征测定。所述测定可以被配置为确定或预测一种或多种多肽的一种或多种特征(例如,大小、特质、同种型等)。可替代地或另外地,所述测定可以是被配置为确定或预测样品中的一种或多种多肽的量的测定。多肽表征测定或定量测定可以被配置为用于单分子检测,其中单独分辨一个或多个多肽分子。例如,在多重使用形式中,可基于单独对多肽的检测来预测或确定多个多肽中的每一多肽的一种或多种特征和/或量。在一些配置中,多肽测定可包括多肽的单分子表征或定量,以确定多个多肽中的一个或多个表位(例如,二聚体、三聚体或四聚体氨基酸序列;翻译后修饰等)的存在。可检测探针或亲和试剂可有利于多肽表征测定,因为它们对结合靶标的亲合力强,并且它们的信号输出强,从而给出高置信度的结合相互作用数据。
当与亲和试剂或可检测探针结合时,多肽或其他分析物可附接于结构化核酸颗粒(SNAP)。图58A显示了附接于SNAP 5850的多肽5840。多肽5840是示例性分析物,并且可用其他所关注的分析物代替。NAP 5850充当多肽5840的保留组分,并且可以用本文在亲和试剂和可检测探针的背景下阐述的保留组分代替或修饰。例如,SNAP 5850可以是核酸折纸,或者可以用荧光颗粒代替。多肽5840可以共价或非共价附接于SNAP 5850。可以使多肽5840与具有基于SNAP的保留组分5810、一个或多个标记组分5820和一个或多个结合组分5830的可检测探针接触。任选地,SNAP 5810可以用本文在亲和试剂和可检测探针的背景下阐述的保留组分代替或修饰。例如,SNAP 5810可以是核酸折纸,或者可以用荧光颗粒代替。因为多肽5840是一个或多个结合组分5830的结合配偶体,所以形成了复合物。所述复合物包括附接于多肽5840的SNAP 5850和附接于一个或多个结合组分5830的SNAP 5810,其中的至少一者与多肽5840结合,SNAP 5810也附接于至少一个标记组分5820。任选地,SNAP 5850可附接于固体支持物,如阵列上的位点。SNAP可采用多种共价或非共价化学方法中的任一种附接于固体支持物,包括但不限于本文在将亲和试剂或可检测探针的组分彼此附接的背景下阐述的那些。
在一些配置中,多肽测定可包括使可检测探针或亲和试剂与多个多肽接触,其中所述多个多肽中的每一多肽在独特的、光学可观察的空间位置处与固体支持物结合,如在多肽阵列中的位点处。在给定的空间位置检测到信号可证明可检测探针或亲和试剂已在所述空间位置与多肽结合,从而表明在所述多肽中的所述空间位置处存在特定的表位或靶部分。一个或多个表位或靶部分的预测或确定的存在或不存在可预测或确定在给定空间位置结合的多肽的特征。此外,基于来自给定空间位置的信号的强度和/或基于阵列中产生指示特定探针(或探针系列)已结合的信号的位点的数目,可以预测或确定样品中的特定多肽的量。
多重结合反应示于图58B中。所述反应以多肽分析物例示,但也可以用本领域中已知或本文阐述的其他分析物进行。多肽阵列5800包括四个不同的多肽5841至5844。多肽中的每一者附接于SNAP 5851。附接可以是共价的或非共价的。阵列5800与多个可检测探针接触。探针中的每一者包括附接于至少一个标记组分和至少一个结合组分的基于SNAP的保留组分5811。显示了三个不同的可检测探针,包括第一探针、第二探针和第三探针,所述第一探针具有附接于至少一个标记部分5821和至少一个结合部分5831的SNAP 5811,所述第二探针具有附接于至少一个标记部分5822和至少一个结合部分5832的SNAP 5811,且所述第三探针具有附接于至少一个标记部分5823和至少一个结合部分5833的SNAP 5811。结合反应的产物是所述第一探针和第三探针与阵列5800上的相应多肽的结合。因为多肽5841是一个或多个结合组分5831的结合配偶体,所以形成了第一复合物。所述第一复合物包括附接于多肽5841的SNAP 5851和附接于一个或多个结合组分5831的SNAP 5811,其中的至少一者与多肽5841结合,SNAP 5811也附接于至少一个标记组分5821。因为多肽5843是一个或多个结合组分5833的结合配偶体,所以在阵列5800上形成了第二复合物。所述第一复合物包括附接于多肽5843的SNAP 5851和附接于一个或多个结合组分5833的SNAP 5811,其中的至少一者与多肽5843结合,SNAP 5811也附接于至少一个标记组分5823。在此实例中,多肽5842和5844保持未结合,因为它们不是与任何可检测探针的结合配偶体。而且,包括附接于至少一个结合组分5832和至少一个标记组分5822的SNAP 5811的第三可检测探针在阵列5800上不具有结合配偶体,并且保持未结合。所述第一和第二可检测探针可以在所述阵列上检测,其中它们被空间分辨,且其中可基于它们的不同标记类型对它们进行进一步区别和确认。因此,基于对每一可检测探针的结合特性和与每一可检测探针相关的标记类型的了解,自阵列位点检测到的信号可用于确认多肽。
在图58B的实例中,多肽虽然分隔到阵列5800上的单独位点中,但还附接于具有共同结构的SNAP。例如,SNAP 5851可以是核酸折纸,且多肽可以附接于彼此具有相同支架折叠的折纸。折纸中的一个或多个订书钉的亚组在折纸之间可以是不同的,例如以适应附接不同的多肽。使用共同的SNAP结构或就此而言的其他保留组分可提供多肽在阵列上的方便装载。例如,所述阵列可以被配置为具有与SNAP的均匀结构元件相互作用的均匀位点,以实现将所述多肽附接于所述阵列。共同的保留组分结构也可用于多个不同的可检测探针或多个不同的亲和试剂。如图58B中所例示,三个可检测探针在附接于SNAP 5811的标记组分和结合组分方面不同。然而,三个亲和探针具有基本上相同的SNAP结构。例如,SNAP 5811可以是对于三个可检测探针中的每一者具有相同支架折叠的核酸折纸。折纸中的一个或多个订书钉的亚组在不同的可检测探针之间可以不同,例如以适应附接不同的标记组分或不同的结合组分。虽然图58B以附接于不同分析物的共同SNAP和附接于不同的可检测探针的共同SNAP例示,但将要理解的是,所述SNAP反而可在结构上有所不同。此外,SNAP可包括可检测探针间不同或多肽间不同的序列标签。标签可用于确认混合物中的个别探针或确认阵列中的个别多肽。
阵列可用于分析物的多重处理,由此并行处理或检测多种不同类型的分析物。特别有用的分析物包括但不限于本文阐述的亲和试剂的结合配偶体,如多肽、核酸等。虽然也可以采用本文阐述的方法的一个或多个步骤连续处理不同类型的分析物,但并行处理可提供成本节约、时间节省和条件的均一性。阵列可包括至少2、10、100、1000、1x 10
阵列可附接于流动池壁的内表面或附接于流动池内部的固体支持物。所述流动池或固体支持物可由用于分析生物化学的多种材料中的任一种制成。合适的材料可包括玻璃、聚合材料、硅、石英(熔融二氧化硅)、硼浮法玻璃、二氧化硅、基于二氧化硅的材料、碳、金属、光纤或光纤束、蓝宝石或塑料材料。可基于特定用途所需的特性来选择材料。例如,对所需辐射波长透明的材料可用于将利用该波长下的辐射的分析技术。相反,可能希望选择不能通过某一波长的辐射的材料(例如不透明的、吸收性的或反射性的)。其他可以利用的材料特性有如本文阐述的对在下游过程中使用的某些试剂的惰性或反应性或处理的容易程度或制备的低成本。
多肽或其他分析物可以以提供单分子水平的检测的方式附接于支持物。例如,多个不同的多肽可以以这样的方式附接于固体支持物,即与所述支持物上的个别多肽位点结合的个别可检测探针或亲和试剂可与所述阵列上的所有邻近位点区别开来,即使邻近位点与可检测探针或亲和试剂结合。如此,一个或多个不同的多肽(或本文阐述的可检测探针或亲和试剂的其他结合配偶体)可以以这样的形式附接于固体支持物,其中每一单个多肽分子被物理分离,并以这样的方式被检测,即将所述单个分子从所述固体支持物上的所有其他分子中分辨出来。可替代地,可以对一个或多个集合体实施本公开的方法,集合体是基本上相同类型的分析物的群体,如具有共同序列的核酸或多肽的群体。
图22示出多肽测定的配置。多个多肽任选通过锚定基团2230(例如SNAP或化学接头)与固体支持物2210结合。可检测探针2240与多个多肽接触,从而允许可检测探针2240与可用的结合靶标结合。在接触后,可检测探针2240已与第一多肽2221和第四多肽2224结合,并且未与第二多肽2222或第三多肽2223结合。如果通过适当的检测系统如荧光显微镜观察,则可以在固体支持物2210上对应于第一多肽2221和第四多肽2224的位置的空间位置处观察到可检测的信号。
多肽可以是天然或合成来源的。多肽可含有一个或多个翻译后修饰。可替代地或另外地,多肽中可以不存在一个或多个翻译后修饰。在一些情况下,可以处理多肽以移除、逆转或改变翻译后修饰。例如,可以进行本文阐述的多肽测定以检测移除、逆转或改变翻译后修饰之前和之后的一个或多个多肽。比较之前和之后的结果可提供益处,如增加确认多肽的翻译后修饰的数目或类型的置信度。在一些情况下,可以处理多肽以产生翻译后修饰。例如,可以进行本文阐述的多肽测定以检测进行翻译后修饰之前和之后的一个或多个多肽。相反,可以进行本文阐述的多肽测定以检测移除翻译后修饰之前和之后的一个或多个多肽。比较之前和之后的结果可提供益处,如确认多肽易受影响的翻译后修饰或合成后修饰的数目或类型。在一些情况下,多肽可以被蛋白水解以移除多肽的至少一部分。例如,可以进行本文阐述的多肽测定以检测蛋白水解之前和之后的一个或多个多肽。比较之前和之后的结果可提供益处,如相对于多肽中的蛋白水解位点的位置定位多肽中的表位或靶部分。比较之前和之后的结果的进一步益处可以是更容易确认易受蛋白水解影响的多肽中的翻译后修饰的数目或类型。
翻译后修饰可包括豆蔻酰化、棕榈酰化、异戊二烯化、异戊烯化、法尼基化、香叶酰香叶酰化、脂酰化、黄素部分附接、血红素C附接、磷酸泛酰巯基乙胺化(phosphopantetheinylation)、亚视黄基席夫碱形成、双苯二甲胺形成、乙醇胺磷酸甘油附接、高赖氨酸、β-赖氨酸加成、酰化、乙酰化、脱乙酰化、甲酰化、烷基化、甲基化、C-末端酰胺化、精氨酰化、聚谷氨酰化、聚甘氨酰化、丁酰化、γ-羧化、糖基化、糖化、聚唾液酸化、丙二酰化、羟基化、碘化、核苷酸加成、磷酸酯形成、氨基磷酸酯形成、磷酸化、腺苷酰化、尿苷酰化、丙酰化、焦谷氨酸形成、S-谷胱甘肽化、S-亚硝基化、S-亚磺酰化、S-亚磺酰基化、S-磺酰化、琥珀酰化、硫酸化、糖化、氨基甲酰化、羰基化、异肽键形成、生物素化、氨甲酰化、氧化、还原、聚乙二醇化、ISG化、SUMO化、泛素化、类泛素化、蛹化(pupylation)、瓜氨酸化、脱酰胺、乙氨基化(elminylation)、二硫桥形成、蛋白水解切割、异天冬氨酸形成、外消旋化和蛋白质剪接。特别受关注和有用的翻译后修饰是蛋白水解,其可以是位点特异性的(即发生在特定的氨基酸残基或氨基酸序列上)或非位点特异性的。使用生物酶、化学试剂或如本领域技术人员已知的那些物理处理可以自多肽逆转或移除翻译后修饰。使用生物酶、化学试剂或如本领域技术人员已知的那些物理处理可以对多肽进行翻译后修饰。
表征的多肽可具有特定的大小。多肽可以为至少约0.1道尔顿(Da)、0.5Da、1Da、5Da、10Da、50Da、100Da、200Da、300Da、400Da、500Da、600Da、700Da、800Da、900Da、1千道尔顿(kDa)、1.5kDa、2kDa、2.5kDa、3kDa、3.5kDa、4kDa、4.5kDa、5kDa、6kDa、7kDa、8kDa、9kDa、10kDa、15kDa、20kDa、25kDa、30kDa、40kDa、50kDa、60kDa、70kDa、80kDa、90kDa、100kDa、200kDa、300kDa、400kDa、500kDa、600kDa、700kDa、800kDa、900kDa、1000kDa、1200kDa、1400kDa、1600kDa、1800kDa、2000kDa、2500kDa、3000kDa、3500kDa、4000kDa或更大。可替代地或另外地,多肽可以不大于约4000kDa、3500kDa、3000kDa、2500kDa、2000kDa、1800kDa、1600kDa、1400kDa、1200kDa、1000kDa、900kDa、800kDa、700kDa、600kDa、500kDa、400kDa、300kDa、200kDa、100kDa、90kDa、80kDa、70kDa、60kDa、50kDa、40kDa、30kDa、25kDa、20kDa、15kDa、10kDa、9kDa、8kDa、7kDa、6kDa、5kDa、4.5kDa、4kDa、3.5kDa、3kDa、2.5kDa、2kDa、1.5kDa、1kDa、900Da、800Da、700Da、600Da、500Da、400Da、300Da、200Da、100Da、50Da、10Da、5Da、1Da、0.5Da或更小。多肽可含有最小或最大数目的氨基酸残基。多肽可含有至少约2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、60、70、80、90、100、125、150、200、250、300、400、500、600、700、800、900、1000、1500、2000、3000、4000、5000、6000、7000、8000、9000、10000、15000、20000、30000、40000个或更多个氨基酸残基。可替代地或另外地,多肽可含有不大于约40000、30000、20000、15000、10000、9000、8000、7000、6000、5000、4000、3000、2000、1500、1000、900、800、700、600、500、400、300、200、250、200、150、125、100、90、80、70、60、50、45、40、35、30、25、20、15、10、9、8、7、6、5、4、3个或更少的氨基酸残基。
多肽测定可涉及一种或多种流体转移操作,包括含有可检测探针或亲和试剂的流体和介导涉及可检测探针或亲和试剂的结合相互作用的流体(例如,冲洗流体、移除试剂)。当流体被转移进或转移出诸如流动池或芯片的流体装置时,可以发生流体转移操作。多肽表征测定可能需要与固体支持物结合的多个多肽始终与流体介质相接触。流体转移操作可利用第二流体介质自流动池置换第一流体介质,以确保始终存在与包括多个多肽的固体支持物接触的流体。
可以向多肽检测系统或方法提供样品。样品可作为例如包括多个多肽或其他分析物的级分提供。样品可作为包括多个多肽缀合物或其他分析物缀合物的级分提供。分析物缀合物可包括直接或经由接头部分如结构化核酸颗粒、聚合物或蛋白质部分附接于固体支持物的分析物(例如多肽分析物)。可以在液体介质(例如,水性、pH缓冲介质)中向检测系统或方法提供样品。可以将样品作为固体(例如,冻干、沉淀或结晶的样品)向检测系统或方法提供。固体在被添加到检测系统或方法中之前、期间或之后可以被溶解或悬浮在液体介质中。样品在被提供给系统后可以储存在检测系统中。
包括多肽或其他分析物的样品可以与流体装置中的固体支持物结合。包括样品的流体可以被泵送或流过流体系统到达检测室,如流动池或孔,包括流体装置内的固体支持物。包括样品的流体可以与固体支持物接触足够长的时间,以将分析物附接于固体支持物。任选地,分析物可以与介导分析物附接于固体支持物的物质如结构化核酸颗粒缀合。在一些情况下,另外的流体可以与样品流体混合以促进分析物与固体支持物的结合。如果样品包括多肽,则固体支持物可首先与包括多肽连接基团(例如,结构化核酸颗粒、聚合物、蛋白质)的流体接触足够长的时间以将多肽连接基团沉积在固体支持物的表面上。在固体支持物已经沉积有多肽连接基团后,包括样品的流体介质可以被泵送或流入在流体装置中含有固体支持物的检测室。可以允许多肽与多肽连接基团之间的附接反应发生足够长的时间以将多肽附接于连接基团。可以将一种或多种试剂添加到流体装置中以促进多肽附接反应,如反应物和/或催化剂。在一些情况下,多肽和多肽连接基团可以被配置为经由自发附接反应如“点击”反应进行反应。在一些情况下,多肽可直接附接于固体支持物,例如通过多肽上的官能团与固体支持物上的官能团之间的键。在附接反应之后,固体支持物将包括与所述固体支持物结合的一个或多个多肽。
在分析物(例如多肽)已例如在流体装置内附接于固体支持物之后,可以一次或多次冲洗流体装置的检测室。冲洗过程可利用一种或多种洗涤或冲洗试剂,它们一起或连续地被泵送或流入流体装置。提供给流体装置的冲洗流体的体积可超过包括固体支持物的检测室的总体积。冲洗步骤可移除一些或所有未结合的多肽、多肽缀合物或其他试剂。可以限制流向流体装置的冲洗流体的流速以防止附接的分析物自固体支持物逐出。
任选地,附接的分析物(例如缀合的多肽)可经受一个或多个改变分析物的结构的过程。例如,多肽分析物可以部分或完全变性,例如通过向流体装置中添加变性流体。变性流体可以与固体支持物接触足够的时间以促进多肽的完全变性,或者可以与固体支持物短暂接触以引起多肽的部分变性。也可以通过对固体支持物应用改变试剂例如酶(连接酶、激酶、糖基化酶、磷酸酶、蛋白酶等)、氧化剂或还原剂来改变多肽。流体装置可以在添加结构改变试剂之后经历冲洗过程,从而自流体装置移除残余试剂。在一些情况下,固体支持物可保持与改变剂(例如,变性剂)接触,直到亲和试剂被引入流体装置。在一些情况下,多肽在结构改变过程之后可部分或完全重新折叠。
亲和试剂可例如在流体装置中与包括多个多肽(例如多肽的阵列)或其他分析物的固体支持物接触。在一些配置中,亲和试剂可作为可检测探针或亲和试剂提供。可以在流体介质中提供亲和试剂如可检测探针,所述流体介质被泵送或流入流体装置。流体介质可包括单一种类的亲和试剂或可检测探针,或者可包括不同种类的亲和试剂或可检测探针的混合物。例如,流体介质可包括具有不同表位结合特异性的至少两个可检测探针或亲和试剂。或者,流体介质可包括至少两个可检测探针或亲和试剂,它们是不同类型的可检测探针或亲和试剂,例如1个适体探针和1个抗体探针。亲和试剂或可检测探针可与固体支持物在流体装置中接触足够长的时间,以促进亲和试剂或可检测探针与至少一种分析物中存在的表位或靶部分(例如多肽中的氨基酸序列表位)结合。
结合测定中利用的亲和试剂或结合组分可通过其结合特异性的性质加以区别。特别地,亲和试剂可具有已经以概率方式表征的表位结合特异性。本公开的亲和试剂可以通过多种结合概率来表征,而不是以二元方式表征(例如,亲和试剂A与表位X结合,不与表位Y结合)。例如,在8000个可能的三聚体氨基酸序列(20x20x20)中,对于一些或所有8000个序列可已知、测量或估计亲和试剂的非零结合概率。在一些情况下,如果亲和试剂对第一表位具有高的已知、测量或估计的结合概率(例如,大于50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%、99.9%、99.99%、99.999%或更高的结合概率),且对第二表位具有低的已知、测量或估计的结合概率(例如,小于1%、0.1%、0.01%、0.001%、0.0001%、0.00001%、0.000001%或更低的结合概率),则其可用于本公开。在一些情况下,亲和试剂可包括对表位家族高的已知、测量或估计的结合概率(例如,大于50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%、99.9%、99.99%、99.999%或更高的结合概率)和对其他表位低的已知、测量或估计的结合概率(例如,小于1%、0.1%、0.01%、0.001%、0.0001%、0.00001%、0.000001%或更低的结合概率)。表位家族可包括通过氨基酸序列(例如,氨基酸序列AXA,其中A是丙氨酸,且X可以是任何氨基酸;氨基酸序列αAAAβ,其中α和β独立地为任何可能的氨基酸侧翼序列)相关或可通过化学特性(例如,非极性、极性、带正电荷、带负电荷、翻译后修饰等)相关的表位。
在给予亲和试剂如可检测探针足够的时间与流体装置中的分析物(例如多肽分析物)结合之后,所述装置的检测室可经历一次或多次洗涤或冲洗以移除任何未结合的亲和试剂。多肽表征测定可以在亲和试剂结合后仅利用单个冲洗步骤使分析物-亲和试剂相互作用被破坏的可能性最小化。亲和试剂冲洗流体可以在冲洗过程之后由被配置用于进行物理测量的介质如光学成像缓冲液自流体装置置换。
可以在亲和试剂或可检测探针已经与同固体支持物结合的多种分析物接触之后测量分析物:亲和试剂或分析物:探针相互作用。物理测量如可检测探针的标记组分的检测可以在静止流体条件下进行。通过隔离所有的入口和出口端口,例如通过关闭阀门,流体可以在流体中保持静态。可以将流体在流体装置中保持足够长的时间以允许对一个、一些或所有独特的、光学可观察的空间位置进行成像。
在已经对分析物:亲和试剂或分析物:探针相互作用进行结合和/或物理测量之后,可以通过向流体装置中添加破坏介质来自分析物剥离结合的亲和试剂或可检测探针。破坏介质可包括变性剂、离液剂或有可能破坏分析物:亲和试剂或分析物:探针相互作用的其他化学实体。破坏介质可以在静止或流动条件下与分析物接触。在破坏介质已经与分析物接触之后,可以用冲洗介质冲洗或洗涤流体装置一次或多次,以自流体装置移除任何未结合的亲和试剂或未结合的可检测探针。
在一些情况下,分析物(例如多肽分析物)可以在结合测量期间或之后自固体支持物的表面移除。例如,可以对多个多肽进行表征以确定哪些多肽被糖基化,接着自固体支持物释放所有非糖基化的多肽。在一些情况下,在表征测定完成后可以自固体支持物释放所有分析物以允许重新使用流体装置。可以通过添加剥离流体来自固体支持物释放分析物或分析物-缀合物。剥离流体可以提供比表征测定期间利用的其他冲洗介质更严格的洗涤,使得其导致分析物自固体支持物置换。分析物自固体支持物的置换也可以利用诸如热或光的物理条件,例如通过切断分析物与固体支持物之间的可光活化的接头。
在分析物自固体支持物的置换期间或之后,冲洗介质可流过流体装置以移除置换的分析物。随后可通过物理测量方法观察固体支持物以确定或确认分析物自表面的置换。
不管上述特异性如何,在一些情况下,可基于对结合或不结合该蛋白质的不同探针的一系列观察来确认特定的多肽分析物。这些系列可以使用利用概率建模的软件算法来进行评估,以评价给定系列确认给定蛋白质或多肽的概率。在多重使用配置中,可以观察多个不同多肽的结合和非结合模式。例如,可以在阵列中展示蛋白质,所述阵列由单独可分辨的位点组成,每个位点具有所述多肽之一。可以对每个位点进行一系列观察,观察不同的探针是否结合。可以由在每个位点的一系列观察来确定在每个位点的多肽的特质。在每个位点的一系列观察的总体模式可用于确认阵列中的多个多肽。可用于确认蛋白质的软件算法、方法和组合物的实例描述于例如公布的国际专利申请第WO 2019/133892号、美国专利第10,473,654号或美国专利申请公布第2020/0286584A1号中,上述专利文献中的每一者通过引用并入本文。
在一些情况下,多肽的检测、确认或表征可利用本文阐述的亲和试剂。本公开的亲和试剂可以是混杂或广谱亲和试剂,其具有与样品中的一个以上多肽相互作用(例如,结合)的可能性。在一些情况下,亲和试剂可具有与样品中的两个或更多个独特的、结构上不同的蛋白质相互作用的可能性。例如,基于在其他方面不同的蛋白质内的结构相似的区域,亲和试剂可以以接近相等的概率与特定的膜蛋白和特定的细胞质蛋白结合。在一些情况下,结合亲和试剂可具有与特定氨基酸表位或表位家族结合的可能性,而不管序列背景(例如,来自所述表位的氨基酸序列上链和/或下链)如何。
本公开的亲和试剂可以被表征,使得其具有经确认、确定或评估的基于概率的结合概况。亲和试剂可具有以经确认、确定或评估的大于约50%(例如,至少约50%、60%、70%、80%、90%、95%、99%、99.9%、99.99%、99.999%或大于约99.999%)的结合概率与第一多肽结合并以经确认、确定或评估的小于约50%(例如,不大于约50%、40%、30%、20%、10%、5%、1%、0.1%、0.01%、0.001%或小于约0.001%)的结合概率与第二结构上不同的多肽结合的特性。在特定情况下,观察到的亲和试剂与第一和第二多肽的结合概率的差异可能是由于第一或第二多肽中特定表位或表位家族的存在、不存在或不可及性所致。可以通过体外测量或计算机预测来确定或确认概率性亲和试剂结合概况。
可替代和另外的实施方案和实施例
技术人员将会很容易认识到本公开的可检测探针和亲和试剂的有用性,包括例如它们的可调亲合力和可观察性特征。本公开的可检测探针或亲和试剂组合物可用于在微尺度以及单分子系统和环境中提供高分辨率空间表征。所描述的可检测探针或亲和试剂还可以为生物学背景提供有用的特征,如诊断和治疗应用。
本公开的可检测探针或亲和试剂可促进免疫组织化学用于诸如阐明细胞和组织结构的目的。可检测探针或亲和试剂可以以对特定细胞组分(例如,表面生物标志物、多糖、结构蛋白、细胞器蛋白等)的高特异性附接于多个结合组分。可检测探针或亲和试剂可直接与细胞(例如,微生物)或组织样品(例如,组织切片、冷冻组织样品、福尔马林固定的石蜡包埋样品)接触,并孵育足够的时间,以允许可检测探针或亲和试剂与细胞或组织相关靶标之间的结合相互作用,从而形成经处理的细胞或组织样品。可以通过任意合适的方法(依赖于探针—例如荧光显微镜、闪烁计数等)直接观察经处理的细胞或组织样品。由于可检测探针或亲和试剂的高结合亲合力和高可观察性,可检测探针或亲和试剂可有利于免疫组织化学应用。结合数据的分析可以提供关于细胞和/或组织样品中的生物标志物或生物分子数量和分布的高分辨率空间数据。
可以利用可检测探针或亲和试剂作为下拉或捕获试剂。高结合亲合力可促进自物质的异质混合物捕获和保留靶向的物质。亲和试剂可以是在溶液中游离的,或者可以在与结合配偶体结合期间或之后附接于固体支持物(例如,珠粒、芯片或色谱树脂)。亲和试剂与可包括结合配偶体的异质混合物接触可允许结合配偶体与混合物的至少一种其他组分分隔。例如,附接于固体支持物的亲和试剂可以与样品接触,以允许结合配偶体经由亲和试剂与固体支持物结合,固体支持物可以与样品分隔,并且可任选洗涤固体支持物以自固体支持物移除残余的样品组分。在另一个实例中,亲和试剂可以与样品接触,以允许结合配偶体与亲和试剂结合,所得亲和试剂-结合配偶体复合物可以附接于固体支持物,固体支持物可以与样品分隔,并且可任选洗涤固体支持物以自固体支持物移除残余的样品组分。在任一实例中,亲和试剂的后续收集和分离或结合配偶体的释放可以实现结合配偶体与样品(例如异质混合物)的分隔。任选地,然后可在本文别处阐述的检测测定中检测通过上述方法捕获的一个或多个结合配偶体。例如,可以从样品中捕获不同多肽的亚组,从而从样品中移除其他多肽,然后可以采用本文阐述的多肽测定法对多肽的亚级分进行量化或表征。
可检测探针或亲和试剂可用作分隔系统如亲和色谱柱内的组分。可以配制亲和色谱系统,以附接对多孔基质或树脂内的一个或多个结合配偶体、表位或靶部分具有特定亲和力的多个可检测探针或亲和试剂。以多肽作为示例性分析物,可以将包括多肽的混合物(例如,细胞裂解物、合成蛋白质或肽的样品、含有可能的生物污染的非生物样品等)施加到包括可检测探针或亲和试剂的柱上,以影响靶向多肽(例如,包括结合配偶体、表位或靶部分的那些)与非靶向多肽之间的分隔。可检测探针或亲和试剂亲和色谱系统可包括树脂或基质,其将可检测探针或亲和试剂与树脂或基质永久或不可逆地缀合,从而允许重复使用系统。捕获的多肽可以在混合物的非靶向级分已经通过柱后从柱上洗脱。可检测探针或亲和试剂亲和色谱系统可包括树脂或基质,其将可检测探针或亲和试剂不可逆地附接于树脂或基质,从而允许自所述系统释放包括捕获的靶标的可检测探针或亲和试剂。在一些情况下,亲和色谱系统可包括检测系统(例如,荧光测量、IR、UV),其允许在探针自所述系统洗脱时检测来自可检测探针或亲和试剂的信号。检测系统可允许测量背景或可检测探针或亲和试剂自树脂或基质的非预期释放,并且监测可检测探针或亲和试剂自基质或树脂的预期释放。在从混合物中捕获靶多肽之后,可以通过释放可检测探针或亲和试剂自所述系统洗脱多肽。在一些情况下,可以收集释放的可检测探针-多肽复合物(或亲和试剂-多肽复合物),然后沉积在固体支持物上用于多肽测定,如多肽表征测定或结合配体测定。
图17A-17C描绘了利用亲和试剂作为捕获剂的方案。如图17A中所示,提供亲和试剂1710,其中所述亲和试剂包括捕获柄1720和对靶结合配偶体1730具有高结合特异性的多个结合组分。捕获柄可包括任意合适的柄,如捕获标签(例如,生物素)、核酸或官能团(例如,点击官能团)。亲和试剂1710与包括靶结合配偶体1730和多个非靶物质1735的异质混合物接触,从而促进亲和试剂1710与靶结合配偶体1730的结合。任选地,可以存在包括被配置为与捕获柄1720结合的捕获位点1740的固体支持物1750。捕获位点可以在固体支持物上产生,例如作为图案化阵列或随机阵列。如图17B中所示,异质混合物与亲和试剂1710-靶结合配偶体1730复合物分隔。如果存在固体支持物1750,则亲和试剂1710和靶结合配偶体1730可以在由捕获位点1740处的捕获柄1720的结合产生的锚定点1745处与固体支持物结合。亲和试剂1710和靶结合配偶体1730在固体支持物1750上的沉积可产生捕获的靶结合配偶体(例如,靶多肽)的随机或图案化阵列。可替代地,亲和试剂1710-靶结合配偶体1730复合物可以通过分隔方法如亲和色谱法、尺寸排阻色谱法、重力沉降、过滤、(磁性或顺磁性固体支持物的)磁力捕获或离心从游离溶液中分隔出来。
图17C描绘了任选的最终步骤。可利用可检测探针1760作为测定试剂对捕获的靶结合配偶体1730进行表征或量化测定。一个或多个可检测探针1760可以与捕获的靶结合配偶体1760接触,以表征靶结合配偶体1730与可检测探针1760之间存在或不存在结合相互作用。对来自可检测探针1760的可检测的信号的存在或不存在进行观察可指示在固体支持物1750上的观察位置存在结合配偶体、表位或靶部分的概率。
可检测探针或亲和试剂可用于共结合测定。共结合测定可以指其中多个亲和试剂和/或可检测探针同时与结合配偶体、表位或靶部分接触以同时确定结合靶标中两个或更多个特征(例如,表位)的存在的任何测定。可以利用共结合测定,例如以确定多肽中的两个不同表位的同时存在,从而产生多肽特质的高置信度预测。
可以配制可检测探针或亲和试剂,用于通过组合两个或更多个独特种类的可检测探针或亲和试剂进行共结合测定,每个通过独特的检测标志或指纹来区别(例如,第一探针使用
可替代地,利用可检测探针或亲和试剂的共结合测定可以用包括核酸条形码的可检测探针或亲和试剂进行。图18A-18C描绘了利用条形码检测信号进行共结合测定的方案。图18A描绘了与第一可检测探针1810和第二可检测探针1840接触的结合配偶体1890。第一可检测探针1810被配置为与第一表位或靶部分1870结合,并且包括具有条形码序列1838和末端引发序列1830的第一接头1820。第二可检测探针1840被配置为与第二表位或靶部分1880结合,并且包括具有末端互补引发序列1860的第二接头1850。如果在第一可检测探针1810与第一表位或靶部分1870之间发生结合相互作用,并且在第二可检测探针1840与第二表位或靶部分1880之间发生结合相互作用,则末端引发序列1830和互补引发序列1860可足够接近以通过核酸碱基配对进行杂交。如图18B中所示,接触的聚合酶1865可以在引发序列处与杂交的核酸结合,从而允许发生延伸反应。如图18C中所示,在延伸反应之后,第二可检测探针1840可以在互补条形码序列1868已被添加至互补引发序列1860后自结合配偶体1890解离。可检测探针条形码的后续分析将检测转录的条形码,从而表明两个可检测探针同时结合了结合配偶体1890。
本公开的可检测探针或亲和试剂可用于医学诊断目的,如诊断测定。可检测探针或亲和试剂可适用于体外和体内系统。可检测探针或亲和试剂可适应于常见的体外测定,如蛋白质印迹和ELISA,其中可检测探针或亲和试剂代替这类测定中通常使用的抗体。可检测探针或亲和试剂也可用作捕获或下拉试剂,用于从流体或其他生物样品中定位蛋白质或其他生物标志物。例如,可检测探针或亲和试剂可以与血液或血浆接触以分离血源性生物标志物。可检测探针或亲和试剂可用于体内测定,诸如PET扫描。在一些配置中,体内可检测探针或亲和试剂可附接于放射性标记(例如,
亲和试剂或可检测探针可用作用于医疗应用的治疗剂。高亲合力亲和试剂或探针可构成体内信号传导和/或结合过程的逻辑破坏物或促进物。亲和试剂或可检测探针可附接于多个结合配体(例如,激素、细胞因子等)或结合靶标(例如,表面受体)以促进与体内信号传导或结合系统的相互作用。可以向体内系统足量提供高亲合力亲和试剂或可检测探针,以部分或完全阻断信号传导或结合受体系统,从而减少或增加细胞反应。可以向体内系统足量提供高亲合力亲和试剂或可检测探针,以部分或完全捕获一个或多个信号传导或结合配体,从而减少或增加生物反应。高亲合力亲和试剂或可检测探针可用作抗微生物或抗病毒组合物。例如,亲和试剂或可检测探针可以被配置为结合微生物或病毒用来启动其生殖周期的受体系统。或者,亲和试剂或可检测探针可以被配置为结合微生物或病毒(例如,通过病毒刺突蛋白),从而抑制微生物或病毒与细胞靶标结合的能力。
包括替代结合组分的可检测探针或亲和试剂可用于治疗学、诊断学或药物开发。包括多个附接的亲和试剂嵌合体的可检测探针或亲和试剂可用于治疗或药物开发目的。亲和试剂嵌合体可包括任何复合物,包括与次级分子如小分子、核酸、肽或蛋白质偶联的亲和试剂。嵌合体可包括具有特定生物学功能的次级分子,如反义核酸、外显子、内含子、转录抑制子、转录启动子、受体结合配体、酶结合配体、酶底物等。亲和试剂嵌合体可包括适体-siRNA嵌合体、抗体-siRNA嵌合体、适体-配体嵌合体或抗体-配体嵌合体。包括亲和试剂嵌合体的可检测探针或亲和试剂可用于定位次级分子的靶标,如结合靶分子以将反义RNA递送至靶分子。在一些配置中,可检测探针或亲和试剂可包括与所述探针偶联的多个亲和试剂和与所述可检测探针或亲和试剂偶联的另外多个次级分子。
可检测探针或亲和试剂可用作药物递送平台。本文提供的可检测探针或亲和试剂增加的结合亲合力将允许与膜受体或用于细胞摄取的其他可靶向系统高度结合。可检测探针或亲和试剂可以与药物递送制剂缔合,如胶体颗粒或包衣药物制剂。图38A-38D描绘了使用可检测探针或亲和试剂进行细胞药物递送。图38A显示了包括疏水性表面修饰基团3810的可检测探针或亲和试剂与包括药物制剂3830的胶体药物颗粒3820的组合。如图38B中所示,胶体颗粒3820与可检测探针或亲和试剂3810的疏水性修饰基团之间的疏水相互作用形成靶向的药物递送复合物。图38C描绘了由于膜相关蛋白3845与靶向的药物递送复合物之间的结合相互作用而在嵌入细胞3840的细胞膜3842内的膜相关蛋白3845(例如,细胞受体)与靶向的药物递送复合物之间的相互作用。图38D描绘了在靶向的药物递送复合物已经与靶向的膜相关蛋白3845相互作用之后药物制剂3830摄取到细胞3840中,从而将药物制剂3830释放到细胞3840中。可检测探针或亲和试剂3810可以在胶体颗粒3820的摄取期间被释放或吸收到细胞中。
可检测探针或亲和试剂可用于表征非生物材料。高亲合力试剂或探针可以被配置为与非生物靶标(例如,纳米颗粒、聚合物结构等)结合。可检测探针或亲和试剂可实现非生物材料中的结构的高分辨率成像。例如,对某些纳米颗粒结构具有亲合力的可检测探针或亲和试剂可用于研究复合催化剂材料的结构、降解和中毒过程。同样,对某些带电表面活性位点具有亲合力的可检测探针或亲和试剂可用于提供有关材料表面上的反应性位点的分布和可用性的高分辨率数据。可检测探针或亲和试剂可用于靶向和定位聚合物系统如合成及天然织物中的微尺度降解和/或破坏。高亲合力探针提供的分辨率可允许在多种材料中确认对于通常的光学检查过程来说不明显的特征。
可检测探针或亲和试剂可应用于另外的多肽表征方法。可检测探针或亲和试剂可以被配置为实现单分子检测埃德曼降解技术。一般来说,埃德曼降解可通过逐步移除和检测来自每个肽的单个氨基酸残基来产生多个肽的序列读数。可通过使用可检测探针或亲和试剂检测末端氨基酸或末端氨基酸序列来促进埃德曼降解的单分子方法。图19A-19D描绘了利用可检测探针来增加每个序列读数的信号强度的埃德曼降解的可能方法。图19A描绘了具有与固体支持物1910结合的多个多肽的固体支持物1910。第一多肽1920具有带侧链R1的末端氨基酸残基,且第二多肽1930具有带侧链R2的末端氨基酸残基。图19B描绘了多个肽与可检测探针组合物的接触,所述可检测探针组合物包括对每个天然末端氨基酸残基具有高结合特异性的多个探针物质(例如,包括至少20个独特的探针物质)。第一多肽1920由被配置为对侧链R1具有结合特异性的可检测探针1940结合。第二多肽1930由被配置为对侧链R2具有结合特异性的可检测探针1950结合。可检测探针组合物的每个可检测探针具有独特的检测标志或指纹,从而允许唯一地确认每个结合事件。图19C描绘了在多个多肽中的每个肽已经与异硫氰酸酯化合物反应形成可切割产物之后埃德曼降解过程中的典型中间步骤。第一多肽1925具有带侧链R1的末端修饰氨基酸残基,且第二多肽1935具有带侧链R2的修饰末端氨基酸残基。图19D描绘了多个修饰肽与可检测探针组合物的接触,所述可检测探针组合物包括对每个修饰的天然末端氨基酸残基具有高结合特异性的多个探针物质(例如,包括至少20个独特的探针物质)。第一修饰的多肽1925由被配置为对侧链R1具有结合特异性的可检测探针1945结合。第二修饰的多肽1935由被配置为对侧链R2具有结合特异性的可检测探针1955结合。可检测探针组合物的每个可检测探针具有独特的检测标志或指纹,从而允许唯一地确认每个结合事件。在一些配置中,可检测探针组合物可以在修饰末端氨基酸残基以增加序列读数的置信度之前和之后与可检测探针组合物接触。
技术人员将容易认识到所讨论的许多实施方案可以很容易地被配置为利用上文讨论的其他技术,如使用如图15A-15D中描绘的串联条形码,或用于形成如图8、9A和9B中描绘的那些弱次级结合相互作用的方法。
实施例
实施例1:以折纸瓦片作为保留组分的亲和试剂的设计和合成
利用附有内部python脚本的CADNANO软件设计了基于折纸瓦片的亲和试剂。瓦片被设计为形状近似方形的核酸折纸,具有单层。瓦片被设计为具有在所述瓦片的顶面上的20个DNA适体结合位点和沿瓦片分子的侧面均匀分布的44个染料分子附接位点。图23描绘了基于瓦片的亲和试剂2310的示意图,其中点2330代表适体附接位置且圆圈2320代表染料附接位置。瓦片被设计的边长为大约83纳米(nm)
使用含有7249个核苷酸的M13单链环状DNA链的支架链制备折纸瓦片。设计并合成了217个单链寡核苷酸,用于与作为“订书钉”的支架链杂交,以允许组装基于瓦片的亲和试剂。
通过将支架链与217个寡核苷酸组合来组装折纸瓦片。将DNA链在90℃下在pH8.0的含有5mM Tris-HCl、5mM NaCl、1mM EDTA、12.5mM MgCl
经由HPLC尺寸排阻色谱或100kDa尺寸截止旋转过滤器纯化退火的基于瓦片的亲和试剂。将纯化的基于瓦片的亲和试剂重新悬浮在pH 8.0的含有5mM Tris-HCl、200mMNaCl、1mM EDTA、11mM MgCl
实施例2:折纸瓦片的图像分析
如实施例1中所述制备基于折纸瓦片的亲和试剂。经由透射电子显微术(TEM)对瓦片探针进行成像以确认组装方法成功。将瓦片探针溶液点样在辉光放电的碳沉积铜栅上,并使用甲酸双氧铀进行负染色。
在120千伏(kV)的加速电压下,以30,000倍的放大倍数在FEI Tecnai T12透射电子显微镜上对瓦片探针进行成像。如所预测,瓦片探针看起来形状近似方形,边长为约83nm。
实施例3:具有基于抗体的结合组分的基于瓦片的亲和试剂的设计和合成
利用附有内部python脚本的CADNANO软件设计抗体瓦片可检测探针。折纸瓦片被设计为形状近似方形,具有单层。瓦片被设计为具有6个抗体结合位点(2个在顶面上,且沿着瓦片的每一侧有1个)和沿瓦片分子的侧面均匀分布的40个染料分子附接位点。图25描绘了基于瓦片的亲和试剂2510的示意图,其中抗体组分2520在各自的附接位置,且圆圈2530代表标记组分的附接位置。瓦片被设计边长为大约83纳米(nm)
使用含有7249个核苷酸的M13单链环状DNA链的支架链制备折纸瓦片。设计并合成了217个单链寡核苷酸,用于与支架链杂交以允许组装瓦片探针。寡核苷酸中的6个是用反式环辛烯修饰的核苷酸合成的,以使得能够经由点击反应附接抗体组分。
通过将支架链与217个寡核苷酸组合来组装瓦片。将DNA链在90℃下在pH8.0的含有5mM Tris-HCl、5mM NaCl、1mM EDTA、12.5mM MgCl
经由HPLC尺寸排阻色谱法或100kDa尺寸截止旋转过滤器纯化退火的瓦片。将纯化的瓦片重新悬浮在pH 8.0的含有5mM Tris-HCl、200mM NaCl、1mM EDTA、11mM MgCl
图27显示了经由TCO-mTz点击反应产生的纯化抗体-DNA寡核苷酸缀合物的SDS-page凝胶。泳道A含有抗体-DNA寡核苷酸缀合物。泳道B含有mTz修饰的抗体阴性对照。泳道C含有未修饰的抗体对照。观察到最上面的黑色条带,证实抗体成功地附接于DNA寡核苷酸。
实施例4:具有基于适体的结合组分的基于瓦片的亲和试剂的结合
根据实施例1的方法制备四个不同种类的适体瓦片探针。每种基于瓦片的亲和试剂含有对末端组氨酸标签具有不同结合亲和力的不同适体。使用的四个适体是:B1(最高亲和力)、A1(中等亲和力)、D1(低亲和力)和SC2(无亲和力)。用20个适体和40个
筛选每个适体针对带his标签的泛素的单分子阵列的结合。通过在流体芯片上沉积泛素缀合物(附接于结构化核酸颗粒的泛素)的10纳克/微升溶液来制备蛋白质阵列。每个流体芯片含有3个泳道,每个泳道具有玻璃表面,玻璃表面覆盖有3-氨丙基三乙氧基硅烷(APTMS)包衣。制备三种不同类型的蛋白质阵列,每个芯片上每个泳道1个:带his标签的泛素;带flag标签的泛素(阴性对照);和不带标签的泛素(阴性对照)。每个沉积的蛋白质缀合物含有
为了测试结合,使15μl的20nM亲和试剂溶液流入流体芯片。允许探针结合10分钟。在亲和试剂结合之后,用冲洗溶液冲洗流体芯片。使用ThorLab显微镜以20x放大倍数和647nm激发在表面上对结合进行成像。将在647nm下的显微镜图像与在488nm下的图像进行比较,以确定由施加的亲和试剂结合的蛋白质的分数。针对3个阵列中的每一个测试了所有四个亲和试剂种类。每组重复进行12次实验。
图28A-28D描绘了结合的占据率。占据率被确定为观察到具有检测到的结合的位置与具有已知蛋白质缀合物的总位置的比率。图28A显示了B1适体试剂的占据率相比于A1适体试剂的占据率。尽管结合亲和力较低,但A1适体试剂显示出具有几乎与B1适体试剂一样高的占据率。图28B显示了B1适体试剂的占据率相比于D1适体试剂的占据率。图28C和28D分别比较了B1相比于SC2和D1相比于SC2的占据。如图28B和28D中所示,尽管对带his标签的蛋白质的结合亲和力低,但观察到D1适体试剂的占据率几乎是B1适体试剂的一半,并且显著高于阴性对照SC2适体试剂,表明可检测探针可以通过亲合力效应显著提高对弱结合适体观察到的结合亲和力。
实施例5.具有基于抗体的结合组分的基于瓦片的亲和试剂的结合
根据实施例2和3制备具有基于抗体的结合组分的基于瓦片的亲和试剂。用六个10x抗His抗体和40个
图29A-29C显示了试剂结合的荧光显微镜图像。图29A和29B分别显示了试剂与不带标签的和带flag标签的泛素阵列的结合。图29C显示了试剂与带his标签的泛素阵列的结合。观察到与带his标签的阵列的更高水平的探针结合。
图30显示了亲和试剂针对6个不同芯片上的3个不同蛋白质阵列的占据率。对于所有6个芯片都观察到带his标签的蛋白质阵列上的高占据率,而对每个流体芯片上的其他不带his标签的蛋白质观察到的占据率低得多。
实施例6.多重结合测定
组装包括1型或2型荧光团的可检测的亲和试剂。可用的荧光团具有红色、黄色、绿色或蓝色波长(R、Y、G、B)的发射。命名每个荧光团以指示可检测探针上的每一荧光团的总数。例如,具有10个红色荧光团和10个黄色荧光团的可检测的亲和试剂将被命名为“R10Y10”。具有独特荧光团组合的每一亲和试剂附接于对靶部分具有独特结合特异性的独特种类的结合组分。形成了两个独特的荧光团池,其中每个池的组成列于下表1中。
使亲和试剂池与第一结合配偶体接触。在对应于四个可能的荧光团的波长下测量荧光强度。测得的荧光强度与可能可用的荧光团数目相关。表2展示了基于荧光强度测得的荧光团计数,以及来自每个池的结合探针的组合,其将产生观察到的荧光强度的独特组合。
表2
基于观察到的荧光强度,可以预测结合配偶体可用的靶部分。
使亲和试剂池与第二结合配偶体接触。在对应于四个可能的荧光团的波长下测量荧光强度。测得的荧光强度与可能可用的荧光团数目相关。表3展示了基于荧光强度测得的荧光团计数,以及来自每个池的结合的亲和试剂的组合,其将产生观察到的荧光强度的独特组合。
基于观察到的荧光强度,可以预测结合配偶体可用的靶部分。可检测的亲和试剂的多重池的合理工程化可产生独特的结合标志,其预测结合配偶体内同时存在多个靶部分。
实施例7.亲和色谱法
准备三个亲和色谱柱。第一色谱柱包括第一色谱树脂,该第一色谱树脂包括共价附接于树脂的亲和试剂。第一柱中的亲和试剂对多肽具有一般的结合亲和力,而不管氨基酸序列如何。第二色谱柱包括第二色谱树脂,该第二色谱树脂包括共价附接于树脂的亲和试剂。第二柱中的亲和试剂对在其氨基酸序列内包括赖氨酸-精氨酸-丙氨酸(KRA)氨基酸三聚体序列的多肽具有结合亲和力。第三色谱柱包括第三色谱树脂,该第三色谱树脂包括通过寡核苷酸杂交与树脂偶联的亲和试剂。第三柱中的亲和试剂对在其氨基酸序列内包括赖氨酸-谷氨酸-天冬酰胺(KEN)氨基酸三聚体序列的多肽具有结合亲和力。
三个亲和色谱柱依次排列。将粗细胞裂解物施加于第一通用分离柱。自粗细胞裂解物捕获多肽,而裂解物的非多肽级分通过柱并被弃去。在弃去裂解物的非多肽之后,通过将洗脱缓冲液施加于第一柱来洗脱多肽级分。捕获洗脱的级分,并将其施加于第二KRA特异性色谱柱。多肽的第一级分被捕获在KRA特异性树脂上,而第二级分通过柱并被捕获。在自柱的端部收集第二级分之后,通过洗脱缓冲液从柱中洗脱多肽的第一级分,并在柱端部收集。
将来自KRA特异性色谱柱的第一收集的多肽级分添加到第三KEN特异性色谱柱中。多肽的第一级分被捕获在KEN特异性树脂上,而第二级分通过柱并被捕获。在自柱的端部收集第二级分之后,通过加热柱从柱中洗脱多肽的第一级分以使寡核苷酸杂交解链,从而从柱中释放可检测探针。
用新批次的KEN特异性可检测的亲和试剂补充由第一级分分离释放的亲和试剂来使KEN特异性柱再生。然后对来自KRA特异性柱的第二收集的级分重复分离。收集第一通过的级分,接着是第二捕获的级分。在自KRA特异性柱分离出两个级分之后,形成总共四个级分。图40显示了从初始细胞裂解物到最终四个多肽级分的色谱过程的示意图,其中四个级分的初步确定的特征列于底部。基于每个级分的色谱行为评价四个级分的初步表征。由于假阴性或假阳性捕获相互作用的可能性,表征被认为是初步的。
收集在KEN特异性柱上捕获的多肽的两个级分作为亲和试剂-多肽复合物。将亲和试剂结合的多肽级分中的每一者依次施加于包括多个附接位点的图案化硅固体支持物,其中每个位点被配置为捕获并结合亲和试剂。在将每个亲和试剂结合的级分施加于芯片之后,使用荧光显微术测量并记录固体支持物上每个占据的附接位点的位置。
来自KEN特异性柱的两个非捕获的级分附接于结构化核酸颗粒。将每个非捕获的级分施加于硅固体支持物,与捕获的级分一样,通过荧光显微术观察占据的附接位点。在所有四个级分与固体支持物结合之后,已产生多肽的图案化阵列用于多肽测定。
实施例8.基于FluoSphere
使用包括可修饰的表面化学性质的高荧光性有机纳米颗粒制备可检测的亲和试剂。图41示出了用于制备基于FluoSphere
在将寡核苷酸附接于FluoSpheres
表4.寡核苷酸附接柄序列
实施例9.基于量子点的亲和试剂的合成
使用包括可修饰的表面化学性质的高荧光性无机纳米颗粒制备可检测的亲和试剂。将15nm羧化量子点(Thermo Fisher)用聚乙二醇部分修饰,以在量子点颗粒周围形成非粘附层。将量子点与NH
在将寡核苷酸附接于量子点之后,提供用于偶联亲和试剂的附接位点。将寡核苷酸官能化的量子点与包括官能化寡核苷酸柄的互补序列的寡核苷酸合并。将混合物加热到95℃持续5分钟,然后在70℃下退火10分钟,之后冷却到室温。可替代地,互补寡核苷酸可以被退火到DBCO官能化的寡核苷酸上,之后附接于量子点。寡核苷酸的序列列于表4中。
实施例10.基于FluoSphere
检查基于FluoSphere
通过测量ζ电位以确定表面钝化的程度来表征PEG化FluoSpheres
将PEG化FluoSpheres
制备PEG基团大小不同的PEG化FluoSpheres
实施例11.基于FluoSphere
测试基于FluoSphere
通过将生物素化三聚体氨基酸序列固定至链霉亲和素包被板来制备用于结合研究的肽靶标。图43A显示了各种适体制剂(中靶:P7-B1-P5-FS是FluoSphere
测量基于FluoSphere
实施例12.基于FluoSphere
测试制备的基于FluoSphere
实施例13.基于FluoSphere
与单适体P7-B1-P5-荧光团缀合物的结合亲和力相比,测量P7-B1-P5偶联的基于FluoSphere
图45A-45D分别显示了基于FluoSphere
实施例14.基于量子点的亲和试剂的结合表征
根据实施例9的方法制备含有量子点荧光团作为保留组分的可检测亲和试剂。将基于量子点的亲和试剂与P7-B1-P5适体(靶组氨酸标签)偶联。进行结合测量以确定基于量子点的亲和试剂的结合特性。
图24A和24B展示了P7-B1-P5-基于量子点的亲和试剂的结合测量数据。图24A展示了与带his标签的Her2蛋白(中靶结合)和肌红蛋白(脱靶对照)接触的基于量子点的P7-B1-P5亲和试剂的荧光测量值。针对Her2-his靶标,观察到荧光信号随着亲和试剂浓度的增加而增加。当亲和试剂与肌红蛋白对照接触时,几乎没有观察到荧光信号变化,表明基于量子点的P7-B1-P5适体能够区别和结合它们的预期靶标。图24B展示了基于量子点的P7-B1-P5亲和试剂针对HHH肽的EC50测量数据。EC50经测量为60nM,表明基于量子点的亲和试剂与它们的预期靶标结合。
实施例15.基于FluoSphere
制备具有不同官能化基团与非官能化基团比率的基于FluoSphere
实施例16.亲和试剂与基于FluoSphere
经由结合组分与官能化纳米颗粒的直接缀合来制备基于FluoSphere
实施例17.荧光dUTP核苷酸的酶促掺入
将AlexaFluor-647dUTP核苷酸酶促掺入到适体的3’端区域,如图49B中所述。掺入到适体的荧光团在647nm下显现,如图52中所示,显示了荧光团成功掺入。
实施例18.AlexaFluor-647 NHS酯缀合至氨基烯丙基dUTP
采用图49B中描述的方法将AAdUTP核苷酸掺入至适体中。将所得标记适体与荧光团化学缀合,在凝胶上运行,用SYBR处理,并在488nm下显现以显示双链DNA(图53A),并在647nm下显现以显示荧光团的存在(图53B)。
实施例19.dsDNA-647标记的适体浓度测量
使用在260nm下的吸光度测量dsDNA-647标记的适体浓度,结果示于图54中。为了检查AlexaFluor-647与适体的缀合效率,使用荧光团标准曲线(图55A)来确定荧光团浓度(图55B)。荧光团浓度测量用于确定估计标记程度的荧光团:DNA比率,如图56中所示。
实施例20.dsDNA-647中靶结合和成像
为了评估标记适体的靶结合和成像,使用对表位HHH特异性的dsDNA-647标记适体进行实验。将HHH肽固定在微板表面上,并暴露于标记适体,如图57A中所示。图57B显示了标记的适体与HHH肽的结合,图57C显示了缺乏与阴性对照肽MetGluThr的结合。
为了评估成像,在定制的20x物镜落射荧光显微镜上以各种浓度显现标记适体,如图57D中所示。
虽然本文已经显示和描述了本发明的优选实施方案,但本领域技术人员显而易见的是,这类实施方案仅是以举例的方式提供的。本发明并不旨在受说明书内提供的具体实施例的限制。虽然已经参考前述说明书描述了本发明,但对本文的实施方案的描述和说明并不意味着在限制意义上进行解释。在不脱离本发明的情况下,本领域技术人员将会设想到许多变化、改动和替换。此外,将要理解的是,本发明的所有方面并不局限于本文阐述的具体描述、配置或相对比例,这些取决于各种条件和变量。应当理解的是,在实施本发明时可以采用本文描述的本发明的实施方案的各种替代方案。因此预期本发明还将涵盖任何这类替代、修饰、变化或等同方案。以下权利要求旨在限定本发明的范围,并且由此涵盖这些权利要求范围内的方法和结构及其等同方案。
- 颗粒、具有针对目标物质的配体的亲和颗粒、包含其的体外诊断用试剂和试剂盒和目标物质的检测方法
- 使活性多肽的结合亲和力和结合特异性增强的蛋白质骨架模块
