线虫抑制
文献发布时间:2024-04-18 19:58:21
相关申请的交叉引用
本申请根据35 U.S.C.§1.19(e)要求2021年4月13日提交的美国临时专利申请号63/174,191的优先权权益,将该专利通过引用以其全文并入本文。
技术领域
本披露涉及线虫抑制方法。还提供了提高易感线虫植物的产量的方法。
通过引用并入以电子方式提交的材料
本申请含有作为本披露的单独部分的、计算机可读形式的序列表,该序列表通过引用以其全文并入并且标识如下:文件名:202662_Seqlisting.txt;大小:15,423字节;创建于:2022年3月21日。
背景技术
线虫是一种活的、柔软的、细长的生物体,生活在潮湿表面上或液体环境中,包括土壤内的水膜和其他生物体内的潮湿组织。许多线虫物种已进化为非常成功的植物和动物寄生虫,并给农业和畜牧业造成重大经济损失,并导致人类发病和死亡(Whitehead(1998)Plant Nematode Control.[植物线虫防治]CAB International[国际应用生物科学中心],纽约)。
据估计,寄生线虫每年给全球园艺和农业行业造成的损失超过780亿美元,这是基于所有主要作物的年平均损失为12%的估计。例如,据估计,全球每年因线虫造成的大豆损失大约为32亿美元(Barker等人(1994)Plant and Soil Nematodes:Societal Impact andFocus for the Future.[植物和土壤线虫:社会影响和未来的焦点]The Committee onNational Needs and Priorities in Nematology.[线虫学国家需要和优先事项委员会]Cooperative State Research Service[国家合作研究服务处],US Department ofAgriculture and Society of Nematologists[美国农业部和线虫学家协会])。植物寄生线虫是全球所有主要粮食商品的害虫,包括玉米、大麦、高粱、燕麦、黑麦、水稻、马铃薯、木薯、甘薯、小麦、大豆、油菜籽和向日葵(Nicol等人(2011)),此外也是水果和蔬菜作物、纤维作物(例如,棉花)、观赏性植物和草坪草的重要害虫(Current Nematode Threats toWorld Agriculture.[当前线虫对世界农业的威胁],J.Jones等人(编辑)Genomics andMolecular Genetics of Plant-Nematode Interactions[植物线虫相互作用的基因组学和分子遗传学],Springer Science+Business Media B.V.[施普林格科学和商业媒体公司]2011)。
众所周知,线虫影响作物和植物的产量、生长和健康。由线虫的幼虫和/或成虫引起的寄主植物根部的生理变化可导致虫瘿的形成,从而破坏植物根部的维管系统。根部伸长会完全停止,减少的根系可能导致提供的水分和养分供应不足,从而造成叶子萎黄和/或枯萎以及生长发育迟缓,任何一种情况都可能导致低产量或死亡。另外,线虫可以引起生理效应,导致植物根部对细菌和/或真菌(包括植物原本抵抗的细菌和/或真菌)攻击的易感性增加。这种攻击会导致大量的二次腐解和腐烂。
根腐线虫最短尾短体线虫(Pratylenchus brachyurus)已成为越来越重要的大豆病原体。它具有广泛的寄主范围,并且广泛分布于热带和亚热带地区,特别是在巴西、非洲和美国南部。最短尾短体线虫已成为巴西塞拉多(Cerrado)地区大豆、玉米和棉花种植者关注的问题,并且被认为是该地区大豆的主要线虫病原体。在大豆中,这种线虫可以使产量降低30%至50%,其中在沙质土壤中观察到更大的损害。
可以采用几种跨栽培防治、生物防治和化学防治的方法进行线虫管理。寄主植物抗性(一种栽培防治形式)一直是最有效且最具成本效益的管理方法。然而,针对许多线虫物种(尤其是迁徙性寄生虫,如最短尾短体线虫)的寄主植物抗性都不可得到。寄主植物抗性的采用在以下情况也会受到限制:遗传复杂(即涉及多个基因),还赋予了负面农艺性状,或者存在能够克服该抗性的害虫生物型。其他栽培防治策略包括植物检疫、作物轮作和耕作。植物检疫限制了可能携带入侵性害虫物种或促进其增加的植物部分的进口和移动。植物检疫可以防止线虫进入一个国家或地区,但如果线虫物种已经在一个国家或地区广泛分布(如巴西的最短尾短体线虫),这样的检疫是不可行的。
作物轮作是在单个位置跨季节交替生长多种作物的做法。对于寄主范围有限的线虫害虫,作物轮作是一种有效的管理策略。线虫的寄主范围定义为那些能够支持线虫物种存活和繁殖的植物。许多迁徙性害虫(如最短尾短体线虫)的寄主范围特别广泛,因此轮作到非寄主是不切实际的。对于巴西的最短尾短体线虫,所有与大豆轮作的主要经济作物都是合适的寄主。只有有限数量的覆盖作物(如大托叶猪屎豆(Crotalaria spectabilis)和狭叶猪屎豆(Crotalaria ochroleuca))是非寄主。然而,这些覆盖作物不提供可销售的粮食或饲料产量,因此种植成本高,没有经济回报。让田地休耕一季是与种植非寄主覆盖作物类似的另一种策略。虽然田地休耕消除了种植覆盖作物的成本,但也带来了潜在的负面生态后果(如土壤侵蚀)的固有风险。大多数线虫也可以处于静止状态,从而可以在休耕田地中长期存活直到种植了合适的寄主。对于最短尾短体线虫,在没有寄主植物的情况下可以维持存活超过90天(Ribeiro等人,Heliyon[赫利永]6:e05075,2020)。最后,耕作是一种潜在的线虫防治策略,但对于那些由于土壤健康原因而实行免耕农业的农民来说并不适用。耕作是通过物理干扰为种植准备土壤。巴西塞拉多地区的大部分大豆耕地采用免耕方式(即在生长季节期间或耕作季节之间不进行机械耕作)。耕作也可能对不同的线虫物种产生相反的影响。大豆胞囊线虫(Heterodera glycines,soybean cyst nematode)和最短尾短体线虫在塞拉多地区的许多田地中共存。耕作会增加大豆胞囊线虫的发病率(Workneh等人,Phytopathology[植物病理学]89:844-850,1999)、传播(Gavassoni等人,Phytopathology[植物病理学]91:534-545,2001)和伤害,而在一些生产系统中,需要两到三轮深耕来减少短体线虫属物种群体(Khan等人,(2021)Emerging Important NematodeProblems in Field Crops and Their Management.[大田作物及其管理中出现的重要线虫问题].Singh K.P.,Jahagirdar S.,Sarma B.K.(编辑)Emerging Trends in PlantPathology.[植物病理学的新趋势]Springer[施普林格],新加坡)。
线虫的生物防治不易操纵。最近开发了具有线虫抑制特征的真菌和细菌种子处理。一般来说,这些种子处理有几个局限性,包括额外的成本、功效中等、不同环境下表现各异和保护窗口期短(通常仅限于生长季节的早期)(Dias-Arieira等人,Journal ofPhytopathology[植物病理学杂志]166:722-728,2018)。
对于许多缺乏足够的寄主植物抗性的作物来说,防治植物寄生线虫的化学手段仍然至关重要。然而,化学剂的活性往往不具有选择性,并且可能对非靶标生物体产生负面影响,包括暂时破坏有益微生物群体。近年来,多种化学杀线虫剂的注册被撤销、取消或限制使用,从而限制了沟内杀线虫剂的可用性(Fosu-Nyarko和Jones,Advances in BotanicalResearch[植物学研究进展]v73 doi:10.1016/bs.abr.2014.12.012,2015)。
因此,需要额外手段来防治伤害和/或损害农业上重要植物的线虫群体。
发明内容
在一方面,本文描述了一种抑制场所中线虫群体的方法,该方法包括在场所中生长抗线虫植物,其中生长该抗线虫植物在该抗线虫植物生长期间和/或之后的时间段抑制该场所中的线虫群体,或者维持对该场所中该线虫群体的抑制。在一些实施例中,时间段延伸至抗线虫植物生长的生长季节之后的一个或多个生长季节。在一些实施例中,方法进一步包括在生长抗线虫植物之后的时间,在场所中生长次生植物。在一些实施例中,方法进一步包括在生长抗线虫植物之前的时间,在场所中生长次生植物。在一些实施例中,方法进一步包括在场所中同时生长抗线虫植物与次生植物。
在一些实施例中,次生植物是易感线虫植物。在一些实施例中,易感线虫植物是多年生植物或一年生植物。在一些实施例中,易感线虫植物是大豆植物、玉米植物、棉花植物、油菜植物、甘蔗植物、马铃薯植物、小麦植物、蔬菜植物、水稻植物、苜蓿植物、大麦植物、高粱植物、燕麦植物、黑麦植物、木薯植物、甘薯植物、向日葵植物、水果植物、果园植物(如果树或坚果树)、观赏植物、或葡萄藤。在一些实施例中,线虫群体被抑制或维持在检测限或检测限以下。在另外的实施例中,次生植物为臂形草属(Brachiaria),并且当每克根的线虫数量为、约为或小于约60个线虫时,实现对线虫群体的抑制。在一些实施例中,次生植物为玉米,并且当每克根的线虫数量为、约为或小于约300个线虫时,实现对线虫群体的抑制。在另一些实施例中,次生植物为棉花,并且当每克根的线虫数量为、约为或小于约60个线虫时,实现对线虫群体的抑制。在一些实施例中,次生植物为高粱,并且当每克根的线虫数量为、约为或小于约250个线虫时,实现对线虫群体的抑制。在另外的实施例中,在次生植物生长的场所中对线虫群体的抑制在以下情况实现:当每克根的线虫数量相对于在与次生植物生长的场所相当的场所中每克根的线虫数量减少、减少约或至少减少约5%时。
在另一方面,本文描述了一种针对场所的线虫管理方法,该方法包括:在第一生长季节在场所中生长抗线虫植物,其中在该第一生长季节中生长该抗线虫植物抑制该场所中的线虫群体或维持对该场所中该线虫群体的抑制;在相同的或随后的生长季节,在该场所中生长易感线虫植物;以及与该线虫群体未被抑制的情况下预期的健康和/或产量相比,实现对该易感线虫植物的健康和/或产量的改善。
在一些实施例中,抗线虫植物表达Cry蛋白,例如但不限于杀线虫Cry蛋白。在一些实施例中,抗线虫植物是大豆植物、玉米植物、棉花植物、油菜植物、甘蔗植物、甜菜植物、马铃薯植物、小麦植物、水稻植物、苜蓿植物、大麦植物、高粱植物、燕麦植物、黑麦植物、木薯植物、甘薯植物、向日葵植物、蔬菜植物、水果植物、观赏植物、果园植物(如果树或坚果树)、或葡萄藤。
在一些实施例中,线虫是选自以下的线虫物种:短体线虫属物种(Pratylenchusspp.)线虫群体例如最短尾短体线虫(Pratylenchus brachyurus)、根结线虫属物种(Meloidogyne spp.)、胞囊线虫属物种(Heterodera spp.)例如大豆胞囊线虫(Heteroderaglycines)、黄金线虫属物种(Globodera spp.)、肾形肾状线虫(Rotylenchulusreniformis)、螺旋线虫属物种(Helicotylenchus spp.)例如双宫螺旋线虫(Helicotylenchus dihystera)、小尾盾线虫(Scutellonema brachyurus)、图比萨巴图克萨阿线虫(Tubixaba tuxaua)或水稻干尖线虫(Aphelencoides besseyi)。在一些实施例中,短体线虫属物种为最短尾短体线虫。
在一些实施例中,易感线虫植物的健康的改善包括以下中的一个或多个:改善根发育(例如,改善根或根毛生长);改善产量;更快出苗;改善植物胁迫管理,包括提高耐逆性和/或改善胁迫恢复;增加机械强度;改善抗旱性;减少真菌、细菌和/或病毒性疾病感染;或其任何组合。
还提供了保护易感线虫植物免受线虫伤害或损害的方法,这些方法包括在种植该易感线虫植物之前的至少一个生长季节,在场所中生长抗线虫植物;以及在生长该抗线虫植物之后的至少一个生长季节,在该场所中生长易感线虫植物。在一些实施例中,保护易感线虫植物免受线虫损害包括提高收获的易感线虫植物材料的产量、或增加从销售收获的易感线虫植物材料所赚取的钱。
还提供了针对场所的线虫管理方法,该方法包括在场所中生长抗线虫植物;以及在生长该抗线虫植物之后的时间,在该场所中生长易感线虫植物。在一些实施例中,易感线虫植物是多年生植物。在一些实施例中,易感线虫植物是一年生植物。
在另一方面,本披露提供了针对场所的线虫管理方法,该方法包括在场所中同时生长抗线虫植物与易感线虫植物。在一些实施例中,易感线虫植物是多年生植物。在一些实施例中,易感线虫植物是一年生植物。
在另一方面,本披露提供了针对场所的线虫管理方法,这些方法包括在场所中种植易感线虫植物,其中该易感线虫植物是一年生植物或多年生植物;以及在种植该易感线虫植物之后的时间,在该场所中生长抗线虫植物。在一些实施例中,易感线虫植物是蔬菜植物、水果植物、果园植物、观赏植物、或葡萄藤。
在另一方面,本披露提供了一种具有抑制的线虫群体密度的场所,其中该抑制的线虫群体密度通过本文所述的方法实现。还提供了一种在场所中生长的抗线虫植物、从该植物中收获的植物材料、和由该植物产生的种子;以及以下场所,该场所:(i)不需要耕作、(ii)不需要覆盖作物、或(iii)不需要在每年或每次作物轮作休耕一个生长季节。在一些实施例中,场所提供以下益处中的一种或多种:a.该场所不需要在每个作物轮作周期休耕一个生长季节;b.该场所不需要在每个作物轮作周期耕作一个生长季节;以及c.该场所不需要种植覆盖作物。在一些实施例中,抑制的线虫群体密度为、约为或小于约250、200、150、100、50、20或10个线虫/克(g)根。
本文所述的方法和系统通过以下方式在作物轮作系统中提供益处和价值:(i)在作物轮作周期中的至少一个生长季节期间,能够增加不需要休耕、耕作或生长覆盖作物的场所的使用,以防治线虫;以及(ii)通过抑制场所中的线虫群体,使该场所能够更成功地使用,从而使具有内在价值的易感线虫植物成功生长并提高产量。还提供了一种在场所中生长的易感线虫植物、从该易感线虫植物收获的植物材料(例如,在棉花植物的情况下,棉绒和棉纤维)、以及由易感线虫植物产生的种子。
在另一方面,本披露提供了一种用于增加场所使用的系统,该系统包括在第一生长季节在场所中生长抗线虫植物;以及在随后的生长季节在该场所中生长易感线虫植物。在一些实施例中,抗线虫植物和第一易感线虫植物中的每一种都是具有内在价值的作物植物。在一些实施例中,在随后的生长季节中,场所在生长季节没有休耕。在一些实施例中,在随后的生长季节期间,没有生长覆盖植物或覆盖作物。在一些实施例中,抗线虫植物、第一易感线虫植物和第二易感线虫植物在三个连续的生长季节中生长。在一些实施例中,抗线虫植物、第一易感线虫植物和第二易感线虫植物中的每一种都是具有内在价值的作物植物。
在又一方面,本披露提供了一种用于改善作物轮作系统的方法,该方法包括在第一生长季节期间,在场所中生长抗线虫植物;以及在随后的生长季节期间,在该场所中生长易感线虫植物,其中在该第一生长季节期间在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该易感线虫植物能够在该随后的生长季节中生长或改善该易感线虫植物在该随后的生长季节中的生长。在一些实施例中,改善的作物轮作系统可以进一步包括以下中的一个或多个:
a.每年场所至少多使用一个生长季节;
b.降低场所的耕作;
c.减少对易感线虫作物种子的杀线虫剂处理;
d.在易感线虫植物的生长季节之前或期间,减少场所的使用杀线虫剂的处理面积;
e.在易感线虫植物的生长季节之前或期间,降低对易感线虫植物和/或场所的杀线虫剂施用率;
f.在生长季节期间,降低对易感线虫植物和/或场所的杀线虫剂施用次数;
g.提高场所的可用性;
h.增加场所的价值;
i.改善可持续农业实践;和/或
j.提高易感线虫作物的产量。
在另一方面,本披露提供了一种针对场所的线虫管理方法,该方法包括:在生长季节期间,在场所中生长抗线虫植物;以及在该生长季节之前、期间和/或之后,在该场所中生长多年生植物,其中在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该多年生植物能够生长或改善该多年生植物的生长。
在一些方面,本披露提供了用于营销作物轮作系统的方法,该方法包括:在第一生长季节期间,促进抗线虫植物的使用;以及在相同的或随后的生长季节期间,促进场所中易感线虫植物的使用,其中在该第一生长季节期间在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该易感线虫植物能够在该随后的生长季节中生长或改善该易感线虫植物在该随后的生长季节中的生长。在一些实施例中,随后的生长季节紧邻第一生长季节。
在另外的方面,本披露提供了针对作物轮作系统的营销材料,该作物轮作系统在第一生长季节期间生长抗线虫植物,与此协调或在此之后,在随后的生长季节期间在该场所中生长易感线虫植物,其中在该第一生长季节期间在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该易感线虫植物能够生长或改善该易感线虫植物的生长。在一些实施例中,营销材料旨在促进作物轮作系统。
在一些方面,提供了针对场所的线虫管理方法,这些方法包括:在场所中生长次生作物之前、同时或之后,在该场所中生长抗线虫植物。在一些实施例中,抗线虫植物表达与SEQ ID NO.1具有至少95%、96%、97%、98%或至少99%序列同一性的杀线虫Cryl4Ab蛋白。在一些实施例中,抗线虫植物包含优良种事件(elite event)EE-GM5。在另外的实施例中,抗线虫植物包含优良种事件EE-GM4。在本披露的任何方面或实施例中,抗线虫植物表达苏云金芽孢杆菌毒素Cry14Ab-1。在本披露的任何方面或实施例中,抗线虫植物包含优良种事件EE-GM5。在本披露的任何方面或实施例中,抗线虫植物包含优良种事件EE-GM4。
附图说明
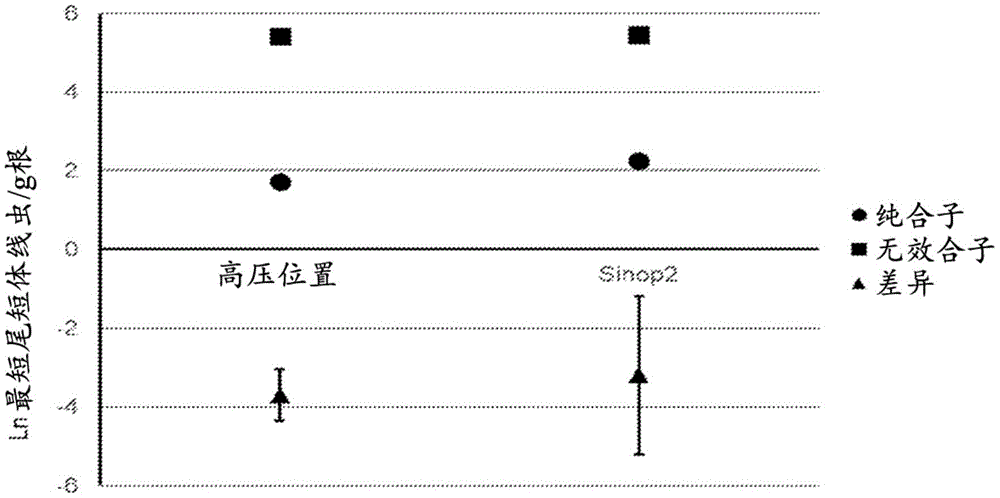
图1为显示GMB151大豆对最短尾短体线虫群体密度的影响的图。估计了GMB151纯合子大豆品系和无效合子(Nullizygous)大豆品系在三个预计高压地点和Sinop2地点(该地点的最短尾短体线虫群体密度高于预计)的最短尾短体线虫群体密度。GMB151转基因大豆性状显著减少了最短尾短体线虫群体。95%置信区间由纯合子品系和无效合子品系之间估计差异的误差条表示。
图2为显示每个研究地点中GMB151纯合子品系和无效合子品系之间的大豆产量差异的图。研究地点从最低到最高最短尾短体线虫群体密度排列。估计产量差异的误差条表示95%置信区间。GMB151性状不影响最短尾短体线虫群体密度最低的三个位置的产量。在最短尾短体线虫群体密度最高的三个地点,GMB151显著提高了大豆产量,平均提高了7.0蒲式耳/英亩或21%。
图3提供了实例3中描述的田间试验种植图。在第一季(safra)(夏季或第一茬)大豆季节种植大豆。在随机完全区组设计中,每个处理种植五个重复。在大豆收获后种植第二季(safrinha)(冬季或第二茬)棉花和玉米试验品。将第二季作物试验品种植在大豆试验地的顶部,第二季作物行垂直于收获的第一季大豆行。第二季作物试验设计也构成了一个随机完全区组设计,但每种作物只有三个重复。
图4为显示在2019/20巴西生长季节(戈亚斯州(Goiás)的里奥韦尔迪(Rio Verde)田地)GMB151大豆提供的最短尾短体线虫防治量的图。星号表示P<0.05的显著差异。
图5为显示在2019/20生长季节(戈亚斯州的里奥韦尔迪田地)第一季大豆和第二季玉米产量和总收入的图。
图6为显示在2019/20巴西生长季节在所有田间试验地点GMB151大豆提供的最短尾短体线虫防治(以第二季作物中每克根的最短尾短体线虫量记)的图。
图7为显示在2019/20生长季节在所有田间试验地点的第二季玉米和棉花产量的图。
图8提供了示例性作物轮作系统。
图9为显示GMB151大豆对最短尾短体线虫群体密度的影响的图。在49个试验地点,针对GMB151纯合子大豆品系和无效合子大豆品系对最短尾短体线虫群体密度进行了估计。GMB151转基因大豆性状显著减少了最短尾短体线虫群体。平均值的标准误差由纯合子品系和无效合子品系的平均值的误差条表示。
图10为显示48个试验地点的GMB151纯合子品系和无效合子品系之间的大豆产量差异的图。误差条描述了处理平均值的标准误差。GMB151性状显著提高了大豆产量,平均提高4.2蒲式耳/英亩或9%。
图11为显示替代性线虫管理工具及其对第一季大豆作物中最短尾短体线虫群体密度的影响的图。对GMB151和无效(null)大豆都施用了杀线虫剂种子处理和沟内杀线虫剂。GMB151大豆提供的防治显著优于种子处理或沟内杀线虫剂。
图12为显示与GMB151大豆事件相比,耕作的线虫栽培防治策略功效及其对最短尾短体线虫群体密度的影响的图。与传统耕作相比,GMB151大豆事件对第一季大豆作物中最短尾短体线虫的防治显著更优。
图13为显示在第二季作物田间试验中GMB151大豆提供的最短尾短体线虫防治(以第二季作物中每克根的最短尾短体线虫量记)的图。
具体实施方式
植物寄生线虫能够攻击农业轮作或作物轮作系统中的多种栽培植物(本文定义为“作物”或“农作物”),并且可以随着时间的推移建立大的群体密度。农民认为具有经济效益的栽培植物(“经济作物”)或对农民有其他价值或有用的栽培植物(如牲畜饲料)(所有这些都是具有“内在价值”的作物),以及仅为保护田地免受侵蚀或提供其他土壤健康益处而栽培的无盈利的植物或作物(“覆盖作物”)几乎都或多或少地易受线虫伤害。某些植物可能是具有内在价值的作物或者是无利润的作物,这取决于它们的使用方式。其中一种植物是臂形草属,也被称为信号草(signal grass)。信号草可以作为放牧作物(因此是一种具有内在价值的作物)生长,或者在不用于放牧时作为无利润的覆盖作物生长。值得注意的是,作为非限制性实例,经济作物(如大豆、棉花、玉米、小麦、甘蔗、马铃薯、甜菜、水稻、苜蓿、大麦、高粱、燕麦、黑麦、木薯、甘薯、向日葵、蔬菜、水果植物、果树、坚果树、观赏植物、葡萄藤和油菜)易受线虫的影响,并且线虫造成的伤害或损害会显著降低产量,从而导致农民收入减少。农民必须确定有效的管理选项,以防治线虫害虫对他们种植的每种作物造成伤害和损害。
此外,农民可能不得不调整他们的作物轮作或作物演替,以避免在连续的生长季节生长多种易感作物。当农民面对寄主范围广、能够在许多农作物上繁殖的线虫时,这个问题可能具有挑战性。在最坏的情况下,农民可能会被迫放弃种植具有经济效益的经济作物,转而种植无盈利的覆盖作物,甚至更糟的是,由于一些线虫的寄主范围非常广(甚至包括大多数覆盖作物),农民可能会被迫让田地休耕。因为大多数线虫可以在没有寄主植物的情况下存活很长时间(>9个月),所以即使让田地休耕也只能给农民带来有限的缓解。线虫害虫可以简单地处于休眠状态,直到农民种植易感作物。
此外,农民还面临着管理线虫带来的农艺挑战,原因是这样的挑战必须在更大的背景下应对,即每个农民都需要遵守旨在保护整体环境和解决土壤侵蚀等生态问题的其他要求。目前,存在线虫管理实践与其他农艺实践和要求相互矛盾的情况,使农民很难做出选择。例如,可以通过每年进行多次耕作来管理短体线虫属物种。然而,耕作会促进土壤侵蚀、水分流失、有机碳流失,而且通常不利于作物产量提高。此外,即使在农民可能愿意种植无盈利的覆盖作物进行线虫管理的情况下,限制线虫繁殖的覆盖作物也可能与提供更大土壤健康益处(如增加有机碳)的覆盖作物不同(Amorim等人,Journal of AgriculturalScience[农业科学杂志]11:333-340,2019)。线虫管理方法(包括抑制或防止场所中线虫群体增加,同时限制对农作物生长的干扰)对农民来说是最有利的。
本披露基于以下发现,即在场所(例如,田地或地块)中生长的抗线虫植物的杀线虫活性的益处超出了该抗线虫植物生长的时间段。在场所中生长抗线虫植物抑制该场所中的线虫群体或维持对该场所中线虫群体的抑制,其中对线虫群体的抑制或对线虫群体抑制的维持超过了抗线虫植物生长的时间段。因此,在一些方面,本披露提供了针对场所的线虫管理方法,该方法包括:在该场所中生长次生植物之前、同时或之后,在田地中生长抗线虫植物。
在一些实施例中,在第一生长季节在场所(例如,田地或地块)中生长的抗线虫植物的杀线虫活性的益处(其中这样的杀线虫活性保护该抗线虫植物免受线虫损害和伤害)还将线虫保护扩展到任何其他植物(例如,包括或不包括抗线虫植物的经济作物),仅需要通过在相同的或随后的生长季节在同一场所生长这一植物即可。抗线虫植物可以定期(例如,连续的生长季节、每隔一个生长季节、每三个生长季节、每四个生长季节、每五个生长季节等)生长,以降低或防治特定场所中线虫的总体群体密度。在一些实施例中,抗线虫植物在每个生长季节生长。在一些实施例中,抗线虫植物在紧邻次生植物(例如,易感线虫植物)生长季节的生长季节生长。因此,抗线虫植物不仅保护自身免受线虫伤害,还保护在同一时间或稍后时间在同一场所生长的任何植物,包括易感线虫植物。
如本文所用的术语“场所(locus/loci)”是指适合植物生长的一个位置(或多个位置)。示例性场所包括但不限于盆或其他容器、温室或其他容纳地点、田地、山丘、任何土地地块、果园、葡萄园或其他适合植物生长的环境。
如本文所用的术语“抗线虫植物”是指表达以下核酸的植物,该核酸在线虫与该植物接触的情况下会导致线虫的运动、进食、发育、繁殖或其他功能受损。在一些实施例中,抗线虫植物已经被操纵以表达这样的核酸,或者源自已通过分子生物学技术被操纵以表达这样的核酸的植物。线虫受损的一个实例是当线虫因摄入抗线虫植物的一部分而被杀死,但不限于此。在一些实施例中,抗线虫植物包括但不限于大豆植物、玉米植物、棉花植物、油菜植物、甘蔗植物、甜菜植物、马铃薯植物或小麦植物、水稻植物、苜蓿植物、大麦植物、高粱植物、燕麦植物、黑麦植物、木薯植物、甘薯植物、向日葵植物、蔬菜植物、水果植物、观赏植物、果园植物(如果树或坚果树)、或葡萄藤。
如本文所用的术语“易感线虫植物”是指不表达以下核酸的植物,该核酸在线虫与该植物接触的情况下会导致线虫的运动、进食、发育、繁殖或其他功能受损。本领域普通技术人员理解,任何植物都可以是抗线虫植物或易感线虫植物,这取决于该植物是否表达以下核酸,该核酸在线虫与该植物接触的情况下会导致线虫的运动、进食、发育、繁殖或其他功能受损。在一些实施例中,抗线虫植物已经被操纵以表达这样的核酸,或者源自已通过分子生物学技术被操纵以表达这样的核酸的植物。在一些实施例中,易感线虫植物包括但不限于大豆植物、玉米植物、棉花植物、油菜植物、甘蔗植物、马铃薯植物、小麦植物、蔬菜植物、水稻植物、苜蓿植物、大麦植物、高粱植物、燕麦植物、黑麦植物、木薯植物、甘薯植物、向日葵植物、水果植物、果园植物(如果树或坚果树)、观赏植物、或葡萄藤。
本披露还基于以下发现,即在场所中抗线虫植物的生长导致对该场所中线虫群体密度的持久抑制。线虫抑制可以通过多种方式进行测量,包括但不限于确定场所中、该场所生长的植物根中、或在另一个有意义的区域中的线虫群体密度。
方法
本披露涉及一种抑制场所中线虫群体的方法,该方法包括:在场所中生长抗线虫植物,其中生长该抗线虫植物在该抗线虫植物生长期间和之后的时间段抑制该场所中的线虫群体。在一些实施例中,时间段延伸至抗线虫植物生长的生长季节之后的一个或多个生长季节。
在一些实施例中,方法进一步包括在生长抗线虫植物之后的时间,在场所中生长次生植物(其可以是任何植物)。在一些实施例中,方法进一步包括在生长抗线虫植物之前的时间,在场所中生长次生植物。在一些实施例中,方法进一步包括在场所中同时生长抗线虫植物与次生植物。在一些实施例中,次生植物是易感线虫植物。在一些实施例中,抗线虫植物生长在与次生植物生长的行相邻的行中。在一些实施例中,抗线虫植物生长在次生植物生长的行中。在一些实施例中,抗线虫植物既生长在与次生植物生长的行相邻的行中,又生长在次生植物生长的行中。本披露考虑了本领域已知的用于生长抗线虫植物和次生植物的任何配置(例如,在同一行或相邻行中生长;在窄与宽的行宽中生长;在田地边缘与在田地中心生长;混合生长且没有明显的行)。在一些实施例中,次生植物是易感线虫植物。
本披露还涉及一种抑制场所中线虫群体的方法,该方法包括:在场所中生长抗线虫植物,其中生长该抗线虫植物在该抗线虫植物生长期间和/或之后的时间段抑制或维持对该场所中已被抑制的线虫群体的抑制。在一些实施例中,时间段延伸至抗线虫植物生长的生长季节之后的一个或多个生长季节。例如,抗线虫植物可以在以下场所中生长,该场所先前已经生长了抗线虫植物和/或先前已使用一些其他用于抑制线虫群体的机制。
本披露还涉及一种抑制线虫群体的方法,该方法包括:在第一生长季节在场所中生长抗线虫植物,其中该抗线虫植物的生长导致对该场所中线虫群体的抑制;以及在相同的或随后的生长季节(例如,第二、第三、第四、或第五生长季节)在同一场所中生长次生植物(其可以是任何植物),其中该次生植物表现出的线虫伤害少于在该第一生长季节未在该场所中生长该抗线虫植物时所看到的线虫伤害。在一些实施例中,随后的生长季节紧邻生长季节。在一些实施例中,线虫群体在随后的生长季节期间很少再次出现或没有再次出现。第一生长季节可以是全年的任何生长季节。抗线虫植物可以在每年的一个或多个生长季节期间(包括在连续的生长季节期间)生长。在一些实施例中,场所的线虫群体已经被抑制,并且该场所中抗线虫植物的生长维持了对该线虫群体的抑制。抗线虫植物的生长不需要持续特定的时间量或特定的发育阶段,只要抑制了场所中的线虫群体或维持了对场所中线虫群体的抑制即可。对线虫群体的抑制可以通过在先前寄生了抑制该线虫群体的抗线虫植物的场所中生长抗线虫植物来维持,其中对该线虫群体抑制的维持可以通过以下来指示:在该场所中存在的线虫比在相同或相当的场所中存在的线虫更少。对线虫群体的抑制或对线虫群体抑制的维持可以通过以下来指示:在场所中存在的线虫比在相同或相当的场所(没有采取线虫管理措施(包括生长抗线虫植物)的情况下)中存在的线虫更少。可替代地,或除此之外,对线虫群体的抑制或对线虫群体抑制的维持可以意味着抗线虫植物在场所中的生长实现和/或维持该场所中的线虫水平处于检测限或检测限以下。
在一些实施例中,对线虫群体的抑制或对线虫群体抑制的维持通过以下来指示:在场所中存在的线虫比在相同或相当的场所(没有采取线虫管理措施(包括生长抗线虫植物)的情况下)中存在的线虫更少。在一些实施例中,相当的场所是从未生长过抗线虫植物的场所。在一些实施例中,相当的场所是在当前作物轮作周期之前但不是期间已经生长了抗线虫植物的场所。
在一些实施例中,当每克根的线虫数量为、约为或小于约60个线虫时,当次生植物为臂形草属时,实现对线虫群体的抑制或对线虫群体抑制的维持。在另外的实施例中,当每克根的线虫数量为、约为或小于约50、40、30、20、10、或5个线虫时,当次生植物为臂形草属时,实现对线虫群体的抑制。在另外的实施例中,当每克根的线虫数量为或约为5-60、10-60、20-60、5-50、10-50、20-50、5-40、5-30、5-20、10-40、10-30、10-20、20-40、或20-30个线虫时,当次生植物为臂形草属时,实现对线虫群体的抑制。
在一些实施例中,当每克根的线虫数量为、约为或小于约300个线虫时,当次生植物为玉米时,实现对线虫群体的抑制或对线虫群体抑制的维持。在另外的实施例中,当每克根的线虫数量为、约为或小于约250、200、150、100、50、20、10、或5个线虫时,当次生植物为玉米时,实现对线虫群体的抑制。在另外的实施例中,当每克根的线虫数量为或约为5-300、5-250、5-200、5-150、5-100、5-50、10-300、10-250、10-200、10-150、10-100、10-50、50-300、50-250、50-200、50-150、或50-100个线虫时,当次生植物为玉米时,实现对线虫群体的抑制。
在一些实施例中,当每克根的线虫数量为、约为或小于约60个线虫时,当次生植物为棉花时,实现对线虫群体的抑制或对线虫群体抑制的维持。在另外的实施例中,当每克根的线虫数量为、约为或小于约50、40、30、20、10、或5个线虫时,当次生植物为棉花时,实现对线虫群体的抑制。在另外的实施例中,当每克根的线虫数量为或约为5-60、10-60、20-60、5-50、10-50、20-50、5-40、5-30、5-20、10-40、10-30、10-20、20-40、或20-30个线虫时,当次生植物为棉花时,实现对线虫群体的抑制。
在一些实施例中,当每克根的线虫数量为、约为或小于约250个线虫时,当次生植物为高粱时,实现对线虫群体的抑制或对线虫群体抑制的维持。在另外的实施例中,当每克根的线虫数量为、约为或小于约200、150、100、50、20、10、或5个线虫时,当次生植物为高粱时,实现对线虫群体的抑制。在另外的实施例中,当每克根的线虫数量为或约为5-250、5-200、5-150、5-100、5-50、10-250、10-200、10-150、10-100、10-50、50-250、50-200、50-150、或50-100个线虫时,当次生植物为高粱时,实现对线虫群体的抑制。
在一些实施例中,在次生植物生长的场所中对线虫群体的抑制或对线虫群体抑制的维持在以下情况实现:当每克根的线虫数量相对于在与次生植物生长的场所相当的场所中每克根的线虫数量减少、减少约或至少减少约5%时。在另外的实施例中,对场所(例如,次生植物生长的场所)中线虫群体的抑制在以下情况实现:当每克根的线虫数量相对于在相当的场所(没有采取线虫管理措施(包括生长抗线虫植物)的情况下)中每克根的线虫数量减少、减少约或至少减少约5%、10%、20%、25%、30%、40%、50%、60%、70%或80%时。在一些实施例中,相当的场所是从未生长过抗线虫植物的场所。在一些实施例中,相当的场所是在当前作物轮作周期之前但不是期间已经生长了抗线虫植物的场所。在本披露的任何方面或实施例中,每克根的线虫数量的测定由本领域普通技术人员进行。
本披露涉及一种抑制线虫群体的方法,该方法包括:在第一生长季节在场所中生长抗线虫植物,其中该抗线虫植物的生长导致对该场所中线虫群体的抑制;以及在相同的或随后的生长季节(例如,第二、第三、第四、或第五生长季节)在同一场所中生长易感线虫植物,其中该易感线虫植物表现出的线虫伤害少于在该第一生长季节未在该场所中生长该抗线虫植物时所看到的线虫伤害。在一些实施例中,线虫群体在随后的生长季节期间很少再次出现或没有再次出现。
在一些实施例中,方法包括在第一生长季节在场所中生长抗线虫植物,在随后的生长季节(例如,在该场所中生长该抗线虫植物之后的第二、第三、第四或其他生长季节)在该场所中生长第一易感线虫植物,以及在生长该第一易感线虫植物之后在该场所中生长第二易感线虫植物。可以在随后的生长季节在场所中生长第三、第四、第五易感线虫植物等。
在一些实施例中,在生长第一易感线虫植物之前,在场所中生长抗线虫植物。本领域技术人员理解,一旦在场所中实现线虫抑制,就不需要特定的种植顺序。
在一些实施例中,抗线虫植物是单子叶植物。在一些实施例中,抗线虫植物是双子叶植物。在一些实施例中,抗线虫植物是一年生植物。在一些实施例中,抗线虫植物是多年生植物。
在一些实施例中,抗线虫植物是大豆植物、玉米植物、棉花植物、油菜植物、甘蔗植物、甜菜植物、马铃薯植物、小麦植物、水稻植物、苜蓿植物、大麦植物、高粱植物、燕麦植物、黑麦植物、木薯植物、甘薯植物、向日葵植物、蔬菜植物、水果植物、观赏植物、果园植物(如果树或坚果树)、或葡萄藤。
在一些实施例中,抗线虫植物是大豆植物,并且该大豆植物在第一生长季节在场所中生长;并且易感线虫植物是在第二生长季在同一田地或其他场所生长的大豆植物、玉米植物、棉花植物、油菜植物、甘蔗植物、甜菜植物、马铃薯植物、小麦植物、水稻植物、苜蓿植物、大麦植物、高粱植物、燕麦植物、黑麦植物、木薯植物、甘薯植物、向日葵植物、蔬菜植物、水果植物、果园植物(如果树或坚果树)、观赏植物、或者葡萄藤;并且抗线虫大豆植物在第三生长季节生长。
在一些实施例中,抗线虫植物是大豆植物,并且该大豆植物在第一生长季节在场所中生长;并且易感线虫植物是大豆植物、玉米植物、棉花植物、油菜植物、甘蔗植物、甜菜植物、马铃薯植物、小麦植物、水稻植物、苜蓿植物、大麦植物、高粱植物、燕麦植物、黑麦植物、木薯植物、甘薯植物、向日葵植物、蔬菜植物、水果植物、果园植物(如果树或坚果树)、观赏植物、或者葡萄藤,并且在相同的生长季节或第二生长季节在同一场所中生长;并且任选地,易感线虫植物在第三生长季节在同一场所中生长,其中该易感线虫植物是大豆植物、玉米植物、棉花植物、油菜植物、甘蔗植物、甜菜植物、马铃薯植物、小麦植物、水稻植物、苜蓿植物、大麦植物、高粱植物、燕麦植物、黑麦植物、木薯植物、甘薯植物、向日葵植物、蔬菜植物、水果植物、果园植物(如果树或坚果树)、观赏植物、或者葡萄藤。对于一年生植物来说,种植的季节顺序并不重要,只要在一年生植物种植之前或同时在场所生长抗线虫植物,并且只要该场所的线虫群体受到或保持足以为该一年生植物带来益处的抑制。
在一些实施例中,在相同的生长季节期间或在同一时间,易感线虫植物与抗线虫植物在同一场所一起生长。在一些实施例中,易感线虫植物可以是多年生植物,包括但不限于蔬菜植物、水果植物、果园植物(例如,果树或坚果树)、观赏植物或葡萄藤。通过这种方式,抗线虫植物可用于保护多年生植物免受线虫伤害。在一些实施例中,抗线虫植物在种植多年生植物之前在场所中生长,以在种植该多年生植物之前抑制该场所中的线虫群体。在一些实施例中,抗线虫植物在种植多年生植物之前生长,并且与多年生植物同时生长或一起生长,例如,如果抗线虫植物是一年生植物,则每年种植。在一些实施例中,抗线虫植物在已经含有多年生植物的场所中生长,其中该多年生植物从向该场所中添加该抗线虫植物而获得益处。对于多年生植物来说,种植的季节顺序并不重要,只要在多年生植物种植之前、同时或之后在场所生长抗线虫植物,并且只要该场所的线虫群体受到或保持足以为该多年生植物带来益处的抑制。
还提供了一种保护易感线虫植物免受线虫损害或线虫伤害的方法,该方法包括在生长该易感线虫植物之前的至少一个生长季节,在场所中生长抗线虫植物;以及在与该抗线虫植物的生长季节相同的生长季节或之后的至少一个生长季节,在该场所中生长易感线虫植物。如本文所用的术语“线虫伤害”是指线虫对植物造成的物理损伤或破坏。如本文所用的术语“线虫损害”是指线虫对可销售商品造成的金钱损失。
还提供了用于提高易感线虫植物产量的方法。方法包括在第一生长季节在田地中生长抗线虫植物;以及在相同的或随后的生长季节期间,在田地中生长易感线虫植物。与在相同或相当的场所(没有采取线虫管理措施(包括生长抗线虫植物)的情况下)中生长的易感线虫植物的产量相比,在与抗线虫植物的生长相同的季节或之后的季节生长易感线虫植物提高了易感线虫植物的产量。在一些实施例中,易感线虫植物的提高的产量是与在相同或相当的场所中生长的易感线虫植物的产量进行比较,在该场所中,在最近的作物轮作周期期间未生长抗线虫作物。在一些实施例中,相当的场所是从未生长过抗线虫植物的场所。在一些实施例中,相当的场所是在当前作物轮作周期之前但不是期间已经生长了抗线虫植物的场所。
如本文所用的,植物的术语“产量”是指植物产生的生物质的质量和/或数量。“生物质”意指任何测量的植物产物。生物质生产的增加是指测量的植物产物的产量的任何提高。提高植物产量具有几种商业应用。例如,增加植物叶片的生物质可以提高绿叶蔬菜的产量供人类或动物消费。此外,增加叶生物质可以用于增加植物来源的药品或工业产品的生产。在一些实施例中,与在相同或相当的场所(没有采取线虫管理措施(包括生长抗线虫植物)的情况下)中生长的易感线虫植物相比,在生长抗线虫植物之后生长易感线虫植物使该易感线虫植物的产量提高至少1%(或至少2%、至少3%、至少4%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少100%)。在一些实施例中,相当的场所是从未生长过抗线虫植物的场所。在一些实施例中,相当的场所是在当前作物轮作周期之前但不是期间已经生长了抗线虫植物的场所。
在各种实施例中,与在相同或相当的场所(没有采取线虫管理措施(包括生长抗线虫植物)的情况下)中生长的易感线虫植物相比,在与抗线虫植物的生长同时或之后的生长季节中生长易感线虫植物为该易感线虫植物带来例如以下益处:改善根发育(例如,改善根或根毛生长);改善产量;更快出苗;改善植物胁迫管理,包括提高耐逆性和/或改善胁迫恢复;增加机械强度;改善抗旱性;减少真菌、细菌和/或病毒性疾病感染;和/或改善植物健康。在一些实施例中,相当的场所是从未生长过抗线虫植物的场所。在一些实施例中,相当的场所是在当前作物轮作周期之前但不是期间已经生长了抗线虫植物的场所。还可以获得任何这些益处的组合。
在各种实施例中,在特定场所中生长抗线虫植物之后或同时的生长季节中生长植物可以使由于技术、栽培和/或监管原因而不适于成为抗线虫植物的植物能够生长。可用于本发明的这样的植物的非限制性实例包括澳大利亚的果树或坚果树、观赏植物、葡萄藤或小麦。
本发明适用于迁徙性线虫物种和定居性线虫物种两者。此外,在迁徙类和定居类中都存在新出现的线虫物种,这些线虫物种也可以通过本发明防治。在一些实施例中,线虫来自线虫群体,特别是短体线虫属物种线虫群体例如最短尾短体线虫、根结线虫属物种、胞囊线虫属物种例如大豆胞囊线虫、黄金线虫属物种、肾形肾状线虫、螺旋线虫属物种例如双宫螺旋线虫、小尾盾线虫、图比萨巴图克萨阿线虫(Tubixaba tuxaua)或水稻干尖线虫。
还考虑了具有抑制的线虫群体密度(例如,每体积土壤中的线虫)或减少的线虫数量(例如,每克根中的线虫)的场所(例如田地或地块),其中通过本文所述的方法实现抑制的线虫群体密度或减少的线虫数量。场所中抑制的线虫群体密度或减少的线虫数量的测量在实际意义上是可互换的,因为两者都是场所中存在线虫的指示,区别仅在于用于测量线虫存在的方法。可以用多种方式测量抑制的线虫群体,这些方式都不限于本发明。在各种实施例中,抑制的线虫群体密度为、约为或小于约250、200、150、100、50、20或10个线虫/克(g)根。
杀线虫核酸、杀线虫蛋白和抗线虫植物
本文所述的方法描述了表达杀线虫核酸的植物的用途。在一些实施例中,本文所述的方法涉及经由转化生物体或使用包含编码杀线虫蛋白的异源核苷酸序列的生物体通过分子生物学技术操纵的植物的用途。有许多分子生物学技术可以用于使植物表达杀线虫核酸,并且用于获得抗线虫植物的技术途径不限于本文的方法。
如本文所用的术语“杀线虫核酸”和“杀线虫蛋白”是指对一种或多种线虫害虫具有活性的毒素,该一种或多种线虫害虫包括但不限于根结线虫属物种、肾形肾状线虫、双宫螺旋线虫、小尾盾线虫、图比萨巴图克萨阿线虫(Tubixaba tuxaua)、水稻干尖线虫、和短体线虫属物种(包括艾伦短体线虫(Pratylenchus alleni)、最短尾短体线虫、咖啡短体线虫(Pratylenchus coffeae)、刻痕短体线虫(Pratylenchus crenatus)、杜氏短体线虫(Pratylenchus dulscus)、谲诈短体线虫(Pratylenchus fallax)、薄片状短体线虫(Pratylenchus flakkensis)、古氏短体线虫(Pratylenchus goodeyi)、六裂短体线虫(Pratylenchus hexincisus)、卢斯短体线虫(Pratylenchus loosi)、微短体线虫(Pratylenchus minutus)、穆氏短体线虫(Pratylenchus mulchandi)、音乐短体线虫(Pratylenchus musicola)、落选短体线虫(Pratylenchus neglectus)、穿刺短体线虫(Pratylenchus penetrans)、草地短体线虫(Pratylenchus pratensis)、肾形短体线虫(Pratylenchus reniformia)、斯克里布纳短体线虫(Pratylenchus scribneri)、刺尖短体线虫(Pratylenchus thornei)、伤残短体线虫(Pratylenchus vulnus)、和玉米短体线虫(Pratylenchus zeae))。
在一些实施例中,杀线虫蛋白是Cry蛋白。Cry蛋白是本领域技术人员所熟知的。Cry蛋白的杀线虫活性已在例如国际公开号WO 2010/027805、WO 2010/027809、WO 2010/027804、WO 2010/027799、WO 2010/027808和WO 2007/147029中描述。在一些实施例中,杀线虫蛋白包括Cry14蛋白(参见,例如,国际公开号WO 2018119336和美国临时专利申请序列号62/112,832(2020年11月12日提交),各自通过引用以其全文并入本文)。在各种实施例中,Cry14蛋白是Cry14Aa1(GENBANK登录号AAA21516)或Cry14Ab1(也称为Cry14Ab-1;GENBANK登录号KC156652)。在一些实施例中,Cry14Ab-1蛋白(SEQ ID NO:1(氨基酸序列)和SEQ ID NO:2(核苷酸序列))如国际公开号WO 2018/119361和WO 2018/119364及其变体和片段中所述。在各种实施例中,抗线虫植物表达与SEQ ID NO.1具有、具有约、或具有至少或至少约95%、96%、97%、98%或至少99%序列同一性的杀线虫Cryl4Ab蛋白。
许多具有杀线虫活性的核酸是本领域技术人员熟知的,用于产生具有线虫抗性的植物的分子生物学技术也是如此。在一些实施例中,由抗线虫植物表达的核酸通过例如国际公开号WO 2011/82217、WO 2013/078153、WO 2020/243365、WO 2018/005491和WO 2021/016098中所述的序列产生。
用于产生抗线虫植物的分子生物学技术包括(作为非限制性实例)基因组编辑以产生导致杀线虫活性的核酸;导致杀线虫活性的RNA分子的表达;和/或异源或转基因杀线虫蛋白的表达。其他技术,如诱导突变,也可以用于产生抗线虫植物。在一些实施例中,由抗线虫植物表达的杀线虫核酸由Cry基因产生。在一些实施例中,Cry基因是Cry14基因。在一些实施例中,Cry14基因是Cry14Aa基因或Cry14Ab基因。
除了导致杀线虫活性的核酸之外,抗线虫植物还可以表达一种或多种通过分子生物学技术引入的额外的核酸,包括但不限于提供除草剂耐受性、对鞘翅目害虫的抗性、对鳞翅目害虫的抗性、对其他害虫(包括其他昆虫)的抗性、和/或抗病性的核酸。这样的其他核酸可以来源于例如分子生物学技术,例如但不限于基因组编辑活性、RNA的表达、或异源蛋白的表达。此外,借助其他技术(如引入突变、经由育种而渗入性状、和/或本领域普通技术人员熟知的其他技术),抗线虫植物可以表达其他非天然核酸。这样的其他核酸和/或性状的存在不限于本文的方法。
在一些实施例中,除了提供杀线虫活性的核酸之外,抗线虫植物还表达一种或多种额外的非天然核酸。在一些实施例中,提供杀线虫活性的核酸与一种或多种大豆GM事件组合,该事件对基于草甘膦、基于草铵膦、基于HPPD抑制剂、基于磺酰脲或咪唑啉酮、AHAS或ALS抑制型和/或生长素型(例如,麦草畏、2,4-D)除草剂中任一种或组合提供耐受性,如事件EE-GM3(又名FG-072,MST-FG072-3,描述于WO 2011063411,USDA-APHIS请愿书09-328-01p)、事件SYHT0H2(又名0H2,SYN-000H2-5,描述于WO2012/082548和12-215-01p)、事件DAS-68416-4(又名Enlist大豆,描述于WO 2011/066384和WO 2011/066360,USDA-APHIS请愿书09-349-01p)、事件DAS-44406-6(又名Enlist E3,DAS-44406-6,描述于WO 2012/075426和USDA-APHIS 11-234-Olp)、事件MON87708(Roundup Ready 2Xtend大豆的麦草畏耐受事件,描述于WO 2011/034704和USDA-APHIS请愿书10-188-Olp,MON-87708-9)、事件MON89788(又名Genuity Roundup Ready 2Yield,描述于WO 2006/130436和USDA-APHIS请愿书06-178-01p)、事件40-3-2(又名Roundup Ready,GTS 40-3-2,MON-04032-6,描述于USDA-APHIS请愿书93-258-01)、事件A2704-12(又名LL27,ACS-GM005-3,描述于WO2006108674和USDA-APHIS请愿书96-068-Olp)、事件127(又名BPS-CV127-9,描述于WO2010/080829)、事件A5547-127(又名LL55,ACS-GM006-4,描述于WO 2006108675和USDA-APHIS请愿书96-068-01p)、事件MON87705(MON-87705-6,Vistive Gold,公布的PCT专利申请WO 2010/037016,USDA-APHIS请愿书09-201-01p)、大豆事件HB4(OECD唯一标识符IND-00410-05,USDA-APHIS请愿书17-223-01p)、或事件DP305423(又名DP-305423-1,公布的PCT专利申请WO 2008/054747,USDA-APHIS请愿书06-354-01p);或导致杀线虫活性的核酸与以下事件的组合进行组合:事件MON98788 x MON87708(又名Roundup Ready 2Xtend大豆,MON-87708-9x MON-89788-1)、事件HOS x事件40-3-2(又名Plenish高油酸大豆x RoundupReady大豆)、事件EE-GM3 x EE-GM2(又名FG-072xLL55,描述于WO 2011063413)、事件MON87701x MON 89788(又名Intacta RR2 Pro大豆,MON-87701-2x MON-89788-1)、DAS-81419-2x DAS-44406-6(又名Conkesta
在一些实施例中,抗线虫植物是含有如国际公开号WO 2018/119361中所述的EE-GM4事件的大豆植物或含有如国际公开号WO 2018/119364中所述的EE-GM5事件(也称为GMB151事件)的大豆植物。国际公开号WO 2018/119361和WO 2018/119364的披露内容通过引用以其全文并入本文。
在一些实施例中,抗线虫植物含有一种或多种提供线虫抗性的原生性状。这样的原生性状对于本领域技术人员来说是熟知的(例如,参见Fosu-Nyarko,J.,和M.G.K.Jones.2015.Application of biotechnology for nematode control in cropplants[生物技术在作物植物线虫防治中的应用].第339-376页于:Advances inBotanical Research[植物学研究进展]第73卷,Plant Nematode Interactions:A Viewon Compatible Interrelationships[植物线虫相互作用:相容相互关系的观点].第14章.C.Escobar和C.Fenoll编辑.Elsevier,Oxford[牛津爱思唯尔出版社])。原生性状可以与抗线虫植物的线虫抑制作用互补,并且在一些实施例中,一个或多个这样的原生性状存在于抗线虫植物的种质中。
因此,本文提供了通过如本文所述的抗线虫植物表达的杀线虫核酸或蛋白来杀死、抑制或防治线虫害虫群体(例如,短体线虫属物种线虫群体(例如,最短尾短体线虫)、根结线虫属物种、胞囊线虫属物种(例如,大豆胞囊线虫)、黄金线虫属物种、肾形肾状线虫、螺旋线虫属物种(例如,双宫螺旋线虫)、小尾盾线虫、图比萨巴图克萨阿线虫(Tubixabatuxaua)或水稻干尖线虫)的方法。在特定的实施例中,杀线虫蛋白包括国际公开号WO2018/119361、WO 2018/119364或美国临时专利申请序列号62/112,832中所述的Cry14蛋白,以及其变体和片段。
系统
在另一方面,本文描述了一种用于提高易感线虫植物生长效率的系统,该系统包括:在第一生长季节期间,在场所中生长抗线虫植物;以及在相同的或随后的生长季节期间,在场所中生长易感线虫植物。在一些实施例中,在生长第一易感线虫植物之后,在场所中生长第二易感线虫植物。在一些实施例中,提高易感线虫植物的生长效率可以通过以下中的一个或多个来指示或测量:a.每年场所至少多使用一个生长季节;b.降低场所的耕作;c.减少对易感线虫作物种子的杀线虫剂处理;d.在易感线虫植物的生长季节之前或期间,减少场所的使用杀线虫剂的处理面积;e.在易感线虫植物的生长季节之前或期间,降低对易感线虫植物和/或场所的杀线虫剂施用率;f.在生长季节期间,降低对易感线虫植物和/或场所的杀线虫剂施用次数;提高场所的可用性;增加场所的价值;改善可持续农业实践;和/或g.提高易感线虫作物的产量。
在另一方面,本文描述了一种用于增加场所使用的系统,该系统包括:在第一生长季节在场所中生长抗线虫植物;以及在相同的或随后的生长季节,在该场所中生长第一易感线虫植物。在一些实施例中,抗线虫植物和第一易感线虫植物在相同的或连续的生长季节中生长。在其他实施例中,抗线虫植物和第一易感线虫植物在非连续的生长季节中生长。在一些实施例中,场所在随后的生长季节中没有休耕。在一些实施例中,在随后的生长季节中不种植覆盖作物。在一些实施例中,场所中不进行耕作。
在另一方面,本文描述了一种用于增加场所(例如但不限于田地或地块)使用的系统,该系统包括:在第一生长季节在场所中生长抗线虫植物;在相同的或随后的生长季节,在该场所中生长第一易感线虫植物;以及在该场所中生长第一易感线虫作物之后,在该场所中生长第二易感线虫作物。在一些实施例中,抗线虫植物、第一易感线虫植物和第二易感线虫植物在连续的生长季节中生长。在其他实施例中,抗线虫植物、第一易感线虫植物和第二易感线虫植物在非连续生长季节中生长,或者三种植物中只有两种在连续或非连续的生长季节中生长。在一些实施例中,场所在随后的生长季节中没有休耕。在一些实施例中,在随后的生长季节中不种植覆盖作物。在一些实施例中,场所中不进行耕作。
如本文所用的术语“作物轮作系统”或“耕作系统”是指遵循作物轮作周期的实践,在该周期中,在场所(例如田地)中种植一种农业作物后的时间段内种植一种或多种连续作物。单一作物轮作周期所涵盖的时间段不一定与历年相对应,也不一定是12个月的周期。在一些情况下,单一作物轮作周期可能跨越两到三年甚至更长的时间段。在一些实施例中,甘蔗处于约5年的周期(例如,4-5年的甘蔗,然后是一个非甘蔗季节)。种植的精确时间、周期的时间段、以及要种植的作物是由环境决定的,并且是因地制宜的。作物轮作系统的使用原因很多,如考虑每种作物的养分需求、减少疾病和/或害虫压力以及业务多样化。例如,典型的巴西大豆耕作系统中,在一个历年中连续种植两种作物。主要生长季节被称为“第一季”从9月至12月种植第一茬作物如大豆开始。在1月至3月之间收获第一季作物。在收获第一季作物后立即种植第二期作物,称为“第二季(safrinha)”。然后在5月至8月收获第二季作物。参见图8。在美国,作物轮作周期因环境和农民的目标而异,并且不一定与历年相关联。在一个实例中,主要生长季节从2月至5月种植主要作物开始,并在8月至10月进行收获。然后在9月至11月或在次年2月至5月种植第二茬作物。其他位置或地理区域支持在三个生长季节的作物轮作周期期间的作物生长,还有一些其他位置或地理区域支持在四个或更多个生长季节的作物轮作周期期间的作物生长。
在一方面,本文描述了一种抑制场所中线虫群体的方法,该方法包括在场所中生长抗线虫植物,其中生长该抗线虫植物在该抗线虫植物生长期间和/或之后的时间段抑制该场所中的线虫群体,或者维持对该场所中该线虫群体的抑制。在一些实施例中,抗线虫植物在第一季期间生长。在一些实施例中,方法进一步包括在紧接着第一季的第二季期间,在场所中生长次生植物。在一些实施例中,次生植物是易感线虫植物。在一些实施例中,抗线虫植物和次生植物都是具有内在价值的作物植物。在一些实施例中,抗线虫植物和次生植物都是经济作物植物。在一些实施例中,抗线虫植物是大豆植物,并且次生植物选自由玉米、棉花、高粱、小麦和甘蔗组成的组。
在一些方面,本文描述了一种用于改善作物轮作系统的方法,该方法包括:在第一生长季节期间,在场所中生长抗线虫植物;以及在相同的或随后的生长季节期间,在该场所中生长易感线虫植物,其中在该第一生长季节期间在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该易感线虫植物能够在该相同的或随后的生长季节中生长或改善该易感线虫植物在该相同的或随后的生长季节中的生长。在一些实施例中,在生长第一易感线虫植物之后,在场所中生长第二易感线虫植物。
在一些实施例中,改善的作物轮作系统可以通过以下中的一个或多个来指示或测量:a.每年场所至少多使用一个生长季节;b.降低场所的耕作;c.减少对易感线虫作物种子的杀线虫剂处理;d.在易感线虫植物的生长季节之前或期间,减少场所的使用杀线虫剂的处理面积;e.在易感线虫植物的生长季节之前或期间,降低对易感线虫植物和/或场所的杀线虫剂施用率;f.在生长季节期间,降低对易感线虫植物和/或场所的杀线虫剂施用次数;提高场所的可用性;增加场所的价值;改善可持续农业实践;和/或g.提高易感线虫作物的产量。
应当理解,本发明不限于所述的特定方法学、方案、植物物种或属、构建体和试剂。还应当理解,本文所用的术语仅用于描述特定实施例,而不意图限制本发明的范围,本发明的范围将仅受所附权利要求的限制。必须指出,除非上下文另外清楚地指明,否则如本文和所附权利要求中所用的,单数形式“一个/一种(a/an)”和“该(the)”包括复数指示物。因此,例如,“一种载体”指的是一种或多种载体,并且包括本领域普通技术人员已知的其等效物等。
营销
如本文所用的,“营销”是指由实体或代表实体进行的任何沟通,其目的是提醒公共客户/潜在客户注意商业产品,并鼓励接受和/或使用这些产品。印刷营销/材料可以包括但不限于手册、小册子、传单、目录、名片、标志、海报、广告牌、商业文献、种子袋、种子袋标签、标牌或其他宣传。其他类型的营销/材料可以包括但不限于任何类型的数字信息,包括网站、电子邮件、短信、任何公司赞助的宣传/披露产品的沟通或活动、或任何社交媒体平台上的信息。营销还包括针对农民购买一种或多种产品的任何回扣/激励,根据本文提供的方法,在作物轮作周期中通过使用抗线虫植物来提高对其的使用。
在一些方面,本披露还提供了用于营销作物轮作系统的方法,这些方法包括在第一生长季节期间促进场所中抗线虫植物的使用;以及在相同的或随后的生长季节期间,促进场所中易感线虫植物的使用,其中在该第一生长季节期间在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该易感线虫植物能够在该随后的生长季节中生长或改善该易感线虫植物在该随后的生长季节中的生长。在另外的方面,提供了用于营销抑制场所中线虫群体的作物轮作系统的方法,这些方法包括在第一生长季节期间促进场所中抗线虫植物的使用;以及在相同的或随后的生长季节期间,促进场所中易感线虫植物的使用,其中在该第一生长季节期间在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该易感线虫植物能够在该随后的生长季节中生长或改善该易感线虫植物在该随后的生长季节中的生长。
在另外的方面,本披露提供了针对系统的营销材料,该系统在第一生长季节期间在场所中生长抗线虫植物,与此协调或在此之后,在随后的生长季节期间在该场所中生长易感线虫植物,其中在该第一生长季节期间在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该易感线虫植物能够在随后的生长季节中生长或改善该易感线虫植物在随后的生长季节中的生长。在一些实施例中,营销材料旨在促进系统,该系统在第一生长季节期间在场所中生长抗线虫植物,与此协调或在此之后,在随后的生长季节期间在该场所中生长易感线虫植物,其中在该第一生长季节期间在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该易感线虫植物能够在随后的生长季节中生长或改善该易感线虫植物在随后的生长季节中的生长。
在一些方面,本披露提供了一种用于改善作物轮作系统的营销的方法,以经由对线虫群体的抑制来减少线虫群体、减少线虫对作物的伤害和/或增加作物产量,该方法包括特征,例如但不限于回扣计划、营销声明、关联优惠、或综合解决方案,或针对购买一种或多种产品的任何促销优惠中的一个或多个,根据本文提供的方法,在作物轮作周期中通过使用抗线虫植物来提高其使用。
在另外的方面,本披露提供了一种试剂盒,该试剂盒包含如本文所述的营销材料(例如,与营销作物轮作系统有关)和/或各自如本文所述的抗线虫大豆植物或其细胞、部分、种子或子代。在一些实施例中,试剂盒进一步包含次生植物或其细胞、部分、种子或子代。在一些实施例中,试剂盒进一步包含可用于生长植物,其细胞、部分、种子或子代的任何产品,包括但不限于除草剂、杀真菌剂、杀昆虫剂、杀线虫剂、生物制剂、肥料、种子处理剂、接种剂、决策或遥感工具、作物侦察服务、作物诊断工具和/或服务。在本披露的任何方面或实施例中,试剂盒是任何包装或材料,该包装或材料包括营销用于抑制或维持场所中线虫群体的系统或方法,使得该场所中产生的线虫群体为约250个线虫/克(g)根或更少。在各种实施例中,试剂盒是任何包装或材料,该包装或材料包括营销用于抑制或维持场所中线虫群体的系统或方法,其中该场所中产生的线虫群体为、约为、或小于约250、200、150、100、50、20、或10个线虫/克(g)根或更少。
如本文所述,本披露的产品、系统和方法还通过实现改善的农业实践(例如,通过碳信用机会)来提供改善的价值和可持续性。例如,本披露的实施例所创造的可持续性机会可以包括但不限于(i)改善场所,使其需要更少的耕作;(ii)在每年至少一个生长季节期间无需生长覆盖作物或休耕场所;和/或(ii)使具有更健康和更大根系的植物(与具有较小根系或根被线虫损害的植物相比,能够捕获更多的碳)能够生长。本披露提供的另一个相关优点涉及改善固氮作用。线虫降低大豆中的固氮作用,从而增加了下一季种植的作物(例如,玉米作物)对化学氮的需求。在本披露的任何方面或实施例中,如本文所述的抗线虫植物抑制线虫群体,并且使大豆的固氮作用得到改善或达到完全固氮,从而降低了下一季玉米作物对化学氮的需求。此外,化学氮会造成环境问题并引起关注(例如,参见Crews等人,Agriculture,Ecosystems and Environment[农业、生态系统和环境]102(2004)279-297)。
实施例:
1.一种抑制场所中线虫群体的方法,该方法包括:
在场所中生长抗线虫植物,其中生长该抗线虫植物在该抗线虫植物生长期间和/或之后的时间段抑制该场所中的线虫群体,或者维持对该场所中该线虫群体的抑制。
2.如实施例1所述的方法,其中该时间段延伸至该抗线虫植物生长的生长季节之后的一个或多个生长季节。
3.如实施例1或2所述的方法,该方法进一步包括在生长该抗线虫植物之后,在该场所中生长次生植物。
4.如实施例1或2所述的方法,该方法进一步包括在生长该抗线虫植物之前,在该场所中生长次生植物。
5.如实施例1或2所述的方法,该方法进一步包括在该场所中同时生长该抗线虫植物与次生植物。
6.如实施例3-5中任一项所述的方法,其中该次生植物是易感线虫植物。
7.如实施例1-6中任一项所述的方法,其中该线虫群体被抑制或维持在检测限或检测限以下。
8.如实施例3-6中任一项所述的方法,其中该次生植物为臂形草属,并且当每克根的线虫数量为、约为或小于约60个线虫时,实现对该线虫群体的抑制。
9.如实施例3-6中任一项所述的方法,其中该次生植物为玉米,并且当每克根的线虫数量为、约为或小于约300个线虫时,实现对该线虫群体的抑制。
10.如实施例3-6中任一项所述的方法,其中该次生植物为棉花,并且当每克根的线虫数量为、约为或小于约60个线虫时,实现对该线虫群体的抑制。
11.如实施例3-6中任一项所述的方法,其中该次生植物为高粱,并且当每克根的线虫数量为、约为或小于约250个线虫时,实现对该线虫群体的抑制。
12.如实施例3-11中任一项所述的方法,其中在该次生植物生长的场所中对该线虫群体的抑制在以下情况实现:当每克根的线虫数量相对于在与该次生植物生长的场所相当的场所中每克根的线虫数量减少、减少约或至少减少约5%时。
13.一种保护植物免受线虫伤害或损害的方法,该方法包括:
在种植易感线虫植物之前的至少一个生长季节,在场所中生长抗线虫植物;以及
在生长该抗线虫植物之后的至少一个生长季节,在该场所中生长易感线虫植物。
14.如实施例13所述的方法,其中保护该易感线虫植物免受线虫损害包括提高收获的易感线虫植物材料的产量、和/或增加从销售收获的易感线虫植物材料所赚取的钱。
15.一种提高易感线虫植物的产量的方法,该方法包括:
在种植该易感线虫植物之前的至少一个生长季节,在场所中生长抗线虫植物;以及
在生长该抗线虫植物之后的至少一个生长季节,在该场所中生长易感线虫植物。
16.如实施例15所述的实施例,其中该易感线虫植物的提高的产量与先前未生长抗线虫作物的相同或相当的场所中该易感线虫植物的产量进行比较,或者该易感线虫植物的提高的产量与在生长该抗线虫植物之前生长在相同的场所或相当的场所中该易感线虫植物的产量进行比较。
17.一种针对场所的线虫管理方法,该方法包括:
在场所中生长抗线虫植物;以及
在生长该抗线虫植物的同时或之后的时间,在该场所中生长易感线虫植物。
18.如实施例6-17所述的方法,其中该易感线虫植物是多年生植物或一年生植物。
19.如实施例6-18中任一项所述的方法,其中该易感线虫植物是大豆植物、玉米植物、棉花植物、油菜植物、甘蔗植物、马铃薯植物、小麦植物、蔬菜植物、水稻植物、苜蓿植物、大麦植物、高粱植物、燕麦植物、黑麦植物、木薯植物、甘薯植物、向日葵植物、水果植物、果园植物(如果树或坚果树)、观赏植物、或葡萄藤。
20.如实施例1-19中任一项所述的方法,其中该抗线虫植物表达Cry蛋白,例如但不限于杀线虫Cry蛋白。
21.如实施例1-20中任一项所述的方法,其中该抗线虫植物是大豆植物、玉米植物、棉花植物、油菜植物、甘蔗植物、甜菜植物、马铃薯植物、小麦植物、水稻植物、苜蓿植物、大麦植物、高粱植物、燕麦植物、黑麦植物、木薯植物、甘薯植物、向日葵植物、蔬菜植物、水果植物、观赏植物、果园植物(如果树或坚果树)、或葡萄藤。
22.如实施例1-21中任一项所述的方法,其中该线虫是选自以下的线虫物种:短体线虫属物种线虫群体例如最短尾短体线虫、根结线虫属物种、胞囊线虫属物种例如大豆胞囊线虫、黄金线虫属物种、肾形肾状线虫、螺旋线虫属物种例如双宫螺旋线虫、小尾盾线虫、图比萨巴图克萨阿线虫或水稻干尖线虫。
23.如实施例22所述的方法,其中该短体线虫属物种是最短尾短体线虫。
24.一种针对场所的线虫管理方法,该方法包括:
在场所中同时生长抗线虫植物与易感线虫植物。
25.一种针对场所的线虫管理方法,该方法包括:
在场所中种植易感线虫植物;以及
在种植该易感线虫植物之后的时间,在该场所中生长抗线虫植物。
26.一种具有抑制的线虫群体密度的场所,其中该抑制的线虫群体密度通过如实施例1-25中任一项所述的方法实现。
27.如实施例26所述的场所,该场所提供以下益处中的一种或多种:该场所不需要在每年或每个作物轮作周期休耕一个生长季节;b.该场所不需要在每个作物轮作周期耕作一个生长季节;以及c.该场所不需要种植覆盖作物。
28.如实施例26或实施例27所述的场所,其中该抑制的线虫群体密度为、约为或小于约250、200、150、100、50、20或10个线虫/克(g)根。
29.如实施例26所述的场所,该场所不需要在每个作物轮作周期休耕一个生长季节。
30.一种在如实施例26所述的场所中生长的抗线虫植物。
31.一种从如实施例30所述的植物中收获的植物材料。
32.一种由如实施例31所述的植物产生的种子。
33.一种用于增加场所使用的系统,该系统包括:
在第一生长季节在场所中生长抗线虫植物;以及
在随后的生长季节在该场所中生长易感线虫植物。
34.如实施例33所述的系统,其中该场所在随后的生长季节期间没有休耕。
35.如实施例33所述的系统,其中在该随后的生长季节期间,没有生长覆盖植物或覆盖作物。
36.如实施例33所述的系统,其中该抗线虫植物和该易感线虫植物在连续的生长季节中生长。
37.如实施例33-36中任一项所述的系统,其中该抗线虫植物和该易感线虫植物中的每一种都是具有内在价值的作物植物。
38.一种用于改善作物轮作系统的方法,该方法包括:
在第一生长季节期间,在场所中生长抗线虫植物;以及
在随后的生长季节期间,在该场所中生长易感线虫植物,其中在该第一生长季节期间在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该易感线虫植物能够在该随后的生长季节中生长或改善该易感线虫植物在该随后的生长季节中的生长。
39.如实施例38所述的方法,其中改善的作物轮作系统可以进一步包括以下中的一个或多个:
a.每年该场所至少多使用一个生长季节;
b.降低该场所的耕作;
c.减少对易感线虫作物种子的杀线虫剂处理;
d.在该易感线虫植物的生长季节之前或期间,减少该场所的使用杀线虫剂的处理面积;
e.在该易感线虫植物的生长季节之前或期间,降低对该易感线虫植物和/或该场所的杀线虫剂施用率;
f.在生长季节期间,降低对该易感线虫植物和/或该场所的杀线虫剂施用次数;
g.提高该场所的可用性;
h.增加该场所的价值;
i.改善可持续农业实践;和/或
j.提高易感线虫作物的产量。
40.一种针对场所的线虫管理方法,该方法包括:
在生长季节期间,在场所中生长抗线虫植物;以及
在该生长季节之前、期间和/或之后,在该场所中生长多年生植物,其中在该场所中生长该抗线虫植物导致对该场所中线虫群体的抑制,使得该多年生植物能够生长或改善该多年生植物的生长。
41.如实施例40所述的方法,其中该多年生植物是易感线虫植物。
42.如实施例40所述的方法,其中该多年生植物是蔬菜植物、水果植物、果园植物、观赏植物、或葡萄藤。
43.一种针对场所的线虫管理方法,该方法包括:
在第一生长季节在场所中生长抗线虫植物,其中在该第一生长季节中生长该抗线虫植物抑制该场所中的线虫群体或维持对该场所中该线虫群体的抑制;
在相同的或随后的生长季节,在该场所中生长易感线虫植物;以及
与该线虫群体未被抑制的情况下预期的健康和/或产量相比,实现对该易感线虫植物的健康和/或产量的改善。
44.如实施例43所述的方法,其中该易感线虫植物的健康的改善包括以下中的一个或多个:改善根发育(例如,改善根或根毛生长);改善产量;更快出苗;改善植物胁迫管理,包括提高耐逆性和/或改善胁迫恢复;增加机械强度;改善抗旱性;减少真菌、细菌和/或病毒性疾病感染;或其任何组合。
45.如上述实施例1-44中任一项所述,其中该抗线虫植物表达与SEQ ID NO.1具有至少95%、96%、97%、98%或至少99%序列同一性的杀线虫Cryl4Ab蛋白。
46.如实施例1-44中任一项所述,其中该抗线虫植物包含优良种事件EE-GM5。
47.如实施例1-44中任一项所述,其中该抗线虫植物包含优良种事件EE-GM4。
48.如实施例1-44中任一项所述,其中该抗线虫植物表达苏云金芽孢杆菌毒素Cry14Ab-1或其功能截短或变体。
49.一种针对场所的线虫管理方法,该方法包括:
在场所中生长抗线虫植物,其中该抗线虫植物在南美国家如巴西或巴拉圭的第一季期间生长;以及
在生长该抗线虫植物之后,在该场所中生长易感线虫植物,其中该易感线虫植物在南美国家如巴西或巴拉圭的第二季期间生长。
50.如实施例49所述的方法,其中该抗线虫植物表达苏云金芽孢杆菌毒素Cry14Ab-1或其功能截短或变体,并且该易感线虫植物选自由玉米、棉花、高粱、小麦和甘蔗组成的组。
以下实例是以说明的方式而不是限制的方式提供的。
实例
实例1-抗线虫植物的生成
从BC2:F2选择的植物中创建含有GMB151转基因事件(即EE-GM5,如国际公开号WO2018/119364中所述)的大豆品系。这些大豆品系对GMB151事件的接合性不同。创建了一个针对GMB151事件的纯合子品系,同时还选择了针对GMB151事件的第二无效合子品系。这两个品系与普通回交亲本大豆品系具有约87.5%遗传同一性。因此,除了存在GMB151事件外,这些品系在农艺上是相似的。
实例2-通过表达苏云金芽孢杆菌毒素Cry14Ab-1的GMB151转基因大豆防治根腐线虫最短尾短体线虫(Godfrey)
研究了Cry14Ab-1在田地对最短尾短体线虫的防治能力。特别地,考虑了表达Cry14Ab-1的事件GMB151可以减少最短尾短体线虫在田地生长的大豆中的繁殖,并且最短尾短体线虫繁殖的这种减少可导致显著的产量保护。
材料和方法:
在2018/19大豆生长季节期间,在巴西的巴拉那州(Paraná)、戈亚斯州和马托格罗索州(Mato Grosso)进行了田间试验。田间试验位置如下表1所示:
表1.最短尾短体线虫研究试验位置:
a
b
c
d
GMB151事件被渗入大豆成熟组IX背景中,该背景适应在巴西生产。通过利用成熟组IX品系作为轮回亲本来完成渗入。在BC2:F2代,选择针对GMB151事件的纯合子和无效合子植物来创建两个大豆品系,这两个品系在存在或不存在GMB151事件的情况下有所不同,但在其他方面与轮回亲本的遗传相关性大约为87.5%。
如表1所示,在具有不同最短尾短体线虫群体密度梯度的六个研究地点进行大豆试验。三个研究地点的最短尾短体线虫群体密度预期会降低大豆产量,而三个地点的最短尾短体线虫群体密度预计不足以显著降低大豆产量。基于2017/18大豆作物样品或与农场管理者的沟通,对最短尾短体线虫害虫压力进行了预测。
实验设计和试验处理的差异在预计的高压地点和低压地点之间有所不同。预计的低压试验地点是作为随机完全区组设计试验进行的,有五个重复。每个田地地块由四排5米长的大豆行组成,间隔0.5米。每个试验中包括两种处理,即GMB151纯合子品系(纯合子)和GMB151无效合子品系(无效合子)。
与低压地点相比,在三个高压地点的试验中进行了两个改变。首先,将GMB151事件与杀线虫种子处理组合进行评估。试验包括三种种子处理。将种子处理的处理因子与接合性(即纯合子或无效合子)的处理因子完全交叉,以产生六种处理。六种处理采用裂区设计进行布置,其中接合性为全地块处理,而种子处理为子地块处理。子地块的大小与其他地点相同,为四排5米长的大豆行,间隔76.2厘米。对高压地点试验的第二个改变是将重复个数从五减少到三。由于包括了种子处理子地块和可用于田间试验的空间有限,重复个数减少了。
数据收集:
通过测量种植后90天(dap)大豆根系中最短尾短体线虫的群体密度来评估GMB151对最短尾短体线虫的功效。选择90dap的时间点是因为它近似于先前最短尾短体线虫研究的采样时间(Lima等人,2015)。在90dap时,将每个地块十株植物的大豆根系从田地中移出。从每个地块的第一行和第四行取样五个根系。选择这些行是因为它们没有被收获,因此最短尾短体线虫的采样不会影响季节结束时的产量估计。根样品被带到实验室进行称重,然后在搅拌机中均质化。然后使用Jenkins(1964)的方法从根片中提取线虫。然后将提取的线虫悬浮于水中,并在显微镜下计数1ml子样品中的最短尾短体线虫的数量。计算每个样品中最短尾短体线虫数量/g根。
在生理成熟时对每个地块的大豆产量进行估计。收获每四行地块中间的两行。测量每个地块的粒重和水分,并将产量标准化为13%水分。
数据分析:
分别分析了三个高压位置和三个低压位置的最短尾短体线虫群体密度数据。在分析之前,对最短尾短体线虫数量/克(g)根进行自然对数转换,以减少异质性。每个试验的产量数据都单独进行了分析,因为研究试验位置存在广泛的最短尾短体线虫群体密度,这将影响最短尾短体线虫造成的伤害量。产量数据以蒲式耳/英亩进行分析。
对数据进行分析,以估计GMB151接合性对最短尾短体线虫群体密度和大豆产量的影响。将数据拟合到混合效应模型ANOVA中,并以95%置信区间估计纯合子品系和无效合子品系之间的差异。不包括种子处理子地块的试验使用了如下模型,该模型包括重复作为随机效应,以及接合性作为固定效应。重复和接合性的相互作用被认为是误差项。包括种子处理子地块的试验包括接合性、种子处理、和种子处理的接合性相互作用作为固定效应。重复和所有其他因子之间的相互作用被认为是随机效应。重复和接合性的相互作用被认为是全地块误差项,而重复、接合性和种子处理的相互作用被认为是子地块误差项。种子处理对最短尾短体线虫、大豆产量及其与GMB151性状的相互作用的影响超出了本文报道的研究范围。因此,数据仅通过种子处理的接合性进行总结。
结果:
在两个高压位置(里奥韦尔迪和Sinop1)和一个低压位置(Sinop2),最短尾短体线虫群体密度高于Lima等人(2015)观察到的导致地上疾病症状的群体密度。高压卢皮奥诺波利斯(Lupinópolis)位置的平均最短尾短体线虫群体密度在Lima等人(2015)在有症状的田地外区域观察到的范围之内,因此预期会导致较少的产量下降(如果有的话)。最后两个低压位置(伊比波朗(Ibiporá)和特林达迪岛(Trinidade))的最短尾短体线虫群体处于检测限,因此不会影响大豆产量。
纯合子大豆品系使三个高压位置的最短尾短体线虫群体密度减少96%(P<0.0001)。在预计的低压位置Sinop2,纯合子品系也使最短尾短体线虫群体显著减少了90%(P<0.01)。在单独的试验位置,最短尾短体线虫的平均减少率在90%-97%之间(图1)。
卢皮奥诺波利斯和伊比波朗两个地点的大豆产量都受到与该区域成熟组拟合较差的负面影响。较差的拟合导致所有试验处理的绝对产量较低。在这两个试验地点,处理产量的范围为从12.4蒲式耳/英亩到16.9蒲式耳/英亩。其他四个位置的处理产量的范围为从28.0蒲式耳/英亩至57.1蒲式耳/英亩。
纯合子品系和无效合子品系之间的产量差异取决于试验位置的最短尾短体线虫群体密度(图2)。在最短尾短体线虫群体密度最低的三个位置中的任一个位置中,这两个大豆品系之间均没有显著的产量差异。在最短尾短体线虫群体密度最高的三个地点中,纯合子品系和无效合子品系之间都有显著的产量差异。在每个位置,与无效合子品系相比,纯合子品系的平均产量提高了6.2-7.8蒲式耳/英亩或14%-25%。
讨论:
所选的六个研究地点中最短尾短体线虫群体密度范围为从低于检测限至每克根组织近1,000个线虫。这六个地点使我们能够评估GMB151转基因大豆事件对最短尾短体线虫的功效及其保护大豆产量的能力。GMB151事件对最短尾短体线虫是非常有效的。进入生长季节三个月后,在针对GMB151事件的纯合子大豆品系中,最短尾短体线虫群体相比无效合子品系平均低>90%。这种防治水平远远超过了当前的管理实践(包括作物轮作、休耕和化学防治)所提供的水平(Lima等人.2015,Ribeiro等人.2014,Rodrigues等人.2014)。
GMB151事件对大豆产量保护的益处取决于最短尾短体线虫的群体密度。在最短尾短体线虫低压下,大豆产量不受GMB151性状的影响。这一结果表明,在不存在最短尾短体线虫的情况下,GMB151对大豆产量没有任何负面影响。在最短尾短体线虫群体密度最高的三个试验位置中的每一个中,针对GMB151性状的纯合子大豆品系的大豆产量都明显更高。这些地点的大豆产量提高范围在14%-25%之间。因此,我们的结果与先前的研究一致,即估计最短尾短体线虫的产量伤害在10%-30%之间(Dias等人,2007,Franchini等人,2007)。
本文报道的田间试验的结果表明,表达Cry14Ab1的大豆性状GMB151对最短尾短体线虫具有显著的功效,从而提高了大豆产量。这些结果是在田间生产条件下获得的,其中最短尾短体线虫群体密度在巴西商业生产田报告的范围内(Franchini等人,2007,Lima等人,2015)。因此,GMB151性状代表了一种潜在的独特的新管理工具,用于防治目前几乎没有可行的管理选项的经济上重要的作物害虫。
实例2的参考文献:
Barbosa,B.F.F.,J.M.dos Santos,J.C.Barbosa,P.L.M.Soares,A.R.Ruas,和R.B.de Carvalho.2013.Aggressiveness of Pratylenchus brachyurus to thesugarcane,compared with key nematode P.zeae[与关键线虫玉米短体线虫相比,最短尾短体线虫对甘蔗的攻击性].Nematropica[向线性]43:119-130.
Dias,W.P.,N.R.Ribeiro,I.O.N.Lopes,A.Garcia,G.E.S.Carneiro,和J.F.V.Silva.2007.Manejo de nematoides na cultura da soja[大豆作物的线虫管理].于:Congresso Brasileiro de Nematologia[巴西线虫学大会];8月12日;
Franchini,J.C.,O.F.Saraiva,H.Debiase,和S.L.Goncalves.2007.
Inomoto,M.M.,A.M.C.Goulart,A.C.Z.Machado,和A.R.Monteiro.2001.Effectof population densities of Pratylenchus brachyurus on the growth of cottonplants[最短尾短体线虫群体密度对棉花植物生长的影响].Fitopatologia Brasileira[巴西植物病理学]26:192-196.
Jenkins,W.R.1964.A rapid centrifugal-flotation technique forseparating nematodes from soil[用于从土壤中分离线虫的快速离心浮选技术].PlantDisease Reporter[植物疾病报道]48:692.
Lima,F.S.D.O.,G.R.D.Santos,S.R.Nogueira,P.R.R.D.Santos,和V.R.Correa.2015.Population dynamics of the root lesion nematode,Pratylenchusbrachyurus,in soybean fields in Tocantins State and its effect to soybeanyield[托坎廷斯州大豆田根腐线虫最短尾短体线虫的群体动态及其对大豆产量的影响].Nematropica[向线性]45:170-177.
Lima,F.S.O.,V.R.Correa,S.R.Nogueira,和P.R.R.Santos.2017.Nematodesaffecting soybean and sustainable practices for their management[影响大豆的线虫及其管理的可持续实践].Intech doi:10.5772/67030.
Ribeiro,N.R.,W.P.Dias,和J.M.Santos.2010.
Ribeiro,L.M,H.D.Campos,C.R.Dias-Arieira,D.L.Neves,和G.C.Ribeiro.2014.Effect of soybean seed treatment on the population dynamicsof Pratylenchus brachyurus under water stress conditions[水分胁迫条件下大豆种子处理对最短尾短体线虫群体动态的影响].Bioscience Journal[生物科学杂志]30:616-622.
Rios,A.D.F.,M.R.Rocha,A.S.Machado,K.A.G.B.Avila,R.A.Teixeira,L.C.Santos,和L.R.S.Rabelo.2016.Host suitability of soybean and corn genotypesto the lesion caused by nematode under natural infestation conditions[大豆和玉米基因型对自然侵染条件下线虫引起的损害的寄主适宜性].
Rodrigues,D.B.,C.R.Dias-Arieira,M.V.V.Vedoveto,M.Roldi,H.F.D.Molin,和V.H.F.Abe.2014.Crop rotation for Pratylenchus brachyurus control in soybean[大豆中最短尾短体线虫防治的作物轮作].Nematropica[向线性]44:146-151.
Wei,J.,K.Hale,L.Carta,E.Platzer,C.Wong,S.Fang,和F.V.Aroian.2003.Bacillus thuringiensis crystal proteins that target nematodes[靶向线虫的苏云金芽孢杆菌晶体蛋白].Proceedings of the National Academy ofSciences[美国国家科学院院刊]100:2760-2765.
实例3-表达苏云金芽孢杆菌毒素Cry14Ab-1的GMB151转基因大豆在第二季(“第二次收获”)作物中提供杀线虫保护
巴西的大豆耕作系统可以在一个历年生产两种作物。主要生长季节被称为“第一季”,从9月至12月种植大豆开始。在1月至3月之间收获第一季大豆作物。在大豆收获后立即种植第二期作物,称为“第二季(safrinha)”。然后在5月至8月收获第二季作物。在大豆耕作系统中,巴西最常见的第二季作物是玉米和棉花。在巴西,大豆、玉米和棉花都易受染植物寄生线虫最短尾短体线虫的影响。因此,研究了在第一季种植GMB151大豆是否可以为随后的易感线虫第二季作物提供线虫抑制。
两个大豆品系(一个是针对GMB151性状的纯合子品系,另一个是针对其的无效品系)被种植在最短尾短体线虫感染的生产田中。2018年和2019年,利用了三块最短尾短体线虫感染的田地进行研究。大豆田间试验包括三个(2018年)或五个(2019年)重复,采用随机完全区组设计进行布置,其中单个地块长6米,宽12大豆行。在2019年和2020年4/5月大豆试验收获后,立即在同一块地的顶部种植第二季作物。在2019年,信号草作为第二季作物种植。在每个位置平行于收获的大豆行种植信号草地块。在大豆田间试验地顶部种植信号草的三个重复。因此,地块长6米,宽12行。在2020年4月,继大豆之后,玉米和棉花作为第二季作物种植。在大豆试验地顶部种植玉米地块的三个重复和棉花地块的三个重复。玉米行和棉花行垂直于收获的大豆行种植。棉花地块种植在重复一、重复二、和重复三前3米的顶部。玉米地块种植在重复五、重复四、和重复三后3米的顶部。因此,棉花地块和玉米地块长9米,两个重复宽8行,并且每种作物的第三个重复宽4行(图3)。
收集数据是为了确定是否可以为继GMB151大豆之后种植的第二季作物提供最短尾短体线虫保护。通过测量最短尾短体线虫群体密度和作物产量来评估对第二季作物的保护。最短尾短体线虫群体密度测量为线虫数量/g根组织。分别于种植后30天(dap)、60dap和90dap,测量第二季作物中最短尾短体线虫的群体密度。针对每次最短尾短体线虫测量,每个地块收集十株植物的根系。从每个地块的第一行和最后一行收集五个根。没有对中间行进行采样,因为根样品具有破坏性,并且会干扰每个地块中间行产量数据的收集。在2020年8月,从棉花和玉米第二季地块的中间行收集粒产量。信号草是作为放牧作物生长的,因此2019年没有从信号草地块中获取产量。
对数据进行分析,以评估与传统大豆相比,继GMB151大豆之后的地块之间,最短尾短体线虫群体密度和粒产量是否不同。分别对每种第二季作物(玉米、棉花和信号草)的数据进行分析。所有数据均采用混合效应ANOVA模型进行分析。模型包括位置、GMB151接合性及其相互作用的固定效应。实验重复被认为是随机效应。
讨论:
在第一季期间,通过预先种植GMB151大豆,所有三种第二季作物的最短尾短体线虫群体密度都显著降低。取决于第二季作物、试验位置和采样时间点,最短尾短体线虫群体密度减少28%-100%,平均减少了87%。没有明确的迹象表明,在这三种作物中的任一种作物中,最短尾短体线虫群体抑制在第二季减少,或线虫群体再次出现。因此,在整个耕作系统(例如,参见图8)中,从第一季大豆作物开始,延伸至第二季作物收获,种植GMB151大豆减少了最短尾短体线虫群体。在大豆季节结束时,GMB151大豆使最短尾短体线虫群体减少了99%,这导致在整个第二季作物季节中(从种植到收获玉米第二季作物(图4和图7)和棉花第二季作物(图7)),最短尾短体线虫受到显著抑制。
在马托格罗索州的里奥韦尔迪,第二季作物保护使玉米产量大幅提高。例如,如图5所示,GMB151大豆提供的最短尾短体线虫防治导致大豆产量在数量上提高,以及第二季耕作季节的玉米产量显著提高。GMB151通过最短尾短体线虫防治提供的产量提高使农民增加了大约90美元/英亩的总收入。总收入估计是基于巴西平均粮食价格为每蒲式耳大豆9.00美元以及每蒲式尔玉米6.30美元。
本实例中提供的数据表明,将高效转基因杀线虫蛋白结合至寄主作物中不仅可以为转化作物提供保护,还可以为与转化作物轮作的易感作物或随后种植在与转化作物相同的场所的易感作物提供保护。这提供了一种在整个农业生产系统中提供线虫防治的有效方法。转化单一作物以为整个生产系统提供保护限制了与生产和注册转基因作物相关的开发和监管成本。它还提供了一种将线虫抗性引入不具备原生抗性(这是迁徙性植物寄生线虫如短体线虫属物种的一个特别常见的问题)的作物中的经济有效的方法。这种途径还提供了向作物(如小麦)引入转基因线虫保护的机会,虽然使最终用户接受转基因粮食可能是一个障碍,但短体线虫属物种可能是一种导致显著减产的病原体,且几乎没有有效的管理选项。
在一个实施例中,转基因GMB151大豆为巴西种植者带来显著的产量和耕作系统管理益处。GMB151对最短尾短体线虫的高功效为种植者提供了第一季大豆保护和对多种第二季作物的保护。正是这种对第二季作物的益处,也为种植者在生产系统中提供了自由和灵活性,可以选择最盈利、农艺上最有利的轮作,而不用考虑作物对最短尾短体线虫的易感性。
实例3的参考文献:
Barker,K.R.,和S.R.Koenning.1998.Developing sustainable systems fornematode management[开发线虫管理的可持续系统].Annual Review of Phytopathology[植物病理学年度评论]36:165-205.
Cook,R.2004.Genetic resistance to nematodes:where is it useful?[对线虫的遗传抗性:它在哪里有用?]Australasian Plant Pathology[澳大利亚植物病理学]33:139-150.
Inagaki,H.,和M.Tsutsumi.1971.Survival of the soybean cyst nematodeHeterodera glycines Ichinohe(Tylenchida:Heteroderidae)under certain storageconditions[大豆胞囊线虫在一定储存条件下的存活].Applied Entomology and Zoology[应用昆虫学和动物学]6:156-162.
IRAC.2018.Nematicide resistance risk statement[杀线虫剂抗性风险声明].https://irac-online.org/teams/nematodes.
Nicol,J.M.,S.J.Turner,D.L.Coyne,L.den Nijs,S.Hockland,和Z.T.Maafi.2011.Current nematode threats to world agriculture[当前线虫对世界农业的威胁],于:J.Jones,G.Gheysen,C.Fenoll(编辑),Genomics and Molecular Geneticsof Plant-Nematode Interaction[植物-线虫相互作用的基因组学和分子遗传学],Springer,Germany[德国施普林格],pp.21-43.
Wei,J.,K.Hale,L.Carta,E.Platzer,C.Wong,S.Fang,和F.V.Aroian.2003.Bacillus thuringiensis crystal proteins that target nematodes[靶向线虫的苏云金芽孢杆菌晶体蛋白].Proceedings of the National Academy ofSciences[美国国家科学院院刊]100:2760-2765.
实例4-通过表达苏云金芽孢杆菌毒素Cry14Ab-1的GMB151转基因大豆防治根腐线虫最短尾短体线虫(Godfrey)
扩展了实例2中描述的实验,进一步研究了Cry14Ab-1在田地防治最短尾短体线虫的能力。特别地,考虑了表达Cry14Ab-1的事件GMB151可以减少最短尾短体线虫在田地生长的大豆中的繁殖,并且最短尾短体线虫繁殖的这种减少可导致显著的产量保护。
材料和方法:
在2018/19、2019/20和2020/21大豆生长季节期间,在巴西的巴伊亚州、戈亚斯州、马托格罗索州、巴拉那州和圣保罗州进行了田间试验。在三个第一季总共种植了49个大豆试验。
GMB151事件被渗入到从MG VI到IX的多种大豆背景中,每种背景都适应在巴西生产。通过利用适应巴西的背景作为轮回亲本来完成渗入。对于每种背景,在BC2:F2或BC3:F2代,选择针对GMB151事件的纯合子和无效合子植物来创建两个大豆品系,这两个品系在存在或不存在GMB151事件的情况下有所不同,但在其他方面与轮回亲本的遗传相关性大约为87.5%(BC2:F2)或93.75%(BC3:F2)。
在受到一系列最短尾短体线虫群体密度侵扰的研究地点进行大豆试验。
实验设计和试验处理的差异在试验地点之间有所不同。49个试验地点中的每一个都包括两个主要地块处理,以随机完全区组设计进行重复,并且进行五到六个重复。每个试验中包括的两个主要地块处理是(1)针对GMB151事件的BC2:F2或BC3:F2纯合子品系,以及(2)针对GMB151性状的相应BC2:F2和BC3:F2无效合子品系。在位置子集中包括额外的裂区处理。九个位置都进行了化学杀线虫剂处理的裂区处理。在这九个位置中,每个大豆品系都用以下处理(1)基础杀真菌剂/杀昆虫剂种子处理、(2)基础杀真菌剂/杀昆虫剂种子处理和杀线虫剂种子处理、以及(3)基础杀真菌剂/杀昆虫剂种子处理和液体杀线虫剂的沟内施用。其他三个位置采用了略有不同的试验设计,其中主要地块处理是耕作(传统耕作或免耕生产)的水平。在这三个地点的裂区处理是大豆品系,即针对GMB151性状的纯合子品系,或无效合子品系。
所有位置的地块均为长5米,宽4行。
数据收集:
通过测量种植后90天(dap)大豆根系中最短尾短体线虫的群体密度来评估GMB151、化学杀线虫剂和耕作对最短尾短体线虫的功效。选择90dap的时间点是因为它近似于先前最短尾短体线虫研究的采样时间(Lima等人,2015)。在90dap时,将每个地块十株植物的大豆根系从田地中移出。从每个地块的第一行和第四行取样三至五个根系。选择这些行是因为它们没有被收获,因此最短尾短体线虫的采样不会影响季节结束时的产量估计。根样品被带到实验室进行称重,然后在搅拌机中均质化。然后使用Jenkins(1964)的方法从根片中提取线虫。然后将提取的线虫悬浮于水中,并在显微镜下计数1ml子样品中的最短尾短体线虫的数量。计算每个样品中最短尾短体线虫数量/g根。
在生理成熟时对每个地块的大豆产量进行估计。收获每四行地块中间的两行。测量每个地块的粒重和水分,并将产量标准化为13%水分。
数据分析:
首先分析了所有位置的最短尾短体线虫群体密度和产量数据,以估计GMB151对最短尾短体线虫群体密度的影响。在分析之前,对最短尾短体线虫数量/克(g)根进行自然对数转换,以减少异质性。产量数据以蒲式耳/英亩进行分析。
然后,分别分析了九个试验的最短尾短体线虫群体密度和产量数据,从而评估化学杀线虫剂与GMB151组合。然后完成了第三项分析,以评估三个试验位置,比较耕作实践和GMB151性状的最短尾短体线虫防治和大豆产量保护。
结果:
在49个试验中的33个试验中,GMB151无效品系的最短尾短体线虫群体密度高于Lima等人(2015)观察到的导致地上疾病症状的群体密度。
在49个试验中,纯合子大豆品系使最短尾短体线虫群体密度降低了91%(P<0.0001)(图9)。GMB151性状也显著提高了大豆产量,平均提高4.2蒲式耳/英亩或9%(图10)。与种子处理或施用沟内杀线虫剂相比,纯合子品系提供了显著更好的最短尾短体线虫防治(图11)。与传统耕作相比,纯合子品系也提供了显著更好的防治(图12)。
纯合子品系和无效合子品系之间的产量差异取决于试验位置的最短尾短体线虫群体密度,在具有较高最短尾短体线虫群体密度的试验中通常观察到较大的产量效益。平均而言,纯合子品系的大豆产量比无效品系高4.2蒲式耳/英亩或9.4%(图2)。
讨论:
所进行的49个研究试验的最短尾短体线虫群体密度范围为从接近检测限至每克根组织近1,000个线虫。这些试验使我们能够评估GMB151转基因大豆事件对最短尾短体线虫的功效及其保护大豆产量的能力。GMB151事件对最短尾短体线虫是非常有效的。进入生长季节三个月后,在针对GMB151事件的纯合子大豆品系中,最短尾短体线虫群体相比无效合子品系平均低>90%。这种防治水平远远超过了当前的管理实践(包括作物轮作、休耕和化学防治)所提供的水平(Lima等人.2015,Ribeiro等人.2014,Rodrigues等人.2014)。
本文报道的田间试验的结果表明,表达Cry14Ab1的大豆性状GMB151对最短尾短体线虫具有显著的功效,从而提高了大豆产量。这些结果是在田间生产条件下获得的,其中最短尾短体线虫群体密度在巴西商业生产田报告的范围内(Franchini等人,2007,Lima等人,2015)。因此,GMB151性状代表了一种潜在的独特的新管理工具,用于防治目前几乎没有可行的管理选项的经济上重要的作物害虫。
实例4的参考文献:
Barbosa,B.F.F.,J.M.dos Santos,J.C.Barbosa,P.L.M.Soares,A.R.Ruas,和R.B.de Carvalho.2013.Aggressiveness of Pratylenchus brachyurus to thesugarcane,compared with key nematode P.zeae[与关键线虫玉米短体线虫相比,最短尾短体线虫对甘蔗的攻击性].Nematropica[向线性]43:119-130.
Dias,W.P.,N.R.Ribeiro,I.O.N.Lopes,A.Garcia,G.E.S.Carneiro,和J.F.V.Silva.2007.Manejo de nematoides na cultura da soja[大豆作物的线虫管理].于:Congresso Brasileiro de Nematologia[巴西线虫学大会];8月12日;
Franchini,J.C.,O.F.Saraiva,H.Debiase,和S.L.Goncalves.2007.
Inomoto,M.M.,A.M.C.Goulart,A.C.Z.Machado,和A.R.Monteiro.2001.Effectof population densities of Pratylenchus brachyurus on the growth of cottonplants[最短尾短体线虫群体密度对棉花植物生长的影响].Fitopatologia Brasileira[巴西植物病理学]26:192-196.
Jenkins,W.R.1964.A rapid centrifugal-flotation technique forseparating nematodes from soil[用于从土壤中分离线虫的快速离心浮选技术].PlantDisease Reporter[植物疾病报道]48:692.
Lima,F.S.D.O.,G.R.D.Santos,S.R.Nogueira,P.R.R.D.Santos,和V.R.Correa.2015.Population dynamics of the root lesion nematode,Pratylenchusbrachyurus,in soybean fields in Tocantins State and its effect to soybeanyield[托坎廷斯州大豆田根腐线虫最短尾短体线虫的群体动态及其对大豆产量的影响].Nematropica[向线性]45:170-177.
Lima,F.S.O.,V.R.Correa,S.R.Nogueira,和P.R.R.Santos.2017.Nematodesaffecting soybean and sustainable practices for their management[影响大豆的线虫及其管理的可持续实践].Intech doi:10.5772/67030.
Ribeiro,N.R.,W.P.Dias,和J.M.Santos.2010.
Ribeiro,L.M,H.D.Campos,C.R.Dias-Arieira,D.L.Neves,和G.C.Ribeiro.2014.Effect of soybean seed treatment on the population dynamicsof Pratylenchus brachyurus under water stress conditions[水分胁迫条件下大豆种子处理对最短尾短体线虫群体动态的影响].Bioscience Journal[生物科学杂志]30:616-622.
Rios,A.D.F.,M.R.Rocha,A.S.Machado,K.A.G.B.Avila,R.A.Teixeira,L.C.Santos,和L.R.S.Rabelo.2016.Host suitability of soybean and corn genotypesto the lesion caused by nematode under natural infestation conditions[大豆和玉米基因型对自然侵染条件下线虫引起的损害的寄主适宜性].
Rodrigues,D.B.,C.R.Dias-Arieira,M.V.V.Vedoveto,M.Roldi,H.F.D.Molin,和V.H.F.Abe.2014.Crop rotation for Pratylenchus brachyurus control in soybean[大豆中最短尾短体线虫防治的作物轮作].Nematropica[向线性]44:146-151.
Wei,J.,K.Hale,L.Carta,E.Platzer,C.Wong,S.Fang,和F.V.Aroian.2003.Bacillus thuringiensis crystal proteins that target nematodes[靶向线虫的苏云金芽孢杆菌晶体蛋白].Proceedings of the National Academy ofSciences[美国国家科学院院刊]100:2760-2765.
实例5-表达苏云金芽孢杆菌毒素Cry14Ab-1的GMB151转基因大豆在第二季(“第二次收获”)作物中提供杀线虫保护
基于并扩展了实例3中描述的实验,本实例试图进一步确定在第一季种植GMB151大豆是否可以为随后的易感线虫第二季作物提供线虫抑制。
在第一季生产季节期间在最短尾短体线虫感染的田地中,两个大豆品系(一个是针对GMB151性状的纯合子品系,另一个是针对其的无效品系)被种植在生产田中。在2019年、2020年和2021年4/5月大豆试验收获后,立即在同一块地的顶部种植传统的第二季作物。每个第二季作物试验由三个重复组成,以随机完全区组设计进行布置。在2019年,臂形草属(信号草)作为第二季作物种植。在每个位置平行于收获的大豆行种植信号草地块。地块长5米,宽12行。在2020年和2021年4月,继大豆之后,玉米和棉花作为第二季作物种植。在大豆试验地顶部种植玉米地块的三个重复和棉花地块的三个重复。玉米行和棉花行垂直于收获的大豆行种植。棉花地块种植在重复一、重复二、和重复三前3米的顶部。玉米地块种植在重复五、重复四、和重复三后3米的顶部。因此,棉花地块和玉米地块长9米,两个重复宽8行,并且每种作物的第三个重复宽4行(图3)。在2021年,在三个位置,棉花第二季试验被高粱第二季试验取代。
收集数据是为了确定是否可以为继GMB151大豆之后种植的易感第二季作物提供最短尾短体线虫保护。通过测量最短尾短体线虫群体密度和作物产量来评估对第二季作物的保护。最短尾短体线虫群体密度测量为线虫数量/g根组织。分别于种植后30天(dap)、60dap和90dap,测量第二季作物中最短尾短体线虫的群体密度。针对每次最短尾短体线虫测量,每个地块收集十株植物的根系。从每个地块的第一行和最后一行收集三到五个根。没有对中间行进行采样,因为根样品具有破坏性,并且会干扰每个地块中间行产量数据的收集。在2020年和2021年8月,从棉花、玉米和高粱第二季地块的中间行收集粒产量。臂形草属是作为放牧作物生长的,因此2019年没有从信号草地块中获取产量。
对数据进行分析,以评估与传统大豆相比,继GMB151大豆之后的地块之间,最短尾短体线虫群体密度和粒产量是否不同。分别对每种第二季作物(玉米、棉花、高粱和臂形草属)的数据进行分析。所有数据均采用混合效应ANOVA模型进行分析。模型包括位置、GMB151接合性及其相互作用的固定效应。实验重复被认为是随机效应。
讨论:
在第一季期间,通过预先种植GMB151大豆,所有四种第二季作物的最短尾短体线虫群体密度都显著降低(图13)。取决于第二季作物,在种植后90天,最短尾短体线虫群体密度平均减少66%-93%,平均减少了80%。没有明确的迹象表明,在这三种作物中的任一种作物中,最短尾短体线虫群体抑制在第二季减少,或线虫群体再次出现。因此,在整个耕作系统(例如,参见图8)中,从第一季大豆作物开始,延伸至第二季作物收获,种植GMB151大豆减少了最短尾短体线虫群体。这导致第一季大豆作物(图10)和随后的第二季作物(图7)的产量都有所提高。在这个实例位置,在大豆季节结束时,GMB151大豆使最短尾短体线虫群体减少了99%,这导致在整个第二季作物季节中(从种植到收获玉米第二季作物(图4和图6)和棉花第二季作物(图6)),最短尾短体线虫受到显著抑制。
在马托格罗索州的里奥韦尔迪,第二季作物保护使玉米产量大幅提高。例如,如图5所示,GMB151大豆提供的最短尾短体线虫防治导致大豆产量在数量上提高,以及第二季耕作季节的玉米产量显著提高。GMB151通过最短尾短体线虫防治提供的产量提高使农民增加了大约90美元/英亩的总收入。总收入估计是基于巴西平均粮食价格为每蒲式耳大豆9.00美元以及每蒲式尔玉米6.30美元。
实例3和本实例5中提供的数据表明,将高效转基因杀线虫蛋白结合至寄主作物中,不仅可以为转化作物提供保护,还可以为与转化作物轮作的易感作物或随后种植在与转化作物相同的场所的易感作物提供保护。这提供了一种在整个农业生产系统中提供线虫防治的有效方法。转化单一作物以为整个生产系统提供保护限制了与生产和注册转基因作物相关的开发和监管成本。它还提供了一种将线虫抗性引入不具备原生抗性(这是迁徙性植物寄生线虫如短体线虫属物种的一个特别常见的问题)的作物中的经济有效的方法。这种途径还提供了向作物(如小麦)引入转基因线虫保护的机会,虽然使最终用户接受转基因粮食可能是一个障碍,但短体线虫属物种可能是一种导致显著减产的病原体,且几乎没有有效的管理选项。
在一个实施例中,转基因GMB151大豆为巴西种植者带来显著的产量和耕作系统管理益处。GMB151对最短尾短体线虫的高功效为种植者提供了第一季大豆保护和对多种第二季作物的保护。正是这种对第二季作物的益处,也为种植者在生产系统中提供了自由和灵活性,可以选择最盈利、农艺上最有利的轮作,而不用考虑作物对最短尾短体线虫的易感性。
本文所示的针对一种易感线虫植物的效果也预期对具有相同线虫易感性的寄主有效。下表显示了一些常见作物的易感性:
/>
牧场耕地面积估计
*包括覆盖作物面积
关于耕作面积估计,另参见Camila Thaiana Rueda da Silva等人,Agriculture[农业]2020,10,13;Doi:10.3390/农业10010013;Renato Lara De Assis等人,ExplAgric.[实验农业]:第1页,共20页
实例5的参考文献:
Barker,K.R.,和S.R.Koenning.1998.Developing sustainable systems fornematode management[开发线虫管理的可持续系统].Annual Review of Phytopathology[植物病理学年度评论]36:165-205.
Cook,R.2004.Genetic resistance to nematodes:where is it useful?[对线虫的遗传抗性:它在哪里有用?]Australasian Plant Pathology[澳大利亚植物病理学]33:139-150.
Inagaki,H.,和M.Tsutsumi.1971.Survival of the soybean cyst nematodeHeterodera glycines Ichinohe(Tylenchida:Heteroderidae)under certain storageconditions[大豆胞囊线虫在一定储存条件下的存活].Applied Entomology and Zoology[应用昆虫学和动物学]6:156-162.
IRAC.2018.Nematicide resistance risk statement[杀线虫剂抗性风险声明].https://irac-online.org/teams/nematodes.
Nicol,J.M.,S.J.Turner,D.L.Coyne,L.den Nijs,S.Hockland,和Z.T.Maafi.2011.Current nematode threats to world agriculture[当前线虫对世界农业的威胁],于:J.Jones,G.Gheysen,C.Fenoll(编辑),Genomics and Molecular Geneticsof Plant-Nematode Interaction[植物-线虫相互作用的基因组学和分子遗传学],Springer,Germany[德国施普林格],pp.21-43.
Wei,J.,K.Hale,L.Carta,E.Platzer,C.Wong,S.Fang,和F.V.Aroian.2003.Bacillus thuringiensis crystal proteins that target nematodes[靶向线虫的苏云金芽孢杆菌晶体蛋白].Proceedings of the National Academy ofSciences[美国国家科学院院刊]100:2760-2765.
说明书中提到的所有出版物和专利申请都指示了本发明所属领域技术人员的技术水平。所有出版物和专利申请均通过引用并入本文,其程度如同每个单独的出版物或专利申请被特定且单独地指示通过引用并入。
尽管出于清楚理解的目的,已经通过说明和实例的方式对前述发明进行了详细描述,但是显而易见的是,在所附权利要求的范围内可以进行某些改变和修改。
序列表
<110>巴斯夫农业解决方案种子美国有限责任公司(BASF Agricultural SolutionsSeed US LLC)
<120>线虫抑制
<130>32471/202662
<150>US 63/174,191
<151>2021-04-13
<160>2
<170>PatentIn 3.5版
<210>1
<211>1185
<212>PRT
<213>人工序列
<220>
<223>合成
<220>
<221>尚未归类的特征
<223>Cry14Ab1氨基酸序列
<400>1
Met Asp Cys Asn Leu Gln Ser Gln Gln Asn Ile Pro Tyr Asn Val Leu
1 5 1015
Ala Ile Pro Val Ser Asn Val Asn Ser Leu Thr Asp Thr Val Gly Asp
202530
Leu Lys Lys Ala Trp Glu Glu Phe Gln Lys Thr Gly Ser Phe Ser Leu
354045
Thr Ala Leu Gln Gln Gly Phe Ser Ala Ser Gln Gly Gly Thr Phe Asn
505560
Tyr Leu Thr Leu Leu Gln Ser Gly Ile Ser Leu Ala Gly Ser Phe Val
65707580
Pro Gly Gly Thr Phe Val Ala Pro Ile Ile Asn Met Val Ile Gly Trp
859095
Leu Trp Pro His Lys Asn Lys Asn Ala Asp Thr Glu Asn Leu Ile Asn
100 105 110
Leu Ile Asp Ser Glu Ile Gln Lys Gln Leu Asn Lys Ala Leu Leu Asp
115 120 125
Ala Asp Arg Asn Glu Trp Ser Ser Tyr Leu Glu Ser Ile Phe Asp Ser
130 135 140
Ser Asn Asn Leu Asn Gly Ala Ile Val Asp Ala Gln Trp Ser Gly Thr
145 150 155 160
Val Asn Thr Thr Asn Arg Thr Leu Arg Asn Pro Thr Glu Ser Asp Tyr
165 170 175
Thr Asn Val Val Thr Asn Phe Ile Ala Ala Asp Gly Asp Ile Ala Asn
180 185 190
Asn Glu Asn His Ile Met Asn Gly Asn Phe Asp Val Ala Ala Ala Pro
195 200 205
Tyr Phe Val Ile Gly Ala Thr Ala Arg Phe Ala Ala Met Gln Ser Tyr
210 215 220
Ile Lys Phe Cys Asn Ala Trp Ile Asp Lys Val Gly Leu Ser Asp Ala
225 230 235 240
Gln Leu Thr Thr Gln Lys Ala Asn Leu Asp Arg Thr Lys Gln Asn Met
245 250 255
Arg Asn Ala Ile Leu Asn Tyr Thr Gln Gln Val Met Lys Val Phe Lys
260 265 270
Asp Ser Lys Asn Met Pro Thr Ile Gly Thr Asn Lys Phe Ser Val Asp
275 280 285
Thr Tyr Asn Val Tyr Ile Lys Gly Met Thr Leu Asn Val Leu Asp Ile
290 295 300
Val Ala Ile Trp Pro Ser Leu Tyr Pro Asp Asp Tyr Thr Ser Gln Thr
305 310 315 320
Ala Leu Glu Gln Thr Arg Val Thr Phe Ser Asn Met Val Gly Gln Glu
325 330 335
Glu Gly Thr Asp Gly Ser Leu Arg Ile Tyr Asn Thr Phe Asp Ser Phe
340 345 350
Ser Tyr Gln His Ser Pro Ile Pro Asn Asn Asn Val Asn Leu Ile Ser
355 360 365
Tyr Tyr Asn Asp Glu Leu Gln Asn Leu Glu Leu Gly Val Tyr Thr Pro
370 375 380
Pro Lys Lys Gly Ser Gly Tyr Ser Tyr Pro Tyr Gly Phe Val Leu Asn
385 390 395 400
Tyr Ala Asn Ser Lys Tyr Lys Tyr Gly Asp Ser Asn Asp Pro Glu Ser
405 410 415
Leu Gly Gly Leu Ser Thr Leu Ser Ala Pro Ile Gln Gln Val Asn Ala
420 425 430
Ala Thr Gln Asn Ser Lys Tyr Leu Asp Gly Glu Ile Leu Asn Gly Ile
435 440 445
Gly Ala Ser Leu Pro Gly Tyr Cys Thr Thr Gly Cys Ser Pro Thr Glu
450 455 460
Pro Pro Phe Ser Cys Thr Ser Thr Ala Asn Gly Tyr Lys Ala Ser Cys
465 470 475 480
Asn Pro Ser Asp Thr Asn Gln Lys Ile Asn Ala Leu Tyr Pro Phe Thr
485 490 495
Gln Ala Asn Val Lys Gly Asn Thr Gly Lys Leu Gly Val Leu Ala Ser
500 505 510
Leu Val Ser Tyr Asp Leu Asn Pro Lys Asn Val Phe Gly Glu Leu Asp
515 520 525
Ser Asp Thr Asn Asn Val Ile Leu Lys Gly Ile Pro Ala Glu Lys Gly
530 535 540
Tyr Phe Pro Asn Asn Ala Arg Pro Thr Val Val Lys Glu Trp Ile Asn
545 550 555 560
Gly Ala Ser Ala Val Pro Leu Asp Ser Gly Asn Thr Leu Phe Met Thr
565 570 575
Ala Thr Asn Leu Thr Ala Thr Gln Tyr Arg Ile Arg Ile Arg Tyr Ala
580 585 590
Asn Pro Asn Ser Asn Thr Gln Ile Gly Val Arg Ile Thr Gln Asn Gly
595 600 605
Ser Leu Ile Ser Ser Ser Asn Leu Thr Leu Tyr Ser Thr Thr Asp Met
610 615 620
Asn Asn Thr Leu Pro Leu Asn Val Tyr Val Ile Gly Glu Asn Gly Asn
625 630 635 640
Tyr Thr Leu Gln Asp Leu Tyr Asn Thr Thr Asn Val Leu Ser Thr Gly
645 650 655
Asp Ile Thr Leu Gln Ile Thr Gly Gly Asp Gln Lys Ile Phe Ile Asp
660 665 670
Arg Ile Glu Phe Val Pro Thr Met Pro Val Pro Gly Asn Thr Asn Asn
675 680 685
Asn Asn Gly Asn Asn Asn Gly Asn Asn Asn Pro Pro His His Val Cys
690 695 700
Ala Ile Ala Gly Thr Gln Gln Ser Cys Ser Gly Pro Pro Lys Phe Glu
705 710 715 720
Gln Val Ser Asp Leu Glu Lys Ile Thr Thr Gln Val Tyr Met Leu Phe
725 730 735
Lys Ser Ser Pro Tyr Glu Glu Leu Ala Leu Glu Val Ser Ser Tyr Gln
740 745 750
Ile Ser Gln Val Ala Leu Lys Val Met Ala Leu Ser Asp Glu Leu Phe
755 760 765
Cys Glu Glu Lys Asn Val Leu Arg Lys Leu Val Asn Lys Ala Lys Gln
770 775 780
Leu Leu Glu Ala Ser Asn Leu Leu Val Gly Gly Asn Phe Glu Thr Thr
785 790 795 800
Gln Asn Trp Val Leu Gly Thr Asn Ala Tyr Ile Asn Tyr Asp Ser Phe
805 810 815
Leu Phe Asn Gly Asn Tyr Leu Ser Leu Gln Pro Ala Ser Gly Phe Phe
820 825 830
Thr Ser Tyr Ala Tyr Gln Lys Ile Asp Glu Ser Thr Leu Lys Pro Tyr
835 840 845
Thr Arg Tyr Lys Val Ser Gly Phe Ile Gly Gln Ser Asn Gln Val Glu
850 855 860
Leu Ile Ile Ser Arg Tyr Gly Lys Glu Ile Asp Lys Ile Leu Asn Val
865 870 875 880
Pro Tyr Ala Gly Pro Leu Pro Ile Thr Ala Asp Ala Ser Ile Thr Cys
885 890 895
Cys Ala Pro Glu Ile Gly Gln Cys Asp Gly Glu Gln Ser Asp Ser His
900 905 910
Phe Phe Asn Tyr Ser Ile Asp Val Gly Ala Leu His Pro Glu Leu Asn
915 920 925
Pro Gly Ile Glu Ile Gly Leu Lys Ile Val Gln Ser Asn Gly Tyr Ile
930 935 940
Thr Ile Ser Asn Leu Glu Ile Ile Glu Glu Arg Pro Leu Thr Glu Met
945 950 955 960
Glu Ile Gln Ala Val Asn Arg Lys Asn Gln Lys Trp Glu Arg Glu Lys
965 970 975
Leu Leu Glu Cys Ala Ser Ile Ser Glu Leu Leu Gln Pro Ile Ile Asn
980 985 990
Gln Ile Asp Ser Leu Phe Lys AspGly Asn Trp Tyr AsnAsp Ile Leu
995 1000 1005
Pro HisVal Thr Tyr Gln AspLeu Lys Asn Ile IleIle Pro Glu
1010 1015 1020
Leu ProLys Leu Lys His TrpPhe Ile Glu Asn LeuPro Gly Glu
1025 1030 1035
Tyr HisGlu Ile Glu Gln LysMet Lys Glu Ala LeuLys Tyr Ala
1040 1045 1050
Phe ThrGln Leu Asp Glu LysAsn Leu Ile His AsnGly His Phe
1055 1060 1065
Thr ThrAsn Leu Ile Asp TrpGln Val Glu Gly AspAla Gln Met
1070 1075 1080
Lys ValLeu Glu Asn Asp AlaLeu Ala Leu Gln LeuPhe Asn Trp
1085 1090 1095
Asp AlaSer Ala Ser Gln SerIle Asn Ile Leu GluPhe Asp Glu
1100 1105 1110
Asp LysAla Tyr Lys Leu ArgVal Tyr Ala Gln GlySer Gly Thr
1115 1120 1125
Ile GlnPhe Gly Asn Cys GluAsp Glu Ala Ile GlnPhe Asn Thr
1130 1135 1140
Asn SerPhe Ile Tyr Gln GluLys Ile Val Tyr PheAsp Thr Pro
1145 1150 1155
Ser ValAsn Leu His Ile GlnSer Glu Gly Ser GluPhe Ile Val
1160 1165 1170
Ser SerIle Asp Leu Ile GluLeu Ser Asp Asp Gln
1175 1180 1185
<210>2
<211>3558
<212>DNA
<213>人工序列
<220>
<223>合成
<220>
<221>尚未归类的特征
<223>Cry14Ab1核苷酸序列
<400>2
atggattgca accttcagtc ccagcagaac attccataca acgtgctcgc tattccagtt60
tctaacgtga actcccttac tgataccgtg ggtgatctta agaaggcttg ggaagagttc 120
caaaagaccg gatctttctc tcttactgct ctccaacagg gattctctgc ttctcaaggt 180
ggaaccttca actaccttac ccttctccag tctggaattt ctcttgctgg atccttcgtt 240
ccaggtggaa ctttcgtggc tccaatcatc aacatggtga ttggatggct ttggccacac 300
aagaacaaga acgctgatac cgagaacctc attaacctca tcgattccga gattcagaag 360
cagcttaaca aggctcttct cgatgctgat aggaacgagt ggtcctctta ccttgagtcc 420
atcttcgatt cctccaacaa cctcaacggt gctattgtgg atgctcagtg gagtggaact 480
gttaacacta ccaacaggac ccttagaaac ccaaccgagt ccgattacac caacgttgtg 540
accaacttca ttgctgctga tggcgatatt gccaacaacg agaaccacat catgaacgga 600
aacttcgatg ttgctgctgc tccatacttc gttattggag ctaccgctag attcgctgct 660
atgcaatcct acatcaagtt ctgcaacgct tggattgaca aagtgggact ttccgatgct 720
caacttacta cccagaaggc taaccttgat aggaccaagc agaacatgag gaacgctatc 780
cttaactaca cccagcaggt tatgaaggtg ttcaaggact ccaagaacat gccaaccatt 840
ggcaccaaca agttctctgt ggacacctac aacgtgtaca tcaagggcat gaccttgaac 900
gtgctcgata ttgtggctat ttggccatcc ctttacccag atgattacac ctctcagact 960
gctcttgagc aaactagggt gaccttctct aacatggtgg gtcaagaaga aggtactgac1020
ggatctctca ggatctacaa caccttcgac tcattctctt accagcactc cccaatccca1080
aacaacaacg tgaacctcat ctcctactac aacgacgagc ttcagaacct tgagcttgga1140
gtttacaccc caccaaagaa gggatctgga tactcttacc catacggctt cgtgcttaac1200
tacgccaact ccaagtacaa gtacggcgat tctaacgatc cagagtctct tggaggactt1260
tctacccttt ccgctccaat tcaacaggtt aacgctgcta cccagaactc taagtacctc1320
gatggcgaga ttcttaacgg aattggagct tcccttccag gatattgcac tactggatgc1380
tctccaactg aaccaccatt ctcttgcact tctaccgcta acggatacaa ggcttcttgc1440
aacccatctg acaccaacca gaagatcaac gctctttacc cattcactca ggctaacgtg1500
aagggaaaca ccggaaagct tggagttctt gcttctctcg tgtcctacga tctcaaccca1560
aagaacgtgt tcggagagct tgattccgat accaacaacg tgattctcaa gggaattcca1620
gctgagaagg gctatttccc aaacaacgct aggccaaccg ttgtgaaaga gtggattaac1680
ggcgcttctg ctgttccact tgattctggc aacacccttt tcatgaccgc tactaacctt1740
actgctaccc agtacaggat taggatcaga tacgccaacc caaactccaa cacccaaatc1800
ggagttagga ttacccagaa cggatccctt atttcttctt ccaacctcac cctttactct1860
accaccgaca tgaacaacac ccttccactt aacgtgtacg tgattggaga gaacggaaac1920
tacacccttc aggaccttta caacaccacc aacgtgcttt ctaccggtga tattaccctc1980
caaatcaccg gtggagatca gaagattttc atcgacagga tcgagttcgt tccaactatg2040
ccagttccag gcaacactaa caacaacaac ggaaacaaca atggcaacaa taacccacca2100
catcatgtgt gtgctattgc tggaactcag cagtcttgtt ctggaccacc aaagttcgag2160
caagtgtccg atcttgagaa gattaccacc caggtgtaca tgcttttcaa gtcctcccca2220
tacgaagaac ttgctcttga ggtgtcctct taccagattt cccaagtggc tcttaaggtg2280
atggctctct ccgatgaact tttctgcgaa gagaagaacg tgcttaggaa gcttgtgaac2340
aaggccaagc aacttcttga ggcttccaac cttcttgttg gaggcaactt cgagactact2400
cagaactggg tgttgggaac taacgcctac atcaactacg attccttcct cttcaacggt2460
aactaccttt ctcttcagcc agcttctgga ttcttcacct cctacgccta ccaaaagatt2520
gatgagtcca cccttaagcc atacaccagg tacaaggtgt caggattcat tggacagtct2580
aaccaggtgg agcttatcat ttccagatac ggcaaagaga tcgacaagat cctcaacgtt2640
ccatatgctg gaccacttcc aattaccgct gatgcttcca ttacttgctg cgctccagaa2700
attggacaat gcgacggcga acagtctgat tctcacttct tcaactactc catcgatgtg2760
ggtgctcttc atccagaact caacccagga attgagatcg gactcaagat cgttcagtcc2820
aacggttaca tcaccatttc caacctcgag atcattgagg aaaggccact taccgagatg2880
gaaatccagg ctgtgaatag gaagaaccag aagtgggaga gggaaaagct tcttgagtgc2940
gcttctattt ctgagcttct ccagcctatc atcaaccaga ttgactccct cttcaaggat3000
ggaaactggt acaacgatat ccttccacat gtgacctacc aggacctcaa gaacattatc3060
atcccagagc ttccaaagct taagcactgg ttcattgaga acttgcctgg tgagtaccat3120
gagatcgagc agaagatgaa ggaagctctc aagtacgctt tcacccagct tgatgagaag3180
aacctcattc acaacggaca tttcaccacc aacctcattg attggcaagt tgagggtgat3240
gctcagatga aggtgttgga gaacgatgct cttgctcttc agctcttcaa ctgggatgct3300
tctgcttccc agtccattaa catcctcgag ttcgatgagg ataaggctta caagcttagg3360
gtttacgctc aaggatctgg aactatccag ttcggaaact gcgaagatga ggccattcag3420
ttcaacacca acagcttcat ctaccaagag aagatcgtgt acttcgatac cccatctgtg3480
aaccttcaca ttcagtctga gggatccgag ttcattgtgt cctccatcga tctcattgag3540
ctttccgacg accagtga3558
- 象耳豆根结线虫MSP19蛋白及其编码基因以及它们作为靶标在抑制线虫中的应用
- 象耳豆根结线虫MSP19蛋白及其编码基因以及它们作为靶标在抑制线虫中的应用
