自发性早期肺癌小鼠模型及其构建方法和应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于动物模型构建技术领域,具体涉及自发性早期肺癌小鼠模型及其构建方法和应用。
背景技术
肺癌是恶性程度最高的肿瘤之一,在世界范围内发病率和死亡率均居高不下,严重危害人们的生命与健康,五年生存率仅为15%,早期发现早期治疗是提高肺癌患者生存率的重要手段。肺癌的发生是经历早期的非典型增生,原位癌到浸润癌的复杂过程,但是其发生发展的机制尚不明确。因此,深入探索肺癌发生的病理机制,是防治肺癌恶性进程、提高肺癌患者生存率所亟需解决的关键问题。
G蛋白及其配体组成的GPCR超家族可激活PI3K、MAPK及离子通道等多种二级信号通路,参与调控一系列的细胞生物学行为,在多种肿瘤的发生中发挥重要作用,GPCR及其下游信号通路的异常表达和活化已被证明是肿瘤恶性进程的重要标志。近年来许多研究对肺部自发性肿瘤的模型进行了探,但多为浸润性癌模型。腺病毒诱导的条件性肺部Kras G12D的突变可以诱导早期肺癌非典型腺瘤样增生,但是常同时伴有乳头状腺瘤的存在,而在人体肿瘤常很少同时发生乳头状腺瘤,而且肿瘤的形成和发展程度受到腺病毒数量的影响。因此探索一种可以短时间内自发发生早期肺癌的动物模型,对深入研究肺癌从早期的非典型增生至如何逐步发展成浸润性癌的机制,从而寻找肺癌早期诊断的标志物及重要的治疗靶点非常关键。因此,亟需找到一种能够短期构建发生早期肺癌小鼠的方法,方便科研人员的对肺癌发生发展机制及药物开发靶点的研究探索。
发明内容
本发明的目的在于提供自发性早期肺癌小鼠模型及其构建方法和应用,所述自发性早期肺癌小鼠模型可短期内诱发早期肺癌发生,大大拓展了肺部肿瘤科研可利用模型的广度,也节约了科研工作的时间和成本。
本发明提供了一种自发性早期肺癌小鼠模型的构建方法,包括以下步骤:将条件性过表达GNGT1的小鼠与肺部特异性打靶的Scgb1a1-Cre工具鼠进行杂交,F
优选的,所述条件性过表达GNGT1的小鼠的构建方法,包括将包含过表达GNGT1基因的表达框插入到C57BL/6J小鼠6号染色体的Rosa26基因位点处,得所述条件性过表达GNGT1的小鼠。
优选的,所述表达框的结构包括CAG-loxp-stop-loxp-Gngt1-WPRE-pA。
优选的,肺部特异性打靶的Scgb1a1-Cre工具鼠的构建方法,包括在Scgb1a1基因终止密码子位点后定点敲入IRES-Cre表达框。
优选的,所述杂交,包括以条件性过表达GNGT1的小鼠为母本,以肺部特异性打靶的Scgb1a1-Cre工具鼠为父本。
优选的,所述杂交后,还包括对杂交后F1代进行筛选,筛选LSL-GNGT1和Scgb1a1-IRES-Cre双杂合基因型小鼠;
所述LSL-GNGT1杂合,包括利用核苷酸序列如SEQ ID No.10和SEQ ID No.11所示的引物对,以及SEQ ID No.12和SEQ ID No.13所示的引物对均能扩增出条带;
所述Scgb1a1-IRES-Cre杂合,包括利用核苷酸序列如SEQ ID No.18和SEQ IDNo.19所示的引物对,以及SEQ ID No.20和SEQ ID No.21所示的引物对均能扩增出条带。
优选的,所述自发性早期肺癌小鼠模型产生肺部上皮非典型增生的时间小于30d。
本发明还提供利用上述构建方法构建得到的自发性早期肺癌小鼠模型在以下任一用途中的应用;
(1)研究肺癌发生和发展过程;
(2)研究肺癌致病机理;
(3)制备肺癌的早期检测和/或诊断工具;
(4)研制针对肺癌的药物;
(5)筛选对肺癌有效的药物。
有益效果:本发明提供了一种自发性早期肺癌小鼠模型的构建方法,包括以下步骤:将条件性过表达GNGT1的小鼠与肺部特异性打靶的Scgb1a1-Cre工具鼠进行杂交,F
附图说明
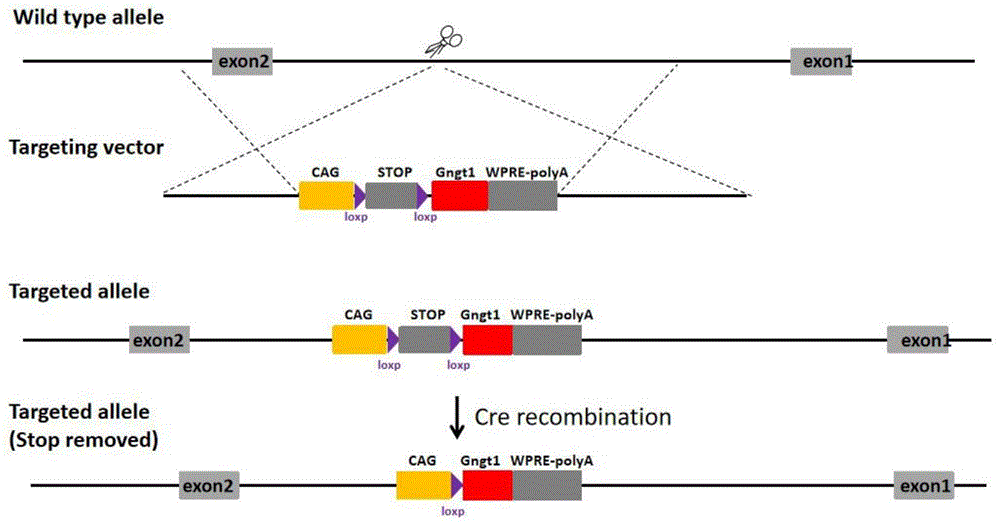
图1为C57BL/6J-LSL-GNGT1条件性过表达小鼠的基因编辑区域示意图;
Wild type allele:野生型等位基因;gRNAregion:引导RNA(guide RNA,简称
gRNA)剪切区域;targeting vector:目标载体;targeted allele:被靶向的等位基因;targeted allele(Stop removed):过表达重组后(Cre recombination)的等位基因;
图2为实施例1中为体外转录载体示意图;R26-LSL-GNGT1 DonorVector(GNGT1).Seq:R26-LSL-GNGT1敲入载体序列;bp:碱基;5’arm:5’长末端重复序列;3’arm:3’长末端重复序列;Bgh-polyA:哺乳动物终止密码子Bgh多聚腺苷酸尾;cRosa-5t-r和cRosa-3t-f:小鼠6号染色体上由三个外显子构成的非编码基因安全位点;WPRE:土拨鼠肝炎病毒转录后调节元件;Xhol,BgIII:酶切位点;kozak:3’kozak序列;CAG-enhancer:CAG增强子区;loxP:loxP插入位点;
图3~4为实施例1中F
图5~6为实施例1中F
图7~8为实施例1中F
图9为Scgb1a1-e(IRES-Cre)1肺部特异性打靶工具小鼠的基因编辑区域示意图;Wild type allele:野生型等位基因;targeting vector:靶向载体;targeted allele:被靶向的等位基因;3‘UTR:3‘非编码区;homology arm:同源重组臂,coding region:编码区;uncoding region:非编码区;
图10为实施例2中体外转录载体示意图;Amp:氨苄霉素抗性区;5’arm:5’长末端重复序列;3’arm:3’长末端重复序列;EcoRV:EcoRV限制性内切酶;Scgb1a1-e(IRES-Cre)1DonorVector sequence:Scgb1a1-e(IRES-Cre)1敲入载体序列;
图11~12为实施例2中F
图13为实施例2中F
图14~15为实施例2中F
图16~17为实施例3中小鼠基因型鉴定结果示意图;
图18为实施例3中获得的早期肺癌小鼠模型组织示意图;
图19为实施例3中获得的早期肺癌小鼠模型组织示意图。
具体实施方式
本发明提供了一种一种自发性早期肺癌小鼠模型的构建方法,包括以下步骤:将条件性过表达GNGT1的小鼠与肺部特异性打靶的Scgb1a1-Cre工具鼠进行杂交,F
本发明所述条件性过表达GNGT1的小鼠的构建方法,优选包括将包含过表达GNGT1基因的表达框插入到C57BL/6J小鼠6号染色体的Rosa26基因位点处,得所述条件性过表达GNGT1的小鼠。本发明所述表达框的结构包括CAG-loxp-stop-loxp-Gngt1-WPRE-pA,且所述表达框中Gngt1的核苷酸序列优选如NCBI数据库中NM_010314.3所示,利用所述方法构建得到的条件性过表达GNGT1的小鼠C57BL/6J-GNGT1条件性过表达小鼠(简称LSL-GNGT1)。本发明对C57BL/6J品系鼠的来源没有特殊限定,常规购买得到即可。本发明所述LSL-GNGT1优选购自上海南方模式生物科技股份有限公司,项目编号N1-6336,具体设计策略如图1所示。
本发明所述肺部特异性打靶的Scgb1a1-Cre工具鼠的构建方法,优选包括在Scgb1a1基因终止密码子位点后定点敲入IRES-Cre表达框。本发明所述肺部特异性打靶的Scgb1a1-Cre工具鼠(Scgb1a1-IRES-Cre),优选购自上海南方模式生物科技股份有限公司,货号为NM-KI-210120,具体设计策略如图9所示。
本发明所述杂交,优选包括以条件性过表达GNGT1的小鼠为母本,以肺部特异性打靶的Scgb1a1-Cre工具鼠为父本。本发明在所述杂交后,优选还包括对杂交后F
GNGT1正向引物P1(SEQ ID No.10):5’-TCAGATTCTTTTATAGGGGACACA-3’;
GNGT1反向引物P2(SEQ ID No.11):5’-TAAAGGCCACTCAATGCTCACTAA-3’;
GNGT1正向引物P3(SEQ ID No.12):5’-AGGAACTCAAAGGAGGCTGTG-3’;
GNGT1反向引物P4(SEQ ID No.13):5’-AAGGAAGGTCCGCTGGATTG-3’。本发明利用上述GNGT1的两对引物(P1和P2,P3和P4)进行扩增时,基因型判读方法优选为:
野生型:只有(P1,P2)扩增出967bp条带,(P3,P4)无条带;
杂合子:(P1,P2)扩增出967bp条带,(P3,P4)也扩增出条带568bp;
纯合子:(P1,P2)无条带,(P3,P4)可扩增出条带568bp。
本发明所述Scgb1a1-IRES-Cre杂合,优选包括利用核苷酸序列如SEQ ID No.18和SEQ ID No.19所示的引物对,以及SEQ ID No.20和SEQ ID No.21所示的引物对均能扩增出条带。
IRES-Cre正向引物P1(SEQ ID No.18):5’-GGTCTTCAGTCCCCTTCAGC-3’;
IRES-Cre反向引物P2(SEQ ID No.19):5’-ACTCACTCCAGCTCCAATGC-3’;
IRES-Cre正向引物P3(SEQ ID No.20):5’-GGTCTTCAGTCCCCTTCAGC-3’;
IRES-Cre反向引物P4(SEQ ID No.21):5’-AGACCCCTAGGAATGCTCGT-3’。本发明利用上述两对引物(IRES-Cre P1和IRES-Cre P2,IRES-Cre P3和IRES-Cre P4)进行扩增验证时,基因型判读方法优选包括:
野生型:只有(P1,P2)扩增出672bp条带,(P3,P4)无条带;
杂合子:(P1,P2)扩增出672bp条带,(P3,P4)也扩增出条带647bp;
纯合子:(P1,P2)无条带,(P3,P4)可扩增出条带647bp。
本发明所述自发性早期肺癌小鼠模型产生肺部上皮非典型增生的时间小于30d。
本发明还提供了利用上述构建方法构建得到的自发性早期肺癌小鼠模型,且述自发性早期肺癌小鼠模型的中位发病时间小于30d。本发明所述自发性早期肺癌优选包括肺早期鳞状细胞癌合并早期腺癌。
本发明还提供利用上述构建方法构建得到的自发性早期肺癌小鼠模型在以下任一用途中的应用;
(1)研究肺癌发生和发展过程;
(2)研究肺癌致病机理;
(3)制备肺癌的早期检测和/或诊断工具;
(4)研制针对肺癌的药物;
(5)筛选对肺癌有效的药物。
为了进一步说明本发明,下面结合实施例对本发明提供的自发性早期肺癌小鼠模型及其构建方法和应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例1
1、条件性GNGT1过表达的小鼠的构建:
C57BL/6J-GNGT1条件性过表达小鼠(LSL-GNGT1),购自上海南方模式生物科技股份有限公司,具体设计策略如图1所示。该公司提供的构建过程包括:
通过体外转录的方式,获得Cas9 mRNA和gRNA(具体序列为5’-GGGGACACACTAAGGGAGCTTGG-3’,SEQ ID NO.1);通过In-Fusion cloning的方法构建同源重组载体(donorvector),该载体包含3.3kb 5’同源臂、CAG-loxp-stop-loxp-Gngt1-WPRE-pA和3.3kb 3’同源臂,该载体中各部分除目标基因外的序列外,其余部分的结构和序列均来源于南方模式生物公司,与该公司所售其他材料中所用序列一致,具体参考文献:Liu Y,Xun Z,Ma K,et al.Identification of a tumour immune barrier in the HCCmicroenvironment that determines the efficacy of immunotherapy.JHepatol.2023;78(4):770-782.doi:10.1016/j.jhep.2023.01.011如图2所示。
将Cas9 mRNA、gRNA和donorvector显微注射到C57BL/6J小鼠的受精卵中,获得F
PCR扩增体系为:DNA模板1μL、GNGT1正向引物0.3μL、GNGT1反向引0.3μL、KOD-Multi&Epi(TOYOBO,Code No:KME-101)0.35μL、2×PCRBuffer10μL,ddH
所述5’臂同源重组阳性基因组应扩增GNGT1正向引物的核苷酸序列如SEQ IDNO.2所示,具体为:5’-GGCGGGAGGTAGGTGGGGTGAGG-3’;
所述5’臂同源重组阳性基因组应扩增GNGT1GNGT1反向引物的核苷酸序列如SEQID NO.3所示,具体为:5’-TGAGGGCAATCTGGGAAGGTT-3’;
所述3’臂同源重组阳性基因组应扩增GNGT1正向引物的核苷酸序列如SEQ IDNO.4所示,具体为:5’-GGGGGAGGGGAGTGTTGC-3’;
所述3’臂同源重组阳性基因组应扩增GNGT1反向引物的核苷酸序列如SEQ IDNO.5所示,具体为:5’-TTCTTCCTGCCTGCCTTCTGTGAC-3;
PCR扩增程序为:94℃预变性3min;98℃变性20s,61℃退火30s,68℃延伸3min,35个循环;68℃保持5min,然后置于12℃保存待检测。
预期结果为:5’臂同源重组阳性基因组应扩增出3.6kb片段,阴性基因组应扩增出5.2kb片段;3’臂同源重组阳性基因组应扩增出3.6kb片段,阴性基因组应扩增出6.5kb片段。如图4所示。
根据上述PCR检测得到GNGT1基因敲入的F
2、F
取步骤1得到的F
PCR扩增体系为:DNA模板1μL、GNGT1正向引物0.3μL、GNGT1反向引0.3μL、KOD-Multi&Epi(TOYOBO,Code No:KME-101)0.35μL、2xPCRBuffer10μL,ddH
所述5’臂同源重组阳性基因组应扩增GNGT1正向引物的核苷酸序列如SEQ IDNO.6所示,具体为:5’-TTATGGAGGGGAGGACTGGG-3’;
所述5’臂同源重组阳性基因组应扩增GNGT1GNGT1反向引物的核苷酸序列如SEQID NO.7所示,具体为:5’-TGAGGGCAATCTGGGAAGGTT-3’;
所述3’臂同源重组阳性基因组应扩增GNGT1正向引物的核苷酸序列如SEQ IDNO.8所示,具体为:5’-GGGGGAGGGGAGTGTTGC-3’;
所述3’臂同源重组阳性基因组应扩增GNGT1反向引物的核苷酸序列如SEQ IDNO.9所示,具体为:5’-TTCTTCCTGCCTGCCTTCTGTGAC-3’;
PCR扩增程序为:94℃预变性3min;98℃变性20s,61℃退火20s,68℃延伸3min,35个循环;68℃保持5min,然后置于12℃保存待检测。
预期结果为:5’臂同源重组阳性基因组应扩增出5.0kb片段,阴性基因组应扩增出6.6kb片段;3’臂同源重组阳性基因组应扩增出3.6kb片段,阴性基因组应扩增出6.5kb片段。如图6所示。在后续小鼠交配繁殖过程中,可通过短片段PCR的方式对小鼠基因型进行鉴定。
所述短片段PCR小鼠基因型鉴定的方法如下:小鼠出生后14天编号并剪鼠尾,鼠尾要求长度为0.5cm,鼠尾可存放至-20℃冰箱保存备用。
试剂:
鼠尾裂解液:1M Tris HCL(pH=8.0)10ml,0.5M EDTA4ml,1MNaCl 400ml,10%SDS100ml,超纯水486ml。
蛋白酶K溶液(PK):20mg/ml,-20℃储藏;
TE缓冲液:1M Tris HCL(PH=8.0)5ml,0.5M EDTA 1ml,超纯水494ml。
实验流程:
鼠尾样品中分别加入300μl裂解液和5μl PK,55℃消化过夜。消化过夜后,向消化后的样品中各加入600μl-20℃预冷的无水乙醇,上下颠倒,直到可以清楚的看见絮状沉淀,停止颠倒,在12000rpm下离心5min。
离心后,倒出上层液体,将离心管垂直倒放在一张平板纸上,维持10min后,将立着的管子换一个位置,向下轻按,等待至完全晾干,此时沉淀变透明,提取的DNA质量佳。
向离心管中加入200μl TE缓冲液,使用上下振摇的方式充分溶解DNA,得到DNA模板;取3μl DNA模板,在25μl的反应体系中进行PCR。
PCR扩增体系为:DNA模板3μL、正向引物F 0.5μL、反向引物R 0.5μL、Taq酶及反应物预混液12.5μL,ddH
GNGT1正向引物P1的核苷酸序列如SEQ ID No.10所示,具体为:5’-TCAGATTCTTTTATAGGGGACACA-3’;
GNGT1反向引物P2的核苷酸序列如SEQ ID No.11所示,具体为:5’-TAAAGGCCACTCAATGCTCACTAA-3’;
GNGT1正向引物P3的核苷酸序列如SEQ ID No.12所示,具体为:5’-AGGAACTCAAAGGAGGCTGTG-3’;
GNGT1反向引物P4的核苷酸序列如SEQ ID No.13所示,具体为:5’-AAGGAAGGTCCGCTGGATTG-3’。具体引物鉴定示意图如图7所示。
PCR扩增程序为:95℃预变性3min;95℃变性15s,60℃退火30s,72℃延伸1min,35个循环;72℃保持5min,然后置于12℃保存待检测;
电泳:根据目标条带配置1%的琼脂糖凝胶,将1g琼脂糖溶于100ml TAE缓冲液,微波炉加热至琼脂糖融化,加入10μl核酸染料(EB替代物),倒入电泳模板中,并插入梳子,待冷凝后使用;向琼脂糖凝胶中加入适量的DNA,小孔加10μl,大孔加20μl,并根据目标条带大小选择合适DNAmarker加入凝胶中。于120V电压,跑胶后,使用凝胶成像系统观察、拍摄照片,得到基因型鉴定结果报告,如图8所示。具体基因型判读方法为
野生型:只有(P1,P2)扩增出967bp条带,(P3,P4)无条带;
杂合子:(P1,P2)扩增出967bp条带,(P3,P4)也扩增出条带568bp;
纯合子:(P1,P2)无条带,(P3,P4)可扩增出条带568bp。
实施例2
1、肺部特异性打靶的Scgb1a1-Cre工具鼠的构建
肺部特异性打靶的Scgb1a1-Cre工具鼠(Scgb1a1-IRES-Cre),购自上海南方模式生物科技股份有限公司,货号为NM-KI-210120,具体设计策略如图9所示。该公司提供的构建过程包括:通过体外转录的方式,获得Cas9 mRNA和gRNA;通过In-Fusion cloning的方法构建同源重组载体(donorvector),该载体包含3.0kb 5’同源臂、IRES-Cre和3.0kb 3’同源臂。如图10所示。
将Cas9 mRNA、gRNA和donorvector显微注射到C57BL/6J小鼠的受精卵中,获得F
PCR扩增体系为:DNA模板1μL、正向引物0.5μL、反向引物0.5μL、2.5mM dNTP 2μL、GXL DNAPolymerase 0.8μL、GXL PCR Buffer 2μL,ddH
所述5’臂同源重组阳性基因组扩增IRES-Cre正向引物的核苷酸序列如SEQ IDNO.14所示,具体为:5’-TAAGATGCTAAGAGATTTTGATACAGTCAC-3’;
所述5’臂同源重组阳性基因组扩增IRES-Cre反向引物的核苷酸序列如SEQ IDNO.15所示,具体为:5’-ACGGCAATATGGTGGAAAATAACATATAGA-3’;
所述3’臂同源重组阳性基因组扩增IRES-Cre正向引物的核苷酸序列如SEQ IDNO.16所示,具体为:5’-ACAACCATGGTGCCCAAGAA-3’;
所述3’臂同源重组阳性基因组扩增IRES-Cre反向引物的核苷酸序列如SEQ IDNO.17所示,具体为:5’-TCCCCAGGTTCCTCAGAGTT-3’;
PCR扩增程序为:94℃预变性3min;98℃变性15s,63℃退火15s,68℃延伸3min,35个循环;68℃保持5min,然后置于12℃保存待检测。
预期结果为:5’臂同源重组阳性基因组应扩增出3.9kb片段,阴性基因组无片段;3’臂同源重组阳性基因组应扩增出4.4kb片段,阴性基因组无片段。如图12所示。
根据上述PCR检测得到IRES-Cre基因敲入的F
2、取步骤1得到的F
预期结果为:5’臂同源重组阳性基因组应扩增出3.9kb片段,阴性基因组无片段;3’臂同源重组阳性基因组应扩增出4.4kb片段,阴性基因组无片段。如图13所示。
后续获得F
PCR扩增体系为:DNA模板3μL、正向引物F 0.5μL、反向引物R 0.5μL、Taq酶及反应物预混液12.5μL,ddH
IRES-Cre正向引物P1的核苷酸序列如SEQ ID No.18所示,具体为:5’-GGTCTTCAGTCCCCTTCAGC-3’;
IRES-Cre反向引物P2的核苷酸序列如SEQ ID No.19所示,具体为:5’-ACTCACTCCAGCTCCAATGC-3’;
IRES-Cre正向引物P3的核苷酸序列如SEQ ID No.20所示,具体为:5’-GGTCTTCAGTCCCCTTCAGC-3’;
IRES-Cre反向引物P4的核苷酸序列如SEQ ID No.21所示,具体为:5’-AGACCCCTAGGAATGCTCGT-3’。具体引物鉴定示意图如图14所示。
PCR扩增程序为:94℃预变性5min;94℃变性30s,60℃退火30s,72℃延伸1min,35个循环;72℃保持5min,然后置于12℃保存待检测;
电泳:根据目标条带配置1%的琼脂糖凝胶,将1g琼脂糖溶于100ml TAE缓冲液,微波炉加热至琼脂糖融化,加入10μl核酸染料(EB替代物),倒入电泳模板中,并插入梳子,待冷凝后使用;向琼脂糖凝胶中加入适量的DNA,小孔加10μl,大孔加20μl,并根据目标条带大小选择合适DNAmarker加入凝胶中。于120V电压,跑胶后,使用凝胶成像系统观察、拍摄照片,得到基因型鉴定结果报告,如图15所示。具体基因型判读方法为:
野生型:只有(P1,P2)扩增出672bp条带,(P3,P4)无条带;
杂合子:(P1,P2)扩增出672bp条带,(P3,P4)也扩增出条带647bp;
纯合子:(P1,P2)无条带,(P3,P4)可扩增出条带647bp。
实施例3
取实施例1中得到的LSL-GNGT1雌性小鼠2只与实施例2中得到的Scgb1a1-IRES-Cre基因纯合雄性小鼠合笼交配3周后获得13只F1幼鼠,按照实施例1中的方法进行鼠尾鉴定,结果如图16~17所示。
由图16~17结果可知,其中LSL-GNGT1;Scgb1a1-IRES-Cre双杂合基因型小鼠4只,阳性率30.77%,理论阳性率50.00%。13只F1小鼠基因鉴定结果,9只呈Scgb1a1-IRES-Cre杂合阳性。其中LSL-GNGT1;Scgb1a1-IRES-Cre双杂合基因型小鼠即为本发明所述自发性早期肺癌小鼠模型,又称GNGT1-CRE小鼠。
实施例4
采用实施例1~3的方法另外构建了10只LSL-GNGT1;Scgb1a1-IRES-Cre双杂合基因型小鼠,经鼠尾鉴定基因型准确无误后,在SPF级动物房中进行常规饲养,4周龄内每周观察一次,4周龄后每两天观察一次小鼠健康状态,分别在4周龄,8周龄,12周龄,16周龄处死小鼠,将肺组织保存于福尔马林中后续进行石蜡包埋及切片,用于HE染色或免疫组化实验(如图18所示,4周龄小鼠早期肺癌病变组织学光镜图,左侧为肺泡上皮早期病变;右侧为支气管上皮早期病变)。
由图18可知,本发明构建的模型小鼠可以自发快速形成早期肺部肿瘤,本发明构建的模型小鼠形成的肺部肿瘤存在肺泡上皮和支气管上皮的早期病变。可代表在临床实践中遇到的肺癌最常见的两种病理类型,肺腺癌和肺鳞状细胞癌的前期病变,此小鼠模型的病理特征较为符合,因此该模型具有一定的临床代表性且适用于实验室研究。另外,该模型的构建为世界首例,此前未曾有研究报道。
对比例1
对实施例1中构建条件性过表达LSL-GNGT1杂合小鼠,实施例2中构建的Scgb1a1-Cre杂合小鼠,以野生型小鼠经实施例1中的鼠尾鉴定方式鉴定基因型准确无误后,在SPF级动物房中进行常规饲养,4周龄内每周观察一次,4周龄后每两天观察一次小鼠健康状态。分别在4周龄,8周龄,12周龄,16周龄处死小鼠,将肺组织保存于福尔马林中后续进行石蜡包埋及切片,用于HE染色或免疫组化实验,确定是否发生早期肺癌改变,几种小鼠均无早期肺癌的形态学特征,如图19所示。
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
