一种茄科植物生防菌及其培养方法
文献发布时间:2024-04-18 20:01:55
技术领域
本发明属于生物防治领域,具体涉及一种对茄科植物具有侵染和防治能力的生防真菌及其培养方法。
背景技术
外来生物入侵威胁农田环境生态安全、农业生产和人类健康,因此受到各国研究者的广泛关注。刺萼龙葵(Solanum rostratum)又称刺茄、黄花刺茄,是茄科茄属的一种有严重危害的恶性植物,在我国被列为具有较大入侵危险性的检疫植物。刺萼龙葵直根系,株高80cm以上,全株密被黄色长短不等的刺,刺长0.3~1.0cm,刺上有带柄的星状毛;叶片卵形或椭圆形,长6~18cm、宽4~9cm,不规则羽状深裂及部分裂片又羽状半裂,裂片椭圆形或近圆形,单叶互生,叶片正反面均有刺,叶柄长0.5~5.0cm;总状花序,花冠黄色,辐射对称。刺萼龙葵繁殖力高、适应性强,耐瘠薄、干旱,常生长于荒地、草原、河滩和过度放牧的牧场,也能侵入农田、果园中。自1981年首次在我国辽宁省朝阳县被发现,40多年来,在我国多地相继被发现,并且蔓延趋势仍在不断扩大。竞争能力强,可严重抑制其他植物生长,常形成大面积单一群落,破坏当地生物多样性。全株密被刺毛,可伤害家畜,影响放牧和羊毛产量。植株有毒,误食后可引起严重的肠炎和出血,果实含有神经毒素茄碱,可致牲畜死亡。同时,该种还是马铃薯甲虫和马铃薯卷叶病毒的野外寄主,造成了严重的经济损失和生态环境破坏。
目前针对刺萼龙葵的防治技术主要有人工及机械铲除、化学药剂防治和替代植物种植3种。机械铲除在生长初期,尤其在4片真叶前的幼苗期铲除,物理防治简单易行且对环境无污染,但消耗大量人力物力,并且刺萼龙葵生长速度极快,如待植株成熟,由于其全株具刺,会给铲除工作带来一定的难度。化学防治喷施化学农药,对刺萼龙葵的清除效果好、见效速度快,但易产生污染、残留以及存在抗药性等问题,不宜长期施用;替代控制可有效抑制刺萼龙葵的生长却无法彻底清除该杂草。
为实现该杂草的绿色防控,利用病原真菌研制微生物除草剂是必然选择,而病原真菌的侵染效果会受到环境的影响,故发酵条件就显得尤为重要。但目前,缺乏对刺萼龙葵生防菌发酵培养基以及发酵条件的研究,无法进一步研制和开发微生物除草剂。因此本研究对碳氮源、培养温度、pH值、培养时间等发酵过程中重要的控制参数开展研究,以期明确各因素与菌株发酵生产之间的关系,从而为菌剂的规模化生产提供理论依据。
发明内容
第一方面,本发明提供一种抑制茄科植物生长的除草剂,所述除草剂含有茄科植物生防菌和/或其发酵液,所述茄科植物生防菌包括链格孢菌、高粱附球菌、木贼镰刀菌、弯孢属菌C.hawaiiensis和/或稻黑孢霉菌。
进一步的,所述茄科植物包括但不限于喀西茄、雪山茄、疏刺茄、刺萼龙葵、龙葵、刺天茄中的一种或多种。
进一步的,所述茄科植物选自刺萼龙葵。
第二方面,本发明提供一种茄科植物生防菌发酵培养的培养基,所述培养基主要含有碳源和氮源,以及其他无机盐和水分。
进一步的,所述碳源选自麦芽糖、葡萄糖、可溶性淀粉、蔗糖、乳糖和甘油中的一种或多种。
进一步的,所述碳源选自乳糖和甘油。
进一步的,所述氮源选自蛋白胨、牛肉膏、酵母膏、硫酸铵、氯化铵和脲素中的一种或多种。
进一步的,所述氮源选自酵母和硫酸铵。
进一步的,所述碳源与氮源的比例为:1~3:1~3。
在本申请的一种实施方式中,本申请的生防菌选自链格孢菌,链格孢菌的液体发酵培养基中葡萄糖、乳糖、酵母、硫酸铵的比例为3:3:1:3;发酵的培养条件为:母液量为5%、摇瓶装量为15%、温度为30℃、初始pH值为6、培养6d。
在本申请的一种实施方式中,本申请的生防菌选自高粱附球菌,高粱附球菌的液体发酵培养基中麦芽糖、蔗糖、酵母、硫酸铵的比例为2:1:3:3;发酵的培养条件为:母液量为25%、摇瓶装量为25%、温度为20℃、初始pH值为7、培养8d。
在本申请的一种实施方式中,本申请的生防菌选自木贼镰刀菌,木贼镰刀菌的液体发酵培养基中麦芽糖、蔗糖、酵母、硫酸铵的比例为1:3:3:2;发酵的培养条件为:母液量为15%、摇瓶装量为15%、温度为20℃、初始pH值为5、培养4d。
在本申请的一种实施方式中,本申请的生防菌选自C.hawaiiensis,C.hawaiiensis的液体发酵培养基中可溶性淀粉、蔗糖、牛肉膏、蛋白胨的比例为2:2:1:2;发酵的培养条件为:母液量为25%、摇瓶装量为15%、温度为20℃、初始pH值为5、培养4d。
在本申请的一种实施方式中,本申请的生防菌选自稻黑孢霉菌,稻黑孢霉菌的液体发酵培养基中乳糖、甘油、酵母、硫酸铵的比例为2:2:1:2;发酵的培养条件为:母液量为25%、摇瓶装量为25%、温度为20℃、初始pH值为5、培养4d。
第三方面,本发明提供一种茄科植物生防菌培养基的筛选方法,所述方法包括如下步骤:
S1.液体母种的制备:打取纯培养的真菌菌饼接于PDA液体培养基中,按一定条件进行摇瓶培养,所得液体母种中的菌丝体相互紧密纠缠形成颗粒,均匀地悬浮在培养液中;
S2.碳源的单因素筛选:在基础培养基I上加入6种不同的碳源,再分别将液体母种接入不同的培养基中,对比6种碳源对生物量的影响,确定菌丝生物量最高的碳源;
S3.氮源的单因素筛选:在基础培养基II上加入6种不同的氮源,再分别将液体母种接入不同的培养基中,对比6种氮源对生物量的影响,确定菌丝生物量最高的氮源;
S4.碳氮比的选择:根据所得生物量最高的碳源、氮源各两个为因素,不加其他任何成分,按四因素三水平设计正交试验,对比不同C/N对真菌生长的影响,筛选出最佳的碳氮比。
进一步的,在步骤S1中,摇瓶培养是以培养基装量为20%,25℃,120rpm,摇瓶培养72h为培养条件。
进一步的,在步骤S2中,所述基础培养基I是以蛋白胨2%,MgSO4.H2O 0.05%,KH2PO40.1%为基础培养基。
进一步的,所述碳源选自麦芽糖、葡萄糖、可溶性淀粉、蔗糖、乳糖和甘油中的一种或多种。
进一步的,在步骤S3中,所述基础培养基II是以蔗糖2%,MgSO4.H2O 0.05%,KH2PO40.1%为基础培养基。
进一步的,在步骤S2和S3中,所述液体母种的接种量为5%的接种量接种。
进一步的,所述氮源选自蛋白胨、牛肉膏、酵母膏、硫酸铵、氯化铵和脲素中的一种或多种。
进一步的,所述碳源与氮源的比例为:1~3:1~3。
第四方面,本发明提供一种生防菌剂在制备抑制茄科植物生长除草剂中的应用,所述茄科植物生防菌包括链格孢菌、高粱附球菌、木贼镰刀菌、弯孢属菌C.hawaiiensis和/或稻黑孢霉菌。
进一步的,所述茄科植物包括但不限于喀西茄、雪山茄、疏刺茄、刺萼龙葵、龙葵、刺天茄中的一种或多种。
进一步的,所述茄科植物选自刺萼龙葵。
附图说明
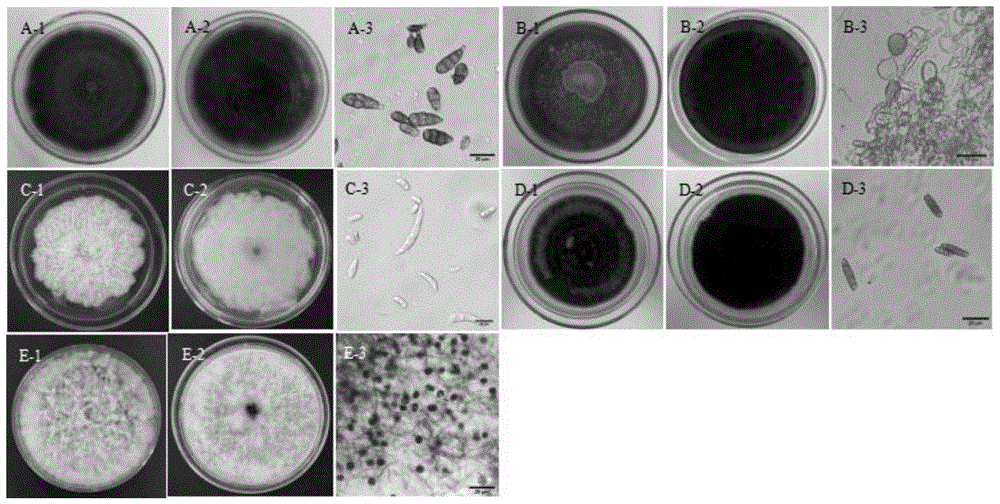
图1刺萼龙葵病原菌菌落和分生孢子的形态特征(A-1,A-2:链格孢菌菌落形态;A-3:链格孢菌分生孢子的形态;B-1,B-2:高粱附球菌菌落形态;B-3:高粱附球菌分生孢子形态;C-1,C-2:菌株木贼镰刀菌菌落形态;C-3:菌株木贼镰刀菌分生孢子形态;D-1,D-2:菌株弯孢属菌菌落形态;D-3:菌株弯孢属菌分生孢子形态;E-1,E-2:菌株稻黑孢霉菌菌落形态;E-3:菌株稻黑孢霉菌分生孢子形态);
图2五种病原菌对刺萼龙葵种子胚根萌发抑制效果;
图3接种病原菌菌饼叶片发病情况(A-1、A-2、A-3:接种链格孢菌3、7、11天后叶片发病情况;B-1、B-2、B-3:接种高粱附球菌3、7、11天后叶片发病情况;C-1、C-2、C-3:接种木贼镰刀菌3、7、11天后叶片发病情况;D-1、D-2、D-3:接种弯孢属菌3、7、11天后叶片发病情况;E-1、E-2、E-3:接种稻黑孢霉菌3、7、11天后叶片发病情况);图4接种病原菌孢子悬浮液叶片发病情况(A-1、A-2、A-3:接种链格孢菌3、7、11天后叶片发病情况;B-1、B-2、B-3:接种高粱附球菌3、7、11天后叶片发病情况;C-1、C-2、C-3:接种木贼镰刀菌3、7、11天后叶片发病情况;D-1、D-2、D-3:接种Curvul aria hawaiiensis 3、7、11天后叶片发病情况;E-1、E-2、E-3:接种稻黑孢霉菌3、7、11天后叶片发病情况);
图5链格孢菌发酵液碳氮源对菌丝生物量的影响(A:碳源对菌丝生物量的影响;B:氮源对菌丝生物量的影响);
图6高粱附球菌发酵液碳氮源对菌丝生物量的影响(A:碳源对菌丝生物量的影响;B:氮源对菌丝生物量的影响);
图7木贼镰刀菌发酵液碳氮源对菌丝生物量的影响(A:碳源对菌丝生物量的影响;B:氮源对菌丝生物量的影响);
图8Curvularia hawaiiensis发酵液碳氮源对菌丝生物量的影响(A:碳源对菌丝生物量的影响;B:氮源对菌丝生物量的影响);
图9稻黑孢霉菌发酵液碳氮源对菌丝生物量的影响(A:碳源对菌丝生物量的影响;B:氮源对菌丝生物量的影响);
图10母液接种量对病原菌菌丝生物量的影响;
图11摇瓶装量对病原菌菌丝生物量的影响;
图12培养温度对病原菌菌丝生物量的影响;
图13初始pH值对病原菌菌丝生物量的影响;
图14培养时间对病原菌菌丝生物量的影响。
具体实施方式
下面结合具体实施例对本发明进行详细说明,但本发明的保护范围不限于下述的实施例。如无特殊说明,本发明所采用的实验方法均为常规方法,所用实验器材、材料、试剂等均可从商业途径获得。
实施例1刺萼龙葵生防菌分离与鉴定
1.供试材料
刺萼龙葵植株种子、刺萼龙葵感病叶片、75%酒精、12%次氯酸钠、马铃薯葡萄糖培养基、培养皿(d=90mm)、人工气候箱(ZRG-1500A-L)、真菌基因组DNA抽提试剂盒(生工生物工程股份有限公司)。
2.叶片病原微生物分离培养
选取发病植株,采用组织分离法分离出样本中的植物病原菌。接种于PDA培养基上,28℃培养7d。对所有生长的菌落进行分类,用打孔器(d=5mm)打取每种真菌边缘处的培养基移植于新的PDA培养基上,28℃培养7d,以获得纯培养菌株。将成功分离纯化的菌株保存在PDA斜面上,置于4℃冰箱保藏。
3.叶片病原微生物鉴定
观察菌落特征,记录其形态、颜色等特征。用接种针挑取少量菌丝放置于载玻片上,加入几滴无菌水,盖上盖玻片制成临时装片,观察菌丝形态;待产孢后,收集孢子,加入无菌水配制成孢子悬浮液,用移液枪吸取5μL孢子悬浮液至洗净干燥载玻片上,制成临时玻片,在光学显微镜下观察分生孢子和分生孢子梗等形态特征并拍照。参考《真菌鉴定手册》对病原菌进行形态学鉴定。
取真菌菌丝于液氮中充分研磨成粉末,用上海生工UNIQ-10柱式真菌基因组抽提试剂盒提取DNA。以通用引物ITS4(5’-TCCTCCGCTTATTGATATGC-3’)和ITS5(5’-GGAAGTAAAAGTCGTAACAAGG-3’)作为PCR扩增引物,25μLPCR反应体系包括:Taq PCR MasterMix 12.5μL、ITS4和ITS5两条正反向引物各1μL、基因组模板DNA 2μL、ddH2O 8.5μL。扩增条件包括:94℃预变性3min,94℃变性30s,51℃退火30s,72℃延伸45s,72℃再延伸10min,共30个循环。PCR产物由生工生物工程(上海)股份有限公司进行基因测序,用Chromas软件进行序列分析,获得完整的目的片段扩增序列,将结果提交到NCBI数据库,经Blast与数据库中的已知序列进行同源性比对,确定病原菌种类。
4.刺萼龙葵病原菌分离鉴定结果
对不同调查地点的120份病叶进行病原菌分离,经过培养和观察,其在PDA平板上培养性状和菌落形态共分为5种(见图1),菌落及孢子形态描述见表1。根据菌落形态特征和孢子形态特征进行形态学鉴定,5种病原菌初步鉴定为链格孢属Alternaria sp.、附球菌属Epicoccum sp.、镰刀菌属Fusarium sp.、弯孢属Curvularia sp.、黑孢霉属Nigrosporasp.。进一步,通过分子生物学鉴定到种,5种病原菌分别为链格孢菌Alternariaalternata、高粱附球菌Epicoccum sorghinum、木贼镰刀菌Fusarium equiseti、弯孢属菌Curvularia hawaiiensis、稻黑孢霉菌Nigrospora oryzae。5种菌株的ITS序列长度分别为574bp、541bp、544bp、533bp、499bp,与NCBI数据库中的已知序列进行Blast同源性比对,分别与链格孢菌、高粱附球菌、木贼镰刀菌、弯孢属菌Curvularia hawaiiensis、稻黑孢霉菌的同源性最高,分别为99%、100%、100%、100%、99%。
表1刺萼龙葵病原菌识别特征及形态学鉴定结果
实施例2五种病原菌对刺萼龙葵致病力测定
1.五种病原菌对刺萼龙葵种子的萌发抑制率测定
在无菌超净台中,将灭菌后的2层滤纸装入无菌的直径为90mm的培养皿中,将配制好的病原菌孢子悬浮液分别倒入培养皿中,并标记编号,每种设置3个重复,对照组用无菌水代替,培养皿中倒入的病原菌孢子悬浮液要以正好浸湿无菌滤纸为宜。将刺萼龙葵种子放在2层滤纸上,每个培养皿中放20粒刺萼龙葵种子,置于培养箱中28℃、黑暗条件下培养,箱内湿度70%。出现胚根即认为已经萌发,试验过程中适时添加悬浮液,保持湿润,每天观察种子发芽情况,待种子萌发后每天测量胚根萌发长度。
结果:5种病原菌处理后均对种子胚根萌发长度具有抑制作用,其中,稻黑孢霉菌的抑制作用最强(见图2)。稻黑孢霉菌处理24h后,种子胚根平均萌发长度为1.00mm,显著低于对照组(F=4.35,df=5,114,P<0.05),其他病原菌处理后无显著差异。无菌水处理72h后胚根平均萌发长度为2.55mm,5种病原菌处理72h后胚根平均萌发长度分别为1.79mm、1.62mm、1.63mm、1.68mm、1.54mm,均显著低于对照组(F=8.69,df=5,114,P<0.05),且稻黑孢霉菌对胚根萌发长度抑制率最高,为47.76%(表2)。
表2五种病原菌处理后刺萼龙葵种子胚根萌发长度及抑制率
2.五种病原菌对刺萼龙葵离体叶片的致病力测定
选取长势整齐一致的刺萼龙葵植株,每株取大小一致的叶片分别置于培养皿中。培养皿底部先铺一层无菌滤纸,滤纸用无菌水浸湿。离体的叶片用清水冲洗叶片后用滤纸吸干表面水分,75%酒精消毒30s,3%NaClO溶液消毒1min,无菌水冲洗3次。每个叶片在距主叶脉2mm处用灭菌后的昆虫针水平划伤6处,每处伤口为2mm,以刺破下表皮同时上表皮完好为标准,打取PDA平板上培养7d的菌饼(5mm),将带有菌丝的培养基朝向叶片紧贴在伤口位置,以没有接菌的PDA培养基作为对照,置于温度25℃,湿度90%条件下培养。
测量病斑面积,根据面积大小确定接种菌株的致病性(按照叶片发病面积占总叶片面积的百分比分级:0级=叶片未发病;1级=叶片发病1%~5%;2级=叶片发病5%~25%;3级=叶片发病25%~50%;4级=叶片发病50%~75%;5级=叶片发病75%~100%(含死亡株))。
病情指数=∑(病级的接种点数×相应病级)/(总接种点数×最高病级)×100%
致病力情况:病情指数为0,不致病;病情指数为0~45,弱致病力;病情指数为45~75,中等致病力;病情指数为75~100,强致病力。
结果:在刺萼龙葵离体叶片上接种五种病原菌菌饼3d后,叶片开始出现明显病斑,接种处附近组织变为灰色。病斑沿着接种处开始扩散,7d后病斑面积扩大,接种处叶片出现破损,病斑颜色由灰色变为灰黑色。11d后叶片整体变黄,接种链格孢菌、高粱附球菌和稻黑孢霉菌后的叶片逐渐枯萎(见图3)。从接种发病的叶片上再次分离出病原菌进行分离鉴定后,与接种时所用的病原菌完全一致,验证了科赫式法则。
不同菌株的致病力存在差异,其中接种链格孢菌、木贼镰刀菌、稻黑孢霉菌后叶片发病率均为100%,其次为高粱附球菌和C.hawaiiensis,发病率分别为92.46%和88.10%。接种稻黑孢霉菌3d、7d后,叶片发病面积占比显著大于其他四种病原菌(F=26.23,df=5,12,P<0.05;F=8.21,df=5,12,P<0.05),11d后叶片发病病情指数最高,为60%,其次为链格孢菌,病情指数为46.67%,都具有中等致病力(表3)。
表3病原菌菌丝对刺萼龙葵离体叶片的致病力分析
注:致病力情况:病情指数为0,不致病;病情指数为0~45,弱致病力;病情指数为45~75,中等致病力;病情指数为75~100,强致病力。
3.五种病原菌对刺萼龙葵盆栽植株的致病力测定
每个叶片在距主脉1mm处用灭菌后的针水平划伤8处,每处伤口为2mm,采用分生孢子悬浮液喷雾接种到健康刺萼龙葵叶片上,以无菌水喷雾接种健康叶片作为对照,接种后用保鲜袋将植株套袋保湿2d,置于温度25℃,湿度90%条件下培养。测量方法同“五种病原菌对刺萼龙葵离体叶片的致病力测定”中的测量方法。
结果:在刺萼龙葵盆栽植株上接种五种病原菌孢子悬浮液后,刺萼龙葵叶片均出现了典型病斑(见图4)。接种3d后,叶片上出现细小病斑,7d后病斑面积扩大,接种处叶片周围组织坏死。11d后,接种高粱附球菌和稻黑孢霉菌的叶片破损卷曲,边缘枯黄。从接种发病的叶片上再次分离出病原菌进行分离鉴定后,与接种时所用的病原菌完全一致,验证了科赫式法则。
接种五种病原菌后,除C.hawaiiensis外其他四种病原菌的发病率均为100%。接种高粱附球菌和稻黑孢霉菌11d后,叶片发病面积占比显著大于其他三种病原菌(F=8.22,df=4,55,P<0.05)。不同病原菌对刺萼龙葵盆栽植株的致病力存在显著差异,其中,高粱附球菌的致病力最强,植株发病的病情指数最高,达78.30%。其次为稻黑孢霉菌,植株发病的病情指数为70.00%,具有中等致病力(表4)。
表4病原菌孢子悬浮液对刺萼龙葵盆栽植株的致病力分析
对自然感病的刺萼龙葵进行病原菌的分离鉴定,初步明确了其病原微生物为链格孢菌、高粱附球菌、木贼镰刀菌、弯孢属菌C.hawaiiensis、稻黑孢霉菌。对该杂草的种子和叶片进行致病力测试,结果表明稻黑孢霉菌处理后对种子胚根萌发长度抑制作用最强,叶片接种稻黑孢霉菌和高粱附球菌后,发病面积显著大于其他病原菌。
实施例3发酵培养基优化试验
液体母种的制备方法:打取纯培养的真菌菌饼(d=5mm)接于PDA液体培养基中,其培养基装量为20%,25℃,120rpm,摇瓶培养72h,所得液体母种中的菌丝体相互紧密纠缠形成颗粒,均匀地悬浮在培养液中,利于氧的传递及营养物的输送,利于菌丝的生长和代谢产物的生成。
碳源的单因素筛选:以蛋白胨2%,MgSO4.H2O 0.05%,KH2PO40.1%为基础培养基,分别将6种碳源:麦芽糖、葡萄糖、可溶性淀粉、蔗糖、乳糖、甘油以2%的体积分数加入,制备培养基,培养基装量20%,再分别以5%的接种量将液体母种接入不同的培养基中,120rpm,26℃,摇瓶培养6天,对比6种碳源对生物量的影响。
氮源的单因素筛选:以蔗糖2%,MgSO4.H2O 0.05%,KH2PO40.1%为基础培养基,分别将6种氮源:蛋白胨、牛肉膏、酵母膏、硫酸铵、氯化铵、脲素以2%的体积分数加入,制备培养基,培养基装量20%,再分别以5%的接种量将液体母种接入不同的培养基中,120rpm,26℃,摇瓶培养6天,对比6种氮源对生物量的影响。
生物量的测定方法:各培养基处理分别接种孢子悬浮液1mL,每种培养基三个重复,装液量为V。将菌丝体倒在烘于至恒重的滤纸(滤纸质量,M1)上,真空抽滤后于80℃恒温干燥箱内烘千至恒重,分析天平称重(滤纸与菌丝体总质量,M2):生物量(g/L)=(M2-M1)/V。
碳氮比的选择:根据所得的单因素结果,分别选出生物量最高的碳源、氮源各两个为因素,不加其他任何成分,按四因素三水平设计正交试验,对比不同C/N对真菌生长的影响。
正交设计如表5所示。
表5碳氮比L
结果:
1.链格孢菌发酵液碳氮源筛选
在6种碳源培养基中,链格孢菌的菌丝均能生长,其中在以葡萄糖为碳源的培养基中,菌丝生物量最高,为1.06g/L。其次为以乳糖为碳源的培养基,生物量为0.48g/L(图5A)。因此,筛选出葡萄糖和乳糖为培养基碳源。
在6种氮源培养基中,链格孢菌的菌丝能在以氯化铵、硫酸铵、酵母和蛋白胨的培养基中生长,其中在以酵母为碳源的培养基中,菌丝生物量为14.09g/L,显著大于其他5种氮源(F=4.87,df=5,12,P<0.05)。其次为以硫酸铵为碳源的培养基,生物量为2.06g/L(图5B)。因此,筛选出酵母和硫酸铵为培养基氮源。
2.高粱附球菌发酵液碳氮源筛选
在6种碳源培养基中,高粱附球菌的菌丝均能生长,其中在以麦芽糖和蔗糖为碳源的培养基中,菌丝生物量最高,分别为10.47g/L和10.68g/L,显著高于其他四种碳源(F=29.82,df=5,12,P<0.05)(图6A)。因此,筛选出麦芽糖和蔗糖为培养基碳源。
在6种氮源培养基中,高粱附球菌的菌丝能在以氯化铵、硫酸铵、酵母、牛肉膏和蛋白胨的培养基中生长,其中在以酵母为碳源的培养基中,菌丝生物量为20.87g/L,显著大于其他5种氮源(F=154.85,df=5,12,P<0.05)。其次为以硫酸铵为碳源的培养基,生物量为1.13g/L(图6B)。因此,筛选出酵母和硫酸铵为培养基氮源。
3.木贼镰刀菌发酵液碳氮源筛选
在6种碳源培养基中,木贼镰刀菌的菌丝均能生长,其中在以葡萄糖和可溶性淀粉为碳源的培养基中,菌丝生物量最高,分别为11.95g/L和10.70g/L(图7A),显著高于碳源为麦芽糖、甘油、乳糖和蔗糖的培养基(F=11.03,df=5,12,P<0.05)。因此,筛选出葡萄糖和可溶性淀粉为培养基碳源。
在6种氮源培养基中,木贼镰刀菌的菌丝能在以氯化铵、硫酸铵、酵母、牛肉膏和蛋白胨的培养基中生长,其中在以酵母为氮源的培养基中,菌丝生物量最高,为16.58g/L(图7B),显著高于其他五种培养基(F=394.47,df=5,12,P<0.05),其次为以氯化铵和硫酸铵为碳源的培养基,生物量分别为3.84g/L和2.98g/L,显著高于其他三种培养基,且硫酸铵的菌丝生物量高于氯化铵。因此,筛选出酵母和硫酸铵为培养基氮源。
4.Curvularia hawaiiensis发酵液碳氮源筛选
在6种碳源培养基中,C.hawaiiensis的菌丝均能生长,其中在以可溶性淀粉和蔗糖为碳源的培养基中,菌丝生物量最高,分别为11.36g/L和9.60g/L,显著高于其他四种碳源(F=42.65,df=5,12,P<0.05)(图8A)。因此,筛选出可溶性淀粉和蔗糖为培养基碳源。
在6种氮源培养基中,C.hawaiiensis的菌丝能在以氯化铵、硫酸铵、酵母、牛肉膏和蛋白胨的培养基中生长,其中在以牛肉膏为氮源的培养基中,菌丝生物量为10.33g/L(图8B),显著高于其他五种培养基(F=93.41,df=5,12,P<0.05)。其次为以蛋白胨为碳源的培养基,生物量为8.09g/L,显著高于其他四种培养基。因此,筛选出牛肉膏和蛋白胨为培养基氮源。
5.稻黑孢霉菌发酵液碳氮源筛选
在6种碳源培养基中,稻黑孢霉菌的菌丝均能生长,其中在以甘油为碳源的培养基中,菌丝生物量最高,为0.78g/L,显著高于碳源为麦芽糖、葡萄糖、可溶性淀粉和蔗糖的培养基(F=11.03,df=5,12,P<0.05)。其次为以乳糖为碳源的培养基,生物量为0.58g/L(图9A)。因此,筛选出甘油和乳糖为培养基碳源。
在6种氮源培养基中,稻黑孢霉菌的菌丝能在以氯化铵、硫酸铵、酵母、牛肉膏和蛋白胨的培养基中生长,其中在以硫酸铵为氮源的培养基中,菌丝生物量分别为4.58g/L(图9B),显著高于氮源为脲素、牛肉膏和蛋白胨的培养基(F=6.78,df=5,12,P<0.05),且硫酸铵和酵母的菌丝生物量最高。因此,筛选出硫酸铵和酵母为培养基氮源。
6.发酵液碳氮比结果
表6五种病原菌最佳碳氮比
结果如表6所示,刺萼龙葵病原菌发酵培养基,其中稻黑孢霉菌的碳源为乳糖、甘油,氮源为酵母、硫酸铵,处理2(酵母1%、硫酸铵2%、乳糖2%、甘油2%)的菌丝生物量最高,为1.08g/L,发酵培养基中乳糖、甘油、酵母、硫酸铵的最佳比例为2:2:1:2。
实施例4液体发酵条件的筛选
接种量对生物量的影响:将液体母种按5%、10%、15%、20%和25%的量接入发酵培养基中,120rpm,25℃,摇瓶培养6天,测生物量。
摇瓶装量对生物量的影响:将液体母种接种于液体发酵培养基中,在三角瓶中分别装入5%,10%,15%,20%,25%不同量的培养基,摇瓶发酵6天,测生物量。
培养温度对生物量的影响:将液体母种接种于液体发酵培养基中,分别于15℃,20℃,25℃,30℃,35℃的温度下,摇瓶发酵6天,测生物量。
培养成分不同起始pH值对生物量的影响:将发酵培养基用1mLNaOH或HCl分别调pH为5.0,6.0,7.0,8.0,9.0,液体母种分别接入,摇瓶发酵培养6天,测生物量。
培养时间对生物量的影响:将液体母种接种于液体发酵培养基分别发酵2,4,6,8,10天,测生物量。
正交试验优化发酵条件:在上述单因素试验的基础上,采用正交设计,以接种量、摇瓶装量、培养温度、培养基初始pH值以及培养时间五个条件为主要研究因素,采用L25(55)的正交表进行5因子的正交设计试验,每个因子取5个水平,每组试验重复3次,以生物量为菌株生长检测指标。正交设计如表7和8所示。
表7液体发酵正交因素水平表/体积分数
表8液体发酵正交试验设计表
结果:
1.母液接种量对五种病原菌发酵的影响
链格孢菌在母液接种量为5%时,菌丝生物量最高,为22.31g/L。木贼镰刀菌在母液接种量为15%时,菌丝生物量最高,为9.72g/L。高粱附球菌、C.hawaiiensis、稻黑孢霉菌在母液接种量为25%时,菌丝生物量显著高于其他接种量(F=42.91,df=4,10,P<0.05;F=6853.15,df=4,10,P<0.05;F=138.87,df=4,10,P<0.05),分别为2.07g/L、5.81g/L、1.89g/L。(见图10)
2.摇瓶装量对五种病原菌发酵的影响
链格孢菌和木贼镰刀菌在摇瓶装量为15%时,菌丝生物量最高,分别为6.46g/L和5.71g/L。高粱附球菌、C.hawaiiensis、稻黑孢霉菌在摇瓶装量为25%时,菌丝生物量最高,分别为6.8g/L、0.17g/L、0.20g/L。(见图11)
3.培养温度对五种病原菌发酵的影响
高粱附球菌、木贼镰刀菌、C.hawaiiensis、稻黑孢霉菌在培养温度为20℃时,菌丝生物量显著高于其他温度(F=669.29,df=4,10,P<0.05;F=794.08,df=4,10,P<0.05;F=3011.96,df=4,10,P<0.05;F=118.23,df=4,10,P<0.05),分别为为7.57g/L、9.28g/L、8.15g/L、5.80g/L。链格孢菌在培养温度为30℃时,菌丝生物量显著高于其他温度(F=5208.47,df=4,10,P<0.05),为22.31g/L。(见图12)
4.初始pH值对五种病原菌发酵的影响
木贼镰刀菌、C.hawaiiensis和稻黑孢霉菌在初始pH值为5时,菌丝生物量最高,为9.78g/L、30.61g/L和14.92g/L。链格孢菌在初始pH值为6时,菌丝生物量最高,为9.78g/L。高粱附球菌在初始pH值为7时,菌丝生物量显著高于其他四组(F=250.07,df=4,10,P<0.05),为8.86g/L。(见图13)
4.2.5培养时间对五种病原菌发酵的影响
木贼镰刀菌、C.hawaiiensis和稻黑孢霉菌在培养时间为4d时,菌丝生物量最高,为5.05g/L、4.25g/L和1.27g/L。链格孢菌在培养时间为6d时,菌丝生物量最高,为22.31g/L。高粱附球菌在培养时间为8d时,菌丝生物量显著高于其他四组(F=370.00,df=4,10,P<0.05),为10.14g/L。(见图14)
综上实验结果表明:
链格孢菌的液体发酵培养基中葡萄糖、乳糖、酵母、硫酸铵的比例为3:3:1:3;发酵的培养条件为:母液量为5%、摇瓶装量为15%、温度为30℃、初始pH值为6、培养6d。
高粱附球菌的液体发酵培养基中麦芽糖、蔗糖、酵母、硫酸铵的比例为2:1:3:3;发酵的培养条件为:母液量为25%、摇瓶装量为25%、温度为20℃、初始pH值为7、培养8d。
木贼镰刀菌的液体发酵培养基中麦芽糖、蔗糖、酵母、硫酸铵的比例为1:3:3:2;发酵的培养条件为:母液量为15%、摇瓶装量为15%、温度为20℃、初始pH值为5、培养4d。
C.hawaiiensis的液体发酵培养基中可溶性淀粉、蔗糖、牛肉膏、蛋白胨的比例为2:2:1:2;发酵的培养条件为:母液量为25%、摇瓶装量为15%、温度为20℃、初始pH值为5、培养4d。
稻黑孢霉菌的液体发酵培养基中乳糖、甘油、酵母、硫酸铵的比例为2:2:1:2;发酵的培养条件为:母液量为25%、摇瓶装量为25%、温度为20℃、初始pH值为5、培养4d。
