一种皮肤损伤修复水凝胶敷料及其制备方法
文献发布时间:2024-04-18 20:01:55
技术领域
本发明涉及生物医药技术领域,尤其涉及一种皮肤损伤修复水凝胶敷料及其制备方法。
背景技术
随着核技术在疾病诊疗、军事和工业等领域的广泛应用,医疗照射及意外辐射暴露引起的损伤给患者及社会带来潜在危害。皮肤是外源电离辐射进入机体的必经之路,且皮肤细胞更新快速,因此对电离辐射更为敏感。放射性皮肤损伤的早期急性病变表现为辐射导致的DNA双链或单链断裂、细胞坏死、凋亡,症状包括干性脱皮和红斑、皮肤皱襞和湿性脱屑,严重的可发展成溃疡、出血和皮肤坏死。晚期慢性皮肤反应发生于放射后的数周至数年,病理特征为促炎细胞因子过度分泌、免疫细胞功能紊乱和慢性炎症,症状有慢性溃疡、皮肤纤维化、毛细血管扩张、继发性皮肤癌和角化病等。因此,慢性皮肤辐射损伤存在发病周期长、伤口难愈合的特点,给社会带来沉重的经济负担、降低患者生活质量,是临床面临的极大挑战。目前临床上治疗皮肤辐射损伤多使用对创面进行抗炎、抗氧化、促愈合或保湿的功能敷料,由于辐射损伤具有复杂的生物学机制,针对单一致病因素的治疗方案疗效并不理想。此外,糖尿病、烫伤等因素导致的慢性皮肤损伤也面临着伤口愈合难的问题。
因此,提供一种新的多功能敷料用于慢性皮肤损伤修复具有重要意义。
发明内容
为了解决上述技术问题,本发明提供了一种皮肤损伤修复水凝胶敷料及其制备方法,本发明提供的水凝胶敷料合成方法简单、生物相容性好、可生物降解,能够用于皮肤辐射损伤修复,且在糖尿病、烫伤等因素导致的慢性皮肤损伤修复中具有很好的应用前景。
第一方面,本发明提供了一种皮肤损伤修复水凝胶敷料,所述水凝胶敷料由多肽、虫草素和氧化透明质酸制备得到。
本发明提供的水凝胶敷料能够清除损伤组织中的ROS并产生NO,促进辐射损伤后血管内皮细胞的迁移功能,显著降低细胞的DNA损伤,增强虫草素在组织中的稳定性,减少血管内细胞衰老,促进皮肤损伤修复,在辐射、糖尿病以及烫伤等导致的慢性皮肤损伤修复治疗中具有很好的应用前景。具体而言:
辐射会导致DNA损伤和细胞衰老,细胞衰老是一种进化上保守的稳定复制停滞状态,由促衰老应激源诱导,也涉及辐射性溃疡的发病机制,包括端粒磨损、氧化应激、DNA损伤和蛋白质不稳定性。衰老细胞常伴有大量促炎因子分泌增加等生理特征,统称为衰老相关分泌表型(SASP),可以以旁分泌的方式诱导组织功能障碍和恶化。衰老细胞的积累可以驱动与衰老相关的表型和病理发生发展,衰老细胞会产生一种衰老的炎症性细胞龛阻止干细胞增殖和再生,而通过使用中和抗体减少衰老细胞分泌SASP因子,可以加速年轻和老年小鼠的肌肉再生能力。此外,衰老的人内皮细胞中,eNOS的活性降低且一氧化氮(NO)的产生减少,具体表现为NO生物利用度的降低和内皮功能的损伤,而NO在抗菌作用和调节血管稳态中起着核心作用。
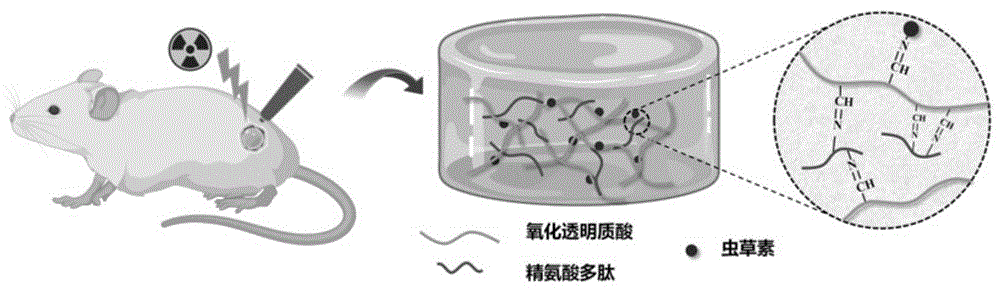
本发明提供的水凝胶敷料中包括虫草素,其作为腺苷的天然衍生物,具有多种优势,如具有许多细胞内包括核酸(DNA/RNA)生成、细胞凋亡和细胞周期等生理活动的生物学靶点;具有抗氧化、抗肿瘤、抗炎、神经保护、防止骨丢失等多种药理活性。虫草素可以通过增强细胞抗氧化能力,减轻辐照引起的DNA损伤,减少SASP分泌;通过降低过氧化氢对细胞的损伤能力,减轻瘢痕的形成,进而促进辐射损伤皮肤伤口愈合。而且本发明提供的水凝胶敷料将虫草素与氧化透明质酸通过动态共价键连接,在损伤处的偏酸性环境中可以释放虫草素,提高了虫草素的稳定性,避免了虫草素进入体内后因其活性基团氨基被广泛存在于各种组织中的腺苷脱氨酶快速水解导致的失活,从而大大提高其活性。而本发明的水凝胶敷料中的多肽,通过分子间非共价相互作用以及与氧化透明质酸通过动态共价键形成稳定组装体,能够清除辐射产生的ROS并产生NO,使得本发明提供的水凝胶敷料兼具NO和虫草素的优异性能,进而能够促进辐射损伤后血管内皮细胞的迁移功能,更好地减少辐射导致的血管内细胞衰老,促进放疗后小鼠的伤口修复,且在慢性皮肤损伤修复治疗中具有很好的应用前景,本发明提供的水凝胶敷料的应用示意图如图1所示。
作为本发明的一种优选技术方案,所述多肽的氨基酸序列如FFRR(SEQ ID NO:1)、FFRRR(SEQ ID NO:2)或FFRRRR(SEQ ID NO:3)所示。
本发明提供的水凝胶敷料包括低聚精氨酸多肽,其相对于精氨酸具有更长效的ROS清除能力以及NO释放能力,一方面作为精氨酸供体和NO供体,能够维持血管内皮细胞功能和血管稳态,还利用其正电荷相关的抗菌特性及其穿透性在伤口愈合中发挥重要作用,降低辐射引起的氧化损伤,最终缓解电离辐射导致的机体损伤。精氨酸作为NO、多胺等分子物质的前体,参与多种营养物质的合成与代谢,在营养与代谢上发挥着重要的作用。作为一种带电子的碱性氨基酸,精氨酸通过胍基基团向自由基提供电子并与自由基反应,从而终止自由基链反应而显示出还原能力与抗氧化能力。此外,精氨酸对尿素、多胺、胍丁胺和磷酸肌酸的合成至关重要。精氨酸有助于调节炎症反应、胶原蛋白形成、血管生成和进一步的组织重塑,在伤口愈合中起不可或缺的作用。因此,精氨酸不仅能够作为NO生物合成的前体维持血管内皮细胞功能和血管稳态,还能够降低辐射引起的氧化损伤,最终缓解电离辐射导致的机体损伤,进而使得本发明提供的水凝胶敷料具有修复辐射损伤的作用。
作为本发明的一种优选技术方案,所述多肽的N端利用封端基团进行修饰。
本发明并不对所述封端基团进行过多限定,只要是本领域常用的多肽链封端基团即可。本发明以X代表封端基团,即所述的多肽序列为X-FFRR、X-FFRRR或X-FFRRRR,其结构式如下所示:
X-FFRR;
X-FFRRR;
X-FFRRRR。
作为本发明的一种优选技术方案,所述多肽的N端利用萘基修饰,即所述的多肽序列为Nap-FFRR、Nap-FFRRR或Nap-FFRRRR,其结构式如下所示:
Nap-FFRR;
Nap-FFRRR;
Nap-FFRRRR。
作为本发明的一种优选技术方案,所述多肽的制备方法包括如下步骤:
(1)将树脂、Fmoc-Arg(Pbf)-OH、催化剂混合进行反应,利用封闭液封闭,脱保护;
(2)将Fmoc-Arg(Pbf)-OH、活化剂、催化剂加入步骤(1)得到的产物中进行反应,脱保护;之后重复步骤(2)连接剩余的氨基酸,直至最后一个氨基酸;
(3)将封端剂、活化剂、催化剂加入步骤(2)得到的产物中进行反应,酸切,得到所述多肽。
作为本发明的一种优选技术方案,步骤(1)所述树脂选自2-Cl-Trt树脂。
作为本发明的一种优选技术方案,所述封端剂选自2-萘乙酸。
作为本发明的一种优选技术方案,所述催化剂选自
作为本发明的一种优选技术方案,所述活化剂选自苯并三氮唑-
本发明中多肽具有自组装功能且能够产生NO,通过基于Fmoc保护的固相合成法制备得到,即每一个氨基酸的氨基都被芴甲基羰基(Fmoc)保护,反应过程中脱除Fmoc使之裸露出氨基与已经活化的下一个氨基酸的羧基交联缩合,形成肽键。反应过程中以苯并三氮唑-
作为本发明的一种优选技术方案,步骤(1)中所述封闭液为体积比为8.5:1:0.5的二氯甲烷、甲醇、
作为本发明的一种优选技术方案,所述脱保护使用的溶液为20%的哌啶/DMF溶液。
作为本发明的一种优选技术方案,所述酸切使用的酸为体积比为9.5:0.25:0.25的三氟乙酸、三羟甲基氨基甲烷和水的混合液。
作为本发明的一种优选技术方案,所述多肽的制备方法包括如下步骤:
(1)将2-Cl-Trt树脂、Fmoc-Arg(Pbf)-OH、
(2)将Fmoc-Arg(Pbf)-OH、苯并三氮唑-
(3)将2-萘乙酸等封端剂、苯并三氮唑-
作为本发明的一种优选技术方案,所述多肽、虫草素和氧化透明质酸的质量比为(0.5-2):2.5:(10-40),例如0.5:2.5:10、0.5:2.5:20、0.5:2.5:40、1:2.5:10、1:2.5:20、1:2.5:40、2:2.5:10、2:2.5:20、2:2.5:40等。
第二方面,本发明提供了第一方面所述的水凝胶敷料的制备方法,所述制备方法包括:将多肽、虫草素和氧化透明质酸进行席夫碱反应,得到所述水凝胶敷料。多肽、虫草素分别和氧化透明质酸进行席夫碱反应,并发生分子间的非共价自组装,得到所述水凝胶敷料。
本发明利用席夫碱反应使氧化透明质酸(AHA)与虫草素(CCS)及多肽通过动态化学键共价连接,形成微米纤维结构,提高虫草素的稳定性,并使其具有药物控释能力,制备得到的水凝胶敷料能够清除损伤组织中的ROS并产生NO,促进辐射损伤后血管内皮细胞迁移,显著降低细胞的DNA损伤,减少血管内细胞衰老,促进放疗后伤口修复,在皮肤辐射损伤修复治疗,糖尿病、烫伤等因素导致的慢性皮肤损伤修复中均具有良好的应用前景。
作为本发明的一种优选技术方案,所述制备方法还包括在所述席夫碱反应之前将多肽、虫草素和氧化透明质酸置于溶剂中进行溶解。
作为本发明的一种优选技术方案,所述溶剂选自PBS溶剂。
作为本发明的一种优选技术方案,所述溶解时的温度≥60℃,例如70℃、80℃、90℃、100℃等。本发明并不对所述溶解时的温度的上限进行限定,只要能够加热使多肽、虫草素和氧化透明质酸溶解即可。
本发明首先将多肽、虫草素和氧化透明质酸溶解于溶剂中并进行加热沸腾30 s,然后自然冷却,之后再进行席夫碱反应,通过加热-冷却过程,形成微米纤维结构,得到稳定的水凝胶敷料。
作为本发明的一种优选技术方案,所述多肽、虫草素和氧化透明质酸的质量比为(0.5-2):2.5:(10-40)。
作为本发明的一种优选技术方案,所述多肽、虫草素和氧化透明质酸的质量和与所述溶剂的体积比为(13-44.5) mg:1 mL,例如14mg:1mL、15 mg:1 mL、20 mg:1 mL、25 mg:1 mL、30 mg:1 mL、35mg:1mL、40 mg:1 mL等。
作为本发明的一种优选技术方案,所述水凝胶敷料通过席夫碱反应及多肽分子的组装驱动得到。本发明中多肽、虫草素分别和氧化透明质酸进行席夫碱反应,并发生分子间的非共价自组装,得到所述水凝胶敷料。
作为本发明的一种优选技术方案,所述席夫碱反应的反应温度为15-30℃,例如18℃、20℃、22℃、24℃、26℃、28℃等。
作为本发明的一种优选技术方案,所述席夫碱反应的反应时间为10-20 h,例如12h、14 h、16 h、18 h等。
本发明还提供了所述氧化透明质酸(AHA)的制备方法,包括如下步骤:将透明质酸与高碘酸钠混合进行反应,得到所述氧化透明质酸。
反应式如下所示:
。
本发明并不对氧化透明质酸进行过多限定,任意能够实现本发明目的的氧化透明质酸均可以应用于本发明。
作为本发明的一种优选技术方案,所述混合为将高碘酸钠的溶液逐滴加入所述透明质酸中。
作为本发明的一种优选技术方案,所述高碘酸钠与透明质酸的质量比为57:100。
第三方面,本发明提供了一种皮肤损伤修复剂,包含第一方面所述的皮肤损伤修复水凝胶敷料,或由第一方面所述的皮肤损伤修复水凝胶敷料制备而成。
本发明实施例提供的技术方案与现有技术相比具有如下优点:
本发明提供的皮肤损伤修复水凝胶敷料合成方法简单、生物相容性好、可生物降解,能够清除损伤组织中的ROS并产生NO,促进辐射损伤后血管内皮细胞的迁移功能,显著降低细胞的DNA损伤,增强虫草素在组织中的稳定性,减少血管内细胞衰老,皮肤损伤修复,在辐射、糖尿病以及烫伤等导致的慢性皮肤损伤修复治疗中具有很好的应用前景。
附图说明
此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本发明的实施例,并与说明书一起用于解释本发明的原理。
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本发明提供的水凝胶敷料的应用示意图;
图2为制备例2得到的多肽Nap-FFRR的质谱图;
图3为制备例2得到的多肽Nap-FFRRR的质谱图;
图4为制备例2得到的多肽Nap-FFRRRR的质谱图;
图5为制备例2得到的多肽Nap-FFRR成胶后图片;
图6为制备例2得到的多肽Nap-FFRRR成胶后图片;
图7为制备例2得到的多肽Nap-FFRRRR成胶后图片;
图8为制备例2得到的多肽Nap-FFRR的透射电镜图;
图9为制备例2得到的多肽Nap-FFRRR的透射电镜图;
图10为制备例2得到的多肽Nap-FFRRRR的透射电镜图;
图11为制备例4制备得到的水凝胶敷料的成胶后图片;
图12为制备例5制备得到的水凝胶敷料的成胶后图片;
图13为对比制备例4制备得到的水凝胶敷料的成胶后图片;
图14为对比制备例5制备得到的水凝胶敷料的成胶后图片;
图15为制备例3制备得到的水凝胶敷料在不同放大倍数下的扫描电镜图一;
图16为制备例3制备得到的水凝胶敷料在不同放大倍数下的扫描电镜图二;
图17为经R2、游离精氨酸处理的C166细胞在辐照后的ROS流式检测结果;
图18为经R2、游离精氨酸处理后的C166细胞在辐照后的NO流式检测结果;
图19为经R2、AHA-R2、AHA-R2-CCS、游离精氨酸处理的HUVEC细胞在辐照6 h、10 h时的迁移图片;
图20为经R2、AHA-R2、AHA-R2-CCS、游离精氨酸处理的HUVEC细胞在辐照6 h、10 h后的迁移结果;
图21为经CCS、AHA-R2、AHA-R2-CCS处理的3T3细胞在辐照后DNA损伤结果图片;
图22为经CCS、AHA-R2、AHA-R2-CCS处理的HUVEC细胞在辐照7 d后β-半乳糖苷酶染色结果;
图23为分别用AHA、AHA-CCS、AHA-Arg-CCS、AHA-R2、AHA-R2-CCS处理的各组小鼠伤口修复结果图;
图24为分别用AHA、AHA-CCS、AHA-Arg-CCS、AHA-R2、AHA-R2-CCS处理的各组小鼠伤口切片H&E染色和Masson染色情况结果。
具体实施方式
为了能够更清楚地理解本发明的上述目的、特征和优点,下面将对本发明的方案进行进一步描述。需要说明的是,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但本发明还可以采用其他不同于在此描述的方式来实施;显然,说明书中的实施例只是本发明的一部分实施例,而不是全部的实施例。
制备例1
本制备例提供了氧化透明质酸的制备方法,包括如下步骤:
在100 mL 1%的透明质酸溶液中逐滴加入5 mL 0.5 M的高碘酸钠溶液,边加边搅拌,反应2 h后,加入1 mL乙二醇终止反应,透析三天,冻干得到氧化透明质酸产物。
制备例2
本制备例提供了多肽Nap-FFRR(R2)、Nap-FFRRR(R3)和Nap-FFRRRR(R4)的制备方法,包括如下步骤:
称取0.5 mg的2-Cl-Trt树脂,加入固相合成管中,用DCM溶胀5min。用西林瓶称取298 mg(0.5 mmol)Fmoc-Arg(Pbf)-OH,并加入DCM使之溶解,再加200 μL DIEA(1 mmol),混合均匀。挤出合成管中的液体,将上述混匀的溶液加入其中,反应2 h。反应结束后挤出反应液,用DCM洗5次,加入甲醇封闭液(DCM:CH
之后按1:2的投料比,重复上述加-洗-脱-洗的步骤连接剩余的氨基酸,直至最后一个氨基酸。然后配186 mg(1 mmol)的2-萘乙酸、379mg(1 mmol)的HBTU、400 μL DIEA(2mmol)的DMF溶液加入其中过夜反应。可用茚三酮试剂监测反应程度,若反应完全则树脂呈无色,若反应未完全则树脂呈蓝紫色。用DMF洗净未反应的原料后,用DCM洗净树脂中的DMF,加入95%的三氟乙酸(TFA)(TFA:三羟甲基氨基甲烷(Tris):H
性能测试1
利用液相色谱-质谱联用仪对制备例2得到的多肽产物进行检测,质谱图如图2-4所示,其中,图2为多肽Nap-FFRR的质谱图,图3为多肽Nap-FFRRR的质谱图,图4为多肽Nap-FFRRRR的质谱图,验证了所得产物的结构式。
性能测试2
将制备例2得到的多肽分别配制为10 mg/mL的多肽水溶液,用Na
1、观察其成胶情况:如图5-7所示,其中,图5为多肽Nap-FFRR成胶后图片,图6为多肽Nap-FFRRR成胶后图片,图7为多肽Nap-FFRRRR成胶后图片。
2、透射电镜测试:在避光条件下,取上述多肽水溶液10 μL滴在铜网表面上静置5min,随后用滤纸从边缘吸去多余的样品,尽量避免损坏铜网。随后,将样品用3%的醋酸双氧铀染色3 min,用滤纸吸去多余的样品。将铜网干燥过夜,在透射电镜下观察并拍照,结果如图8-10所示,其中,图8为多肽Nap-FFRR的透射电镜图,图9为多肽Nap-FFRRR的透射电镜图,图10为多肽Nap-FFRRRR的透射电镜图。
由图5-7和图8-10的对比可知,在pH为7.4,加热-冷却的条件下,Nap-FFRRR与Nap-FFRRRR形成的凝胶外观不够稳定,而Nap-FFRR在相同条件下能形成外观稳定的凝胶,且在透射电镜下呈均一纤维状。
制备例3
本制备例提供了一种水凝胶敷料及其制备方法,具体包括如下步骤:
将1.588 mg Nap-FFRR、2.5 mg虫草素和30 mg氧化透明质酸溶解于1 mL PBS,加热沸腾后冷却,常温反应过夜,得到水凝胶敷料(AHA-R2-CCS)。
制备例4
本制备例提供了一种水凝胶敷料及其制备方法,所述制备方法包括如下步骤:
将2 mg Nap-FFRR、2.5 mg虫草素和40 mg氧化透明质酸溶解于1mL PBS,加热沸腾后冷却,常温反应过夜,得到水凝胶敷料(AHA- R2´-CCS),图11为制备例4制备得到的水凝胶敷料的成胶后图片。
制备例5
本制备例提供了一种水凝胶敷料及其制备方法,所述制备方法包括如下步骤:
将0.5 mg Nap-FFRR、2.5 mg虫草素和10 mg氧化透明质酸溶解于1 mL PBS,加热沸腾后冷却,常温反应过夜,得到水凝胶敷料(AHA-R2〞-CCS),图12为制备例5制备得到的水凝胶敷料的成胶后图片。
制备例6
本制备例提供了一种水凝胶敷料及其制备方法,所述制备方法包括如下步骤:
将2mg Nap-FFRRR、2.5 mg虫草素和30 mg氧化透明质酸溶解于1mL PBS,加热沸腾后冷却,常温反应过夜,得到水凝胶敷料(AHA-R3-CCS)。
制备例7
本制备例提供了一种水凝胶敷料及其制备方法,所述制备方法包括如下步骤:
将2 mg Nap-FFRRRR、2.5 mg虫草素和30 mg氧化透明质酸溶解于1mL PBS,加热沸腾后冷却,常温反应过夜,得到水凝胶敷料(AHA-R4-CCS)。
对比制备例1
本对比制备例提供了一种水凝胶敷料及其制备方法,所述制备方法包括如下步骤:
将1.588 mg Nap-FFRR和30 mg氧化透明质酸溶解于1 mL PBS,加热沸腾后冷却,常温反应过夜,得到水凝胶敷料(AHA-R2)。
对比制备例2
本对比制备例提供了一种水凝胶敷料及其制备方法,所述制备方法包括如下步骤:
将1.588 mg 精氨酸、2.5 mg虫草素和30 mg氧化透明质酸溶解于1mL PBS,加热沸腾后冷却,常温反应过夜,得到水凝胶敷料(AHA-Arg-CCS)。
对比制备例3
本对比制备例提供了一种水凝胶敷料及其制备方法,所述制备方法包括如下步骤:
将2.5 mg虫草素和30 mg氧化透明质酸溶解于1mL PBS,加热沸腾后冷却,常温反应过夜,得到水凝胶敷料(AHA-CCS)。
对比制备例4
本对比制备例提供了一种水凝胶敷料及其制备方法,所述制备方法包括如下步骤:
将2mg Nap-FFRRR和30 mg氧化透明质酸溶解于1 mL PBS,加热沸腾后冷却,常温反应过夜,得到水凝胶敷料(AHA-R3),图13为对比制备例4制备得到的水凝胶敷料的成胶后图片。
对比制备例5
本对比制备例提供了一种水凝胶敷料及其制备方法,所述制备方法包括如下步骤:
将2 mg Nap-FFRRRR和30 mg氧化透明质酸溶解于1 mL PBS,加热沸腾后冷却,常温反应过夜,得到水凝胶敷料(AHA-R4),图14为对比制备例5制备得到的水凝胶敷料的成胶后图片。
性能测试3
将制备例3制备得到的水凝胶敷料进行扫描电镜测试。
将制备例3制备得到的水凝胶敷料分别置于-80℃,过夜。冻干6 h,取出冻干样品。使用导电胶带,从样品表面沾粘至样品托,做为导电通道,并在金属胶带附近区域对样品进行成像,利用喷金仪等对样品进行导电镀膜处理,在低真空模式下进行观察,结果如图15和图16所示,其中,图15和图16为制备例3制备得到的水凝胶敷料在不同放大倍数下的扫描电镜图,从图中可以看到透明质酸的片层结果,以及纤维状多肽。
性能测试4
探究Nap-FFRR(R2)对辐照处理后细胞内ROS含量的影响。
选用小鼠血管内皮细胞(C166)和小鼠胚胎成纤维细胞(3T3)进行细胞水平研究。用分别含R2和游离精氨酸(等胍基量20 μΜ)的DMEM完全培养基孵育上述细胞24 h后,照射6 Gy-γ射线,置于培养箱中继续孵育。孵育12 h后,用PBS洗1遍,各加入1 mL
5 μM ROS探针(DCFH-DA),37℃孵育30 min。弃去上清,用PBS洗1次,然后用胰酶消化细胞,离心收集细胞于1.5 mL EP管中,加入400 μL PBS重悬,然后使用流式细胞仪进行检测,检测结果如图17所示。
图17为经R2、游离精氨酸处理的C166细胞在辐照后的ROS流式检测结果,可以发现,相较于游离精氨酸,R2具有更长的ROS清除能力。
性能测试5
探究Nap-FFRR(R2)对辐照处理后细胞内NO含量的影响。
选用小鼠血管内皮细胞(C166)和小鼠胚胎成纤维细胞(3T3)进行细胞水平研究。用分别含R2和游离精氨酸(等胍基量20 μΜ)的DMEM完全培养基孵育上述细胞24 h后,照射6 Gy-γ射线,置于培养箱中继续孵育。孵育12 h后,用PBS洗1遍,各加入1 mL
1 μM NO荧光探针(DAF-FM),37℃孵育30 min。弃去上清,用PBS洗1遍,然后用胰酶消化细胞,离心收集细胞于1.5 mL EP管中,加入400 μL PBS重悬,然后使用流式细胞仪进行检测,检测结果如图18所示。
图18为经R2、游离精氨酸处理后的C166细胞在辐照后的NO流式检测结果,可以发现,相较于游离精氨酸,R2具有更长的NO释放能力。
性能测试6
探究R2、AHA-R2、AHA-R2-CCS和游离精氨酸对辐照处理后内皮细胞迁移的影响。
选用原代人脐静脉内皮细胞(HUVEC)进行细胞水平研究。使用4孔划痕插件,将生长闭合度达到80%的HUVEC细胞进行消化,离心,弃去上清,将细胞配置为66万细胞/mL的细胞悬液,将吹打均匀的细胞加入划痕插件孔里,每个小孔添加150 μL细胞悬液(一个插件共600μL,约40万细胞),让其在ECM完全培养基中培养24 h使细胞充分贴壁,之后将原先的培养基弃去并轻轻移去插件,用PBS洗涤一遍洗去未贴壁的悬浮细胞,然后分别加入含有R2、AHA-R2、AHA-R2-CCS和游离精氨酸(Arg)(等胍基量20 μΜ)的无血清ECM培养基,同时以相同条件下加入同体积无血清培养基作为对照,以倒置显微镜拍摄此时的细胞状态作为0 h的对照,在辐照6 Gy后,细胞与材料继续共同作用6、10 h时拍摄细胞迁移情况图片,如图19所示。
图19为经R2、AHA-R2、AHA-R2-CCS、游离精氨酸处理的HUVEC细胞在辐照6 h、10 h时的迁移图片。
最后使用Image J软件对迁移的细胞进行定量分析,检测结果如图20所示。
图20为经R2、AHA-R2、AHA-R2-CCS、游离精氨酸处理的HUVEC细胞在辐照6 h、10 h后的迁移结果,可以发现,本发明提供的水凝胶敷料对于辐照后的内皮细胞具有良好的促进迁移能力。
性能测试7
探究CCS、AHA-R2、AHA-R2-CCS对辐照处理后细胞DNA损伤的影响。
选用小鼠胚胎成纤维细胞(3T3)进行细胞水平研究。将生长闭合度达到80%的3T3细胞进行消化,离心,弃去上清,重悬,一个共聚焦小皿20万细胞。在DMEM完全培养基中培养24 h使细胞充分贴壁,将原先的培养基弃去,分别加入含有AHA-R2-CCS、AHA-R2或CCS(R2等胍基量10 μL,CCS等摩尔量100 μL)的DMEM完全培养基孵育上述细胞24 h后,照射6 Gy-γ射线,置于培养箱中继续孵育1 h。吸弃上清,用1 mL PBS洗2次,使用1 mL 4%多聚甲醛室温固定30 min。吸弃上清,用1 mL PBS洗3次,加入1 mL冰甲醇,置于-20℃通透10 min。吸弃上清,用1 mL PBS洗3次,加入500 μL 1% BSA,室温封闭1 h。吸弃上清,加入500 μL γ-H2AX抗体(1:500,1% BSA稀释)过夜。吸弃上清,用1mL PBS洗3次,每次3 min。加入二抗(1:500,1% BSA稀释),室温避光孵育1 h。吸弃上清,用1 mL PBS洗3次,每次3 min。加入500 μLDAPI染液,室温避光孵育10 min。吸弃上清,用1 mL PBS洗1次,加入1 mL PBS。最后在共聚焦显微镜下(oil×60)观察并拍照,结果如图21所示。
图21为经CCS、AHA-R2、AHA-R2-CCS处理的3T3细胞在辐照后DNA损伤结果图片,由图可知,AHA-R2-CCS水凝胶敷料能够显著降低辐照对细胞的DNA损伤。
性能测试8
探究CCS、AHA-R2、AHA-R2-CCS对辐照处理后内皮细胞衰老情况的影响。
选用原代人脐静脉内皮细胞(HUVEC)进行细胞水平研究。将生长闭合度达到80%的HUVEC细胞进行消化,离心,弃去上清,重悬,5万细胞/孔六孔板,在ECM完全培养基中培养24h使细胞充分贴壁,将原先的培养基弃去,分别加入AHA-R2-CCS、AHA-R2或CCS,辐照8 Gy后,置于培养箱。7天后,吸弃细胞培养液,用1 mL PBS洗1次,加入1 mL β-半乳糖苷酶染色固定液,室温固定15 min。吸弃细胞固定液,用1 mL PBS洗涤3次,每次3 min。吸弃PBS,每孔加入1 mL染色工作液。37℃孵育过夜,用parafirm封口膜封住六孔板防止蒸发并防止二氧化碳影响结果。最后在倒置光学显微镜明场下观察并拍照,结果如图22所示。
图22为经CCS、AHA-R2、AHA-R2-CCS处理的HUVEC细胞在辐照7 d后β-半乳糖苷酶染色结果,可以发现,经辐照后细胞形状变大、变平,细胞核增大,明显蓝染,而本发明提供的AHA-R2-CCS水凝胶敷料组形态与未辐照组几乎一致,并未观察到染蓝细胞。
性能测试9
探究AHA-R2-CCS水凝胶敷料对小鼠新辅助放疗伤口愈合的影响。
选取5-8周龄BALB/c小鼠,背部脱毛,局部辐照背部皮肤5次6Gy,照射间隔1 d,共计30 Gy。最后一次辐照后,麻醉后手术切除背部皮肤,造成对称伤口(直径5 mm),当天给药,分别用AHA、AHA-CCS、AHA-Arg-CCS、AHA-R2、AHA-R2-CCS连续涂抹伤口7 d,观察7 d,拍照记录伤口情况,结果如图23所示,图23为分别用AHA、AHA-CCS、AHA-Arg-CCS、AHA-R2、AHA-R2-CCS处理的各组小鼠伤口修复结果图。由图可知,本发明提供的AHA-R2-CCS水凝胶敷料具有良好的促进修复效果。
停止实验,并将小鼠处死,收集伤口部位皮肤。皮肤组织取样、固定、脱水、包埋、切片。将水化后的组织样本的切片使用PBS溶液浸泡清洗,每次浸泡5 min,总共清洗3次。之后用移液枪吸取已经预先配制好的苏木素染色液,每个组织切片滴加100 μL,充分染色10min。染色完毕后使用蒸馏水洗去多余的苏木素染色液。然后再使用1%的盐酸乙醇进行分化,使细胞核中结合过多的染液和细胞浆中的多余的染液被除去。分化完成后,再用双蒸水将组织切片冲洗干净。为了使苏木素染蓝色,使用弱碱性的促蓝液加入组织切片中,让细胞核染蓝色。反蓝结束后先用清水进行清洗,再用双蒸水将组织切片冲洗干净。加入伊红染液,并使组织可以充分染色3 min,染色完毕后,再将组织切片进行梯度脱水,分别使用浓度为80%、95%以及无水乙醇进行操作。80%的乙醇脱水5 s,95%乙醇脱水2 min,无水乙醇脱水2min。将脱水后的组织样本切片使用二甲苯浸泡2次,每次持续4 min,然后将组织样本切片,并使用中性树胶封片。最后在显微镜下观察并拍照,结果如图24所示。图24为分别用AHA、AHA-CCS、AHA-Arg-CCS、AHA-R2、AHA-R2-CCS处理的各组小鼠伤口切片H&E和Masson染色情况结果。由图可知,相较于其他组弥漫性炎性浸润,AHA-R2-CCS水凝胶敷料组愈合良好,观察到其皮肤附件皮脂腺、汗腺、毛囊恢复。
综上,本发明提供的水凝胶敷料能够清除ROS且长效释放NO,对于辐射后的内皮细胞具有良好的促进迁移能力,显著降低细胞的DNA损伤,减少血管内细胞衰老,促进放疗后的伤口愈合,在辐射、糖尿病以及烫伤等导致的慢性皮肤损伤修复治疗中具有很好的应用前景。
需要说明的是,在本文中,诸如“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
以上所述仅是本发明的具体实施方式,使本领域技术人员能够理解或实现本发明。对这些实施例的多种修改对本领域的技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所述的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
