用于在外科程序期间或之前调节器官的温度的装置和方法
文献发布时间:2024-04-18 20:01:55
关于联邦政府资助的研究和开发的声明
无。
相关申请数据
本申请要求共同待决的美国临时申请序列第63/200,657号(2021年3月19日提交)和第63/265,834号(2021年12月21日提交)的权益,该临时申请的全部公开内容通过引用明确并入。
技术领域
本申请一般涉及在例如器官移植程序的外科程序期间使用的装置,并且更具体地,涉及用于维持诸如肾脏的移植器官所需的术前和/或术中温度的温度调节装置,以及使用此类装置的方法。
背景技术
肾脏移植是肾衰竭的目前最佳治疗。然而,三分之一肾脏移植患者(33%)经历移植肾功能延迟恢复(DGF),其被定义为移植受体在移植手术七天内需要透析。出现DGF的患者住院时间更长,排斥反应率更高,且移植物存活时间估计缩短三到五年(3-5年)。这些患者体内的移植物过早衰竭意味着,由于持续的免疫抑制治疗或移植手术,又要回到长期透析和高发病率,缺乏移植手术的益处。
人们认为,DGF的发病机制与器官获取和移植之间的时间段中持续的缺血性损伤有关。肾脏的新陈代谢主要是有氧代谢,这使得肾脏特别易受缺氧损伤和缺血的影响。低体温通过显著减少肾脏依赖能量的代谢活动而防止缺氧。移植手术的最佳肾脏低体温是在约一到两摄氏度(1-2℃)下实现的,而基于机器的冷灌注是在约四到八摄氏度(4-8℃)下实现的。器官移植团队在器官从捐献者身上取下后和在运输期间立即使用此防腐效果。尸体肾脏通常在至少低于四摄氏度(4℃)下包装和维持。然而,在受体移植手术期间,不存在有效方法来防止再次复温和随后发生的缺氧损伤。超过坏死阈值的肾脏升温最早开始于进入外科吻合程序的十分钟时。移植缝合时段期间供体肾脏升温(即第二次热缺血时间(“SWIT”))与较高的移植功能延迟率、移植物过早衰竭以及外科医生对高风险肾脏的低接受率是独立关联的。对于解剖结构复杂的患者和肾脏、儿科患者、微创手术和肥胖症患者来说,SWIT会延长。
将SWIT缩短到30分钟(30分)以内可以将发生DGF的风险降低3.5倍。此外,通过在移植期间将移植物冷却到约四摄氏度(4℃)的目标温度来消除热缺血,这可以将大多数细胞的新陈代谢降低到正常水平的百分之五到百分之八(5-8%),并降低酶的活性,从而最大限度地减少缺血性损伤。这显著降低DGF,并改善器官功能。
仍然需要一种在移植手术期间控制器官的温度的可靠方法。能够在移植程序前和/或期间调节肾脏或其他器官的温度的装置或方法将是有用的。
发明内容
本申请涉及与器官移植程序有关的医疗装置,以及更具体地,涉及这样的装置,该装置用于有利于涉及移植器官的手术和/或用于器官的低体温处理,例如以将诸如肾脏的移植器官维持在所需的术前和/或术中温度,并且涉及使用此类装置例如以改善外科程序期间工作流程的方法。
本文中的装置和方法有利于在手术期间肾脏或其他器官的术中处理。器官的意外滑动可以被减少并且装置可以附接到牵开器(例如Bookwalter或Thompson牵开器)和/或附接或夹紧到外科帘,这可以解放助手的双手,使其在血管吻合术期间更有效地协助外科医生。诸如牵引手柄、温度传感器和方向指示器的其他装置属性可以在吻合术期间为外科医生提供视觉和触觉支持。在一些示例中,装置不具有在移植外科医生工作时妨碍该医生的管道或附件。相比于传统装置,该装置可以具有小体积,而传统装置(尤其与带有外部管道的那些装置)可能妨碍例如在吻合术期间使用的精细缝合线等。传统装置不能将器官冷却足够长时间和/或不可持续冷却器官,可能改变程序的工作流程,并且可能不易用于肥胖患者或解剖结构复杂的患者。
根据一个示例,提供一种装置,该装置用于(例如在术前或术中)调节从供体移植到受体的器官的温度,该装置包括壳体,该壳体包括围绕尺寸设计成容纳器官的内部空腔的一个或多个壁,以及用于进入该空腔的开口,其中壁中的一个或多个包括:内层,该内层限定用于接触在空腔中放置的器官的内表面;外层(例如隔热层),该外层限定壳体的外表面;以及在内层和外层之间的冷却层,该冷却层被配置成通过内层吸收空腔内的器官的热能。
根据另一个示例,提供用于调节器官的温度的装置,该装置包括壳体,该壳体包括围绕尺寸设计成容纳器官的内部空腔的一个或多个壁,以及用于进入该空腔的开口,壁中的一个或多个包括包含相变材料的冷却层,该相变材料被配置成通过内层从空腔内的器官吸收热能。
可选地,在本文装置中的任一个中,外壁可以包括具有低导热性的材料,以使冷却层暴露于外部温度最小化。
可选地,在本文装置中的任一个中,内壁可以包括具有高导热性的材料,以使器官暴露于冷却层最大化。
可选地,装置可以包括一个或多个紧固件,该紧固件用于至少部分闭合开口以固定空腔内的器官,例如,从开口的一个边缘彼此邻近地延伸的一对带子,一对带子可以穿过开口固定到壳体。
可选地,装置可以包括从壳体延伸的手柄,以有利于操纵壳体,例如,从与开口大致相对的壳体的后壁延伸的手柄。
可选地,装置可以包括壳体上的指示器,该指示器被配置成提供空腔内容纳的器官的解剖取向的视觉指示。
可选地,装置可以包括用于测量空腔内容纳的器官的温度的邻近内表面的温度传感器,以及用于提供测量温度的输出的输出装置。
可选地,装置可以包括计时器,该计时器被配置成在外科程序期间启用,以提供程序期间所耗用时间的指示。
可选地,装置可以包括邻近内表面的一个或多个传感器,该传感器用于测量空腔内容纳的器官的一个或多个特征,诸如超声或多普勒传感器,被配置成评估血管流量指标、电阻指数、肾脏外观中的一个或多个或获取囊下图像的传感器,和/或用于测量空腔内容纳的器官的温度的温度传感器。可选地,装置可以包括用于将(一个或多个)传感器获取的数据传输到远程装置的无线发射器。
可选地,装置可以包括安装在壳体上的GPS跟踪装置,以使得能够监测装置的位置。
可选地,装置可以包括与开口邻近的一个或多个灯,例如以照亮邻近开口的外科区域。
根据另一个示例,提供用于冷却器官的方法:提供壳体,该壳体包括围绕内部空腔的一个或多个壁,其中壁中的一个或多个包括外绝缘层和邻近空腔的内表面的冷却层;以及将器官放置在空腔内。
本发明的其他方面和特征通过结合附图理解以下描述而变得显而易见。
附图说明
结合附图阅读下面的详细描述,可以更好地理解本发明。需要强调的是,根据惯例,附图中的各种特征和设计元件并非按比例绘制。相反,为了清晰起见,各种特征和设计元件的尺寸经任意扩大或缩小。附图中包括以下各图。
图1A和图1B是概述示意图,其示出从夹紧主动脉和提取供体肾脏到植入受体中的当前肾脏移植程序中涉及的温度时期,图示了第一热缺血期、冷缺血期和第二热缺血期。
图2示出常用技术,该技术用于使用纱布、碎冰和外科夹钳和/或牵开器来冷却并提供供体肾脏的抓取表面。
图3示出用于在移植程序之前和/或期间调节器官的温度的装置的示例。
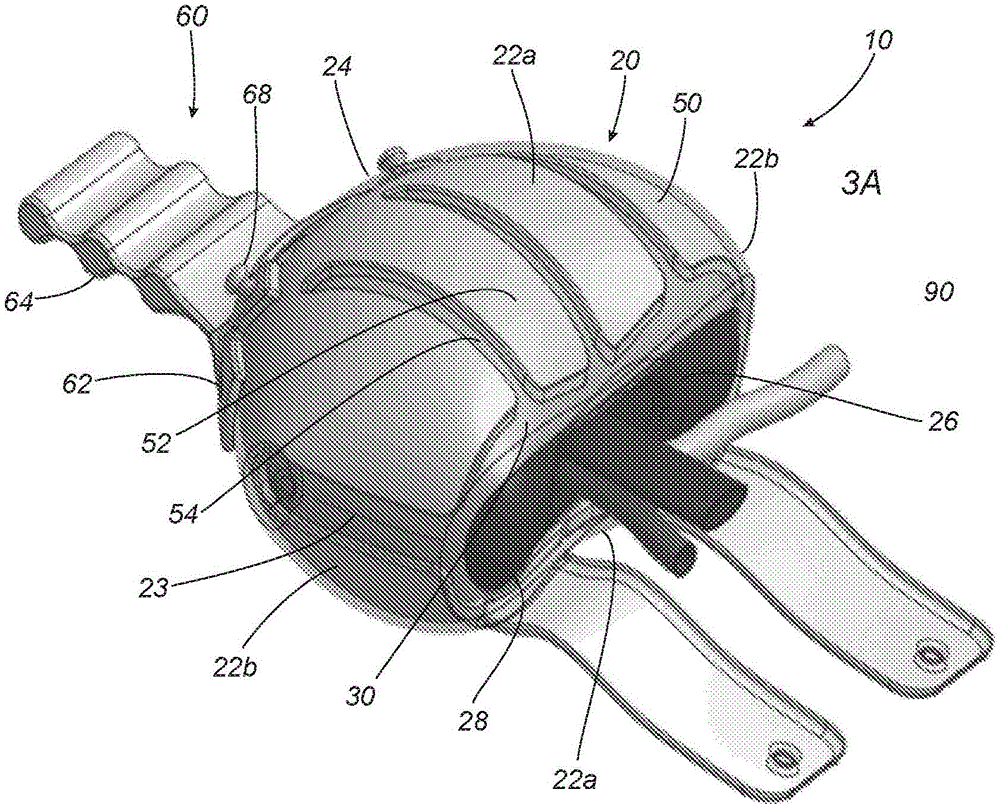
图3A是截面细节图,其示出图3的装置的壁的构造。
图4A-图4D是图3的装置在容纳器官之后以及在收拢带子以将器官固定在其中之前的各种视图。
图4E-图4H是图3的装置在将带子固定以将器官固定在其中之后的各种视图。
图5A-图5D示出低体温装置(hypothermic device)的替代示例,该低体温装置包括装置壳体的下壁中的开口和延伸穿过下壁以将器官固定在装置内的带子。
图5E是图5A-图5D的装置的截面,其示出装置中容纳的肾脏。
图6A-图6D示出在移植程序期间使用诸如图3的装置的低体温装置的示例性方法。
图7A-图7C示出低体温装置的替代示例,该低体温装置包括可以包裹器官的柔性壳体。
图8是用于调节器官温度的装置的示例的示意图,该装置包括内部静态冷却部。
图9是用于调节器官的温度的装置的另一个示例的示意图,其中冷却层包括多个流体通道和用于从外部储罐通过流体通道循环冷却剂的泵。
图10示出用于调节器官的温度的装置的示例,其中冷却层包括用于容纳来自外部源的冷却剂的多个流体通道,其可以被包括在图9的装置中。
图11是用于调节器官的温度的装置的另一个示例的示意图,其中冷却层包括多个流体通道和用于通过流体通道在内部循环冷却剂的泵。
图12A-图12D示出向移植用器官提供冷灌注的示例性方法。
图13示出用于调节器官的温度的装置的示例,其中冷却层包括由外部热交换器控制的多个热电元件。
具体实施方式
在描述示例前,应理解本发明并不局限于所描述的特定示例,因为此类示例当然可以变化。同样应理解,本文中使用的术语仅用于描述特定示例,并不具有限制性,因为本发明的范围仅受所附权利要求书限制。
在提供数值范围时,应理解,除非上下文另有明确规定,否则也已具体公开该范围的上限和下限之间的每个中间值(达到下限的单位的十分之一)。本发明涵盖所述范围中的任何所述值或中间值与所述范围中的任何其他所述值或中间值之间的每个较小范围。这些较小范围的上限和下限可独立地包括或不排除在该范围内,并且在任一个、零个或两个限值包括在较小范围中的情况下每个范围也包括在本发明中,但须受限于所述范围中任何明确排除的限值。在所述范围包括限值中的一个或两个的情况下,不包括这些所包括限值中任一个或两个限值的范围也包括在本发明中。
除非另有限定,否则本发明中使用的所有技术和科学术语的含义与本发明所属技术领域的普通技术人员通常理解的含义相同。尽管与本文所述方法和材料相似或等效的任何方法和材料都可以用于实践或试验本发明,但现在只描述一些可能的和示范性的方法和材料。
须注意,如本文及所附权利要求书中所使用的,除非上下文有明确规定,否则单数形式“一”、“一个”和“该/所述”包括复数指代。因此,例如,“一种化合物”包括多种此类化合物,并且对“该聚合物”的引用包括本领域技术人员已知的一种或多种聚合物及其等同物,如此等等。
某些范围在本文中用冠以术语“约”的数值来呈现。术语“约”在本文中用于为其前面的精确数字以及接近或近似于该术语前面的数字提供字面支持。在确定一个数字是否接近或近似于具体表述的数字时,接近或近似于未表述的数字可以这样的数字,该数字在其呈现的上下文中提供该具体表述的数字的实质等同物。
终末期肾病(ESRD)的患者的肾脏工作不佳,不足以维持生命。目前,对生命危险的患者进行的治疗是长期透析或肾脏移植。因为接受肾脏移植的患者比接受长期透析的患者具有显著延长的预期寿命,所以肾脏移植是这些患者的最佳治疗。
目前,肾脏移植的治疗标准(“SOC”)在外科医生从捐赠者身上摘除肾脏时开始。当肾脏停止接收含氧血液时,细胞开始无氧代谢,从而导致耗尽ATP储存且释放有害副产品。这些事件导致细胞死亡和器官功能障碍,并且需要在持续许多小时内得到缓解,才能为受体保存捐赠肾脏的存活能力。冷却是缓解缺血性损伤和保留供肾活力的所熟知方法。在不导致细胞冻结和破裂的情况下,尽快将供体肾脏的温度降至约2-6摄氏度(2-6℃),可减慢无氧代谢,这进而减慢细胞死亡的进程。为了讨论受体肾脏在其从供体移除之后用于低体温处理的当前SOC,图1A和图1B示出在移植过程的三个阶段期间肾脏的(假设)温度:阶段1——供体手术;阶段2——运输;阶段3——受体(即移植者)手术。
参与移植过程每个阶段的临床团队的一个目标是减少热缺血性损伤,即肾脏在高温下得不到血液和氧气灌注时所经历的时间。在阶段1,移植团队试图通过从捐献者体内移除肾脏并通过立即将其放在冰上或经其他冷却方法冷却该器官来减慢缺血性损伤。这样做的目的是尽快将肾脏的温度从体温(图1B中显示为三十七摄氏度(37℃))降至目标温度(例如,约一至七摄氏度(1-7℃)),并且减少器官的第一热缺血性损伤(“FWII”)。
在阶段2中,肾脏从捐献者运送到患有ESRD的预期受体。受体可以与捐献者处在相同医院中,也可在全国各地;因此,阶段2的持续时间通常在2到18小时(或更长)之间。幸运的是,FDA批准的多种装置都适用于在阶段2期间对肾脏进行安全有效的低体温处理。这些装置能够使器官在运输期间维持在目标温度下。
在阶段3——受移植者手术期间,需要装置,以对供体肾脏进行低体温处理。在阶段3发生的第二热缺血性损伤(“SWII”)与受体的不良短期和长期结果以及所移植肾脏过早衰竭有关。由于缺血损伤是累积性的,即SWII会增加FWII,所以SWII也导致减少可用供体肾脏库。移植外科医生意识到这一事实,因而增加他们为其患者拒绝的供体肾脏数量(例如,从心脏事件后死亡的供体处获得的肾脏)。除了由SWII对受体的肾脏造成的直接伤害外,对受体的间接伤害可以来源于移植程序的时效性。外科医生意识到SWII,因此尽快完成吻合术,这反而可能导致错误和外科并发症。
例如,如图2所示,在阶段3期间减轻SWII影响的SOC是在为受者准备手术时,将肾脏包裹在纱布和冰块中。然而,这并未一致地用在手术的吻合部分,这是因为使用这些临时冷却方法完成手术步骤存在技术难度。当肾脏不再由纱布和冰块围绕时,该器官迅速升温并且可以在十分钟内达到十五摄氏度(15℃)。随着受体肾脏升温,与将肾脏保持冷却时相比,肾脏的缺血性损伤速度高了六倍。外科医生可能尚未意识到温度升高的速度及其对肾脏的影响,因为阶段3期间没有测量器官的术中温度,并且因此,外科医生一直专注于尽快完成吻合术。
转到图3,示出装置10的示例,该装置用于对诸如肾脏的器官90进行低体温处理,例如,用于调节从供体移植到受体的器官90的温度,特别是在阶段3的术前和/或吻合程序期间的术中温度。可以理解,装置10还可以在其他时段使用,例如,在从供体移除器官(阶段1)后立即储存器官、在运输期间(阶段2)储存器官和/或在术前,例如,在备用工作台准备期间储存器官。此外,本文中的装置和方法还可以有利于外科植入程序,例如,诸如在器官的血管与受体血管连接的吻合程序期间加强外科工作流程。此外,本文中的装置和方法还可以有利于微创和/或机器人程序,例如以有利于在植入程序期间冷却、定位和/或操纵器官。
尽管本文中的装置和方法是具体参考肾脏移植进行一般描述的,但可以理解,该装置和方法可以用于移植其他器官,例如心脏、肺或肝脏,或移植物和/或其他结构,诸如心脏瓣膜、血管移植物、四肢或其他身体部位和类似物。此外,本文中的装置还可以用于包围或储存用于移植或其他手术(例如,在采购、运输和/或受体手术期间)或其他患者护理领域的流体溶液、保存溶液、血液、血浆、药物和/或其他温敏材料的袋子或其他容器,以便在所需持续时间内将材料维持在所需温度。例如,该装置可以在采集期间和/或在备用工作台准备期间冲洗供体器官时用于覆盖或容纳保存溶液以使其冷却。
一般来说,如图3所示,装置10包括壳体20,该壳体20包括围绕尺寸设计成容纳器官90的内部空腔或隔间26的一个或多个壁22、24,以及用于进入空腔26的开口28。例如,壳体20可以包括彼此相对的从而围绕空腔26的上侧壁和下侧壁22a以及端壁22b,以及与开口28相对的以另外包围空腔26的后壁24。在所示示例中,上下壁22a可以长于端壁22b,例如,使得壳体20限定例如与肾脏形状对应的长圆形或其他细长形状。
此外或替代地,壁22、24也可以是圆形和/或其他形状,以便在空腔26内以最小空气空间容纳肾脏。例如,图5A-图5D示出与装置10大致类似的替代装置10',不同之处在于,例如从图5B中清晰可见的,壳体20'具有大致肾形的截面。如图所示,壳体20'包括可以一体形成在一起的凸形或其他圆形的上壁22a'、相对的侧壁22b'、第一端壁22c'和第二端壁22d',以及包括开口28的下壁22e'。侧壁22b'可以长于端壁22c'、22d',而下壁22e'可以具有部分凹面或平坦形状,从而限定肾形截面。
回到图3,壳体20的壁22、24可以例如由柔性材料一体形成在一起,以提供具有大致固定尺寸的开口28的外套或套筒,器官90可以通过该开口插入空腔26中。替代地,可以提供一个或多个间隙、狭槽、铰链或其他特征(未示出),例如,沿端壁24的狭槽23,从而使得壳体20能够为了有利于放置器官90而打开,并且然后围绕器官90闭合,例如围绕器官折叠或以其他方式包裹器官,以使空腔26内器官90周围的空间最小化。在另一种替代形式中,可以提供例如具有不同尺寸和/或形状以适应不同尺寸器官的多个装置,使得可以为正在移植的特定器官选择合适装置,例如以便使器官90周围空腔26内的空气空间最小化。
再参考图3A,壳体20的一个或多个壁22可以采用多层结构来构造,例如,在壳体20的一个或多个壁内封装诸如相变凝胶或其他冷却剂的冷却材料。例如,如图所示,壳体20的一个或多个壁22可以包括:内层30,该内层限定用于接触放置在空腔26中的器官90的内表面32;外层40,该外层限定壳体20的外表面42;以及冷却层50,该冷却层位于内层30和外层40之间。
在一个示例中,内层30和外层40可以由柔性材料形成,例如诸如水凝胶的聚合物材料、诸如硅酮的弹性材料和类似物。材料可以是弹性的和/或另外可拉伸的,也可以是无弹性的,例如具有限定尺寸和形状。内层30可以具有一定的厚度和/或相对较高的导热性,以便于将热能从空腔20中容纳的器官90转移到冷却层50。相反,外层40可以有一定的厚度和/或相对较低的导热性,以使冷却层50最小地暴露到外部温度。内层30和外层40可以独立形成并且然后例如用粘合剂、熔合、声波焊接和诸如此类的一种或多种粘合方式永久附接在一起,或者可以例如通过模塑、铸造、3D打印和诸如此类整体形成在一起。
此外或替代地,壳体20中还可包含其他材料,例如编织纺织品、陶瓷纤维和类似物,例如以提供所需热特性和/或为壳体20的内表面32和/或外表面42提供所需的光洁度。可选地,外层40可以包括一个或多个额外隔热特征,例如气袋、泡沫填充物和类似物(未示出),以降低外层40的导热性。此外或替代地,例如,如果一个或多个壁由弹性或可拉伸材料形成,则(一个或多个)壁可以包括偏压机构,例如,嵌入壁内或以其他方式附接到一个或多个壁的一个或多个带状弹簧或其他结构(未示出),以为壳体20提供所需的形状和/或结构完整性。可选地,此类偏压机构可以是可展开的,例如,使得壳体20可以拉伸或以其他方式展开,以适应在空腔26中容纳器官。在释放时,偏压机构可以压缩壳体20,例如以使器官90周围的空气空间最小化和/或以其他方式加强将器官90固定在壳体20内。
冷却层50可以包括相变材料,该材料经组成以将空腔26和其中的器官90维持在所需的温度范围内,例如,约一至七摄氏度(1-7℃)之间、约二至六摄氏度(2-6℃)之间或约四摄氏度(4℃)之间。相变材料可以包括相变凝胶,即通过从固相变为液相来吸收热能。在此相变期间,相变凝胶维持基本恒定的温度,从而通过内层30从器官90吸收热能,以将器官90维持在所需的温度范围内。相变凝胶的示例材料可以包括已知的生物相容性相变凝胶,诸如1-正癸醇(癸醇)、正十四烷(正-TD)和类似物。
在图3所示的示例中,相变材料密封在内层30和外层40之间的多个单元格或区域52内(图中用影像示出冷却层50),例如使得相变材料与内部空腔26隔离。如图3所示,冷却层50的单元格52可以例如通过间隙54而至少部分地相互隔离。此类间隙可以加强内层30和外层40之间的连接和/或增强壳体20的整体结构完整性。替代地,相变材料可以连续地提供在内层30和外层40之间,例如,密封在其间以防止相变材料在使用期间泄露,例如,内层30和外层40通过一个或多个接缝或其他连接点(未示出)连接在一起。在另一种替代形式中,冷却层可以只被包含在装置的一些壁中。例如,图5A-图5D中所示的装置10'可以主要在顶壁22a'和端壁22c'中包括冷却层,这两个壁可以充分围绕壳体20'的内部空腔26',以充分冷却在其中容纳的器官90。
在另一种替代方案中,相变材料可以容纳在壳体20壁内的单独袋或腔室中,例如,在可拆卸或永久固定在壳体20内的密封袋中(未示出)。例如,如果装置10是可重复使用的,则可以将之前程序中的相变材料在对壳体20进行清洁和灭菌之后移除,并用新相变材料替换。否则,如果装置10是一次性使用的,则相变材料可以永久密封在壳体20的壁内,使得整个装置10可以在程序之后丢弃。
可以选择冷却层50的厚度和相变材料的位置,以在空腔26周围提供所需的相变材料体积,从而在所需时长内维持器官90的所需温度,例如,在约四十五分钟到七十分钟(45-70min)之间,在约二十分钟到六十分钟(20-60min)之间,在约三十分钟到六十分钟(30-60min)之间,或者更长时间(如果需要的话),例如在延长的运输时间段内。在一个示例中,冷却层50的厚度可以在约十分之一到三厘米(0.1-3.0cm)之间,或者在约一到三厘米(1.0-3.0cm)之间。
可选地,装置10可以包括一个或多个有利于装置10的操纵的特征。例如,如图所示,可以在壳体20上提供手柄60,其例如可拆卸地安装到后壁24,如图4A-图4D清晰可见的。在所示的示例中,手柄60包括尺寸和/或形状设计成与后壁24一致的底板62和从底板62延伸的刚性牵开器手柄64,其例如基本上垂直于底板62。如图所示,牵开器手柄64可以具有包括多个抓取特征的刀片形状,这可以有利于例如在运输期间和/或在吻合程序期间操纵装置10。牵开器手柄64还可以包括一个或多个连接器或其他特征(未示出),其有利于将装置连接到牵开器和/或其他外科装置,例如以将装置10稳定在外科区域内。
底板62和后壁24可以包括一个或多个配合连接器,例如棘爪、卡扣和类似物(未示出),以将手柄60机械地固定到壳体20,同时允许在需要时移除手柄60。此外,如果壳体20包括一个或多个传感器或其他电气部件(例如,如本文其他部分所述),则底板62和后壁24可以包括一个或多个电气连接器,其在手柄60附连到壳体20时耦连在一起。此类可拆卸的手柄60可以有利于操纵,同时在不需要时可拆卸,例如以有利于存储和/或使装置10的外形最小化。替代地,手柄60可以通过用粘合剂粘合、熔接、焊接、机械连接器和类似物中的一种或多种方式(未示出)永久附接到壳体20,例如,附接到后壁24。
可选地,如图4A清晰可见,可以在底板62上提供指示器66,例如以提供容纳在空腔26内的器官90的解剖取向的视觉指示。例如,如图所示,指示器66可以提供在手柄60的底板62上,其包括沿壳体20的长度(例如,与侧壁22a平行)对齐的人体的呈现。指示器66可以有利于医生或其他用户将器官90以与正确的解剖学取向对应的取向插入空腔26中,例如,器官的顶部朝向指示器66的头部取向。此外,例如,如本文其他部分所述,在植入程序期间,外科医生和/或其他用户可以在开始吻合术之前,将装置10贴着受体定位,其中指示器66相对于受体的身体处于适当取向。此外或替代地,如果需要,还可以在壳体20外表面42的其他位置上提供一个或多个其他可视指示器,以另外有助于将器官90放入装置10中和/或在植入程序期间。
可选地,装置10可以包括一个或多个紧固件或其他特征,用于至少部分闭合开口28和/或以其他方式固定容纳在空腔26内的器官90。例如,如图3所示,可以邻近开口28提供一对带子70,其可以穿过开口28而被固定。如图所示,每个带子70包括附接到开口29的一个边缘的第一端72和第二自由端74,第一端72例如通过粘合剂粘合、熔合、焊接、缝合和类似方式中的一种或多种方式被永久附接。带子70可以根据需要由与例如带或不带冷却层的壳体20类似的材料制成。
带子70的自由端74和壳体20可以包括用于将带子70固定到壳体20的配合连接器,使得带子70可以穿过开口28延伸并且被固定,从而防止器官90从空腔26中掉落或移出。例如,如图4A-图4B清晰可见的,每个自由端74可以包括孔眼或其他开口76,而对应柱或按钮68可以提供在手柄60的底板62上,使得例如,如图4E-图4H所示,自由端74可以围绕壳体20的外表面42和容纳在孔眼76中的柱68包裹。可选地,如果壳体20由柔性材料形成,则将带子70包裹在开口28上和外表面42周围可以将相对的边缘拉近,例如以使器官90的暴露最小化和/或进一步将器官90固定在空腔26内。
如图所示,带子70沿开口28的同一边缘附接并且彼此间隔开,使得开口28的一部分29在带子之间保持敞开,以允许空腔内容纳的器官90的血管或其他结构92从壳体20延伸。例如,如本文其他部分所述,如果器官90是肾脏,则髂血管92可以从开口28的中央部分29延伸,这可以有利于完成吻合程序,而无需移除肾脏90。
虽然图中示出孔眼76和柱68,但可以理解,该连接件可以颠倒变化,或者其他连接件可以提供在带子70的自由端74和壳体20上,诸如夹子、扣子、磁铁和诸如此类(未示出)。此外,壳体20上的连接器可以被提供在外表面32上的其他位置处,而不是手柄60的底板62上,并且带子70的长度也可以被改变以适应其他位置。此外或替代地,也可以在壳体20和/或带子70上提供多个连接器,例如,一排柱或孔眼(未示出),其使得带子70能够在一个或多个位置处固定到壳体20,例如以使得在固定连接器之前带子70能够更紧和/或进一步闭合开口28。
替代地,如图5A-图5D所示,一对带子70'可以被提供在下壁22e'的一个端部处(例如,邻近端壁22c'附接),并且可以具有足够的长度以延伸穿过开口28',使得带子70'的自由端74'可以被固定到下壁22e'的另一端,例如,邻近端壁22d'。壳体20'和带子70'的端部74'可以包括配合连接器(未示出),其可以用于可释放地固定带子70',例如以将器官90固定在壳体20'内,例如,图5E所示。如图5A所示,带子70'可以间隔开,使得器官的动脉和静脉血管92可以从带子70'之间的空腔26'延伸,如本文其他地方所述,这可以有利于完成吻合术。在器官为肾脏的示例中,输尿管94可以位于空腔26'内,例如以在吻合术期间使输尿管远离外科区域,如本文其他部分另外所述。
可选地,图3的装置10(或本文中的其他装置中任一个)可以包括一个或多个额外的闭合特征,例如以至少部分闭合开口28。例如,一条或多条拉绳可以被至少部分地提供在开口28的周边处(未示出),该拉绳可以被拉动或以其他方式被操纵,以例如在固定带子70之前或之后至少部分地收缩开口28。然后,拉绳可以打结或以其他方式固定,以维持收缩状的开口28。当需要移除器官时,可以解开、切断、松开和/或以其他方式释放拉绳,以允许开口28扩大。此外或替代地,如果需要的话,此类拉绳或其他约束特征(未示出)还可以被提供在壳体的壁内的其他位置处,以允许壳体在容纳器官之被压缩。
此外或替代地,装置10还可以包括一个或多个带子、袋或其他特征(未示出),以有利于存储从空腔26中容纳的器官90延伸的一个或多个结构和/或控制从空腔26中容纳的器官90延伸的一个或多个结构的暴露。例如,在肾脏的情况下,可能期望暴露肾血管92,例如以有利于与受体的髂血管进行吻合,同时例如通过邻近开口28或在该开口内固定输尿管,来挡住肾门脂肪(kidney's hilar fat)和/或输尿管。
可选地,图3的装置10(或本文中其他装置中的任一个)可以包括一个或多个电气部件。例如,一个或多个温度传感器(未示出)可以被提供在壳体20的内表面32上或以其他方式提供成邻近该内表面,以测量空腔26中容纳的器官90的温度。(一个或多个)传感器可以耦连到壳体20上的处理器和/或输出装置,例如以向外科医生和/或装置10的其他用户提供测量温度的输出。例如,如图6A和图6B所示,显示器80可以安装在手柄60上,该显示器可以耦连到(一个或多个)传感器,以显示测量温度的数值,使得用户可以确认器官90正被维持在所需温度下。此外或替代地,还可以提供其他输出装置,例如,可发出与器官90的状态对应的颜色的一个或多个灯或变色材料,例如,包括指示器官90正被维持在所需温度范围内的绿灯和/或指示器官90在所需范围外的黄灯或红灯。替代地,例如,如图5A所示,此类显示器和/或指示器80'也可以被提供在其他位置处,例如在壳体20'的上壁22a'上。
可选地,图3的装置10(或本文中其他装置中的任一个)可以包括例如与(一个或多个传感器)和/或显示器或处理器耦连的无线发射器,例如以将温度数据传输到诸如手机、平板电脑、计算机和类似物(未示出)的远程电子装置,以使得用户能够监测温度。此外或替代地,装置10还可以包括一个或多个附加传感器,例如,超声波和/或多普勒传感器,其可以耦连到处理器(和/或与远程装置通信),以评估空腔26中容纳的器官90的一个或多个特征,例如,以评估血管流量指标(包括电阻指数)、肾脏外观,和/或可以获取囊下图像。此外或替代地,装置10还可以包括GPS跟踪装置(未示出),该装置可以耦连到处理器和/或无线发射器,以使得例如在运输期间能够监测装置10的位置。
可选地,图3的装置10(或本文中其他装置中的任一个)还可以包括例如在开口28周围或以其他方式邻近开口28的一个或多个光源,例如安装到壳体20的一个或多个LED(未示出),该光源可以启用以照亮邻近开口28的区域,例如以在吻合术期间照亮外科区域。此外或替代地,装置10还可以包括计时器(未示出),其例如安装在手柄60上和/或包括在显示器80上,该显示器可以用于监测耗用的时间。
转到图6A-图6D,示出使用装置10(诸如图3中所示的装置)的示例性方法(但是该方法适用于本文所述的所有装置)。在阶段3开始时,例如,如图1A和图1B所示,肾脏或其他移植器官90可以从用于在阶段2期间冷却器官90的运输介质(例如灌注机器或在冷却器内的冷藏库(未示出))中移除。然后,器官90可以按照标准方式经历移植用备用工作台准备,而在完成后,器官90可以保存在由冰块围绕的雪泥(威斯康星州(Wisconsin))溶液中,以将其温度维持在4±3℃下。
可选地,该装置10可以在器官采集和/或运输期间使用,例如以将器官90维持在特定温度范围内和/或提供运输期间温度变化信息。此外或替代地,装置10也可以在植入到受体前在器官90的备用工作台准备期间使用。
在使用前,装置10可以存放在冷冻箱、冰箱和/或其他条件下,例如以防止相变材料或其他冷却剂升温。当要使用装置10时,例如,紧接在移植程序的任何阶段之前或期间,可以将装置10从储存器中移除,并且使其达到容纳器官90的适当温度。
例如,在受体的髂血管暴露期间,装置10可以从冷冻箱中移除,并且被放置在冰上或雪泥机内一段时间。紧接在吻合术前,器官90可以从雪泥溶液中移除,放置在装置10的空腔26内,并且固定带子70可以用于将器官90固定在装置10内部,例如,如图6A所示。可选地,装置10和其中的器官90可以连接到邻近受体的一个或多个结构,例如一个或多个牵开器(未示出),以相对于外科区域来稳定装置10。例如,手柄60可以固定到牵开器或其他结构,这可以有利于例如在开腹程序、微创程序或机器人程序期间稳定装置10。
可选地,装置10上的计时器可以被启用,以开始跟踪吻合时间和/或器官表面温度测量结果。例如如图6B所示,在肾脏移植方面,装置10可以保持肾脏90,使得肾静脉和肾动脉92被暴露,而装置10可以被定位成邻近受体身体,使得肾脏90的肾静脉和肾动脉92容易接近,以便缝合,同时肾脏90保持在装置10内并冷却。然后,将静脉和动脉92与受体内的相应髂血管缝合。可选地,装置10可以包括一个或多个带子、袋或其他特征(未示出),以有利于存储从空腔26中容纳的器官90延伸的一个或多个结构和/或控制该结构的暴露。例如,在肾脏的情况下,可能需要暴露髂血管92,例如以有利于与受体的血管进行吻合,同时例如通过邻近开口28或在该开口内固定输尿管,而挡住肾脏的输尿管。
在完成吻合术并且松开受体的髂动脉和静脉后,可以再次按下装置10(如果包括的话)上的计时器,以发出吻合术结束的信号,并且然后记录吻合术总时间。如图6C和图6D所示,带子70可以从壳体20上释放,并且装置10可以从器官90周围移除,并从外科区域移除。因此,可以理解,装置10可以有利于冷却器官90,同时允许迅速接近器官90的血管92,这可以有利于植入程序期间的工作流程,从而例如有利于吻合术。
然后,可以按SOC进行输尿管与膀胱的吻合术和/或其他剩余程序。可选地,在完成吻合程序之后,器官90可以留在装置20内,例如,同时对器官90进行灌注和/或调节术后器官的复温。
转到图7A-图7C,示出低体温装置10'的替代示例,其可以具有一般构造,并且包括上述关于装置10所述的特征中的任一个。在此替代形式中,壳体20'包括沿共用边缘23'附接的上壁22a'和下壁22b'。例如使用本文其他部分所述的类似材料和方法,可以将壁22a'、22b'整体形成在一起,或分开形成,并且然后将它们沿边缘23'附接。类似于装置10,一个或两个壁22a'、22b'可以包括冷却层,例如包括一个或多个相变材料区域(未示出)。例如,壁22a'、22b'可以相对于彼此移动,例如使得壳体20'可以打开,例如平放,以适应将器官90放置在壳体20'内。例如,如图7B所示,在壳体20'打开的情况下,可以将器官90放置在下壁22b'上,并且然后如图7C所示,将上壁22a'被折叠或以其他方式定位在器官90上,然后带子70'被固定,这与装置10类似。
在此壳体20'的情况下,从共用端23'延伸的壁22a'、22b'的侧边缘可以保持分开,例如,仅彼此邻近和/或部分重叠。替代地,可以沿着侧边缘设置一个或多个拉绳、卡扣和/或其他连接器(未示出),它们可以被连接以将侧边闭合和/或以其他方式固定在一起。一旦器官90被固定在壳体20'内,就可以用与本文中的其他装置类似方法来使用装置10'。
转到图8,示出低体温装置的示意图,该装置可以包括关于装置10所描述的部件中任一个。如图所示,壳体20可以包括静态冷却部件50,例如,封装或以其他方式固定在壳体20的一个或多个壁内的含有相变材料的冷却层(未示出)。例如,与装置10类似,壳体20可以包括覆盖在冷却部件上的外层40,例如包括热绝缘材料,以使通过装置10的外表面的热量损失最小化。可以理解,还可以在壳体20内提供其他静态冷却材料和/或系统,以调节壳体20内容纳的器官90的温度。如图所示,装置10还包括耦连到显示器80的温度传感器82,例如在壳体20的内表面上或邻近内表面,该传感器可以提供器官90的温度读数,例如,如本文其他部分所述。
转到图9,示出低体温装置110的另一个示例的示意图,该装置包括壳体120,该壳体例如在壳体120的一个或多个壁内包含冷却部件150,并且该装置可以包括外层或其他热损失防止部件140,这类似于本文中的其他装置。如图所示,装置110包括耦连到显示器180的温度传感器182,并且可选地可以包括关于本文中其他装置描述的任何其他特征或部件。
与之前的装置不同,冷却部件150包括主动冷却系统,该系统包括泵152,泵可以用于例如以开环配置的形式在壳体120的一个或多个壁内循环冷却剂。例如,如图10所示,泵152可以与外部储罐或其他冷却剂源154以及壳体120的一个或多个壁(或以其他方式邻近内表面提供)内的多个流体通道154连通。如图10所示,外部管道158可以将储罐154与壳体120连接,以输送和移除由泵152循环的冷却剂。储罐154包含例如呈液相、气相或混合相形式的可流动冷却剂,该冷却剂可以通过通道进行冷却和循环,以传递壳体120内容纳的器官90的热能。例如,冷却剂可以包括以下中的一种或多种:诸如硅胶的可流动凝胶、微球凝胶、酒精、冷冻水(例如,温度在二至四摄氏度(2-4℃)之间或其他所需的温度)、在混合时产生吸热反应(endothermic reaction)的一组可流动化学品和类似物。
可选地,泵152或储罐154可以包括制冷系统或其他处理系统,例如热交换器(未示出),以例如在冷却剂通过通道156循环之后从该冷却剂中去除热能,以将器官90维持在所需的温度下。替代地,储罐154可以包括冷却剂源容器和水盛装器(未示出),使得来自初始源的冷却剂可以通过通道156循环并且然后移除并储存起来,不经处理和再返回通道156。
例如,与泵152耦连的处理器184可以包括温度调节算法,该算法可以基于来自温度传感器182的信号来控制泵152和/或储罐154的工作,以维持目标温度。这可以包括改变通过通道156的冷却剂流速和/或调整泵152输送的冷却剂的温度。
替代地,还可以提供除去任何外部储罐和/或管道的装置。例如,如图11所示,可以提供包括主动冷却部250的闭环配置的装置210。例如,泵252可以与壳体220内的内部储罐(未示出)和多个流体通道(也未示出)连通,以使冷却剂通过壳体220的一个或多个壁循环。泵252可以嵌入或以其他方式安装到壳体220,或者替代地,该泵可以在壳体220外部并且可以通过管道的一个或多个部段(未示出)与流体通道连通。装置210可以包括温度调节算法,例如与温度传感器282和泵252耦连的处理器284,以控制冷却系统的一个或多个参数,从而将器官90维持在所需温度下。
再转到图13,在另一种替代形式中,图中所示的低体温装置310包括多层壳体320,其包括热电冷却系统。例如,壳体320的一个或多个壁可以包括例如邻近内表面332的压电元件(未示出),该压电元件可以耦连到热交换器、处理器和/或电源384,以控制元件的启用和/或操作。例如,元件可以包括不同半导体层,该半导体层可以利用珀尔帖效应从壳体320内容纳的器官90吸收热能,例如以将器官90维持在所需的温度范围内。
转到图12A-图12D,示出为例如肾脏90的器官提供开环冷却的示例性系统和方法。例如,如图12A所示,带有球囊尖端320的导管310可以被插入输尿管92并且被充气。如图12B所示,冷却液或凝胶(诸如冷冻的2-4℃Wisconsin溶液或类似保存溶液)可以经由导管310的输液管腔被注入肾脏90,并且经由导管310的移除管腔(未示出)而被移除,以维持冷却的肾脏。在另一个示例中,冷却液经由单腔导管周期性地注入和排出。如图12C和图12D所示,完成吻合程序后,球囊320可以被放气并且导管310被移除。
在描述代表性示例时,说明书可以将方法和/或过程呈现为特定步骤顺序。但是,如果方法或流程不依赖于本文所述的特定步骤顺序,则方法或流程不应局限于所述的特定步骤顺序。本领域的普通技术人员可以理解,其他步骤顺序也是可以的。因此,说明书中所述步骤的特定顺序不应被解释为对权利要求的限制。
虽然本发明可以有各种改变和替代形式,但其具体实例已在附图中示出,并在本文详细描述。然而,应当理解的是,本发明并不限于所公开的特定形式或方法,相反,本发明涵盖落入所附权利要求书范围内的所有改变形式、等同形式和替代形式。
