一种(S)-BIONL衍生物CSP填料及制备方法和应用
文献发布时间:2023-06-19 09:29:07
技术领域
本发明涉及分析化学技术领域,尤其涉及一种(S)-BIONL衍生物CSP填料 及其制备方法和应用。
背景技术
手性是人类赖以生存的自然界的本质属性之一,生物大分子如蛋白质、多 糖、核酸等都具有手性,具有光学活性的手性物质广泛存在于动植物体内。近 几十年来,手性分离在科学研究领域以及工业,特别是生物、药物和农业领域 受到广泛关注。不同的对映体可能产生不同的生物学活性和毒性。因此,手性 识别和对映异构体的拆分研究对生物、医学及材料领域有着至关重要的实用价 值和理论意义。
高效液相色谱法(HPLC法)具有高效、快速、简单的优点,是分离光学异构 体和分析对映体纯度应用最广泛的方法,其中,手性固定相法(CSP法)由于高 效方便,既可用于分析分离,又可用于对映体的制备和半制备,已成为手性对 映体分离中最为引人注目的方法。20世纪70年代以来,CSP的研制得到了飞 速的发展,已有100多种液相色谱手性固定相被商品化。常用的手性固定相有 刷型CSP,环糊精及衍生物CSP,冠醚及衍生物CSP,大环抗生素CSP,多糖衍 生物CSP等等。但迄今为止,还没有一种CSP能够适应多种结构类型的对映体 分离及较高的对映体分离选择性,因此,不断研究开发新型手性固定相具有重 要的科学意义和应用价值。
1,1'-联萘酚(BINOL)具有C
发明内容
本发明的目的是针对上述问题,提供一种(S)-BIONL衍生物CSP填料及制备 方法和应用。该S构型的BIONL衍生物CSP填料对多种结构类型的手性化合物具有 较优的分离性能,可对多种结构类型的手性化合物进行分离,同时具有很好的 稳定性能,适合用作高效液相色谱填料。
为了实现上述目的,本发明的技术方案是:
一种(S)-BIONL衍生物CSP填料,其结构式如下所示:
其中,
作为对上述技术方案的改进,本发明并提供了一种上述(S)-BIONL衍生物 CSP填料的制备方法,其特征在于,该制备方法包括以下步骤:
SA1、对S构型的BINOL中的两个羟基进行MOM保护,在该化合物的3位 引入醛基,并将醛基氧化为羧酸甲酯;
SA2、将该羧酸甲酯进行水解得到相应的羧酸化合物,具有如下结构式:
SA3、将步骤SA2所得到的化合物与硅烷化试剂进行缩合反应,得到缩合 产物;
SA4、将步骤SA3得到缩合产物键合到酸化硅胶载体上,得到(S)-BIONL 衍生物CSP填料。
本发明另外还提供了一种上述(S)-BIONL衍生物CSP填料的制备方法,其 特征在于,该制备方法包括以下步骤:
SB1、将硅烷化试剂与酸化硅胶载体进行硅烷化反应,得到硅烷化硅胶;
SB2、对S构型的BINOL中的两个羟基进行MOM保护,在该化合物的3位 引入醛基,并将醛基氧化为羧酸甲酯;
SB3、将该羧酸甲酯进行水解得到相应的羧酸化合物,具有如下结构式:
SB4、将步骤SB3所得到的化合物键合到所述硅烷化硅胶上,得到所述 (S)-BIONL衍生物CSP填料。
作为对上述技术方案的改进,所述硅烷化试剂为3-氨基丙基三乙氧基硅烷 或3-氨基丙基三甲氧基硅烷。
作为对上述技术方案的改进,所述酸化硅胶载体由硅胶进行酸化得到。
作为对上述技术方案的改进,所述硅胶包括色谱用球形硅胶或无定形硅 胶。
作为对上述技术方案的改进,所述酸化使用的酸化试剂为盐酸,所述盐酸 的浓度为3~6mol/L,酸化时,所述硅胶与盐酸的用量比为硅胶10g:100mL。
作为对上述技术方案的改进,所述缩合反应的时间为3~4h。
本发明并提供了上述(S)-BIONL衍生物CSP填料的应用。
与现有技术相比,本发明具有的优点和积极效果是:
本发明的(S)-BIONL衍生物CSP填料,可对多种结构类型的手性化合物进行 分离,同时具有很好的稳定性能,适合用作高效液相色谱填料。实施例的数据 表明,本发明提供的(S)-BIONL衍生物CSP填料,在正相条件下能够拆分1,1'-联 二萘酚、N-(3,5-二硝基苯甲酰基)-α-苯乙胺、2'-羟基黄烷酮3种手性化合物。 该填料在正相色谱模式下具有稳定的手性识别能力,能满足对映体分离分析和 生产质量控制的需要。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施 例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述 中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付 出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
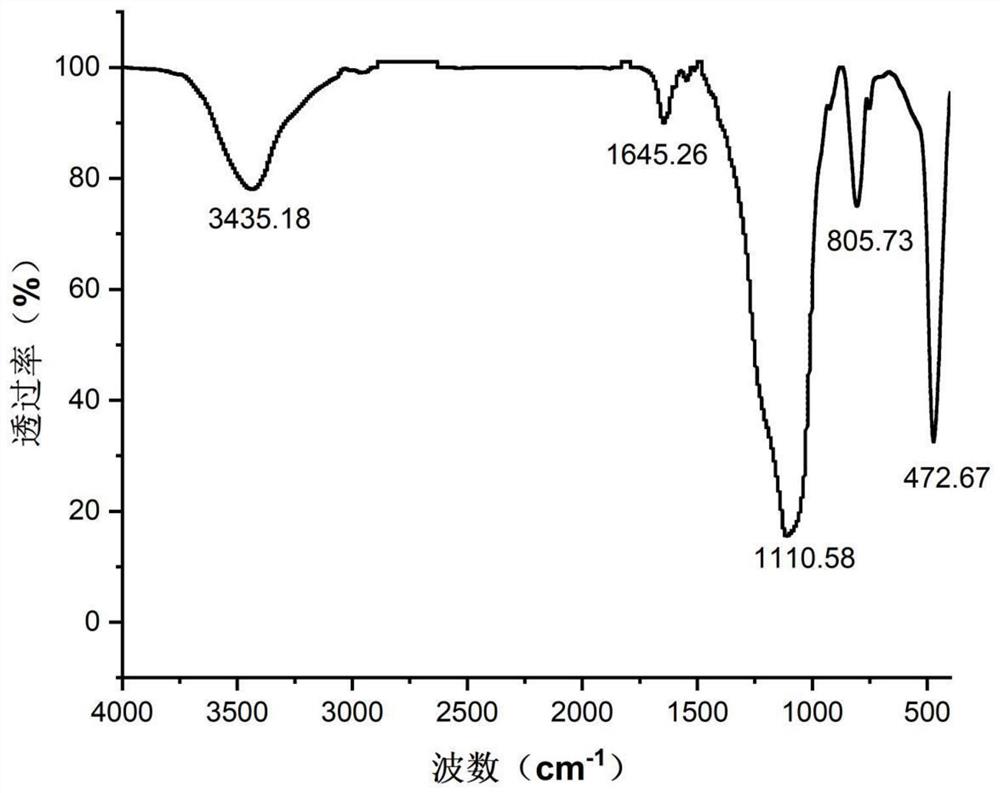
图1为(S)-BIONL衍生物CSP的红外光谱图;
图2为1,1'-联二萘酚(1,1'-Binaphthol)在(S)-BIONL衍生物CSP上的拆 分色谱图;
图3为N-(3,5-二硝基苯甲酰基)-α-苯乙胺 (N-(3,5-Dinitrobenzoyl)-1-phenyleth-ylamine)在(S)-BIONL衍生物CSP上 的拆分色谱图;
图4为2'-羟基黄烷酮(2'-Hydroxyflavanone)在(S)-BIONL衍生物CSP上 的拆分色谱图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清 楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是 全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造 性劳动前提下所获得的所有其他实施例,所作的任何修改、等同替换、改进等, 均应包含在本发明的保护范围之内。
本发明提供了一种(S)-BIONL衍生物CSP填料(简写为(S)-BINOL-SA CSP), 结构式如式I所示;
式I中,代表硅
在本发明中,所述式I中苯环上的化学键加黑代表固定相为S构型。
本发明还提供了上述技术方案所述(S)-BINOL-SA CSP填料的制备方法,包 括以下步骤:
对S构型的BINOL中的两个羟基进行MOM保护,在该化合物的3位引入醛 基,并将醛基氧化为羧酸甲酯,再将该羧酸甲酯进行水解得到相应的羧酸化合 物,得到具有式Ⅱ所示结构的化合物;
将具有式Ⅱ所示结构的化合物与硅烷化试剂进行缩合反应,得到缩合产 物;
将所述缩合产物键合到酸化的硅胶载体上,(S)-BINOL-SA CSP填料。
本发明还提供了另一种上述技术方案所述(S)-BINOL-SA CSP填料的制备 方法,包括以下步骤:
将硅烷化试剂与酸化的硅胶载体进行硅烷化反应,得到硅烷化硅胶;
对S构型的BINOL中的两个羟基进行MOM保护,在该化合物的3位引入醛 基,并将醛基氧化为羧酸甲酯,再将该羧酸甲酯进行水解得到相应的羧酸化合 物,得到具有式Ⅱ所示结构的化合物;
将具有式Ⅱ所示结构的化合物键合到所述硅烷化硅胶上,得到所述 (S)-BINOL-SA CSP填料。
本发明优选对S构型的BINOL进行结构修饰,对BINOL中的两个羟基进行 MOM保护,在该化合物的3位引入醛基,并将醛基氧化为羧酸甲酯,再将该羧 酸甲酯进行水解得到相应的羧酸化合物(S)-1。本发明对所述羟基保护的具体 方式没有特殊的限定,采用本领域技术人员熟知的方式即可。
得到将具有式Ⅱ所示结构的化合物后,本发明将所述具有式Ⅱ所示结构的 化合物与硅烷化试剂进行缩合反应,分别得到缩合产物。
在本发明中,所述硅烷化试剂优选为3-氨基丙基三乙氧基硅烷或3-氨基 丙基三甲氧基硅烷。
在本发明中,所述缩合反应的时间优选为3~4h。
在本发明的具体实施例中,优选为:0℃条件下,以化合物(S)-1(3.3g, 7.9mmol)为原料,无水CH
得到缩合产物(S)-2后,本发明将所述缩合产物键合到酸化的硅胶载体上, 得到所述一种(S)-BIONL衍生物CSP填料。
在本发明中,所述酸化的硅胶载体优选由硅胶进行酸化得到。
在本发明中,所述硅胶优选包括色谱用球形或无定形硅胶。
在本发明中,所述酸化使用的酸化试剂优选为盐酸,所述盐酸的浓度优选 为3~6mol/L,所述硅胶与盐酸的用量比优选为硅胶10g:100mL。
在本发明的具体实施例中,优选为:在250mL单口烧瓶中加入硅胶(10g), 用4M的盐酸(100mL)回流5小时,5小时后用砂芯漏斗过滤硅胶,用水洗至 中性,150℃真空干燥24小时。在250mL单口烧瓶中称取(S)-2(1.36g),酸 化硅胶(3.5g)并加入重蒸甲苯(100mL),氮气保护,回流反应12小时。反应 结束后冷却至室温,用砂芯漏斗过滤硅胶,用二氯甲烷和甲醇多次洗涤,50℃ 真空干燥4小时,得到(S)-BINOL-SA CSP。以硅烷化试剂为3-氨基丙基三乙氧 基硅烷为例,所述制备一种(S)-BIONL衍生物CSP填料的方程式如下式所示(由(S)-1为开始):
本发明还提供了另一种上述技术方案所述(S)-BINOL-SA CSP填料的制备 方法,包括以下步骤:
将硅烷化试剂与酸化的硅胶载体进行硅烷化反应,得到硅烷化硅胶;
对S构型的BINOL中的两个羟基进行MOM保护,在该化合物的3位引入醛 基,并将醛基氧化为羧酸甲酯,再将该羧酸甲酯进行水解得到相应的羧酸化合 物,得到具有式Ⅱ所示结构的化合物;
将具有式Ⅱ所示结构的化合物键合到所述硅烷化硅胶上,得到所述 (S)-BINOL-SA CSP填料。
本发明将硅烷化试剂与酸化的硅胶载体进行硅烷化反应,得到硅烷化硅 胶。
在本发明的具体实施例中,优选为:取硅胶10g,4M盐酸100mL,N
本发明对S构型的BINOL中的两个羟基进行MOM保护,在该化合物的3位 引入醛基,并将醛基氧化为羧酸甲酯,再将该羧酸甲酯进行水解得到相应的羧 酸化合物,得到具有式Ⅱ所示结构的化合物;
本发明对进行羟基保护的具体方式没有特殊的限定,采用与上述方案一致 即可。
得到硅烷化硅胶和具有式Ⅱ所示结构的化合物后,本发明将具有式Ⅱ所示 结构的化合物键合到所述硅烷化硅胶上,分别得到所述(S)-BINOL-SA CSP填 料。
在本发明的具体实施例中,优选为:取化合物(S)-1(1.0g)用12mL的无 水二氯甲烷溶解,置于0℃下搅拌5min,加入三乙胺(1.852g)和2-(7-氧化苯 并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯(5.575g)继续反应2h,撤去冰浴, 加入硅烷化硅胶(4.0g)继续反应24h后制得(S)-BINOL-SA CSP填料。
以硅烷化试剂为3-氨基丙基三乙氧基硅烷为例,所述制备(S)-BINOL-SA CSP填料。的方程式如下式所示:
本发明还提供了上述技术方案所述一种(S)-BIONL衍生物CSP填料在手性 拆分领域中的应用。
为了进一步说明本发明,下面结合实例对本发明提供的一种(S)-BIONL衍 生物CSP填料及其制备方法和应用进行详细地描述,但不能将它们理解为对本 发明保护范围的限定。
实施例1
本实施例是对S构型的BINOL中的两个羟基进行MOM保护,在该化合物的 3位引入醛基,并将醛基氧化为羧酸甲酯,再将该羧酸甲酯进行水解得到相应 的羧酸化合物,得到化合物(S)-1;(S)-1经硅烷化后键合到酸化的硅胶载体上, 得到(S)-BINOL-SA CSP填料。
0℃条件下,以化合物(S)-1(3.3g,7.9mmol)为原料,无水CH
在250mL单口烧瓶中加入硅胶(10g),用4M的盐酸(100mL)回流5小 时。5小时后用砂芯漏斗过滤硅胶,用水洗至中性,150℃真空干燥24小时。 在250mL单口烧瓶中称取上步产物化合物(S)-2(1.36g),酸化硅胶(3.5g)并 加入重蒸甲苯(100mL),氮气保护,回流反应12小时。反应结束后冷却至室 温,用砂芯漏斗过滤硅胶,用二氯甲烷和甲醇多次洗涤,50℃真空干燥4小时, 得到(S)-BINOL-SA CSP填料。
图1为(S)-BINOL-SA CSP的红外光谱图,由图1可知,本发明制备得到的 了(S)-BINOL-SA CSP。
本实施例所述(S)-BINOL-SA CSP在正相色谱条件下的具体分离参数如下:
拆分化合物1,1'-联二萘酚(1,1'-Binaphthol)使用的流动相为正己烷/乙 醇/三氟乙酸=97/3/0.3(v/v/v);
拆分化合物N-(3,5-二硝基苯甲酰基)-α-苯乙胺 (N-(3,5-Dinitrobenzoyl)-1-phenylethylamine)使用的流动相为正己烷/乙 醇=97/3/0.4(v/v/v);
2'-羟基黄烷酮(2'-Hydroxyflavanone)使用的流动相为:正己烷/正丙醇 =99/1(v/v);
所使用的流速均为1mL/min,检测波长:254nm,温度:25℃。分离结果见 表1和图2~4,图2为1,1'-联二萘酚(1,1'-Binaphthol)在(S)-BINOL-SA CSP 上的拆分色谱图,图3为N-(3,5-二硝基苯甲酰基)-α-苯乙胺 (N-(3,5-Dinitrobenzoyl)-1-phenyleth-ylamine)在(S)-BINOL-SA CSP上的 拆分色谱图,图4为2'-羟基黄烷酮(2'-Hydroxyflavanone)在(S)-BINOL-SA CSP上的拆分色谱图。由表1和图2~4可知,本实施例制得的(S)-BINOL-SA CSP 在正相条件下能够拆分1,1'-联二萘酚、N-(3,5-二硝基苯甲酰基)-α-苯乙胺、2'-羟基黄烷酮3种手性化合物。填装有(S)-BINOL-SA CSP手性柱在经过2000 次进样分析之后依然具有良好的手性识别能力,能满足日常药物分析和生产质 量控制的需要。
表1正相色谱条件下(S)-BINOL-SA CSP对3种手性化合物的分离结果
k
实施例2
本实施例是对S构型的BINOL中的两个羟基进行MOM保护,在该化合物的 3位引入醛基,并将醛基氧化为羧酸甲酯,再将该羧酸甲酯进行水解得到相应 的羧酸化合物,得到化合物(S)-1,将化合物(S)-1键合至氨丙基硅胶载体上, 得到(S)-BINOL-SA CSP。
取硅胶10g,4M盐酸100mL,N
取化合物(S)-1(1.0g)用12mL的无水二氯甲烷溶解,置于0℃下搅拌 5min,加入三乙胺(1.852g)和2-(7-氧化苯并三氮唑)-N,N,N',N'-四甲基脲六 氟磷酸酯(5.575g)继续反应2h,撤去冰浴,加入硅烷化硅胶(4.0g)继续反应 24h后制得(S)-BINOL-SA CSP。
对本实施例制得的(S)-BINOL-SA CSP进行红外表征,结果与实施例1类似。
以上所述仅是本发明的优选实施方式,并非对本发明作任何形式上的限 制。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的 前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护 范围。
