用于分离和纯化多核苷酸的溶胞线圈设备及其用途
文献发布时间:2023-06-19 10:00:31
相关申请的引用
本申请主张2018年5月31日提交的美国临时专利申请号62/678,355的优先权,该申请的内容以其全部内容作为参考并入本文。
背景技术
通常出于多种研究和开发的目的,并且在多种情况下为了生产用于治疗患者的生物药物而处理和纯化生物分子。具体地,可以从宿主细胞纯化多核苷酸,包括DNA质粒。
作为治疗剂(即,DNA基因疗法)用于治疗遗传性疾病和用于基因免疫的DNA递送备受关注。由于使用潜在感染性病毒的安全问题,研究人员已使用裸DNA或DNA递送的其它非病毒方法研究了病毒的替代物。随着对基因疗法的需求的增加,将需要大量质粒或适合的DNA。然而,在对于人应用所必需的纯度水平下分离越来越大量的DNA的当前方法存在的限制可以阻碍该领域的发展。
通常,DNA质粒生产方法包括质粒在宿主细胞中的复制、溶胞(溶菌,分解,lysing)和从这些细胞中释放质粒,然后分离质粒等步骤。这均需要在获得在人中进行临床研究所必需的高纯度水平和以对于临床研究并最终对于商品化供应提供适当剂量水平所必需的量的条件下进行。
存在多种纯化质粒的现有方法;然而,这些方法不适合于大规模制备。实验室规模的纯化技术不能简单放大用于大规模质粒制备中所涉及的量。大规模制备需要优化得率和分子完整性,同时最大程度除去污染物并使质粒浓度最大化。在以高浓度生产大量质粒DNA时,问题在于将质粒保持为超螺旋和开环松弛形式。储存条件通常需要高盐,并且在存在盐的情况下,分子随时间的降解仍是问题。多种现有的纯化方法依赖于使用潜在危险、毒性、致突变或污染的物质,和/或昂贵的物质或设备,这对于大规模制备也是不希望的。一些现有的纯化方法使用酶来消化蛋白以用于最终的消除,并且这些酶对于大规模生产是昂贵的并且可以引起生物污染风险。
存在多种使宿主细菌细胞溶胞的方法。以实验室规模使用的质粒纯化的熟知方法包括酶促消化(例如,用溶菌酶)、热处理、压力处理、机械研磨、超声处理、离液剂(例如,异硫氰酸胍)处理和用有机溶剂(例如,苯酚)处理。尽管可以容易地以小规模实践这些方法,但是几乎都没有已成功用于质粒制备的大规模使用。目前,使细菌溶胞以用于质粒纯化的优选方法是通过使用碱和去污剂。该技术最初是由Birnboim和Doly(1979,Nucleic AcidsRes.7,1513 1523)描述的。该程序的常用修改描述于Sambrook等人(Molecular Cloning:ALaboratory Manual,2.sup.nd Ed.,Cold Spring Harbor Laboratory Press,ColdSpring Harbor,N.Y.)的第1.38 1.39页。这种溶胞方法具有独特的优势:除了提供质粒分子从细胞的有效释放外,该程序还通过除去大部分宿主蛋白、脂质和基因组DNA而提供了质粒的基本纯化。基因组DNA的除去是特别有价值的,因为它可以难于通过其它方式与质粒DNA分离。这些优势使其成为在实验室规模进行质粒纯化期间使细菌细胞溶胞的优选方法。
先前已认为细胞悬浮液和溶胞溶液的混合必须在极低剪切力下进行。已针对含质粒细菌的悬浮液与包含碱和去污剂的溶胞溶液的混合进行了描述。美国专利号5,837,529和美国专利公开号2002/0198372分别考虑使用静态混合器来实现连续低剪切混合,而美国专利号6,395,516考虑使用设计的容器来用于以分批模式进行受控混合。这些方法具有明显的缺陷。在一个方面,在力求使过度的剪切力最小化的同时,细胞悬浮液与溶胞溶液的混合可能不完全。在另一个方面,使用静态混合器限制了方法的灵活性。如美国专利公开号2002/0198372中所述,必需优化静态混合元件的数目以及流体流过所述元件的流速。这种优化限制了在给定时间内可以由优化的静态混合器处理的材料量。这限制了提高处理规模的能力,除非构建并优化新的大容量静态混合器。如美国专利号6,395,516中所述,分批混合容器的使用具有相当的缺陷。在分批混合容器的所有区域中实现完全混合是本领域技术人员熟知具有挑战性的。此外,分批混合容器非常不适合需要控制其中细胞悬浮液与溶胞溶液接触的暴露时间的应用。具体地,熟知延长含质粒细胞对碱的暴露可以导致过量永久变性质粒的形成,该永久变性质粒通常是非活性、不希望并且随后难以与生物学活性质粒分离的。通常,期望将这种暴露时间限制在约10分钟或更低。使用大规模分批混合实现这种受限暴露时间是困难或不可能的。在美国专利公开号2009/0004716A1中部分描述了上述问题的解决方案。
因此,在本领域中仍需要大规模生产所关注的生物学活性分子、如质粒的方法,并且具体地需要配置为大规模生产、便携、一次性(使用一次)和/或经济的包括溶胞线圈设备的生产设备和使用这种设备的生产方法。
发明内容
本发明的一个方面包括一种溶胞线圈(lysis coil)设备,其能够流体接收细胞悬浮液溶液和溶胞溶液并且作为溶液混合物流体输送所述溶液,从而使细胞悬浮液中的细胞溶胞并释放内容物,该设备包括:具有一定高度的圆柱形溶胞线圈支架(lysis coilholder)和具有第一端、第二端和位于两者之间的一定长度的柔性溶胞线圈,所述柔性溶胞线圈配置为接收来自第一端的细胞悬浮液溶液和溶胞溶液并将所述混合物溶液从所述第二端输送出所述溶胞线圈;其中所述溶胞线圈支架能够接收柔性溶胞线圈并将其紧固在所述圆柱形溶胞线圈支架的外表面上。在本发明的一些方面,溶胞线圈支架具有嵌入均匀螺旋槽的表面,该均匀螺旋槽具有横贯(横跨,贯穿,穿过,traversing)溶胞线圈支架的高度的长度,其中所述柔性溶胞线圈具有使得溶胞线圈能够被溶胞线圈支架的槽接收的尺寸的内径,并且横贯所述溶胞线圈支架的槽的长度。
在一些实施方式中,所述溶胞线圈的内径小于约1英寸并且可以包括7/8、3/4、5/8、1/2、3/8或1/4英寸,并且优选地,在一些实施方式中,所述溶胞线圈的内径为3/4,在一些实施方式中为1/2英寸,或者在其它优选实施方式中为3/8英寸。在一些实施方式中,溶胞线圈配置为使溶液混合物以线流速流动,从而致使在溶胞线圈中的保留时间为约4至约6分钟,并且优选地为约5分钟。而在一些实施方式中,溶胞线圈配置为允许溶液混合物以8m/min至约12m/min的线流速流动,并且优选地以约9.95、9.90、9.85、9.80、9.75、9.70、9.65、9.60、9.55或9.50m/min,并且更优选地9.80、9.75或9.70m/min的线流速流动。溶胞线圈可以具有大于100英尺长,并且优选地140、145、150、155、160、165或170英尺长,并且更优选地150、155或160英尺长的长度。在溶胞线圈设备的一些实施方式中,溶胞线圈在单次使用后可丢弃。
溶胞线圈支架可以具有约20、21、22、23、24、25、26、27、28、29或30英寸,并且优选地23、24或25英寸的径向直径,和约3英尺至约6.25英尺,约3.5英尺至约6.25英尺,约4英尺至约6.25英尺,约4.5英尺至约6.25英尺,约5.0英尺至约6.25英尺,约3.5英尺至约6.0英尺,约4英尺至约6.0英尺,约4.5英尺至约6.0英尺,约5.0英尺至约6.0英尺,约3.5英尺至约5.75英尺,约3.75英尺至约5.75英尺,约4英尺至约5.75英尺,约4.5英尺至约5.75英尺或约5.0英尺至约5.75英尺,并且优选地约5.8、5.9、6.0、6.1或6.2英尺的高度。在溶胞线圈设备的一些实施方式中,溶胞线圈支架的槽以约2.15度至约3.43度的斜角绕过(横跨,横贯,traverse)溶胞线圈支架的圆周。溶胞线圈支架可以具有滚轮支撑件(wheel support),通过该滚轮支撑件可以容易地运输溶胞线圈设备。
在溶胞线圈设备的一些优选实施方式中,溶胞线圈具有约3/8英寸、1/2英寸或3/4英寸的内径,并且溶胞线圈配置为允许溶液混合物以约9.70、9.75或9.80m/min的线流速流动。在溶胞线圈设备的一些优选实施方式中,溶胞线圈具有约150英尺、155英尺或160英尺长的长度并且保留时间为约4.8min、4.9min、5.0min、5.1min或者5.2min。在其它优选实施方式中,线流速为约9.75m/min,并且溶胞线圈的长度为约150英尺长。此外,在一些优选的实施方式中,长度为约150英尺长,并且溶胞线圈配置为允许溶液混合物以约9.75m/min的线流速流动。在其它优选实施方式中,溶胞线圈的内径为3/8英寸,并且溶胞线圈的长度为约150英尺长。
本发明的另一个方面是使用溶胞线圈设备使含有所期望的多核苷酸的细胞溶胞的方法,该溶胞线圈设备能够流体接收细胞悬浮液溶液和溶胞溶液并作为溶液混合物流体输送所述溶液以接触中和溶液,从而使细胞悬浮液中的细胞溶胞并释放内容物,该溶胞线圈设备包括:具有一定高度的圆柱形溶胞线圈支架和具有第一端、第二端和位于两者之间的一定长度的柔性溶胞线圈,所述柔性溶胞线圈配置为接收来自第一端的细胞悬浮液溶液和溶胞溶液并将所述混合物溶液从第二端输送出溶胞线圈;其中所述溶胞线圈支架具有嵌入均匀螺旋槽的表面,该螺旋槽具有以恒定斜角横贯溶胞线圈支架的高度的长度;并且其中所述柔性溶胞线圈具有使得溶胞线圈能够被溶胞线圈支架的槽接收的尺寸的内径,并且横贯所述溶胞线圈支架的槽的长度,该方法包括以下步骤:将一次性溶胞线圈紧固到溶胞线圈支架的槽中;将细胞悬浮液溶液输送至溶胞线圈的第一端;将溶胞溶液输送至溶胞线圈的第一端以使得细胞悬浮液溶液能够与溶胞溶液混合;并且将溶液混合物与中和溶液一起流体输送至隔室以结束溶胞过程。
在细胞溶胞方法的一些实施方式中,以约8m/min至约12m/min的线流速发生输送步骤。在细胞溶胞方法的其它实施方式中,使混合物溶液在约4分钟至6分钟内穿过溶胞线圈长度。在一些实施方式中,以约9.75m/min的线流速发生输送步骤。
附图说明
当结合附图阅读时,将更好地理解以下本发明的优选实施方案的详细说明。出于说明本发明的目的,在附图中显示了本发明优选的实施方式。然而,应理解本发明不局限于附图中所示的实施方式的确切方案和仪器。
图1显示了示例性溶胞线圈设备的侧视图。
图2显示了示例性溶胞线圈设备的俯视图。
图3显示了示例性溶胞线圈设备的顶端的放大图。
图4显示了示例性溶胞线圈设备的区段的截面图。
图5显示了示例性溶胞线圈设备的技术图。
图6A和图6B显示了测量具有:3/4英寸内径和160英尺长度(图6A);和3/8英寸内径和150英尺长度(图6B)的溶胞线圈中线圈保持时间、流体流速和流体线速度之间的关系的结果。
图7A和图7B显示了质粒A的纯化数据结果。
图8显示了再悬浮细胞和不同阶段的溶胞液的HPLC分析结果。
图9显示了6个质粒批次的纯化数据总结。
图10A至图10C显示了使用3种不同溶胞线圈设备构造的质粒纯化测试结果。
图11A和图11B显示了5个质粒纯化批次中使用的溶液总结结果。
图12显示了使用2种不同溶胞线圈设备构造的6个质粒纯化批次结果的列表。
图13显示了图12中的6个质粒纯化批次的质粒浓度的HPLC分析结果的列表。
图14显示了图12中的6个质粒纯化批次的整体释放测试结果的列表。
图15A和图15B显示了图12中6个质粒纯化批次的溶胞和Q过程的凝胶分析结果列表。
图16A至图16F显示了溶胞液样品的HPLC分析的结果。
具体实施方式
除非另外定义,否则本文所使用的所有技术和科学术语具有与本发明所属领域的技术人员通常理解的含义相同的含义。尽管可以在本发明的实践和/或测试中使用与本文的那些类似或等价的任何方法和材料,但是本文描述了优选的材料和方法。在描述和主张本发明时,将根据其定义使用以下术语,其中提供了定义。
还应理解本文所使用的术语仅出于描述具体实施方式的目的,而不意欲进行限制。
如本文所使用的,术语“一”或“一种”可以表示一个或多于一个。如本文在权利要求中所使用的,当结合词语“包含”使用时,词语“一”或“一种”可以表示一个或多于一个。如本文所使用的,“另一种”可以表示至少第二种或更多种。
如本文所使用的,术语“碱”是指当将足量的物质加入至水中时,提供大于约8的pH的物质。术语碱包括但不限于氢氧化钠(NaOH)、氢氧化钾(KOH)或氢氧化锂(LiOH)。
如本文所使用的,术语“去污剂(detergent)”是指任何两亲性试剂或表面活性剂,无论是中性、阴离子、阳离子或两性离子的。术语去污剂包括但不限于十二烷基硫酸钠(SDS)、Triton(聚乙二醇叔辛基苯基醚,Dow Chemical Co.Midland,Mich.)、Pluronic(环氧乙烷/环氧丙烷嵌段共聚物,BASF Corp.,Mount Olive,N.J.)、Brij(聚氧乙烯醚,ICIAmericas,Bridgewater N.J.)、3-[(3-胆酸酰胺基丙基)二甲基铵]-1-丙磺酸(CHAPS)、3-[(3-胆酸酰胺基丙基)二甲基铵]-2-羟基-1-丙磺酸(CHAPSO)、Tween.RTM.(聚乙二醇脱水山梨糖醇,ICI Americas,Bridgewater,N.J.)、胆汁酸盐、十六烷基三甲基铵、N-月桂酰肌氨酸、两性洗涤剂(n-烷基-N,N-二甲基-3-铵-1-丙磺酸,Calbiochem,San Diego,Calif.)等。
如本文所使用的,术语“离子交换”是指主要基于所关注的分子和适合的离子交换材料之间的离子相互作用的分离技术。尽管离子交换材料可以最常见地采取色谱树脂或膜的形式,但是它可以是适合于进行基于所述离子相互作用的分离的任何材料。术语离子交换涵盖了阴离子交换、阳离子交换以及阴离子和阳离子交换两者的组合。
如本文所使用的,术语“阴离子交换”是指主要基于所关注的一种或多种分子上的一个或多个负电荷与适合的带正电荷的阴离子交换材料之间的离子相互作用的分离技术。尽管阴离子交换材料可以最常见地采取色谱树脂或膜的形式,但是它可以是适合于进行基于所述离子相互作用的分离的任何材料。
如本文所使用的,术语“阳离子交换”是指主要基于所关注的一种或多种分子上的一个或多个正电荷与适合的带负电荷的阳离子交换材料之间的离子相互作用的分离技术。尽管阳离子交换材料可以最常见地采取色谱树脂或膜的形式,但是它可以是适合于进行基于所述离子相互作用的分离的任何材料。
如本文所使用的,术语“疏水相互作用”和“HIC”表示主要基于所关注的分子和适合的基本疏水性或亲水性材料之间的疏水相互作用的分离技术。尽管基本疏水性或亲水性材料可以最常见地采取色谱树脂或膜的形式,但是它可以是适合于进行基于疏水相互作用的分离的任何材料。
如本文所使用的,术语“质粒”是指不是宿主细胞的基本基因组的一部分或片段的任何特征性细胞来源的核酸实体。如本文所使用的,术语“质粒”可以表示由RNA或DNA组成的环状或线性分子。术语“质粒”可以表示单链或双链分子,并且包括核酸实体,如病毒和噬菌体。
如本文所使用的,术语“基因组DNA”是指来源于宿主细胞基因组的DNA。如本文所使用的,该术语包括包含宿主细胞基本基因组的全部或任何部分的DNA分子,无论是线性还是环状、单链还是双链的。
如本文所使用的,术语“内毒素”是指来源于革兰氏阴性细菌并且在动物中导致副作用的脂多糖物质。通常可以通过鲎变形细胞溶解物(limulus amebocyte lysate,“LAL”)测定检测内毒素。
如本文所使用的,术语“色谱”包括涉及一种或多种分子与基质相互作用的任何分离技术。基质可以采取固体或多孔珠粒、树脂、颗粒、膜或任何其它适合的材料的形式。除非另作说明,否则色谱包括流穿(flow-through)和分批技术两者。
如本文所使用的,术语“沉淀”是指其中存在于溶液、悬浮液、乳液等状态中的一种或多种组分形成固体材料的过程。
如本文所使用的,术语“沉淀溶液”表示引起沉淀的任何溶液、悬浮液或其它流体。除非另作说明,否则沉淀溶液还可以提供中和。
如本文所使用的,术语“中和”是指其中使酸性或碱性物质的pH接近中性的过程。通常,中和使pH达到约6至约8的范围。
如本文所使用的,术语“中和溶液”表示当与酸性或碱性物质混合时,产生中和的任何溶液、悬浮液或其它流体。除非另作说明,否则中和溶液也可以提供沉淀。
如本文所使用的,术语“中和/沉淀溶液”是指提供中和以及沉淀两者的任何溶液、悬浮液或其它流体。
如本文所使用的,术语“细胞组分”包括来源于细胞的任何分子、分子组或分子部分。细胞组分的实例包括但不限于DNA、RNA、蛋白、质粒、脂质、碳水化合物、单糖、多糖、脂多糖、内毒素、氨基酸、核苷、核苷酸等。
如本文所使用的,如对于色谱或分离方法和材料所使用的术语“膜”是指具有流体可以通过其流动的多个孔或通道的任何基本连续的固体材料。膜可以无限制地包括以下几何形状,如扁平片材、褶皱或折叠层以及浇铸或交联的多孔整体柱。相反,当用于表示细胞组分时,术语“膜”表示包围细胞的基于脂质的被膜的全部或部分。
如本文所使用的,术语“鼓泡混合器”是指使用气泡使两种或更多种未混合或未完全混合的材料混合的任何装置。
如本文所使用的,术语“细胞悬浮液”是指包含细胞、细胞团(细胞聚集体,cellaggregates)或细胞碎片的任何流体。
如本文所使用的,术语“细胞溶胞液”是指任何包含细胞的材料,其中细胞的主要部分已破裂并释放出它们的内部组分。
如本文所使用的,术语“溶胞溶液”是指导致接触细胞溶胞的任何溶液、悬浮液、乳液或其它流体。
如本文所使用的,术语“澄清的溶胞液”是指已基本不含可见的颗粒固体的溶胞液。
如本文所使用的,术语“大颗粒”是指包含大于或约100μm直径的颗粒的固体物质。
如本文所使用的,术语“微颗粒”是指包含小于约100μm直径的颗粒的固体物质。
如本文所使用的,术语“超滤”和“UF”表示其中使溶液或悬浮液经受保留大分子而使溶剂和小溶质分子透过的半透膜的任何技术。超滤可以用于提高溶液或悬浮液中大分子的浓度。除非另作说明,否则术语超滤涵盖了连续和分批技术两者。
如本文所使用的,术语“渗滤”和“DF”表示其中通过超滤除去存在于大分子的溶液或悬浮液中的溶剂和小溶质分子并用不同的溶剂和溶质分子替代的任何技术。渗滤可以用于改变大分子溶液或悬浮液的pH、离子强度、盐组成、缓冲液组成或其它性质。除非另作说明,否则术语渗滤涵盖了连续和分批技术两者。
如本文所使用的,术语“超滤/渗滤”和“UF/DF”表示顺序或同时进行超滤和渗滤两者的任何技术或技术组合。
本发明的方面包括可以整合(集成,intergrated)到用于质粒生产或质粒制备、并且具体地用于包括DNA质粒的大规模生产的那些整体系统或方法中的溶胞线圈设备。本文的溶胞线圈设备可以整合到生产方法中,使得旨在与溶胞溶液如碱性溶胞溶液混合的细胞悬浮液可以一起流入溶胞线圈设备的一端。混合物可以穿过溶胞线圈设备的长度,然后从所述溶胞线圈设备的相对端离开并进入室或其它类似设备,从而使溶胞溶液中和。优选地,长度和时间能够使几乎所有细胞溶胞,而不会损害所期望的多核苷酸,例如,DNA质粒,同时避免基因组多核苷酸的不期望的断裂。溶胞线圈设备包括溶胞线圈支架和溶胞线圈。优选地,溶胞线圈支架为对称的几何形状,并且更优选为圆柱体。溶胞线圈支架在外表面上具有能够接收溶胞线圈的槽。优选地,槽具有容纳和支持溶胞线圈的深度和尺寸,并且更优选地,槽以所期望的斜角在溶胞线圈支架的整个高度上对称布置。上述情况使得溶液具有以本文的线流速穿过溶胞线圈长度的所期望的持续时间,从而使细胞有效溶胞。
可以使用多种可用发酵方法中的任一种产生细胞培养物,包括分批发酵和分批补料发酵。致使细胞悬浮液与溶胞溶液组合进入并通过溶胞线圈的发酵设备和方法的一种实施方式是在美国专利公开号2009/0004716A1中描述的那些。在特别优选的实施方式中,细胞是含有高拷贝数的所关注的质粒的大肠杆菌(E.coli),并且使用分批或分批补料技术将含质粒细胞发酵至高密度。通过任何方式收获细胞,如离心或过滤以形成细胞糊(cellpaste)。这些收获方法对于本领域技术人员是熟知的。用于制备这些含质粒大肠杆菌(E.coli)细胞和实施这种分批和分批补料发酵的方法对于本领域技术人员来说是熟知的。可以通过常规方式收获细胞,如离心或过滤以形成细胞糊。这些收获方法对于本领域技术人员来说是熟知的。可以使用溶胞溶液使所收获的细胞溶胞以将它们的内容物(包括所关注的生物学活性分子)释放至溶胞液溶液中。此外,本领域技术人员将认识到可以立即处理所收获的细胞或细胞糊或者将其以冷冻或冷藏状态保存以用于随后的处理。
高产发酵方法对于生产高产DNA质粒是重要的,因为高生长将得到高水平的起始材料。这些高产发酵方法包括提供>500mg/L质粒得率的那些,其包括Merck法(在公开WO2005078115中更详细地描述,其以其全部内容并入本文)、Boerhinger Ingleheim法(在公开WO2005097990中更详细地描述,其以其全部内容并入本文)和Nature TechnologyCorporation法(在公开WO2006023546中更详细地描述,其以其全部内容并入本文)等。
通常,在经由溶胞线圈设备使细胞溶胞之前,可以将细胞糊用于制备含有所关注的生物学活性分子的细胞悬浮液。可以将细胞在任何适合的溶液中悬浮。可以将在悬浮液溶液中含有细胞的悬浮液保持在储槽或其它储存容器中。可以使用两个容器,其中在第一容器用于溶胞过程中的同时,第二容器可以用于使额外量的细胞再悬浮。在一些实施方式中,悬浮液溶液可以包括pH约8的约25mM Tris-盐酸盐(“Tris-HCl”)和约10mM的乙二胺四乙酸二钠(“Na
在发酵过程之后,可以使细胞溶胞以将它们的内容物(包括所关注的细胞组分)释放到溶液中。可以将溶胞溶液载置于储槽中,溶胞溶液优选地含有一种或多种溶胞试剂,如碱、酸、酶、有机溶剂、去污剂、离液剂、变性剂、或者两种或更多种这些试剂的混合物。更优选地,溶胞溶液包括碱、去污剂或其混合物。适合的碱包括但不限于NaOH、LiOH或KOH。去污剂可以是非离子的、阳离子的、阴离子的或者两性离子的。适合的去污剂包括但不限于十二烷基硫酸钠(“SDS”)、Triton、Tween、pluronic型试剂(基于环氧乙烷和环氧丙烷的嵌段共聚物)、Brij和CHAPS、CHAPSO、胆汁酸盐、十六烷基三甲基铵、N-月桂酰肌氨酸和两性洗涤剂。适合的碱或去污剂的选择完全在本领域常规技术范围内。在一些实施方式中,溶胞溶液可以包括NaOH和SDS。在一些实施方式中,NaOH的浓度可以为约0.1至约0.3N,并且在一些实施方式中,可以为约0.2N。在一些实施方式中,SDS的浓度可以为约0.1%至约5%,并且在一些实施方式中,为约1%。在一些实施方式中,溶胞溶液可以保持在储槽或其它储存容器中。本文公开了用于实施该步骤的优选方法,并且在下文中进行了详细描述。
可以将细胞悬浮液和溶胞溶液组合以使细胞溶胞并产生溶胞液溶液。在一些实施方式中,可以将它们合并、混合并作为混合物保持足够的时间以有利于高水平的细胞溶胞和生物材料的释放,因此形成溶胞液溶液。
在一些实施方式中,将细胞悬浮液和溶胞溶液保持在单独的储槽中并使用一个或多个泵从这些储槽中取回。可以使用“Y型”连接器或者在溶胞线圈的接收端处或附近引入细胞悬浮液以及溶胞溶液的任何其它连接器使细胞悬浮液和溶胞溶液彼此接触。然后,将连接器通过溶胞线圈的第一端、优选地溶胞线圈的下端连接至溶胞线圈设备。在一些实施方式中,可以使用双头泵以相等流速泵送等体积的细胞悬浮液和溶胞溶液。然而,本领域技术人员将认识到如果需要,可以使用单个泵以不同速度泵送不同体积的细胞悬浮液和溶胞溶液。在一些实施方式中,通过双头泵或2个单独的泵以约0.3L/min至约2L/min同时泵送细胞悬浮液和溶胞溶液,其中接触流体以约0.6L/min至约4L/min的速度离开“Y型”连接器。本领域技术人员将认识到可以容易地升高或降低这些流速和升高或降低管尺寸以满足任何生产量要求。在离开“Y型”连接器后,细胞悬浮液和溶胞溶液一起流入溶胞线圈的第一端并穿过溶胞线圈的整个长度直至它们从溶胞线圈的第二端离开。
本发明的一个方面涉及以受控方式使细胞溶胞以提取所关注的细胞组分的方法。细胞可以是含有所关注的细胞组分的任何细胞。优选地,它们是微生物细胞。更优选地,它们是大肠杆菌(E.coli)细胞。可以使用本发明从细胞提取任何所关注的细胞组分。优选地,这些将是大分子,如质粒或蛋白。更优选地,它们是质粒。因此,在一个优选的实施方式中,本发明涉及使含质粒大肠杆菌(E.coli)细胞溶胞以提取并最终分离质粒的有利方法。
本发明的另一个方面涉及用于从细胞溶胞液纯化所关注的细胞组分的方法。细胞溶胞液可以是含有所关注的细胞组分的任何类型的细胞的溶胞液。此外,可以通过本领域技术人员已知的任何方式生产细胞溶胞液。优选地,溶胞液包括经溶胞的含质粒细胞。更优选地,溶胞液包括通过碱、去污剂或它们的组合溶胞的含质粒细胞。优选地,所关注的细胞组分是质粒。
在一些实施方式中,溶胞线圈设备设计为通过保持如本文所提供的期望的溶胞线圈参数、同时使用一次性产物接触流路来确保过程的一致性。溶胞线圈设备设计为以实现期望斜角的所需角度来保持具有所需内径和所需长度的一次性溶胞线圈,从而将一种溶液(或多种溶液)以过程流速保留所需时间。
在一个实施方式中,使再悬浮的大肠杆菌(E.coli)和溶胞溶液的混合组合流入溶胞线圈的下端并以2.8L/min的过程流速保留5±1分钟。确定不同密度的流体不湍流、不滞留或分离。存在通过线圈的线性流,并且具有完全变性的大肠杆菌(E.coli)细胞组分的流体离开线圈顶部。溶胞线圈设备并入了使得保持如本文所提供的关键参数的一次性流体流路能够简单并快速安装和移除的设计要素。在图1-4中提供了溶胞线圈设备的实施方式的图。
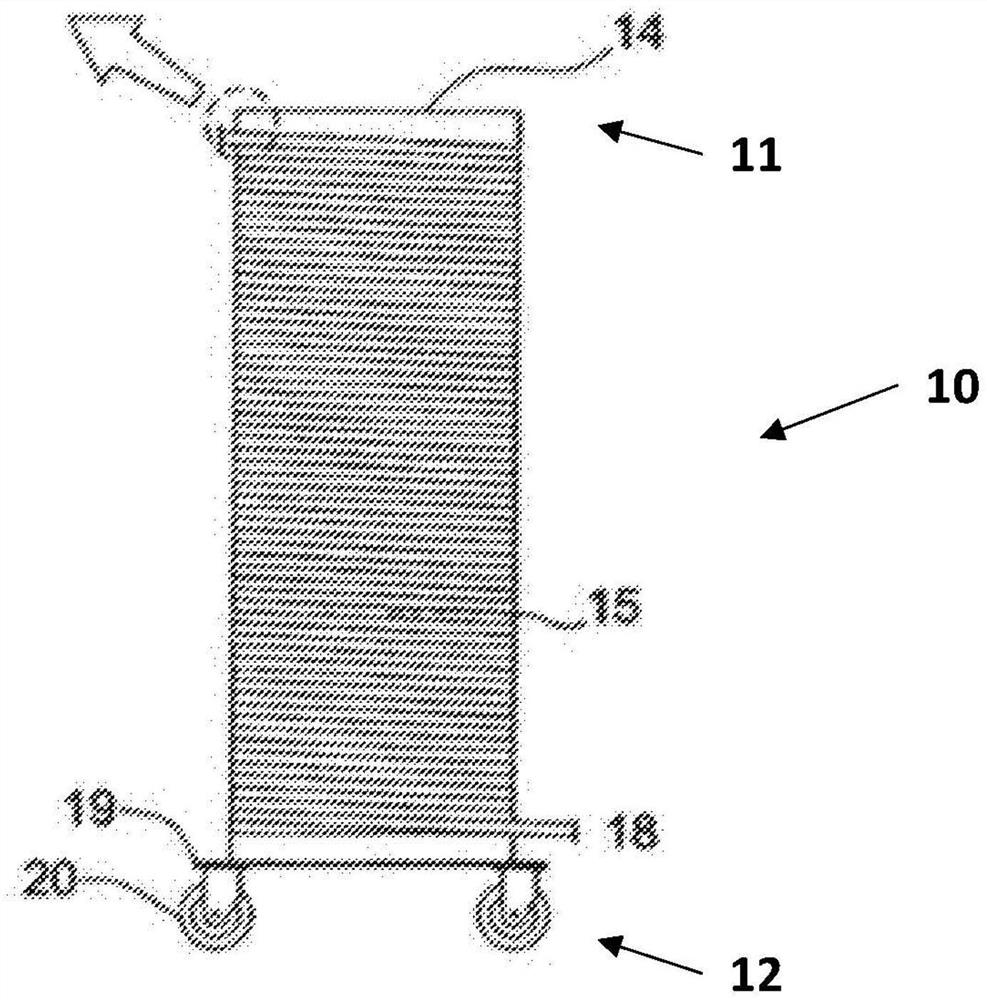
图1、图2和图5分别显示了示例性溶胞线圈设备10的侧视图、俯视图和技术图。设备10包括具有上端(顶端,superior end)11和下端(底端,inferior end)12的基本圆柱形的柱14。柱14具有任何适当尺寸的直径26和高度28。例如,直径26可以为约20、21、22、23、24、25、26、27、28、29或30英寸,并且优选为23、24或25英寸,并且高度28可以为至少1英尺或大于12英尺,如约6英尺。在一些实施方式中,柱14是可堆叠的,从而可以根据需要将两个或更多个柱14组合以提高或降低设备10的高度。柱14可以稳定附接至基座19。在一些实施方式中,基座19还可以包括一个或多个滚轮支撑件20以有利于设备10的移动和输送。每个滚轮支撑件20可以是可锁定的以将设备10停放就位。
设备10还包括溶胞线圈15,其为具有将开口的第一端16和开口的第二端18连接的腔的细长管。溶胞线圈15可以围绕柱14的外表面以螺旋状方式卷绕,使得溶胞线圈15的第一端16位于柱14的上端11附近,而溶胞线圈15的第二端18位于柱14的下端12附近。第一端16和第二端18分别可流体连接至泵、阀、管、储罐、容器、储槽、接头(接合器,adapters)、连接器等以进行所期望的溶胞过程。如图3所示,第一端16和第二端18均可以从设备10自由延伸。在一些实施方式中,可以使用一个或多个固定夹17将第一端16和第二端18紧固至柱14。
如图4和图5所示,柱14可以包括尺寸定为配合溶胞线圈15外径的、嵌入其外表面内的槽22。可以围绕柱14的外表面以螺旋形图案(式样,pattern)形成槽22以引导溶胞线圈15的线圈。在一些实施方式中,槽22可以具有小于槽22直径的槽开口24以牢固保持溶胞线圈15。槽22可以覆盖(跨,遍布,span)具有高度30的柱14的区段。高度30的尺寸可以根据设备10的总高度28、溶胞线圈15的长度和槽距32(即每个槽22之间的距离)的尺寸而改变。例如,高度30可以为至少6英寸或大于11英尺,如约5英尺。
所采用的使用一次性溶胞保留线圈的溶胞线圈设备将消除批次间产物残留。已表明与使用处于不受控角度的较大内径的管相比,通过使用本文所述的原理能够实现的、并且通过使用该设备确保的含质粒大肠杆菌(E.coli)细胞与溶胞溶液的组合一致性地保留规定的时间量,会将溶胞过程的质粒得率提高300%,并且将整体纯化过程得率提高300%。
溶胞线圈设备的优选实施方式包括以下性质:
优选实施方式的流体保留时间:
细胞悬浮液和溶胞溶液的混合物在溶胞线圈中的保留时间为1min至10min、2min至10min、2min至9min、2min至8min、2min至7min、2min至6min、2min至5min、3min至10min、3min至9min、3min至8min、3min至7min、3min至6min、3min至5min、4min至10min、4min至9min、4min至8min、4min至7min、4min至6min、4min至5min、5min至10min、5min至9min、5min至8min、5min至7min或者5min至6min。优选地,保留时间为4至6min;并且优选地,保留时间为约4.8min、4.9min、5.0min、5.1min或5.2min。
优选实施方式的流体流速:
细胞悬浮液和溶胞溶液的混合物穿过溶胞线圈的流体流速(体积/时间)是实现致使产生均匀溶液的线流速(长度/时间)的速度。实现这种情况的线流速在约5m/min至约25m/min、5m/min至约20m/min、5m/min至约19m/min、5m/min至约18m/min、5m/min至约17m/min、5m/min至约16m/min、5m/min至约15m/min、5m/min至约14m/min、5m/min至约13m/min、5m/min至约12m/min、5m/min至约11m/min、5m/min至约10m/min、6m/min至约25m/min、6m/min至约20m/min、6m/min至约19m/min、6m/min至约18m/min、6m/min至约17m/min、6m/min至约16m/min、6m/min至约15m/min、6m/min至约14m/min、6m/min至约13m/min、7m/min至约12m/min、6m/min至约11m/min、6m/min至约10m/min、7m/min至约25m/min、7m/min至约20m/min、7m/min至约19m/min、7m/min至约18m/min、7m/min至约17m/min、7m/min至约16m/min、7m/min至约15m/min、7m/min至约14m/min、7m/min至约13m/min、7m/min至约12m/min、7m/min至约11m/min、7m/min至约10m/min、8m/min至约25m/min、8m/min至约20m/min、8m/min至约19m/min、8m/min至约18m/min、8m/min至约17m/min、8m/min至约16m/min、8m/min至约15m/min、8m/min至约14m/min、8m/min至约13m/min、8m/min至约12m/min、8m/min至约11m/min、8m/min至约10m/min、9m/min至约25m/min、9m/min至约20m/min、9m/min至约19m/min、9m/min至约18m/min、9m/min至约17m/min、9m/min至约16m/min、9m/min至约15m/min、9m/min至约14m/min、9m/min至约13m/min、9m/min至约12m/min、9m/min至约11m/min或9m/min至约10m/min的范围内;并且更优选地,8m/min至10m/min;并且包括约8m/min、8.25m/min、8.50m/min、8.75m/min、9m/min、9.25m/min、9.50m/min、9.55m/min、9.60m/min、9.65m/min、9.70m/min、9.75m/min、9.80m/min、9.85m/min、9.90m/min、9.95m/min和10m/min的实施方式,并且优选地为9.50m/min、9.70m/min、9.75m/min、9.80m/min或10m/min。
并入具有本文所述的内径的溶胞线圈的实施方式内的这些线流速可以实现5000mL/min、4000mL/min、3000mL/min、2900mL/min、2800mL/min、2700mL/min、2600mL/min、2500mL/min、2400mL/min、2300mL/min、2200mL/min、2100mL/min、2000mL/min、1900mL/min、1800mL/min、1700mL/min、1600mL/min、1500mL/min、1400mL/min、1300mL/min、1200mL/min、1100mL/min、1000mL/min、900mL/min、800mL/min、700mL/min、600mL/min或500mL/min的流速。流速受溶胞线圈的内径影响,并且与溶胞线圈设备一起使用的流速是与具有本文的内径的溶胞线圈一起使用的那些。例如,内径为3/4英寸的溶胞线圈可以具有约2317mL/min至3475mL/min,并且优选地约2780mL/min的整体流体流速。在另一个实例中,内径为3/8英寸的溶胞线圈可以具有约543mL/min至814mL/min,并且优选地约651.5mL/min的整体流体流速。
在优选实施方式中使用的溶胞线圈的长度:
在一些实施方式中,溶胞线圈具有大于100英尺、大于105英尺、大于110英尺、大于115英尺、大于120英尺、大于125英尺、大于130英尺、大于135英尺、大于140英尺、大于145英尺、大于150英尺、大于155英尺、大于160英尺、大于165英尺、大于170英尺、大于175英尺、大于180英尺、大于185英尺、大于190英尺、大于195英尺或大于200英尺的长度。优选地,长度为150英尺、155英尺或160英尺长。
在优选实施方式中使用的溶胞线圈的高度:
在一些实施方式中,溶胞线圈具有约3英尺至约6.25英尺、约3.5英尺至约6.25英尺、约4英尺至约6.25英尺、约4.5英尺至约6.25英尺、约5.0英尺至约6.25英尺、约3.5英尺至约6.0英尺、约4英尺至约6.0英尺、约4.5英尺至约6.0英尺、约5.0英尺至约6.0英尺、约3.5英尺至约5.75英尺、约3.75英尺至约5.75英尺、约4英尺至约5.75英尺、约4.5英尺至约5.75英尺或约5.0英尺至约5.75英尺的高度。优选地,高度为约5.8、5.9、6.0、6.1或6.2英尺。
在优选实施方式中使用的溶胞线圈的斜角:
在一些实施方式中,将溶胞线圈在溶胞线圈支架的槽中排列,使得溶胞线圈保持2.0度至4.0度角、2.0度至3.8度角、2.0度至3.6度角、2.0度至3.43度角、2.0度至3.4度角、2.0度至3.2度角、2.0度至3.2度角、2.0度至3.0度角、2.0度至2.8度角、2.0度至2.6度角、2.0度至2.5度角、2.1度至3.4度角、2.1度至3.2度角、2.1度至3.2度角、2.1度至3.0度角、2.1度至2.8度角、2.1度至2.6度角、2.1度至2.5度角、2.1至2.25度角、2.15至2.2度角或2.1至2.15度角的斜角,并且优选地,2.1、2.15或2.2度角。
在优选实施方式中使用的溶胞线圈的内径:
在一些实施方式中,溶胞线圈的内径小于约1英寸,包括7/8、3/4、5/8、1/2、3/8或1/4英寸。优选地,所述溶胞线圈的内径在一些实施方式中为3/4英寸,在一些实施方式中为1/2英寸,或者在其它优选实施方式中为3/8英寸。
可以使用任何适合的材料制备溶胞线圈设备的组件。可以用硬质(刚性,rigid)材料,如塑料、金属或木材制备某些组件,如柱14和基座19。可以由较大的金属块磨铣或者可以由熔融金属铸造基本包括金属的组件。同样地,可以由较大的块磨铣、浇铸或注塑基本包括塑料或聚合物的组件。在一些实施方式中,可以使用3D打印或本领域中常用的其它增材制造技术制备组件,其包括但不限于熔融沉积、立体平版印刷术、烧结、数字光处理、选择性激光熔化、电子束熔化和分层实体制造。可以单独印制组件,或者将组件至少部分印制在一起以最大程度减少组装。可以使用与增材制造相容的多种材料,如各种聚合物,包括硅酮和ABS;金属,包括铝、不锈钢和钛;和其它材料,包括陶瓷和复合材料。
可以由基本柔性的材料如软质或柔性聚合物制备某些组件,如溶胞线圈15。优选地,材料与0.1-1N的碱溶液相容,优选为USP级VI材料。在一些实施方式中,材料与0.5NNaOH溶液相容。在多个实施方式中,聚合物可以是生物惰性的并且在存在溶胞溶液的情况下耐腐蚀和降解。适合的聚合物包括但不限于:聚(氨酯)、聚(硅氧烷)或硅酮、聚(乙烯)、聚(乙烯基吡咯烷酮)、聚(2-羟基乙基甲基丙烯酸酯)、聚(N-乙烯基吡咯烷酮)、聚(甲基丙烯酸甲酯)、聚(乙烯醇)、聚(丙烯酸)、聚丙烯酰胺、聚(乙烯-共-乙酸乙烯酯)、聚(乙二醇)、聚(甲基丙烯酸)、聚乳酸(PLA)、聚乙醇酸(PGA)、聚(丙交酯-共-乙交酯)(PLGA)、尼龙、聚酰胺、聚酐、聚(乙烯-共-乙烯醇)(EVOH)、聚己酸内酯、聚(乙酸乙烯酯)(PVA)、聚乙烯醇(polyvinylhydroxide)、聚(环氧乙烷)(PEO)、聚原酸酯、聚氯乙烯(PVC)等。可以基于其构造改变溶胞线圈15的柔性。例如,提高溶胞线圈15的壁厚可以降低其柔性,而降低溶胞线圈15的壁厚可以提高其柔性。在另一个实例中,溶胞线圈15的壁可以包括皱折以提高柔性,其中皱折可以构造在溶胞线圈15的外部上,从而不干扰内部流体流动。
在某些实施方式中,可以用一种或多种涂层或表面处理来改性溶胞线圈15。涂层或表面处理可以通过改变溶胞线圈15的内表面的疏水性或亲水性来提高流体的流动或溶胞以及材料的分离。可以使用任何适合的方法沉积或应用涂层或表面处理,包括旋涂、浸涂、化学气相淀积、化学溶液沉积、物理蒸汽沉积、液池浸没(liquid bath immersion)等。可以沉积或应用任何适合厚度的涂层或表面处理。
在一些实施方式中,溶胞线圈15是从设备10可移除的。例如,溶胞线圈15可以是一次性组件,其可以在每次使用后丢弃并更换。还可以以具有多种内部尺寸和材料构成的几种不同的构造提供溶胞线圈15,其中可以基于所期望的溶胞过程来转接多种溶胞线圈15的构造。
应理解溶胞线圈设备10适应任何适当的改性以增强其功能。例如,在某些实施方式中,柱14可以在其内部安放一个或多个装置。适合的装置包括但不限于:加热器、冷却器、流量传感器、温度传感器、振荡器等。在另一个实例中,柱14是围绕基座19可旋转的以有利于溶胞线圈15在设备10上的卷绕和绕开(解卷,uncoiling)。可以手动旋转柱14,如通过附接至其上端11的把手,或者柱14可以配备有电动机以用于机械化旋转。柱14还可以包含锁紧机构,从而一旦溶胞线圈15已完全卷绕或绕开,则终止旋转。
然后,可以通过将其与中和溶液(其还被称为中和沉淀溶液)合并来中和由溶胞线圈设备产生的溶胞液溶液,以产生包括中和的溶胞液溶液和碎片的分散体。然后,可以保持所得的分散体以促进中和的溶胞液溶液与碎片的分离。
在一些实施方式中,可以通过将其与中和溶液在中和室中混合来中和包含溶胞细胞(经溶胞的细胞,裂解细胞,lysed cell)的溶胞液溶液。可以通过在中和室中混合来方便地进行溶胞液溶液的这种中和。在一些实施方式中,这种中和可以通过在鼓泡塔混合器中鼓泡进行。优选地,中和结合鼓泡塔混合器中的鼓泡混合一起发生。在一些实施方式中,离开保持线圈的溶胞液溶液可以进入鼓泡塔混合器,同时泵可以将中和/沉淀溶液从另一个储槽递送至鼓泡塔混合器。在一些实例中,也是同时地,将来自另一个储槽的压缩气体喷入鼓泡塔混合器的底部。在一些实施方式中,溶胞液溶液可以从一侧进入塔底,而中和/沉淀溶液可以从相对侧进入底部。可以将压缩气体喷入并通过烧结的分布器(喷洒器,分散器,sparger),该分布器设计为将气泡基本均匀地递送穿过塔的截面。包含溶胞细胞的溶胞液溶液以及中和溶液垂直向上流过塔并通过位于顶部附近侧面上的出口离开。气泡通过垂直液柱的通道用于将溶胞液溶液与中和/沉淀溶液混合。通过上升气泡所提供的混合较充分,但温和且剪切力低。随着中和/沉淀溶液与溶胞液溶液的溶胞细胞混合,细胞组分从溶液中沉淀。可以在鼓泡塔混合器的顶部设置排气管以排放过量气体。在共有专利申请美国专利公开号20090004716A1中详细提供了实例,其以其全部内容并入本文。
在一些实施方式中,溶胞液溶液包括通过碱、去污剂或其混合物溶胞的含质粒细胞,并且中和/沉淀溶液中和碱并使宿主细胞组分如蛋白、膜、内毒素和基因组DNA沉淀。在一些实施方式中,碱可以是NaOH,去污剂可以是SDS,并且中和/沉淀溶液可以包括乙酸钾、乙酸铵或其混合物。在一些实施方式中,中和/沉淀溶液可以包括含有约1M乙酸钾和约3M至约7M乙酸铵的无缓冲溶液。使用这些中和/沉淀溶液产生pH约7至约8的悬浮液,其优于酸性pH,因为酸性条件可以导致DNA脱嘌呤。在一些实施方式中,可以以约2℃至约8℃的冷却形式提供中和/沉淀溶液。
鼓泡塔混合器以低剪切力方式提供混合,并因此避免基因组DNA和内毒素过量释放到中和溶胞液溶液中。本领域技术人员将能够确定通过鼓泡塔混合器的流动气体的适合流速。可以使用约2标准升每分钟至约20标准升每分钟(“slpm”)的气体流速。可以使用任何适合的气体,包括但不限于空气、氮气、氩气和二氧化碳。气体可以是过滤的压缩空气。
溶胞液溶液和中和溶液的组合产生含有中和的溶胞液溶液和碎片的分散体。可以在储槽或其它储存容器中收集中和的溶胞液溶液。在一些实施方式中,将容器骤冷至5-10℃。中和溶胞液在容器中的保持时间不是强制的,并且可以在小于1小时、约1小时至约12小时、约12小时至约15小时或者大于15小时之间改变。在一些实施方式中,所使用的时间为约12小时,而一些实例包括约15小时的时间,而在其它实例中,时间为“过夜”(定义为大于约15小时)。在一个实施方式中,使用足够的保持期以实现细胞碎片从中和溶胞液溶液中的基本完全分离,致使所得粗溶胞液具有有限的固体颗粒,以有利于后续澄清处理。然而,处理规模受限于粗溶胞液保持储槽,并且处理时间被该保持期延长。
为了实现低产质粒产物的大规模纯化,中和溶胞液的保持期可以缩短至小于1小时。在一些实施方式中,可以在其产生时同时处理中和的溶胞液溶液,因此在容器中的保持时间是可忽略的。在一些实施方式中,在收集容器中的溶胞液的约5分钟至约60分钟的周期后,通过以下方法同时处理溶胞液溶液。溶胞液保持时间的缩短或消除还可除去容器对处理能力的限制,因为在其产生时立即处理溶胞液。
中和后,可以通过任何固/液分离方法使中和的溶胞液溶液澄清,例如,袋滤、柱体过滤、分批离心、连续离心。期望完全除去溶液中的颗粒以避免后续纯化方法中膜或柱的堵塞。同时,可以不使溶胞液经受将切碎基因组DNA并引起基因组DNA、碎片基因组DNA、内毒素及其它污染物向含质粒溶液中释放的过度剪切力。分批过滤可以用于处理小体积的溶胞液,但是在大规模情况下是不实用的。连续离心也是不适合的,因为沉淀物会经受高剪切应力并向溶液释放较高水平的污染物。在一些实施方式中,可以利用使用不同等级过滤介质的一系列过滤。一级过滤可以用于除去大部分范围在微米尺寸的大细胞絮状物,而后续二级过滤保留剩余的细颗粒。当对于后续过程期望严格澄清度并且二级过滤不充分时,可以实施任选的三级过滤。
在分离澄清的溶胞液后,在一些实施方式中,可以对含有所关注的细胞组分的溶液进行离子交换色谱法。优选地,使用基于膜的方法进行该过程。优选地,该过程是阴离子交换膜色谱法。在本文其它处进一步详细公开了实施该步骤的具体方法。
在离子交换色谱法后,对由离子交换色谱法所产生的部分纯化的材料进行疏水相互作用色谱法。优选地,使用基于膜的方法进行该过程。在下文中详细地进一步公开了实施该步骤的具体方法。在某些实施方式中,可以省略该步骤。
此后,对由疏水相互作用色谱法(如果实施)或离子交换色谱法(如果省略HIC)所产生的材料进行超滤和渗滤以浓缩所关注的细胞组分并从溶液除去过量的盐。超滤/渗滤的使用对于本领域技术人员是熟知的,特别是对于生物大分子,如蛋白或质粒。
在过滤步骤后,在一些实施方式中,任选地对浓缩并脱盐的产物进行无菌过滤,例如,使其适合于药物使用。另外,用于实施该步骤的方法完全在本领域技术人员的知识范围内。
如果需要,可以对浓缩、脱盐产物进一步进行无菌过滤。用于实施这种操作的多种方法是熟知的,并且将在本领域技术人员的能力范围内。当产物是质粒时,可以优选地使用截留分子量(cut-off)为0.22um的Pall AcroPak 200过滤器进行无菌过滤。所得的纯化、浓缩、脱盐、无菌过滤的质粒基本不含杂质,如蛋白、基因组DNA、RNA和内毒素。如通过二辛可宁酸测定(Pierce Biotechnology,Rockford,Ill.)所确定的,残余蛋白将优选地小于约1%(按重量计)并且更优选地小于或等于约0.1%。如通过鲎变形细胞溶解物(“LAL”)测定所确定的,残余内毒素将优选地小于约100内毒素单位/毫克质粒(EU/mg)。更优选地,内毒素将小于约50EU/mg,最优选地小于约20EU/mg。残余RNA优选地小于或为按重量计约5%,更优选地小于或为约1%(通过琼脂糖凝胶电泳或疏水相互作用HPLC)。残余基因组DNA优选地小于按重量计约5%,更优选地小于约1%(通过琼脂糖凝胶电泳或狭缝印迹)。
本领域技术人员将认识到可以通过增减、减少或替换对于溶胞线圈设备所选的步骤或方法,包括本领域中已知或可用,但在本文中未明确提及的那些来改变本发明。认为所有这些改变是本发明的一部分。因此,在一个实施方式中,本发明提供了使用鼓泡混合器将细胞溶胞液或含有所关注的细胞组分的流体与一种或多种其它流体混合的方法。在其它实施方式中,本发明提供了使用鼓泡混合器来混合细胞溶胞液与沉淀溶液,同时还提供了气泡在沉淀细胞组分中的截留(entrapping)。在另一个实施方式中,本发明提供了包括可以用于实践上述方法的鼓泡混合器的装置。更进一步,本发明提供了使细胞溶胞的方法,包括使用所提供的溶胞线圈设备将细胞悬浮液与溶胞溶液混合,然后使用鼓泡混合器将溶胞细胞与沉淀溶液混合的组合。在另一个实施方式中,本发明提供了从流体溶胞液分离沉淀的细胞组分的方法,包括使用鼓泡混合器将气泡截留在沉淀的细胞组分中,在储槽中收集材料,使沉淀的细胞组分形成漂浮层,任选地施加真空以压紧沉淀组分并对溶胞液脱气,并通过将其从沉淀组分下方排出或泵出来回收流体溶胞液。在另一个实施方式中,本发明提供了从细胞溶胞液纯化所关注的细胞组分的方法,包括使溶胞液经受离子交换膜,任选地疏水相互作用膜、超滤/渗滤程序,以及任选地,无菌过滤程序。本发明还涵盖了当前实施方式中的每一个以及一个或多个实施方式的任何组合。
具体参考本文对于质粒生产所公开的步骤描述了本发明的创新教导内容。然而,本领域技术人员应理解对于质粒生产的这些步骤和方法的使用仅提供了本文中多种有利使用和创新教导内容的一个实例。在不以任何方式背离本发明的精神和范围的情况下,可以对所公开的方法进行多种非实质性改变、修改和替换。提供以下实施例以说明本文所公开的方法和装置,并且决不应将其视作对本发明范围的限制。
单独的测试表明与在相等处理流速下的1”ID线圈相比,3/4”ID线圈经由更快速的线速度提供了更均匀的线性流。
另一组测试表明当将流速缩小至与1”ID线圈相同的线速度时,3/4”ID线圈显示出更均匀的线性流。这表明溶胞线圈的最优最大ID是3/4”,并且应通过提高或降低线圈的长度来针对更快的流速将保持时间调整至5+/-1分钟。可以使用具有较小内径和相等长度的溶胞线圈以保守的线速度完成低流速下的处理。
为了确定线圈的最佳角度,在24”直径支架上以3’高和6’高测试了1”ID和3/4”ID的线圈。1”和3/4”ID线圈两者在6’总高下分别在3.43°和2.15°的角度下表现的更好。3/4”ID线圈表明粗溶胞液通过线圈的更均匀的线性流。
这些组测试表明以2.15-3.43°角度,3/4”ID线圈将产生溶胞线圈的最佳性能。
由于期望一次性溶胞线圈,因此将原型支架设计为适于3/4”ID一次性溶胞线圈的快速、简单和稳定安装,其长度要求获得4-6分钟的保留时间,并且角度必需有利于均匀的线性流。将原型成功用于不同生产规模的多个生产批次。
将原型进一步发展成当前的设计。将聚丙烯开槽圆柱体设计成以2.15°角保持160英尺长的3/4”ID管。与原型相比,这种设计有利于溶胞线圈更快速且更稳定的安装,同时保持粗溶胞液通过线圈所期望的线速度和均匀流动。
另一组测试研究了两个溶胞线圈中线圈保持时间、流体流速和流体线速度之间的关系,其中第一线圈是160英尺长的3/4英寸ID的管,而第二线圈是150英尺长的3/8英寸ID的管。图6A和图6B分别显示了结果。
从400L发酵批料生产DNA质粒的方法包括:i)细胞溶胞和过滤;ii)Mustang Q阴离子交换膜色谱;iii)丁基疏水相互作用色谱;和iv)超滤/渗滤(UF/DF)。图7A和图7B中总结了质粒A的纯化数据。
通过miniprep法,估测细胞糊中的初始DNA质粒为3.17g/kg WCW(湿细胞重),并且纯化前的初始质粒为71.3g。最终的UF产物为5.3g,从而得到7.4%的整体纯化得率。确定该结果是400L发酵批料的不正常得率。
对每个步骤进行得率分析(参见图7A和图7B)。UF(iv)的步骤得率>100%,因此作为低得率的原因排除步骤iv。丁基步骤(iii)对于总DNA的回收率为34.8%,其似乎低于典型的60%的回收率。然而,凝胶14Jul11-4(图7A和图7B)显示,由于用3M硫酸铵的1:4v/v的上样稀释,在流通液中除去了开环(OC)和gDNA的百分比。无迹象表明在丁基步骤中损失了超螺旋质粒产物。考虑到丁基上样中约60%的RNA,质粒的回收率为87.0%。因此,步骤iii不是得率降低的原因。Q步骤(ii)获得了14.3g总DNA,但是基于质粒A粗溶胞液(图8)的HPLC分析,Q之前的初始材料估计为10.4g总DNA。Q产物中所估计的5.7g质粒得到约58.1%的Q步骤质粒回收率(与5kb质粒的约50%的Q回收率相当),从而表明步骤ii的表现是典型的。由于排除了步骤ii、iii和iv,因此推断步骤I是导致纯化得率降低的主要阶段。
如图8所示,再悬浮细胞和不同阶段的溶胞液的HPLC分析显示了细胞和粗溶胞液样品之间明显的浓度降低。再悬浮细胞仍具有2.8g/kg WCW的总得率,这与3.17g/kg的初始估计相当。但是粗溶胞液具有0.9g/kg WCW的得率,其浓度降低了68%。估计由于过滤所造成的35%的体积降低合计造成了步骤i中86%的质粒损失。合并的溶胞/过滤回收率仅为13.8%。物料衡算推断初始溶胞阶段(而非过滤)是质粒A的低得率的根本原因。
研究了有助于细胞溶胞过程的可能因素,其包括a)空气流、b)鼓泡塔内径、c)空气分布器、d)溶胞线圈、e)混合器、f)溶液、g)操作人员和h)室温。检查了来自6个不同质粒生产批次(质粒B、C、D、A、E和F)的数据(参见图9)。当它们处于规定范围内时,推断因素a、b、c和e的影响最小。认为因素f是最小因素,并且当环境温度小于或等于25℃时完全消除。相对于操作人员,因素g不表明任何趋势,因此不是低得率的原因。因素h室温可以导致溶液储存差异,但是与其它纯化批次相比,对一次质粒纯化未识别出明显差异。
认为导致低溶胞得率的最可能原因是因素d-溶胞线圈。在质粒E和质粒F的生产运行之前,清洁、消毒并再使用溶胞线圈。对于这些质粒,实施了新线圈的再组装。由不同的操作人员进行线圈角度和高度的改变,这可以影响不同运行期间粗溶胞液的流动均匀性。粗溶胞液5+/-1min的保持时间对于细胞完整度和之后的质粒复性是重要的。使用不同长度和角度的不同线圈实施了3次生产设计测试。在图10A至图10C中提供了数据和结论。与测试#2—1英寸内径和100英尺长相比,在使用较小内径线圈—3/4英寸内径和160英尺长的测试#3中,观察到粗溶胞液的线性流更均匀。在测试#3的整个运行期间,确认了5+/-1min的保持时间,但是对于1英寸内径的溶胞线圈怀疑相差>30%的粗溶胞液浓度变化。对于3/4英寸内径溶胞线圈表明得率升高,并且对于质粒F的生产运行布置了该线圈。
使用内径(ID)为3/4”并且由聚氯乙烯(PVC)(Thermoplastic Processes)制成的溶胞线圈进行质粒F的纯化。PVC管符合USP VI级并且根据21CFR 178.3740生产。另外,对于该生产方法中使用的连接器选择HDPE。HDPE连接器由Cole Parmer销售,并且是USP VI级材料且根据21CFR177.1520生产。溶胞线圈足够长以产生5+/-1分钟的溶胞保持时间,其中在每端上具有不锈钢1/2”倒钩接头。这得到了具有160英尺长的溶胞线圈。
与1英寸内径的使用相比,3/4”内径溶胞线圈的使用提高了得率并且降低了溶胞过程的变化。更具体地,使用新线圈对质粒F、质粒G、质粒H和质粒I进行生产运行。图12中总结了6个连续批次的纯化数据,其中2个批次使用1英寸内径线圈,而4个批次使用3/4英寸内径线圈。在图13中总结了溶胞液样品中质粒浓度的HPLC分析。在图14中提供了6个批次的整体释放测试结果的总结。在图15A和图15B中显示了6个批次的溶胞和Q过程的凝胶分析。图16A至图16F显示了6个批次的溶胞液样品的HPLC分析。
对个整个纯化过程,质粒A具有7.4%的低得率(图12,24行)。Q纯化步骤的产物得率比初始估计低得多(图12,8和9行)。在溶胞中识别出根本原因。与通过mini-prep的初始得率估计(图13,4行)相比,过滤的溶胞液中的质粒得率仅为20.8%(图13,10行)。这种质粒损失是不寻常的并且主要是由于1英寸ID溶胞线圈不一致的保持时间所造成的。凝胶分析确认质粒浓度降低并且Q洗脱液中基因组背景高(图15A和图15B)。能够通过1:4v/v 3M硫酸铵的丁基上样条件降低高gDNA杂质,但是随后无法恢复溶胞步骤中的质粒损失。
质粒E的整体纯化得率小于15%(图12,24行),并且Q得率小于初始估计(图12,8和9行)。与质粒E有关的其它OOS在整体产物中为高gDNA(图14,14行)。1英寸ID溶胞线圈的使用导致过滤的溶胞液中的质粒产量(48.9%)降低,并且gDNA的变性不充分。无法通过1:5v/v3M硫酸铵的丁基上样条件消除溶胞液和Q洗脱液中的高gDNA(图15A和图15B)。因此,最终产物具有6%的gDNA,它比可以实现的典型过程高10-100倍。
质粒F是实施3/4”ID溶胞线圈的第一个cGMP批次。Q步骤的实际得率为61.7%(图12,9行),这与估计值相似(图12,8行)。典型的整体纯化得率为约30%。总得率为21.5%,但是主要受丁基步骤中产物损失的影响。与通过mini-prep的初始得率估计(图13,4行)相比,过滤的溶胞液中的质粒得率为104%(图13,10行)。凝胶分析确认所有溶胞液样品中质粒浓度一致,并且Q洗脱液中基因组背景低(图15A和图15B)。最终的整体释放测试结果表明了低杂质分布谱,具体地gDNA:0.03%(图14,14行)。对于质粒F,3/4”溶胞线圈的使用防止了低溶胞得率和高gDNA的潜在问题。实现了高得率(直至Q步骤)和高质量产物。
质粒G测试还实施了3/4”溶胞线圈。Q步骤的实际得率为58.5%(图12,9行),这高于估计值(图12,8行)。整体纯化得率为44.0%,高于之前3个纯化运行。过滤的溶胞液中的质粒得率为90.9%(图13,10行),这与初始得率估计一致(图13,4行)。凝胶分析还表明所有溶胞液样品中质粒浓度一致,并且Q洗脱液中基因组背景低(图15A和图15B)。使用了1:5v/v3M硫酸铵的丁基上样条件,其对gDNA的减少影响很小。然而,最终的整体gDNA为0.2%(图14,14行)。另外,对于质粒G,3/4”ID溶胞线圈的使用实现了高得率(Q步骤和整体得率)和高质量产物。
与质粒G相比,对于质粒H实现了类似的结果。通过使用3/4”ID溶胞线圈证明了高得率(Q步骤和整体得率)和高质量产物。
质粒I在Q步骤具有稍微较低的得率(图12,9行),但是认为这与特定的Q囊(胶囊,囊膜,capsule)有关,并且具有Q步骤和整体的高质量。与初始得率估计值(图13,4行)相比,过滤的溶胞液中的质粒得率为88.2%(图13,10行)。预计通过过滤Miniprep变化和浓度降低,并且大于或等于80%的得率百分比是正常的。还使用了1:5v/v 3M硫酸铵的丁基上样条件,并且最终的整体gDNA为0.2%(图14)。因此,对于质粒I,3/4”ID溶胞线圈的使用还实现了优良的得率和高质量产物。
本文所引用的每篇专利、专利申请和公开的公开内容以其全部内容作为参考并入本文。尽管已参考具体实施方式公开了本发明,但是显然在不背离本发明的真正精神和范围的情况下,本领域其它技术人员可以设计本发明的其它实施方式和变化。所附权利要求旨在视为包括所有这些实施方式和等价变化。
- 用于分离和纯化多核苷酸的溶胞线圈设备及其用途
- 溶素-抗微生物肽(AMP)多肽构建体、溶素、其分离的编码多核苷酸及其用途
