表达人源化抗体的非人转基因动物及其用途
文献发布时间:2023-06-19 10:41:48
本申请为分案申请,原申请的申请日为2009年11月30日,申请号为200980151815.7(PCT/GB2009/002781),发明名称为“表达人源化抗体的非人转基因动物及其用途”。
发明领域
本发明涉及使用转基因非人哺乳动物响应抗原攻击而衍生和选择各种功能性亲和力成熟四聚体免疫球蛋白(包含重链和轻链)库的改进方法及其用途。
具体地讲,本发明涉及经过工程改造使得其产生小鼠内源κ和/或λ轻链免疫球蛋白的能力大大降低或者轻链与重链复合的能力降低、消除或被阻断的非人哺乳动物,优选小鼠。本发明的非人哺乳动物产生小鼠功能性内源重链的能力也下降。因此,其形成包含由所述突变基因座产生的重排重链和轻链的功能性免疫球蛋白四聚体的能力已大大降低或消除。本发明还披露了产生这类哺乳动物的方法以及利用这类哺乳动物使用免疫球蛋白重链和轻链转基因产生人四聚体抗体和杂交四聚体抗体的方法。
在下面的说明中,所有氨基酸残基的位置号根据由Kabat等人((1991),美国公共卫生署(US Public Health Services)出版物第91-3242号)设计的编号系统给出。
发明背景
抗体
抗体的结构是本领域众所周知的。大多数天然抗体是四聚体,包含2条重链和2条轻链。重链通过大致位于每条重链中部的铰链结构域之间的二硫键彼此连接。轻链在铰链结构域的N端侧与各重链缔合。每条轻链通常通过接近铰链结构域的二硫键与其对应的重链结合。
当抗体分子正确折叠时,每条链折叠成许多通过较为线性的多肽序列连接的独特的球状结构域。例如,轻链折叠成可变(V
体外操纵重链免疫球蛋白基因以构建新的抗体最早披露于二十世纪八十年代。大多数早期抗体工程研究使用针对充分表征的抗原产生的重排小鼠免疫球蛋白μ基因(IgM)。该抗体的特征是已知存在于V
正常人B细胞在14号染色体上含有单个免疫球蛋白重链基因座,通过重排从中产生编码重链的基因。在小鼠中,重链基因座位于12号染色体上。正常的重链基因座包含多个V基因区段、许多D基因区段和许多J基因区段。大多数V
现可从响应抗原攻击的转基因小鼠中得到全人抗体(H
一种不同的方法是通过破坏编码鼠重链的基因的膜外显子(membrane exon)来限制小鼠B细胞发育和免疫球蛋白分泌。因此,虽然内源鼠重链基因由于在响应抗原攻击时被转录并进行VDJ重排而具有功能,但是因为IgM从不在前B细胞的细胞表面上表达,所以进一步的发育受到抑制,导致对抗原攻击非生产性的应答(Kitamura等(1991)Nature,350,423-426),即使内源小鼠κ和λ轻链基因两者仍保持结构完整和功能性也是如此(Tuaillon(2000)Molecular Immunology,37,221-231)。
在内源小鼠重链和轻链基因座保持功能的情况下,任何其它引入的免疫球蛋白重链转基因也受等位基因排斥的调节,因此一些B细胞只功能性表达小鼠重链和轻链基因座,而其它B细胞只功能性表达人重链基因座和小鼠轻链基因座(Nussenzweig等(1987)Science,236,816-819)。在任何单个非人转基因动物中存在高度多样化的表达抗体的B细胞群,所述抗体响应不同抗原攻击而来源于可能所有免疫球蛋白基因座。采用已确立的杂交瘤技术,利用HAT选择进行随后的抗原特异性抗体的选择(Davis等(1982)J.Immunol.Methods,50,161-171)无法区分表达一种重链免疫球蛋白基因座的杂交瘤与表达另一种重链免疫球蛋白基因座的杂交瘤。
免疫球蛋白重链转基因中存在的调节元件包含必需的组织特异性增强子元件以确保以拷贝数依赖性方式进行B细胞特异性表达。5’内含增强子和3’LCR的存在确保了转基因在B细胞成熟的所有阶段都有活性(Guglielmi等(2003)Biochim.Biophys.Acta,1642,181-190)。在转基因座中加入重链和轻链特异性LCR确保不仅表达是B细胞特异性的,而且不论整合入基因组的位点都进行表达(WO90/10077,Mills等(1997)J.Exp.Med.,186,845-858和Pettersson等(1997)Immunobiol.,198,236-248))。因此,假若存在LCR,则每个转基因不论其在基因组中的位置都具有功能。在存在于转基因的LCR部分缺失的情况下,转基因周围的染色质在任何时间点只是部分对转录开放,导致位置效应镶嵌表达(mosaicexpression),因此转基因跨靶组织的表达水平受限(Festenstein等(1996)Science,23,271(5252):1123-5;Milot等(1996)Cell,87(1),105-14)。
在小鼠背景中产生人免疫球蛋白的备选方法是用人的同源基因区段置换鼠免疫球蛋白基因区段。因此,如果只是小鼠V、D和J基因区段被人同源物置换,则在抗原攻击后可形成包含人V
因此,在本领域中仍需要不依赖于基因组DNA大量区段缺失或多重缺失的方法,这允许(i)简化小鼠的产生,该小鼠在响应抗原攻击时以B细胞特异性的方式表达内源重链和轻链免疫球蛋白基因的能力大大降低,或者在抗原攻击后在B细胞中表达内源免疫球蛋白重链和/或轻链基因,但是编码缺乏装配成为功能性免疫球蛋白四聚体的能力的免疫球蛋白重链和轻链蛋白,导致对抗原攻击的非生产性应答;(ii)用于构建并B细胞特异性表达多个重链转基因座的可再现的简化方法,所述重链转基因座尽管可总共包含所有39个人V基因区段,但各自包含优选的较小的V基因区段群,各与所有D和J基因区段以及一些或全部恒定(效应子)区组合,其功能性表达是抗原依赖性的,并且最终由等位基因排斥确定;以及(iii)具有这样的能力:选择排除表达残余内源小鼠免疫球蛋白的杂交瘤,并选出表达和分泌装配的包含存在于重链转基因座上的完整V区段库的免疫球蛋白四聚体的杂交瘤,或者选出表达存在于与另一重链转基因座相对的重链转基因座上的一亚组V基因区段的杂交瘤。
发明详述
根据本发明第一个方面,提供含有内源λ轻链基因座、内源κ轻链基因座和内源重链基因座的非人哺乳动物,每个基因座可重排使得在抗原攻击后在B细胞中形成并表达免疫球蛋白重链和轻链基因,但是所述基因座已经突变使得形成包含从所述突变基因座产生的重排重链和轻链的功能性免疫球蛋白四聚体的能力已大大降低或消除。
在非人哺乳动物中,可通过将移码突变、多肽编码序列和/或一个或多个终止密码子引入某内源基因座或各内源基因座中,使内源λ轻链基因座、内源κ轻链基因座和内源重链基因座的至少一个已发生突变。
突变优选为插入小于50个核苷酸。
在非人哺乳动物中,可通过剔除某基因座或各基因座的部分或全部LCR,使内源λ轻链基因座、内源κ轻链基因座和内源重链基因座的至少一个的表达已大大减少。
优选引入位于内源κ轻链基因座上。
备选地,引入位于内源λ轻链基因座上。
在另一备选中,引入位于内源κ轻链基因座和内源λ轻链基因座上。
引入还可位于内源重链基因座上。
在进一步的备选中,引入可位于内源κ轻链基因座和内源重链基因座上。
在又进一步的备选中,引入可位于内源λ轻链基因座和内源重链基因座上。
在更进一步的备选中,引入可位于内源λ轻链基因座、内源κ轻链基因座和内源重链基因座上。
优选在内源κ轻链基因座上有如上限定的引入,并且在内源λ基因座上有部分或完整的如上限定的LCR缺失。
如有需要,可使内源重链基因座突变,使得发生重链基因重排、mRNA转录和蛋白质合成,但是阻断B细胞活化。
优选如上定义的非人哺乳动物包含含有一个或多个异源κ轻链基因座和相关B细胞特异性调节元件的转基因。
非人哺乳动物还可包含含有一个或多个异源λ轻链基因座和相关B细胞特异性调节元件的转基因。
在如上定义的非人哺乳动物中,含有异源轻链基因座的转基因可包含显性选择标记基因。
如上定义的非人哺乳动物还可包含含有一个或多个异源重链基因座和相关B细胞特异性调节元件的转基因。
如有需要,非人哺乳动物可包含两个或更多个含有两个或更多个不同的异源重链基因座和相关B细胞特异性调节元件的转基因。
在非人哺乳动物中,含有异源重链基因座的某转基因或每个转基因可包含显性选择标记基因。
在非人哺乳动物中,每个异源重链基因座可包含CTCF结合位点。
优选非人哺乳动物包含含有异源κ轻链基因座的转基因和含有一个或多个异源重链基因座的转基因。
备选地,非人哺乳动物可包含含有异源λ轻链基因座的转基因和含有一个或多个异源重链基因座的转基因。
在进一步的备选中,非人哺乳动物可包含含有异源κ轻链基因座的转基因、含有λ轻链基因座的转基因和含有一个或多个异源重链基因座的转基因。
优选每个异源基因座整合了关联LCR。
每个异源基因座优选为人基因座。
然而,每个异源基因座可以是包含来源于多于一种物种的可变区和恒定区的杂交基因座,例如包含人可变区和大鼠或鼠恒定区的杂交基因座。
非人哺乳动物可包含含有不同群的不同异源重链基因座的转基因群,其中每个转基因群包含不同的显性选择标记基因。
备选地,非人哺乳动物可包含含有异源轻链基因座的转基因和含有异源重链基因座的转基因,其中含有异源轻链基因座的转基因和含有异源重链基因座的转基因各自包含不同的显性选择标记基因。
非人哺乳动物优选为啮齿动物,例如小鼠。
按照第二个方面,本发明提供产生抗原特异性异源单克隆抗体的方法,所述方法包括:
(a)用抗原对前述权利要求中任一项的非人转基因哺乳动物进行免疫;
(b)从免疫的转基因哺乳动物的B细胞制备分别产生单克隆抗体的杂交瘤或无限增殖化B细胞系;
(c)任选地,通过使用存在于包含异源免疫球蛋白轻链和重链基因座的转基因上的显性选择标记基因来选择至少一种表达异源抗体的杂交瘤或无限增殖化B细胞系;以及
(d)选择至少一种产生与抗原特异性结合的抗体的杂交瘤或无限增殖化B细胞系。
按照本发明又一个方面,提供由杂交抗体得到哺乳动物(优选人)的抗体的方法,所述方法包括:
(a)进行上述方法;
(b)选择至少一种产生特异性结合抗原并包含选定物种的V
(c)对V
(d)使选出的包含V
(e)在选定的细胞类型中使用表达载体共表达再克隆的编码所需物种的重链和轻链多肽的序列。
按照本发明又一个方面,提供用于产生如上定义的非人哺乳动物的方法,所述方法包括使哺乳动物祖细胞中的内源重链基因座、内源κ轻链基因座和任选内源λ轻链基因座突变,并由所述祖细胞产生哺乳动物,其中突变使得:在哺乳动物中,每个基因座可以重排,使得在抗原攻击后在B细胞中形成并表达免疫球蛋白重链和轻链基因,但是形成包含由所述突变基因座产生的重排重链和轻链的功能性免疫球蛋白四聚体的能力已大大降低或消除。
优选祖细胞为非人胚胎干细胞。
非人哺乳动物优选为啮齿动物,例如小鼠。
本发明还提供使用如上定义的非人哺乳动物或方法得到的优选人的抗原特异性异源功能性免疫球蛋白四聚体作为药物、诊断剂或试剂的用途。
本发明的发明人通过开发用于产生非人哺乳动物(特别是小鼠)的简化方法,预料不到地克服了现有技术的局限,其中通过由优选在κ恒定区和/或λ恒定区中导致移码或mRNA翻译过早终止的小插入事件引起恒定区非功能性,或者通过部分或全部剔除关联内源LCR,使内源κ和/或λ轻链基因的功能性表达大大减少。这与需要通过完全或部分缺失一些或所有轻链基因编码序列而使内源免疫球蛋白轻链基因功能性沉默的备选策略截然不同。
所述策略同样可很好地应用于免疫球蛋白重链基因座。因此,例如,LCR的完全或部分缺失将引起重链基因表达大大减少。优选在μC区的C
因此,内源轻链基因座和/或重链基因座产生相互作用并形成功能性免疫球蛋白四聚体的重链和轻链的能力在引入移码突变后可消除或大大降低,因为移码突变导致无关蛋白序列的合成,并一般伴有由存在异读框终止密码子引起的蛋白质合成过早终止。
这可通过在负责形成功能性免疫球蛋白四聚体的重链或轻链多肽序列中或上游插入外源DNA或者少量缺失DNA来实现。优选的方法是插入新的序列。所设计的在氨基酸编码序列中引起移码、导致编码mRNA的翻译过早终止的有效插入事件,可限于单个核苷酸的引入。因此,编码区内插入一个或多个核苷酸(nucleocleotide)可导致移码。备选地,编码其它肽且包含终止密码子的序列的框内插入也将导致截短蛋白的合成(US5591669)。靶向插入事件也可包括引入选择标记基因和其它功能体,条件是保留所有内源序列,且所得融合蛋白破坏免疫球蛋白四聚体的形成,或者一个或多个框内终止密码子的存在引起mRNA翻译的过早终止,导致不能形成功能性免疫球蛋白四聚体的截短蛋白的合成。
优选插入事件位于免疫球蛋白κ轻链恒定区。任选插入事件位于免疫球蛋白κ和/或λ轻链恒定区。实际上,插入可包含任何重组酶识别位点,例如lox位点。仅此就可导致移码。加入确保移码的其它核苷酸或者一个或多个终止密码子的密码子,也可提高插入序列在破坏重链和轻链通过重链C
对于本领域技术人员显而易见的是,移码和截短蛋白的合成还可通过在编码序列中缺失一个或多个核苷酸以及加入包含终止密码子的最小添加序列来实现。优选插入或缺失事件发生在重链和轻链基因的恒定区,而不发生在内源基因座的多个V、D和J区。优选的选择是κ轻链恒定区。
因此,对于消除内源免疫球蛋白基因重排或mRNA转录,不依赖大规模基因缺失的策略。相同的插入策略可用来通过重链同种型C
假若内源免疫球蛋白四聚体的功能性装配在功能上受损,则具有V
本发明还提供非人哺乳动物,其中通过剔除部分或全部λ轻链LCR使内源λ轻链基因表达大大减少,通过剔除部分或全部κ轻链LCR使内源κ轻链基因表达大大减少。在本发明的一个实施方案中,通过剔除部分或全部相关LCR,仅使内源κ轻链表达大大减少,或者仅使λ轻链表达大大减少。
内源轻链基因座可保持功能性,因为它们可以重排,并被转录为功能性mRNA,但是转录水平通过剔除一些或全部内源LCR功能性而大大降低(WO90/10077)。通过在小鼠ES细胞中靶向核酸酶超敏位点的基因,或者在ES细胞不存在时通过使用核移植(Soulter(1998)Nature,394,315-316)或来源于其它哺乳动物物种的iPS细胞(参见Gottweiss.和Minger(2008)Nature Biotechnology,26,271-272)进行克隆,除去LCR功能性。备选地,可通过靶向诱变,例如锌指核酸酶技术和DNA修复(例如http://www.sigmaaldrich.com/life-science/functional-genomics-and-rnai/zinc-finger-nuclease-technology),实现重链或轻链的破坏。
通过剔除部分或全部κ轻链LCR,可使内源κ轻链基因表达大大减少,而在缺失或插入事件之后,可使λ轻链基因在功能上沉默。
通过剔除部分或全部λ轻链LCR,可使内源λ轻链基因表达大大减少,而在缺失或插入事件之后,可使κ轻链基因在功能上沉默。
在LCR剔除或插入事件之后,可使内源κ轻链基因在功能上沉默。
本发明还提供非人哺乳动物,其中通过剔除部分或全部κ轻链LCR和/或剔除部分或全部λ轻链LCR,使内源κ轻链基因表达和内源λ轻链基因表达的任一种或两种大大减少。通过剔除部分或全部λ轻链LCR,可使内源κ基因在功能上沉默且使内源λ基因活性大大降低。
通过剔除部分或全部κ轻链LCR,可使κ轻链基因表达大大减少,并且使λ基因表达在功能上沉默。
可通过剔除κ链LCR而大大减少或者通过缺失或插入事件而在功能上沉默仅内源κ轻链基因表达。
上述内源κ和/或λ轻链基因表达在功能上沉默或者内源κ和/或λ轻链基因表达大大减少的非人哺乳动物,其内源重链基因表达也可减少或在功能上沉默。按照一个实施方案,在本发明的非人哺乳动物中,内源重链基因表达在缺失一些或全部包含LCR的核酸酶超敏位点后减少,或者在缺失或插入事件之后在功能上沉默。优选在前B细胞阶段阻断内源重链基因的表达,使得内源重链不在B细胞表面上表达,并且采用与Kitamura等人(Kitamura等(1991)Nature,350,423-426)所述类似的策略,阻断由B细胞膨胀引起的生产性表达。
上述非人哺乳动物另可包含一个或多个包含异源重链和轻链基因座及相关的B细胞特异性调节元件(优选包含关联LCR)的转基因。
在本发明的上下文中,术语“异源(的)”是指对于其所位于的哺乳动物而言不是内源的本文所述核苷酸序列或基因座。
因此,非人哺乳动物可包含含有异源κ轻链基因座和相关的B细胞特异性调节元件(优选包含LCR)的转基因和/或含有异源λ轻链基因座和相关的B细胞特异性调节元件(优选包含LCR)的转基因。
关联LCR的存在不是B细胞特异性表达所必需的。在基因座内包含关联LCR确保高水平转基因表达发生在每个整合位点,而不依赖于只有一些整合事件偶尔发生在B细胞中活跃转录的染色质区内的随机整合事件。关联LCR的使用显著减少筛选抗体表达所需要的转基因动物的数量,并允许插入多于一个的基因座,确保插入的所有基因座可以B细胞特异性方式按基本正常的水平表达。因此,LCR技术的应用,结合等位基因排斥机制可将内源免疫球蛋白基因与多个竞争转基因区分开来的出人意料的观察结果,开启了包含一个或多个免疫球蛋白重链或轻链基因座的转基因非人哺乳动物的装配途径,每个因座的V基因的复杂性比内源基因的低,而且与内源基因座(1-2Mb)相比,包含相对易处理的DNA断片(<300Kb)以进行体外装配。例如,可将39个功能性人免疫球蛋白重链V基因区段克隆至两个或更多个免疫球蛋白重链基因座上。每一个可包含不同的V基因区段,但却具有共同的D和J基因区段及恒定(效应子)区。加入LCR确保了不论基因组内的整合位点,每一个都以相同的方式表达。因此,与存在于技术上难以操作的单个大基因片段上的单个更复杂基因相比,以这种方式加入两个或更多个小基因座提供相同的V基因复杂性。
每个异源轻链基因座可包含V
备选地,异源轻链基因座可以是包含哺乳动物源(优选人源)的可变结构域和来自不同哺乳动物的恒定(效应子)区的杂交基因座,该不同哺乳动物例如但不限于小鼠、大鼠、仓鼠、兔、猪、山羊和牛。如果宿主哺乳动物是小鼠,则优选恒定区来源于啮齿动物,更优选为小鼠或大鼠。这类异源轻链基因座包含优选仅来自一个物种的V
如果预期杂交κ轻链转基因,则V
所预期的所有轻链转基因的特征是,在抗原攻击后,轻链以B细胞特异性方式重排,在转录和翻译后,所得轻链能够与在同一B细胞中产生的转基因来源的重链免疫球蛋白复合。免疫球蛋白四聚体的生产性表达引起B细胞膨胀和转基因编码的抗原特异性四价免疫球蛋白复合体在缺乏显著水平的内源免疫球蛋白四聚体时在血清中蓄积。
如果内源λ轻链表达在功能上未受抑制,则可检测到低水平的包含内源λ轻链的宿主抗体或杂交抗体。这些可在筛选杂交瘤上清液后弃去。
在人中,有36个功能性κV
存在于本发明非人哺乳动物的转基因上的异源λ轻链基因座优选包含鼠λLCR及人λ轻链V1和V2基因区段、人λJ1、J2、J3和J4基因区段及人λ轻链C1、C2、C3和C4恒定区区段(WO90/10077和WO2003/000737)。任选人λ轻链C1、C2、C3和C4恒定区区段可置换为优选大鼠或小鼠源的备选λ轻链恒定区。
存在于本发明非人哺乳动物的转基因上的异源重链基因座优选包含重链免疫球蛋白LCR(优选为鼠源)、一个或多个人V基因区段,一个或多个J基因区段和一个或多个D基因区段。优选存在10个或更多个不同的人V基因区段及所有的人J和D基因区段。
基因座还可包含一个或多个人恒定(效应子)区,优选μ和γ恒定区。任选人恒定效应子区可置换为来自其它非人哺乳动物的效应子区。如果非人哺乳动物宿主是小鼠或大鼠,则优选恒定(效应子)区来源于大鼠或小鼠。与人的相比,小鼠和大鼠B细胞受体复合体(BCR)的跨膜结构域是100%保守的。因此,在抗原攻击后,包含大鼠恒定(效应子)区基因的抗体基因座的小鼠转基因应发挥与包含小鼠恒定(效应子)区基因的基因座一样良好的作用,并且可优于包含人恒定(效应子)区基因的基因座(De Franco等(1995)Ann.NYAcad.Sci.,766,195-201)。转基因可包含优选小鼠或人源的重链、κ和λ轻链LCR。在所有哺乳动物物种中起作用的LCR是已知的,并且可替代转基因的人或小鼠LCR(Li等(1999)Trends Genet.,10,403-8)。
如果预期产生完整人抗体,则克隆的来源于由杂交瘤表达的杂交抗体的人抗原特异性V
作为进一步的改进,每个免疫球蛋白κ和/或λ轻链基因座还可包含显性选择标记基因。
掺入基因座的显性选择标记基因可具有相同或不同的作用机制。对于本发明的目的,可使用任何显性选择标记基因,条件是在选择性或毒性攻击存在下,该基因的表达为杂交瘤或来源于非人转基因哺乳动物的转化B细胞提供选择性益处。通常,显性选择标记基因是原核来源的,并选自:赋予有毒药物抗性的基因,例如嘌呤霉素(Vara等(1986)NAR,14,4617-4624)、潮霉素(Santerre等(1984)Gene,30,147-156)和G418(Colbere-Garapin等(1981)150,1-14),或者包括这样的基因:其消除对某些营养的需要,使得其表达将有毒物质转化成必需氨基酸,例如将吲哚转化为色氨酸或将组氨醇转化为组氨酸(Hartmann和Mulligan,(1988)PNAS,85,8047-8051)。
本发明这个方面的必要条件是,将显性选择标记掺入免疫球蛋白轻链转基因座内,并且与所需的免疫球蛋白轻链等位基因共表达,以确保B细胞特异性表达。备选地,可采用同源重组结合ES细胞或核移植方法,将药物抗性基因插入内源或外源(转基因)免疫球蛋白基因座(te Riele等(1992),PNAS,89,11,5128-5132)。
非人哺乳动物还可包含含有异源重链基因座和相关B细胞特异性LCR及调节元件的转基因。可存在多于一个的不同转基因重链基因座,各包含LCR和调节元件。
各包含一个或多个V基因区段、一个或多个D基因区段、一个或多个J基因区段和一个或多个恒定(效应子)区的重链基因座作为转基因引入,各基因座包含关联LCR。
各基因座包含驱动B细胞特异性表达所必需的5’和3’调节元件。在响应抗原攻击时,每个重链或轻链基因座以与内源基因座基本相同的方式表达,导致转基因编码的抗原特异性亲和力成熟的四聚体免疫球蛋白在小鼠血清中循环。
优选每个重链基因座包含一个或多个V基因区段,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、45、50、60或更多个V基因区段,其可来源于任何脊椎动物物种,优选非人哺乳动物。优选不超过20个V基因区段存在于任何单个重链基因座上。
在一个实施方案中,每个基因座可只包含一个V基因区段。在该实施方案的一个备选实施方案中,存在多个V基因区段,每个V基因区段不同于所有其它V基因区段。在这个实施方案中,任一个基因座上的V基因区段可全部来源于同一物种的生物,例如所有的V基因区段可以来源于人。备选地,任一个基因座上的V基因区段可来源于不同物种的生物,例如一些V基因区段来自人,其它则来自绵羊、牛、兔、骆驼(camelid)或甚至鲨鱼。在第二个备选实施方案中,每个V基因区段与所有其它V基因区段相同。不论存在的V基因区段数目和性质,每个基因座上其余的D和J基因区段可与所有其它基因座上的区段相同或不同。
因此设想非人哺乳动物可含有多个拷贝的重链基因座。这具有使在B细胞中发生生产性重排的可能性最优化的优势,因此允许用于抗原识别的免疫球蛋白重链的最适产生。
在另一个实施方案中,每个基因座包含多个V基因区段。
优选V基因区段来源于人。
术语“V基因区段”涵盖任何来源于脊椎动物的天然存在的V基因区段,包括但不限于鲨鱼、啮齿动物、骆驼和人。V基因区段必须能够与D基因区段、J基因区段和编码重链恒定(效应子)区的基因区段重组,以当重排核酸在B细胞中表达时产生能够与κ或λ免疫球蛋白轻链复合的免疫球蛋白重链抗体。
V基因区段在其范围内还包括编码天然或工程改造的同源物、衍生物或蛋白质片段的任何基因序列,其能够与D基因区段、J基因区段和编码重链恒定区的基因区段重组,以当重排核酸在B细胞中表达时产生能够与κ或λ免疫球蛋白轻链复合的免疫球蛋白重链抗体。V基因区段可来源于例如T细胞受体基因座。
优选本发明的多个重链基因座包含39种功能性人V基因区段及其改造变体的任何数目或组合。它们可在任何数目的基因座上,例如4个包含8个V基因区段的基因座加1个包含7个V基因区段的基因座;7个包含4个V基因区段的基因座加1个包含3个V基因区段的基因座;或39个各包含1个V基因区段的基因座。
将人V基因分成7个家族V
在本发明上下文中,“免疫球蛋白重链基因座”涉及最小的微基因座,其编码包含一个或多个V基因区段、一个或多个D基因区段和一个或多个J基因区段并与一个或多个编码重链恒定(效应子)区的基因区段有效连接的V
本发明的优势是,在相同的转基因非人哺乳动物中通过利用等位基因排斥来使用多个免疫球蛋白重链基因座,可使在重排V、D和J基因区段中得到的抗体库和多样性最大化。随机选择基因座之一开始重组,如果第一重组是非生产性的,则接着下一个基因座等等,直到从基因座之一产生生产性重组,这种等位基因排斥的过程可确保实际上所有存在于合并基因座上的V基因区段都可成为整个重组过程的部分。
为了提高任何给定免疫球蛋白重链基因座上所有V
根据在B细胞中进行的距离测量以及在V
最近也越来越清晰的是,在许多基因座上通过成环形成的折叠结构经由称为CTCF的特定染色质结合蛋白介导。如诱变实验证实的一样,CTCF似乎直接参与染色质成环的形成(Splinter等(2006)Genes Dev.,20,2349-2354)。更近期的研究表明,黏结蛋白这种将姐妹染色单体保持在一起的蛋白质复合体存在于CTCF结合位点上(Wendt等(2008)Nature,451,796-801)。免疫球蛋白V
包含异源重链基因座的每个转基因还可包含显性选择标记。优选显性选择标记不同于引入κ或λ轻链基因座内的显性选择标记。
对于本发明的目的,可使用任何显性选择标记基因,条件是在选择性或毒性攻击存在下,基因的表达为杂交瘤或来源于非人转基因哺乳动物的转化B细胞提供选择性益处。通常,显性选择标记基因可以是原核来源的,并选自:赋予有毒药物抗性的基因,例如嘌呤霉素(Vara等(1986)NAR,14,4617-4624)、潮霉素(Santerre等(1984)Gene,30,147-156)和G418(Colbere-Garapin等(1981)150,1-14),或者包括这样的基因:其消除对某些营养的需要,使得其表达将有毒物质转化成必需氨基酸,例如吲哚转化为色氨酸或组氨醇转化为组氨酸(参见Hartmann和Mulligan(1988)PNAS,85,8047-8051)。
本发明的必要条件是,使显性选择标记(如使用的话)位于免疫球蛋白重链转基因座内,以确保B细胞特异性共表达。备选地,可采用同源重组结合ES细胞或核移植方法,将药物抗性基因插入内源或外源(转基因)免疫球蛋白基因座(例如te Riele,Robanus Maandag和Berns(1992),PNAS,89,11,5128-5132)。
可将相同的显性选择标记基因掺入所有重链基因座内。备选地,不同的重链基因座或重链基因座群可包含不同的显性选择标记基因。
由于转基因轻链基因座内的功能性显性选择标记基因共表达,因此可以选择不含表达内源免疫球蛋白的细胞的来源于本发明表达四聚体抗体的转基因小鼠的杂交瘤或转化B细胞,优选转化的长寿浆细胞(Slifka等(1998)Immunity,8,363-372)。此外,与掺入轻链基因座中的显性选择标记相比,由于重链基因座内不同显性选择标记的存在和共表达,因此也可选择表达来源于转基因重链基因座上存在的特定V区段群的抗体的杂交瘤或转化B细胞系。例如,在κ轻链转基因座内加入嘌呤霉素抗性基因使得能够选择所有表达κ轻链转基因的细胞。备选地,在包含优选的V基因区段的重链转基因座中加入G418抗性基因使得能够选择所有表达优选的V基因区段的细胞。
具体地讲,本发明提供产生抗原特异性异源单克隆抗体的方法,所述方法包括:
(a)用抗原对上述非人转基因哺乳动物进行免疫;
(b)从已免疫的转基因哺乳动物的B细胞制备分别产生单克隆抗体杂交瘤或无限增殖化B细胞系;
(c)通过使用存在于包含异源免疫球蛋白轻链和重链基因座的转基因上的显性选择标记基因,选出至少一种表达异源抗体的杂交瘤或无限增殖化B细胞系;和
(d)选择至少一种产生与抗原特异性结合的抗体的杂交瘤或无限增殖化B细胞系。
下面参照下列附图的详细描述,仅通过实施例对本发明进行描述。
附图:
图1A:小鼠IgH基因座的3’端。
该图谱复印自IMGT数据库(
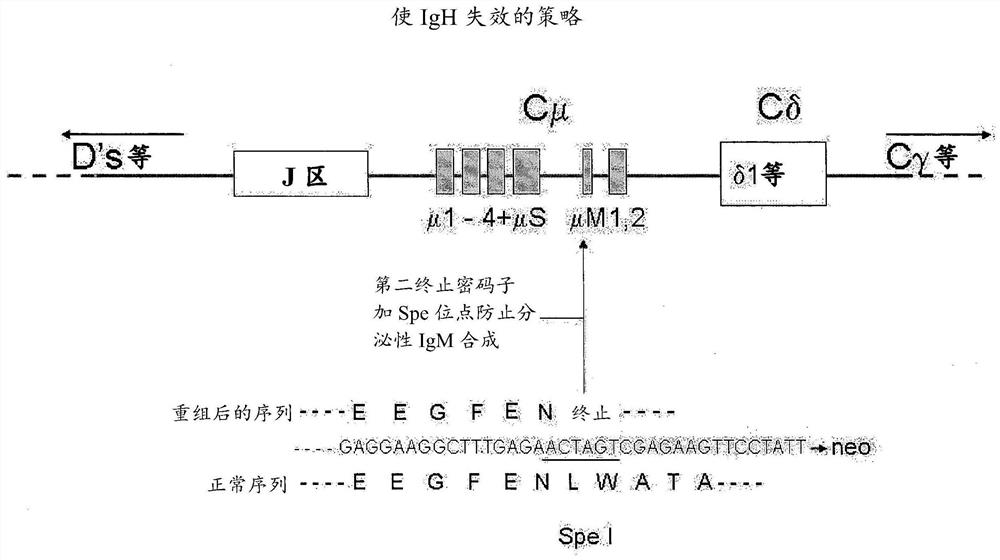
图1B:使IgH失效的策略
首行显示具有包括编码膜形式的IgM的2个外显子在内的不同外显子的小鼠Cμ区。往左为基因座的J、D和V
图1C:ES细胞中使Cμ失效的重组
该图显示通过覆盖重组插入片段3’侧的PCR分析而得到的ES细胞的两个重组阳性克隆。较大的片段相当于在图1B标出的位置上插入M1外显子中的neo选择标记。
图1D:Cμ敲除小鼠的FACS分析
在M1外显子被终止密码子和neo基因中断后,将ES细胞引入胚泡得到嵌合体。将这些嵌合体培育成纯合性,并分析血液中B细胞的存在情况。上两图表示使用B细胞标记B220和CD 19对正常野生型小鼠和杂合中断的M1外显子小鼠进行的FACS分析。下两图表示两个纯合小鼠,其未显示B220
图1E:培育成重组小鼠后neo的缺失
使图1D的小鼠与表达重组酶的小鼠杂交以缺失neo基因。右边两条泳道显示高于亲本动物的neo基因的长片段PCR产物,左侧紧邻的两条泳道表示携带neo缺失和野生型等位基因的两个杂合小鼠。左侧相邻的4条泳道为野生型小鼠,而最左一条泳道表示携带纯合缺失的neo基因和失活的M1外显子的小鼠。
图2:小鼠Ig
该图谱复印自IMGT数据库(
图3:小鼠V
通过LCR缺失使小鼠Ig
通过同源重组将lox新霉素抗性基因盒插入到ES细胞中置换3’
图4:插入小鼠C
基因座(首行)与图3的相同。尾行表示C
图5:小鼠C
基因座(首行)与图3的相同。尾行表示C
图6A:小鼠C
基因座(首行)与图3的相同。尾行表示C
图6B:ES细胞中使C
凝胶显示了图13A所示ES细胞中对C
图7:人Ig
该图谱复印自IMGT数据库(
图8:用于转基因作用的杂交人/大鼠Ig
基因座的3’端获自含有小鼠κ3’增强子(黄色)的小鼠(黄色)。小鼠恒定编码序列用大鼠的恒定编码序列置换,包括其通过长片段PCR获自大鼠基因组DNA(红色)的5’增强子。从Vκ4-1下游直到人J
图9:V
在5’端含有新霉素选择标记的该基因座用作构建人/小鼠杂交基因座的起始原料。按照WO2008/035216中所述构建该基因座。标尺以千碱基为单位。基因座含有4个V
图10:4个V
存在于V
图11:包含λLCR的Igλ增强子的缺失
使用潮霉素抗性基因和杀稻瘟菌素S(blasticin S)抗性基因,采用标准置换型载体通过同源重组剔除λ基因座增强子,所述潮霉素抗性基因两侧是与邻接增强子2-4的区同源的序列,所述杀稻瘟菌素S抗性基因两侧是与邻接4-10增强子的区同源的区段。置换产生丢失增强子且表达减少的λ基因座。潮霉素抗性基因用红色表示,杀稻瘟菌素S抗性基因用橙色表示。小鼠V
图12:用于转基因作用的人大鼠V
基因座与图8的相同,但已将其它人V
图13A:人大鼠杂交基因座的产生
通过将V
图13B:人/大鼠IgH基因座的起始构建体
凝胶表示在添加V
图13C:V
凝胶表示XhoI/SalI消化的17个不同V
图14:转基因人大鼠重链免疫球蛋白基因座
引入同一动物中的两个重链基因座的实例。彼此的对立选择通过等位基因排斥进行。可将其它V
图15:人/大鼠λ转基因轻链基因座
图显示人/大鼠基因座的实例。其3’端获自含有小鼠λ3’LCR(黄色)的小鼠(黄色)。小鼠恒定编码序列用通过长片段PCR从大鼠基因组DNA获得的大鼠恒定编码序列(红色)替换。V
实施例
在下面的实施例中,产生转基因小鼠,其表达作为转基因通过显微注射引入受精卵(常规转基因过程)的杂交人/大鼠重链和轻链基因座。对供卵小鼠进行修饰以不表达或非常低地表达内源小鼠重链基因和小鼠轻链基因。小鼠中有κ链和λ链两种轻链基因座,其中λ仅用于约2%的小鼠H2L2抗体。因此,实施例在具有IgH基因座且仅内源κ基因座失活的小鼠中,或者在具有IgH和失活的κ基因座且剔除λ基因座的调节序列以更进一步地降低λ基因座的表达的小鼠中。
用于构建重链和轻链基因座,在抗原攻击后形成和筛选转基因小鼠的方法基本上如前所述(Janssens等(2006)PNAS,10,103(41),15130-5;WO2006/008548、WO2007/096779、GB0805281.3和2008年6月11日申请的要求GB0805281.3的优先权的PCT申请),在所有重链基因座上保留C
实施例1
在该实施例中,通过类似于Kitamura和Rajewsky发表的策略,使IgH基因座(图1A)失活,其差别在于将终止密码子在Kitamura等人(Kitamura等(1991)Nature,350,423-426)所述位置前一个氨基酸的位置上引入C
备选地,可在IgH KO细胞中直接敲除κ等位基因。可采用若干不同的策略达到κ失活。可通过使用ES细胞或iPS细胞中的同源重组将两侧是lox位点的neo基因插入C
接下来,按照之前对于人V
同样,将包括3’κ增强子的小鼠κ基因座的3’端与大鼠恒定(C
在所示实施例中,将最常用的V
同样,构建杂交人/大鼠IgH基因座。此外,就起始原料而言有许多可能性。在该实施例中,起始原料为含有4个人V
后面的PAC在J区和恒定区之间具有独特的CeuI大范围核酸酶位点。为使得能够容易地构建杂交基因座,使用该CeuI位点除去人3’端序列,并将这些替换为大鼠恒定区和转换区(Cμ、Cγ3、Cγ1和Cγ2)。这些通过标准长片段PCR扩增自大鼠基因组DNA。最后,添加小鼠重链LCR。该调节序列以3个部分由小鼠基因组DNA扩增,并亚克隆到一起以恢复完整的LCR,并加至大鼠恒定区3’侧(图10)。因此,所得杂交IgH基因座含有neo选择标记、人V、D和J区及大鼠恒定区与小鼠调节序列。
随后杂交基因座插入片段作为大的DNA片段从PAC中分离,并注射入来源于IgH/Ig
随后培育杂交IgH和杂交Ig
本领域技术人员应理解的是,可对该方法作各种变化以产生杂交转基因小鼠,例如使用不同的载体、不同的选择标记、不同的重组位置以使小鼠基因失活,或可在杂交基因座的实际(常规)克隆策略中作出各种变化。可采用同一方法,使用来源于任何单一哺乳动物物种的免疫球蛋白DNA产生任何正常基因座或杂交基因座,或者使用来自两个或更多个物种的DNA得到杂交基因座。
实施例2
本实施例基本上与实施例1相同,除了通过降低内源小鼠Ig
后者使得能够阳性选择杀稻瘟菌素S抗性(Karreman,(1998)NAR,26,(10),2508-2510)。标记的这种组合当置换调节区时,使得能够在2种ES细胞重组中进行阳性选择。重组在实施例1产生的ES细胞中进行,或者备选地,在正常ES细胞中平行进行,并且培育成上面实施例1中所述小鼠。
所得转基因小鼠含有杂交人大鼠IgH和Ig
实施例3
实施例3类似于上述实施例,但是杂交Ig
实施例4
实施例4类似于上述实施例中所描述的方法,但在这里通过使用18个V
在所有这些实施例中,通过加入V区段作为存在于同一小鼠中的其它重链或轻链转基因座的一部分,将进一步提高应答的复杂度。由于所有基因座经历等位基因排斥(参见WO2007/096779),因此在抗原攻击后,体内仅选出优选的重排,导致B细胞膨胀及抗体在血清积累。图14表示可引入同一动物的2个重链基因座的实例,每一个可通过等位基因排斥而被利用。显然,可加入更多的V
实施例5
在该实施例中,通过培育将人/大鼠Igλ基因座加入携带上述实施例中所述的人/大鼠IgH和/或Ig
在所有这些实施例中,可使用来自不同物种的V
- 表达人源化抗体的非人转基因动物及其用途
- 表达人源化抗体的非人转基因动物及其用途
