于体外将人多能干细胞诱导为神经中胚层祖细胞并维持自我更新的培养体系、方法及应用
文献发布时间:2023-06-19 10:52:42
技术领域
本发明涉及生物医药工程技术领域,涉及一种于体外诱导人多能干细胞分化为神经中胚层祖细胞,并维持神经中胚层祖细胞长期培养的体系和方法。
背景技术
人多能干细胞(human pluripotent stem cells,hPSCs)根据来源不同可分为人胚胎干细胞和人诱导性多能干细胞。人胚胎干细胞(human embryonic stem cells,hESCs)是从早期囊胚的内细胞团中分离而来,通过培养条件优化能够在体外长期稳定培养的细胞系。 hESCs在体外可以维持稳定自我更新和多向分化潜能,具有分化产生所有类型成体细胞的潜能。hESCs的获得以及细胞系的建立,为细胞替代治疗提供潜在的细胞来源,在再生医学应用方面拥有巨大的发展前景,尤其是近年在诱导性多能干细胞(inducedpluripotent stem cells,iPSCs)研究的进步,可以首次不必依赖胚胎而获得人个体化的多能干细胞,这也使得再生医学迈向了蓬勃发展的新时期。
脊髓作为中枢神经系统,具有上下传导神经信号、神经信号整合、协调运动等多种功能。肌萎缩性脊髓侧索硬化、神经性肌肉萎缩等脊髓退行性病变以及外源性创伤都将导致脊柱损伤,然而目前的手术、药物治疗方式对脊髓损伤的治疗效果有限,细胞移植有望成为脊髓损伤治疗的新手段。神经中胚层祖细胞(neuromesodermal progenitors,NMPs)不仅可以分化为脊髓中的神经细胞,而且还可以产生脊髓周边的中胚层组织,在脊髓损伤的细胞治疗中具有独特的应用价值。
目前,已有文献报道将多能干细胞诱导产生神经中胚层祖细胞,但是如何实现神经中胚层祖细胞的自我更新仍是有待解决的问题。本领域尚缺乏有效诱导方法将hPSCs诱导为可稳定自我更新的神经中胚层祖细胞(self-renewing neuromesodermalprogenitors, srNMPs),尤其是无法在化学成分明确的培养条件下实现神经中胚层祖细胞的体外稳定自我更新。
发明内容
本发明是为解决上述问题而进行的,针对现有技术中诱导产生的神经中胚层祖细胞难以维持稳定的自我更新的缺陷,提供了一种将多能干细胞(hPSCs)诱导为可稳定自我更新的神经中胚层祖细胞(srNMPs)的培养方法。
本发明的第一方面,提供了一种于体外将hPSCs诱导为srNMPs并维持自我更新的培养体系,该体系包括一种化学成分明确的神经中胚层祖细胞培养基。使用该培养体系,可以将hPSCs经过10天的快速诱导后成为srNMPs,同时该细胞可在体外稳定传代超过30 代,并维持细胞表型的稳定。
该培养体系包括基础培养基以及添加在该基础培养基内的诱导分化因子:0.01-500 μM TGFβ抑制剂、0.01-500μM BMP抑制剂、0.01-50μM GSK3抑制剂、0.01-500ng/mL FGF家族生长因子、0.01-500ng/mL EGF家族生长因子。以上诱导分化因子是能够诱导、维持srNMPs的分子表型及稳定自我更新的关键因子。
其中,基础培养基(记为N2B27)包括液体基础培养基、0-5×B27添加剂、0-5×N2添加剂、1%青霉素/链霉素、0-500μg/mL 2-磷酸-维生素C。
优选的,液体基础培养基为DMEM/F12、0.5×N2、0.5×B27、60μg/mL 2-磷酸-维生素C、1%青霉素/链霉素;
TGFβ抑制剂包括但不限于SB431542、LY2109761及A-83-01等小分子TGFβ抑制剂中的一种或多种;
BMP抑制剂包括但不限于DMH1、K02288、LDN-193189等小分子BMP抑制剂中的一种或多种,以及Noggin等BMP抑制蛋白;
所述GSK3抑制剂包括但不限于CHIR99021、BIO及LY2090314等小分子GSK3抑制剂中的一种或多种;
EGF家族生长因子包括但不限于EGF、TGFα及HB-EGF中的一种或多种;
FGF家族生长因子包含但不限于FGF 1~FGF23中的任意一种或多种。
进一步优选,诱导分化因子各组分和最优浓度如下:TGFβ抑制剂为2μM的SB431542,BMP抑制剂为2μM的DMH1,GSK3抑制剂为3μM的CHIR99021,FGF 家族生长因子为10ng/mL的FGF2,EGF家族生长因子为10ng/mL的EGF。
本发明的具体实施方式中,采用上述组分进行实验,但每种组分中不限于上述具体成分。如,TGFβ抑制剂中选择2μM的SB431542进行实验,但LY2109761及A-83-01也能实现相应功能。其他组分的成分选择亦然。
优选的,hPSCs为人胚胎内细胞团来源的胚胎干细胞细胞系或经体细胞重编程获得的诱导性多能干细胞。
本发明的第二方面,提供了一种采用上述培养体系将hPSCs诱导为srNMPs并维持其自我更新的方法,包括如下步骤:
A、采用hPSCs培养基将hPSCs培养至细胞密度为50%-70%;
B、当hPSCs密度达到50%-70%时,使用所述培养体系进行细胞诱导,每天半量换液,在细胞密度达到90%时按1:6进行细胞传代,传代培养时向所述培养体系内添加浓度为非肌肉肌球蛋白IIATPase抑制剂,连续诱导10天以上。
优选的,步骤A中,hPSCs培养基的成分如下:基础培养基DMEM/F12、0.5×N2、 0.5×B27、60μg/mL 2-磷酸-维生素C、1%青霉素/链霉素、40ng/mL碱性成纤维生长因子、 2ng/mL转化生长因子-β。步骤B中,非肌肉肌球蛋白II ATPase抑制剂为5μM的 Blebbistatin。
发明人将上述培养体系获得的srNMPs进行单细胞克隆自发分化,从单细胞水平证明了srNMPs的神经和中胚层双向分化潜能,srNMPs的悬浮培养分化产生的细胞球经过体外的长期培养,可产生类似于脊柱结构。将srNMPs进行向神经和中胚层定向分化,可分别产生脊髓背侧中间神经元和脊髓腹侧的运动神经元以及骨骼肌细胞,进一步地证明了 srNMPs具有神经和中胚层双向分化的潜能。
据此,本发明的第三方面提供了根据本发明的培养方法获得的srNMPs的应用,如在神经中胚层祖细胞的产生机制、神经中胚层祖细胞的自我更新机制、脊髓神经元的诱导、轴旁中胚层的诱导、脊柱发育的细胞模型、脊髓损伤疾病的体外药物筛选、脊髓损伤疾病的细胞治疗、脊髓损伤修复的组织工程中的应用潜能。
本发明的有益保障及效果如下:
通过实验,使用本发明的化学成份明确的培养体系可将hPSCs经过10天的快速诱导后成为srNMPs,该细胞共表达神经干细胞分子标志SOX2和中胚层分子标志T,同时该细胞可在体外稳定传代超过30代,并维持细胞表型的稳定。srNMPs的单细胞克隆自发分化实验和悬浮培养分化实验,证明了srNMPs的神经和中胚层双向分化潜能。将srNMPs 进行向神经和中胚层定向分化,可分别产生脊髓背侧中间神经元和脊髓腹侧的运动神经元以及骨骼肌细胞,进一步证明了srNMPs具有神经和中胚层双向分化的潜能。
进一步地,将srNMPs进行成球实验,使得其自发分化,可产生类似于脊柱结构的细胞团组织。该细胞能够同时分化产生神经细胞和中胚层细胞,提示了该细胞在脊柱损伤方面具有重要的应用潜能和优势。
附图说明
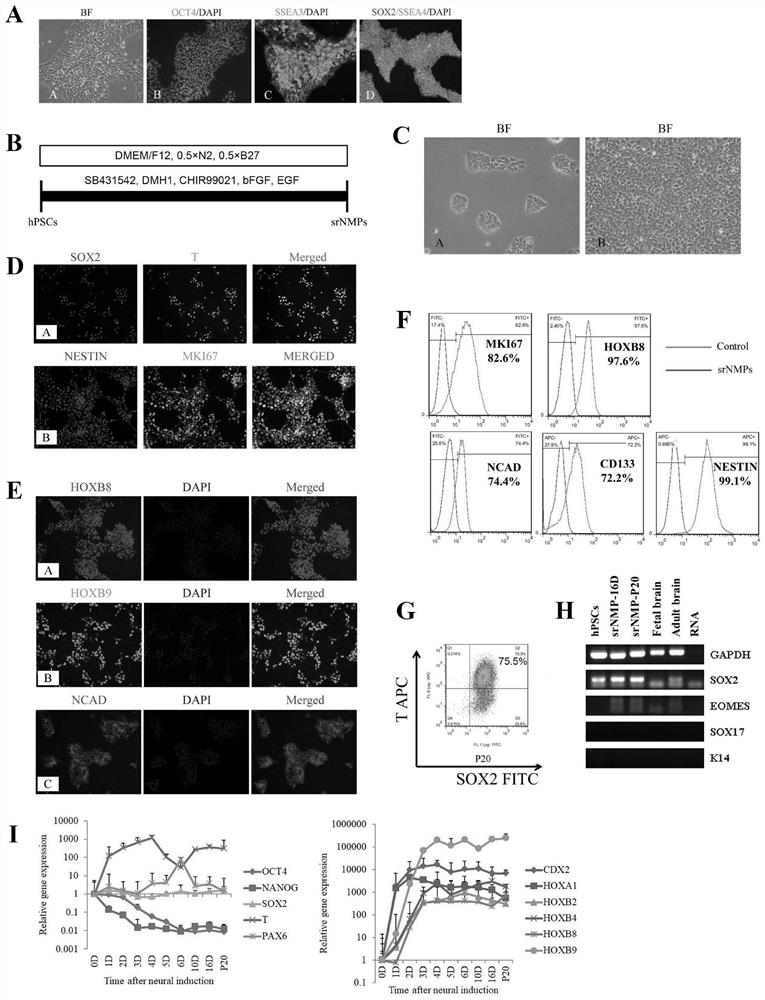
图1为srNMPs的诱导过程及分子表型鉴定结果。其中,(A)hPSCs低密度时在光镜下形态呈克隆样生长,典型上皮样形态(200倍视野下拍摄),免疫荧光染色检测多能性标志基因OCT4、SSEA3(200倍视野下拍摄)以及SOX2和SSEA4(100倍视野下拍摄)的表达水平;(B)srNMPs的诱导方案;(C)光镜下,srNMPs低密度时呈克隆样形态,srNMPs高密度时呈铺路石样典型上皮细胞形态(200倍视野下拍摄)。(D-H) 为通过免疫荧光染色和流式细胞术检测神经中胚层祖细胞的分子标志表达情况,RT-PCR 检测中胚层、内胚层胚层、表皮外胚层分子标志的表达情况;(I)qRT-PCR检测srNMPs 诱导过程中基因变化情况。
图2为srNMPs具有神经和中胚层双向分化潜能的检测结果。其中,(A-B)为srNMPs的单细胞克隆自发分化实验结果;(C-E)srNMPs悬浮培养四个月的细胞团可检测到神经组织、软骨组织、骨骼肌组织;(F-H)为srNMPs的悬浮培养八个月的细胞团检测结果。注:图F中右图为脊椎动物胚胎中的脊髓照片(图片来自网络,VertebraAnd Spinal CordDevelopment is aphotograph by Steve Gschmeissner which was uploaded on June27th,2016.)。
图3为srNMPs向神经自发分化的实验结果。其中,(A-B)为脊髓神经元及其前体细胞分类、标志基因;(C)为srNMPs的自发神经分化的实验方案;(D-F)为通过免疫荧光染色和RT-PCR检测相关分子标志结果,分析所得神经元的脊髓定位。
图4为srNMPs定向分化为脊髓腹侧运动神经元的实验结果。(A)为srNMPs定向分化为脊髓腹侧运动神经元的实验方案;(B和C)qRT-PCR和免疫荧光染色检测腹侧运动神经元分子标志结果。
图5为srNMPs定向分化为脊髓背侧中间神经元的实验结果。(A)为srNMPs定向分化为脊髓背侧中间神经元的实验方案;(B和C)qRT-PCR和免疫荧光染色检测背侧中间神经元分子标志结果。
图6为srNMPs定向分化为骨骼肌细胞的实验结果。(A)qRT-PCR检测srNMPs向中胚层分化情况;(B)免疫荧光染色检测骨骼肌细胞分子标志。
具体实施方式
现结合实施例对本发明作详细描述,但本发明的实施不仅限于此。
本发明所用试剂和原料均市售可得或可按文献方法制备。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
实施例1:srNMPs的诱导及分子表型鉴定
1、hPSCs的复苏、培养及鉴定
细胞的培养皿表面用含1%基质胶(Corning,Cat#356231)的DMEM/F12培养基预先包被,并于4℃保存过夜。本实验室的冻存的hPSCs系有H1(passage 70-85)和HUES9(passage 20-35)。从-80℃冰箱取出后,在37℃水浴中快速震荡,溶解至有少许冰残留。快速放入低温水平离心机中离心细胞,1000rpm离心5min,吸弃冻存液,用hPSCs培养基重悬,接种于基质胶包被的培养板中,每天换液。细胞使用TrypLE消化酶(Gibco,Cat# 12605-010)消化后,按1:10传代,并加入5μM的Blebbistatin(Selleck,S7099)防止细胞自发起泡引起的细胞凋亡。
hPSCs培养基的最优成分如下:基础培养基DMEM/F12(Thermo FisherScientific), 0.5×N2(Thermo Fisher Scientific,Cat#17502048),0.5×B27(ThermoFisher Scientific, Cat#17504044),60μg/mL 2-磷酸-维生素C(Sigma-Aldrich,Cat#A8960),1%青霉素 /链霉素,40ng/mL碱性成纤维生长因子(PeproTech,AF-100-18B),2ng/mL转化生长因子-β(PeproTech,100-21)。
倒置显微镜下观察,hPSCs呈克隆样生长,为典型铺路石样上皮细胞形态,核仁明显,核质比大。定期通过细胞免疫荧光染色评价细胞未分化状态,99%以上的hPSCs保持多能性标志基因OCT4、SOX2、SSEA3、SSEA4阳性(图1A)。
2、srNMPs的诱导过程及分子表型鉴定
将hPSCs诱导为srNMPs的培养体系包含如下组分:液体基础培养基、0.5×B27添加剂、0.5×N2添加剂、1%青霉素/链霉素、60μg/mL 2-磷酸-维生素C、2μM小分子TGFβ抑制剂SB431542(Selleck,S1067)、2μM小分子BMP抑制剂SB431542(Selleck,S7146)、 3μM小分子GSK3抑制剂CHIR99021(Selleck,S2924)、10ng/mL FGF家族生长因子 FGF2(PeproTech,AF-100-18B)、10ng/mL EGF家族生长因子EGF(PeproTech, AF-100-15),将此培养基命名为srNMPs培养基。
当hPSCs密度达到50%-70%时,开始使用srNMPs培养基诱导,连续培养10天以上,每天换液一半(图1B)。细胞密度达到90%时进行传代,细胞的培养皿表面用含1%基质胶的DMEM/F12培养基预先包被,并于4℃保存过夜。
所示实验结果在H1和HUES9两种细胞系中均能实现,这表明srNMPs的诱导对不同的hPSCs有良好的的重现性。展示结果均以H1细胞系来源的srNMPs为例。
srNMPs可在体外长期培养,维持稳定地自我更新,保持典型上皮样细胞形态。光镜下观察,核仁明显,核质比较高,在低密度传代时,细胞会聚成克隆,形态均一,克隆边缘清晰。细胞存在接触抑制现象,培养皿内长满后细胞停止增殖,并迅速发生凋亡,不会发生重叠生长的现象。高密度传代时,细胞分布均匀,形态均一,仍然保持上皮样形态(图 1C)。
进一步通过免疫荧光染色和流式细胞术检测结果显示,srNMPs阳性表达神经干细胞分子标志SOX2、NESTIN、NCAD、CD133、早期中胚层分子标志T、细胞增殖分子标志 MKI67,并且SOX2和T可以共表达,双阳性细胞比例达75.5%,证明了srNMPs能够在体外维持长期稳定的自我更新(图1D、图1E、图1F、图1G)。
通过逆转录PCR检测结果显示,srNMPs不表达其他胚层的分子标志,如中胚层分子标志EOMES、内胚层分子标志SOX17、外胚层表皮分子标志K14,这说明诱导过程中细胞没有向中胚层、内胚层、表皮外胚层方向分化(图1H)。
3、srNMPs的早期诱导过程
定量PCR结果显示,srNMPs诱导过程中多能性分子标志OCT4、NANOG表达迅速降低,说明在诱导三天时所有的hPSCs都已经退出多能性状态。另一个多能性分子标志,同时也是神经干细胞的分子标志SOX2在诱导过程中基本不变,始终处于高表达状态。中胚层分子标志T在诱导过程中逐渐表达上升,诱导10天后表达逐渐稳定。这说明经过10 天诱导,可以将hPSCs可诱导为srNMPs。另外,在诱导过程中,脊髓分子标志CDX2及 HOX家族基因表达迅速上调,并始终保持高表达状态。其中,表达水平最高的是HOXB9,更后端的HOX基因不表达(结果未显示),这说明该方法诱导产生srNMPs在前后轴上对应胸段脊髓的位置(图1I)。
以上结果显示使用本发明的化学成份明确的培养体系可将hPSCs经过10天的快速诱导后成为srNMPs,同时该细胞可在体外稳定传代超过30代,并维持细胞表型的稳定。
实施例2:srNMPs具有神经和中胚层双向分化潜能
1、srNMPs的单细胞分化实验:
将srNMPs消化成单细胞后,以极低密度(每孔约50个细胞)接种至基质胶包被的六孔板,在srNMPs培养条件下生长五天后,大部分单细胞形成克隆(图2A),然后换成N2B27 基础培养基条件使其自发分化,继续培养两到三周,通过免疫荧光染色检测到单细胞来源的srNMPs克隆,同时表达神经分子标志MAP2和中胚层分子标志αSMA(图2B),这说明单个srNMPs细胞形成的克隆,可分化产生神经元和中胚层细胞,从单细胞水平证明了srNMPs具有神经和中胚层的双向分化潜能。
2、srNMPs的悬浮培养分化实验:
将srNMPs消化形成单细胞,然后传代到低吸附培养板中培养,培养条件为N2B27基础培养基。srNMPs悬浮培养形成的细胞球,可在体外长期培养。
将悬浮培养四个月的细胞球通过石蜡包埋切片,进行H&E染色。能观察到胞核密集、有树杈状分布的纤维突出的神经组织,胞质部分被染为深蓝色、软骨囊和细胞之间出现较大的空隙的软骨组织,以及胞质亮红色、细胞核偏位的骨骼肌组织,以及富含浅红色的波浪状胶原纤维的纤维细胞和纤维母细胞(图2C)。甘氨银染色可将神经纤维成深褐色,番红固绿染色可将软骨组织染成浅红色,MASSON染色能将胶原纤维染成浅蓝色,进一步证明了细胞球中的神经组织、软骨组织的存在(图2D)。免疫组织化学染色检测到神经组织中成熟神经元分子标志NEUN阳性,在神经组织外周检测到星形胶质细胞的分子标志S-100 阳性,骨骼肌组织中检测到骨骼肌转录因子MYOD阳性。以上结果表明,悬浮培养四个月的细胞球内除了有神经元,还有星形胶质细胞和骨骼肌细胞(图2E)。
悬浮培养八个月的细胞球中各组织发育更加成熟,出现更加复杂的组织结构,类似于早期胚胎中的脊柱(图2F)。将悬浮培养八个月的细胞球进行冰冻切片,通过免疫荧光染色检测到对应区域成熟神经元分子标志NEUN、骨骼肌细胞分子标志DESMIN、软骨分子标志COL2A1表达阳性,从蛋白质水平验证了细胞球中的神经组织、骨骼肌组织、软骨组织(图2G、图2H)。
实施例3:srNMPs的神经定向分化
1、srNMPs向神经方向的自发分化
将srNMPs在不含有任何形态发生素的神经分化培养基中进行神经分化连续诱导三周,培养条件是以B27培养基为基础,添加0.2μMγ-secretase抑制剂RO4929097(EMDChemicals),10ng/mL BDNF(PeproTech,450-02)、10ng/mL GDNF(PeproTech,450-10),将此神经元分化条件记为BGRO(图3C)。
srNMPs在BGRO条件下分化产生的神经元,能够表达广谱的神经分子标志TUJ1、MAP2及HOX家族的HOXB8、HOXB9(图3D、图3E),这说明诱导以后的神经元仍然保持着其脊髓后端的定位。通过RT-PCR检测到V0区分子标志DBX1、PAX2表达阳性,谷氨酸转运体基因SLC1A1表达阳性(图3E),这说明srNMPs可自发产生兴奋性的谷氨酸能神经元。进一步地免疫荧光染色结果显示,srNMPs在BGRO条件下分化产生的神经元能够分化为NEUN阳性的成熟神经元,同时还检测到V0
综上,srNMPs自发神经分化后,产生的神经元主要是谷氨酸能神经元,且与脊髓中的 V0
2、srNMPs可定向分化为脊髓腹侧运动神经元
联合使用SHH蛋白、SAG(SHH激动剂)、反式维甲酸RA将srNMPs进行腹侧化处理一周,培养条件是以N2B27培养基为基础,添加蛋白质10ng/ml SHH(R&D,8908-SH)、 0.2μMSAG(Selleck,S7779)、1ng/ml反式维甲酸RA(Sigma,PHR1187),将此条件记为SSR。进一步使用神经元分化培养基将腹侧化的srNMPs继续培养约3周,形成分化成熟的神经元,检测相关分子标志的改变。神经元分化培养基是以B27培养基为基础,添加 5μM Forskolin(Selleck,S2449),10ng/mL BDNF、10ng/mL GDNF,将该神经元分化条件记为BGF(图4A)。
定量PCR结果显示,经过一周的腹侧化诱导后,中胚层分子标志T不再表达,而运动神经元前体细胞分子标志OLIG2显著上升,这表明经过腹侧化诱导后,srNMPs被诱导为运动神经元祖细胞。继续分化可得到运动神经元,其高表达运动神经元关键转录因子ISL1,以及乙酰胆碱转移酶ChAT和囊泡乙酰胆碱转运蛋白vAChT(图4B)。免疫荧光染色结果显示,srNMPs分化产生的运动神经元表达通用神经分子标志TUJ1、MAP2,还检测到运动神经元分子标志ISL1,并能与ChAT、vAChT共表达(图4C)。
以上结果表明,srNMPs可以响应腹侧化信号的诱导,转变成OLIG2阳性的运动前体细胞,并进一步在体外培养产生成熟的运动神经元。
3、srNMPs可定向分化为脊髓背侧中间神经元
同时激活WNT和BMP信号通路,将srNMPs进行背侧化诱导处理一周。培养条件是以N2B27培养基为基础,添加3μM CHIR99021,20ng/ml BMP4(Gibco,PHC9531),将此条件记为B20C3,最后使用BGF神经元分化培养基分化2-3周(图5A)。
定量PCR结果和免疫荧光染色结果显示,诱导前的srNMPs即高表达转录因子PAX3、PAX7,说明未处理的srNMPs的定位在背侧。将srNMPs在背侧培养条件中诱导一周后,背侧转录因子PAX3、PAX7表达升高。分化成熟的神经元高表达背侧分子标志PAX3、PAX7、 LHX5以及pd1区神经元分子标志ATOH1(也叫MATH1)。这说明背侧化处理后诱导产生的神经元主要是pd1区神经元(图5B、图5C)。
以上实验结果说明了srNMPs可定向分化为神经元,并能响应背腹轴的信号,进一步分化产生脊髓背侧和腹侧的神经元。
实施例4:srNMPs的骨骼肌分化
同时激活WNT和FGF信号通路,使srNMPs向中胚层分化。培养条件是以N2B27培养基为基础,添加10μM CHIR99021,40ng/ml FGF2,将此条件记为C10F40。定量PCR结果结果显示,同时激活WNT和FGF信号通路可使srNMPs向中胚层分化,神经干细胞分子标志 SOX2、PAX6表达下调,中胚层分子标志T、TBX6、MSGN1均表达上调(图6A)。
将中胚层分化后的srNMPs进一步使用肌肉分化培养基向骨骼肌分化三周。培养条件是以N2B27培养基为基础,添加10ng/ml IGF1(Gibco,PHG0071)和10ng/ml HGF(Gibco,PHG0254)。免疫荧光染色结果显示,肌肉细胞的分子标志DESMIN、MF20、TTN、MYOG、 PAX7均表达阳性,这说明中胚层方向分化后的srNMPs可进一步分化产生骨骼肌细胞(图 6B)。
以上实验结果说明了srNMPs可向中胚层分化,并进一步分化产生骨骼肌细胞。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 于体外将人多能干细胞诱导为神经中胚层祖细胞并维持自我更新的培养体系、方法及应用
- 前脑神经干细胞体外诱导及长期培养体系、诱导培养方法及应用
