一种用于肿瘤精准治疗的药物的筛选方法
文献发布时间:2023-06-19 11:08:20
技术领域
本发明涉及药物筛选技术领域,具体而言,涉及一种用于肿瘤精准治疗的药物的筛选方法。
背景技术
肿瘤学中的精准医学需要为个体癌症患者量身定制治疗策略。到目前为止,大多数靶向药物都是基于基因信息的,有些药物可以处方给某些基因突变的患者,以获得最佳疗效;而不给另一些基因突变的患者,因为有很大的副作用。然而,临床资料显示,越来越多的基因参与肿瘤对某种药物的反应,使得基于基因精准医学的预后变得复杂。或者,对患者的活检样本直接进行药物筛选,可提供药物敏感性的直接信息。然而,活检样本仅含有有限数量的细胞,给传统的基于96孔板的药物筛选带来麻烦。虽然进行多次活检取样可以获得足够的肿瘤细胞数,但也增加了癌症扩散的风险。在药物筛选之前,体外培养原代肿瘤细胞可以获得足够的细胞数目。但是,这可能会导致子细胞的意外突变,并且误导药物筛选的暗示。
鉴于此,特提出本发明。
发明内容
本发明的目的在于提供一种用于肿瘤精准治疗的药物的筛选方法。
本发明是这样实现的:
第一方面,本发明提供一种用于肿瘤精准治疗的药物的筛选方法,其包括体外筛选步骤:
所述体外筛选步骤包括:将原代肿瘤细胞分别置于多种不同培养条件下进行培养;所述原代肿瘤细胞源自患肿瘤个体的肿瘤组织;
多种不同培养条件包括:至少一个存在待筛选药物的第一培养条件以及至少一个不存在待筛选药物的第二培养条件;
比较所述第一培养条件和所述第二培养条件下的原代肿瘤细胞的存活情况,选择所述第一培养条件下原代肿瘤细胞存活情况差于所述第二培养条件下原代肿瘤细胞存活情况的所述第一培养条件中所用的待筛选药物作为用于肿瘤精准治疗的药物。
第二方面,本申请提供了上述用于肿瘤精准治疗的药物的筛选方法所筛选出的药物在制备用于精准医疗中治疗肿瘤的药物中的应用。
第三方面,本申请提供一种用于实现上述肿瘤精准、个体化药物的筛选方法的数字微流控芯片,其包括底板,所述底板上形成有电极阵列组和输出电压焊点;所述电极阵列组包括至少两个用于对原代肿瘤细胞与待筛选药物组中的药物分别进样的进样电极组、用于将进样的原代肿瘤细胞与待筛选药物组中的药物进行混合得到载药细胞的混合电极、用于将所述载药细胞进行移动的移动电极组和用于将所述载药细胞移动至培养区进行培养的培养电极组;其中,所述混合电极同时与所述进样电极组和所述移动电极组相邻,所述培养电极组与所述移动电极组相邻。
第四方面,本申请提供一种便携式数字微流控系统,其包括上述任一实施方式的数字微流控芯片。
本发明具有以下有益效果:
本申请中提供的用于肿瘤精准治疗的药物的筛选方法,通过直接采用原代肿瘤细胞与待筛选的药物进行培养,无需对原代肿瘤细胞进行体外培养,有效避免了培养过程中子细胞发生意外突变而导致药物筛选结果存在偏差的情况。本申请中还通过建立肿瘤模型,通过将上述用于肿瘤精准治疗的药物的筛选方法筛选出的药物应用到肿瘤模型上,其与相应的个体肿瘤反应结果相一致,暗示了本申请中提供的用于肿瘤精准治疗的药物的筛选方法快速确定最佳药效药物的有效性和个性化肿瘤治疗的潜在价值。此外,本申请提供的数字微流控芯片可以实现对原代肿瘤细胞在多种不同培养条件下进行培养,本申请提供的便携式数字微流控系统操作便携,工作台尺寸小,可以快速确定个性化癌症治疗的有效药物。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
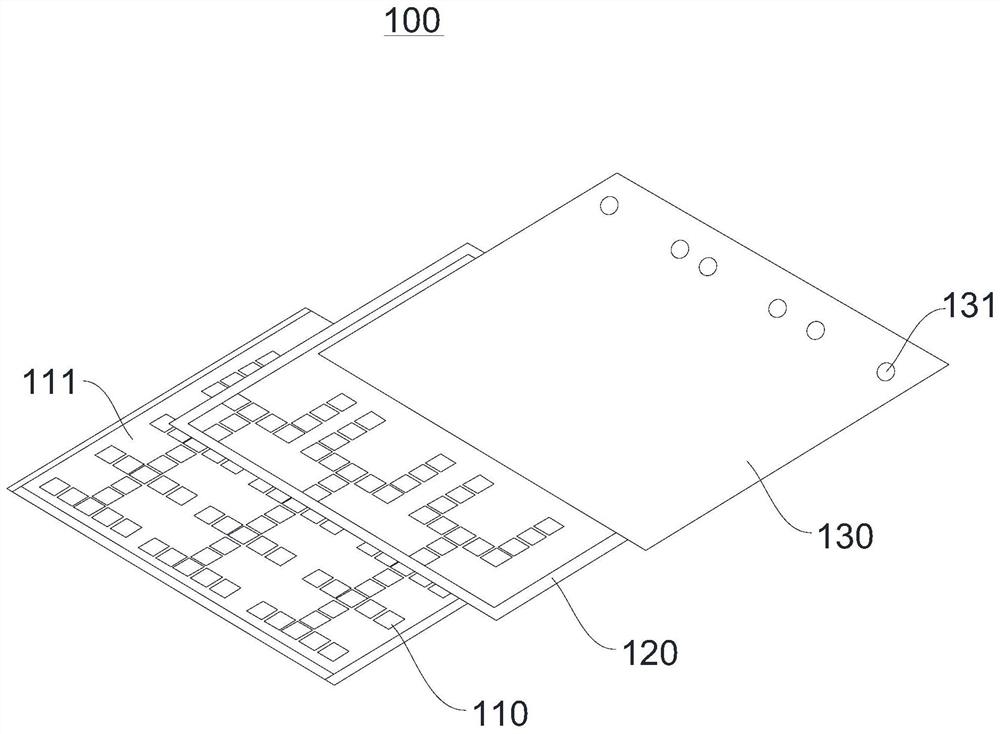
图1为本申请实施例提供的数字微流控芯片的结构示意图;
图2为本申请实施例提供的数字微流控芯片的底板的结构示意图;其中,V1至V24为输出电压焊点的编号,而E1至E24为电极的编号;
图3为本申请实施例提供的数字微流控芯片中单个电极阵列组的结构示意;
图4为本申请实施例提供的数字微流控芯片中单个电极阵列组的相同编号的电极的串联结构示意图;
图5为本申请实施例提供的数字微流控芯片通过给相邻电极通电促使液滴移动的原理示意图;
图6为本申请实施例提供的数字微流控芯片上加载有载药样品和细胞样品后进行移动混合培养的示意图;
图7为本申请其他实施例提供的数字微流控芯片中单个电极阵列组的相同编号的电极的串联结构示意图;
图8为本申请实施例提供的药物浓度产生器用于组合药物毒性测试的原理示意图;
图9为本申请实施例提供的便携式数字微流控系统的结构示意图;
图10为本申请实施例提供的便携式数字微流控系统的设计原理图;
图11为本申请实施例提供的便携式数字微流控系统用于移植鼠乳腺癌模型活检样本的药物筛选示意图;
图12为本申请实施例提供的实验方法的实验过程图;其中,A表示乳腺癌MDA-MB-231肿瘤模型的建立,活检样本的获取,芯片上药物筛选及筛选结果指导体内治疗的路线图;B表示活检针和从肿瘤部位取出活检标本的图片结果;C表示活检前后小鼠肿瘤部位周围皮肤粘连的图像;D-F表示小鼠治疗结果,D表示给药次数与肿瘤体积的关系,E表示给药次数与小鼠体重的关系;F表示药物治疗后肿瘤大小的拍照结果;
图13为本申请实施例提供的药物浓度产生器的喷射参数对喷射体积的影响的实验过程图;其中,(a)为药物浓度产生器的设计及工作原则示意图;(b)为药物顺铂浓度与荧光强度间的校正曲线,(c)为喷射频率对喷射体积的影响,喷射电极条宽度固定在400微米,喷射电压峰峰值固定在1020v,(d)为喷射电压,(e)为喷射时间对喷射体积的影响,喷射频率固定在800Hz;本实验中使用的药物为顺铂;
图14为鼠2活检样本解离的肿瘤细胞用于芯片上药物顺铂毒性测试结果;
图15为鼠2活检样本解离的肿瘤细胞用于芯片上药物EP毒性测试结果;
图16为鼠2活检样本解离的肿瘤细胞用于芯片上药物wzb毒性测试结果;其中,红色荧光细胞为死细胞。
图标:100-数字微流控芯片;110-底板;111-电极阵列组;112-进样电极组;112a-载药样品进样单元;112b-细胞样品进样单元;113-混合电极;114-移动电极组;115-培养电极组;116-输出电压焊点;120-垫片;130-顶板;131-加样孔;200-便携式数字微流控系统;210-电路控制板;211-电源接口;212-控制按钮;213-信号发生器;214-变压器;215-电磁继电器;220-手持式设备本体。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
本申请提供了一种用于肿瘤精准治疗的药物的筛选方法,其包括体外筛选步骤:将原代肿瘤细胞分别置于多种不同培养条件下进行培养;多种不同培养条件包括:至少一个存在待筛选药物的第一培养条件以及至少一个不存在待筛选药物的第二培养条件;
比较第一培养条件和第二培养条件下的原代肿瘤细胞的存活情况,选择第一培养条件下原代肿瘤细胞存活情况差于第二培养条件下原代肿瘤细胞存活情况的第一培养条件中所用的待筛选药物作为用于肿瘤精准治疗的药物。
其中,原代肿瘤细胞源自患肿瘤个体的肿瘤组织,患肿瘤个体所患的肿瘤类型为乳腺癌、肺癌、肾癌、子宫内膜癌、食道癌、胃癌、胰腺癌、肝癌、胶质瘤、卵巢癌、前列腺癌、原髓细胞白血病和结肠癌中的任一种。患肿瘤个体为哺乳动物;优选地,哺乳动物为人;优选地,哺乳动物为非人哺乳动物;优选地,非人哺乳动物选自小鼠、大鼠、狗、猪、兔、牛、马、羊、猴以及猿中的任一种。
本申请中通过将原代肿瘤细胞直接与多种不同的待筛选药物进行混合并培养,无需将原代肿瘤细胞进行体外培养增殖,可以有效避免在体外培养增殖过程中出现的意外突变。本申请中通过对每个培养条件下的原代肿瘤细胞的存活情况来判断原代肿瘤细胞对该待筛选药物的敏感度,具体来说,是通过向培养条件中添加荧光剂实现对死细胞和/或活细胞进行染色,最后通过荧光细胞数量的多少来判断原代肿瘤细胞对该待筛选药物的敏感度。对细胞进行染色的方法或荧光剂有多种,本申请中的荧光剂包括但不限于死细胞染料、Live/Dead染色、蛋白表达染色和中性红染色中的任一种。应理解,采用其他的染色方式只要能够对细胞的数量进行统计均可实施,本申请不再一一列举。
本申请中对原代肿瘤细胞和待筛选药物进行培养的方式也有多种,包括但不限于在96孔板、数字微流控系统或管道微流控上进行。
其中,96孔板所需的原代肿瘤细胞的数量较多,需要多次进行活检取样,这给传统的基于96孔板的药物筛选带来麻烦。而微流控技术以其小样本量需求的特点,在生物医学领域具有潜在的应用价值,尤其是基于原代肿瘤细胞的药物筛选方面。微流控技术根据原理可分为两类:基于机械力驱动的通道微流控和基于电压驱动的数字微流控。药物筛选已经在通道微流控芯片中被广泛研究。在这些工作中,研究学者利用来自不同器官的人类原代肿瘤样本进行了一系列药物敏感试验。因为药物筛选试验的最终目的是发现相对有效的药物给个体患者来延长他们的寿命。但这些文献对相关药物的体内效应没有进一步的探讨,因此大大降低了其应用价值。此外,通道微流控中细长毛细管的使用使得活检样本的浪费不可避免;庞大的辅助设备和机械的操作模式也阻碍了其更广泛的推广。
与通道微流控不同,数字微流控(DMF)利用基于介电润湿(EWOD)现象的电驱动信号操纵电极阵列上的单个液滴,方便对单个样品进行自动化分析。在DMF芯片上进行细胞培养已被许多研究小组所探索,如原代细胞培养、单细胞培养或商业化肿瘤细胞系的药物毒性试验。然而,所有这些先前的研究都使用商业化的癌细胞系作为模型细胞。原代肿瘤样本的培养和药物筛选工作从未在便携式数字微流控系统上进行过。更重要的是,体外药物筛选是否能可靠地指导体内治疗尚不清楚。
因此,本申请中,优选采用数字微流控系统对上述原代肿瘤细胞和待筛选药物进行培养。
具体来说,通过将药物和原代肿瘤细胞进样至数字微流控系统内,然后通过对数字微流控系统内的相邻的电极通电以移动并混合进样的样品;数字微流控系统内具有多个电极,分别用以实现对电极上的液滴进行移动和混合,多个电极由对应的电压进行驱动;电压的个数小于或等于电极的个数,也即是,本申请中的多个电极中的每一个电极均可利用一个单独的输出电压通道进行控制,也可以多个电极中的某几个利用一个共用输出电压通道进行控制。
具体来说,本申请中,优选对数字微流控系统中的数字微流控芯片进行设计,仅仅作为一个典型的示意例,本申请中的数字微流控芯片的底板上形成有电极阵列组和输出电压焊点;电极阵列组包括至少两个用于对不同样品分别进样的进样电极组、用于将进样的不同样品进行混合的混合电极、用于将混合后的样品进行移动的移动电极组和用于将移动至培养区进行培养的培养电极组;其中,混合电极同时与进样电极组和移动电极组相邻,培养电极组与移动电极组相邻。
其中,进样的方式也有多种,例如,可以通过将预先配制的多种药物的不同浓度的药物与原代肿瘤细胞悬液进行混合后再进样;或者;通过将预先配制的多种药物的不同浓度的药物与原代肿瘤细胞悬液进样至所述进样电极组后再进行混合;或者;通过将多种药物中待混合的药物进样至进样电极组,然后将原代肿瘤细胞悬液与不同体积的药物进行混合。
优选地,通过给设置于进样电极组上的药物浓度产生器施加方波放大的尖锐脉冲波以产生小于进样药物体积的药物液体;药物浓度产生器包括第一电极条和第二电极条,第二电极条的宽度为第一电极条的宽度的7-9倍;第一电极条的宽度为10-60μm,第二电极条的宽度为300-500μm。
接下来,本申请中将详细对数字微流控芯片100的具体结构进行阐述。
请参阅图1,本申请提供了一种数字微流控芯片100,其包括底板110、垫片120和顶板130。顶板130通过垫片120连接至底板110的上方,底板110上形成有电极阵列组111和输出电压焊点116(图2)。
具体地,请参阅图2和图3,电极阵列组111包括进样电极组112、混合电极113、移动电极组114和培养电极组115。
进样电极组112用于对不同样品分别进样。
进样电极组112的个数至少为两个,可实现对至少两种样品进行进样,每个进样电极组112均包括多个依次设置且编号不同的电极,且所有进样电极组112的电极编号相同,本申请中,通过依次给相邻的电极通电以促使进样的样品液滴移动。
优选的,本实施例中,进样电极组112的个数为两个,具体包括载药样品进样单元112a和细胞样品进样单元112b,分别用于实现对肿瘤细胞样品和不同浓度的药物样品进行分别进样。载药样品进样单元112a和细胞样品进样单元112b分别连接至混合电极113的两侧;进样后的载药样品和细胞样品移动至混合电极113处并在混合电极113处混合。具体来说,本申请中混合电极113的左侧为载药样品进样单元112a,右侧为细胞样品进样单元112b。应理解,载药样品进样单元112a和细胞样品进样单元112b的位置可以互换,并且其内部电极的个数以及形状均可以视情况进行调整,本申请不做具体限制。
具体地,载药样品进样单元112a具有多个依次设置且编号不同的电极,细胞样品进样单元112b中的电极与载药样品进样单元112a的电极个数和编号相同;载药样品进样单元112a和细胞样品进样单元112b中编号相同的电极串联且共同连接至一个输出电压焊点(请参阅图4)。本申请中通过将载药样品进样单元112a和细胞样品进样单元112b设置成具有相同个数和相同编号的电极,在载药样品和细胞样品进样后,可以通过控制同一个输出电压实现对相同编号的电极进行充电控制,从而实现同时对载药样品和细胞样品的移动进行控制。
混合电极113用于将进样的不同样品进行混合。
混合电极113同时与进样电极组112和移动电极组114相邻,混合电极113可以实现移动至混合电极113处的载药样品和细胞样品进行混合,并将混合后的样品进行输出。
移动电极组114用于将混合后的样品进行移动。
由于本申请是通过对相邻的电极进行依次连续通电以促进样品液滴移动,其移动原理图可参阅图5,为了避免液滴的移动方向发生错误,本申请中,任意三个相邻的电极的编号需要不同,因此,本申请中移动电极组114包括至少三个依次设置且编号不同的电极。该设计原理(任意三个相邻的电极的编号需要不同)也同样适用于进样电极组112和培养电极组115。
移动电极组114至少包括一个移动电极单元,移动电极单元至少包括依次相邻的三个电极,移动电极单元远离混合电极的一个电极与混合电极113共用一个输出电压焊点116,移动电极单元的其他电极与进样电极组112靠近混合电极113的相同个数的电极对应编号相同,且相同编号共用同一输出电压焊点116。
培养电极组115用于将混合后的样品移动至培养区进行培养。
培养电极组115与移动电极组114中的任一电极相邻,可以实现对移动电极组114上的混合样品进行改变方向从而移动至培养电极组115,本申请中培养电极组115的电极为经亲水性预处理后的电极,其可以促进细胞粘附。
具体来说,培养电极组115包括多组相同或不同的培养单元;培养单元具有多个依次设置且编号不同的电极;移动电极组114中的任一电极可与多组不同的培养单元相邻;或者,移动电极组114中的不同电极可与对应个数的多组相同的培养单元相邻;
结合图3可以看出,培养电极组115为两组不同的培养单元,两组不同的培养单元分别与移动电极单元的与混合电极113共用一个输出电压焊点116的电极的两侧相邻。并且,每组培养单元的个数与移动电极单元的个数相同。
本申请中分别对进样电极组112中的多个电极、混合电极113、移动电极组114中的多个电极以及培养电极组115中的多个电极分别进行编号(E1至E24),同时对输出电压焊点116进行编号(V1至V24)。输出电压焊点116的个数与电极阵列组111中电极的编号数相同;编号不同的电极分别对应连接至各自的输出电压焊点116;编号相同的电极串联且共同连接至一个输出电压焊点116。
为了更清楚的说明本申请,本申请以典型非限制性的示例对电极阵列组111中的多个电极进行编号并逐一说明。
在该示例中,进样电极组112为两组共10个电极,分别为载药样品进样单元112a和细胞样品进样单元112b,载药样品进样单元112a具有5个电极,分别编号为E22、E23、E24、E5和E3,同样的,细胞样品进样单元112b也具有5个电极,其编号与载药样品进样单元112a的编号保持一致,也编号为E22、E23、E24、E5和E3。混合电极113为一个,其编号为E4。移动电极组114具有3个编号不同的电极,分别编号为E5、E3和E4,其中,移动电极单元远离混合电极113的一个电极将其编号为E4,与混合电极113具有相同的编号,因此,这两个电极共用一个输出电压焊点116,而移动电极单元的其他电极有两个(即移动电极单元中编号为E5和E3的电极)与进样电极组112靠近混合电极113的2个的电极(即进样电极组112中编号为E5和E3的电极)对应编号相同,且相同编号共用同一输出电压焊点。移动电极组114共计3组移动电极单元,共9个电极。培养电极组115具有6组共计12个电极以实现对6个不同浓度的载药样品进行培养分析,具体的,每组均具有2个电极,分别编号为E1和E2,或者编号为E6和E7,具体来说,编号为E1和E2的电极组有3组,编号为E6和E7的电极组也有3组。
其中,进样电极组112中至少有两个电极与移动电极组114中的两个电极编号相同,即进样电极组112中编号为E3和E5的电极和移动电极组114中编号为E3和E5的电极具有相同的编号,同时,移动电极组114中的编号E4的电极与混合电极113的编号相同。由于本申请中,编号相同的电极串联且共同连接至一个输出电压焊点116,这样使得本申请的一个电极阵列组111共具有24个电极,但只需要8个输出电压即可实现将载药样品和细胞样品进行移动、混合并移动至培养电极处。
本示例中的电极通电次序为:载药样品和细胞样品分别从进样孔进入到两个E22号电极,E22号电极同时通电,随后E23号→E24号→E5号→E3号→E4号混合电极113载药样品和细胞样品进行混合,再次对E5号电极进行通电,此时,混合后的样品沿着移动电极组114进行移动,当移动到E4号电极时,可以选择对E2号电极或E7号电极进行通电,使得混合样品移动至不同的培养电极。
值得说明的是,在本申请的其他实施例中,进样电极组112的个数还可以有其他的选择(可参阅图7给出的一种示例),只要至少包括一个电极即可,同样的,移动电极组114中可至少包括一组3个编号不同的电极,且可以选择与混合电极113的编号不同,而培养电极组115可以只有一个电极。这样的电极设置通过让相邻的电极依次通电可以实现将载药样品和细胞样品移动、混合最终移动至培养电极处。
而本申请的典型示例中,采用的电极个数、编号以及排列顺序可以实现连续进样。具体来说,本申请针对6个不同浓度的载药样品与细胞样品进行混合后同时培养以观察细胞对不同浓度的载药样品的敏感性,以筛选出最佳的药物。本申请的载药样品和细胞样品在进入E22号电极后,当其移动至进样电极组112的E5号电极时,可以再次进行进样,此时,第一次进样的样品从E5号电极上的液滴移动至E3号电极再移动在E4号电极进行混合,而第二次进样的样品从E22号移动至E23号电极再移动至E24号电极,当第一次进样的样品再次通移动电极组114的E5号电极时,第一次进样的样品沿着移动电极组114进行移动,并经过E3号电极和E4号电极;而第二次进样的样品移动至进样电极组112的E5号电极,随后经过E3号电极和E4号电极进行混合。同样的,当第二次进样的样品移动至进样电极组112的E5号电极时,可以再次进行进样。当第一次进样的混合样品移动至移动电极组114的最后一个电极(即第三组的编号为E4的电极)时,此时,第二次进样的混合样品移动至移动电极组114中第二组编号为E4的电极,而第三次进样的混合样品移动至移动电极组114中第一组编号为E4的电极,此时可以选择使其进入培养电极组115,即实现一次性进入三个混合样品。本申请中通过这样的设置可以实现连续进料,多组样品同时在不同位置点进行运动,有利于实现同一电压对多个电极进行控制,以最大化反应点数量和药物筛选通量。
进一步的,本申请中电极阵列组111为三个且并联设置,其中,三个电极阵列组111的E22、E23和E24号电极可以分别串联,以实现同步进料。
此外,本申请中,顶板130的材料为ITO玻璃;顶板130上开设有多个用于向进样电极组112进样的加样孔131。底板110的每个电极的周围还设有用于防止载药样品和细胞样品漂移的栅栏;优选地,栅栏的材料为SU-8;栅栏的厚度为50-70微米。底板110的上表面和顶板130的下表面均涂布有厚度为80-120nm的聚四氟乙烯层;聚四氟乙烯层有利于促进液滴的顺利移动。垫片120用于连接底板110和顶板130,具体的,垫片120的厚度为80-120微米,垫片120的材料包括但不限于导电胶。
本申请中的数字微流控芯片100是采用刻蚀的方式制备获得。具体的,利用AutoCAD软件设计了三组平行电极阵列组111作为掩膜版。
先在底板110上涂布10微米厚的SU-8作为介电层,然后在底板110上进行图形化刻蚀。显影后,涂布第二层60微米厚的SU-8图案层作为栅栏,以防止液滴漂移。切割尺寸为35mm×20mm的ITO玻璃作为顶板130。用ZKJ激光切割机(上海ZKJ激光)在ITO玻璃上钻取直径为1.5毫米的孔作为加样孔131。为了促进液滴的顺利移动,在顶板130和底板110涂布厚度为80-120nm的聚四氟乙烯。80-120微米厚的垫片120连接底板110和顶板130。
此外,值得说明的是,本申请中,进样电极组上设置有药物浓度产生器(请参阅图8),药物浓度产生器包括第一电极条和第二电极条,第二电极条的宽度为第一电极条的宽度的7-9倍;第一电极条的宽度为10-60μm,第二电极条的宽度为300-500μm。通过给药物浓度产生器施加方波放大的尖锐脉冲波以产生一系列体积小的药物液体;这种方法可以产生横跨三到四个数量级范围的药物浓度梯度。
通过对带有药滴的特殊电极条施加高压脉冲信号,药滴将喷射大量的小体积药滴。当细胞悬液与喷射的小体积药物液滴混合时,将产生一定浓度的药物细胞悬液混合物。通过调整喷射参数(喷射电压,喷射电极条宽度和喷射时间),该药物浓度产生器可以轻松实现不同药物浓度的产生(三到四个数量级)。
该药物浓度产生器可灵活产生一系列药物浓度,并且可有效评估药物毒性。由于电极条设计的简单性,产生的药物浓度横跨四个数量级的灵活性,所设计的药物浓度产生器在优化组合药物筛选用于癌症治疗及其他相关浓度研究方面具有巨大的潜在应用价值。
第二方面,请参阅图9和图10,本申请还提供了一种便携式数字微流控系统200,其包括上述数字微流控芯片100。
具体的,便携式数字微流控系统200还包括手持式设备本体220和电路控制板210,电路控制板210和数字微流控芯片100均集成于手持式设备本体220中。便携式数字微流控系统200的总尺寸为20-25cm×14-18cm×3-4cm。该便携式数字微流控系统200体积小,操作占用空间小,便携。
优选地,电路控制板210包括电源接口211、控制按钮212和用于提供交流驱动信号的信号发生器213,信号发生器213与控制按钮212通讯连接,电源接口211与控制按钮212电连接,控制按钮212与数字微流控芯片100和电磁继电器215电连接;优选地,交流驱动信号为0.5–10Vrms的正弦波。本申请中,控制按钮212与芯片电极排列一致,以控制每一个电极的通断电。
电路控制板210还包括用于将交流驱动信号放大并为数字微流控芯片100上的电极充电的变压器214,变压器214与控制按钮212和电磁继电器215电连接。
信号发生器213可提供一定波形的驱动信号,然后由变压器214将信号发生器213提供的正弦波信号放大为70-120V的液滴驱动信号。考虑到便携式数字微流控系统200便携式应用的安全性,本申请在直流放大电路和交流放大电路中,采用电磁继电器215作为中转站实现按钮开关的低电压激活。当按下按钮开关时,5v电源适配器提供的5v电源连接电源接口211通过按钮开关和电磁继电器215接通交流放大电路,给数字微流控芯片100上的电极充电。由于数字微流控芯片100上设计了三个并联的电极阵列组111来提高药物筛选的通量,因此按钮开关也被设计成与芯片上的电极序列相对应的阵列组,从而简化了操作,具体来说,控制按钮212的个数为多个且与数字微流控芯片100上的输出电压焊点116的个数对应以分别独立的控制不同编号的电极的电压。
请参阅图11,本申请提供的便携式数字微流控系统200的工作过程为:
通过两个进样孔分别向数字微流控芯片100的进样电极组112进样载药样品和细胞样品,然后对应编号的电极的按钮开关,并依次进行连续充电,以促使载药样品和细胞样品在进样电极组112上移动,当移动至混合电极113处进行混合后,再次按照对应编号的电极进行充电,使混合后的样品继续沿着移动电极组114移动,最终移动至培养电极组115。每个电极阵列组111可进行6个不同浓度的载药样品的进样,6个不同浓度的载药样品分别与细胞样品混合后被移动至各自的培养电极处,随后将数字微流控芯片100置于细胞培养皿中进行培养,培养完成后置于荧光显微镜下进行观察(请参阅图6)。本申请中的便携式数字微流控系统200共具有3组并联的电极阵列组111,从而可以实现同时对三种不同药物(每种药物设置6个浓度梯度)进行筛选,药物筛选的通量比传统设计提高了3倍。原代肿瘤样品获取和芯片药物毒性试验的整个工作流程可在36小时内完成,芯片上的小鼠个体药物筛选结果与个体肿瘤治疗效果相一致,暗示了基于异种移植动物肿瘤模型快速确定最佳有效药物的可靠性。这种“串联电路”设计的方式将提高芯片的利用率。本申请提供的便携式数字微流控系统200在个性化癌症治疗中具有巨大的应用潜力。
本申请中涉及到的试剂为:
SU8和SU-8显影剂购自MicroChem;Pluronic F127购自从Sigma Aldrich;硅油(1cSt)购自美国Clearco公司;磷酸盐缓冲液(PBS)购自Gibco;HBSS购自美国LifeTechnologies公司;顺铂(II)二氯、盐酸表阿霉素(EP)购自Sigma;Wzb117购自Selleckchem;DMEM/F12培养基购自Hyclone;胰岛素、氢化可的松、霍乱毒素和透明质酸酶购自Sigma;表皮生长因子(EGF)购自Invitrogen;胶原酶III购自沃辛顿;RBC裂解缓冲液购自美国eBioscience;StemMACS iPS Brew XF培养基购自美国米尔顿生物技术公司;EthD-1购自赛默飞世尔科技公司。
一、实验方法
(1)移植裸鼠模型
所有动物实验均依照澳门动物福利法进行。本发明将100微升的人乳腺癌MDA-MB-231细胞悬液(2×10
(2)原代肿瘤样本解离
本发明按照常规的原代肿瘤标本解离方法对本实验中的样本进行解离操作并将解离步骤大大简化。简单地,首先本发明将利用活检针获得的小鼠活检样本分别转移到24孔板上,用PBS冲洗两次。然后用移液管吸去PBS后,将0.5mL消化缓冲液I(含5%FBS的DMEM/F12培养基、5μg/ml胰岛素、500ng/ml氢化可的松、10ng/ml表皮生长因子(EGF)、20ng/ml霍乱毒素、300U/ml胶原酶III和100U/ml透明质酸酶)分别加入24孔板的解离样本中。然后将24孔板放入培养箱(37℃,5%CO2)中,以100rpm振荡消化约3h。每隔30分钟用移液管轻轻吹打溶液以加速分解。然后将孔板中的悬液分别移入1.5ml无菌离心管中,在400g下旋转3分钟,随后弃去离心管中的上清液,并向离心管中加入0.5ml RBC裂解缓冲液(eBioscience,USA)进行红细胞裂解30s,最后加入0.5ml HBSS(Life Technologies,USA)用来终止裂解反应。最后,本发明用细胞仪对解离的细胞进行计数,并用StemMACS iPS Brew XF培养基稀释至(美国米尔滕生物技术公司)细胞密度为1.5*10
(3)芯片上药物筛选
以顺铂(II)二氯(Cis)、Wzb117(葡萄糖转运蛋白1抑制剂,简称wzb)和盐酸表阿霉素(EP)为药物模型,本发明在24小时内监测其对分离的原代活检肿瘤样品解离的肿瘤细胞的毒性。对于这三种药物,Cis是一种广泛使用的抗癌化疗药物。wzb可阻断葡萄糖转运,促进细胞凋亡,抑制肿瘤生长。EP具有广泛的抗肿瘤作用,尤其对转移性乳腺癌和小细胞肺癌治疗有效。本发明首先用试管内连续稀释的方式制备Cis、wzb和EP系列浓度(0、1、10、20、40μM)。然后将Pluronic F127和EthD-1分别加入到PCR管中小鼠(1.5×10
(4)异种移植裸鼠药物治疗
根据每只小鼠的芯片上药物毒性试验结果,本发明将小鼠分为三组,每组7只。一组注射相对有效药物(Cis),另一组注射相对低效药物(wzb),第三组注射PBS作为非治疗对照。注射方式为腹腔注射,每周2次。Cis的注射剂量为10mg/kg。为保证三组注射剂量相等,另外两组的治疗剂量也为10mg/kg。在每次给药前,测量并计算小鼠体重和肿瘤体积,疗程为1个月。
二、具体实验操作:
(1)原代肿瘤样品的芯片上药物筛选
原代肿瘤样本的获取过程如图12中A-C所示。简单地,本发明对30只雌性裸鼠注射人乳腺癌MDA-MB-231细胞悬液。当肿瘤肉眼可见时,测量其大小。当小鼠肿瘤体积增大到0.1-0.3cm
如表1所示,三种药物对14只小鼠的原代肿瘤样品均有不同程度的毒性。对于Cis治疗,来自小鼠14的原代肿瘤样本的敏感性最低(“+”),而小鼠2的原代肿瘤样本的敏感性最高(“++++”)。除了鼠9的原代肿瘤样品未测量到毒性外,其他样本的灵敏度水平也不同,分别为“++”、“+++”或“++++”。对于EP治疗,除了小鼠1和8的原代肿瘤样品未测得毒性外,来自小鼠9、13和14的原代肿瘤样品没有敏感性。其他小鼠的原代肿瘤样品有不同的敏感度,为“+”、“++”、“+++”或“+++”。三种药物对来自小鼠2的原代肿瘤样本的毒性试验的荧光显微镜成像结果如图14、图15和图16所示。当细胞死亡时,荧光染料EthD-1进入细胞并发出红色荧光。本发明可以清楚地看到,随着药物(Cis和EP)浓度的增加,红色荧光细胞的数量增加。对于wzb,随着药物浓度的增加,红细胞数量并无明显变化。总体上,与EP治疗相比,小鼠的原代肿瘤样本对Cis治疗更敏感。对于wzb治疗,11只小鼠对该药物均没有敏感性。只有小鼠3和13的样品对药物有一定的敏感性。从整体上看,表1的结果表明,不同个体对同一种药物或不同药物的治疗有不同的反应。
表1.裸鼠原代肿瘤样品的芯片上药物毒性测试结果。
注:“/:细胞毒性未被测量到;-:没有明显的细胞毒性;细胞毒性(+++++>++++>+++>++>+)”
(2)异种移植裸鼠药物治疗
为了研究体外原代肿瘤细胞药物筛选结果是否与体内药物治疗结果一致,本发明通过给每只小鼠注射一种芯片上筛选出的有效药物或无效药物或PBS缓冲液作为对照来研究肿瘤生长情况。每组7只小鼠。本发明通过给MDA-MB-231乳腺癌细胞异种移植鼠腹腔注射一定剂量的药物,研究药物的体内治疗效果。本发明根据芯片药物筛选结果将小鼠分为三组,每组7只。一组注射相对有效药物(Cis);另一组注射相对低效药物(wzb);第三组注射PBS作为对照(三组小鼠的平均肿瘤体积相一致)。图12中D的结果显示,在1个月的治疗中,Cis治疗组的肿瘤体积明显小于wzb治疗组和PBS对照组,与芯片药物筛选结果吻合良好。另外,三组小鼠肿瘤体积的变化趋势不同,提示存在个体差异。在相同治疗时间内,Cis治疗组小鼠2的肿瘤体积测量值最小,与芯片上药物筛选结果一致(小鼠2的原代肿瘤样品对药物Cis最敏感)。体内药物毒性评价方法通常采用体重测量法。图12中E显示,wzb治疗组和对照PBS治疗组小鼠体重无明显变化。Cis治疗组小鼠体重有一定程度的降低,提示Cis的潜在毒性。图12中F显示治疗后肿瘤的拍照结果。可见Cis处理组小鼠肿瘤体积明显小于其他各组。
所有的结果表明,通过芯片上筛选出的药效最好的药物,药效最差的药物,以及对照组的比较,清楚地揭示:体外芯片上的小鼠药物筛选结果与个体治疗效果相一致,暗示了该便携式数字微流控系统200用于精准医学的可行性。考虑到用于芯片药物筛选的样品可以小到直径为1mm、长10mm的切片,结果可以在24小时内返回,DMF平台便携,工作台尺寸小,DMF系统可以快速确定个性化癌症治疗的有效药物。因此,该便携式数字微流控系统200的芯片上药物筛选对体内药物治疗具有一定的指导意义。
(3)浓度产生器的喷射参数对喷射体积的影响
本申请中,采用荧法测量法定量喷射体积。图13中(a)展示了药物浓度产生器的设计方案和工作原理。本申请研究了喷射参数(喷射频率,喷射电极条宽度和喷射电压)对喷射量的影响(图13中b-e)。对于没有荧光发射特性的普通药物,在药物中添加荧光染料是一种实现喷射微小液滴精确体积定量的便捷方法。本申请利用顺铂作为无荧光药物的模型用于喷射体积定量测试。将含有10μM cy3的4mM顺铂母液(溶于50%DMSO溶液)用作喷射药滴。没有荧光的DMEM培养基用作拾取液滴。在实验之前,测量不同顺铂浓度(溶解在DMEM介质中)的荧光强度以获得顺铂标准曲线(图13中b)。通过测量拾取液滴的荧光强度并通过顺铂标准曲线进行计算来量化喷射量。本工作首先研究喷射频率和喷射量之间的关系。如图13中c所示,喷射量随着喷射频率的增加而增加。但随着喷射频率的增加,每次平行测试之间的误差也在增大。这可能是由于以下原因引起的:当喷射频率超过800Hz时,喷射区域超出拾取液滴的电极范围,从而导致喷射出的一些微小液滴的浪费。因此,本申请选择了800Hz作为固定喷射频率用于以下实验。本申请随后研究了喷射电极条宽度与喷射量之间的关系。图13中d表明:无论喷射电压(556v,660v,768v,864v,980v,1020v)多高,当喷射电极条宽度较宽时,喷射量都在增大。对于测试的喷射电极条宽度(50微米,100微米,200微米,300微米和400微米),喷射量与喷射电压具有线性关系。因此,可以得出结论,当喷射电极条宽度变窄并且喷射电压较低时,喷射量较小,反之亦然。对于测试的喷射电极条宽度和喷射电压参数,结果见图13中d:最小喷射量为0.015nL,电极条宽为50微米,电压峰峰值为556v;最大喷射量为0.829nL,电极条宽为400微米,电压峰峰值为1020v。因此,通过调节喷射电极条宽度和喷射电压参数,喷射量将覆盖0.015nL-0.829nL的范围,具有两个数量级的范围。然后,本申请测试了喷射时间,这是另一个影响喷射量的因素。如图13中e所示,喷射量与喷射时间成线性关系。对于400微米的喷射电极条宽度,用峰值1020v电压喷射2s可以产生0.722nL的体积,而喷射30s可以产生11.93nL的体积。
具有红色荧光发射特性的表柔比星盐酸盐被用作喷射量定量测试的另一种药物模型。将5mM表柔比星盐酸盐母液(DMSO:H2O(体积比)=1:1)用作喷射液滴。没有荧光的DMEM培养基用作拾取液滴。设计的浓度产生器产生范围为0.0015nL-11.39nL的喷射量。传统上,在药物毒性测试中,药物浓度范围涵盖2到3个数量级。因此,通过使用本申请设计的芯片上浓度产生器,可以轻松灵活地完成药物毒性测试。
综上所述,本申请中提供的用于肿瘤精准治疗的药物的筛选方法,通过直接采用原代肿瘤细胞与待筛选的药物进行培养,无需对原代肿瘤细胞进行体外培养,有效避免了培养过程中子细胞发生意外突变而导致药物筛选结果存在偏差的情况。本申请中还通过建立肿瘤模型,通过将上述用于肿瘤精准治疗的药物的筛选方法筛选出的药物应用到肿瘤模型上,其与相应的个体肿瘤反应结果相一致,暗示了本申请中提供的用于肿瘤精准治疗的药物的筛选方法快速确定最佳药效药物的有效性和个性化肿瘤治疗的潜在价值。本申请提供了一种数字微流控芯片100,用于异种小鼠乳腺癌模型的活检样品的药物筛选。与传统的芯片上电极设计方式相比,本申请在小尺寸的数字微流控芯片100(3.76cm×3.76cm)上通过“串联电路”的方式设计三个平行的电极阵列组111,可以同时检测三种抗癌药物的毒性(传统的设计中,24个输出电压通道控制24个电极;在本申请的设计中,24个输出电压通道可以控制96个电极)。小鼠体内原代肿瘤样品获取和药物毒性试验的整个工作流程可在36小时内完成,单个小鼠芯片上药物筛选结果与相应的个体肿瘤反应结果相一致,暗示了基于异种移植动物肿瘤模型DMF芯片上快速确定最佳药效药物的有效性和基于DMF平台的个性化肿瘤治疗的潜在价值。
本申请中通过解离移植鼠的活检样本(直径1mm,长10mm,约10000个细胞),并将其加载到数字微流控芯片100上,与不同浓度的每种药物混合以进行药物敏感性试验。以培养24小时后的细胞存活率为基础,评价原代肿瘤细胞对各种药物的敏感性。然后将体外筛选出的最敏感药物注射到相应的小鼠体内进行治疗,具有潜在的最高疗效。
为了验证便携式数字微流控系统200和方法的有效性,本申请将人乳腺癌细胞(MDA-MB-231)移植到裸鼠体内,建立人乳腺癌模型。以顺铂(Cis)、Wzb117(葡萄糖转运蛋白1抑制剂,简称wzb)和盐酸表阿霉素(EP)为模型药物进行药物筛选和体内治疗研究。通过芯片上筛选出的药效最好的药物,药效最差的药物,以及对照组的比较,清楚地揭示:体外芯片上的小鼠药物筛选结果与个体治疗效果相一致,暗示了该数字微流控平台用于精准医学的可行性。考虑到用于芯片药物筛选的样品可以小到直径为1mm、长10mm的切片,结果可以在24小时内返回,便携式数字微流控系统200便携,工作台尺寸小,本申请提供的便携式数字微流控系统200将是一个很有前途的平台,可以快速确定个性化癌症治疗的有效药物。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种用于肿瘤精准治疗的药物的筛选方法
- 一种肝转移三阴性乳腺癌精准治疗药物的筛选方法
