包含取代茚满的固体分散体和药物组合物及其制备和使用方法
文献发布时间:2023-06-19 11:21:00
相关申请的交叉引用
本申请要求2018年10月30日提交的美国临时申请No. 62/752,685的权益,其经此引用并入本申请的公开内容。
发明背景
向组织充分供氧对维持哺乳动物细胞功能和生理机能至关重要。向组织供氧不足是其中血流量不足以提供充分氧合作用的许多病理生理状况的特征。组织的缺氧(低氧)环境激活信号级联以驱动与例如血管生成(新生血管)、葡萄糖代谢和细胞存活/死亡之类事件有关的许多基因的转录的诱导或阻遏。这种缺氧转录反应的关键在于转录因子,缺氧诱导因子(HIF)。HIF在一大系列的癌症中通过缺氧相关和无关的机制失调,并且其表达与患者预后不良相关联。
HIF由氧敏感的HIFα亚基和结构性表达的ΗIFβ亚基组成。当HIF被激活时,HIFα和ΗIFβ亚基组装功能异源二聚体(α亚基与β亚基异源二聚)。HIFα和ΗIFβ都具有两个相同的结构特征,碱性螺旋-环-螺旋(bHLH)和PAS结构域(PAS是第一个蛋白质PER、ARNT、SIM的首字母缩写词,其中这一基序是确认的)。有三种氧敏感的人类HIFα亚基(HIF-1α、HIF-2α和HIF-3α)。在这三种亚基中,HIF-1α最广泛表达并在许多细胞和组织类型中被低氧浓度诱导。HIF-2α在结构和功能上都非常类似于HIF-1α,但表现出更有限的细胞和组织特异性表达,并且也可能通过核转位差异性调节。HIF-3α也在HLH和PAS结构域中表现出与HIF-1α和HIF-2α的守恒。HIF-1β(也称为ARNT - 芳香烃受体核转运子)——HIFα亚基的二聚配偶体(dimerization partner),在所有细胞类型中结构性表达并且不受氧浓度调节。
发明概述
在某些方面中,本公开提供一种固体分散体,其包含式(I)的化合物:
在一些实施方案中,该固体分散体进一步包含可药用聚合物。该聚合物可包含疏水区和亲水区。在一些实施方案中,该聚合物选自纤维素酯;纤维素醚;聚环氧烷;聚氯乙烯;聚乙烯醇;聚丙烯酸酯;聚甲基丙烯酸酯;N-乙烯基内酰胺的均聚物和共聚物、聚丙烯酰胺和乙酸乙烯酯;聚乙二醇、聚乙烯基己内酰胺和聚乙酸乙烯酯的接枝共聚物;低聚糖;多糖;及其混合物。在一些实施方案中,该聚合物是纤维素酯或纤维素醚。在一些实施方案中,该聚合物选自甲基纤维素、乙基纤维素、羟乙基纤维素、邻苯二甲酸乙酸纤维素(CAP)、羟丙甲纤维素(HPMC)、羟丙基纤维素、邻苯二甲酸羟丙甲纤维素(HPMCP)、醋酸琥珀羟丙甲纤维素(HPMCAS)、聚(乙二醇)甲基、聚乙二醇-聚乙酸乙烯酯-聚乙烯基己内酰胺接枝共聚物(poly-ethylene glycol vinyl acetate vinylcaprolactam,Soluplus)、聚乙二醇6000(PEG 6000)、聚乙烯基吡咯烷酮(PVP)、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(polyvinylpyrrolidone vinyl acetate,PVP-VA)、聚(丙烯酸乙酯-共-甲基丙烯酸甲酯-共-甲基丙烯酰氧乙基三甲基氯化铵) 1:2:0.1(例如Eudragit RS 100)、B型甲基丙烯酸共聚物(例如Eudragit S 100)、B型甲基丙烯酸共聚物、聚乙酸乙烯邻苯二甲酸酯(例如Sureteric)、聚氧乙烯-聚氧丙烯嵌段共聚物(例如Pluronic F-68)和聚氧乙烯(20)山梨糖醇酐单油酸酯(Tween 80)。在一些实施方案中,该聚合物选自HPMCAS、CAP和聚乙二醇乙酸乙烯酯乙烯基己内酰胺(例如Soluplus)。在一些实施方案中,该聚合物选自HPMCAS-L、HPMCAS-M和HPMCAS-H,如HPMCAS-H。
在一些实施方案中,式(I)的化合物以固体分散体的1重量%至50重量%的量存在。在一些实施方案中,该聚合物以固体分散体的50重量%至99重量%的量存在。在一些实施方案中,式(I)的化合物以固体分散体的15重量%至35重量%的量存在。在一些实施方案中,该聚合物以固体分散体的65重量%至85重量%的量存在。在一些实施方案中,式(I)的化合物以固体分散体的22.5重量%至27.5重量%的量存在。在一些实施方案中,该聚合物以固体分散体的72.5重量%至77.5重量%的量存在。在一些实施方案中,式(I)的化合物以固体分散体的大约25重量%的量存在。在一些实施方案中,该聚合物以固体分散体的大约75重量%的量存在。在一些实施方案中,式(I)的化合物与该聚合物的重量比为1:99至1:1,如15:85至35:65。在一些实施方案中,式(I)的化合物与该聚合物的重量比为22.5:77.5至27.5:72.5,如大约25:75。
在一些实施方案中,该固体分散体是基本非晶的。在一些实施方案中,该固体分散体是非晶的。在一些实施方案中,该固体分散体表现出在80至100℃之间,如在82至92℃之间的玻璃化转变温度(T
在一些实施方案中,该固体分散体的粒度分布以小于6 µm的d
在某些方面中,本公开提供一种非晶固体分散体,其包含,按重量相对于固体分散体的总重量计:
(a) 22.5%至27.5%的式(I)的化合物:
(b) 72.5%至77.5%的HPMCAS。
在某些方面中,本公开提供一种药物组合物,其包含本文所述的固体分散体和可药用赋形剂。在一些实施方案中,该药物组合物是胶囊或片剂。在一些实施方案中,该药物组合物配制用于口服递送。在一些实施方案中,可药用赋形剂包含粘合剂、填料、崩解剂、润滑剂、助流剂或其组合。在一些实施方案中,固体分散体以药物组合物的15重量%至50重量%的量存在。在一些实施方案中,该药物组合物包含,按重量相对于药物组合物的总重量计:(a) 15%至50%的固体分散体;(b) 20%至50%的粘合剂;(c) 20%至40%的填料;(d) 1.0%至5.0%的崩解剂;和(e) 0.25%至1.25%的润滑剂。在一些实施方案中,粘合剂是微晶纤维素。在一些实施方案中,填料是甘露糖醇。在一些实施方案中,崩解剂是交联羧甲基纤维素钠。在一些实施方案中,润滑剂是硬脂酸镁。在一些实施方案中,该药物组合物进一步包含,按重量相对于药物组合物的总重量计,0.1%至1.25%的助流剂,任选其中助流剂是胶体二氧化硅。在一些实施方案中,该药物组合物进一步包含包衣,任选其中包衣是基于聚(乙烯)醇聚合物的包衣。在某些实施方案中,该药物组合物中的基于聚(乙烯)醇聚合物的包衣进一步包含聚乙二醇。在具体实施方案中,该药物组合物具有为OpaDry II的包衣。
在某些方面中,本公开提供一种包装固体分散体,其包括本文所述的固体分散体和干燥剂。在一些实施方案中,干燥剂是SiO
在某些方面中,本公开提供一种治疗von Hippel-Lindau(VHL)疾病的方法,其包括给予需要其的对象有效量的本文所述的固体分散体或药物组合物。在一些实施方案中,该对象也患有成血管细胞瘤、嗜铬细胞瘤、胰腺神经内分泌肿瘤或肾细胞癌,如肾细胞癌。本公开还提供一种治疗肾细胞癌的方法,其包括给予需要其的对象有效量的本文所述的固体分散体或药物组合物。在一些实施方案中,肾细胞癌是透明细胞肾细胞癌。
在某些方面中,本公开提供一种治疗HIF-2α介导的疾病或病况的方法,其包括给予需要其的对象治疗有效量的本文所述的固体分散体或药物组合物。在一些实施方案中,该疾病或病况是癌症。在一些实施方案中,该疾病或病况选自肾细胞癌、von Hippel-Lindau疾病、肺动脉高压、胶质母细胞瘤和结肠炎。本公开还提供一种抑制HIF-2α的方法,其包括使HIF-2α与有效量的本文所述的固体分散体或药物组合物接触。本文所述的方法可进一步包括给予第二治疗剂。
在某些方面中,本公开提供一种制备本文所述的固体分散体的方法,其包括:(a)提供式(I)的化合物和聚合物在溶剂中的溶液;和(b) 除去所述溶剂以提供固体分散体。在一些实施方案中,该溶剂包括丙酮、甲乙酮、四氢呋喃、水或其组合。在一些实施方案中,该溶剂包含丙酮。在一些实施方案中,该溶剂包含最多5%水。在一些实施方案中,通过冷冻蒸发或喷雾干燥除去溶剂。在一些实施方案中,通过喷雾干燥除去溶剂。该方法可进一步包括在盘式干燥机中干燥所述固体分散体,由此除去残留溶剂。在一些实施方案中,该溶液包含8重量%至14重量%固体。
在某些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含(a) 包含式(I)的化合物的固体分散体;和(b) 一种或多种可药用赋形剂。在一些实施方案中,该固体剂型是胶囊或片剂。在一些实施方案中,该固体剂型是片剂。在一些实施方案中,所述一种或多种可药用赋形剂包含粘合剂、填料、崩解剂和润滑剂。在一些实施方案中,固体分散体以固体剂型的15重量%至50重量%的量存在。在一些实施方案中,固体分散体包含可药用聚合物。在一些实施方案中,可药用聚合物是HPMCAS。在一些实施方案中,该聚合物以固体剂型的15重量%至35重量%的量存在。在一些实施方案中,式(I)的化合物以固体剂型的1重量%至15重量%的量存在。该固体剂型可包含5mg至100 mg的式(I)的化合物,如大约10 mg的式(I)的化合物或大约40 mg的式(I)的化合物。
本公开的固体剂型可包含固体剂型的20重量%至50重量%的量的粘合剂,任选其中粘合剂是微晶纤维素。该固体剂型可包含固体剂型的20重量%至40重量%的量的填料。在一些实施方案中,该固体剂型包含颗粒内填料和颗粒外填料,其中颗粒内填料以固体剂型的12重量%至22重量%的量存在,且其中颗粒外填料以固体剂型的8%至18%的量存在。在一些实施方案中,填料是甘露糖醇。该固体剂型可包含固体剂型的1.0重量%至5.0重量%的量的崩解剂。在一些实施方案中,该固体剂型包含颗粒内崩解剂和颗粒外崩解剂,其中颗粒内崩解剂以固体剂型的0.9重量%至3.0重量%的量存在,且其中颗粒外崩解剂以固体剂型的0.1%至2.0%的量存在。在一些实施方案中,崩解剂是交联羧甲基纤维素钠。该固体剂型可包含固体剂型的0.25重量%至1.25重量%的量的润滑剂。在一些实施方案中,该固体剂型包含颗粒内润滑剂和颗粒外润滑剂,其中颗粒内润滑剂以固体剂型的0.15重量%至0.75重量%的量存在,且其中颗粒外润滑剂以固体剂型的0.10%至0.50%的量存在。在一些实施方案中,润滑剂是硬脂酸镁。在一些实施方案中,该固体剂型包含固体剂型的0.10重量%至1.25重量%的量的助流剂。在一些实施方案中,助流剂是胶体二氧化硅,如CabOSil。在一些实施方案中,该固体剂型包含包衣。在一些实施方案中,包衣基于PVA,如OpaDry II。
本公开的固体剂型可表现出在5至25 KP之间的硬度。在一些实施方案中,该固体剂型的重量在50至750 mg之间,如大约125 mg或大约500 mg。在一些实施方案中,该固体剂型包含少于2重量%的杂质。在一些实施方案中,该固体剂型在室温下储存6个月后包含少于2重量%的杂质。在一些实施方案中,该固体剂型包含少于3重量%的水。在一些实施方案中,该固体剂型在室温下储存6个月后包含少于3重量%的水。在一些实施方案中,该固体剂型以1至5分钟之间的崩解时间为特征。
在某些方面中,本公开提供一种包装固体剂型,其包括本文所述的固体剂型和干燥剂。在一些实施方案中,干燥剂是SiO
在某些方面中,本公开提供一种治疗von Hippel-Lindau(VHL)疾病的方法,其包括给予需要其的对象本文所述的固体剂型。在一些实施方案中,对象也患有成血管细胞瘤、嗜铬细胞瘤、胰腺神经内分泌肿瘤或肾细胞癌,如肾细胞癌。本公开还提供一种治疗肾细胞癌的方法,其包括给予需要其的对象本文所述的固体剂型。在一些实施方案中,肾细胞癌是透明细胞肾细胞癌。
在某些方面中,本公开提供一种治疗HIF-2α介导的疾病或病况的方法,其包括给予需要其的对象本文所述的固体剂型。在一些实施方案中,该疾病或病况是癌症。在一些实施方案中,该疾病或病况选自肾细胞癌、von Hippel-Lindau疾病、肺动脉高压、胶质母细胞瘤和结肠炎。本公开还提供一种抑制HIF-2α的方法,其包括使HIF-2α与本文所述的固体剂型接触。任何所述方法可进一步包括给予第二治疗剂。
在某些方面中,本公开提供一种制备本文所述的固体剂型的方法,其包括:(a) 混合式(I)的化合物和一种或多种可药用赋形剂以形成磨碎颗粒;和(b) 通过施加5 kN至20kN的压缩力而压缩颗粒。本公开还提供一种制备本文所述的固体剂型的方法,其包括:(a)掺合式(I)的化合物、粘合剂、填料、崩解剂和润滑剂,由此形成掺合混合物;(b) 任选使用碾压机,将掺合混合物制粒,由此形成颗粒状混合物;(c) 将第二填料、第二崩解剂和第二润滑剂与所述颗粒状混合物混合,由此形成压片混合物;和(d) 将所述压片混合物压缩成片剂,其中填料和第二填料相同或不同;崩解剂和第二崩解剂相同或不同;且润滑剂和第二润滑剂相同或不同。在一些实施方案中,该方法进一步包括将助流剂与(c)的颗粒状混合物混合。在一些实施方案中,该方法进一步包括用包衣,如OpaDry II包覆所述片剂。
经此引用并入
本说明书中提到的所有出版物、专利和专利申请经此引用并入本文,就像各个出版物、专利或专利申请明确地和单独地被指明经此引用并入。
附图简述
图1描绘式(I)的结晶化合物的XRPD图谱。
图2描绘式(I)的化合物的七种固体分散体、式(I)的结晶化合物和式(I)的喷雾干燥化合物的衍射图的叠加。后两个衍射图以尖锐、明显的峰为特征。
图3描绘式(I)的化合物的三种固体分散体和式(I)的结晶化合物的衍射图的叠加。
图4提供式(I)的化合物和HPMCAS-H(左)、CAP(中)或SOLUPLUS(右)的固体分散体在5,000x放大率下的SEM图像。
图5描绘式(I)的化合物的固体分散体和式(I)的结晶化合物的XRPD图谱的三组叠加。在每组中,顶部宽曲线代表在40℃和75% RH下敞开储存4周的固体分散体,中间宽曲线代表在相同条件下封闭储存4周的固体分散体,且底部宽曲线代表在储存前的固体分散体(t=0)。含有尖锐、明显的峰的曲线代表式(I)的结晶化合物。
图6描绘1:3式(I)的化合物:HPMCAS-H固体分散体的XRPD图谱。
图7提供1:3式(I)的化合物:HPMCAS-H固体分散体在500x(左)和5,000x(右)放大率下的SEM图像。
图8显示固体分散体的粒度分布。
图9描绘空白(底部迹线)、式(I)的化合物(中间迹线)和式(I)的化合物和HPMCAS-H的固体分散体(顶部迹线)的HPLC迹线。
图10描绘在暴露于33%湿度(顶部曲线)、50%湿度(中间曲线)或75%湿度(底部曲线)24小时后1:3式(I)的化合物:HPMCAS-H固体分散体的mDSC曲线。
图11提供在室温下保存1天、3天、5天或7天的湿固体分散体的XRPD图谱(分别为从上到下的曲线)。
图12提供1:3式(I)的化合物:HPMCAS-H固体分散体的XRPD图谱。
图13显示固体分散体的粒度分布。
图14描绘制备固体剂型的工艺流程图。
图15描绘10和40 mg片剂的溶出曲线。
发明详述
临床有用的药物候选物的大规模生产通常需要良好生产规范。在本文中提供制备包含式(I)的化合物的药物组合物的方法:
本文中提供的组合物具有有利的物理性质,这可在加工、配制、稳定性、生物利用度、储存和操作方面提供益处,还有其它重要的药物特性。本文所述的方法能使大规模生产符合良好生产规范(GMP)指南。
如本文所用和除非另行规定,本文以3-(((1S,2S,3R)-2,3-二氟-1-羟基-7-(甲基磺酰基)-2,3-二氢-1H-茚-4-基)氧基)-5-氟苯甲腈为名提到的化合物对应于下面描绘的式(I)的化合物:
除非另行指明,本文使用的所有技术和科学术语具有本发明所属领域的技术人员通常理解的相同含义。
除非上下文清楚地另行规定,否则说明书和权利要求书中所用的单数形式“一”和“该”包括复数指代。
“任选”或“任选地”是指随后描述的事件或情形可能发生或可能不发生,并且该描述包括其中该事件或情形发生的情况和其中该事件或情形不发生的情况。例如,“任选取代的芳基”是指芳基可能被取代或未取代,并且该描述包括取代芳基和无取代的芳基。
式I的化合物还包括该化合物的结晶和非晶形式、可药用盐和具有相同类型活性的这些化合物的活性代谢物,包括例如该化合物的共晶、多晶型物、假多晶型物、溶剂化物、水合物、未溶剂化的多晶型物(包括无水物)、构象多晶型物和非晶形式,及其混合物。
本文所用的术语“共晶”是指其中通过非离子相互作用,包括但不限于氢键合、偶极-偶极相互作用、偶极-四极相互作用或分散力(van der Waals)将两种或更多种不同分子和/或离子组分(通常以化学计量比)结合在一起的固相(其可以是结晶的或可以不是结晶的)。在不同组分之间不存在质子转移并且该固相不是简单盐也不是溶剂化物。关于共晶的论述可见于例如S. Aitipamula等人, Crystal Growth and Design. 2012, 12 (5),第2147-2152页。
本文所用的术语“固体形式”是指不是主要为液态或气态的化合物。本文所用的术语固体形式包含半固体。固体形式可以是结晶的、非晶的、部分结晶、部分非晶或其混合物。包含式(I)的化合物的“单组分”固体形式基本由式(I)的化合物组成。包含式(I)的化合物的“多组分”固体形式在该固体形式内包含一种或多种另外的物类,如离子和/或分子。例如,在特定实施方案中,包含式(I)的化合物的非晶多组分固体形式包含一种或多种聚合物和分散在包含聚合物的固体基质中的式(I)的化合物。
术语“结晶”当用于描述物质、化合物、组分、产物或形式时是指该物质、化合物、组分、产物或形式是基本结晶的,例如,如通过X-射线衍射测定。
术语“晶型”是指包含给定物质的结晶变形,包括单组分晶型和多组分晶型,并且包括但不限于,多晶型物、溶剂化物、水合物、共晶、其它分子配合物、盐、盐的溶剂化物、盐的水合物、盐的共晶、和盐的其它分子配合物、和它们的多晶型物。在一些实施方案中,物质的一种晶型可基本不含非晶形式和/或其它晶型。在另一些实施方案中,物质的一种晶型可含有基于重量计少于大约1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%或50%的一种或多种非晶形式和/或其它晶型。可通过许多方法获得物质的晶型。这样的方法包括,但不限于,熔体再结晶、熔体冷却、溶剂再结晶、在受限空间中例如在纳米孔隙或毛细管中再结晶、在表面或模板上例如在聚合物上再结晶、在添加剂例如共晶反分子存在下再结晶、去溶剂化、脱水、快速蒸发、快速冷却、缓慢冷却、蒸气扩散、升华、研磨和溶剂滴磨(solvent-drop grinding)。
术语“多晶型物”和“多晶型(polymorphic form)”是指基本由相同分子或离子组成的两种或更多种晶型。由于晶格中的分子或离子的不同排列或构象,不同多晶型物可能具有不同的物理性质,例如熔融温度、熔化热、溶解度、溶出度和/或振动光谱。多晶型物表现出的物理性质差异可能影响药物参数,如储存稳定性、可压缩性和密度(在配制和产品生产中重要)和溶出度(生物利用度中的重要因素)。稳定性的差异可源于化学反应性的变化(例如差异性的氧化,以致由一种多晶型物组成的剂型比由另一多晶型物组成时更快变色)或机械变化(例如片剂在储存时破碎,因为动力学有利的多晶型物转化成热力学更稳定的多晶型物)或两者(例如一种多晶型物的片剂在高湿度下更容易分解)。由于溶解度/溶出差异,在极端情况下,一些多晶型转变可能导致效力不足,或在另一极端情况下,导致毒性。此外,晶体的物理性质可能在加工中重要;例如,一种多晶型物更有可能形成溶剂化物或可能难以过滤和洗净杂质(例如在多晶型物之间,粒子形状和粒度分布可能不同)。
术语“非晶”和“非晶形式”在本文中用于描述如通过X-射线衍射测定的基本未结晶的物质、组分或产物。在某些实施方案中,物质的非晶形式可基本不含晶体形式。在另一些实施方案中,物质的非晶形式可含有基于重量计少于大约1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%或50%的一种或多种晶体形式。在另一些实施方案中,物质的非晶形式可包含另外的组分或成分(例如可用来进一步稳定非晶形式的添加剂、聚合物或赋形剂)。在一些实施方案中,非晶形式可以是固溶体。可通过许多方法获得物质的非晶形式。这样的方法包括,但不限于,加热、熔体冷却、快速熔体冷却、溶剂蒸发、快速溶剂蒸发、去溶剂化、升华、研磨、球磨、低温研磨、喷雾干燥和冻干。
除非另行规定,术语“固体分散体”是指包含至少两种成分的固态,其中一种成分明显均匀地均匀分散遍布在其它一种或多种成分中。其包括固溶体或玻璃溶液,即成分的分散方式使得该组合物在性质上化学和物理均匀。在一个实施方案中,第一成分是活性药物成分(API),如式(I)的化合物,且第二成分是包含聚合物的基质,其中API明显均匀地分散在基质(聚合物)内。API可以以非晶状态或以细晶分散形式存在。API也可作为非晶形式和结晶形式的混合物供应。固体分散体可包含多于两种成分。例如,可将两种或更多种API分散到基质中,并且基质可包含两种或更多种聚合物。非限制性地,固体分散体可物理分类为低共熔混合物、固溶体、玻璃溶液或悬浮液、在玻璃状或结晶载体中的非晶沉淀物、复合物、复合形式(complexed formation)或不同体系的组合。此外,固体分散体可使用本领域技术人员已知的各种技术制备,如通过将API和聚合物共溶解在溶剂中,然后喷雾干燥、喷雾凝结、蒸发、固化或微波、掺合和直接压缩、在升高但非熔化温度下机械混合、湿法制粒、挤出-滚圆、熔体熔合、热熔挤出等。“固体基质”是指固体形式的基质。
术语“聚合物”是指包含通过共价化学键连接的重复结构单元(单体)的化合物。聚合物可进一步衍生化、交联、接枝或封端。聚合物的非限制性实例包括共聚物、三元共聚物、四元聚合物和同系物。术语“共聚物”是指基本由两种或更多种不同类型的重复结构单元(单体)组成的聚合物。
术语“大约”和“近似”在关于量使用时,是指在指定量的30%内,如在20%内、在15%内、在10%内或在5%内的量。
本文所述的化合物可能表现出它们的天然同位素丰度,或一个或多个原子可能人为富集具有相同原子序数但原子质量或质量数不同于自然界中主要发现的原子质量或质量数的特定同位素。本公开的化合物的所有同位素变体,无论是否放射性,都包含在本公开的范围内。例如,氢具有三种天然存在的同位素,标为
“异构体”是具有相同分子式的不同化合物。“立体异构体”是只有原子的空间排列方式不同的异构体。“对映异构体”是互为不重叠镜像的一对立体异构体。一对对映异构体的1:1混合物是“外消旋”混合物。如果适当,术语“(±)”用于表示外消旋混合物。“非对映异构体”或“非对映体”是具有至少两个不对称原子但不互为镜像的立体异构体。根据Cahn-Ingold-Prelog R-S系统指定绝对立体化学。当化合物为纯对映异构体时,可通过R或S指定各手性碳上的立体化学。绝对构型未知的拆分化合物可根据它们在钠D线的波长下使平面偏振光旋转的方向(右旋或左旋)被指定为(+)或(-)。本文所述的某些化合物含有一个或多个不对称中心并因此可产生对映异构体、非对映体和其它立体异构形式,其不对称中心可根据绝对立体化学被指定为(R)-或(S)-。本化学实体、药物组合物和方法意在包括所有这些可能的立体异构体,包括外消旋混合物、光学纯的形式、非对映体的混合物和中间混合物。旋光(R)-和(S)-异构体可使用手性合成子或手性试剂制备或使用常规技术拆分。可通过任何合适的方法分析化合物的旋光性,包括但不限于手性色谱法和偏振测定法,并可测定一种立体异构体相对于其它异构体的优势度。
如果需要,可通过任何合适的分离或提纯程序,例如过滤、萃取、结晶、柱色谱法、薄层色谱法或厚层色谱法或这些程序的组合实施本文所述的化学实体和中间体的分离和提纯。合适的分离和离析程序的具体示例可参考下文的实施例。但是,也可使用其它等同的分离或离析程序。
术语“盐”或“可药用盐”是指衍生自本领域中公知的各种有机和无机抗衡离子的盐。可药用酸加成盐可用无机酸和有机酸形成。可由其生成盐的无机酸包括例如盐酸、氢溴酸、硫酸、硝酸、磷酸等。可由其生成盐的有机酸包括例如乙酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。可药用碱加成盐可用无机和有机碱形成。可由其生成盐的无机碱包括例如钠、钾、锂、铵、钙、镁、铁、锌、铜、锰、铝等。可由其生成盐的有机碱包括例如伯胺、仲胺和叔胺、取代胺(包括天然存在的取代胺)、环胺、碱性离子交换树脂等,尤其例如异丙胺、三甲胺、二乙胺、三乙胺、三丙胺和乙醇胺。在一些实施方案中,可药用的碱加成盐选自铵、钾、钠、钙和镁盐。
术语“可药用赋形剂”包括但不限于,美国食品和药品管理局(United StatesFood and Drug Administration)已批准可用于人类或家畜的任何辅助剂、载体、赋形剂、粘合剂、填料、崩解剂、润滑剂、助流剂、甜味剂、稀释剂、防腐剂、染料、着色剂、增味剂、表面活性剂、润湿剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂或乳化剂。
术语“有效量”或“治疗有效量”是指足以影响预期应用,包括但不限于如下文定义的疾病治疗的本文所述的化合物的量。治疗有效量可随预期治疗应用(体内)、或治疗的对象和疾病状况,例如对象的体重和年龄、疾病状况的严重程度、给药方式等而变,这是本领域普通技术人员容易确定的。该术语也适用于在靶细胞中引发特定响应,例如血小板粘附和/或细胞迁移的减少的剂量。具体剂量随所选的特定化合物、遵循的给药方案、是否与其它化合物联合给药、给药时间安排、其给药至的组织和携带其的物理递送系统而变。
本文所用的“治疗”是指用于获得关于疾病、障碍或医疗状况的有益或所需结果,包括但不限于治疗效益和/或预防效益的方法。治疗效益是指所治疗的基础障碍的消除或改善。与基础障碍相关的一种或多种生理症状的消除或改善也实现治疗效益,以致在对象中观察到改善,尽管对象可能仍受基础障碍困扰。在某些实施方案中,关于预防效益,可将该组合物给药于有发生特定疾病的风险的对象或给药于报告了疾病的一种或多种生理症状的对象,即使可能尚未确诊这一疾病。
本文所用的术语“治疗效果”包含如上所述的治疗效益和/或预防效益。预防效益包括延迟或消除疾病或状况的出现,延迟或消除疾病或状况的症状的发作,减慢、暂停或逆转疾病或状况的进展,或它们的任何组合。
本文所用的术语“联合给药”、“与…联合给药”和它们的语法等同物包含两种或更多种药剂向动物包括人类的给药,以使这两种药剂和/或它们的代谢物同时存在于对象体内。联合给药包括在分开的组合物中同时给药、在分开的组合物中在不同时间给药或在其中同时存在这两种药剂的组合物中给药。
术语“拮抗剂”和“抑制剂”可互换使用,且它们是指具有抑制靶蛋白或酶(例如HIF-2α)的生物功能(例如活性、表达、结合、蛋白-蛋白相互作用)的能力的化合物。相应地,在靶蛋白的生物作用的背景下定义术语“拮抗剂”和“抑制剂”。尽管本文中的优选拮抗剂特异性地与靶相互作用(例如结合),但通过与以靶蛋白为成员的信号转导通路的其它成员相互作用而抑制靶蛋白的生物活性的化合物也明确包含在这一定义内。拮抗剂抑制的优选生物活性与炎症相关。
本文所用的术语“激动剂”是指具有引发或增强靶蛋白的生物功能的能力的化合物,无论是否通过抑制靶蛋白的活性或表达。相应地,在靶多肽的生物作用的背景下定义术语“激动剂”。尽管本文中的优选激动剂特异性地与靶相互作用(例如结合),但通过与以靶多肽为成员的信号转导通路的其它成员相互作用而引发或增强靶多肽的生物活性的化合物也明确包含在这一定义内。
“信号转导”是期间向细胞内和在细胞内传送刺激或抑制信号以引起细胞内响应的过程。信号转导通路的调节剂是指调节映射到同一特定的信号转导通路上的一种或多种细胞蛋白的活性的化合物。调节剂可增强(激动剂)或抑制(拮抗剂)信号传导分子的活性。
本文所用的术语“异源二聚”是指通过HIF-2α非共价结合到ΗIF-1β(ARNT)上形成的复合物。HIF-2α与ΗIF-1β(ARNT)的异源二聚是HIF-2α DNA结合和转录活性所需的并由HLH和PAS-B结构域介导。在HIF-2α与HIF-1β(ARNT)的异源二聚后的转录活性可影响五组靶基因,包括血管生成因子、葡萄糖转运体和糖酵解酶、干细胞因子、存活因子和侵入因子。
术语“HIF-2α”是指除C-端调控区外还含有三个保守结构域的单体蛋白:碱性螺旋-环-螺旋(bHLH)和被指定为PAS-A和PAS-B的两个Per-ARNT-Sim(PAS)结构域。“HIF-2α”在科学文献中也替代性地以几个其它名字为人所知,最常见的是内皮PAS结构域包含蛋白1(EPAS-1),其通过EPAS1基因编码。替代性的名称包括碱性螺旋-环-螺旋-PAS蛋白(MOP2)。作为bHLH/PAS家族的转录因子的成员,“HIF-2α”通过经由非共价相互作用结合到ARNT(也称为HIF-1β)蛋白上而形成活性异源二聚转录因子复合物。
术语“HIF-2α PAS-B域腔(domain cavity)”是指HIF-2α的PAS-B结构域内的内腔。PAS-B结构域的晶体结构在其核中可含有大的(大约290 Å)空腔。但是,溶液结构中的氨基酸侧链是动态的。例如,这些侧链可倾向于更深地侵入核中,并可使空腔收缩成1或2个更小的空腔或甚至使空腔膨胀。空腔以HIF-2α PAS-B结构域的包含PHE-244、SER-246、HIS-248、MET -252、PHE-254、ALA-277、PHE-280、TYR-281、MET-289、SER-292、HIS-293、LEU-296、VAL-302、VAL-303、SER-304、TYR-307、MET-309、LEU-319、THR-321、GLN-322、GLY-323、ILE-337、CYS-339和ASN-341的氨基酸残基为衬。编号系统来自RCSB Protein Data Bank中以PDB代码3H7W报告的已知结构。其它以PDB编号的系统可规定作为空腔内衬的上文表达的相同氨基酸。
术语“细胞增殖”是指由分裂造成细胞数改变的现象。这一术语也包括细胞生长,借此与增殖信号一致地,细胞形态已改变(例如尺寸增大)。
术语“选择性抑制”或“选择性地抑制”是指生物活性剂通过与靶直接或间接相互作用而与脱靶信号传导活性相比优先降低靶信号传导活性的能力。
“对象”是指动物,如哺乳动物,例如人类。本文所述的方法可用于人类治疗和兽医应用。在一些实施方案中,对象是哺乳动物,在一些实施方案中,对象是人类。“哺乳动物”包括人类和家养动物,如实验室动物和家庭宠物(例如猫、狗、猪、牛、绵羊、山羊、马、兔子)和非家养动物,如野生动物等。
术语“体内”是指在对象身体内发生的事件。
术语“体外”是指在对象身体外发生的事件。例如,体外测定包括在对象体外进行的任何测定。体外测定包括基于细胞的测定,其中使用活或死的细胞。体外测定也包括无细胞测定,其中不使用完整的细胞。
本公开也意在包含所公开的化合物的体内代谢产物。这样的产物可来自例如所给药化合物的氧化、还原、水解、酰胺化、酯化等,主要归因于酶促过程。因此,本公开包括由包括将本公开的化合物给药于哺乳动物足以产生其代谢产物的一段时间的过程产生的化合物。通常通过将放射性标记的本公开的化合物以可检测剂量给药于动物,如大鼠、小鼠、豚鼠、猴子或人类、留出足够时间以发生代谢并从尿样、血样或其它生物样品中分离其转化产物来识别这样的产物。
术语“OpaDry II”是指Colorcon以下表中概述的规范生产的水性薄膜包衣:
本文所用的化学命名程序和结构图是I.U.P.A.C.命名系统的修改形式,使用ChemDraw Professional 15.1或OpenEye Scientific Software's mol2nam应用程序。对于本文所用的复杂化学名称,取代基通常在其连接的基团前命名。例如,环丙基乙基包含具有环丙基取代基的乙基主链。除非如下所述,在本文的化学结构图中指定所有键,除了在假设键合到足够多的氢原子上以完成化合价的一些碳原子上的所有键。
在某些方面中,本公开提供一种固体分散体,其包含式(I)的化合物或其可药用盐:
在一些实施方案中,该固体分散体进一步包含可药用聚合物。式(I)的化合物可分散在包含聚合物的固体基质中。在一些实施方案中,该聚合物包含疏水区和亲水区。在一些实施方案中,该聚合物是水溶性聚合物。
用于本固体分散体的合适的聚合物包括但不限于纤维素酯;纤维素醚;聚环氧烷;聚丙烯酸酯;聚甲基丙烯酸酯;N-乙烯基内酰胺的均聚物和共聚物、聚丙烯酰胺、乙酸乙烯酯聚合物;聚乙二醇、聚乙烯基己内酰胺和聚乙酸乙烯酯的接枝共聚物;低聚糖;多糖;及其混合物。
在一些实施方案中,该聚合物是纤维素醚聚合物。例如,该聚合物可选自甲基纤维素、乙基纤维素、(羟烷基)纤维素(例如羟乙基纤维素(HEC)或羟丙基纤维素(HPC))或(羟烷基)烷基-纤维素(例如羟丙基甲基纤维素(HPMC或羟丙甲纤维素))。在一些实施方案中,该聚合物是甲基纤维素。在一些实施方案中,该聚合物是乙基纤维素。在一些实施方案中,该聚合物是HEC。在一些实施方案中,该聚合物是HPC。在一些实施方案中,该聚合物是HPMC。
在一些实施方案中,该聚合物是纤维素酯聚合物。在一些实施方案中,该聚合物是邻苯二甲酸纤维素(例如邻苯二甲酸乙酸纤维素或邻苯二甲酸羟丙甲纤维素(HPMCP))或琥珀酸纤维素(例如琥珀酸羟丙甲纤维素(HPMCS)或醋酸琥珀羟丙甲纤维素(HPMCAS))。在一些实施方案中,该聚合物是HPMCP。在一些实施方案中,该聚合物是HPMCAS。
本文所述的纤维素聚合物可通过特定等级进一步限定。例如,HPMC聚合物可选自HPMC E3、HPMC E5、HPMC E6、HPMC E15、HPMC K3、HPMC A4或HPMC A15。在一些实施方案中,HPMCAS是HPMCAS-L、HPMCAS-M、HPMCAS-H、HPMCAS-LF、HPMCAS-MF、HPMCAS-HF、HPMCAS-LG、HPMCAS-MG或HPMCAS-HG。在一些实施方案中,HPMCP是HPMCP 50或HPMCP 55。在一些实施方案中,该聚合物是HPMCP。在一些实施方案中,该聚合物是HPMCP 50。在一些实施方案中,该聚合物是HPMCAS-L、HPMCAS-M或HPMCAS-H。在一些实施方案中,该聚合物是HPMCAS-H。在一些实施方案中,该聚合物是HPMCAS-HG。
在一些实施方案中,该聚合物是聚环氧烷。在一些实施方案中,该聚合物是高分子量聚环氧烷。在一些实施方案中,该聚合物是聚环氧乙烷(PEG或PEO)或环氧乙烷和环氧丙烷的共聚物(泊洛沙姆)。合适的PEG包括但不限于PEG 400、PEG 600、PEG 1450、PEG 3350、PEG 4000、PEG 6000、PEG 8000、PEG 20000及其混合物。合适的泊洛沙姆包括但不限于泊洛沙姆124、泊洛沙姆188、泊洛沙姆237、泊洛沙姆338、泊洛沙姆407及其混合物。在一个实施方案中,该聚合物是聚(乙二醇)甲基。在一些实施方案中,该聚合物是聚乙二醇6000(PEG6000)。
在一些实施方案中,该聚合物是聚丙烯酸酯或聚甲基丙烯酸酯。在一些实施方案中,该聚合物是甲基丙烯酸/丙烯酸乙酯共聚物、甲基丙烯酸/甲基丙烯酸甲酯共聚物、甲基丙烯酸丁酯/甲基丙烯酸2-二甲基氨基乙酯共聚物、聚(丙烯酸羟烷基酯)或聚(甲基丙烯酸羟烷基酯)。合适的聚丙烯酸酯或聚甲基丙烯酸酯包括但不限于以Rohm GmbH的Eudragit
在一些实施方案中,该聚合物是N-乙烯基内酰胺的均聚物或共聚物。在一些实施方案中,该聚合物是N-乙烯基吡咯烷酮的均聚物或共聚物。在一些实施方案中,该聚合物是聚乙烯基吡咯烷酮的均聚物(PVP或聚维酮)或共聚物(例如包含N-乙烯基吡咯烷酮和乙酸乙烯酯单体的那些(共聚维酮)或包含N-乙烯基吡咯烷酮和丙酸乙烯酯单体的那些)。合适的聚维酮包括但不限于具有大约12、大约15、大约17、大约25、大约30或大约90的K值(聚维酮水溶液的粘度的量度)的那些及其混合物。在一些实施方案中,该聚合物是聚乙烯基吡咯烷酮K30。在一些实施方案中,该聚合物是聚(1-乙烯基吡咯烷酮-共-乙酸乙烯酯)。
在一些实施方案中,该聚合物是聚丙烯酰胺。在一些实施方案中,该聚合物是乙酸乙烯酯聚合物(例如乙酸乙烯酯和巴豆酸的共聚物、聚乙酸乙烯酯、聚乙烯醇或部分水解的聚乙酸乙烯酯)。在一些实施方案中,该聚合物是聚乙二醇、聚乙烯基己内酰胺和聚乙酸乙烯酯的接枝共聚物(例如BASF的SOLUPLUS
在一些实施方案中,该聚合物选自甲基纤维素、乙基纤维素、羟乙基纤维素、邻苯二甲酸乙酸纤维素(CAP)、羟丙甲纤维素(HPMC)、羟丙基纤维素、邻苯二甲酸羟丙甲纤维素(HPMCP)、醋酸琥珀羟丙甲纤维素(HPMCAS)、聚(乙二醇)甲基、聚乙二醇-聚乙酸乙烯酯-聚乙烯基己内酰胺接枝共聚物(poly-ethylene glycol vinyl acetate vinylcaprolactam,例如SOLUPLUS)、聚乙二醇6000(PEG 6000)、聚乙烯基吡咯烷酮(PVP)、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(polyvinylpyrrolidone vinyl acetate,PVP-VA)、聚(丙烯酸乙酯-共-甲基丙烯酸甲酯-共-甲基丙烯酰氧乙基三甲基氯化铵) 1:2:0.1(Eudragit RS 100)、B型甲基丙烯酸共聚物(Eudragit S 100)、Sureteric、Pluronic F-68和聚氧乙烯(20)山梨糖醇酐单油酸酯(Tween 80)。该聚合物优选选自HPMCAS、CAP和SOLUPLUS,如HPMCAS。在一些实施方案中,该聚合物选自HPMCAS等级L(HPMCAS-L)、HPMCAS等级M (HPMCAS-M)和HPMCAS等级H(HPMCAS-H)。在一些实施方案中,该聚合物是HPMCAS-H。
在一些实施方案中,式(I)的化合物以固体分散体的1重量%至50重量%,如固体分散体的按重量计1%至45%、1%至40%、1%至35%、1%至30%、5%至50%、5%至45%、5%至40%、5%至35%、5%至30%、10%至50%、10%至45%、10%至40%、10%至35%、10%至30%、15%至50%、15%至45%、15%至40%、15%至35%、15%至30%、20%至50%、20%至45%、20%至40%、20%至35%、20%至30%、22.5%至50%、22.5%至45%、22.5%至40%、22.5%至35%、22.5%至30%、22.5%至27.5%、25%至50%、25%至45%、25%至40%、25%至35%、25%至30%、或25%至27.5%的量存在。在一些实施方案中,式(I)的化合物以固体分散体的至少1重量%,如固体分散体的按重量计至少2%、至少3%、至少4%、至少5%、至少7.5%、至少10%、至少12.5%、至少15%、至少17.5%、至少20%、至少22.5%、至少25%、至少27.5%、至少30%、至少32.5%、至少35%、至少37.5%、至少40%、至少42.5%、至少45%、至少47.5%或至少50%的量存在。
在一些实施方案中,式(I)的化合物以固体分散体的按重量计大约1%、大约2%、大约3%、大约4%、大约5%、大约7.5%、大约10%、大约12.5%、大约15%、大约17.5%、大约20%、大约22.5%、大约25%、大约27.5%、大约30%、大约35%、大约40%、大约45%或大约50%的量存在。
在一些实施方案中,式(I)的化合物以固体分散体的1重量%至50重量%的量存在。在一些实施方案中,式(I)的化合物以固体分散体的15重量%至35重量%的量存在。在一些实施方案中,式(I)的化合物以固体分散体的至少22.5重量%至27.5重量%的量存在。在一些实施方案中,式(I)的化合物以固体分散体的大约25重量%的量存在。
在一些实施方案中,该聚合物以固体分散体的50重量%至99重量%,如固体分散体的按重量计55%至99%、60%至99%、65%至99%、70%至99%、50%至95%、55%至95%、60%至95%、65%至95%、70%至95%、50%至90%、55%至90%、60%至90%、65%至90%、70%至90%、50%至85%、55%至85%、60%至85%、65%至85%、70%至85%、50%至80%、55%至80%、60%至80%、65%至80%、70%至80%、50%至77.5%、52.5%至77.5%、55%至77.5%、57.5%至77.5%、62.5%至77.5%、65%至77.5%、67.5至77.5%、70%至77.5%、72.5%至77.5%、50%至75%、52.5%至75%、55%至75%、57.5%至75%、60%至75%、62.5%至75%、65%至75%、67.5至75%、70%至75%、或72.5%至75%的量存在。在一些实施方案中,该聚合物以固体分散体的至少50重量%,如固体分散体的按重量计至少55%、至少57.5%、至少60%、至少62.5%、至少65%、至少67.5%、至少70.5%、至少72.5%或至少75%的量存在。
在一些实施方案中,该聚合物以固体分散体的按重量计大约60%、大约62.5%、大约65%、大约67.5%、大约70%、大约72.5%、大约75%、大约77.5%、大约80%、大约82.5%、大约85%、大约87.5%或大约90%的量存在。
在一些实施方案中,该聚合物以固体分散体的50重量%至99重量%的量存在。在一些实施方案中,该聚合物以固体分散体的65重量%至85重量%的量存在。在一些实施方案中,该聚合物以固体分散体的至少72.5重量%至77.5重量%的量存在。在一些实施方案中,该聚合物以固体分散体的大约75重量%的量存在。
在一些实施方案中,式(I)的化合物与该聚合物的重量比为1:99至1:1,如5:95至1:1、10:90至1:1、15:85至1:1、20:80至1:1、25:75至1:1、1:99至35:65、5:95至35:65、10:90至35:65、15:85至35:65、20:80至35:65、25:75至35:65、1:99至27.5:72.5、5:95至27.5:72.5、10:90至27.5:72.5、15:85至27.5:72.5、20:80至27.5:72.5、或22.5:77.5至27.5:72.5。在一些实施方案中,式(I)的化合物与该聚合物的重量比为1:99至1:1。在一些实施方案中,式(I)的化合物与该聚合物的重量比为15:85至35:65。在一些实施方案中,式(I)的化合物与该聚合物的重量比为22.5:77.5至27.5:72.5。在一些实施方案中,式(I)的化合物与该聚合物的重量比为大约25:75。
本文公开的固体分散体可通过X-射线粉末衍射(XRPD)、差示扫描量热法(DSC)、调制差示扫描量热法(mDSC)、扫描电子显微术(SEM)、Karl Fischer水滴定法(KF)、残留溶剂、粒度、堆密度、振实密度、手性高压液相色谱法(HPLC)和非手性HPLC表征。
XRPD可用于评估固体分散体的结晶度,如识别固体分散体是结晶的、半结晶的还是非晶的。在一些实施方案中,该固体分散体是基本非晶的。在一些实施方案中,如通过X-射线粉末衍射观察,该固体分散体的最多大约20%、最多大约15%、最多大约10%、最多大约5%、最多大约4%、最多大约3%、最多大约2%或最多大约1%是结晶的。在一些实施方案中,该固体分散体是非晶的。非晶固体分散体的XRPD图谱通常以宽背景信号为特征,即缺乏在结晶材料中发现的离散峰的图谱。优选地,使用Bruker D2 Phaser X射线衍射仪,用扫描型耦合θ/2θ进行XRPD,其中将电压设置为30 kV并将电流设置为10mA,通过Zero-Background Cup保持15 rpm的旋转,具有1.0 mm的狭缝宽度和设置为1.0 mm的刀刃宽度。
可使用任何合适的技术如mDSC测量固体分散体的玻璃化转变温度(T
SEM成像可用于视觉表征固体分散体的形态。在一些实施方案中,该固体分散体包含完整和瘪塌球体。球体的表面可以是光滑的。在一些实施方案中,在该固体分散体的SEM图像中没有检测到结晶材料。优选使用带有Polaron Autocoater E5200 Au/Pd靶溅射涂布机的FEI Quanta 200 SEM,用15 kV的电压、3.0 mA的光点尺寸、2.52 A的灯丝电流和96 µA的发射电流下进行SEM。
KF可用于表征固体分散体的水含量。在一些实施方案中,该固体分散体包含少于2重量%的水。在一些实施方案中,该固体分散体在室温下储存3个月后包含少于2%的水。本公开的固体分散体可能是吸湿的。在一些实施方案中,固体分散体暴露于湿度,如33%、50%或75%湿度,降低固体分散体的T
可使用气相色谱顶空(GCHS)分析测定本公开的固体分散体中的残留溶剂水平。例如,可使用配有30m x 0.32 mm, 1.8 µm, JW Scientific DB-624柱的Agilent 6890A/7694 GC/HS仪器使用以下方法参数分析样品:样品温度105℃;定量环温度110℃;传输线温度115℃;GC周期时间45 min;顶空瓶平衡时间30 min;注入定量环尺寸1 mL;顶空瓶压力时间20 sec;载气压力7 psi;和顶空瓶压力15 psi。在一些实施方案中,该固体分散体包含残留溶剂。在一些实施方案中,该固体分散体包含小于25000 ppm的丙酮。在一些实施方案中,该固体分散体包含小于5000 ppm的丙酮。
可在粉末,如本文公开的固体分散体上进行激光散射,以测定粒度分布。例如,具有3 mm料斗高度的Malvern Aero S干粒度分析仪可在0.7巴压力下在40%的进料速率下使用以分析样品。优选地,在10秒的过程中一式三份分析样品。1.681的折射率和0.5 g/mL的密度可用于使用非球面算法和在0.1至15%之间的样品遮挡的分析。在一些实施方案中,使用平均d
可通过测量固体分散体的样品的质量和体积来获得本公开的固体分散体的堆密度。在一些实施方案中,该固体分散体以至少0.10 g/mL,如至少0.15 g/mL、至少0.20 g/mL、至少0.25 g/mL或至少0.30 g/mL的堆密度为特征。
可通过在机械轻敲样品直至几乎没有或没有观察到进一步体积变化后测量固体分散体的样品的质量和体积来获得本公开的固体分散体的振实密度。在一些实施方案中,该固体分散体以至少0.20 g/mL,如至少0.25 g/mL、至少0.30 g/mL、至少0.35 g/mL、至少0.40 g/mL、至少0.45 g/mL或至少0.50 g/mL的振实密度为特征。
可通过高压液相色谱法(HPLC)评估本公开的固体分散体的纯度。例如,配有Kinetex,C18,4.6 x 100 mm,2.6 µm柱的 Agilent 1220仪器,使用以下方法参数:流动相A,0.1%甲酸/水;流动相B,0.1%甲酸/乙腈;梯度95% A (0 min)、60% A (6 min)、5% A (12min)、95% A (15.1 min),余量由流动相B组成;流速0.8 mL/min;柱温40℃;样品温度,室温;注入量5 µL;检测波长240 nm;和运行时间18.5 min。在一些实施方案中,该固体分散体包含少于5重量%的杂质,如少于2重量%的杂质。在一些实施方案中,该固体分散体在室温下储存3个月后包含少于2重量%的杂质。在一些实施方案中,式(I)的化合物的对映体过量为至少95%。在一些实施方案中,式(I)的化合物的对映体过量为至少99%。在一些实施方案中,式(I)的化合物的对映体过量为至少99.5%。
可在non-sink溶出试验中通过测量在暴露于低pH环境(SGF)30分钟后式(I)的化合物在生物相关的肠道介质(FaSSIF)中的溶解度来测试固体分散体的溶出性能。可由溶出曲线获得式(I)的化合物在SGF中的最大浓度(C
在一些实施方案中,该固体分散体的C
在一些实施方案中,该固体分散体的C
在一些实施方案中,该固体分散体的AUC FaSSIF为至少10000 µgA/mL、如至少20000 µgA/mL、至少30000 µgA/mL、至少40000 µgA/mL、至少50000 µgA/mL、至少60000 µgA/mL、至少70000 µgA/mL、至少80000 µgA/mL、至少90000 µgA/mL或至少100000 µgA/mL。优选地,AUC FaSSIF为至少40000 µgA/mL。在一些实施方案中,AUC FaSSIF在10000至200000 µgA/mL之间,如在10000至175000 µgA/mL之间、在15000至150000 µgA/mL之间、在20000至125000 µgA/mL之间、或在25000至100000 µgA/mL之间。在一些实施方案中,AUCFaSSIF为大约90000 µgA/mL,如90000 ± 1000 µgA/mL。在一些实施方案中,AUC FaSSIF为大约65000 µgA/mL,如65000 ± 1000 µgA/mL。
在一些实施方案中,该固体分散体的AUC提高为至少3.0,如至少5.0、至少10.0、至少15.0、至少20.0、至少25.0、至少30.0、至少35.0或至少40.0,其中AUC提高代表固体分散体的AUC FaSSIF与式(I)的化合物的AUC FaSSIF的比率。优选地,AUC提高为至少10。在一些实施方案中,AUC提高在3.0至50.0之间,如在5.0至45.0之间、在10.0至40.0之间、在15.0至40.0之间、在20.0至40.0之间、或在25.0至45.0之间。在一些实施方案中,AUC提高为大约35.0,如35.0 ± 3.0。在一些实施方案中,AUC提高为大约25.0,如25.0 ± 3.0。
在一些方面中,本公开提供一种非晶固体分散体,其包含,按重量相对于固体分散体的总重量计:
(a) 22.5%至27.5%的式(I)的化合物:
(b) 72.5%至77.5%的HPMCAS。
在一些方面中,本公开提供一种非晶固体分散体,其包含,按重量相对于固体分散体的总重量计:
(a) 20%至30%的式(I)的化合物:
(b) 70%至80%的选自纤维素酯和纤维素醚的聚合物,
其中该固体分散体表现出在80至100℃之间的玻璃化转变温度(T
在一些方面中,本公开提供一种非晶固体分散体,其包含,按重量相对于固体分散体的总重量计:
(a) 1%至50%的式(I)的化合物:
(b) 50%至99%的选自HPMCAS、CAP和SOLUPLUS的聚合物。
在一些方面中,本公开提供一种非晶固体分散体,其包含,按重量相对于固体分散体的总重量计:
(a) 10%至30%的式(I)的化合物:
(b) 70%至90%的HPMCAS,
其中该固体分散体包含少于2重量%的水。
在一些方面中,本公开提供一种非晶固体分散体,其包含,按重量相对于固体分散体的总重量计:
(a) 22.5%至27.5%的式(I)的化合物:
(b) 72.5%至77.5%的选自HPMCAS-L、HPMCAS-M和HPMCAS-H的聚合物,
其中式(I)的化合物的对映体过量为至少95%。
在一些实施方案中,本文提供了一种固体分散体,其包含大约25重量%的式(I)的化合物,分散在包含HPMCAS的固体基质中。在一些实施方案中,该固体分散体作为粉末提供。在一些实施方案中,该固体分散体作为颗粒提供。在一些实施方案中,该固体分散体作为膜提供。在一些实施方案中,该固体分散体在25℃和60% RH或40℃和75% RH下储存4周后保持非晶。在一些实施方案中,该固体分散体在2-8℃、25℃和60% RH、或40℃和75% RH下储存3个月后保持非晶。在一些实施方案中,该固体分散体中等吸湿。在一些实施方案中,该固体分散体表现出与纯的式(I)的化合物相比提高的式(I)的化合物在水性介质中的溶解度。在一些实施方案中,该水性介质是水、人工胃液(SGF)、人工肠液(FaSSIF)或5%甘油水溶液。
不希望受制于任何特定理论,本文提供的某些固体分散体表现出适用于临床和治疗剂型的物理性质,例如稳定性、溶解度和/或溶出度。在一些实施方案中,本文提供的某些固体分散体适用于口服给药的固体制剂。
式(I)的化合物的结晶形式至少在药物组合物的生产中有用。
一个实施方案提供式(I)的化合物的一种结晶形式:
其中所述结晶形式表现出图1的XRPD图谱。
一个实施方案提供式(I)的化合物的一种结晶形式:
其中所述结晶形式表现出大约209℃的Tm。
一个实施方案提供式(I)的化合物的一种结晶形式:
其中所述结晶形式表现出大约80℃的Tg。
一个实施方案提供式(I)的化合物的一种结晶形式:
其中所述结晶形式表现出具有选自7.6、15.0、19.6、22.9、25.8或30.2的至少一个2ɵ峰的XRPD图谱。
一个实施方案提供式(I)的化合物的一种结晶形式:
其中所述结晶形式表现出具有选自7.6、15.0、19.6、22.9、25.8或30.2的至少两个2ɵ峰的XRPD图谱。
一个实施方案提供式(I)的化合物的一种结晶形式:
其中所述结晶形式表现出具有选自7.6、15.0、19.6、22.9、25.8或30.2的至少三个2ɵ峰的XRPD图谱。
一个实施方案提供式(I)的化合物的一种结晶形式:
其中所述结晶形式表现出具有选自7.6、15.0、19.6、22.9、25.8或30.2的至少四个2ɵ峰的XRPD图谱。
一个实施方案提供式(I)的化合物的一种结晶形式:
其中所述结晶形式表现出具有选自7.6、15.0、19.6、22.9、25.8或30.2的至少五个2ɵ峰的XRPD图谱。
在一些方面中,本公开提供一种制备本文中公开的固体分散体的方法,其包括(a)提供式(I)的化合物和聚合物在溶剂中的溶液;和(b) 除去所述溶剂以提供固体分散体。该聚合物可选自本文所述的任何合适的聚合物,如HPMCAS。
在一些实施方案中,溶剂包含丙酮、甲乙酮、四氢呋喃、水或其组合。在一些实施方案中,溶剂包含丙酮。溶剂可包含最多5%水。在一些实施方案中,溶剂包含丙酮和最多5%水。在一些实施方案中,溶剂是按体积计95至99%丙酮和1至5%水。在一些实施方案中,溶剂是按体积计90至99%丙酮和1至10%水。
在一些实施方案中,通过冷冻蒸发或喷雾干燥除去溶剂。在一些实施方案中,通过熔融、溶剂蒸发、喷雾干燥、熔结、捏合、共研磨、冻干、热熔挤出、熔体附聚或超临界流体技术获得固体分散体。优选通过喷雾干燥除去溶剂。溶剂脱除可进一步包含在在盘式干燥机中干燥该固体分散体,以除去在喷雾干燥后剩余的残留溶剂。
在一些实施方案中,该溶液包含5重量%至20重量%固体,如8重量%至14重量%固体。在一些实施方案中,该溶液包含大约8重量%固体,如8 ± 2%固体。
在一些实施方案中,(a)的提供包括将式(I)的化合物添加到溶剂(例如丙酮)中并混合所得混合物直至式(I)的化合物完全溶解,或直至获得清澈溶液。(a)的提供可进一步包括将合适的聚合物(例如HPMCAS-H)添加到式(I)的化合物在丙酮中的溶液中,接着混合。在一些实施方案中,(b)的脱除包括喷雾干燥式(I)的化合物和聚合物在溶剂中的溶液。喷雾干燥可在任何合适的干燥器,如配有双流体喷嘴的SPX Anhydro MicraSpray MS-150喷雾干燥单元中完成。在一些实施方案中,在闭环配置中完成喷雾。喷雾干燥的雾化压力可在2.0至3.5巴,如2.5至2.8巴之间。在一些实施方案中,喷雾速率为5.0至20.0 kg/hr,如7.5至12.5 kg/hr。在一些实施方案中,提高入口温度,如在65至85℃之间。也可提高出口温度,如在40至45℃之间。在一些实施方案中,干燥气体流速在150至200 kg/hr之间。喷雾干燥单元的冷凝器温度通常低于冰点,如在-30至-10℃之间。
任选使用二次干燥以除去在喷雾干燥后剩余的残留溶剂。二次干燥可包括盘式干燥,如在Despatch盘式干燥机中。在一些实施方案中,将固体分散体加载到盘式干燥机的托盘中至约1英寸的深度。通常提高干燥机的温度,如30至50℃。在一些实施方案中,二次干燥具有1至24小时,如6至18小时、8至12小时、或大约10小时的持续时间。
任选使用二次回收以在喷雾干燥后从喷雾喷嘴、主室和出口回收残留固体分散体。在一些实施方案中,可收集来自喷雾喷嘴、主室和/或出口的残留固体分散体并添加到散装材料中。从喷雾干燥器的喷雾喷嘴、主室和出口的一处或多处收集的残留固体分散体添加到散装材料中可将固体分散体的总收率提高至少10%,如至少15%、至少20%、至少25%、至少30%、至少35%或至少40%。
在一些方面中,本公开提供一种制备本文中公开的固体分散体的方法,其包括(a)提供式(I)的化合物和HPMCAS在溶剂中的溶液,其中所述溶液包含6重量%至15重量%总固体;和(b) 除去所述溶剂以提供固体分散体。该聚合物可选自本文所述的任何合适的聚合物,如HPMCAS。
在一些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含:(a) 包含式(I)的化合物的固体分散体;和(b) 一种或多种可药用赋形剂。
该固体剂型可以是胶囊或片剂。在一些实施方案中,该固体剂型是片剂。在一些实施方案中,所述一种或多种可药用赋形剂包含粘合剂、填料、崩解剂和润滑剂。在一些实施方案中,所述一种或多种可药用赋形剂进一步包含助流剂和包衣。在一些实施方案中,所述一种或多种可药用赋形剂包含粘合剂、填料、崩解剂、润滑剂、助流剂和包衣。在一些实施方案中,固体分散体以固体剂型的15重量%至50重量%的量存在。
在一些实施方案中,固体分散体包含可药用聚合物,如HPMCAS。在一些实施方案中,该聚合物以固体剂型的15重量%至35重量%的量存在。在一些实施方案中,式(I)的化合物以固体剂型的1重量%至15重量%的量存在。在一些实施方案中,该固体剂型包含5 mg至100 mg的式(I)的化合物,如10 mg或40 mg的式(I)的化合物。
在一些实施方案中,该固体剂型包含固体剂型的20重量%至50重量%的量的粘合剂。粘合剂可以是微晶纤维素。在一些实施方案中,该固体剂型包含固体剂型的20重量%至40重量%的量的填料。填料可以是甘露糖醇。在一些实施方案中,该固体剂型包含颗粒内填料和颗粒外填料,任选其中颗粒内填料以固体剂型的12重量%至22重量%的量存在,且颗粒外填料以固体剂型的8重量%至18重量%的量存在。
在一些实施方案中,该固体剂型包含固体剂型的1.0重量%至5.0重量%的量的崩解剂。该固体剂型可包含颗粒内崩解剂和颗粒外崩解剂,任选其中颗粒内崩解剂以固体剂型的0.9重量%至3.0重量%的量存在,且颗粒外崩解剂以固体剂型的0.1重量%至2.0重量%的量存在。在一些实施方案中,崩解剂是交联羧甲基纤维素钠。
在一些实施方案中,该固体剂型包含固体剂型的0.25重量%至1.25重量%的量的润滑剂。该固体剂型可包含颗粒内润滑剂和颗粒外润滑剂,任选其中颗粒内润滑剂以固体剂型的0.15重量%至0.75重量%的量存在,且颗粒外润滑剂以固体剂型的0.10重量%至0.50重量%的量存在。在一些实施方案中,润滑剂是硬脂酸镁。
在一些实施方案中,该固体剂型包含固体剂型的0.1重量%至1.25重量%的量的助流剂。该固体剂型可包含颗粒内助流剂和颗粒外助流剂,任选其中颗粒内助流剂以固体剂型的0.05重量%至0.75重量%的量存在,且颗粒外助流剂以固体剂型的0.05重量%至0.50重量%的量存在。在一些实施方案中,该固体剂型包含固体剂型的0.2重量%至0.5重量%的量的颗粒外助流剂。在一些实施方案中,助流剂是胶体二氧化硅,如Cab-O-Sil。
在一些实施方案中,该固体剂型包含包衣。在一些实施方案中,包衣基于PVA,如OpaDry II。在一些实施方案中,包衣含颜料,任选其中包衣是蓝色的。该固体剂型可包含固体剂型的1重量%至5重量%的量的包衣,如大约3重量%。
在一些实施方案中,该固体剂型的硬度在5至25 KP之间。该固体剂型的重量可在50至750 mg之间,如大约125 mg或大约500 mg。在一些实施方案中,该固体剂型包含少于2重量%的杂质。
在一些实施方案中,该固体剂型包含少于3重量%的水。在一些实施方案中,该固体剂型在室温下储存6个月后包含少于3重量%的水。在一些实施方案中,该固体剂型以1至5分钟之间的崩解时间为特征。
在一些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含:(a) 包含式(I)的化合物和选自HPMCAS、CAP和SOLUPLUS的聚合物的固体分散体;和(b) 一种或多种可药用赋形剂。
在一些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含:(a) 包含5至100 mg式(I)的化合物的固体分散体;和(b)一种或多种可药用赋形剂。
在一些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含,按重量相对于药物组合物的总重量计:
(a) 15%至50%的包含式(I)的化合物的固体分散体;
(b) 20%至50%的粘合剂;
(c) 20%至40%的填料;
(d) 1.0%至5.0%的崩解剂;和
(e) 0.25%至1.25%的润滑剂。
在一些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含,按重量相对于药物组合物的总重量计:
(a) 15%至50%的包含式(I)的化合物和HMPCAS的固体分散体;
(b) 20%至50%的微晶纤维素;
(c) 20%至40%的甘露糖醇;
(d) 1.0%至5.0%的交联羧甲基纤维素钠;和
(e) 0.25%至1.25%的硬脂酸镁。
在一些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含,按重量相对于药物组合物的总重量计:
(a) 15%至50%的包含式(I)的化合物的固体分散体;
(b) 20%至50%的粘合剂;
(c) 20%至40%的填料;
(d) 1.0%至5.0%的崩解剂;
(e) 0.25%至1.25%的润滑剂;
(f) 0.1%至1.25%的助流剂;和
(g) 1%至5%的包衣。
在一些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含,按重量相对于药物组合物的总重量计:
(a) 15%至50%的包含式(I)的化合物和HMPCAS的固体分散体;
(b) 20%至50%的微晶纤维素;
(c) 20%至40%的甘露糖醇;
(d) 1.0%至5.0%的交联羧甲基纤维素钠;
(e) 0.25%至1.25%的硬脂酸镁;
(f) 0.1%至1.25%的胶体二氧化硅;和
(g) 任选地,基于PVA的包衣。
在一些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含:(a) 包含式(I)的化合物的固体分散体;和(b) 一种或多种可药用赋形剂,其中所述固体剂型的重量在50至750 mg之间。
在一些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含:(a) 包含式(I)的化合物的固体分散体;(b) 一种或多种可药用赋形剂;和(c) 少于2重量%的杂质。
在一些方面中,本公开提供一种用于式(I)的化合物的口服递送的药物固体剂型,
其中所述固体剂型包含:(a) 包含式(I)的化合物的固体分散体;(b) 一种或多种可药用赋形剂;和(c) 在室温下储存6个月后少于3重量%的水。
本公开的化合物或固体分散体可配制在任何合适的药物制剂中。本公开的药物组合物通常含有活性成分(例如式(I)的化合物)和一种或多种可药用赋形剂和/或载体,包括但不限于,惰性固体稀释剂和填料、粘合剂、稀释剂、崩解剂、润滑剂、助流剂、包衣、无菌水溶液和各种有机溶剂、渗透促进剂、增溶剂和辅助剂。本公开的化合物或固体分散体可配制在任何合适的药物制剂中。在一些实施方案中,可药用赋形剂选自微晶纤维素、甘露糖醇、交联羧甲基纤维素钠和硬脂酸镁。在一些实施方案中,可药用赋形剂选自微晶纤维素、甘露糖醇、交联羧甲基纤维素钠、硬脂酸镁和Cab-O-Sil。在一些实施方案中,本公开提供一种药物组合物,其包含式(I)的化合物和选自微晶纤维素、甘露糖醇、交联羧甲基纤维素钠和硬脂酸镁的可药用赋形剂。在一些实施方案中,本公开提供一种药物组合物,其包含式(I)的化合物和选自微晶纤维素、甘露糖醇、交联羧甲基纤维素钠、硬脂酸镁和胶体二氧化硅的可药用赋形剂。在一些实施方案中,本公开提供一种药物组合物,其包含式(I)的化合物、微晶纤维素、甘露糖醇、交联羧甲基纤维素钠和硬脂酸镁。在一些实施方案中,本公开提供一种药物组合物,其包含式(I)的化合物、微晶纤维素、甘露糖醇、交联羧甲基纤维素钠、硬脂酸镁、Cab-O-Sil和基于PVA的包衣。
药物制剂可以任何合适的形式提供,这可取决于给药途径。在一些实施方案中,本文中公开的药物组合物可配制在给药于对象的剂型中。在一些实施方案中,该药物组合物配制为口服、静脉内、动脉内、气溶胶、肠胃外、经颊、局部、透皮、直肠、肌内、皮下、骨内、鼻内、肺内、经粘膜、吸入和/或腹膜内给药。在一些实施方案中,该剂型配制为口服给药。例如,该药物组合物可配制为丸剂、片剂、胶囊、吸入剂、液体混悬剂、液体乳剂、凝胶或粉剂的形式。优选地,该药物组合物配制为丸剂、片剂或胶囊的形式。在一些实施方案中,该药物组合物可以液体、凝胶、半液体、半固体、泡沫或固体形式配制为单位剂型。
所给药的各化合物的量取决于治疗的哺乳动物、障碍或病况的严重程度、给药速率、化合物的处置(disposition)和处方医师的判断。但是,有效剂量可在大约0.001 mg/kg至大约100 mg/kg体重/天的范围内,以单剂量或分剂量。在一些实施方案中,剂量在大约0.1 mg/kg至大约1.0 mg//kg体重/剂的范围内。在一些情况下,低于上述范围的下限的剂量水平可能绰绰有余,而在另一些情况下,可能使用还更大的剂量而不造成任何有害副作用,例如通过将这样的更大剂量分成几个小剂量以全天给药。
在一些实施方案中,本公开提供一种药物组合物,其包含配制为给药于需要其的对象的量的式(I)的化合物。在一些实施方案中,该药物组合物包含大约0.1-1000 mg的式(I)的化合物,如0.1-500 mg、1-250 mg、5-125 mg、5-100 mg、5-75 mg或5-50 mg的式(I)的化合物。在一些实施方案中,该药物组合物包含大约或大于大约1 mg、2 mg、3 mg、4 mg、5mg、6 mg、7 mg、8 mg、9 mg、10 mg、15 mg、20 mg、25 mg、30 mg、35 mg、40 mg、45 mg、50 mg、55 mg、60 mg、65 mg、70 mg、75 mg、80 mg、85 mg、90 mg、95 mg或100 mg的式(I)的化合物。在一些实施方案中,该药物组合物包含在单剂量中1-100 mg的式(I)的化合物,如5-50 mg的式(I)的化合物。在一些实施方案中,该药物组合物包含大约10 mg的式(I)的化合物。在一些实施方案中,该药物组合物包含大约40 mg的式(I)的化合物。
在一些实施方案中,式(I)的化合物的治疗有效量——其可以是在治疗期间给药的每日量——可充分提供任何一种或多种本文所述的治疗效果。作为一个实例,治疗有效量可在大约0.001-100 mg/kg体重、0.001-50 mg/kg体重、0.01-50 mg/kg体重、0.01-25mg/kg体重、0.01-10 mg/kg体重、0.01-5 mg/kg体重、0.01-4 mg/kg体重、0.01-3 mg/kg体重、0.01-2 mg/kg体重、0.01-1 mg/kg体重、0.01-0.75 mg/kg体重、0.1-5 mg/kg体重、0.1-4 mg/kg体重、0.1-3 mg/kg体重、0.1-2 mg/kg体重、0.1-1 mg/kg体重或0.1-0.75 mg/kg体重的式(I)的化合物的范围内。在一些实施方案中,治疗量可为大约或大于大约0.001 mg/kg体重、0.01 mg/kg体重、0.1 mg/kg体重、0.2 mg/kg体重、0.3 mg/kg体重、0.4 mg/kg体重、0.5 mg/kg体重、0.6 mg/kg体重、0.7 mg/kg体重、0.8 mg/kg体重、0.9 mg/kg体重、1mg/kg体重、1.5 mg/kg体重、2 mg/kg体重、3 mg/kg体重、4 mg/kg体重、5 mg/kg体重、6 mg/kg体重、7 mg/kg体重、8 mg/kg体重、9 mg/kg体重或10 mg/kg体重的式(I)的化合物。在一些实施方案中,有效量为至少大约0.01 mg/kg体重的式(I)的化合物。在一些实施方案中,有效量为大约0.01-10 mg/kg体重的式(I)的化合物的量。
在一些实施方案中,该组合物在一个或多个单位剂量中提供。例如,该组合物可在1、2、3、4、5、6、7、14、30、60或更多个剂量中给药。这样的量可每日给药,例如在每日一次、两次或三次或更多次给药的各个剂量中。但是,本文以每日为基础指定的剂量不应被解释为要求每一天都给药所述日剂量。例如,如果药剂之一以合适的缓释形式提供,则可以以较低频率给药两个或更多个日剂量,例如作为每隔一天至每月一次或甚至更久一次的储库制剂(depot)。对对象而言最通常和方便地,式(I)的化合物抑制剂可每天一次给药,例如在早上、在晚上或在日间。
单位剂量可同时或依序给药。该组合物可在长治疗期给药。例如,治疗期可为至少大约1个月,例如至少大约3个月、至少大约6个月或至少大约1年。在一些情况下,给药可持续对象的基本余生。
用于口服给药的药物组合物:在一些实施方案中,本公开提供用于口服给药的药物组合物,其含有至少一种本公开的化合物和适用于口服给药的药用赋形剂。该组合物可为固体、液体、凝胶、半液体或半固体的形式。在一些实施方案中,该组合物为固体形式。在一些实施方案中,该组合物进一步包含第二药剂。
在一些实施方案中,本发明提供用于口服给药的固体药物组合物,其含有:(i) 式(I)的化合物;和(ii) 适用于口服给药的药用赋形剂。在一些实施方案中,该组合物进一步含有:(iii) 第三药剂或甚至第四药剂。在一些实施方案中,各化合物或药剂以治疗有效量存在。在另一些实施方案中,一种或多种化合物或药剂以亚治疗量存在,且化合物或药剂协同作用以提供治疗有效的药物组合物。
适合口服给药的本公开的药物组合物可呈现为离散剂型,如硬或软胶囊、扁囊剂、锭剂、糖锭或片剂,或各自含有预定量的粉末或颗粒形式的活性成分的液体或气溶胶喷雾剂、在水性或非水液体中的溶液剂或混悬剂、水包油乳剂或油包水液体乳剂、或分散性粉剂或颗粒剂、或糖浆或酏剂。优选地,用于口服给药的药物组合物作为片剂提供。这样的剂型可通过药剂学的任何方法制备,通常包括使活性成分与赋形剂结合的步骤。一般而言,通过将活性成分与液体赋形剂或细碎固体赋形剂或两者均匀和密切地混合,然后如果必要,将产物成型为所需形式来制备该组合物。例如,可通过任选与一种或多种可药用赋形剂一起压缩或模制来制备片剂。通过在合适的机器中压缩任选与赋形剂,例如但不限于,粘合剂、填料、崩解剂、助流剂和/或润滑剂混合的自由流动形式如粉末或颗粒形式的活性成分,可制备压缩片剂。通过在合适的机器中模制用惰性液体稀释剂润湿的粉状化合物的混合物,可制备模制片剂。
本公开进一步包括包含活性成分的无水药物组合物和剂型,因为水可促进一些化合物的降解。例如,水可作为模拟长期储存的手段添加(例如大约5%)以测定制剂随时间经过的特性,如贮存寿命或稳定性。可以使用无水或低含湿成分和低水分或低湿度条件制备本公开的无水药物组合物和剂型。如果预计在生产、包装和/或储存过程中会与水分和/或湿气实质接触,可将含乳糖的本公开的药物组合物和剂型制成无水。可以制备并储存无水药物组合物以保持其无水性质。相应地,可使用已知防止暴露于水的材料包装无水组合物以使它们可包括在合适的药盒(formulary kits)中。合适的包装的实例包括,但不限于,低湿气渗透容器、气密密封箔、塑料等、单位剂量容器、泡罩包装和条状包装(strip packs)。
活性成分可根据制药配混技术与药用赋形剂以密切混合物形式合并。根据给药所需的制剂形式,赋形剂可呈现多种多样的形式。在制备口服剂型的组合物时,可使用任何合适的药用介质作为赋形剂,例如,在口服液体制剂(如混悬剂、溶液剂和酏剂)或气雾剂的情况下,水、二醇、油、醇、调味剂、防腐剂、着色剂等;或在口服固体制剂的情况下可使用如淀粉、糖、微晶纤维素、稀释剂、制粒剂、润滑剂、助流剂、粘合剂和崩解剂之类的赋形剂,在一些实施方案中不使用乳糖。如果需要,片剂可通过标准的水性或非水技术包衣。
适用于本药物组合物和剂型的粘合剂包括,但不限于,玉米淀粉、马铃薯淀粉或其它淀粉、明胶、天然和合成树胶如阿拉伯树胶、藻酸钠、藻酸、其它藻酸盐、粉状黄蓍胶、瓜尔胶、纤维素及其衍生物(例如乙基纤维素、乙酸纤维素、羧甲基纤维素钙、羧甲基纤维素钠)、聚乙烯基吡咯烷酮、甲基纤维素、预糊化淀粉、羟丙基甲基纤维素、微晶纤维素及其混合物。在一些实施方案中,粘合剂是微晶纤维素。在一些实施方案中,微晶纤维素选自微晶纤维素PH101、微晶纤维素PH105、微晶纤维素PH112、微晶纤维素PH113、 微晶纤维素PH200、微晶纤维素PH301和微晶纤维素PH302。在一些实施方案中,粘合剂是微晶纤维素PH101或微晶纤维素PH105。在一些实施方案中,粘合剂是微晶纤维素PH101。在一些实施方案中,粘合剂是微晶纤维素PH105。在一些实施方案中,粘合剂以至少0.5 mg、至少1 mg、至少5 mg、至少10mg、至少20mg、至少30 mg、至少50 mg、至少100 mg、至少150 mg、至少200 mg、至少300mg或至少500 mg的量存在。
用于本文中公开的药物组合物和剂型的合适填料的实例包括,但不限于,滑石、碳酸钙(例如颗粒或粉末)、微晶纤维素、粉状纤维素、葡萄糖结合剂(dextrates)、高岭土、甘露糖醇、硅酸、山梨糖醇、淀粉、预糊化淀粉及其混合物。在一些实施方案中,填料是甘露糖醇。在一些实施方案中,甘露糖醇选自甘露糖醇M100、甘露糖醇M200和甘露糖醇M300。在一些实施方案中,填料是甘露糖醇M100。在一些实施方案中,填料以至少0.5 mg、至少1 mg、至少5 mg、至少10 mg、至少20mg、至少30 mg、至少50 mg、至少100 mg、至少150 mg、至少200mg、至少300mg或至少500 mg的量存在。
在本公开的组合物中可使用崩解剂以提供在暴露于水性环境时崩解的片剂。太多崩解剂可能制成在瓶中崩解的片剂。太少的崩解剂可能不足以造成崩解并可能改变从剂型中释放活性成分的速率和程度。不会太少又不会太多到有害地改变活性成分释放的足量崩解剂可用于形成本文中公开的化合物的剂型。所用崩解剂的量可基于制剂的类型和给药模式而变。在药物组合物中可使用大约0.5至大约15重量%的崩解剂,如大约1.0至大约5.0重量%的崩解剂。可用于形成本公开的药物组合物和剂型的崩解剂包括,但不限于,琼脂、藻酸、碳酸钙、微晶纤维素、交联羧甲基纤维素钠、交聚维酮、波拉克林钾、羟乙酸淀粉钠、马铃薯或木薯淀粉、其它淀粉、预糊化淀粉、其它淀粉、粘土、其它藻胶、其它纤维素、树胶或其混合物。在一些实施方案中,崩解剂是交联羧甲基纤维素钠。
可用于形成本公开的药物组合物和剂型的润滑剂包括,但不限于,硬脂酸钙、硬脂酸镁、矿物油、轻质矿物油、甘油、山梨糖醇、甘露糖醇、聚乙二醇、其它二醇、硬脂酸、十二烷基硫酸钠、滑石、氢化植物油(例如花生油、棉籽油、葵花油、芝麻油、橄榄油、玉米油和大豆油)、硬脂酸锌、油酸乙酯、ethylaureate、琼脂或其混合物。另外的润滑剂包括例如syloid硅胶、合成二氧化硅的凝聚型气溶胶(coagulated aerosol)或其混合物。润滑剂可任选以小于药物组合物的大约1重量%的量添加。在一些实施方案中,润滑剂是硬脂酸镁。在一些实施方案中,润滑剂以至少0.1 mg、至少0.2 mg、至少0.3 mg、至少0.4 mg、至少0.5 mg、至少0.6 mg、至少0.7 mg、至少0.8 mg、至少0.9 mg、至少1 mg或至少5 mg的量存在。
可用于形成本公开的药物组合物和剂型的助流剂包括,但不限于,胶体二氧化硅、CAB-O-SIL®(Boston, MA的Cabot Co. )、无石棉的滑石、硬脂酸镁、淀粉和滑石。在一些实施方案中,助流剂以至少0.1 mg、至少0.2 mg、至少0.3 mg、至少0.4 mg、至少0.5 mg、至少0.6 mg、至少0.7 mg、至少0.8 mg、至少0.9 mg、至少1 mg、至少1.1 mg、至少1.2 mg、至少1.3 mg、至少1.4 mg、至少1.5 mg、至少2 mg、至少3 mg、至少4 mg或至少5 mg的量存在。
当口服给药需要水性混悬剂和/或酏剂时,可将其中的活性成分与各种甜味剂或调味剂、着色剂或染料和如果需要,乳化剂和/或悬浮剂以及稀释剂,如水、乙醇、丙二醇、甘油和它们的各种组合合并。
片剂可以是未包衣的或通过已知技术包衣以延迟在胃肠道中的崩解和吸收并由此提供更长时间的持续作用。例如,可使用延时材料,如单硬脂酸甘油酯或二硬脂酸甘油酯。包衣可进一步防止或减慢吸湿。口服使用的制剂也可呈现为硬明胶胶囊,其中将活性成分与惰性固体稀释剂,例如碳酸钙、磷酸钙或高岭土混合,或呈现为软明胶胶囊,其中将活性成分与水或油介质,例如花生油、液体石蜡或橄榄油混合。肠溶衣包括,但不限于,CAP、丙烯酸酯聚合物、HPMCP、HPMC、PVAP、PVA、脂肪酸、脂肪、水杨酸苯酯、蜡、虫胶、氨化虫胶和邻苯二甲酸乙酸纤维素。非肠溶衣包括,但不限于,HPMC、甲基羟乙基纤维素(MHEC)、EC、HPC、聚维酮、羧甲基纤维素钠(SCMC)、PEG和丙烯酸酯聚合物。糖衣片剂是被糖衣包裹的压缩片剂,其有益于遮盖令人不快的味道或气味和防止片剂氧化。薄膜包衣片剂是被水溶性材料的薄层或膜覆盖的压缩片剂。薄膜包衣包括,但不限于,羟乙基纤维素、羧甲基纤维素钠、聚乙二醇4000和邻苯二甲酸乙酸纤维素。薄膜包衣提供与糖衣相同的一般特性。在一些实施方案中,包衣基于PVA,如OpaDry II。在一些实施方案中,包衣含颜料。例如,包衣可包含蓝色、绿色、红色、紫色、橙色、银色和/或黄色颜料。在一些实施方案中,包衣是OpaDry II,如OpaDry II Blue。在一些实施方案中,包衣以至少0.5 mg、至少1 mg、至少2.5 mg、至少5mg、至少7.5 mg、至少10 mg、至少12.5 mg、至少15 mg、至少17.5 mg、至少20 mg、至少25或至少30 mg的量存在。
可用于形成本公开的药物组合物和剂型的表面活性剂包括,但不限于,亲水表面活性剂、亲脂表面活性剂及其混合物。也就是说,可以使用亲水表面活性剂的混合物,可以使用亲脂表面活性剂的混合物,或可以使用至少一种亲水表面活性剂和至少一种亲脂表面活性剂的混合物。
合适的亲水表面活性剂通常可具有至少10的HLB值,而合适的亲脂表面活性剂通常可具有小于大约10的HLB值。用于表征非离子两亲化合物的相对亲水性和疏水性的经验参数是亲水-亲脂平衡(“HLB”值)。具有较低HLB值的表面活性剂更亲脂或疏水并具有更高油溶性,而具有较高HLB值的表面活性剂更亲水并具有在水溶液中的更高可溶性。亲水表面活性剂通常被认为是具有大于大约10的HLB值的那些化合物,以及HLB标度通常不适用的阴离子、阳离子或两性离子化合物。类似地,亲脂(即疏水)表面活性剂是具有等于或小于大约10的HLB值的化合物。但是,表面活性剂的HLB值仅是常用于允许配制工业、药物和化妆品乳剂的粗略指导。
亲水表面活性剂可以是离子型或非离子型的。合适的离子型表面活性剂包括,但不限于,烷基铵盐;梭链孢酸盐;氨基酸、寡肽和多肽的脂肪酸衍生物;氨基酸、寡肽和多肽的甘油酯衍生物;卵磷脂和氢化卵磷脂;溶血卵磷脂和氢化溶血卵磷脂;磷脂及其衍生物;溶血磷脂及其衍生物;肉碱脂肪酸酯盐;烷基硫酸酯的盐;脂肪酸盐;多库酯钠;酰基乳酰乳酸盐(acylactylates);单-和二-甘油酯的单-和二-乙酰化酒石酸酯;琥珀酰化单-和二-甘油酯;单-和二-甘油酯的柠檬酸酯;和它们的混合物。
在上述类别内,离子型表面活性剂包括例如:卵磷脂、溶血卵磷脂、磷脂、溶血磷脂及其衍生物;肉碱脂肪酸酯盐;烷基硫酸酯的盐;脂肪酸盐;多库酯钠;酰基乳酰乳酸盐(acylactylates);单-和二-甘油酯的单-和二-乙酰化酒石酸酯;琥珀酰化单-和二-甘油酯;单-和二-甘油酯的柠檬酸酯;和它们的混合物。
离子型表面活性剂可以是卵磷脂、溶血卵磷脂、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰甘油、磷脂酸、磷脂酰丝氨酸、溶血磷脂酰胆碱、溶血磷脂酰乙醇胺、溶血磷脂酰甘油、溶血磷脂酸、溶血磷脂酰丝氨酸、PEG-磷脂酰乙醇胺、PVP-磷脂酰乙醇胺、脂肪酸的乳酰乳酸酯、硬脂酰-2-乳酰乳酸盐(lactylate)、硬脂酰乳酰乳酸盐(stearoyl lactylate)、琥珀酰化单甘油酯、单/二甘油酯的单/二乙酰化酒石酸酯、单/二甘油酯的柠檬酸酯、cholylsarcosine、己酸盐、辛酸盐、癸酸盐、月桂酸盐、肉豆蔻酸盐、棕榈酸盐、油酸盐、蓖麻油酸盐、亚油酸盐、亚麻酸盐、硬脂酸盐、十二烷基硫酸盐、teracecyl sulfate、多库酯(docusate)、月桂酰肉碱、棕榈酰肉碱、肉豆蔻酰肉碱和它们的盐和混合物的离子化形式。
亲水非离子型表面活性剂可包括,但不限于,烷基葡糖苷;烷基麦芽糖苷;烷基葡糖硫苷;十二烷基聚乙二醇甘油酯;聚氧化烯烷基醚,如聚乙二醇烷基醚;聚氧化烯烷基酚,如聚乙二醇烷基酚;聚氧化烯烷基酚脂肪酸酯,如聚乙二醇脂肪酸单酯和聚乙二醇脂肪酸二酯;聚乙二醇甘油脂肪酸酯;聚甘油脂肪酸酯;聚氧化烯山梨糖醇酐脂肪酸酯,如聚乙二醇山梨糖醇酐脂肪酸酯;多元醇与甘油酯、植物油、氢化植物油、脂肪酸和甾醇类的至少一员的亲水酯交换产物;聚氧乙烯甾醇类、其衍生物和类似物;聚氧乙烯化维生素及其衍生物;聚氧乙烯-聚氧丙烯嵌段共聚物;和它们的混合物;聚乙二醇山梨糖醇酐脂肪酸酯,和多元醇与甘油三酯、植物油和氢化植物油的至少一员的亲水酯交换产物。该多元醇可以是甘油、乙二醇、聚乙二醇、山梨糖醇、丙二醇、季戊四醇或糖。
其它亲水非离子型表面活性剂包括,但不限于,PEG-10月桂酸酯、PEG-12月桂酸酯、PEG-20月桂酸酯、PEG-32月桂酸酯、PEG-32二月桂酸酯、PEG-12油酸酯、PEG-15油酸酯、PEG-20油酸酯、PEG-20二油酸酯、PEG-32油酸酯、PEG-200油酸酯、PEG-400油酸酯、PEG-15硬脂酸酯、PEG-32二硬脂酸酯、PEG-40硬脂酸酯、PEG-100硬脂酸酯、PEG-20二月桂酸酯、PEG-25甘油三油酸酯、PEG-32二油酸酯、PEG-20甘油月桂酸酯、PEG-30甘油月桂酸酯、PEG-20甘油硬脂酸酯、PEG-20甘油油酸酯、PEG-30甘油油酸酯、PEG-30甘油月桂酸酯、PEG-40甘油月桂酸酯、PEG-40棕榈仁油、PEG-50氢化蓖麻油、PEG-40蓖麻油、PEG-35蓖麻油、PEG-60蓖麻油、PEG-40氢化蓖麻油、PEG-60氢化蓖麻油、PEG-60玉米油、PEG-6癸酸酯/辛酸酯甘油酯、PEG-8癸酸酯/辛酸酯甘油酯、聚甘油-10月桂酸酯、PEG-30胆固醇、PEG-25植物甾醇、PEG-30大豆甾醇、PEG-20三油酸酯、PEG-40山梨糖醇酐油酸酯、PEG-80山梨糖醇酐月桂酸酯、聚山梨酯20、聚山梨酯80、POE-9月桂醚、POE-23月桂醚、POE-10油醚、POE-20油醚、POE-20硬脂醚、生育酚PEG-100琥珀酸酯、PEG-24胆固醇、聚甘油-10油酸酯、Tween 40、Tween 60、蔗糖单硬脂酸酯、蔗糖单月桂酸酯、蔗糖单棕榈酸酯、PEG 10-100壬基酚系列、PEG 15-100辛基酚系列和泊洛沙姆。
合适的亲脂表面活性剂包括,仅作为示例:脂肪醇;甘油脂肪酸酯;乙酰化甘油脂肪酸酯;低级醇脂肪酸酯;丙二醇脂肪酸酯;山梨糖醇酐脂肪酸酯;聚乙二醇山梨糖醇酐脂肪酸酯;甾醇类和甾醇衍生物;聚氧乙烯化甾醇类和甾醇衍生物;聚乙二醇烷基醚;糖酯;糖醚;单-和二-甘油酯的乳酸衍生物;多元醇与甘油酯、植物油、氢化植物油、脂肪酸和甾醇类的至少一员的疏水酯交换产物;油溶性维生素/维生素衍生物;和它们的混合物。在这一类内,优选的亲脂表面活性剂包括甘油脂肪酸酯、丙二醇脂肪酸酯及其混合物,或是多元醇与植物油、氢化植物油和甘油三酯的至少一员的疏水酯交换产物。
在一个实施方案中,该组合物可包括增溶剂以确保本公开的化合物的良好溶解和/或溶出并将本公开的化合物的沉淀降至最低。这对非口服使用的组合物,例如注射用的组合物尤其重要。也可加入增溶剂以提高亲水药物和/或其它组分如表面活性剂的溶解度,或使该组合物保持为稳定或均匀的溶液或分散体。
合适的增溶剂的实例包括,但不限于,下列:醇和多元醇,如乙醇、异丙醇、丁醇、苄醇、乙二醇、丙二醇、丁二醇及其异构体、甘油、季戊四醇、山梨糖醇、甘露糖醇、二乙二醇单乙醚(transcutol)、异山梨醇二甲基醚(dimethyl isosorbide)、聚乙二醇、聚丙二醇、聚乙烯醇、羟丙基甲基纤维素和其它纤维素衍生物、环糊精和环糊精衍生物;具有大约200至大约6000的平均分子量的聚乙二醇的醚,如四氢糠醇PEG醚(glycofurol)或甲氧基PEG;酰胺和其它含氮化合物,如2-吡咯烷酮、2-哌啶酮、ε-己内酰胺、N-烷基吡咯烷酮、N-羟烷基吡咯烷酮、N-烷基哌啶酮、N-烷基己内酰胺、二甲基乙酰胺和聚乙烯基吡咯烷酮;酯,如丙酸乙酯、柠檬酸三丁酯、乙酰柠檬酸三乙酯、乙酰柠檬酸三丁酯、柠檬酸三乙酯、油酸乙酯、辛酸乙酯、丁酸乙酯、三醋精、单乙酸丙二醇酯、二乙酸丙二醇酯、ε-己内酯及其异构体、δ-戊内酯及其异构体、β-丁内酯及其异构体;和本领域中已知的其它增溶剂,如二甲基乙酰胺、异山梨醇二甲基醚、N-甲基吡咯烷酮、单辛精、二乙二醇单乙醚和水。
也可使用增溶剂的混合物。实例包括,但不限于,三醋精、柠檬酸三乙酯、油酸乙酯、辛酸乙酯、二甲基乙酰胺、N-甲基吡咯烷酮、N-羟乙基吡咯烷酮、聚乙烯基吡咯烷酮、羟丙基甲基纤维素、羟丙基环糊精、乙醇、聚乙二醇200-100、四氢呋喃聚乙二醇醚(glycofurol)、二乙二醇单乙醚、丙二醇和异山梨醇二甲基醚。特别优选的增溶剂包括山梨糖醇、甘油、三醋精、乙醇、PEG-400、四氢呋喃聚乙二醇醚和丙二醇。
可包括的增溶剂的量不受特别限制。给定增溶剂的量可限于本领域技术人员容易确定的生物可接受量。在一些情况下,可有利地包括远超过生物可接受量的量的增溶剂,例如以使药物浓度最大化,在向患者提供该组合物前使用常规技术如蒸馏或蒸发除去过量增溶剂。如果存在,增溶剂可为药物和其它赋形剂的总重量的按重量计10%、25%、50%、100%或最多大约200%的重量比。如果需要,也可使用极少量的增溶剂,如5%、2%、1%或甚至更少。通常,增溶剂可以以按重量计大约1%至大约100%,更通常大约5%至大约25%的量存在。
该组合物可进一步包括一种或多种可药用添加剂和赋形剂。这样的添加剂和赋形剂包括但不限于脱粘剂(detackifiers)、防沫剂、缓冲剂、聚合物、抗氧化剂、防腐剂、螯合剂、粘度调节剂、张力调节剂、香料、着色剂、添味剂、乳浊剂、悬浮剂、粘合剂、填料、增塑剂、润滑剂及其混合物。
此外,为了利于加工、增强稳定性或出于其它原因,可将酸或碱并入该组合物中。可药用碱的实例包括氨基酸、氨基酸酯、氢氧化铵、氢氧化钾、氢氧化钠、碳酸氢钠、氢氧化铝、碳酸钙、氢氧化镁、硅酸镁铝、合成硅酸铝、合成hydrocalcite、氢氧化镁铝、二异丙基乙基胺、乙醇胺、乙二胺、三乙醇胺、三乙胺、三异丙醇胺、三甲胺、三(羟甲基)-氨基甲烷(TRIS)等。可药用酸,如乙酸、丙烯酸、己二酸、藻酸、链烷磺酸、氨基酸、抗坏血酸、苯甲酸、硼酸、丁酸、碳酸、柠檬酸、脂肪酸、甲酸、富马酸、葡糖酸、氢醌磺酸(hydroquinosulfonicacid)、异抗坏血酸、乳酸、马来酸、草酸、对溴苯基磺酸、丙酸、对甲苯磺酸、水杨酸、硬脂酸、琥珀酸、鞣酸、酒石酸、巯基乙酸、甲苯磺酸、尿酸等的盐形式的碱也合适。也可使用多元酸的盐,如磷酸钠、磷酸氢二钠和磷酸二氢钠。当该碱是盐时,阳离子可以是任何方便的和可药用的阳离子,如铵、碱金属、碱土金属等。实例可包括但不限于钠、钾、锂、镁、钙和铵。
合适的酸是可药用的有机或无机酸。合适的无机酸的实例包括盐酸、氢溴酸、氢碘酸、硫酸、硝酸、硼酸、磷酸等。合适的有机酸的实例包括乙酸、丙烯酸、己二酸、藻酸、链烷磺酸、氨基酸、抗坏血酸、苯甲酸、硼酸、丁酸、碳酸、柠檬酸、脂肪酸、甲酸、富马酸、葡糖酸、氢醌磺酸、异抗坏血酸、乳酸、马来酸、甲磺酸、草酸、对溴苯基磺酸、丙酸、对甲苯磺酸、水杨酸、硬脂酸、琥珀酸、鞣酸、酒石酸、巯基乙酸、甲苯磺酸、尿酸等。
当本公开的方法涉及联合疗法时,例如其中第二药剂与式(I)的化合物联合给药,这些药剂可分开、同时或在一天中的不同时间给药,或它们可在单一组合物中给药。在本公开的联合疗法中,各药剂可以以“速释”方式或以“控释方式”给药。当另外的活性剂是皮质类固醇时,例如,含有这两种活性剂如式(I)的化合物和皮质类固醇的任何剂型可提供皮质类固醇的速释或控释,和式(I)的化合物的速释或控释。在本公开的另一些制剂中,可属于或不属于相同药物类别的两种或更多种另外的活性剂可与式(I)的化合物一起存在。在这样的情况下,与仅使用单一添加的药剂时需要的量相比,存在的任一或各个另外的活性剂的有效量通常降低。
在一些实施方案中,本文中提供的固体分散体、固体剂型或药物组合物,或包含本文中提供的固体分散体、固体剂型或药物组合物的组合物口服、肠胃外、局部或粘膜给药。在一些实施方案中,本文中提供的固体分散体、固体剂型或药物组合物,或包含本文中提供的固体分散体、固体剂型或药物组合物的组合物口服给药。
在一些实施方案中,本文中提供的固体分散体、固体剂型或药物组合物,或包含本文中提供的固体分散体、固体剂型或药物组合物的组合物以每日一次、两次、三次或四次的给药频率给药。在一些实施方案中,本文中提供的固体分散体、固体剂型或药物组合物,或包含本文中提供的固体分散体、固体剂型或药物组合物的组合物包含大约0.1至大约100mg、大约0.5至大约75 mg、大约5至大约50 mg、大约5 mg至大约45 mg、大约5至大约15 mg、或大约35至大约45 mg的量的式(I)的化合物。在一些实施方案中,在本文中提供适合口服给药于人类的单一单位剂型,其包含:等于或大于大约1、2、3、4、5、10、15、20、25、30、35、40、45、50、60、70、80、90或100 mg的量的式(I)的化合物;和可药用赋形剂。在一些实施方案中,活性成分的量为大约10 mg。在一些实施方案中,活性成分的量为大约40 mg。
在一些实施方案中,第二活性剂每日一次或两次、隔天一次、每周一次、每两周一次或每三周一次以大约1至大约1000 mg、大约5至大约500 mg、大约10至大约350 mg、或大约50至大约200 mg的量给药。在一些实施方案中,第二活性剂口服或静脉给药。第二活性剂的具体量取决于所用的具体药剂、治疗或管理的疾病的类型、疾病的严重程度和阶段和本文中提供的化合物和共同给药于患者的任何任选地另外的活性剂的量。
如本文中其它地方论述,也包含一种减轻、治疗和/或预防与常规疗法相关的副作用或不良作用的方法,常规疗法包括但不限于外科手术、化疗、放射疗法、激素疗法、生物疗法和免疫疗法。包含本文中提供的式(I)的化合物和其它活性成分的固体分散体可在与常规疗法相关的副作用发生之前、之中或之后给药于患者。
在某些方面中,本公开提供一种制备固体剂型的方法,其包括:(a) 混合式(I)的化合物和一种或多种可药用赋形剂以形成磨碎颗粒;和(b) 通过施加5 kN至20 kN的压缩力而压缩颗粒。
在某些方面中,本公开提供一种制备固体剂型的方法,其包括:(a) 掺合式(I)的化合物、粘合剂、填料、崩解剂和润滑剂,由此形成掺合混合物;(b) 任选使用碾压机,将掺合混合物制粒,由此形成颗粒状混合物;(c) 将第二填料、第二崩解剂和第二润滑剂与所述颗粒状混合物混合,由此形成压片混合物;和(d) 将所述压片混合物压缩成片剂,其中所述填料和第二填料相同或不同;所述崩解剂和第二崩解剂相同或不同;且所述润滑剂和第二润滑剂相同或不同。在一些实施方案中,粘合剂是微晶纤维素,填料是甘露糖醇,崩解剂是交联羧甲基纤维素钠且润滑剂是硬脂酸镁。在一些实施方案中,第二填料是甘露糖醇,第二崩解剂是交联羧甲基纤维素钠,且第二润滑剂是硬脂酸镁。该方法可进一步包括将助流剂与颗粒状混合物混合。在一些实施方案中,助流剂是胶体二氧化硅,如Cab-O-Sil。在一些实施方案中,该方法进一步包括将片剂包衣。包衣可以是基于PVA的包衣,如OpaDry II。
在一些实施方案中,该方法包括用粘合剂预涂布掺合机壳体(blender shell),任选其中粘合剂是微晶纤维素。预涂布掺合机壳体可包括掺合粘合剂,如掺合粘合剂至少1分钟。该方法可进一步包括在涂布的掺合机中混合颗粒内成分,任选其中颗粒内成分包含式(I)的化合物、粘合剂、填料、崩解剂和任选润滑剂。该混合可包括任选在15 rpm或更高的速度下掺合至少5分钟。在一些实施方案中,该方法进一步包括研磨掺合的颗粒内成分。该方法可进一步包括在掺合机中混合研磨的颗粒内成分,如在至少15 rpm的速度下掺合至少10分钟。在一些实施方案中,将润滑剂如硬脂酸镁添加到掺合机中并与研磨和掺合的颗粒内成分混合。这种混合物可任选使用碾压机制粒。任选地,该方法进一步包括使颗粒状材料经过磨机。该方法可进一步包括将研磨的颗粒转移到掺合机中并与颗粒外成分混合,任选其中颗粒外成分包含填料和崩解剂。在一些实施方案中,该方法进一步包括将润滑剂如硬脂酸镁添加到混合物中并混合以形成片剂掺合物。在一些实施方案中,该方法进一步包括将助流剂如胶体二氧化硅添加到混合物中并混合以形成片剂掺合物。任选地,片剂掺合物使用碾压压实。在一些实施方案中,该方法包括将片剂掺合物压缩成片剂。在一些实施方案中,片剂为椭圆形。在一些实施方案中,压机的压缩力在5至20 kN之间,如大约7.5 kN或大约15 kN。在一些实施方案中,片剂由大约500 mg的片剂掺合物组成,如500 ± 25 mg。在一些实施方案中,片剂由大约125 mg的片剂掺合物组成,如125 ± 10 mg。
在某些方面中,本公开提供一种包装固体分散体,其包含本文所述的固体分散体和干燥剂。合适的干燥剂包括硅胶、膨润土或分子筛。在一些实施方案中,包装包括低湿气渗透容器,如HDPE瓶、LDPE袋、用束线带捆扎的双层LDPE袋、用螺帽罩密封的HDPE瓶、HDPE桶或其组合。
在某些方面中,本公开提供一种包装固体剂型,其包含本文所述的固体剂型和干燥剂。合适的干燥剂包括硅胶、Sorb-it、Clariant、膨润土或分子筛。在一些实施方案中,包装包括低湿气渗透容器,如HDPE瓶、LDPE袋、用束线带捆扎的双层LDPE袋、用螺帽罩密封的HDPE瓶、HDPE桶、箔-箔泡罩(foil-foil blisters)、冷成型箔-箔泡罩、铝塑铝泡罩(aluminum-aluminum blisters)、冷成型铝塑铝泡罩、聚氯乙烯(PVC)泡罩、聚偏二氯乙烯(PVDC)泡罩、Aclar泡罩、聚-氯-三氟乙烯(PCTFE)泡罩、塑料瓶、多层瓶或其组合。包装固体剂型可进一步包括棉、人造丝或聚酯线圈。在一些实施方案中,该包装固体剂型包括容纳固体剂型、干燥剂和任选棉、人造丝或聚酯线圈的瓶子,如HDPE瓶。在一些实施方案中,该包装固体剂型包括容纳固体剂型、干燥剂和棉、人造丝或聚酯线圈的瓶子,如HDPE瓶。
在某些方面中,本公开提供一种药盒,其包括本文所述的固体剂型和关于将所述固体剂型给药于需要其的对象的说明书。在一些实施方案中,该药盒包括与干燥剂一起包装在低湿气渗透容器中的包含式(I)的化合物的固体剂型。任选地,标签在容器上或与容器相关联。例如,当形成标签的字母、数字或其它字符附着于、模制到或蚀刻到容器本身上时,标签在容器上,当其例如作为包装插页存在于也容纳该容器的接受器(receptacle)或载体,如盒子内时,标签与容器相关联。此外,标签可用于指示内容物用于具体的治疗应用。在一些实施方案中,标签包括内容物的使用说明,如在本文所述的方法中。在一些实施方案中,本文中提供的药物组合物存在于容纳一个或多个包含式(I)的化合物的单位剂型的包装或容器中。该包装可含有金属或塑料箔,如泡罩包装。该包装或容器可附有关于单位剂型的给药的说明书。在一些实施方案中,该包装或容器附有管理药物的生产、使用或销售的政府机关规定的形式的公告,所述公告反映了该药物形式被机关批准用于人用或兽用给药。这样的公告例如可以是美国食品和药品管理局(U.S. Food and Drug Administration)批准的用于药物处方的标签,或批准的产品插页。在一些实施方案中,制备包含式(I)的化合物的组合物,置于适当的容器中,并对指示病况的治疗作出标记。
在一个方面中,本公开提供一种治疗需要其的对象的增生性病症的方法,其包括给予所述对象本文中提供的固体分散体、固体剂型或药物组合物。在一些实施方案中,该增生性病症是癌症状况。在一些进一步的实施方案中,所述癌症状况是选自肺癌、头颈部鳞状细胞癌、胰腺癌、乳腺癌、卵巢癌、肾细胞癌、前列腺癌、神经内分泌癌、胃癌、膀胱癌和结肠癌的癌症。在一些进一步的实施方案中,癌症状况是肾细胞癌。在某些方面中,本公开提供一种治疗肾细胞癌的方法,其包括给予需要其的对象有效量的本文中提供的固体分散体、固体剂型或药物组合物。在一些实施方案中,肾细胞癌是透明细胞肾细胞癌。
在一些实施方案中,本公开提供一种治疗癌症状况的方法,其中式(I)的化合物对以下一种或多种有效:抑制癌细胞的增殖、抑制癌细胞的转移、杀死癌细胞和降低与癌细胞的存在相关的症状的严重性或发生率。在另一些实施方案中,所述方法包括将治疗有效量的本文中提供的固体分散体、固体剂型或药物组合物给药于癌细胞。在一些实施方案中,给药发生在体外。在另一些实施方案中,给药发生在体内。
在一些实施方案中,本发明提供一种治疗von Hippel-Lindau(VHL)疾病的方法,其包括给予需要其的对象本文中提供的固体分散体、固体剂型或药物组合物。在一些实施方案中,对象也患有成血管细胞瘤、嗜铬细胞瘤、胰腺神经内分泌肿瘤或肾细胞癌。在一些实施方案中,对象患有肾细胞癌。VHL疾病是一种常染色体显性遗传综合征,其不仅使患者易患肾癌(~70%终生风险),还易患成血管细胞瘤、嗜铬细胞瘤和胰腺神经内分泌肿瘤。VHL疾病导致具有组成活性(constitutively active)HIF-α蛋白的肿瘤,其中大多数依赖于HIF-2α活性(
如本文所用,治疗有效量的固体分散体、固体剂型或药物组合物是指足以实现预期应用,包括但不限于如本文定义的疾病治疗的式(I)的化合物的量。在本方法中也设想了使用亚治疗量的式(I)的化合物治疗预期疾病状况。
固体分散体、固体剂型或药物组合物的给药量可随预期应用(体外或体内)、或治疗的对象和疾病状况,例如对象的体重和年龄、疾病状况的严重程度、给药方式等而变,这是本领域普通技术人员容易确定的。
测量HIF-2α的生物效应的抑制可包括对生物样本如来自对象的样本进行检测。可选择各种样本的任一种,取决于检测。样本的实例包括但不限于血样(例如血浆或血清)、呼出气冷凝液样本、支气管肺泡灌洗液、痰液样本、尿样和组织样本。
可监测用本公开的固体分散体、固体剂型或药物组合物治疗的对象以确定治疗效果并可基于对象对治疗的生理响应调节治疗方案。例如,如果HIF-2α抑制的生物效应的抑制高于或低于阈值,可分别降低或增加给药量或频率。如果确定该疗法有效,该方法可进一步包括继续该疗法。如果确定该疗法有效,该方法可包括维持、递减、减少或停止该疗法中的化合物的给药量。如果确定该疗法无效,该方法可包括增加该疗法中的化合物的给药量。或者,如果确定该疗法无效,该方法可包括停止疗法。在一些实施方案中,如果生物效应的抑制高于或低于阈值,如缺乏响应或有不良反应,停止用式(I)的化合物治疗。生物效应可以是各种生理指标的任一种的变化。
一般而言,HIF-2α抑制剂如式(I)的化合物是抑制HIF-2α的一种或多种生物效应的化合物。HIF-2α的生物效应的实例包括但不限于HIF-2α与HIF-1β的异源二聚、HIF-2α靶基因表达、VEGF基因表达和VEGF蛋白分泌。在一些实施方案中,HIF-2α抑制剂对HIF-2α具有选择性,以使该抑制剂抑制HIF-2α与HIF-1β的异源二聚但不抑制HIF-1α与HIF-1β的异源二聚。这些生物效应可被抑制大约或大于大约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更多。
缺氧诱导因子(HIF)如HIF-2α是对细胞环境中可利用的氧的变化(例如氧减少或缺氧)作出响应的转录因子。HIF信号级联介导缺氧(低氧浓度状态)对细胞的效应。缺氧通常阻止细胞分化。但是,缺氧促进血管的形成并且对胚胎和癌症肿瘤中的血管系统的形成是重要的。伤口中缺氧也促进角化细胞的迁移和上皮组织的恢复。式(I)的化合物可以以有效减轻HIF-2α活性的任何一种或多种这样的效应的量给药。
可通过例如用式(I)的化合物抑制HIF-2α与HIF-1β(ARNT)的异源二聚来抑制HIF-2α活性。可获得各种测量HIF-2α二聚的方法。在一些实施方案中,HIF-2α抑制剂结合HIF-2α的PAS-B域腔。
也可通过HIF-2α靶基因mRNA表达的减少来测定对HIF-2α与HIF-1β(ARNT)的异源二聚的抑制。可使用实时PCR技术进行mRNA量化(Wong等人, “Real-time PCR for mRNAquantitation”, 2005. BioTechniques 39, l: l-l.)。另一种测定对HIF-2α与HIF-1β(ARNT)的异源二聚的抑制的方法是通过免疫共沉淀。
如本文所述,HIF-2α是对调控靶基因的表达起到重要作用的转录因子。HIF-2α靶基因的非限制性实例包括HMOX1、SFTPA1、CXCR4、PAI1、BDNF、hTERT、ATP7A和VEGF。例如,HIF-2α是VEGF的活化剂。HIF-2α靶基因的进一步非限制性实例包括HMOX1、EPO、CXCR4、PAI1、CCND1、CLUT1、IL6和VEGF。式(I)的化合物可以以有效减少由HIF-2α活性诱发的任何一种或多种基因的表达的量给药。各种方法可用于检测基因表达水平,并包括检测基因转录产物(多核苷酸)和转译产物(多肽)。例如,可在DNA、RNA或mRNA层面检测和量化基因表达。已用于量化mRNA的各种方法包括原位杂交技术、荧光原位杂交技术、报告基因、RNase保护检测、Northern印迹、逆转录(RT)-PCR、SAGE、DNA微阵列、瓦片阵列(tiling array)和RNA-seq。用于检测多核苷酸的方法的实例包括但不限于基于金纳米粒子的距离相关光学性质的多核苷酸的选择性比色检测和使用相互作用的荧光标签和竞争杂交的多核苷酸的溶液相检测。用于检测蛋白的实例包括但不限于显微术和蛋白免疫染色、蛋白免疫沉淀、免疫电泳、免疫印迹(western blot)、BCA检测、分光光度法、质谱法和酶检测。
在一些实施方案中,HIF-2α的抑制以VEGF基因表达的减少为特征。可通过各种方法如本文所述的那些的任一种来测量该减少。作为进一步的实例,可通过定量PCR(QT-PCR)、微阵列、RNA-seq和nanostring测量VEGF的mRNA表达水平。作为另一实例,可使用ELISA检测法测量VEGF蛋白分泌水平。
在某些方面中,本公开提供一种治疗HIF-2α介导的疾病或病况的方法,其包括给予需要其的对象治疗有效量的本文所述的固体分散体、固体剂型或药物组合物。在一些实施方案中,该疾病或病况是癌症。在一些实施方案中,该疾病或病况选自肾细胞癌、vonHippel-Lindau疾病、肺动脉高压、胶质母细胞瘤和结肠炎。
在一些实施方案中,本文提供了一种抑制HIF-2α的方法,其包括使HIF-2α与有效量的本文所述的固体分散体、固体剂型或药物组合物接触。在另一些实施方案中,本方法可用于治疗与HIF-2α相关的疾病状况。直接或间接地由HIF-2α的异常活性或表达水平造成的任何疾病状况都可以是预期疾病状况。在一些实施方案中,疾病状况是如本文所述的增生性病症,包括但不限于癌症。HIF-2α在肿瘤发生和肿瘤进展中的作用已涉及许多人类癌症。组成活性HIF-2α可能是有缺陷的VHL或癌细胞中的低氧浓度的结果。由于血管化不良,快速生长的肿瘤通常是低氧的,这是一种激活HIF-2α以支持肿瘤细胞存活和增殖的状态。HIF-2α的组成性激活正成为各种人类癌症的共同主题,因此靶向HIF-2α的药剂具有治疗价值。
下文的实施例中给出的数据证实式(I)的化合物的抗癌作用。因此,本方法特别可用于治疗增生性病症,如肿瘤性病况。这样的病况的非限制性实例包括但不限于棘皮瘤、腺泡细胞癌、听神经瘤、肢端黑色素瘤、肢端汗腺瘤、急性嗜酸性粒细胞白血病、急性淋巴母细胞性白血病、急性原始巨核细胞白血病、急性单核细胞性白血病、急性成髓细胞白血病伴成熟、急性髓细胞树突状细胞白血病、急性髓细胞样白血病、急性早幼粒细胞白血病、釉质瘤、腺癌、腺样囊性癌、腺瘤、牙源性腺样瘤、肾上腺皮质癌、成人T细胞性白血病、侵袭性NK细胞白血病、艾滋病相关癌症、艾滋病相关淋巴瘤、腺泡状软组织肉瘤、成釉细胞纤维瘤、肛门癌、间变性大细胞淋巴瘤、间变性甲状腺癌、血管免疫母细胞性T细胞淋巴瘤、血管肌脂肪瘤、血管肉瘤、阑尾癌、星形细胞瘤、非典型畸胎瘤样横纹肌瘤、基底细胞癌、基底样癌、B细胞白血病、B细胞淋巴瘤、贝里尼管癌、胆道癌、膀胱癌、胚细胞瘤、骨癌、骨肿瘤、脑干神经胶质瘤、脑肿瘤、乳腺癌、布伦纳瘤、支气管肿瘤、细支气管肺泡癌、棕色瘤、伯基特淋巴瘤、类癌瘤、癌瘤、癌肉瘤、卡斯尔曼氏病、中枢神经系统胚胎肿瘤、小脑星形细胞瘤、大脑星形细胞瘤、宫颈癌、胆管细胞型肝癌、软骨瘤、软骨肉瘤、脊索瘤、绒毛膜癌、脉络丛乳头状瘤、慢性淋巴细胞性白血病、慢性单核细胞性白血病、慢性髓细胞性白血病、慢性骨髓增生性病症、慢性中性粒细胞白血病、透明细胞肾细胞癌、透明细胞肿瘤、结肠癌、结肠直肠癌、颅咽管瘤、皮肤T细胞淋巴瘤、隆凸性皮肤纤维肉瘤、皮样囊肿、促纤维增生性小圆细胞肿瘤、弥漫性大B细胞淋巴瘤、胚胎发育不良性神经上皮肿瘤、胚胎性癌、内胚窦瘤、子宫内膜癌、子宫内膜子宫癌、子宫内膜样肿瘤、肠病相关T细胞淋巴瘤、成室管膜细胞瘤、室管膜瘤、上皮样肉瘤、红白血病、食道癌、嗅神经母细胞瘤、尤因氏肉瘤、颅外生殖细胞肿瘤、性腺外生殖细胞肿瘤、肝外胆管癌、乳腺外佩吉特氏病、输卵管癌、纤维瘤、纤维肉瘤、滤泡性淋巴瘤、滤泡性甲状腺癌、胆囊癌、神经节神经胶质瘤、神经节瘤、胃癌、胃淋巴瘤、胃肠癌、胃肠道类癌瘤、胃肠道间质瘤、生殖细胞瘤、胚组织瘤、妊娠性绒毛膜癌、妊娠性滋养层细胞瘤、骨巨细胞瘤、多形性成胶质细胞瘤、神经胶质瘤、大脑神经胶质瘤病、血管球瘤、胰高血糖素瘤、成性腺细胞瘤、粒层细胞瘤、毛细胞性白血病、头颈癌、心脏癌、成血管细胞瘤、血管外皮细胞瘤、血管肉瘤、血液系统恶性肿瘤、肝细胞癌、肝脾T细胞淋巴瘤、霍奇金淋巴瘤、下咽癌、下丘脑神经胶质瘤、炎性乳腺癌、眼内黑色素瘤、胰岛细胞癌、少年骨髓单核细胞白血病、卡波西氏肉瘤、肾癌、肝门胆管肿瘤、库肯勃瘤、喉癌、恶性雀斑样黑素瘤、白血病、唇和口腔癌、脂肪肉瘤、肺癌、黄体瘤、淋巴管瘤、淋巴管肉瘤、淋巴上皮瘤、淋巴系白血病、淋巴瘤、巨球蛋白血症、恶性纤维组织细胞瘤、恶性胶质瘤、恶性间皮细胞瘤、恶性周围神经鞘瘤、恶性横纹肌样瘤、恶性蝾螈瘤、MALT淋巴瘤、套细胞淋巴瘤、肥大细胞白血病、纵隔生殖细胞肿瘤、纵隔肿瘤、甲状腺髓样癌、成神经管细胞瘤、髓上皮瘤、黑色素瘤、脑膜瘤、Merkel细胞癌、间皮瘤、原发性隐匿性转移性鳞状颈癌、转移性尿路上皮癌、苗勒管混合瘤、单核细胞性白血病、口腔癌、粘液性肿瘤、多发性内分泌肿瘤综合征、多发性骨髓瘤、蕈样肉芽肿病、骨髓增生异常疾病、骨髓性白血病、髓样肉瘤、骨髓组织增生性疾病、粘液瘤、鼻腔癌、鼻咽癌、赘生物、神经鞘瘤、成神经细胞瘤、神经纤维瘤、神经瘤、结节性黑色素瘤、非霍奇金氏淋巴瘤、非黑色素瘤皮肤癌、非小细胞肺癌、眼部肿瘤、少突星形细胞瘤、少突神经胶质瘤、嗜酸细胞瘤、视神经鞘脑膜瘤、口腔癌、口咽癌、骨肉瘤、卵巢癌、卵巢上皮癌、卵巢生殖细胞肿瘤、卵巢低恶性潜能肿瘤、肺上沟瘤、胰腺癌、甲状腺乳头状癌、乳头状瘤病、副神经节瘤、鼻旁窦癌、甲状旁腺癌、阴茎癌、血管周围上皮样细胞瘤、咽癌、嗜铬细胞瘤、中分化松果体实质瘤、成松果体细胞瘤、垂体细胞瘤、垂体腺瘤、垂体肿瘤、浆细胞肿瘤、胸膜肺母细胞瘤、多胚瘤、前体T淋巴细胞淋巴瘤、原始神经外胚层瘤、前列腺癌、腹膜假粘液瘤、直肠癌、肾细胞癌、视网膜母细胞瘤、横纹肌瘤、横纹肌肉瘤、Richter’s转化、骶尾部畸胎瘤、唾液腺癌、肉瘤、神经鞘瘤病、皮脂腺癌、继发性肿瘤、精原细胞瘤、浆液性肿瘤、支持间质细胞瘤、性索-间质肿瘤、塞扎里综合征、印戒细胞癌、皮肤癌、小蓝圆细胞肿瘤、小细胞癌、小细胞肺癌、小细胞淋巴瘤、小肠癌、软组织肉瘤、生长抑素瘤、煤烟疣、脊髓肿瘤、脾边缘区淋巴瘤、鳞状细胞癌、胃癌、浅表扩散性黑素瘤、幕上原始神经外胚层肿瘤、表面上皮间质瘤、滑膜肉瘤、急性T细胞型淋巴母细胞白血病、T细胞大颗粒淋巴细胞白血病、T细胞白血病、T细胞淋巴瘤、T细胞幼淋巴细胞白血病、畸胎瘤、晚期淋巴癌、睾丸癌、泡膜细胞瘤、咽喉癌、胸腺癌、胸腺瘤、甲状腺癌、肾盂和输尿管移行细胞癌、移行细胞癌、脐尿管癌、尿道癌、泌尿生殖器肿瘤、子宫肉瘤、葡萄膜黑色素瘤、阴道癌、韦-莫二氏综合征、疣状癌、视觉通路神经胶质瘤、外阴癌、瓦尔登斯特伦氏巨球蛋白血症、沃辛瘤、维尔姆斯瘤或它们的任何组合。
在一些实施方案中,给予本文所述的固体分散体、固体剂型或药物组合物的方法适用于治疗肾上腺、血液、骨髓、脑、乳腺、子宫颈、结肠、头颈部、肾、肝、肺、卵巢、胰腺、浆细胞、直肠、视网膜、皮肤、脊柱、咽喉或它们的任何组合的癌症。
本公开的一些实施方案考虑了人类对象,如已被诊断为具有增生性病症状况或有发展或获得增生性病症状况的风险的对象。某些其它实施方案考虑了非人类对象,例如非人灵长类动物,如猕猴、黑猩猩、大猩猩、长尾猴(vervet)、红毛猩猩(orangutan)、狒狒或其它非人灵长类动物,包括本领域中已知为临床前模型的非人类对象。某些其它实施方案考虑了非人类哺乳动物对象,例如小鼠、大鼠、兔子、猪、绵羊、马、牛、山羊、沙鼠、仓鼠、豚鼠或其它哺乳动物。也考虑了其它实施方案,其中对象或生物源可以是非哺乳类脊椎动物,例如另一高等脊椎动物,或鸟类、两栖动物或爬虫类物种,或另一对象或生物源。在本发明的某些实施方案中,使用转基因动物。转基因动物是非人类动物,其中该动物的一种或多种细胞包括非内源(即异源)核酸并作为其细胞的一部分中的染色体外因子存在或稳定地整合到其胚系DNA中(即在其大多数或所有细胞的基因组序列中)。
在一些实施方案中,基于治疗增生性病症如癌症的效果测量疗效。一般而言,对于增生性病症(例如癌症,无论是良性还是恶性)的治疗,可通过该方法和组合物促进对肿瘤细胞增殖的抑制、对肿瘤血管生成的抑制、肿瘤细胞的根除、肿瘤生长速率的降低和/或至少一种肿瘤的尺寸减小的程度来测量本发明的方法和组合物的疗效。在本文中论述了在疗效的测定中要考虑的几个参数。可由临床医师建立用于特定情况的参数的适当组合。可使用任何合适的方法,如目前临床用于追踪肿瘤尺寸和癌症进展的那些方法来确定本发明的方法在癌症治疗(例如减小肿瘤尺寸或根除癌细胞)中的进程。用于评估通过本发明的方法和组合物治疗癌症的主要疗效参数优选是肿瘤尺寸的减小。可使用任何合适的技术描绘肿瘤尺寸,如测量尺寸、或使用可得的计算机软件如Wake Forest University开发的FreeFlight软件(其能够准确估算肿瘤体积)估算肿瘤体积。可通过使用例如CT、超声、SPECT、螺旋CT、MRI、照片等的肿瘤可视化确定肿瘤尺寸。在治疗期完成后手术切除肿瘤的实施方案中,可通过要切除的组织的全量分析和/或通过切除组织的病理分析确定肿瘤组织的存在和肿瘤尺寸。
在一些实施方案中,由于本发明的方法和组合物,稳定肿瘤的生长(即一种或多种肿瘤的尺寸增加不大于1%、5%、10%、15%或20%和/或不转移)。在一些实施方案中,将肿瘤稳定至少大约1、2、3、4、5、6、7、8、9、10、11、12周或更久。在一些实施方案中,将肿瘤稳定至少大约1、2、3、4、5、6、7、8、9、10、11、12个月或更久。在一些实施方案中,将肿瘤稳定至少大约1、2、3、4、5、6、7、8、9、10年或更久。优选地,本发明的方法将肿瘤尺寸减小至少大约5%(例如至少大约10%、15%、20%或25%)。更优选地,将肿瘤尺寸减小至少大约30%(例如至少大约35%、40%、45%、50%、55%、60%或65%)。再更优选地,将肿瘤尺寸减小至少大约70%(例如至少大约75%、80%、85%、90%或95%)。最优选地,完全消除肿瘤,或减小到检测水平以下。在一些实施方案中,对象在治疗后保持无肿瘤(例如在缓解期)至少大约1、2、3、4、5、6、7、8、9、10、11、12周或更久。在一些实施方案中,对象在治疗后保持无肿瘤至少大约1、2、3、4、5、6、7、8、9、10、11、12个月或更久。在一些实施方案中,对象在治疗后保持无肿瘤至少大约1、2、3、4、5、6、7、8、9、10年或更久。
在一些实施方案中,可通过测量在治疗期完成后手术切除肿瘤的坏死(即死亡)组织的百分比来确定本公开的方法对减小肿瘤尺寸的效力。在一些进一步的实施方案中,如果切除组织的坏死百分比大于大约20%(例如至少大约30%、40%、50%、60%、70%、80%、90%或100%),更优选大约90%或更大(例如大约90%、95%或100%),则治疗为治疗有效的。最优选地,切除组织的坏死百分比为100%,即不存在或不可检出肿瘤组织。
本公开的方法的效力可通过许多二次参数确定。二次参数的实例包括,但不限于,新肿瘤的检测、肿瘤抗原或标志物(例如CEA、PSA或CA-125)的检测、活组织检查、手术降期(即肿瘤的手术分期从不可切除转化为可切除)、PET扫描、存活率、无疾病进展生存期、疾病进展时间、生活质量评估,如Clinical Benefit Response Assessment等,所有这些都可指向人体内的癌症的总体进展(或缓解)。活组织检查特别可用于检测组织内的癌细胞的根除。放射免疫检测(RAID)用于使用由肿瘤产生和/或与肿瘤相关的标志物(抗原)(“肿瘤标志物”或“肿瘤相关抗原”)的血清水平将肿瘤定位和分期,并可用作治疗前的诊断判定、治疗后的复发诊断指标和治疗后的疗效指标。可作为疗效指标评估的肿瘤标志物或肿瘤相关抗原的实例包括但不限于癌胚抗原(CEA)、前列腺特异性抗原(PSA)、CA-125、CA19-9、神经节苷脂分子(例如GM2、GD2和GD3)、MART-1、热休克蛋白(例如gp96)、sialyl Tn(STn)、酪氨酸酶、MUC-1、HER-2/neu、c-erb-B2、KSA、PSMA、p53、RAS、EGF-R、VEGF、MAGE和gp100。其它肿瘤相关抗原是本领域中已知的。与内窥镜检测系统结合的RAID技术也可高效区分小肿瘤与周围组织(参见例如美国专利No. 4,932,412)。
在一些实施方案中,通过一种或多种以下结果证明根据本发明的方法治疗人类患者的癌症:(a) 肿瘤完全消失(即完全应答),(b) 与治疗前的肿瘤尺寸相比,肿瘤尺寸减小大约25%至大约50%,持续治疗期完成后至少4周,(c) 与治疗期前的肿瘤尺寸相比,肿瘤尺寸减小至少大约50%,持续治疗期完成后至少4周,和(d) 与治疗期前的肿瘤相关抗原水平相比,在治疗期完成后大约4-12周特异性肿瘤相关抗原水平降低至少2%(例如降低大约5%、10%、20%、30%、40%、50%、60%、70%、80%或90%)。尽管肿瘤相关抗原水平降低至少2%是优选的,但肿瘤相关抗原水平的任何降低都是通过本发明的方法治疗患者的癌症的证据。例如,关于不可切除的局部晚期胰腺癌,可通过与治疗期前的CA19-9水平相比在治疗期完成后4-12周CA19-9肿瘤相关抗原水平的至少10%降低来证明治疗。类似地,关于局部晚期直肠癌,可通过与治疗期前的CEA水平相比在治疗期完成后4-12周CEA肿瘤相关抗原水平的至少10%降低来证明治疗。
关于生活质量评估,如Clinical Benefit Response Criteria,可根据疼痛强度、止痛剂消耗和/或远期生活质量评估(Karnofsky Performance Scale)分数来证明根据本发明的治疗的治疗效益。替代性地或附加地,人类患者的癌症治疗的证据是:(a) 与治疗前患者报告的疼痛强度相比,例如在治疗完成后12周中的任何连续四周期间,患者报告的疼痛强度降低至少50%(例如降低至少60%、70%、80%、90%或100%),(b) 与治疗前患者报告的止痛剂消耗相比,例如在治疗完成后12周中的任何连续四周期间,患者报告的止痛剂消耗减少至少50%(例如减少至少60%、70%、80%、90%或100%),和/或(c) 与治疗期前患者报告的远期生活质量评估(Karnofsky Performance Scale)分数相比,例如在治疗期完成后12周中的任何连续四周期间,患者报告的远期生活质量评估(Karnofsky Performance Scale)分数提高至少20个点(例如提高至少30个点、50个点、70个点或90个点)。
理想地通过一种或多种(以任何组合)上述结果证明人类患者的增生性病症(例如癌症,无论是良性还是恶性)的治疗,尽管参考的试验和/或其它试验的替代性或附加性的结果可证明疗效。
在一些实施方案中,由于本发明的方法,肿瘤尺寸减小,优选在对象中没有显著的不良事件。不良事件通过美国国家癌症研究所(NCI)的Cancer Therapy EvaluationProgram(CTEP)分类或“分级”,其中等级0代表最小不良副作用,等级4代表最严重的不良事件。理想地,本发明的方法与最小不良事件相关,例如通过CTEP/NCI分级的等级0、等级1或等级2不良事件。但是,如本文中论述,肿瘤尺寸减小尽管是优选的,但不是必需的,因为尽管肿瘤细胞根除,但肿瘤的实际尺寸可能没有收缩。癌细胞的根除足以实现治疗效果。同样地,肿瘤尺寸的任何减小足以实现治疗效果。
在Cancer Facts and Figures 2001, American Cancer Society, New York,N.Y.和国际专利申请WO 01/24684中进一步描述了人类的各种癌症的检测、监测和评级。相应地,临床医师可使用标准试验确定本发明的方法的各种实施方案在癌症治疗中的效力。但是,除肿瘤尺寸和扩散外,临床医师在评估治疗效力时也可考虑患者的生活质量和存活率。
在一个方面中,本公开提供一种治疗肺动脉高压(PAH)的方法。在一个实施方案中,该方法包括将有效量的本文所述的固体分散体、固体剂型或药物组合物给药于所述对象。PAH是各种来源的威胁生命和进行性的疾病,其特征在于肺血管重塑,其导致提高的肺血管阻力和肺动脉压,最常导致右侧心力衰竭。起病时最常见的症状是呼吸急促,随之运动能力受损作为该疾病的标志。PAH包括特发性PAH、遗传性PAH(例如BMPR2、ALK1、endoglin)、药物诱发的PAH、毒素诱发的PAH和与另一病况(例如结缔组织病、HIV感染、门静脉高血压、先天性心脏病、血吸虫病或慢性溶血性贫血)相关的PAH。特发性PAH在不存在已知风险因子的情况下发生并且是该疾病的最常见形式。根据本公开治疗的PAH病况可包括任何这些PAH病况。
通常,基于早期U.S. National Institutes of Health Registry及前瞻性随访,对于194位平均年龄为36岁的无治疗的特发性或遗传性PAH(先前被称为原发性肺动脉高压)患者,在诊断后PAH的中位生存期小于3年。目前,成年人的诊断后平均生存期估计为5至7年,在儿童中具有类似不良的总体预后。在一些实施方案中,该固体分散体、固体剂型或药物组合物以有效增加对象的治疗群体中的平均生存期,例如增加大约或大于大约0.5、1、2、3、4、5、6、7、8、9、10、15年或更久的量给药。
PAH的病理学可包括血管壁的内膜层、中膜层和外膜层的病理变化。血管内皮细胞和平滑肌细胞都具有异常生长的特征,随之发生过度细胞增殖和凋亡抑制。常驻血管细胞中的这些异常,与炎症、过度血管收缩和原位血栓形成相结合,可促进远端肺小动脉的物理缩窄。不受制于任何理论,这种缩窄可导致肺血管阻力的提高,这导致肺动脉压的慢性和进行性提高。在一些情况下,PAH可由缺氧诱发。在一些实施方案中,该固体分散体、固体剂型或药物组合物以有效延迟与PAH相关的一种或多种这样的症状、降低其发生率或降低其严重程度的量给药。
治疗PAH包括治疗被诊断为已有PAH的对象,以及预防PAH。在一些实施方案中,给药于对象的固体分散体、固体剂型或药物组合物的量(在单剂量中或在多剂量中)有效延迟PAH的一种或多种症状的发作或降低其发生率。延迟或发生率降低可能相对于参考人群,如患有PAH的对象的无治疗群体或患有PAH但用另一药剂治疗的对象。PAH的一种或多种症状的延迟或发生率降低可以是降低大约或大于大约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更多。在一些实施方案中,通过疾病进展时间的增加,如在一种或多种首发症状的出现和一种或多种第二症状的出现之间的时间的增加来测量延迟或发生率降低。延迟可为大约或大于大约数天、数周、数月或数年(例如1、2、3、4、5、6、7天或更多天;1、2、3、4、5、6、7、8周或更多周;1、2、3、4、5、6个月或更多个月;或1、2、3、4、5年或更多年)。在预防的情况下,对象可能是有发生PAH的风险的个体。
在一个实施方案中,给药于对象的固体分散体、固体剂型或药物组合物的量(在单剂量中或在多剂量中)有效地(a) 与治疗前的对象的PAP趋势相比,稳定肺动脉压(PAP),或(b) 相对于对象的起始PAP水平,降低PAP;其中PAP是收缩期肺动脉压(SPAP)或舒张期肺动脉压(DPAP)。可获得各种测量PAP的方法。例如,可通过将导管插入肺动脉来测量PAP。通常,平均压力为9 - 18 mmHg且在左心房中测得的楔压可为6-12 mmHg。楔压在左心衰竭、二尖瓣狭窄和其它病况,如镰状细胞疾病中可能升高。
可将对象的PAP稳定在治疗开始时存在的水平,如数天、数周、数月或数年。在一些实施方案中,可将对象的起始PAP水平降低大约或大于大约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或更多。在一些实施方案中,可将PAP的提高率降低大约或大于大约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更多。
给药于对象的固体分散体、固体剂型或药物组合物的量(在单剂量中或在多剂量中)可有效地相对于患有PAH的对象的无治疗群体减轻如通过Fulton’s指数测得的右心室肥厚。Fulton’s指数是右心室的质量与左心室和隔膜的总质量之间的比率的量度(RV /(LV + S))。质量可直接测量(例如在动物研究的情况下)或由活对象的体积测量外推(例如通过超声心动图测定)。减轻可能是相对于患有PAH的对象的无治疗群体。例如,与PAH对象的无治疗群体相比,在用式(I)的化合物治疗的PAH对象群体中Fulton指数的平均降低可为大约或大于大约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或更大。在一些实施方案中,Fulton’s指数的降低为至少大约20%。
在一些实施方案中,给药于对象的固体分散体、固体剂型或药物组合物的量(在单剂量中或在多剂量中)有效地降低PAH的生理指标。该降低可经指定时期测量,如在开始治疗后(治疗可能贯穿该期间)数天(例如大约或大于大约1、2、3、4、5、6、7天或更多天)、数周(例如1、2、3、4、5、6周或更多周)、数月(例如1、2、3、4、5、6、8、10个月或更多个月)或更久(例如1、2、3、4、5年或更多年)的降低水平。可测量各种生理指标的任一种,如肺血管阻力、肺动脉压、全身动脉压、混合静脉血氧饱和度、动脉血氧饱和度、心脏指数、肺毛细血管楔压、右心房压、六分钟步行距离、脑利钠肽水平和肺弥散量。例如,该固体分散体、固体剂型或药物组合物的存在量可有效地(a) 降低以下一种或多种:肺血管阻力、肺动脉压、全身动脉压、肺毛细血管楔压、右心房压和脑利钠肽水平;和/或(b) 提高以下一种或多种:混合静脉血氧饱和度、动脉血氧饱和度、心脏指数、六分钟步行距离和肺弥散量。该固体分散体、固体剂型或药物组合物的量可有效地增加生存期、增加临床恶化时间、降低右心衰竭的发生率或促进在WHO功能分级中的有利变化。
PAH的一个生理指标是肺血管阻力(PVR)。基线或参考PVR水平可以是200 dyn·sec/cm
PAH的另一生理指标是肺动脉压(PAP)。基线或参考PAP水平可为20 mmHg或更高、25 mmHg或更高、30 mmHg或更高、35 mmHg或更高、40 mmHg或更高、45 mmHg或更高、50 mmHg或更高、60 mmHg或更高、或70 mmHg或更高。在一些实施方案中,如果在治疗开始后对象的终点PAP水平从基线或参考PAP水平降低0.5 mmHg或更多、1 mmHg或更多、1.5 mmHg或更多、5 mmHg或更多、10 mmHg或更多、20 mmHg或更多、30 mmHg或更多、40 mmHg或更多、或50mmHg,则本文中提供的治疗是有效的。
PAH的另一生理指标是心脏指数(CI)。基线或参考CI水平可为5 L/min/m
PAH的另一生理指标是肺毛细血管楔压(PCWP)。基线或参考PCWP水平可为36 mmHg或更低、24 mmHg或更低、18 mmHg或更低、10 mmHg、或5 mmHg或更低。在一些实施方案中,如果在治疗开始后终点PCWP水平从基线或参考PCWP水平提高0.2 mmHg或更多、0.3 mmHg或更多、0.4 mmHg或更多、0.5 mmHg或更多、0.6 mmHg或更多、1 mmHg或更多、或5 mmHg或更多,则本文中提供的治疗是有效的。
PAH的另一生理指标是右心房压(RAP)。基线或参考RAP水平可为4 mmHg或更高、6mmHg或更高、8 mmHg或更高、10 mmHg或更高、12 mmHg或更高、16 mmHg或更高、20 mmHg或更高、或25 mmHg或更高。在一些实施方案中,如果在治疗开始后对象的终点RAP水平从基线或参考RAP水平降低5 mmHg或更多、2.5 mmHg或更多、1 mmHg或更多、0.5 mmHg或更多、或0.2mmHg或更多,则本文中提供的治疗是有效的。
PAH的另一生理指标是六分钟步行距离(6 MWD)。基线或参考6 MWD可为50 m或更少、100 m或更少、200 m或更少、300 m或更少、400 m或更少、或500 m或更少。在一些实施方案中,如果在治疗开始后对象的终点6 MWD从基线或参考6 MWD增加10 m或更多、15 m或更多、20 m或更多、25 m或更多、30 m或更多、或50 m或更多;或如果对象的终点6 MWD增加基线水平的3%或更多、4%或更多、5%或更多、10%或更多、或20%或更多,则本文中提供的治疗是有效的。
PAH的另一生理指标是脑利钠肽(BNP)水平。基线或参考BNP水平可为60 pg/mL或更高、80 pg/mL或更高、100 pg/mL或更高、120 pg/mL或更高、140 pg/mL或更高、200 pg/mL或更高、500 pg/mL或更高、或1000 pg/mL或更高。在一些实施方案中,如果在治疗开始后对象的终点BNP水平从基线或参考BNP水平降低,则本文中提供的治疗是有效的。例如,对象的终点BNP水平可降低1 pg/mL或更多、2 pg/mL或更多、5 pg/mL或更多、10 pg/mL或更多、20pg/mL或更多、100 pg/mL或更多、500 pg/mL或更多、或1000 pg/mL或更多。
肺弥散量(DLCO)或CO弥散量也可用作PAH的生理指标。基线或参考DLCO可为90%或更小、80%或更小、70%或更小、50%或更小、45%或更小、或40%或更小。在一些实施方案中,如果在治疗开始后终点DLCO从基线水平提高,则本文中提供的治疗是有效的。例如,终点DLCO可从基线或参考DLCO提高1%或更多、5%或更多、10%或更多、15%或更多、20%或更多、或50%或更多。
平均存活率可用作确定在一个或多个对象的群体中的效力的参数。参考平均存活率可为95%或更低、93%或更低、90%或更低、86%或更低、82%或更低、或78%或更低。平均存活率可为平均1年存活率。在一些实施方案中,如果在治疗开始后平均存活率提高,则本文中提供的治疗在一个或多个对象的群体中是有效的。例如,平均存活率可从参考平均存活率提高1%或更多、2%或更多、5%或更多、10%或更多、或20%或更多。
在一个方面中,本公开提供一种治疗需要其的对象的胶质母细胞瘤(包括多形性胶质母细胞瘤或GBM)的方法。在一个实施方案中,该方法包括将有效量的本文所述的固体分散体、固体剂型或药物组合物给药于所述对象。胶质瘤是一种异质性肿瘤,通常由肿瘤细胞和促进自我更新、增殖和存活的胶质瘤癌干细胞(GSC)组成。这些干细胞群体可优先表达HIF-2α调控基因,如VEGF、Oct4、Glut-1、NOTCH和前列腺酸性磷酸酶(PAP)。GSC群体倾向于驻留在血管周围生态位中以支持血管功能和肿瘤生长,同时表现出抗辐射力。侵袭性胶质瘤生长和干细胞样表型的效应可能通过HIF上游的信号转导通路,如PI3K/AKT/mTOR和HIF-2α活性的一般提高来介导。GBM的组织病理学特征包括浸润性侵入脑实质、明显的栅栏样坏死病灶和微血管增生的广泛模式(extensive patterns)。在一些实施方案中,该固体分散体、固体剂型或药物组合物以有效延迟一种或多种与胶质母细胞瘤相关的这些特征或如本文所述的其它特征的进展、降低其发生率或减轻其程度的量给药。在一些实施方案中,该固体分散体、固体剂型或药物组合物(在单剂量中或在多剂量中)以有效增加对象的治疗群体中的平均生存期,如增加大约或大于大约0.5、1、2、3、4、5、6、7、8、9、10、15年或更久的量给药。
治疗胶质母细胞瘤包括治疗被诊断为已有胶质母细胞瘤的对象,以及预防胶质母细胞瘤,如在有发生胶质母细胞瘤的风险的对象中。在一些实施方案中,给药于对象的固体分散体、固体剂型或药物组合物的量(在单剂量中或在多剂量中)有效地实现以下一种或多种:抑制胶质母细胞瘤细胞的生长、抑制胶质母细胞瘤细胞的转移、杀死胶质母细胞瘤细胞、减小肿瘤尺寸和降低与胶质母细胞瘤细胞的存在相关的症状的严重程度或发生率。这些疗效的一种或多种的程度可为大约或大于大约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更大。在一些实施方案中,可通过疾病进展时间的增加,如在一种或多种首发症状的出现和一种或多种第二症状的出现之间的时间的增加、或在相同症状的两次或更多次发生之间的延迟来测量疗效。延迟可为大约或大于大约数天、数周、数月或数年(例如1、2、3、4、5、6、7天或更多天;1、2、3、4、5、6、7、8周或更多周;1、2、3、4、5、6个月或更多个月;或1、2、3、4、5年或更多年)。在预防的情况下,对象可能是有发生胶质母细胞瘤的风险的个体,如在缓解期、具有家族史和/或具有一些其它易感性的对象。疗效的程度可相对于对象的起始状态(例如肿瘤的尺寸、生长速率、转移速率、一种或多种症状的严重程度或发生率)或相对于参考群体(例如无治疗群体或用不同的药剂治疗的群体)。
可使用任何合适的方法,如目前临床用于追踪肿瘤尺寸和癌症进展的那些方法来确定治疗胶质母细胞瘤的效力。测量肿瘤尺寸是确定生长是否已减慢、停止或逆转(如在杀死胶质母细胞瘤细胞的情况下)的一种方式。可使用任何合适的技术描绘肿瘤尺寸,如测量尺寸、或使用可得的计算机软件,如Wake Forest University开发的FreeFlight软件(其能够准确估算肿瘤体积)估算肿瘤体积。可通过使用例如CT、超声、SPECT、螺旋CT、MRI、照片等的肿瘤可视化确定肿瘤尺寸。在治疗期完成后手术切除肿瘤的实施方案中,可通过要切除的组织的全量分析和/或通过切除组织的病理分析确定肿瘤组织的存在和肿瘤尺寸。
理想地,由于治疗,稳定肿瘤的生长(即一种或多种肿瘤的尺寸增加不大于1%、5%、10%、15%或20%和/或不转移)。在一些实施方案中,将肿瘤稳定至少大约1、2、3、4、5、6、7、8、9、10、11、12周或更久。在一些实施方案中,将肿瘤稳定至少大约1、2、3、4、5、6、7、8、9、10、11、12个月或更久。在一些实施方案中,将肿瘤稳定至少大约1、2、3、4、5、6、7、8、9、10年或更久。优选地,本发明的方法将肿瘤尺寸减小至少大约5%(例如至少大约10%、15%、20%或25%)。更优选地,将肿瘤尺寸减小至少大约30%(例如至少大约35%、40%、45%、50%、55%、60%或65%)。再更优选地,将肿瘤尺寸减小至少大约70%(例如至少大约75%、80%、85%、90%或95%)。最优选地,完全消除肿瘤,或减小到检测水平以下。在一些实施方案中,对象在治疗后保持无肿瘤(例如在缓解期)至少大约1、2、3、4、5、6、7、8、9、10、11、12周或更久。在一些实施方案中,对象在治疗后保持无肿瘤至少大约1、2、3、4、5、6、7、8、9、10、11、12个月或更久。在一些实施方案中,对象在治疗后保持无肿瘤至少大约1、2、3、4、5、6、7、8、9、10年或更久。当在治疗期完成后手术切除肿瘤时,可通过测量坏死的切除组织的百分比来确定本发明的方法对减小肿瘤尺寸的效力。在一些实施方案中,如果切除组织的坏死百分比大于大约20%(例如至少大约30%、40%、50%、60%、70%、80%、90%或100%),更优选大约90%或更大(例如大约90%、95%或100%),则治疗为治疗有效的。最优选地,切除组织的坏死百分比为100%,即不存在或不可检出肿瘤组织。在一些实施方案中,胶质母细胞瘤的生长速率降低大约或大于大约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更多,包括胶质母细胞瘤的生长(例如肿瘤尺寸的变化速率)完全停止。在一些实施方案中,杀死识别的胶质母细胞瘤细胞(例如如在肿瘤块中)的大约或大于大约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更多。
许多二次参数可用于确定疗效。二次参数的实例包括,但不限于,新肿瘤的检测、肿瘤抗原或标志物的检测、活组织检查、手术降期(例如肿瘤的手术分期从不可切除转化为可切除)、PET扫描、存活率、无疾病进展生存期、疾病进展时间、生活质量评估如ClinicalBenefit Response Assessment等,所有这些都可指向人体内的癌症的总体进展(或缓解)。活组织检查特别可用于检测组织内的癌细胞的根除。放射免疫检测(RAID)用于使用由肿瘤产生和/或与肿瘤相关的标志物(抗原)(“肿瘤标志物”或“肿瘤相关抗原”)的血清水平将肿瘤定位和分期,并可用作治疗前的诊断判定、治疗后的复发诊断指标和治疗后的疗效指标。可作为疗效指标评估的胶质母细胞瘤标志物的实例包括但不限于ABCC3、GPNMB、NNMT和SEC61γ(参见例如US7115265)。
作为评估疗效的方法的另一实例,可在随时间经过在对象中表达相同生物标志物的患有疾病或有患病风险的对象之间比较疾病例如胶质母细胞瘤的生物标志物的表达。在一些情况下,可在患有疾病或有患病风险的对象和一个或多个正常对象之间比较同一组生物标志物的表达。在评估疾病结果或治疗效果时,可追踪都患有疾病的患者群体一段时间。可通过评估来自一位患者的样本中的生物标志物表达、评估来自在稍晚时间获得的同一患者的另外的样本的表达和比较稍晚样本与初始样本的生物标志物的表达来建立生物标志物表达水平。在指示例如疾病的进展或恶化、治疗方案缺乏效力、疾病缓解或治疗方案的效力的生物标志物的情况下,可使用这种方法。此外,可通过各种方法评估对象的治疗效力,包括但不限于身体检查、活组织检查或许多成像技术的任一种,如超声波检查、计算机断层扫描、磁共振成像、磁共振波谱学或正电子发射断层扫描。
胶质母细胞瘤与各种症状相关联。该疾病的常见症状包括癫痫、恶心和呕吐、头痛、记忆丧失和轻偏瘫,和由于颞叶和额叶受累而进行性的记忆、人格或神经缺损。在一些情况下,该肿瘤可快速开始产生症状,但有时是无症状的病况直至其达到巨大的尺寸。可根据其中任何一种或多种的减轻,如根据频率或严重程度来测量疗效。在一些实施方案中,如使用适当的量表测得,症状的减轻为大约或大于大约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更多。
关于生活质量评估,如Clinical Benefit Response Criteria,可根据疼痛强度、止痛剂消耗和/或远期生活质量评估(Karnofsky Performance Scale)分数来证明治疗的治疗效益。远期生活质量评估(Karnofsky Performance Scale)能够根据其功能损伤将患者分级。远期生活质量评估(Karnofsky Performance Scale)从0-100打分。一般而言,较低的卡氏评分(Karnofsky score)预测不良的生存预后。在一些实施方案中,替代性地或另外地,人类患者的胶质母细胞瘤治疗的证据是:(a) 与治疗前患者报告的疼痛强度相比,例如在治疗完成后12周中的任何连续四周期间,患者报告的疼痛强度降低至少50%(例如降低至少60%、70%、80%、90%或100%),(b) 与治疗前患者报告的止痛剂消耗相比,例如在治疗完成后12周中的任何连续四周期间,患者报告的止痛剂消耗减少至少50%(例如减少至少60%、70%、80%、90%或100%),和/或(c) 与治疗期前患者报告的远期生活质量评估(KarnofskyPerformance Scale)分数相比,例如在治疗期完成后12周中的任何连续四周期间,患者报告的远期生活质量评估(Karnofsky Performance Scale)分数提高至少20个点(例如提高至少30个点、50个点、70个点或90个点)。
在一个方面中,本公开提供一种治疗需要其的对象的消化系统的炎性疾病的方法。在一些实施方案中,该方法包括给予对象有效量的本文中提供的固体分散体、固体剂型或药物组合物。在一个方面中,本公开提供一种减轻需要其的对象的消化系统的炎症的方法,其包括给予对象有效量的本文中提供的固体分散体、固体剂型或药物组合物。在一些实施方案中,该固体分散体、固体剂型或药物组合物以有效延迟与炎症或炎性疾病相关的一种或多种特征的进展、降低其发生率或减轻其程度的量给药。在一些实施方案中,该固体分散体、固体剂型或药物组合物,在单剂量中或在多剂量中,以有效引发炎症或炎性疾病的缓解的量给药。
消化系统由胃肠道加上附属消化器官组成,包括舌、唾液腺、食管、胃、胰腺、肝、胆囊、小肠、大肠、结肠、肛门和直肠。本公开的一些实施方案具体涉及下胃肠道,包括小肠和大肠。术语“小肠”包含十二指肠、空肠和回肠,术语“大肠”包括盲肠、阑尾、结肠、升结肠、结肠右曲、横结肠、结肠左曲、降结肠、乙状结肠、直肠、以及肛管和肛门。
本公开提供减轻消化系统的炎症的方法和治疗消化系统的炎性疾病的方法。本文所用的术语“炎症”是指由自身免疫应答、身体损伤、感染、血管疾病、化学暴露、辐射或局部免疫应答引发的流体、血浆蛋白和/或白血球的局部积聚的通用术语。通常,炎症以一种或多种迹象为特征,包括例如发红、疼痛、热、肿胀和/或功能丧失。炎症可能与慢性(长期)炎性疾病或病症或急性(短期)炎性疾病或病症相关。
在实施任何本方法时,该固体分散体、固体剂型或药物组合物可减轻消化系统的炎症,如舌、唾液腺、食管、胃、胰腺、肝、胆囊、小肠、大肠、结肠、肛门和直肠的一种或多种的炎症。在一些实施方案中,该固体分散体、固体剂型或药物组合物减轻下胃肠道的炎症,如小肠、大肠或结肠的炎症。在一些示例性实施方案中,该固体分散体、固体剂型或药物组合物减轻结肠的炎症。该炎症可表征为肠炎、胃炎、胃肠炎、结肠炎、小肠结肠炎、十二指肠炎、空肠炎、回肠炎、直肠炎或阑尾炎。该炎症可以是急性或慢性的。在一些优选实施方案中,该炎症被归类为结肠炎。
在生理状态下,胃肠道可以陡峭的氧梯度为特征。慢性炎性肠病通常以募集的炎性细胞包括巨噬细胞、树突细胞和嗜中性粒细胞积极消耗O
不希望受制于任何特定理论,但本发明人推测,在结肠上皮和骨髓细胞中的HIF-2α表达是慢性炎症的引发、进展和维持的主要驱动力。HIF-2α的阻断预计减少或抑制炎性细胞类型及其促炎产物的募集,从而消退或预防消化系统的炎症,尤其是在患有克罗恩氏病和溃疡性结肠炎的对象中。
表现出消化系统炎症的对象可能患有炎性肠病、克罗恩氏病、结肠炎、乳糜泻、嗜酸性肠病或阑尾炎。本文所用的术语“炎性肠病”是指以结肠和/或小肠的炎性状况为特征的病理学。克罗恩氏病和结肠炎是两种类型的炎性肠病。
在一些实施方案中,炎性肠病包括结肠炎,如溃疡性结肠炎。“结肠炎”是结肠的炎症。结肠炎可能是急性或慢性的。本文所用的结肠炎包括溃疡性结肠炎、显微镜下结肠炎、淋巴细胞性结肠炎、胶原性结肠炎、改道性结肠炎、化学性结肠炎、缺血性结肠炎、感染性结肠炎、全结肠炎、左侧结肠炎、广泛性结肠炎、节段性结肠炎、显微镜下结肠炎、放射诱发性结肠炎、药物诱发性结肠炎和直肠炎。“溃疡性结肠炎”是影响结肠的慢性炎性疾病。其以结肠的粘膜炎症为特征。症状可从轻到重,并可包括便血、腹泻、血性腹泻、直肠急迫、里急后重、失禁、疲劳、排便次数增加、粘膜分泌物、夜间排便、腹部不适、发烧、体重减轻、反常性便秘、贫血和腹部压痛。溃疡性结肠炎是间歇性疾病,大多数患者具有复发和缓解的疾病过程和周期性发作(periodic flares)。术语“发作(flare)”或“复发”是指溃疡性结肠炎的症状增加,例如排便频率增加、直肠出血增加和/或通过内窥镜检查证实出现异常粘膜。尽管溃疡性结肠炎的症状可能在没有介入的情况下减轻,但这种疾病通常需要治疗才能缓解。
本文所用的术语“活动性”溃疡性结肠炎是指生物活性的溃疡性结肠炎。活动性疾病的患者可能有症状并表现出溃疡性结肠炎的一种或多种迹象或症状,例如直肠出血、排便频率增加、粘膜炎症或异常实验室测试(例如升高的ESR或CRP值或降低的血红蛋白)。对于特定疗法的“难治性”溃疡性结肠炎是指尽管用该疗法治疗但仍为活动性或复发或发作的溃疡性结肠炎。
本文所用的术语“克罗恩氏病”是指以胃肠道内衬的炎症为特征的一种类型的炎性肠病。症状可包括腹泻、腹痛、发烧、疲劳、血便和体重减轻。
当患者疑似溃疡性结肠炎时,初次诊断通常基于症状、内窥镜表现和组织学的组合。诊断通常包括大便样本、验尿和测试贫血、缺铁、白细胞增多和/或血小板增多。根据疾病的严重程度,炎症标志物,如红细胞沉降率(ESR)和C反应蛋白,可能升高。但是,内窥镜检查+活组织检查通常被认为是用于确诊溃疡性结肠炎的唯一决定性的方法。支持溃疡性结肠炎的诊断的内窥镜表现可包括红斑、失去正常血管形态、糜烂、出血、粒度增加(granularity)、脆碎性(friability)、溃疡和假息肉。活组织检查也可在内窥镜检查时进行以区分溃疡性结肠炎与克罗恩氏病。检查活组织检查样本的隐窝结构变形(distortionof crypt architecture)、隐窝炎症、隐窝缩短(crypt shortening)、固有层中的淋巴细胞和浆细胞的增加、隐窝脓肿、粘蛋白耗竭(mucin depletion)和固有层中的出血或炎症。
溃疡性结肠炎可影响结肠的一部分,或几乎整个结肠。溃疡性结肠炎可以是直肠炎,其中溃疡性结肠炎限于肛门和直肠内衬。溃疡性结肠炎可以是左侧结肠炎,其中结肠炎限于结肠远端到脾曲的部分,更特别是从直肠向近端延伸到脾曲的溃疡性结肠炎。溃疡性结肠炎可以是广泛性结肠炎,其中几乎整个结肠都受影响。相应地,在一些实施方案中,本公开提供一种减轻患有溃疡性结肠炎,包括直肠炎、左侧结肠炎和广泛性结肠炎的对象的炎症的方法。
溃疡性结肠炎通常进一步通过疾病的严重程度表征,如缓解性、轻度、中度或重度溃疡性结肠炎。本公开的方法可用于治疗轻度、中度或重度溃疡性结肠炎,或在缓解期的溃疡性结肠炎。例如,可将有效量的本文中提供的固体分散体、固体剂型或药物组合物给药于患有轻度溃疡性结肠炎的对象。可将固体分散体、固体剂型或药物组合物给药于患有中度溃疡性结肠炎的对象。可将固体分散体、固体剂型或药物组合物给药于患有重度溃疡性结肠炎的对象。可将固体分散体、固体剂型或药物组合物给药于患有轻度或中度溃疡性结肠炎的对象。可将固体分散体、固体剂型或药物组合物给药于患有中度或重度溃疡性结肠炎的对象。可将固体分散体、固体剂型或药物组合物给药于患有在缓解期的溃疡性结肠炎的对象。
存在许多用于评估溃疡性结肠炎的严重程度的指数,包括Mayo分数、Lichtiger分数和简单临床结肠炎活动指数(Simple Clinical Colitis Activity Index)。这些指数通常计入内窥镜分项分数(subscore),如Mayo分数或溃疡性结肠炎内窥镜严重度指数的分项分数。典型的组织学分级包括Robarts Histopathology指数和Nancy指数。可使用复合标准评估疾病严重程度,其包括一种或多种这些指数,疾病对对象的生活质量的影响、疾病活动度和程度的可测量标志物和整体疾病过程,如肠外表现、肠损伤和发作频率。
在一些实施方案中,本文所述的方法进一步包括给予第二治疗剂。第二药剂可静脉或皮下给药。在一些实施方案中,第二药剂每日一次或两次、隔天一次、每周一次、每两周一次或每三周一次给药。第二药剂可以以大约1至大约1000 mg、大约5至大约500 mg、大约10至大约350 mg、或大约50至大约200 mg的量给药。在一个实施方案中,第二活性剂口服给药并且每日一次或两次、隔天一次、每周一次、每两周一次或每三周一次以大约1至大约1000 mg、大约5至大约500 mg、大约10至大约350 mg、大约10至大约200 mg、大约10至大约100 mg、或大约20至大约50 mg的量给药。第二活性剂的具体量取决于所用的具体药剂、治疗或管理的疾病的类型、疾病的严重程度和阶段、和式(I)的化合物和共同给药于患者的任何任选另外的活性剂的量。
实施例
为了举例说明本发明的各种实施方案而给出以下实施例并且无意以任何方式限制本公开。这些实施例,与本文所述的方法一起,目前代表优选实施方案,是示例性的并且无意作为对本发明的范围的限制。本领域技术人员会想到其中的变化和其它用途,它们包含在如权利要求书的范围限定的本发明的精神内。
表征方法
使用Bruker D2 Phaser X射线衍射仪、用扫描型耦合θ/2θ进行XRPD,其中将电压设置为30 kV并将电流设置为10mA,通过Zero-Background Cup保持15 rpm的旋转,具有1.0mm的狭缝宽度和设置为1.0 mm的刀刃宽度。
使用配有TA instruments Refrigerated Cooling System 90的TA InstrumentsQ2000差示扫描量热仪进行MDSC。使用MDSC测量玻璃化转变温度(T
使用气相色谱顶空(GCHS)分析测定残留溶剂水平。例如,使用配有30m x 0.32mm, 1.8 µm, JW Scientific DB-624柱的Agilent 6890A/7694 GC/HS仪器使用以下方法参数分析样品:样品温度105℃;定量环温度110℃;传输线温度115℃;GC周期时间45 min;顶空瓶平衡时间30 min;注入定量环尺寸1 mL;顶空瓶压力时间20 sec;载气压力7 psi;和顶空瓶压力15 psi。
在配有Kinetex,C18,4.6 x 100 mm,2.6 µm柱的 Agilent 1220仪器上使用以下方法参数进行HPLC:流动相A,0.1%甲酸/水;流动相B,0.1%甲酸/乙腈;梯度95% A (0 min)、60% A (6 min)、5% A (12 min)、95% A (15.1 min),余量由流动相B组成;流速0.8 mL/min;柱温40℃;样品温度,室温;注入量5 µL;检测波长240 nm;和运行时间18.5 min。
使用带有Polaron Autocoater E5200 Au/Pd靶溅射涂布机的FEI Quanta 200SEM,用15 kV的电压、3.0 mA的束斑尺寸、2.52 A的灯丝电流和96 µA的发射电流进行SEM成像。
通过mDSC测量3-(((1S,2S,3R)-2,3-二氟-1-羟基-7-(甲基磺酰基)-2,3-二氢-1H-茚-4-基)氧基)-5-氟苯甲腈(式(I)的化合物)的熔融温度(T
式(I)的化合物的溶解度在丙酮和丙酮/H
表1
以1% H
表2
制备包含式(I)的化合物的七种聚合物分散体制剂并根据表3中提供的参数在25:75式(I)的化合物与聚合物的比率下从95:5丙酮:H
表3
在初始喷雾干燥后使用二次盘式干燥法除去残留溶剂。在这种操作中,将“湿”固体分散体加热到40℃并在对流托盘烘箱中储存26小时。在升高的温度下的二级处理从固体分散体中除去残留丙酮。使用气相色谱(GC)顶空分析测量在二次干燥后留在固体分散体中的残留溶剂。测定几种制剂中的残留丙酮远低于International Conference onHarmonization (ICH)提出的5000 ppm的丙酮限度。各固体分散体的总收率、实测T
表4
LOQ: 定量限。
通过mDSC进行的固体分散体的热分析显示,所有分散体具有单一T
使用SEM评估固体分散体的表面形态。观察到固体分散体包含具有光滑表面的完整和瘪塌球体。在固体分散体样品中没有观察到结晶材料。
在非漏槽(non-sink)溶出试验中测试固体分散体的溶出性能。使用溶出试验测量在暴露于低pH环境(SGF)30分钟后在式(I)的本体(bulk)结晶化合物在生物相关的肠道介质(FaSSIF)中的溶解度以上的药物过饱和。在该试验的过程中,将样品从SGF [理论Cmax =2000 µgA/mL]转移到FaSSIF [理论Cmax = 1000 µgA/mL]。
观察到的Cmax GB、Cmax FaSSIF、AUC FaSSIF和AUC提高提供在表5中。如表5中所示,与本体结晶原料药相比,基于HPMCAS-H、CAP和SOLUPLUS的固体分散体提供大约30倍提高的溶解药物(AUC
表5
为体内测试制备三种固体分散体制剂,包含25:75比率的式(I)的化合物 :HPMCAS-H、CAP或SOLUPLUS。所有制剂用如实施例2中所用的类似参数喷雾干燥。在初始喷雾干燥后使用二次盘式干燥法除去残留溶剂。在这种操作中,将“湿”固体分散体加热到40℃并在对流托盘烘箱中储存24小时。在升高的温度下的二级处理从固体分散体材料中除去残留丙酮喷雾溶剂。使用气相色谱顶空(GCHS)分析测量在二次干燥后留在固体分散体材料中的残留溶剂。所有三种制剂中的残留丙酮远低于International Conference onHarmonization (ICH)提出的5000 ppm的丙酮限度,HPMCAS-H和SOLUPLUS制剂小于该试验的LOQ(<200 ppm)。将CAP制剂干燥另外24小时并在重新试验后测定< LOQ。表6显示这两种制剂的残留溶剂结果。在二次干燥后进行HPLC检测和纯度分析并证实该制备法没有引入任何杂质或使式(I)的化合物降解。
表6
LOQ: 定量限。
获得Cmax GB、Cmax FaSSIF和AUC FaSSIF值并报道在表7中。与本体结晶原料药相比,HPMCAS-H、CAP和SOLUPLUS固体分散体提供10至30倍提高的溶解药物(AUC
表7
通过mDSC进行的热分析揭示,所有分散体具有单一T
通过XRPD的固态表征表明固体分散体是非晶分散体,因为在固体分散体衍射图(图3)中没有观察到结晶峰。
使用扫描电子显微术表征固体分散体粒子的表面形态。SEM图像(图4)描绘在5,000x放大率下式(I)的化合物和从左到右,HPMCAS-H、CAP或SOLUPLUS的固体分散体。观察到固体分散体包含具有光滑表面的完整和瘪塌球体。在固体分散体样品中没有观察到结晶材料。
在1重量%的1:1甲基纤维素:Tween 80溶液中在10 mg式(I)的化合物/1 mL的悬浮液浓度下评估固体分散体的悬浮稳定性。在制备后4和24小时使用SGF/FaSSIF溶出试验作为比较标准监测各固体分散体悬浮液的性能。
对于在标准给药媒介物中以10 mgA/mL制备的固体分散体制剂的悬浮液,观察在4小时内的稳定溶出性能(在室温~ 21℃下在750 rpm搅拌下储存时),这将允许在构成悬浮液后留出足够的时间进行体内给药。保持4小时或24小时的固体分散体制剂的悬浮稳定性溶出概况分别可见于表8和9。该溶出试验在SGF中以2.0 mgA/mL给药,并在转移到FaSSIF中后,减少到1.0 mgA/mL。预计该固体分散体悬浮液在给药前可保持最多4小时。
表8
表9
为了快速评估式(I)的化合物的固体分散体制剂的物理和化学稳定性,将分散体在25℃/ 60% RH和40℃/75% RH下、敞开和在含干燥剂的封闭包装中老化4周。固体分散体通过XRPD评估非晶物理状态的变化、通过HPLC评估化学纯度和通过SEM评估粒子形态。
如图5中所示,老化固体分散体样品的XRPD分析表明所有固体分散体制剂保持非晶,在4周后没有可检测的结晶材料。使用扫描电子显微术表征老化固体分散体粒子的表面形态。SEM图像揭示固体分散体由具有光滑表面的完整和瘪塌球体组成,在40/75敞开条件下的SOLUPLUS制剂除外,其看似玻璃状的附聚球体,但如通过XRPD证实,仍然是非晶的。在40/75敞开和封闭条件下都在2和4周对HPMCAS-H和CAP制剂进行老化固体分散体的纯度分析。没有检测到明显杂质。
制备式(I)的化合物和脂质媒介物的五种制剂。在60℃下用这些制剂填充0号明胶胶囊。各胶囊具有500 ± 50 mg的总重量并含有5.0 ± 0.3重量%的式(I)的化合物和大约95重量%的脂质媒介物,其选自:(1) 1:4 TPGS-1000:Gelucire 44/14;(2) 2:3 TPGS-1000:Gelucire 44/14;(3) 1:4 TPGS-1000:Gelucire 50/13;(4) 2:3 TPGS-1000:Gelucire 50/13;和(5) 1:1:1 TPGS-1000:Gelucire 44/14:Gelucire 50/13。
计算各制剂的Cmax GB、Cmax FaSSIF和AUC FaSSIF值并报道在表10中。与本体结晶原料药相比,基于2:3 TPGS-1000:Gelucire 44/14的制剂提供4倍提高的溶解药物。
表10
为体内和加速稳定性测试制备大约35个胶囊,含有在2:3 TPGS-1000:Gelucire44/14中的25 mgA(25 mg式(I)的化合物)。进行HPLC检测和纯度分析。在存在或不存在胶囊赋形剂的情况下,都没有观察到式(I)的化合物的降解。
脂质胶囊在25℃ / 60% RH(封闭)和40℃ / 75% RH(敞开或在封闭包装中)下老化4周。通过HPLC评估脂质胶囊的化学纯度变化。在40/75敞开和封闭条件下都在2和4周进行老化脂质胶囊的纯度分析,存在和不存在胶囊赋形剂。在任一条件下在4周后都没有观察到式(I)的化合物相关的降解。对于所有配置,归因于明胶的峰在4周后从0.30%总峰面积增长到0.9-1.3%总峰面积,但与TPGS-1000相关的峰在研究全程保持恒定。
在带有气动搅拌器的75L罐中装入丙酮(23.0 kg),接着装入式(I)的化合物(0.5kg)。所得悬浮液在室温下混合6分钟,此时获得清澈溶液,表明所有式(I)的化合物已溶解。然后加入HPMCAS-H聚合物(1.5 kg)并将所得溶液在室温下混合14小时。通过使用配有双流体喷嘴的SPX Anhydro MicraSpray MS-150喷雾干燥单元将该溶液喷雾干燥,除去丙酮。在闭环配置中使用以下参数完成喷雾:喷嘴,Spray Systems 2-fluid;溶剂,丙酮;总固体,2.0 kg;溶液组成,8%固体;总溶液重量,25.0 kg;雾化压力,2.5-2.8巴;喷雾速率,10.0kg/hr;入口温度,74.9-77.0℃;出口温度,42.0-42.9℃;干燥气体流速,174 kg/hr;冷凝器温度,-17.6至-17.1℃。
在Despatch 4 ft
在喷雾干燥完成后,观察到固体分散体含有静电。因此,固体分散体在MS-150干燥室中有一些积聚,但该材料仍松散并且没有团聚在一起。总收率仅为64%,可能是由于滞留在室中。在袋室内观察到极少(~100 g)固体分散体,看见在主室壁上的积聚(~400 g)并观察到在出口加工管上的适度积聚(~25 g)。
评估喷雾溶液和湿固体分散体在二次干燥前的保存时间。对保存的喷雾溶液和保存的湿固体分散体通过HPLC观察到的总杂质报道在表11中。喷雾溶液和湿固体分散体都在室温下保存该表中指示的时间。喷雾溶液稳定性数据显示每天0.05%的杂质的近似增长。湿固体分散体稳定性数据显示每天0.02%的杂质的近似增长。
表11
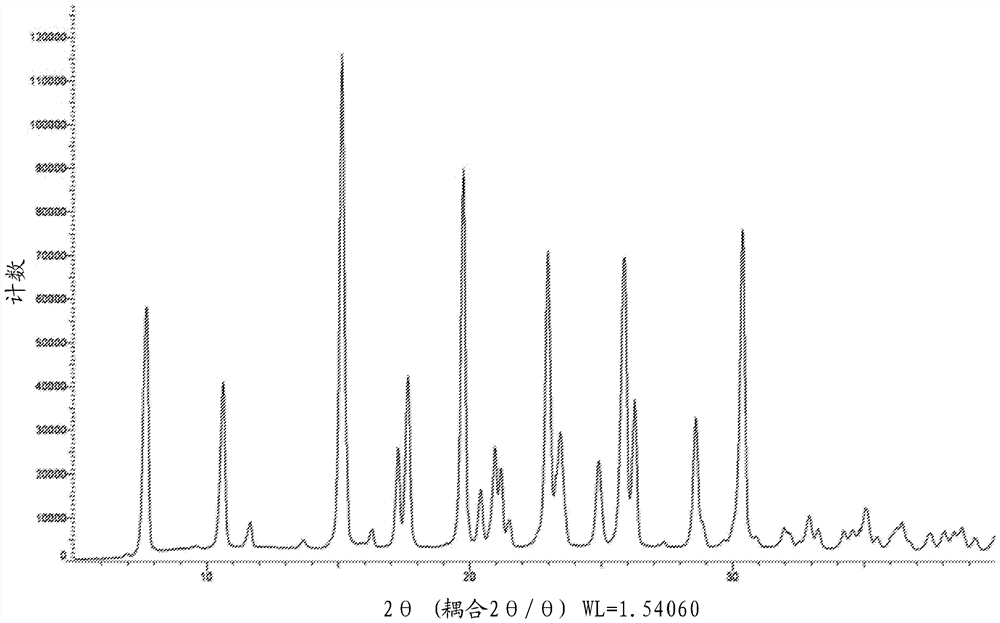
干燥固体分散体通过XRPD、mDSC、SEM、KF、残留溶剂、粒度、堆密度/振实密度和HPLC(手性和非手性)表征。图6显示固体分散体的XRPD图谱。衍射图谱不存在结晶峰并且表明该固体分散体在性质上是非晶的。水和残留溶剂的重量%的测量表明该固体分散体通过KF测得含有0.75重量% H
通过mDSC测量固体分散体的玻璃化转变温度。数据表明T
如图8中所示,在固体分散体粉末上进行激光散射以测定粒度分布。在0.7巴压力下在40%的进料速率下使用具有3 mm料斗高度的Malvern Aero S干粒度分析仪。在10秒的过程中一式三份分析样品。1.681的折射率和0.5 g/mL的密度用于使用非球面算法的分析。样品遮挡在0.1至15%之间。粒度测量显示该固体分散体表现出单峰分布并且测定平均d
也测量堆密度和振实密度。发现堆密度为0.25 g/mL且振实密度为 0.41 g/mL。流动性计算为卡尔指数44.35和豪斯纳比1.80。
通过HPLC分析固体分散体并发现含有24.6%式(I)的化合物。固体分散体(顶部线)、式(I)的化合物(中间线)和空白(底部线)的色谱显示在图9中。通过HPLC,式(I)的化合物和固体分散体表现出极小的杂质差异。也对固体分散体完成手性纯度分析,其显示式(I)的化合物的对映体过量为99.8%。
对该固体分散体检查相对湿度对T
使用动态蒸气吸附(DVS)测定固体分散体的水吸附。对分散体施以从5-95% RH的递增湿度,随后暴露于从95-5% RH的递减湿度以测定水的吸附/解吸。DVS结果表明该固体分散体适度不吸湿并在90% RH下吸附最多5.5重量% H
从喷雾干燥室中收集的滞留材料的样品通过SEM分析粒子形态、通过XRPD分析非晶特性和通过HPLC分析杂质。所有试验显示滞留室中的材料与收集的固体分散体之间的等同性,证明滞留室中的材料和收集的固体分散体可合并。
将固体分散体包装在双层LDPE袋中并置于HDPE桶中。将每批2克的固体分散体包装在双层LDPE袋中,各自用束线带捆扎(goose necked)并密封。袋装样品储存在用螺帽罩密封的75 cc HDPE瓶中。然后在ICH条件下测试包装的固体分散体的稳定性。在2-8℃、25℃/ 60% RH、或40℃ / 75% RH下储存3个月后没有观察到外观、检测(assay)、相关物质、非晶特性或热分析的有意义的变化。在40℃ / 75% RH下,湿度从在T0的0.75%增加到在3个月时的2.42%。将干燥剂添加到包装中预计防止这种湿度增加。对固体分散体收集的稳定性数据概括在表12中。
表12
将式(I)的化合物(2.25 kg)与丙酮(103.5 kg)在室温下混合15分钟直至获得清澈溶液。加入HPMCAS-H聚合物(6.75 kg)并将所得混合物混合8小时并在环境条件下保持整夜。所得溶液使用配有Spray Systems双流体喷嘴的Anhydro MS-150喷雾干燥器喷雾干燥。使用以下喷雾参数并在喷雾干燥的全程监测:入口温度,76.0 ± 20.0℃;出口温度,42.0± 5.0℃;冷却器设定点,-30.0℃;冷凝器温度,-17.0 ± 10.0℃;溶液进料速率,10.0 ±2.0 kg/hr;干燥气体流速,170.0 ± 20.0 kg/hr;雾化压力,2.5 ± 0.5巴;室压力,34cmWC;旋风分离器ΔP,150 mmWC;和袋室ΔP,70 mmWC。在喷雾干燥后,将固体分散体加载到托盘上并在40℃下干燥大约14小时。回收总共8.2 kg干燥固体分散体,其中1.3 kg来自室收集,总收率为92%。将固体分散体包装在双层4-mil LDPE袋中,在袋之间放置20个5克硅胶干燥剂包,然后放置在15 gal HDPE桶中并储存在2-8℃。
将固体分散体以2克批量包装在双层LDPE袋中,各自用束线带捆扎(goosenecked)并密封,在LDPE袋之间加入0.5克干燥剂。将各样品储存在75 cc HDPE瓶中,用螺帽罩密封。样品在2-8℃、25℃和25%相对湿度、或40℃和75%相对湿度下储存3个月,然后表征以评估固体分散体的稳定性。与时间0相比,在任何条件下没有观察到除KF轻微提高外的显著变化。通过XRPD分析没有观察到结晶。
对照批准的规范表征这批固体分散体。分析包括外观、HPLC纯度、手性HPLC纯度、KF、残留溶剂、XRPD和mDSC,列在表13中。
表13
评估式(I)的化合物和HPMCAS-H在各种溶剂组合物中的制剂的溶液粘度和沉淀行为。如表14中所示,发现在丙酮中的粘度随固体载量增加而增加。97:3丙酮/H
表14
视觉评估这三种溶液的沉淀行为。在室温下3天后没有观察到式(I)的化合物或聚合物的沉淀。由于HPMCAS-H,在3天后该喷雾溶液看起来轻微浑浊,并且当聚合物溶解时,粘度增加。
式(I)的化合物与醋酸琥珀羟丙甲纤维素HG等级(HPMCAS-H)以1:3比率(即25%载药量)配制。在97/3丙酮/H
在带有磁搅拌器的烧瓶中装入97/3丙酮/H
在配有双流体喷嘴的Buchi B-290喷雾干燥单元上完成喷雾干燥以除去丙酮/H
发现湿固体分散体收率为93%(没有计入用于稳定性分析的溶液样品)。在盘式干燥机中完成二次干燥以除去在喷雾干燥后剩余的残留丙酮和水。干燥机温度设定点为40℃并将固体分散体干燥24小时。在干燥后获得79%的干燥固体分散体收率,其没有计入用于残留溶剂分析的样品。
该固体分散体在40℃下表现出丙酮的迅速脱除。在加载到干燥机中后接近5小时,干燥完全。该固体分散体满足5000 ppm ICH Option 1丙酮限度。在24小时干燥期后,发现水含量为0.74重量%。
在喷雾干燥过程中收集关于固体分散体的另外的信息以确立喷雾溶液和湿固体分散体在二次干燥前的保存时间。表15显示在室温下保存7天后喷雾溶液和湿固体分散体中的HPLC总杂质。湿固体分散体含有~ 21,000 ppm丙酮。
表15
喷雾溶液稳定性数据没有显示杂质的变化。由这一数据确定该丙酮/H
湿固体分散体也通过XRPD和mDSC分析评估结晶。图11显示该固体分散体在室温下经过7天的XRPD图谱。如XRPD图谱证实,湿固体分散体在储存7天后保持非晶态,没有结晶的证据。如表15中报道,发现T
干燥固体分散体通过XRPD、mDSC、SEM、KF、残留溶剂、粒度和非手性HPLC表征。图12显示固体分散体的XRPD图谱。衍射图谱不存在结晶峰,因此表明该固体分散体在性质上是非晶的。
水和残留溶剂的重量%的测量表明该固体分散体通过KF测得含有0.75重量% H
通过mDSC发现固体分散体的T
如图13中所示,在固体分散体上进行激光散射以测定粒度分布。在0.7巴压力下在40%的进料速率下使用具有3 mm料斗高度的Malvern Aero S干粒度分析仪。在10秒的过程中一式三份分析样品。1.681的折射率和0.5 g/mL的密度用于使用非球面算法的分析。样品遮挡在0.1至15%之间。粒度测量显示该固体分散体表现出单峰分布并且测定平均d
HPLC检测发现固体分散体中的式(I)的化合物的浓度为25.6%。通过HPLC,式(I)的化合物和固体分散体表现出极小的杂质差异(分别为0.90%和0.92%)。
根据实施例3和8中概述的通用程序制备80克批量的固体分散体,其含有1:3式(I)的化合物:HPMCAS-H。使用这种固体分散体在单站压机上使用预压片(slug)、研磨(mill)、掺合(blend)和压缩(compress)法制备三种片剂制剂。在32.00%固体分散体载量(8%活性物)下制备片剂以提供用改良胶囊工具(~16.499 mm x 8.498 mm)在500 mg总重量下压制的40 mg活性片剂。表16、17和18概括这三种片剂制剂的组成。
表16
表17
表18
首先将各制剂压缩到半英寸扁平预压片(half-inch flat slugs)的目标固体分数(~0.7)。通过30目筛子研磨这些预压片(slugs)。加入颗粒外赋形剂并将所得混合物压缩成片剂。对于表16和18的制剂,使用大约90 MPa的压力实现15千克力(KP)的目标硬度。对于表17的制剂,使用大约150 MPa的压缩力实现类似硬度。由表16和18的制剂制成的片剂的崩解在小于1分钟内进行,而由表17的制剂制成的片剂的崩解时间为大约1.5分钟。
在大约10 KP硬度下制备另外的片剂并使用USP装置II(桨)在0.1 N HCl(900 mL)中在37℃下测试溶出。桨速在前60分钟保持在75 rpm,然后在试验的最后15分钟提高到250rpm。在各时间点提取10 mL样品并经10 µm聚乙烯过滤器过滤,然后稀释和通过HPLC分析。溶出试验没有显示这三种制剂之间的释放曲线的差异。
使用表16和18中描述的制剂制备另外的片剂以评估它们的稳定性、药代动力学(PK)和在优化介质中的溶出。遵循实施例10中描述的通用制备方法。压缩片剂表现出白色外观。使用0.7的颗粒固体分数和14 KP的目标片剂硬度(1.61 MPa拉伸强度)。在压缩后通过HPLC评估片剂的效能和总杂质(表19)。
表19
通过HPLC证实片剂的预期效能。在整体总杂质方面没有观察到制剂之间的明显差异。
测试结晶的式(I)的化合物以及1:3式(I)的化合物:HPMCAS-H固体分散体在pH 2和6.8下的典型溶出介质中的溶解度。使用900 mL介质体积与溶解度和片剂剂量强度一起计算sink factor并显示在表20中。
表20
*潜在离群值。
评估两种不同的片剂制剂——片剂制剂1(表16)和片剂制剂3(表18)中的式(I)的化合物的药代动力学(表21)。将各制剂给药于一组禁食的雄性犬(n=4/组)(即各犬接受含有40 mg式(I)的化合物的单次口服剂量)。在给药后的指定时间间隔收集血样以分析式(I)的化合物随时间经过的血浆浓度。为了对比目的,将片剂制剂1和3的药代动力学与作为混悬剂给药的固体分散体(1:3式(I)的化合物:HPMCAS-H)的药代动力学比较。
表21
平均PK参数估算值显示在表21中。式(I)的化合物的AUC
将片剂制剂1和3置于加速稳定性条件(40℃ / 75% RH)中、敞开并在2和4周测试化学纯度和效能。在加速条件下,对于片剂制剂1,在4周后观察到片剂效能从99.3%降低到96.7%,而总杂质从时间0时的1.24%增加到2.02%。对于片剂制剂3,在4周后观察到片剂效能从100.1%降低到96.2%,而总杂质从时间0时的1.25%增加到1.77%。
在0.70固体分数下以14.1 KP的片剂硬度、1.61 MPa拉伸强度预先制备片剂制剂1,40 mg活性物强度(active strength)(见实施例10和11)。这种片剂表现出33秒崩解时间。用0.6的降低的固体分数(颗粒)制备另外的片剂以虑及另外的片剂可压缩性。然后在11.6至39.7 KP片剂硬度(1.2-4.7 MPa拉伸强度)下压缩颗粒并测量崩解。这些片剂的崩解时间为大约30秒。然后通过除去所有颗粒外ac-di-sol和甘露糖醇并换成MCC来修改制剂。然后将片剂压缩到20.7 KP硬度(2.1 MPa拉伸强度)并发现崩解为27秒。颗粒内掺合物也独自压缩到17.9 KP(2.1 MPa拉伸强度)。发现颗粒内掺合物本身的崩解时间为26秒。
由于对制剂作出的小改变不起作用并且颗粒内掺合物本身的压缩表现出极快崩解,将注意力转向研究MCC的等级从PH101变成PH105对崩解时间的影响。这种改变使得固体分散体的粒度更密切匹配主要压缩助剂MCC并因此提供与粒子的更密切接触,从而提高在碾压过程中的粘合。
接着,将40 mg活性片剂——其中将片剂制剂1的PH101等级MCC换成PH105等级MCC——压缩(从固体分数为0.59的颗粒)到27 KP硬度。发现所得片剂表现出1:40分钟崩解时间和0.03%脆碎度。随着崩解时间增加,也压缩10 mg活性片剂并发现表现出10 KP硬度和2:21分钟崩解时间。
制备具有表22中提供的组成的片剂制剂4的共用掺合物,然后压缩10 mg 活性物(active)和40 mg活性片剂。为压缩选择的工具是用于10 mg的标准凹圆0.25”和用于40 mg片剂的0.2750” x 0.5500”改良椭圆。使用480克固体分散体以大约1.25 kg规模制备共用掺合物。由共用掺合物进行分份,以用于压缩10和40 mg片剂。10和40 mg活性片剂制剂的组成显示在表22中。包衣40 mg活性片剂制剂的组成显示在表23中。
表22
表23
用于制粒和片剂制备的设备的主件是具有5 L壳体的箱式掺合机(bin blender)、40目筛子、Quadro Comil U5磨机、Vector TFC Lab-Micro碾压机和Piccola-B旋转式压片机。简言之,制粒和片剂制备法包括掺合、松团(de-lumping)和碾压颗粒内组分、掺合和松团(de-lumping)颗粒外组分和压缩10和40 mg活性片剂。工艺流程图显示在图14中。
更详细地,制备方法包括以下步骤:(1) 用微晶纤维素预涂布掺合机壳体(blender shell)(在20 rpm下1 min);(2) 在涂布的掺合机中混合颗粒内成分(在20 rpm下5 min);(3) 研磨颗粒内成分(Screen 032R,4000 rpm);(4) 在掺合机中混合颗粒内成分(在20 rpm下15 min);(5) 将40目筛分的硬脂酸镁添加到掺合机中并混合(在20 rpm下4min);(6) 该混合物使用碾压机(螺杆速度40 rpm,辊速度3 rpm,压力10 mPA)制粒;(7) 使干燥颗粒状材料经过磨机(Screen 050G,2000 rpm);(8) 将研磨的颗粒转移到掺合机中,并加入除硬脂酸镁外的颗粒外成分并混合(在20 rpm下10 min);(9) 通过加入40目筛分的硬脂酸镁润滑混合物,然后混合(在20 rpm下4 min);(10) 使用带有适当工具的压片机压缩片剂(10 mg和40 mg强度)(在压缩过程中测试重量、厚度和硬度)。
使用碾压以1.25 kg规模制备共用掺合物,目标是大约0.8 g/mL的ribbon堆密度(~0.6固体分数)。在室温(大约25.2℃)下在26%的相对湿度下完成加工。研磨后,除颗粒的粒度外还测量堆密度和振实密度(表24)。
表24
颗粒内掺合物表现出最低堆密度和最高豪斯纳比。在制粒后,堆密度改进到0.5g/mL且豪斯纳比降低,表明流动改进。颗粒外赋形剂的加入没有改变颗粒的堆积性能(bulkproperties),但如较低的豪斯纳比所示,的确略微改进流动性。
粒度分布显示大多数颗粒(48.7%)保留在250-595 µm筛之间,将大部分剩余材料收集在盘中。观察到31%细粒(小于74 µm的粒子)。总收率为96.1%,总共收集1.2 kg最终掺合物。
将颗粒分为10和40 mg片剂压缩。使用949.95 g颗粒制备40 mg活性片剂。工具描述以及站数、目标填充重量和片剂硬度显示在表25中。
表25
Piccola压机在20 rpm下以5 rpm的桨速运行。将压缩力拨到15 kN,预压缩力为480-600 N。发现在运行过程中的顶出力为181 N。在压缩操作的过程中回收总共1736个片剂,91.4%收率。片剂的过程中表征显示16.9-22.8 KP的硬度范围,大多数片剂为大约20KP。片剂厚度为大约5.7-5.8 mm且重量集中于500 mg。崩解试验显示平均1:37且脆碎度为0.14%。
剩余颗粒,约为257.05 g,用于10 mg片剂压缩。Piccola压机在20 rpm下以4 rpm的桨速运行。将压缩力拨到7.5 kN,预压缩力为280 N。发现在运行过程中的顶出力为80-89N。在压缩操作的过程中回收总共1561个片剂,75.9%收率。片剂的过程中表征显示8.8-10.5KP的硬度范围,大多数片剂为大约10 KP。片剂厚度为大约3.9 mm且重量集中于126 mg。崩解试验显示平均2:04且脆碎度为0.01%。
表征片剂的外观、HPLC鉴定、检测(assay)和杂质、含量均匀度、水含量和溶出。试验结果的概要提供在表26中。
表26
片剂的外观为白色,没有观察到斑点或杂色,且通过HPLC测定的效能接近100%。总杂质类似于固体分散体中的杂质且含量均匀度符合USP标准。这两种片剂之间水含量类似。在含0.5% SLS介质的0.01N HCl(pH 2)(900 mL)中在37℃下用75 rpm的桨速进行溶出分析。在5、15、30、45和60分钟完成数据收集。在各时间点提取10 mL样品并经10 µm聚乙烯过滤器过滤,然后稀释和通过HPLC分析。图15显示10和40 mg片剂的合并溶出曲线图。
对这两种片剂强度都在15分钟内观察到完全溶出。对于所有时间点,标准偏差在1-3%之间,且RSD也为1-3%,表明在units之间溶出非常类似。溶出曲线符合关于水难溶性药物的速释剂型的USP/FDA标准,其中在30和/或45分钟后实现85%溶出。
将散装片剂包装在双层LDPE袋中,在袋之间具有SiO
在禁食和饱食犬中评估实施例12中描述的40 mg片剂的药代动力学。将制剂给药于一组禁食雄性犬(n=4/组)和饱食雄性犬(n=4/组),其中各犬只接受40 mg的单次口服剂量。在给药后的指定时间间隔收集血样以分析式(I)的化合物随时间经过的血浆浓度。平均PK参数估算值显示在表27中。
表27
剂量归一化平均AUC
评估实施例12中描述的10和40 mg活性片剂的稳定性。10 mg片剂与0.5 g SiO
表28
表29
甚至在加速储存条件下,经过6个月也没有观察到片剂的物理或化学属性的明显差异。
总检测体积为大约100 μL,配置如下:2 μL化合物在100% DMSO中,88 μL含蛋白质和探针的缓冲液和10 μL SPA珠。该化合物在由10点剂量响应组成的母板(master plate)中用3倍化合物稀释从100 μM稀释到5 nM。在96孔板上进行检测,其中被指定为高信号对照的一列含有DMSO而不含化合物,被指定为低信号对照的另一列不含蛋白。在化合物铺板前,制备由25 mM TRIS pH 7.5 (Sigma)、150 mM NaCl (Sigma)、15%甘油(Sigma)、0.15% BSA(Sigma)、0.001% Tween-20 (Sigma)、150 nM N-(3-氯苯基-4,6-t
在第1天将在180 μL生长培养基中的大约7500个786-O细胞接种到96孔白色透明底的板(07-200-566,Fisher Scientific)的各孔中。在4小时后,在生长培养基中由500xDMSO储液制备10x化合物储液的连续稀释液并将20 μL这些10x储液添加到各孔中以得到如下最终浓度(μM):20、6.67、2.22、0.74、0.25、0.082、0.027、0.009、0.003、0.001和0。各浓度一式两份铺板。在大约20小时后,通过抽吸除去培养基并向各孔供应180 μL生长培养基。将大约20 µl新鲜制备的10x化合物储液添加到各孔中。在大约24小时后,取出细胞培养基并使用购自R&D systems的ELISA试剂盒根据制造商建议的方法测定VEGF浓度。通过GraphPadPrism使用剂量响应抑制(四参数)方程式计算EC
通过用呈递由多个HIF应答元件驱动的荧光素酶基因的商业慢病毒(CignalLenti HIF Reporter (luc): CLS-007L,Qiagen)在25的感染复数(MOI)下感染786-O细胞(ATCC
在处理当天,在生长培养基中由500x DMSO储液制备10x化合物储液的连续稀释液并将10 μL这些10x储液添加到各孔中以得到如下最终浓度(μM):20、6.67、2.22、0.74、0.25、0.08、0.027、0.009、0.003、0.001和0。各浓度一式三份测试。在大约24小时后,使用ONE-Glo荧光素酶检测试剂(E6110,Promega)根据制造商推荐的程序测定荧光素酶活性。使用Dotmatics软件计算EC
在带有顶置式搅拌的50L罐中通过混合所有成分直至明显无固体,制备式(I)的化合物:HPMCAS-H在丙酮中的溶液。溶液组成和混合时间如下:
通过研究各种工艺参数和由上文制备的溶液获得的堆积性质(bulkproperties),检查式(I)的化合物的喷雾干燥分散体(SDD)的制备。在具有200 kg/hr干燥气体容量的开环式喷雾干燥机中考察以下工艺范围:
- 出口温度: 35 - 46℃
- 溶液进料速率: 340 – 455 g/min
- 计算出口相对饱和度: 7 – 11%
根据各种热力学条件和所用喷嘴尺寸,观察到所得堆积性质范围:
- 粒子D (v 0.5): 33 – 67 µm
- 堆密度: 0.16 – 0.20 g/mL。
示范批次前的主导条件(lead condition)用0.121的L:G比和42℃的出口温度制造。这些条件得到具有可接受的稳定性、性能和收率的SDD。选择以下喷雾干燥条件制备25%式(I)的化合物:HPMCAS-H SDD。
基于对示范批次生成的干燥曲线,选择使用对流盘式干燥机的以下二次干燥条件。
尽管在本文中已经显示和描述了本发明的优选实施方案,但本领域技术人员显而易见的是,这些实施方案仅作为实例提供。本领域技术人员可想到许多变化、修改和替代而不背离本发明。应该理解的是,在本发明的实践中可使用对本文所述的本发明的实施方案的各种替代方案。以下权利要求旨在限定本发明的范围并由此涵盖在这些权利要求及其等同物的范围内的方法和结构。
- 包含取代茚满的固体分散体和药物组合物及其制备和使用方法
- 抗癌茚类、茚满类、氮杂茚类、氮杂茚满类、药物组合物和用途
