癌症中紫杉类纳米乳剂与免疫疗法的联合
文献发布时间:2023-06-19 11:27:38
授权信息
本申请的研究部分得到了美国国立卫生研究院的资助(NIH资助号 CA103314、CA132396和HHSN261201500018C)。政府拥有本发明的某些权利。
技术领域
本发明涉及癌症,特别是多药耐药性癌症的治疗。更具体地,本发明涉及类紫杉醇和免疫疗法的联合治疗。
背景技术
PD-1和PD-L1抑制剂是用于治疗各种形式癌症的免疫检查点抑制剂。不幸的是,肿瘤细胞的PD-L1表达可能是与PD-1/PD-L1抑制剂的功效相关甚至可能是其必需的重要参数之一,随肿瘤类型和患者个体而异(例如参见Taube et al.,Clin Cancer Res;20(19):5064-74(2014)以及Sunshine and Taube,Current Opinion in Pharmacology,23:32-38(2015))。CTLA-4抑制剂也是检查点抑制剂,正在开发用于治疗各种形式的癌症。还已经显示出 CTLA-4表达与CTLA-4抑制剂的功效相关。
胰腺导管腺癌(PDAC)是一种致命和侵袭性疾病,在常规追踪的所有肿瘤类型中,其5年患者生存率最低(6%)。PDAC的发病率正在上升,预计到2025年将成为美国癌症相关死亡的第二大主要原因。PDAC的特征是致密的增生基质,富合成纤维细胞、细胞外基质和炎性白细胞(但是少量的浸润效应T细胞)。尽管某些组合化学疗法对PDAC越来越有效,但肿瘤反应率仍然很低,而且耐用性很差。已经证实在人类胰腺肿瘤中存在癌症引发或干细胞(CSC)作为亚群,并且这些CSC被归因于肿瘤生长、侵袭和转移以及对化学疗法和放射疗法的抵抗力。富含胶原蛋白和透明质酸的精心制作的PDAC增生性细胞外基质,严重扭曲了肿瘤内的血管和淋巴引流,导致灌注减少和间质液压力升高。因此,血管功能障碍是PDAC 的另一个标志性特性,它限制了渗透到肿瘤团块深处的癌细胞中以及将药物传递到这些肿瘤中的能力。血管功能障碍还与肿瘤内的欠佳氧气供应有关,从而导致缺氧的微环境,该环境被认为对化学疗法和放射疗法具有抵抗力,并增加了癌细胞的侵袭性和转移潜力。低氧环境中具有高度耐药性的静态细胞,这些细胞表现出CSC样的特征,因此,该干细胞亚群是有效治疗该疾病和解决临床复发的重要治疗靶标。所有这些因素串联在一起构成了设计针对PDAC的安全有效疗法的不可逾越的障碍。
大约二十年来,吉西他滨一直是PDAC化疗的主要手段。一项随机的 III期临床试验证明,吉西他滨的生活质量和中位总生存期在4.41个月至 5.65个月之间优于5-氟尿嘧啶(5-FU)。这项研究之后,已经对化疗药物与吉西他滨的各种组合进行了多项试验。不幸的是,直到最近,除少数例外,大多数这些试验都令人失望地阴性。一项新的联合疗法联合亚叶酸调节的5-氟尿嘧啶、伊立替康和奥沙利铂(FOLFIRINOX)进行了首次联合治疗,表明其总生存期显着提高,中位生存期为11.1个月。但是, FOLFIRINOX方案与明显的毒性相关,包括中性粒细胞减少、腹泻和感觉神经病,将其使用仅限于表现良好的患者。在转移性胰腺腺癌试验 (MPACT)的III期临床试验中引入了另一种新的吉西他滨方案与纳米颗粒白蛋白结合(nab)-紫杉醇
在PDAC中缺乏最佳治疗效果与初始治疗后肿瘤获得的耐药性以及 CSC种子中肿瘤的重新繁殖有关。在联合治疗方案中提供的理想药物是既能使肿瘤散发又能靶向癌症干细胞群体的药物。紫杉醇等药物的优势之一是它们靶向微管蛋白/微管、微管蛋白/微管是细胞存活必不可少的细胞基本成分;但是,可以通过上调多药耐药性(MDR)机制(例如外排泵)或微管蛋白突变来获得耐药性。因此,癌症化学疗法中的持续挑战是开发对肿瘤具有更大选择性、克服MDR、改善药理作用和降低毒性的新的细胞毒剂。
诸如DHA-SBT-1214之类的下一代分类系统可以解决这些问题。它具有几个独特的特性,使其成为独立治疗或与其他治疗手段结合使用的潜在临床疗法。DHA-SBT-1214对多种耐药性肿瘤具有活性,并且不是多种 MDR机制的底物,例如P-糖蛋白(P-gp)转运蛋白的过表达,并且该治疗可导致胰腺肿瘤完全消退,结肠癌和前列腺癌异种移植模型。 DHA-SBT-1214对紫杉醇和多西他赛的抗MDR表型耐药细胞系的效能比紫杉醇和多西他赛高2至3个数量级。其次,已证明DHA-SBT-1214下调了从三种人类结肠癌细胞系DLD-1、HTC-116和HT-29纯化的CSC中的茎相关基因。DHA-SBT-1214在患者来源的前列腺癌干细胞异种移植模型中有效,其中紫杉醇完全无效,而
为了开发DHA-SBT-1214和其他类紫杉醇作为PDAC的临床治疗药物,必须满足几个重要的考虑因素。首先,由于这些药物具有很高的疏水性,因此需要一种能够溶解分子并具有全身释放潜力的安全制剂。其次,通过酯键连接的DHA分子在水性环境中特别是在酯酶存在下易于裂解。第三,重要的是通过增强向肿瘤块的靶向递送来减少类紫杉醇的脱靶作用。根据这些要求,我们开发了一种富含ω-3的鱼油,其中含有水包油纳米乳剂,并且与使用幼稚和PPT-2人类前列腺肿瘤荷瘤小鼠的溶液制剂相比,已评估了该药物的生物分布和药代动力学。
纳米乳剂是由水包油组成的异质体系,其中使用超声波或高压均质方法将油滴减小至纳米尺寸。油滴的表面装饰有两亲分子,以降低界面张力并在水性介质存在下提供稳定性。DHA-SBT-1214可以封装在纳米乳剂的油滴中,并被酯酶保护免受水解。通过增强的渗透性和保留(EPR)效应,由于渗漏的脉管系统,用聚乙二醇(PEG)对油滴进行表面修饰可延长全身给药和被动靶向实体瘤后的循环半衰期。另外,有证据表明,富含ω-3 的油在肿瘤中的积累更高,并且在全身给药后,还可以在将类紫杉醇递送至肿瘤块中提供额外的选择性。
随着癌症免疫疗法的出现,癌症的治疗近来已显着发展。现已将检查点抑制剂(Cl)与更成熟的手术,放射疗法和化学疗法一起作为治疗癌症的基本新方法,并为许多癌症患者提供了新的治疗希望。已经批准使用 PD-1抑制剂派姆单抗
根据所提供的初步证据,NE-DHA-SBT-1214提供了独特的机会,既可以消散肿瘤,又可以杀死癌症干细胞,从而开创了与IO剂结合的前所未有的途径。NE-DHA-SBT-1214和IO疗法的组合的时间序列测定对于揭示这种组合疗法的潜在协同作用将非常重要。通过消散肿瘤并影响基质通透性,我们潜在地将抗原释放到系统中,并且通过杀死癌症干细胞,我们既释放了癌症干细胞抗原,又降低了这些细胞的再种群效应。消散肿瘤的另一个效果是您正在降低肿瘤固有的免疫抑制水平(例如,减少释放免疫抑制细胞因子和免疫抑制配体的肿瘤细胞数量)。减瘤还增强了T细胞对肿瘤间质的渗透性,由于存在增生基质,这是PDAC中的深层障碍。
仍然需要更有效的癌症治疗,并且需要增强免疫学试剂在癌症治疗中的有效性。
发明概述
本发明提供一种组合物以增强在难治性癌症(例如PDAC)中的治疗功效,包含在水包油纳米乳剂(NE)药物递送系统中配制的ω-3多不饱和脂肪酸(PUFA)-紫杉类缀合物、并联合免疫肿瘤剂(IO)。
本发明还提供一种通过下列方式来治疗癌症的方法:向需要治疗的受试者施用有效量的药物组合物,所述药物组合物包含囊封在NE药物递送系统中的PUFA-紫杉类缀合物、并联合IO剂;和治疗癌症。
附图简述
当结合附图考虑时,通过参考以下详细描述,本发明的其他优点将变得容易理解,这是容易理解的,其中:
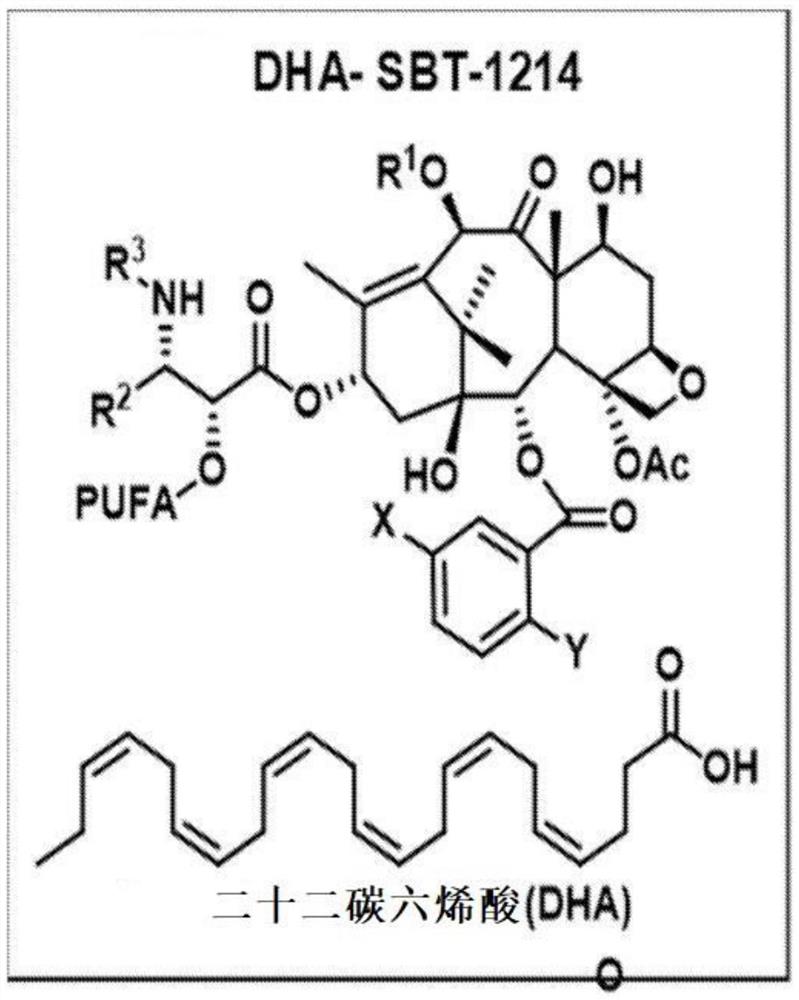
图1是分子DHA-SBT-1214的图。
图2是CFPAC-1肿瘤移植后的中位肿瘤体积的图。
图3是PANC-1肿瘤移植后的中位肿瘤体积图。
图4是Panc-02肿瘤移植后的中位肿瘤体积的图。
图5A和5B是不同抗癌剂对Panc02细胞活性的图。
图6A是纳米乳剂的透射电子显微镜(TEM),图6B示出了以nm为单位的油滴粒径的确定,图6C示出了以mV为单位的油滴上的ζ电势或表面电荷的测量,图6D显示了Panc02细胞中若丹明包封的纳米乳剂的摄取。
图7是在体外和在没有任何体内治疗的情况下响应于不同抗癌剂治疗的PD-L1表面蛋白表达的图。
图8是与Panc02小鼠肿瘤相比未处理的和IFN-γ(20ng/ml,持续4h) 的Panc02细胞的蛋白质印迹。
图9是测试治疗的肿瘤体积与时间的关系图。
图10A-10J是在收获时从不同治疗方式获得的肿瘤图像,图10A示出了用媒介物治疗的小鼠的肿瘤,图10B示出了由PD-L1(200μg)治疗的小鼠的肿瘤,图10C和图10D分别显示了来自ABRAXANE
图11是显示通过用不同组合疗法治疗引起的体重变化的图。
图12是使用RT-PCR分析的来自不同小鼠肿瘤治疗组的PD-L1的 mRNA表达的图,并且计算了相对于鼠b-肌动蛋白的RT-PCR数据的相对基因表达;
图13是使用RT-PCR分析的来自不同小鼠肿瘤治疗组的PD-1的 mRNA表达的图,并且相对于鼠b-肌动蛋白计算了RT-PCR数据的相对基因表达;
图14是使用RT-PCR分析的来自不同小鼠肿瘤治疗组的CD-4的 mRNA表达的图,并且相对于鼠b-肌动蛋白计算了RT-PCR数据的相对基因表达;
图15是使用RT-PCR分析的来自不同小鼠肿瘤治疗组的CD-8的 mRNA表达的图,并且计算了相对于鼠b-肌动蛋白的RT-PCR数据的相对基因表达;
图16是使用RT-PCR分析的来自不同小鼠肿瘤治疗组的Arginase-1的 mRNA表达的图,并且计算了相对于鼠b-肌动蛋白的RT-PCR数据的相对基因表达;
图17显示了制备的来自不同治疗组的肿瘤组织裂解物,并使用蛋白质印迹分析了不同蛋白质的蛋白质水平。
图18A-18J显示了从对照和不同组合治疗的小鼠中收集的Panc02诱导的肿瘤组织的组织病理学评价(苏木精和曙红染色),图18A未处理,图 18B是PD-L1,图18C是ABRAXANE
图19A-19J显示了通过免疫组织化学分析的浸润CD4细胞,图19A 是未处理的,图19B是PD-L1,图19C是ABRAXANE
图20A-20J显示了通过免疫组织化学分析的浸润CD8细胞,图20A 是未处理的,图20B是PD-L1,图20C是ABRAXANE
图21A-21J显示了通过免疫组织化学分析的浸润PD1细胞,图21A是未处理的,图21B是PD-L1,图21C是ABRAXANE
发明详述
本发明总体上涉及用于治疗癌症的组合物。组合物优选是在水包油纳米乳剂(NE)药物递送系统中配制的ω-3多不饱和脂肪酸(PUFA)-紫杉类缀合物、并联合免疫肿瘤剂(IO)。优选实施方案是NE-DHA-SBT-1214,其中PUFA-紫杉类缀合物是DHA-SBT-1214(它的结构如图1所示)并联合抗PD-L1抗体。
术语″第二代紫杉类″将用于指代第一代紫杉烷,例如紫杉醇(紫杉醇) 和多西他赛(紫杉烷),其中(i)C-3′-苯基被烯基或烷基取代(ii)C-10 的位置被某些酰基修饰,而C-3′N的位置是t-Boc。术语“PUFA-紫杉类缀合物”将用于指在C2′位置与多不饱和脂肪酸(PUFA)共轭的紫杉烷。PUFA- 紫杉类缀合物的特征在于它们能够优先积累在肿瘤中并停留很长时间,同时表现出令人印象深刻的功效,尤其是对多药耐药肿瘤(Ojima,I., Taxoid-Fatty Acid Conjugates and Pharmaceutical Compositions Thereof for Treatmentof Cancer″,美国专利7,820,839 B2,10/26/2010)。
术语″纳米乳剂″(NE)将用于指平均液滴直径为50至1000nm的水包油乳液,其中直径>200nm为优选。优选的NE油相如授予Amiji等人的美国专利申请公开US20070148194中所述制备。使用富含ω-3脂肪酸的食用油,例如鱼油或亚麻籽油。可以使用其他油,例如但不限于松子油、红花油、月见草油、黑加仑子油、琉璃苣油、小麦胚芽油、嘉亚油、麻油、紫苏油、葡萄油、角鲨烯油和真菌油。油滴用表面活性剂改性,所述表面活性剂包括含磷脂(例如
如本文所用,术语″免疫肿瘤剂″或″IO剂″是指靶向身体的免疫系统以提供对癌症的反应的任何试剂。许多癌细胞具有与肿瘤相关的抗原,这些抗原可以被人体的免疫系统识别,并且这些抗原可以作为主动免疫疗法的靶标。被动免疫疗法可以增强人体现有的抗肿瘤反应。免疫系统的重要作用是保护人体免受恶性细胞的增殖。免疫调节被越来越多地视为治疗许多癌症的关键。几种新的癌症免疫疗法已获得监管部门的批准,还有许多其他药物正在开发中。尤其是,在许多不同类型的癌症的多变量分析中,无论采用何种疗法,免疫浸润的程度以及效应T细胞与调节性T细胞的比率均已显示出是可靠的预后因素。免疫浸润水平高的癌症通常进展较慢。现在正在验证方法的可重复性免疫浸润定量。
已知几种免疫抑制途径可防止T细胞有效浸润恶性肿瘤和/或抑制浸润淋巴细胞的功能。这些途径包括(1)功能障碍性抗原呈递细胞的产生; (2)免疫系统朝着Th2反应极化,这是癌症免疫排斥反应效率较低的途径;(3)诱导免疫调节细胞,如调节性T细胞和髓样抑制细胞。(4)诱导或分泌免疫抑制细胞因子,例如IL10和转化生长因子(TGF);(5) 诱导T细胞无反应或T细胞衰竭。可能延迟或阻止宿主对肿瘤细胞的应答,使肿瘤进展并最终杀死患者的这种免疫抑制途径,对安全、有效和适当实施靶向免疫调节性癌症疗法提出了高度复杂的诊断和治疗挑战。另外的困难是这些免疫抑制途径可能是由功能性抗肿瘤免疫反应诱导的。
通过调节阳性和阴性调节途径来增强抗肿瘤免疫应答的药物在肿瘤学中变得越来越重要。从效应T细胞亚群“消除刹车”的检查点抑制剂可以介导许多不同癌症中的重要临床活性。结合多种免疫检查点抑制剂或T细胞激动剂的某些组合免疫疗法在临床试验中显示出更大的活性。
缀合物中的PUFA优选是二十二碳六烯酸(DHA)(C-22),但也可以是二十碳五烯酸(EPA,C-20)或α-亚麻酸(LNA,C-18)。
本发明包括PUFA-紫杉类缀合物的制剂,其如在Amiji等人的美国专利申请公开US20070148194(2007)中公开的那样被包封在NE中的纳米颗粒中,其全部内容并入本文。或者,可以将任何类紫杉醇或类紫杉醇的组合封装在NE中,包括但不限于授予Ojima的美国专利号7,820,839中描述的任何PUFA-类紫杉醇缀合物,以及在Ojima I和Das M(2009)中描述的类紫杉醇,两者均全文并入本文。
可以作为NE制剂包括在本发明中的其他类紫杉类包括但不限于 paclitaxel、多西他赛、SBT-1213、SBT-12854、SBT-121303、SBT-1216、 SBT-11033、SBT-121313、SBT-121602、卡巴他赛、SBT-1212、SBT-1217、 SBT-1102、SBT-1103、SBT-1104、SBT-1106、SBT-1107、SBT-121301、 SBT-121302、SBT-121304、SBT-121403、SBT-11031、SBT-11032、SBT-11034、 SBT-12851、SBT-12852、SBT-12853、SBT-12855、SBT-12851-1、 SBT-12851-3、SBT-12852-1、SBT-12852-3、SBT-12853-1、SBT-12853-3、 SBT-12854-1、SBT-12854-3、SBT-12855-1和SBT-12855-3(Ojima,et al., 2009)。还包括PUFA-缀合的第二代紫杉类,包括但不限于DHA-paclitaxel (Bradley,et al.,2001)、DHA-多西他赛、DHA-SBT-1213、DHA-SBT-1103、 DHA-SBT-1104、DHA-SBT-1216、LNA-SBT-1213、LNA-paclitaxel、LNA- 多西他赛、DHA-卡巴他赛和LNA-卡巴他赛,其中LNA=α-亚麻酸。同样,可以使用上述任何第二代紫杉类的DHA或LNA酯。本领域技术人员可以容易地制备这样的酯。在指定的参考文献中可以找到它们的配方和有效性的工作实例,其全部内容并入本文。
IO剂是利用个体的免疫系统攻击和治疗癌症的药物,并且最优选为抗PD-L1抗体。但是,也可以使用任何其他IO剂,例如但不限于抗-PD-1抗体、ipilumumab(CTLA-4抑制剂)、纳武单抗(PD-1检查点抑制剂)、派姆单抗(PD-1检查点抑制剂)、阿特朱单抗(PD-L1检查点抑制剂)、pidiluzumab、德瓦鲁单抗、抗-CD47抗体、吲哚胺(2,3)-双加氧酶抑制剂、抗-GD2抗体、阿仑单抗、奥法木单抗、利妥昔单抗或细胞因子类(干扰素-oc、干扰素-b、干扰素-γ或白介素(1-36)。
本发明提供了一种治疗癌症的方法,该方法通过向需要治疗的受试者施用有效量的药物组合物,所述药物组合物包括与NE药物递送系统一起包封的PUFA-紫杉类缀合物与IO剂的组合,并与IO剂结合使用。组合作用由PUFA-紫杉类缀合物增加肿瘤微环境中PD-L1表达的能力驱动,并引起CD4+和CD8+肿瘤浸润淋巴细胞的增加。以前已经证明,肿瘤微环境中的这些变化通常会使患者对I/O剂的反应更加敏感。
以本文的方法治疗的癌症可以是任何类型的癌症,例如但不限于乳腺癌、卵巢癌、肺癌、头颈癌、结肠癌、直肠癌、胰腺癌、黑素瘤、脑癌、前列腺癌、白血病、肉瘤、甲状腺癌、非霍奇金淋巴瘤、膀胱癌、神经胶质瘤、子宫内膜癌和肾癌。PUFA-紫杉类缀合物可以是本文所述的任何一种,尤其是DHA-SBT-1214。由于PUFA-紫杉类缀合物被包裹在NE中,因此它被人体吸收,并且DHA的裂解比常规递送方法更有效。IO剂优选是抗PD-L1抗体,但是可以是上述的任何IO剂。当施用抗PD-L1时,该方法进一步包括上调PD-L1的步骤。
DHA缀合的SBT-1214(图1)对小鼠中高度耐药的肿瘤异种移植物具有显着的功效,其中DHA缀合的紫杉醇
在图2中,该实验比较了使用240mg/kg或300mg/kg总剂量的人 CFPAC-1胰腺肿瘤异种移植物DHA-SBT-1214的紫杉醇、DHA-紫杉醇和 DHA-SBT-1214的疗效非常有效,导致完全回归并分别治愈5分之5或4 分之4。与赋形剂相比,紫杉醇和DHA-紫杉醇的效果要差得多,只有很小的肿瘤生长延迟。SBT-1214(120mg/kg总剂量)表现出优于紫杉醇的结果,六只小鼠中有六只的肿瘤消退,尽管只有六分之一的患者被治愈,并且比DHA-SBT-1214毒性更高,显示出在第20天之前体重减轻很小 (<4%),而DHA-SBT-1214的体重减轻总剂量为240mg/kg或300mg/kg 可以忽略不计。
在图3中,该实验使用RPAN SCID小鼠中的人PANC-1胰腺肿瘤异种移植物对紫杉醇和DHA-SBT-1214的q7dx3和q3dx3时间表进行了比较。结果表明,这两种方案在该人胰腺肿瘤异种移植中均非常有效(肿瘤生长延迟>90天)。DHA-SBT-1214的MTD似乎是240mg/kg总剂量(80mg/ kg x 3注射剂量=240mg/kg),在300mg/kg总剂量下发生了一次中毒死亡。接受DHA-SBT-1214的所有小鼠均达到CR,基本上已治愈。紫杉醇的疗效较弱,在q7dx3方案中肿瘤生长延迟为18天,在q3dx3方案中肿瘤生长延迟为13天,且无CR。
所开发的纳米乳剂(NE)技术简单,通用且可临床翻译,是由富含PUFA的食用油在水中分散并由两亲性磷脂单层稳定而成的胶体载体。这些NE的流体动力学直径小于200nm,可以在油相的高体积分数中掺入大量疏水性药物,并且适合全身和口服给药。NE是用于药物掺入的高度灵活的载体,完全由通常被认为是安全(GRAS)的材料组成,具有高度良好的安全性并适合使用高压均质器进行大规模GMP生产,这对于快速临床采用具有重要优势。
与较早的制剂相比,本发明中的纳米乳液的改进之一是如何吸收细胞。细胞通过脂质双层的被动扩散来吸收传统制剂。相反,纳米乳剂被受体介导的内吞作用吸收,绕过P-糖蛋白/mdr-1介导的药物流出。进入细胞后,紫杉醇和脂肪酸尾部之间的酯键断裂,导致活性化合物释放。申请人已经成功配制了NE-DHA-SBT-1214,其浓度高达30mg/ml,而在
下面描述了在两个人胰腺肿瘤模型中使用DHA-SBT-1214进行实验的结果(图2和图3)以及在患者来源的CSC模型中的概念验证。 DHA-SBT-1214临床前活性的引人注目的方面是它对CSC的影响。高度可塑性的CSC是治疗难治性肿瘤的重要新药靶标。通过开发专门针对CSC (或除肿瘤细胞之外还针对CSC)的药物,可能会产生更持久的临床反应。除了在细胞培养物中先前描述的细胞毒性测定法外,还从选自干细胞特征性CD133
在关于DHA-SBT-1214和前列腺癌干细胞的研究中,申请人先前确定低浓度的DHA-SBT-1214(0.1-1mM)会导致在致敏性培养条件下维持的高度致瘤性和高度耐药性的前列腺CD 133
除了评估在富含CSC的PDAC模型中的功效外,还在C56BL/6小鼠皮下(subQ)Panc-2同基因胰腺癌模型中检查了NE-DHA-SBT-1214与靶向PD-L1免疫检查点抑制剂的抗体的疗效。移植Panc-2细胞后,通过静脉内施用媒介物(作为对照)、吉西他滨(120mg/kg),
每周注射3组对照和测试制剂后,测量肿瘤体积变化并在处死时切除肿瘤。如图4所示的结果表明,NE-DHA-SBT-1214组在25mg/kg和10mg /kg联合抗PD-L1抗体的情况下,肿瘤生长抑制作用明显更大(p<0.05)。与NE-DHA-SBT-1214相反,最佳剂量的
参考以下实验实施例进一步详细描述本发明。提供这些示例仅出于说明的目的,除非另有说明,否则它们不意图构成限制。因此,本发明决不应解释为限于以下实施例,而是应解释为涵盖由于本文提供的教导而变得显而易见的任何和所有变型。
实施例1
材料和方法
SBT-1214的二十二碳六烯酸缀合物(即DHA-SBT-1214)是由 ChemMasterInternational,Inc.(Stony Brook,NY)按照先前报道的方法合成的。特级纯ω-3富含鱼油的鱼油购自Jedwards International(马萨诸塞州昆西)、Lipoid E80(购自Lipoid GMBH(德国路德维希港))、DSPE PEG2000(购自Avanti Polar Lipids,Inc.)、Tween 80(购自Sigma Chemicals, Inc.(St.Louis,MO))、来自赛默飞世尔(Thermo Scientific)(伊利诺伊州罗克福德)的Dulbecco改良型Eagle培养基(DMEM)和LAL生色内毒素定量试剂盒。青霉素、链霉素和胰蛋白酶购自Invitrogen(美国纽约州格兰德岛)。雌性C57BL/6小鼠(4-6周大)购自Charles River Laboratories (Frederick研究模型设施-NCI)(美国马萨诸塞州剑桥)。来自密理博(爱尔兰科克)的Amicon Ultra-0.5ml离心过滤器。所有其他分析级试剂均通过Fisher Scientific购买。在本研究中,我们使用了吉西他滨(GEM)、紫杉醇(PTX)和ABRAXANE
纳米乳剂制剂的制备和表征
纳米乳剂制剂的制备是按照最近报道的经过完善的方案进行的,并进行了一些修改。代替超声处理方法,通过高压均化方法制备水包油纳米乳剂。
细胞培养
与C57BI/6小鼠同系的鼠类胰腺癌细胞系Panc02是来自内华达州奥马哈市UNMC的Michael A.Hollingsworth教授的礼物。Panc02细胞在75 cm
纳米乳剂摄取和细胞分布的体外评估
将Panc02细胞(0.5×10
细胞活力研究
为了观察不同药物和纳米乳剂的细胞毒性作用,将5000个细胞接种在96孔板的每个孔中,在37℃,含有5%CO
暴露于不同治疗药物后PD-L1的表达
将细胞以0.5×10
免疫印迹
细胞和肿瘤组织用磷酸盐缓冲盐水(PBS)洗涤两次,并在含有2%蛋白酶抑制剂的冰冷裂解缓冲液中裂解(均购自美国密苏里州圣路易斯的 Sigma-Aldrich Co.)。用细胞刮刀回收细胞,搅拌并在冰上孵育15分钟。用超声仪在冰上将小鼠肿瘤组织超声处理10秒。离心裂解物,收集上清液,并使用Bio-Rad蛋白质测定法(Bio-Rad Laboratories,Hercules,CA, USA)测定蛋白质浓度。用裂解缓冲液稀释上清液以产生相等浓度的蛋白质。将五十微克蛋白质在4-12%Bis-Tris凝胶上分离,并使用iBIot Dry Blotting System(均来自LifeTechnologies)根据制造商的规程转移到硝酸纤维素膜上。在室温下用1%的干奶在TBS-T[10mM Tris-HCl(pH 8.0), 150mM NaCl,0.1%Tween-20v/v]中封闭印迹1小时,然后用TBS-T洗涤一次。将膜与TBS-T中的抗PD-L1(来自Abeam)、PD-1、F4/80和Histone 3(均来自Cell Signaling Technology,Inc.)抗体在4℃孵育过夜(稀释比例为1∶1,000)。在TBS-T中清洗3次后,将膜与第二抗兔和小鼠IgG抗体(Life Technologies)在TBS-T中(稀释度为1∶10,000)一起在室温下孵育1小时。使用蛋白质印迹法(ECL Prime;英国白金汉郡的GEHealthcare UK Ltd.)检测免疫复合物。
实时聚合酶链反应(RT-PCR)
如前所述,使用实时PCR测定其他蛋白的PD-L1和mRNA的表达水平。从胰腺癌细胞(Pan02)或肿瘤组织中取出用于mRNA分离的样品。使用市售的RNA提取试剂盒根据提到的方案(Thermo Fisher Scientific(伊利诺伊州罗克福德)提取总mRNA。分离出的RNA储存于-80℃直至用于实时PCR;在后者中,使用商业cDNA合成试剂盒将1pg提取的RNA反转录(Thermo Fisher Scientific(伊利诺伊州罗克福德))。然后将所得的 cDNA用Applied Biosystems
体内研究-皮下肿瘤的诱导和生长
严格按照美国国立卫生研究院实验室动物的护理和使用指南(IACUC)中的建议,通过东北大学机构动物护理和使用委员会批准的研究方案,进行所有涉及动物使用的实验。简而言之,在充分繁殖后,将 Panc02鼠胰腺癌细胞重悬于1∶1 PBS/Matrigel中,并将2×10
体内单药和联合疗法
针对PD-L1的小鼠抗体(10F.9G2)和相关的同种型IgG对照购自Bio X Cell。每只小鼠每周两次通过IP注射200微克针对PD-L1的抗体和相关的同种型IgG对照,持续3周。每周一次腹膜内注射吉西他滨溶液和120mg /kg的阿巴西烷。每周一次通过静脉注射紫杉醇120mg/kg和 NE-DHA-SBT-121410mg/kg或25mg/kg。所有化学疗法药物要么联合注射抗PD-L1抗体,要么注射同种型IgG对照。每个实验总共进行了三种处理。
肿瘤组织的组织学和免疫组织化学(IHC)分析
使用苏木精和曙红(H&E)染色在甲醛固定和石蜡包埋的肿瘤组织上进行小鼠肿瘤负荷的组织学分析。IHC在石蜡包埋的组织切片上进行 PD-1、CD4和CD8抗体的检测。所有针对PD-1、CD4和CD8的小鼠特异性抗体均购自细胞信号技术。根据协议处理IHC,并从细胞信号技术推荐稀释。
统计分析
所有结果均表示为平均值±SD。为了进行治疗实验,每个治疗组分配了三只小鼠。使用GraphPad Prism 6软件进行统计分析。使用不成对的学生t检验分析数据,ANOVA及其差异被认为在p<0.05时具有显着性。
结果
DHA-SBT-1214纳米乳剂制剂的表征
纳米乳剂递送方法在申请人的先前研究中显示出增强的治疗潜力。在这项研究中,申请人已经配制了DHA-SBT-1214的水包油纳米乳剂,这是一种新一代紫杉烷,它使用的鱼油富含PUFA,例如ω-3和ω-6脂肪酸。紫杉醇包封的纳米乳剂用于研究其在胰腺癌临床前小鼠模型中与免疫检查点抑制剂联合使用的疗效。申请人已经使用高压均质技术来配制这种均匀的、乳白色的和稳定的纳米乳剂。如图6A-6D所示,如通过光散射和透射电子显微镜(TEM)观察到的,纳米乳剂液滴的形态接近球形,平均直径为约220nm。荧光显微镜图像显示蓝色(核),红色(若丹明包裹的纳米乳剂)和叠加图像为紫色。图像以63倍放大倍数拍摄。图像比例尺为 100pm。除了粒径之外,纳米乳剂的均匀性和电荷还可以预测其生物利用度。均匀性由多分散性指数(PDI)表示,PDI的较低值(<0.2)表示纳米乳剂的形式均匀且稳定。包封的纳米乳剂的PDI值小于0.1。纳米乳剂中油滴的平均表面电荷为-28.9mV(图6C)。纳米乳剂的负电荷可能归因于用于制备这些纳米乳剂的鱼油中游离脂肪酸的存在。
HPLC测定法用于确定纳米乳剂中的药物浓度。20mg/ml的 DHA-SBT-1214纳米乳剂的载药效率为97%。纳米乳剂的这种高药物包封效率归因于药物的相对亲脂性,因为该药物保留在纳米乳剂的油核中。所有制剂都通过0.2微米过滤器过滤,并在贮藏期间通过Am变形细胞溶血产物(LAL)测定证实具有最低水平的内毒素。
Panc02细胞中DHA-SBT-1214制剂的体外评估
为了检查Panc02细胞中是否存在纳米乳剂,将罗丹明封装到纳米乳剂中并进行了共聚焦显微镜研究。在若丹明2mM温育不同时间点后,观察到若丹明包封的纳米乳剂制剂的最佳细胞和球体摄取(图6D)。如图6D 所示,图像清楚地表明,纳米乳剂确实有效地将包封的染料递送到细胞中,并且若丹明纳米乳剂处理的细胞在增加的时间点处荧光信号的增加表明 Panc02细胞具有更高的细胞内摄取。由于通过细胞摄取实验证实了纳米乳剂制剂的内在化,我们在纳米乳剂制剂中用DHA-SBT-1214代替了罗丹明,并与不同的抗癌药物比较了其对细胞生存力的影响。
使用MTT测定法在Panc02细胞中检查了不同抗癌药物的细胞杀伤效率。除了空白纳米乳剂或媒介物对照外,根据先前的SBT-1214
Panc02细胞药物治疗后PD-L1表达的评估
将Panc02细胞在溶液和纳米乳剂中分别用吉西他滨、Abraxane
联合药物和抗PD-L1抗体疗法的体内评价
申请人已经检查了单独的或组合的不同抗癌剂对阻断针对PD-L1的抗体对Panc02诱导的体内肿瘤生长的作用。将Panc02细胞直接注入皮下,一周后测量肿瘤体积,并持续到实验结束。在肿瘤大小达到大约100mm
抗癌药物诱导Panc02肿瘤模型体内PD-L1表达
研究抗癌剂如何诱导胰腺癌肿瘤组织中PD-L1、PD-1、CD4、CD8和 Arginase-1mRNA表达,通过RT-PCR确定单独或组合使用免疫检查点抑制剂的PD-L1、PD-1、CD4、CD8和精氨酸酶-1的mRNA水平。与它们各自的IgG对照组相比,所有抗癌药物中联合治疗的PD-L1mRNA水平均上调,如图12所示。但是,在抗PD-L1加抗癌剂中,PD-1和CD4 mRNA 水平较低,除了吉西他滨,与其IgG处理组相比,吉西他滨没有显着较高,如图13和14所示。与它们的IgG处理组相比,当与免疫检查点抑制剂组合时,响应于所有抗癌剂的组合处理,CD8 mRNA水平上调,分别如图 15所示。但是,如图16所示,IgG处理组的Arginase-1水平明显高于其免疫检查点抑制剂。除上调PD-L1 mRNA表达水平外,将抗癌药与免疫检查点抑制剂联合使用也可提高PD-L1蛋白表达水平,如图17所示。数据代表至少3个独立实验的平均值±标准差;*p<0.05,**p<0.01。与PD-L1 蛋白表达相似,PD-1表达也被上调,只是NE-DHA-SBT-1214的剂量高于其IgG治疗组。较高的PD-L1蛋白水平可能归因于该较高剂量的 NE-DHA-SBT-1214治疗组中巨噬细胞的存在,这很明显是由于图17中F4 /80的蛋白水平较高。
Panc02肿瘤中CD4+、CD8+和PD-1细胞的浸润
然后,申请人在第21天通过组织学(图18A-18J)和免疫组织化学(图 19A-19J,20A-20J和21A-21J)检查了CD4+、CD8+和PD-1细胞在肿瘤组织中的浸润。来自不同治疗组的肿瘤组织组织学显示,与来自其他治疗组的实体肿瘤块相比,来自NE-DHA-SBT-1214治疗组的肿瘤具有更少的致密基质(图18A-18J)。图像以63倍放大倍数拍摄。
在未经处理的对照肿瘤组织中,发现相对少量的CD4+细胞。与未治疗的肿瘤相比,通过抗PD-L1治疗和不同的抗癌剂联合治疗,CD4+细胞的浸润显着增加(图19A-19J)。
在对照肿瘤组织中仅观察到少量CD8+细胞浸润。用抗PD-L1抗体与 NE-DHA-SBT-1214组合治疗在肿瘤微环境中导致CD8+细胞浸润的显着增加(图20A-20J)。在每个不同的治疗组中,胰腺肿瘤核心中CD8+细胞的浸润可能是抑制肿瘤生长的原因。然而,PD-1在T细胞上的表达在所有治疗组之间是可比的(图21A-21J)。
讨论
胰腺癌由于对常规抗癌剂产生抗性而仍然是一种难治的疾病。当前,由于免疫检查点抑制剂的成功应用和新一代过继细胞转移疗法(例如嵌合抗原受体(CAR)T细胞疗法)的成功,在许多治疗方案中人们对免疫疗法的潜力充满了热情。但是,在许多类型的肿瘤中,尤其是在某些实体瘤 (例如PDAC)中,免疫检查点抑制剂作为单一治疗方案使用时均未显示出令人满意的结果。因此,为了提高应答率和功效,人们在有效结合基于免疫和非免疫的癌症疗法方面进行了广泛的努力。
对于PDAC患者,吉西他滨与ABRAXANE
与紫杉醇相反,一种名为SBT-1214的新一代紫杉醇对表现出MDR表型的耐药癌细胞具有出色的活性。在先前的研究中,通过EPR效应,DHA 缀合的SBT-1214通过增加肿瘤部位的药物蓄积来改善治疗效果。为了进一步提高DHA-SBT-1214的功效,申请人成功地配制和研究了鱼油液滴中含有DHA-SBT-1214的纳米乳剂载体体系,该体系有利地用作药物储库。该胶体系统具有所需的粒度和ζ电位,以保持制剂的体外稳定性并增强其体内性能。DHA-SBT-1214纳米乳剂的表面形态为球形、无可见的药物晶体。定性的细胞摄取分析表明,该纳米乳剂制剂在Panc02细胞中被有效地内化。这表明纳米乳剂确实有效地将有效载荷递送至细胞中的亚细胞部位,并且比其药物溶液更有效。在我们最近的研究中,申请人观察到,当 DHA-SBT-1214以纳米乳剂形式给药时,在更大程度上抑制了肿瘤的生长,强调了其在作为独立疗法使用时具有更高的治疗功效。总之,本项研究的申请人数据表明,DHA-SBT-1214缀合物的纳米乳剂可诱导优异的消退和抑制肿瘤生长,并且具有作为新型抗癌药物的潜力。
在当前的研究中,申请人探索了免疫疗法和抗癌药联合治疗胰腺癌的功效。如先前报道,紫杉醇、ABRAXANE
据申请人所知,这是第一个研究抗癌药联合检查点抑制剂对同基因胰腺癌小鼠模型中PD-L1表达的影响的研究。尽管在先前的研究中已经讨论了化学治疗剂对PD-L1表达的影响,但发现存在矛盾。例如,三项研究表明抗癌剂上调了表面PD-L1的表达,而一项研究则报告了下调了表面 PD-L1的表达。例如,Gong等人报道紫杉醇在两种不同的癌细胞模型中诱导PD-L1表面蛋白和mRNA表达。同样,Peng报告说,紫杉醇、吉西他滨或卡铂治疗通过NF-kB信号增强了卵巢癌细胞系中PD-L1的表达。相反,Ghebeh等人报道,阿霉素可下调乳腺癌细胞中PD-L1的表面表达,并上调PD-L1的核表达。这些先前研究之间差异的一种可能解释,可能是由于每个研究中所使用的细胞系和抗癌剂的差异。
在本研究中,申请人使用ABRAXANE
Freeman等人报道了PD-L1减少了T细胞增殖,但是,申请人发现在抗PD-L1抗体处理后,肿瘤浸润细胞的数量增加了。通过阻断PD-1/PD-L1 途径,IFN-γ的增加已在包括癌症免疫力在内的多种模型中得到证实,包括慢性感染性疾病,除了癌症免疫力。用抗PD-L1抗体治疗增加了PD-L1 的表达,这可能是由于产生IFN-γ的CD8+细胞向肿瘤组织的浸润增加所致。抗PD-L1抗体处理后PD-L1 mRNA和蛋白水平上调的另一个可能原因是募集也表达PD-L1的巨噬细胞和髓样来源的抑制细胞(MDSC)。肿瘤组织中CD8+细胞浸润增加的IFN-γ可能有助于抗肿瘤作用,因为长期来自效应T细胞的大量IFN-γ表达可以诱导炎性细胞如M1巨噬细胞的浸润,从而增强抗肿瘤免疫性。肿瘤微环境中的巨噬细胞过表达精氨酸酶-1,表明除了可能存在MDSC外,这些巨噬细胞还是M1。因此,可以想到,抗PD-L1抗体对肿瘤生长的抑制作用可以主要由NE-DHA-SBT-1214组合治疗组中的肿瘤浸润效应细胞数量增加来解释。换句话说,在未经治疗的组中,PD-L1可能通过减少产生IFN-γ的T细胞和M1巨噬细胞的浸润而减弱该癌症模型中的肿瘤免疫力。在体外进行IFN-γ处理后,注入小鼠体内以形成胰腺肿瘤的相同细胞表达了非常高水平的PD-L1。在申请人的研究中,PD-L1阻断后,肿瘤浸润性CD4+ T细胞的数量并未减少。两者合计,结果表明,PD-L1阻断剂可通过NE-DHA-SBT-1214的协同作用降低胰腺肿瘤负荷。此外,来自不同治疗组的肿瘤组织的组织学表明,与来自其他治疗组的实体瘤相比,来自NE-DHA-SBT-1214治疗组的肿瘤具有较少的致密基质。然而,除NE-DHA-SBT-1214外,最常用的抗癌药的单一疗法和联合疗法出乎意料地没有显示出附加的抗肿瘤作用。 NE-DHA-SBT-1214更好功效的一种可能解释是,与其他抗癌药相比,它在治疗癌症干细胞中的作用。
结论
总而言之,申请人的结果表明,通过阻断与NE-DHA-SBT-1214组合使用的PD-L1,可以显着抑制肿瘤。PD-L1的阻滞增加了肿瘤内产生IFN-γ的T细胞和炎性巨噬细胞的浸润,这直接导致了抗肿瘤作用。相比之下, PD-1和PD-L1的水平在常用的抗癌剂组合中都很高,强调了Treg细胞的肿瘤浸润增加,这可能是非抗肿瘤作用的主要原因。
在整个申请中,作者和年份引用了包括美国专利在内的各种出版物,并且专利引用了编号。下面列出了出版物的完整引用。这些出版物和专利的全部公开内容通过引用结合到本申请中,以便更全面地描述本发明所属的技术水平。
已经以说明性的方式描述了本发明,并且应当理解,所使用的术语旨在具有描述性词语的性质,而不是限制性的。
显然,根据上述教导,可以对本发明进行许多修改和变化。因此,应当理解,在所附权利要求的范围内,可以以不同于具体描述的方式来实践本发明。
参考文献
1.Siegel RL,Miller KD,Jemal A.Cancer statistics,2015.CA Cancer J Clin2015;65:5-29.
2.Semenas J,Allegrucci C,Boorjian SA,Mongan NP,Persson JL. Overcomingdrug resistance and treating advanced prostate cancer.Curr Drug Targets 2012;13:1308-23.
3.Ni J,Cozzi P,Hao J,Duan W,Graham P,Kearsley J,Li Y.Cancer stemcells in prostate cancer chemoresistance.Curr Cancer Drug Targets 2014;14:225-40.
4.Mazur PK,Siveke JT.Genetically engineered mouse models ofpancreatic cancer:unravelling tumour biology and progressing translationaloncology.Gut 2012;61:1488-500.
5.Dorado J,Lonardo E,Miranda-Lorenzo I,Heeschen C.Pancreatic cancerstem cells:new insights and perspectives.J Gastroenterol 2011;46: 966-73.
6.Vredenburg MR,Ojima I,Veith J,Pera P,Kee K,Cabral F,Sharma A,Kanter P,Greco WR,Bernacki RJ.Effects of orally active taxanes on P-glycoprotein modulation and colon and breast carcinoma drug resistance.Journal of the National Cancer Institute 2001;93:1234-45.
7.Von Hoff DD,Ervin T,Arena FP,Chiorean EG,Infante J,Moore M, Seay T,Tjulandin SA,Ma WW,Saleh MN,Harris M,Reni M,et al.Increased survival inpancreatic cancer with nab-paclitaxel plus gemcitabine.N Engl J Med 2013;369:1691-703.
8.Conroy T,Desseigne F,Ychou M,Bouche O,Guimbaud R,Becouarn Y, AdenisA,Raoul JL,Gourgou-Bourgade S,de la Fouchardiere C,Bennouna J, Bachet JB,etal.FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer.N Engl JMed 2011;364:1817-25.
9.Hutchinson L,Kirk R.High drug attrition rates--where are we goingwrong?Nature reviews Clinical oncology 2011;8:189-90.
10.Zhu L,Gibson P,Currie DS,Tong Y,Richardson RJ,Bayazitov IT,Poppleton H,Zakharenko S,Ellison DW,Gilbertson RJ.Prominin 1 marks intestinalstem cells that are susceptible to neoplastic transformation.Nature 2009;457:603-7.
11.Ojima I,Chen J,Sun L,Borella CP,Wang T,Miller ML,Lin S,Geng X,Kuznetsova L,Qu C,Gallager D,Zhao X,et al.Design,synthesis,and biologicalevaluation of new-generation taxoids.J Med Chem 2008;51: 3203-21.
12.Botchkina Gl,Zuniga ES,Das M,Wang Y,Wang H,Zhu S,Savitt AG, RowehlRA,Leyfman Y,Ju J,Shroyer K,Ojima I.New-generation taxoid SB-T-1214 inhibitsstem cell-related gene expression in 3D cancer spheroids induced by purifiedcolon tumor-initiating cells.Molecular cancer 2010;9:192.
13.Das M,Zuniga E,Ojima I.Novel Taxoid-Based Tumor-Targeting DrugConjugates.Chim Oggi 2009;27:54-6.
14.Sauer LA,Dauchy RT.The effect of ω-6 and ω-3 fatty acids on 3H-thymidine incorporation in hepatoma 7288CTC perfused in situ.British journalof cancer 1992;66:297-303.
15.Jones RJ,Hawkins RE,Eatock MM,Ferry DR,Eskens FA,Wilke H, EvansTR.A phase II open-label study of DHA-paclitaxel(Taxoprexin)by 2-hintravenous infusion in previously untreated patients with locally advancedor metastatic gastric or oesophageal adenocarcinoma.Cancer ChemotherPharmacol 2008;61:435-41.
16.Harries M,O′Donnell A,Scurr M,Reade S,Cole C,Judson I, GreystokeA,Twelves C,Kaye S.Phase I/ll study of DHA-paclitaxel in combination withcarboplatin in patients with advanced malignant solid tumours.British journalof cancer 2004;91:1651-5.
17.Hennenfent KL,Govindan R.Novel formulations of taxanes:a review.Old wine in a new bottle?Ann Oncol 2006;17:735-49.
18.Kuznetsova L,Chen J,Sun L,Wu X,Pepe A,Veith JM,Pera P, BernackiRJ,Ojima I.Syntheses and evaluation of novel fatty acid-second-generationtaxoid conjugates as promising anticancer agents. Bioorganic&medicinalchemistry letters 2006;16:974-7.
19.Ahmad G,El Sadda R,Botchkina G,Ojima I,Egan J,Amiji M.Nanoemulsion formulation of a novel taxoid DHA-SBT-1214inhibits prostatecancer stem cell-induced tumor growth.Cancer letters 2017;406:71-80.
20.Couzin-Frankel J.Breakthrough of the year 2013.Cancerimmunotherapy.Science 2013;342:1432-3.
21.Chen L.Co-inhibitory molecules of the B7-CD28 family in thecontrol of T-cell immunity.Nature reviews Immunology 2004;4:336-47.
22.Brahmcr JR,Hammers H,Lipson EJ.Nivolumab:targeting PD-1 to bolsterantitumor immunity.Future Oncol 2015;11:1307-26.
23.Brahmer J,Reckamp KL,Baas P,Crino L,Eberhardt WE, Poddubskaya E,Antonia S,Pluzanski A,Vokes EE,Holgado E,Waterhouse D, Ready N,etal.Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell LungCancer.N Engl J Med 2015;373:123-35.
24.Larkin J,Hodi FS,Wolchok JD.Combined Nivolumab and Ipilimumab orMonotherapy in Untreated Melanoma.N Engl J Med 2015;373: 1270-1.
25.Motzer RJ,Rini Bl,McDermott DF,Redman BG,Kuzel TM,Harrison MR,Vaishampayan UN,Drabkin HA,George S,Logan TF,Margolin KA, Plimack ER,etal.Nivolumab for Metastatic Renal Cell Carcinoma:Results of a RandomizedPhase II Trial.Journal of clinical oncology:official journal of the AmericanSociety of Clinical Oncology 2015;33:1430-7.
26.Li X,Hu W,Zheng X,Zhang C,Du P,Zheng Z,Yang Y,Wu J,Ji M, Jiang J,Wu C.Emerging immune checkpoints for cancer therapy.Acta Oncol 2015;54:1706-13.
27.Jiang C,Cai X,Zhang H,Xia X,Zhang B,Xia L.Activity and ImmuneCorrelates of a Programmed Death-1 Blockade Antibody in the treatment ofRefractory Solid Tumors.J Cancer2018;9:205-12.
28.Xu-Monette ZY,Zhang M,Li J,Young KH.PD-1/PD-L1 Blockade: Have WeFound the Key to Unleash the Antitumor Immune Response?Front Immunol 2017;8:1597.
29.Wang Y,Wu L,Tian C,Zhang Y.PD-1-PD-L1 immune-checkpoint blockadein malignant lymphomas.Ann Hematol 2017.
30.Torphy RJ,Schulick RD,Zhu Y.Newly Emerging Immune Checkpoints:Promises for Future Cancer Therapy.Int J Mol Sci 2017;18.
31.They L,Michaud HA,Becquart O,Lafont V,Guillot B, Boissiere-MichotF,Jarlier M,Mollevi C,Eliaou JF,Bonnefoy N,Gros L.PD-1 blockade at the timeof tumor eseape potentiates the immune-mediated antitumor effects of amelanoma-targeting monoclonal antibody. Oncoimmunology 2017;6:el353857.
32.Nomi T,Sho M,Akahori T,Hamada K,Kubo A,Kanehiro H, Nakamura S,Ehomoto K,Yagita H,Azuma M,Nakajima Y.Clinical significance and therapeuticpotential of the programmed death-1 ligand/programmed death-1 pathway inhuman pancreatic cancer.Clinical cancer research:an official journal of theAmerican Association for Cancer Research 2007;13:2151-7.
33.Okudaira K,Hokari R,Tsuzuki Y,Okada Y,Komoto S,Watanabe C,Kurihara C,Kawaguchi A,Nagao S,Azuma M,Yagita H,Miura S.Blockade of B7-H1 orB7-DC induces an anti-tumor effect in a mouse pancreatic cancer model.Int JOncol 2009;35:741-9.
34.Brahmer JR,Drake CG,Wollner I,Powderly JD,Picus J,Sharfman WH,Stankevich E,Pons A,Salay TM,McMiller TL,Gilson MM,Wang C,et al.Phase I studyof single-agent anti-programmed death-1(MDX-1106)in refractory solid tumors:safety,clinical activity,pharmacodynamics,and immunologic correlates.Journalof clinical oncology:official journal of the American Society of ClinicalOncology 2010;28:3167-75.
35.Brahmer JR,Tykodi SS,Chow LQ,Hwu WJ,Topalian SL,Hwu P, Drake CG,Camacho LH,Kauh J,Odunsi K,Pitot HC,Hamid O,et al.Safety and activity ofanti-PD-Ll antibody in patients with advanced cancer.N Engl J Med 2012;366:2455-65.
36.Le DT,Lutz E,Uram JN,Sugar EA,Onners B,Solt S,Zheng L,Diaz LA,Jr.,Donehower RC,Jaffee EM,Laheru DA.Evaluation of ipilimumab in combination withallogeneic pancreatic tumor cells transfected with a GM-CSF gene inpreviously treated pancreatic cancer.J Immunother 2013;36:382-9.
37.Lutz ER,Wu AA,Bigelow E,Sharma R,Mo G,Soares K,Solt S, Dorman A,Wamwea A,Yager A,Laheru D,Wolfgang CL,et al. Immunotherapy convertsnonimmunogenic pancreatic tumors into immunogenic foci of immuneregulation.Cancer Immunol Res 2014;2:616-31.
38.Zhang P,Su DM,Liang M,Fu J.Chemopreventive agents induceprogrammed death-l-ligand 1(PD-L1)surface expression in breast cancer cellsand promote PD-Ll-mediated T cell apoptosis.Mol Immunol 2008;45:1470-6.
39.Ghebeh H,Lehe C,Barhoush E,Al-Romaih K,Tulbah A,Al-Alwan M,Hendrayani SF,Manogaran P,Alaiya A,Al-Tweigeri T,Aboussekhra A, DermimeS.Doxorubicin downregulates cell surface B7-H1 expression and upregulates itsnuclear expression in breast cancer cells:role of B7-H1 as an anti-apoptoticmolecule.Breast cancer research:BCR 2010;12:R48.
40.Gong W,Song Q,Lu X,Gong W,Zhao J,Min P,Yi X.Paclitaxel induced B7-H1 expression in cancer cells via the MAPK pathway.J Chemother 2011;23:295-9.
41.Peng J,Hamahishi J,Matsumura N,Abiko K,Murat K,Baba T, YamaguchiK,Horikawa N,Hosoe Y,Murphy SK,Konishi I,Mandai M. Chemotherapy InducesProgrammed Cell Death-Ligand 1 Overexpression via the Nuclear Factor-kappaBto Foster an Immunosuppressive Tumor Microenvironment in OvarianCancer.Cancer research 2015;75:5034-45.
42.Ojima I,Wang T,Miller ML,Lin S,Borella CP,Geng X,Pera P, BernackiRJ.Synthesis and structure-activity relatiohships of new second-generationtaxoids.Bioorg Med Chem Lett 1999;9:3423-8.
43.Ojima I,Slater JC,Michaud E,Kuduk SD,Bounaud PY,Vrignaud P,Bissery MC,Veith JM,Pera P,Bernacki RJ.Syntheses and structure-activityrelationships of the second-generation antitumor taxoids:exceptional activityagainst drug-resistant cancer cells.J Med Chem 1996;39:3889-96.
44.Shah L,Gattacceca F,Amiji MM.CNS delivery and pharmacokineticevaluations of DALDA analgesic peptide analog administered in Nano-sized oil-in-water emulsion formulation.Pharmaceutical research 2014;31:1315-24.
45.Kadakia E,Shah L,Amiji MM.Mathematical Modeling and ExperimentalValidation of Nanoemulsion-Based Drug Transport across CellularBarriers.Pharmaceutical research 2017;34:1416-27.
46.Ganta S,Singh A,Rawal Y,Cacaccio J,Patel NR,Kulkarni P,Ferris CF,Amiji MM,Coleman TP.Formulation development of a novel targeted theranosticnanoemulsion of docetaxel to overcome multidrug resistance in ovariancancer.Drug Deliv 2016;23:968-80.
47.Morikane K,Tempera RM,Sivinski CL,Nomoto M,Van Lith ML, Muto T,Hollingsworth MA.Organ-specific pancreatic tumor growth properties and tumorimmunity.Cancer Immunol Immunotherl999;47:287-96.
48.Sarker DK.Engineering of nanoemulsions for drug delivery.Currentdrug delivery 2005;2:297-310.
49.Maude SL,Frey N,Shaw PA,Aplenc R,Barrett DM,Bunin NJ,Chew A,Gonzalez VE,Zheng Z,Lacey SF,Mahnke YD,Melenhorst JJ,et al. Chimeric antigenreceptor T cells for sustained remissiohs in leukemia.N Engl J Med 2014;371:1507-17.
50.Rowinsky EK.The development and clinical utility of the taxaneclass of antimicrotubule chemotherapy agents.Annu Rev Med 1997;48:353-74.
51.McGuire WP,Rowinsky EK,Rosenshein NB,Grumbine FC,Ettinger DS,Armstrong DK,Donehower RC.Taxol:a unique antineoplastic agent withsignificant activity in advanced ovarian epithelial neoplasms.Ann Intern Med1989;111:273-9.
52.Schiff PB,Horwitz SB.Taxol stabilizes microtubules in mousefibroblast cells.Proc NatlAcad Sci U S A 1980;77:1561-5.
53.Jordan MA,Toso RJ,Thrower D,Wilson L.Mechanism of mitotic blockand inhibition of cell proliferation by taxol at low concentrations.Proc NatlAcad Sci U S A 1993;90:9552-6.
54.Maeda H,Wu J,Sawa T,Matsumura Y,Hori K.Tumor vascular permeabilityand the EPR effect in macromolecular therapeutics:a review.J Control Release2000;65:271-84.
55.Rossi J,Giasson S,Khalid MN,Delmas P,Allen C,Leroux JC. Long-circulating polyethylene glycol)-coated emulsions to target solid tumors. EurJ Pharm Biopharm 2007;67:329-38.
56.Bocci G,Danesi R,Di Paolo AD,Innocenti F,Allegrini G,Falcone A,Melosi A,Battistoni M,Barsanti G,Conte PF,Del Tacca M.Comparativepharmacokinetic analysis of 5-fluorouracil and its major metabolite 5-fluoro-5,6-dihydrouracil after conventional and reduced test dose in cancerpatients.Clinical cancer research:an official journal of the AmericanAssociation for Cancer Research 2000;6:3032-7.
57.Kroep JR,Giaccone G,Voorn DA,Smit EF,Beijnen JH,Rosing H, vanMoorsel CJ,van Groeningen CJ,Postmus PE,Pinedo HM,Peters GJ. Gemcitabine andpaclitaxel:pharmacokinetic and pharmacodynamic interactions in patients withnon-small-cell lung cancer.Joumal of clinical oncology:official journal ofthe American Society of Clinical Oncology 1999;17:2190-7.
58.Sakai H,Kokura S,Ishikawa T,Tsuchiya R,Okajima M,Matsuyama T,Adachi S,Katada K,Kamada K,Uchiyama K,Handa O,Takagi T,et al.Effects ofanticancer agents on cell viability,proliferative activity and cytokineproduction of peripheral blood mononuclear cells.J Clin Biochem Nutr 2013;52:64-71.
59.Okino H,Maeyama R,Manabe T,Matsuda T,Tanaka M.Trans-tissue,sustained release of gemcitabine from photocured gelatin gel inhibits thegrowth of heterotopic human pancreatic tumor in nude mice.Clinical cancerresearch:an official journal of the American Association for Cancer Research2003;9:5786-93.
60.Pardoll DM.The blockade of immune checkpoints in cancerimmunotherapy.Nature reviews Cancer 2012;12:252-64.
61.Freeman GJ,Long AJ,Iwai Y,Bourque K,Chernova T,Nishimura H, FitzU,Malenkovich N,Okazaki T,Byrne MC,Horton HF,Fouser L,et al. Engagement ofthe PD-1 immunoinhibitory receptor by a novel B7 family member leads tonegative regulation of lymphocyte activation.J Exp Med 2000;192:1027-34.
62.Latchman Y,Wood CR,Chernova T,Chaudhary D,Borde M, Chernova I,IwaiY,Long AJ,Brown JA,Nunes R,Greenfield EA,Bourque K, et al.PD-L2 is a secondligand for PD-1 and inhibits T cell activation.Nat Immunol 2001;2:261-8.
63.Nishimura H,Honjo T.PD-1:an inhibitory immunoreceptor involved inperipheral tolerance.Trends Immunol 2001;22:265-8.
64.Okazaki T,Maeda A,Nishimura H,Kurosaki T,Honjo T.PD-1immunoreceptor inhibits B cell receptor-mediated signaling by recruiting srchomology 2-domain-containing tyrosine phosphatase 2 to phosphotyrosine. ProcNatl Acad Sci U S A 2001;98:13866-71.
65.Iwai Y,Terawaki S,Honjo T.PD-1 blockade inhibits hematogenousspread of poorly immunogenic tumor cells by enhanced recruitment of effectorT cells.Int Immunol 2005;17:133-44.
66.Dong H,Strome SE,Salomao DR,Tamura H,Hirano F,Flies DB, Roche PC,Lu J,Zhu G,Tamada K,Lennon VA,Celis E,et al. Tumor-associated B7-H1 promotesT-cell apoptosis:a potential mechanism of immune evasion.Nature medicine2002;8:793-800.
67.Hirano F,Kaneko K,Tamura H,Dong H,Wang S,Ichikawa M,Rietz C,FliesDB,Lau JS,Zhu G,Tamada K,Chen L.Blockade of B7-H1 and PD-1 by monoclonalantibodies potentiates cancer therapeutic immunity.Cancer research 2005;65:1089-96.
68.Lukens JR,Cruise MW,Lassen MG,Hahn YS.Blockade of PD-1/B7-H1interaction restores effector CD8+ T cell responses in a hepatitis C viruscore murine model.J Immunol 2008;180:4875-84.
69.Guiducci C, Vicari AP,Sangaletti S,Trinchieri G,ColomboMP.Redirecting in vivo elicited tumor infiltrating macrophages and dendriticcells towards tumor rejection. Cancer research 2005;65:3437-46.
- 癌症中紫杉类纳米乳剂与免疫疗法的联合
- 一种喜树碱类与紫杉类药物的联合纳米制剂及其制备
