一种提高乳酸菌细胞稳定性的优化工艺方法
文献发布时间:2023-06-19 11:44:10
技术领域
本发明涉及乳酸菌技术领域,具体的,涉及一种提高乳酸菌细胞稳定性的优化工艺方法。
背景技术
益生菌是活的微生物,当人或动物摄入足够数量的活菌之后,将对健康产生有益的影响。近年来,随着人们对新型益生菌的了解,含有益生菌的功能性食品的全球需求量大幅增长,然而益生菌却非常脆弱,容易受到保存环境影响而失去活性。如何保持益生菌产品在储存过程中的活菌数不变,充分发挥其功效,扩大应用范围,提高其稳定性亟待解决。
发明内容
本发明提出一种提高乳酸菌细胞稳定性的优化工艺方法,解决了现有技术中的乳酸菌在储存过程中的活菌数降低、稳定性不高问题。
本发明的技术方案如下:
一种提高乳酸菌细胞稳定性的优化工艺方法,包括以下步骤:
S1、将菌株在改良MRS琼脂培养基固体平板上进行培养,筛选菌体;
S2、在S1所得菌体种子培养后发酵培养,在发酵对数后期对发酵液热应激处理;
S3、将S2所得发酵液离心后收集菌泥;
S4、将S3所得菌泥和发酵上清液混合均匀,得到乳化液;
S5、将S4所得乳化液冻干收取菌粉;
S6、将S5所得菌粉重复S1~S5的操作20~25次,得到稳定菌粉;
S7、将S6所得稳定菌粉继续进行培养、离心、乳化、冻干得到最终菌粉。
作为进一步的技术方案,所述步骤S1中,改良MRS琼脂培养基包括以下组分:蛋白胨8~10g、牛肉膏8~10g、酵母膏4~5g、柠檬酸氢二铵2~3g、葡萄糖15~20g、吐温0.5~1ml、乙酸钠4~5g、磷酸氢二钾1~2g、硫酸镁0.5~0.6g、硫酸锰0.2~0.3g、琼脂15~20g、L-半胱氨酸盐酸盐0.4~0.8g、水1L,pH控制在6.2~6.6,所述改良MRS琼脂培养基中还添加碳酸钙8~12g。
作为进一步的技术方案,所述步骤S1中,将菌株在改良MRS琼脂培养基固体平板上37℃倒置培养36~48h,筛选数量比为10%以下的溶钙圈小的菌落。
作为进一步的技术方案,所述步骤S2中,种子培养和发酵培养均采用改良MRS液体培养基,包括以下组分:蛋白胨8~10g、牛肉膏8~10g、酵母膏4~5g、柠檬酸氢二铵2~3g、葡萄糖15~20g、吐温0.5~1ml、乙酸钠4~5g、磷酸氢二钾1~2g、硫酸镁0.5~0.6g、硫酸锰0.2~0.3g、L-半胱氨酸盐酸盐0.4~0.8g、水1L,pH控制在6.2~6.6。
作为进一步的技术方案,所述步骤S2中,热应激处理为40~50℃处理30~60min。
作为进一步的技术方案,所述步骤S4中,菌泥和发酵上清液的质量比为1:(2~3)。
作为进一步的技术方案,所述步骤S5中,冻干具体操作为-40℃预冻3~5h后,冻干24~36h。
作为进一步的技术方案,所述步骤S7中,培养所用培养基为所述改良MRS液体培养基。
作为进一步的技术方案,所述步骤S7中,乳化时菌体中加入保护剂,按照质量1:1的比例混合均匀,制成乳化液,所述保护剂包括以下组分:脱脂乳粉10~20g、海藻糖10~20g、阿拉伯胶15~25g、酵母膏1~2g、维生素C0.05~0.1g、水100ml。
作为进一步的技术方案,所述乳酸菌包括乳杆菌属、链球菌属、双歧杆菌属中的一种或几种。
本发明的有益效果为:
1、本发明提供了一种提高植物乳杆菌、嗜酸乳杆菌细胞储存稳定性的方法,通过种子的筛选,和发酵过程中热应激技术以及冻干过程中抗冻、耐盐技术的处理,提高乳酸菌细胞储存的稳定性。首先,通过在改良MRS琼脂培养基中加入碳酸钙,用溶钙圈大小筛选产酸能力弱的菌体。其次通过热应激处理,得到耐热菌株。最后,菌体与离心后的发酵上清液混合后进行冻干,不添加冻干保护剂,克服了技术偏见,而是直接与含有大量代谢盐类的上清液混合,冻干后能存活下来的即是抗冻、耐盐的菌体。最终得到产酸能力弱、抗冻和耐盐性能较好的菌体。
2、本发明方法通过冷冻应激、热应激、盐应激还有产酸能力弱菌株筛选来提高乳酸菌细胞的稳定性,为益生菌制品的常温储存的提供了可行性,有利于延长产品的货架期。
附图说明
下面结合附图和具体实施方式对本发明作进一步详细的说明。
图1为实施例1植物乳杆菌Lp45菌粉37℃储存28天细胞存活率结果;
图2为实施例2嗜酸乳杆菌La28菌粉37℃储存28天细胞存活率结果;
图3为实施例3植物乳杆菌Lp45菌粉37℃储存28天细胞存活率结果;
图4为实施例4嗜酸乳杆菌La28菌粉37℃储存28天细胞存活率结果;
图5为实施例5植物乳杆菌Lp45菌粉37℃储存28天细胞存活率结果;
图6为实施例6嗜酸乳杆菌La28菌粉37℃储存28天细胞存活率结果;
图7为实施例5植物乳杆菌Lp45菌粉连续传代25代细胞存活率结果;
图8为实施例6嗜酸乳杆菌La28菌粉连续传代25代细胞存活率结果。
具体实施方式
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都涉及本发明保护的范围。
下述实施例中,各益生菌均由河北一然生物科技有限公司提供,均保藏在中国微生物菌种保藏管理委员会普通微生物中心。植物乳杆菌Lp45的保藏编号为CGMCC No.8072,公开的专利申请文件申请号为201910558717.0,申请日为2019.06.26;嗜酸乳杆菌La28的保藏编号为GMCC No.11506公开的专利申请文件申请号为201910612967.8,申请日为2019.07.09,以上均已经经过国家知识产权局承认的用于专利程序的保藏机构保藏,均可以认定为公众可以获得、而不需要进行保藏的情形。
实施例1
该实施例采用植物乳杆菌Lp45。
实验组:
S1、将菌株在改良MRS琼脂固体培养基上平板上涂布,于37℃倒置培养48h,筛选数量比为10%以下的溶钙圈小的菌落,所述改良MRS琼脂固体培养基包括以下组分:蛋白胨8g、牛肉膏8g、酵母膏5g、柠檬酸氢二铵3g、葡萄糖15g、吐温80 0.5ml、乙酸钠4g、磷酸氢二钾1g、硫酸镁0.6g、硫酸锰0.2g、琼脂20g、L-半胱氨酸盐酸盐0.4g、水1L,pH控制在6.4±0.1,所述改良MRS琼脂培养基中还添加碳酸钙8g;重复筛选20次;
S2、在S1所得菌体三级种子培养后发酵培养,三级培养分别为:
(1)一级种子培养:从固体平板培养基上挑单菌落至10mL试管培养液中,37℃培养16h;
(2)二级种子培养:将一级种子液以3%接种到10mL试管培养液中,37℃培养16h;
(3)三级种子培养:将二级种子液以3%接种到250mL三角瓶装液200mL,37℃培养10h;
(4)发酵培养:将三级种子液以3%接种量接种到3L发酵三角瓶装液2L,37℃培养9h;
上述种子培养和发酵培养所用的培养液均为改良MRS液体培养基,包括以下组分:蛋白胨8g、牛肉膏8g、酵母膏5g、柠檬酸氢二铵3g、葡萄糖15g、吐温80 0.5ml、乙酸钠4g、磷酸氢二钾1g、硫酸镁0.6g、硫酸锰0.2g、L-半胱氨酸盐酸盐0.4g、水1L,pH控制在6.4±0.1;
S3、离心乳化冻干:
(1)离心:将发酵液6000转离心20min,收集菌体;
(2)乳化:菌体和保护剂按照质量1:1的比例混合均匀,制成乳化液;
所述保护剂由以下组分组成:脱脂乳粉10g、海藻糖10g、阿拉伯胶15g、酵母膏1g、维生素C0.05g、水100ml;
(3)冻干:将乳化液在-40℃预冻4h,迅速放入冻干机中,冻干24h后,收取菌粉;
对照组直接经过S2、S3种子培养离心乳化冻干,不经过上述步骤S1。
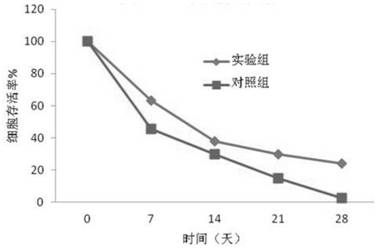
将上述两组植物乳杆菌Lp45菌粉37℃储存28天,细胞存活率结果如图1所示,活菌计数方法:参见GB 4789.35-2016。植物乳杆菌Lp45细胞存活率较对照有明显提高,第28天的细胞存活率较对照提高了约9%。
实施例2
该实施例采用嗜酸乳杆菌La28。
实验组:
S1、将菌株在改良MRS琼脂固体培养基上平板上涂布,于37℃倒置培养48h,筛选数量比为10%以下的溶钙圈小的菌落,所述改良MRS琼脂固体培养基包括以下组分:蛋白胨10g、牛肉膏10g、酵母膏4g、柠檬酸氢二铵2g、葡萄糖20g、吐温80 1ml、乙酸钠5g、磷酸氢二钾2g、硫酸镁0.5g、硫酸锰0.3g、琼脂15g、L-半胱氨酸盐酸盐0.8g、水1L,pH控制在6.3±0.1,所述改良MRS琼脂培养基中还添加碳酸钙12g,重复筛选25次;
S2、在S1所得菌体三级种子培养后发酵培养,三级培养分别为:
(1)一级种子培养:从固体平板培养基上挑单菌落至10mL试管培养液中,37℃培养18h;
(2)二级种子培养:将一级种子液以3%接种到10mL试管培养液中,37℃培养18h;
(3)三级种子培养:将二级种子液以3%接种到250mL三角瓶装液200mL,37℃培养12h;
(4)发酵培养:将三级种子液以3%接种量接种到3L发酵三角瓶装液2L,37℃培养11h;
上述种子培养和发酵培养所用的培养液均为改良MRS液体培养基,包括以下组分:蛋白胨10g、牛肉膏10g、酵母膏4g、柠檬酸氢二铵2g、葡萄糖20g、吐温80 1ml、乙酸钠5g、磷酸氢二钾2g、硫酸镁0.5g、硫酸锰0.3g、L-半胱氨酸盐酸盐0.8g、水1L,pH控制在6.3±0.1;
S3、离心乳化冻干:
(1)离心:将发酵液6000转离心20min,收集菌体;
(2)乳化:菌体和保护剂按照质量1:1的比例混合均匀,制成乳化液;
所述保护剂由以下组分组成:脱脂乳粉20g、海藻糖20g、阿拉伯胶25g、酵母膏2g、维生素C0.1g、水100ml;
(3)冻干:将乳化液在-40℃预冻5h,迅速放入冻干机中,冻干36h后,收取菌粉;
对照组直接经过S2、S3种子培养离心乳化冻干,不经过上述步骤S1。
将上述两组嗜酸乳杆菌La28菌粉37℃储存28天,细胞存活率结果如图2所示,活菌计数方法:参见GB 4789.35-2016。嗜酸乳杆菌La28细胞存活率前14天下降较快,14-28天细胞存活率下降较慢,但实验组存活率整体比对照组要高一些,第28天细胞存活率较对照组提高了约8%。
实施例3
该实施例采用植物乳杆菌Lp45。
实验组:
S1、将菌株在改良MRS琼脂固体培养基上平板上涂布,于37℃倒置培养48h,筛选数量比为10%以下的溶钙圈小的菌落,所述改良MRS琼脂固体培养基包括以下组分:蛋白胨8g、牛肉膏8g、酵母膏5g、柠檬酸氢二铵3g、葡萄糖15g、吐温80 0.5ml、乙酸钠4g、磷酸氢二钾1g、硫酸镁0.6g、硫酸锰0.2g、琼脂20g、L-半胱氨酸盐酸盐0.4g、水1L,pH控制在6.4±0.1,所述改良MRS琼脂培养基中还添加碳酸钙8g;
S2、在S1所得菌体三级种子培养后发酵培养,三级培养分别为:
(1)一级种子培养:从固体平板培养基上挑单菌落至10mL试管培养液中,37℃培养16h;
(2)二级种子培养:将一级种子液以3%接种到10mL试管培养液中,37℃培养16h;
(3)三级种子培养:将二级种子液以3%接种到250mL三角瓶装液200mL,37℃培养10h;
(4)发酵培养:将三级种子液以3%接种量接种到3L发酵三角瓶装液2L,37℃培养9h;
上述种子培养和发酵培养所用的培养液均为改良MRS液体培养基,包括以下组分:蛋白胨8g、牛肉膏8g、酵母膏5g、柠檬酸氢二铵3g、葡萄糖15g、吐温80 0.5ml、乙酸钠4g、磷酸氢二钾1g、硫酸镁0.6g、硫酸锰0.2g、水1L;
S3、离心乳化冻干:
(1)离心:将发酵液6000转离心20min,收集菌体;
(2)乳化:菌体和发酵上清液按照质量1:2的比例混合均匀,制成乳化液;
(3)冻干:将乳化液在-40℃预冻4h,迅速放入冻干机中,冻干24h后,收取菌粉。
S4、重复上述操作20次;
S5、所得菌体三级种子培养后发酵培养,离心乳化冻干,具体为:
(1)一级种子培养:从固体平板培养基上挑单菌落至10mL试管培养液中,37℃培养18h;
(2)二级种子培养:将一级种子液以3%接种到10mL试管培养液中,37℃培养18h;
(3)三级种子培养:将二级种子液以3%接种到250mL三角瓶装液200mL,37℃培养12h;
(4)发酵培养:将三级种子液以3%接种量接种到3L发酵三角瓶装液2L,37℃培养9h;
上述种子培养和发酵培养所用的培养液均为上述改良MRS液体培养基;
(5)离心:将发酵液6000转离心20min,收集菌体;
(6)乳化:菌体和保护剂按照质量1:1的比例混合均匀,制成乳化液;
所述保护剂由以下组分组成:脱脂乳粉20g、海藻糖20g、阿拉伯胶25g、酵母膏2g、维生素C0.1g、水100ml;
(7)冻干:将乳化液在-40℃预冻3h,迅速放入冻干机中,冻干24h后,收取菌粉。
对照组直接按照S5培养离心乳化,不经过上述步骤S1~S4。
将上述两组植物乳杆菌Lp45菌粉37℃储存28天,细胞存活率结果如图3所示,活菌计数方法:参见GB 4789.35-2016。植物乳杆菌Lp45细胞存活率前7天,实验组和对照组比较接近,14天之后,实验组和对照组的细胞存活率有了明显的差距,28天的细胞存活率实验组较对照组提高了约22%。
实施例4
该实施例采用嗜酸乳杆菌La28。
实验组:
S1、将菌株在改良MRS琼脂固体培养基上平板上涂布,于37℃倒置培养48h,筛选数量比为10%以下的溶钙圈小的菌落,所述改良MRS琼脂固体培养基包括以下组分:蛋白胨10g、牛肉膏10g、酵母膏4g、柠檬酸氢二铵2g、葡萄糖20g、吐温80 1ml、乙酸钠5g、磷酸氢二钾2g、硫酸镁0.5g、硫酸锰0.3g、琼脂15g、L-半胱氨酸盐酸盐0.8g、水1L,pH控制在6.4±0.1,所述改良MRS琼脂培养基中还添加碳酸钙12g;
S2、在S1所得菌体三级种子培养后发酵培养,三级培养分别为:
(1)一级种子培养:从固体平板培养基上挑单菌落至10mL试管培养液中,37℃培养18h;
(2)二级种子培养:将一级种子液以3%接种到10mL试管培养液中,37℃培养18h;
(3)三级种子培养:将二级种子液以3%接种到250mL三角瓶装液200mL,37℃培养12h;
(4)发酵培养:将三级种子液以3%接种量接种到3L发酵三角瓶装液2L,37℃培养11h;
上述种子培养和发酵培养所用的培养液均为改良MRS液体培养基,包括以下组分:蛋白胨10g、牛肉膏10g、酵母膏4g、柠檬酸氢二铵2g、葡萄糖20g、吐温80 1ml、乙酸钠5g、磷酸氢二钾2g、硫酸镁0.5g、硫酸锰0.3g、L-半胱氨酸盐酸盐0.8g、水1L,pH控制在6.4±0.1;
S3、离心乳化冻干:
(1)离心:将发酵液6000转离心20min,收集菌体;
(2)乳化:菌体和发酵上清液按照质量1:3的比例混合均匀,制成乳化液;
(3)冻干:将乳化液在-40℃预冻4h,迅速放入冻干机中,冻干24h后,收取菌粉。
S4、重复上述操作25次;
S5、所得菌体三级种子培养后发酵培养,离心乳化冻干,具体为:
(1)一级种子培养:从固体平板培养基上挑单菌落至10mL试管培养液中,37℃培养18h;
(2)二级种子培养:将一级种子液以3%接种到10mL试管培养液中,37℃培养18h;
(3)三级种子培养:将二级种子液以3%接种到250mL三角瓶装液200mL,37℃培养12h;
(4)发酵培养:将三级种子液以3%接种量接种到3L发酵三角瓶装液2L,37℃培养11h;
上述种子培养和发酵培养所用的培养液均为上述改良MRS液体培养基:
(5)离心:将发酵液6000转离心20min,收集菌体;
(6)乳化:菌体和保护剂按照质量1:1的比例混合均匀,制成乳化液;
所述保护剂由以下组分组成:脱脂乳粉20g、海藻糖20g、阿拉伯胶25g、酵母膏2g、维生素C0.1g、水100ml;
(7)冻干:将乳化液在-40℃预冻3h,迅速放入冻干机中,冻干24h后,收取菌粉。
对照组直接经过S5种子培养离心乳化冻干,不经过上述步骤S1~S4。
将上述两组嗜酸乳杆菌La28菌粉37℃储存28天,细胞存活率结果如图4所示,活菌计数方法:参见GB 4789.35-2016。嗜酸乳杆菌La28细胞存活率前14天实验组和对照组比较接近,到28天时,实验组较对照组的细胞存活率提高了15.43%。
以上数据说明,经过多次抗冻和耐盐实验后的种子,制成的菌粉明显提升了Lp45、La28的储存稳定性。
实施例5
该实施例采用植物乳杆菌Lp45。
实验组工艺步骤与实施例3不同的是,在步骤S2发酵对数后期对发酵液热应激处理,升高发酵液培养温度至45℃处理60min,其他操作与实施例3相同。
对照组与实施例3的操作相同。
将上述两组植物乳杆菌Lp45菌粉37℃储存28天,细胞存活率结果如图5所示,活菌计数方法:参见GB 4789.35-2016。植物乳杆菌Lp45细胞存活率从7天开始,实验组明显高于对照组,到28天时,实验组较对照提高了约32%。
实施例6
该实施例采用嗜酸乳杆菌La28。
实验组工艺步骤与实施例4不同的是,在步骤S2发酵对数后期对发酵液热应激处理,升高发酵液培养温度至45℃处理60min,其他操作与实施例4相同。
对照组与实施例4的操作相同。
将上述两组嗜酸乳杆菌La28菌粉37℃储存28天,细胞存活率结果如图6所示,活菌计数方法:参见GB 4789.35-2016。嗜酸乳杆菌La28在37℃储存28天时,细胞存活率实验组较对照提高了约21%。
将实施例5和实施例6中驯化后的种子和对照组,连续传代25代,进行工艺制成菌粉,跟踪菌粉的稳定性,结果如图7~8所示。
经过25次连续传代后的种子,植物乳杆菌Lp45、嗜酸乳杆菌La28制成的菌粉储存稳定性分别比对照组提高约20%、14%。所以驯化后的种子具有遗传稳定性。
综上,本发明实施例1只经过了多次溶钙圈的筛选后得到稳定的植物乳杆菌Lp45菌粉,较没有经过筛选的菌粉,储存28天细胞存活率提高了约9%;而实施例3经过溶钙圈的筛选后进行耐盐抗冻筛选,得到稳定的植物乳杆菌Lp45菌粉较没有经过筛选的菌粉,28天的细胞存活率提高了约22%,稳定性提高程度实施例1有了大幅提升;实施例5经过通过种子的筛选,和发酵过程中热应激技术以及冻干过程中抗冻、耐盐技术的处理得到稳定的植物乳杆菌Lp45菌粉较没有经过筛选的菌粉,28天的细胞存活率提高了约32%,较实施例1和实施例3的处理方法稳定性都有提高。实施例2、4、6采用的嗜酸乳杆菌La28菌粉实验得到的结果与植物乳杆菌Lp45相同,经过通过种子的筛选,和发酵过程中热应激技术以及冻干过程中抗冻、耐盐技术的处理得到的菌粉比单独一种或者两种处理得到的菌粉稳定性有显著提高。
乳酸菌细胞在遭遇环境变化时有一套固有的调整适应机制,称之为应激。应激包括热应激、冷应激、酸应激、盐应激(渗透压应激)等,应激过程通常伴随着特定蛋白的短暂诱导表达以及细胞生理机构的变化,从而增强细胞自身对环境的适应能力,从而提高乳酸菌的稳定性。同时,产酸能力弱的菌体,代谢能力弱,在遭受极端环境时需要的能量少,对自身的保护能力及适应环境的能力强,从而可以提高菌体的稳定性,任何乳酸菌细胞在遭遇环境变化时有一套固有的调整适应机制,从此原理推测本发明的方法可以适用于其它的乳酸菌,比如乳杆菌属(干酪乳杆菌、副干酪乳杆菌、鼠李糖乳杆菌、保加利亚乳杆菌、发酵乳杆菌、罗伊氏乳杆菌、格氏乳杆菌、瑞士乳杆菌、布氏乳杆菌等)、双歧杆菌属(乳双歧杆菌、长双歧杆菌、短双歧杆菌、两歧双歧杆菌、青春双歧杆菌等)、链球菌属(嗜热链球菌、乳酸乳球菌、戊糖链球菌等)等乳酸菌,不限于以上实施例所列乳酸菌。
以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种提高乳酸菌细胞稳定性的优化工艺方法
- 一种提高乳酸菌细胞稳定性的优化工艺方法
