干细胞疗法
文献发布时间:2023-06-19 11:57:35
技术领域
本发明涉及用于扩增造血干细胞和祖细胞的方法。本文中还公开了用于疗法的使用本发明方法扩增的多能细胞。
背景技术
造血干细胞和祖细胞移植(HSCT)是迄今为止最成功且使用最广泛的干细胞疗法。HSCT用于治疗其中常驻免疫系统已经受损的病状,如血液病症或化学放射治疗性处理。HSCT的使用也在基因疗法中得到临床证明并且期望通过新的基因组编辑技术得到进一步扩展。然而,挑战仍然存在,因为移植物必须与接受者是组织匹配的,从而使需求高于供应。
最初,用于移植的造血干细胞和祖细胞(HSPC)仅源自骨髓(BM)。最近,发现脐带血(UCB)也含有能够移植到骨髓中并贯穿接受者的整个寿命产生血细胞的HSPC。与更传统的BM相比,将UCB用作HSPC的来源以在HSCT中使用具有若干优点:UCB在使用前已经过测试和分组并且因此较容易获得,UCB还含有更多的未成熟干细胞,并且由于组织类型的不相容性而示出较不相关的移植物抗宿主疾病(graft versus host disease)。然而,使用源自UCB的细胞的移植物受到一个UCB单位中存在的细胞数量的限制。这种定量限制无法通过将多个UCB单位移植到单个受试者体内来克服,因为HSPC主要从仅一个UCB单位移植。因此,迄今为止,这些移植物已被限制在较小儿童中使用。
移植前,首先分离全脐血单位以丢弃红细胞,并且随后通过分选CD34+细胞或CD133+细胞进一步富集有核细胞。在许多祖/干细胞(包含造血系统的祖/干细胞)中发现标志物CD133。进一步地,已经证实其是长期重新填充细胞常驻的造血细胞的CD133+区室。因此,通过增加这些特定细胞类型的数量,其将大大提高移植并使UCB HSCT适用于治疗年龄较大的儿童和成人。不幸的是,使用传统培养方法,特征在于标志物CD133、CD34、CD90和CD49f的表达的HSC随着其增殖并伴随分化成具有限制效力的细胞类型而迅速耗竭。因此,在开发允许这些HSC扩增而不损害其干细胞特征的培养条件方面引起了很多关注。
存在几种通过尝试模拟这些细胞一般常驻的区位或环境而增加UCB单位中的细胞总数的策略。在20世纪70年代,确立了含有血清和特定细胞因子(主要是干细胞因子(SCF)、促血小板生成素(TPO)、白介素-3(IL3)、白介素-6(IL6)和粒细胞集落刺激因子(G-CSF))的条件可以用于HSC的体外扩增。到90年代早期,进行了使用在含有SCF、G-CSF和MGDF的无血清培养基中扩增10天的UCB细胞的首次临床试验。这种扩增方法使总有核细胞(TNC)扩增56倍并使CD34+细胞扩增4倍。一起或间隔10天向患者输注一种受操纵级分和一种不受操纵级分。这个试验证实了离体扩增UCB单位的可行性和其整体安全性。在经过治疗的37名患者中,所有患者均示出了移植,尽管在30个月后仍然存活的只有12名。使用细胞因子的不同组合进行的进一步工作已经通向更加明确的体外扩增方案,其中一些已经在临床前模型中示出前景。这些方案包含使用SCF、TPO、fms样酪氨酸激酶3-配体(FLT3LG)、IL3和IL6以及最近的Wnt1、骨形态发生蛋白7(BMP7)、血管生成素样5(ANGPTL5)和胰岛素生长因子结合蛋白2(IGFBP2)。
在造血细胞体外扩增期间进行的早期观察证实细胞的加速增殖与这些细胞伴随分化成更多的定向前体或更多的终末分化细胞相关。这导致了以下假设:在特定一组基因在不同阶段处转录或沉默的情况下,命运定向最有可能在表观遗传水平处得到控制。因此,控制或改变表观基因组将会对细胞的总体表型和其行为产生影响。使用包含组蛋白脱乙酰酶抑制剂的组蛋白修饰剂进行的研究产生了有前景的结果。此类研究中的首次研究使用5aza 2'脱氧胞苷和曲古抑菌素A。使用这种方案,UCB CD34+/CD90+细胞的扩增比单独在细胞因子上的细胞的扩增多4倍并且进一步保留了重新填充NOD/SCID小鼠的能力。对这些研究进行扩展以包含替代性组蛋白修饰酶揭示了其它HDAC抑制剂也具有类似的特性,其中丙戊酸和斯克瑞泰尤其有效。这由以下文献报告:Chaurasia,P.和Hoffman,R.在“富集和扩增的人脐带血干细胞用于治疗血液学病症(Enriched and expanded human cord bloodstem cells for treatment of hematological disorders)”(2014)、Araki,H.等人“使用染色质修饰剂扩增人脐带血SCID重新填充细胞(Expansion of human umbilical cordblood SCID-repopulating cells using chromatin-modifying agents)”(2006)以及WO2014/189781。
发现优先允许CD34+细胞扩增并阻止其分化的分子的化学文库筛选产生了若干所关注分子。值得注意的是芳烃受体拮抗剂StemRegenin1,目前在临床试验中用于扩增细胞。另一组值得注意的化合物是嘧啶吲哚衍生物UM729和UM171,如通过标志物CD34、CD90(Thy1)和CD49f的存在以及CD38和CD45RA的不存在而测定的,发现所述嘧啶吲哚衍生物优先扩增HSC。发现优先扩增CD34+细胞的其它分子包含白藜芦醇、GSK-3抑制剂、p18蛋白抑制剂等。
氨磷汀(amifostine,WR1065的前药)由美国军方开发为放射防护化合物并于1995年以Ethyol为名批准供临床使用。药物发挥其效应的确切机制仍在研究中,但其会在体内被代谢成通过p53的活化防止DNA损伤的WR1065(一种ROS清除剂)。对这种化合物对体外造血细胞的作用进行的研究示出,用WR1065预处理骨髓源性CD34+细胞使CFU-GEMM集落和BFU-E集落两者的形成增加多达38倍。
WO9625045公开了用于造血干细胞生长的硫醇(包含氨磷汀)。
发明内容
已经令人惊讶地发现,有可能通过在存在HDAC抑制剂(例如,斯克瑞泰(scriptaid))和另外的氨基硫醇化合物(如WR1065)的情况下培养细胞来实现HSPC的扩增。本发明至少部分地基于本文中所呈现的数据。本发明的关键特征在于,在存在HDAC抑制剂的情况下培养细胞以形成经过培养的群,并且然后,随后将氨基硫醇化合物添加到经过培养的群。这种方法产生扩增的细胞,其中总有核细胞的数量增加。
已经发现,本发明的方法产生示出富集细胞(其是HSC)亚群的扩增的细胞。
已经通过使用HDAC抑制剂和WR1065(一种氨基硫醇化合物)的组合观察到协同作用。HSC的扩增倍数超过在存在单独的HDAC抑制剂或单独的WR1065的情况下培养HSPC的累加效应。本文所呈现的数据示出这种协同效应可以产生扩增的细胞,其中HSC的富集多达500倍。
还已经发现,使用本发明的方法扩增的细胞可以用于体内重新填充骨髓。在存在HDAC抑制剂和WR1065两者的情况下扩增的细胞在施用于经辐照的小鼠时证实了长期移植。进一步地,施用了在存HDAC抑制剂和WR1065两者的情况下扩增的细胞的小鼠在其全血样品中具有较高频率的CD45+细胞。CD45是白细胞常见抗原并且存在于许多免疫系统细胞上。
因此,本发明的第一方面涉及用于扩增造血干细胞和祖细胞(HSPC)的方法,其中所述方法包括:
i)获得分离的HSPC群
ii)在存在组蛋白脱乙酰酶抑制剂(HDAC抑制剂)的情况下培养所述分离的HSPC群,以形成经过培养的群
iii)将以下添加到所述经过培养的HSPC群以形成扩增的细胞:具有式RNH(C
第二方面是一种用于如本文所定义的HSPC的扩增的试剂盒,其中所述试剂盒包括:用于HSPC的扩增的无菌元件、HDAC抑制剂和氨基硫醇化合物,所述氨基硫醇化合物具有式RNH(C
第三方面是一种扩增的细胞(优选地,HSC)群,其中所述扩增的群富集Lin-、CD38、CD34+、CD133+、CD45RA-、CD90+和CD49f+。
第四方面是一种扩增的细胞群,其可通过如上文所描述的方法获得。
第五方面是一种包括用于疗法的扩增的细胞群的组合物,其中所述细胞已经根据以下方法扩增:
i)获得分离的HSPC群
ii)在存在组蛋白脱乙酰酶抑制剂(HDAC抑制剂)的情况下培养所述分离的HSPC群,以形成经过培养的群
iii)将以下添加到所述经过培养的HSPC群以形成扩增的细胞:具有式RNH(C
第六方面是一种治疗方法,其包括以下步骤:
i)获得分离的HSPC群
ii)在存在组蛋白脱乙酰酶抑制剂(HDAC抑制剂)的情况下培养所述分离的HSPC群,以形成经过培养的群
iii)将以下添加到所述经过培养的HSPC群以形成扩增的细胞:具有式RNH(C
iv)向受试者施用所述扩增的细胞。
第七方面是一种包括扩增的细胞群的组合物的用途,其用于制造用于疗法的药剂,其中所述细胞已经通过包括以下的方法扩增:
i)获得分离的HSPC群
ii)在存在组蛋白脱乙酰酶抑制剂(HDAC抑制剂)的情况下培养所述分离的HSPC群,以形成经过培养的群
iii)将以下添加到所述经过培养的HSPC群以形成扩增的细胞:具有式RNH(C
附图说明
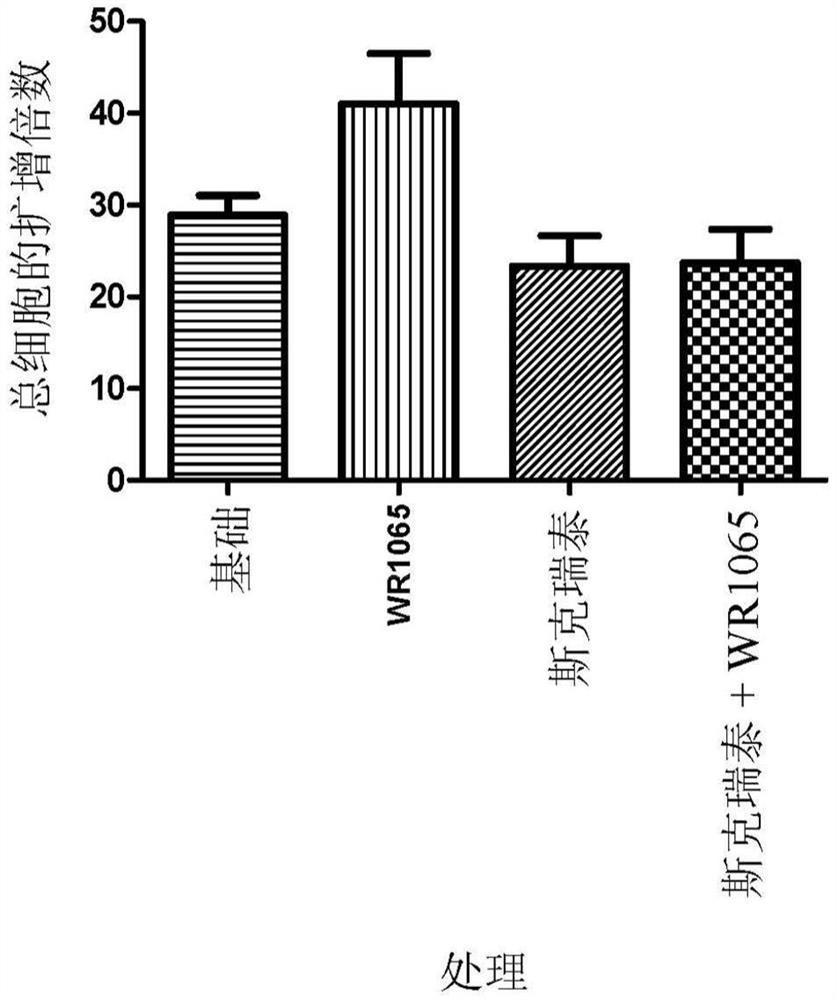
图1示出了源自脐带血的总有核细胞在以下条件下的扩增倍数:补充有细胞因子的基础培养基(基础)、补充有细胞因子和WR1065的培养基(WR 1065)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(斯克瑞泰+WR1065)。
图2示出了在以下条件下存在于源自脐带血的扩增的细胞群中的CD34+/CD133+细胞的比例:补充有细胞因子的基础培养基(基础)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(斯克瑞泰+WR1065)。
图3示出了源自脐带血的扩增的细胞的最终群中的lin-/CD38-/CD34+/CD45RA-/CD133+/CD90+/CD49f+细胞在以下条件下的扩增倍数:补充有细胞因子的基础培养基(基础)、补充有细胞因子和WR1065的培养基(WR 1065)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(斯克瑞泰+WR1065)。
图4示出了在以下条件下存在于源自脐带血的扩增的细胞的最终群中的集落形成单位粒细胞集落、红细胞集落、单核细胞集落、巨核细胞(CFU-GEMM)集落的数量:补充有细胞因子的基础培养基(基础)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(斯克瑞泰+WR1065)。
图5示出了当在以下条件下生长时,源自骨髓的总有核细胞、CD34+细胞和HSC的扩增倍数:补充有细胞因子的基础培养基(基础)、补充有细胞因子和WR1065的培养基(WR1065)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(斯克瑞泰+WR1065)。
图6示出了当在以下条件下生长时,源自外周血的总有核细胞、CD34+细胞和HSC的扩增倍数:补充有细胞因子的培养基(基础)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(斯克瑞泰+WR1065)。
图7示出了I类HDAC抑制剂RG2833对细胞扩增的效应。示出了在以下条件下生长的细胞TNC和HSC的扩增倍数:补充有细胞因子的培养基(基础)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(SC+WR)、补充有细胞因子和10nM RG2833的培养基(RG2 10nM)、补充有细胞因子、10nM RG2833和WR1065的培养基(RG2 10nM+WR)、补充有细胞因子和100nM RG2833的培养基(RG2100nM)、补充有细胞因子、100nM RG2833和WR1065的培养基(RG2 100nM+WR)。
图8示出了I类HDAC抑制剂RGFP966对细胞扩增的效应。示出了在以下条件下生长的细胞TNC和HSC的扩增倍数:补充有细胞因子的培养基(基础)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(SC+WR)、补充有细胞因子和100nM RGFP966的培养基(RGFP 100nM)、补充有细胞因子、100nM RGFP966和WR1065的培养基(RGFP 100nM+WR)、补充有细胞因子和1μM RGFP966的培养基(RGFP 1μM)、补充有细胞因子、1μM RGFP966和WR1065的培养基(RGFP 1μM+WR)。
图9示出了IIa类HDAC抑制剂LMK235对细胞扩增的效应。示出了在以下条件下生长的细胞TNC和HSC的扩增倍数:补充有细胞因子的培养基(基础)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(SC+WR)、补充有细胞因子和10nM LMK235的培养基(LMK 10nM)、补充有细胞因子、10nM LMK235和WR1065的培养基(LMK 10nM+WR)、补充有细胞因子和50nM LMK235的培养基(LMK50nM)、补充有细胞因子、50nM LMK235和WR1065的培养基(LMK 50nM+WR)。
图10示出了IIb类HDAC抑制剂妥巴斯汀A(Tubastatin A)对细胞扩增的效应。示出了在以下条件下生长的细胞TNC和HSC的扩增倍数:补充有细胞因子的培养基(基础)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(SC+WR)、补充有细胞因子和1μM妥巴斯汀A的培养基(Tub 1μM)、补充有细胞因子、1μM妥巴斯汀A和WR1065的培养基(Tub 1μM+WR)、补充有细胞因子和10μM妥巴斯汀A的培养基(Tub10μM)、补充有细胞因子、10μM妥巴斯汀A和WR1065的培养基(Tub 10μM+WR)。
图11示出了广谱HDAC抑制剂苯丁酸钠对细胞扩增的效应。示出了在以下条件下生长的细胞TNC和HSC的扩增倍数:补充有细胞因子的培养基(基础)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(SC+WR)、补充有细胞因子和苯丁酸钠的培养基(NaPB)、补充有细胞因子、苯丁酸钠和WR1065的培养基(NaPB+WR)。
图12示出了广谱HDAC抑制剂奎诺司他(quisinostat)对细胞扩增的效应。示出了在以下条件下生长的细胞TNC和HSC的扩增倍数:补充有细胞因子的培养基(基础)、补充有细胞因子和斯克瑞泰的培养基(斯克瑞泰)、补充有细胞因子、斯克瑞泰和WR1065的培养基(SC+WR)、补充有细胞因子和100nM奎诺司他的培养基(Quin 100nM)、补充有细胞因子、100nM奎诺司他和WR1065的培养基(Quin 100nM+WR)、补充有细胞因子和10nM奎诺司他的培养基(Quin 10nM)、补充有细胞因子、10nM奎诺司他和WR1065的培养基(Quin 10nM+WR)。
图13示出了使用基础培养基、斯克瑞泰以及斯克瑞泰和WR1065的组合治疗的细胞扩增方案的再生性。示出了来自三个单独供体的细胞和细胞的汇集样品的HSC的扩增倍数。
图14示出了HSC在细胞在不同的培养板上扩增时的扩增倍数:Nanex支架、经TC处理的康宁(Corning)24孔板或悬浮液葛莱纳(Greiner Bio)24孔板。
图15示出了小鼠全血样品中的CD45+细胞的频率,以活单线态百分比为单位。y轴以对数尺度绘制。向小鼠施用已经在以下条件下扩增的细胞:用媒剂扩增的细胞(已扩增+媒剂)、用斯克瑞泰扩增的细胞(已扩增+SS)、用斯克瑞泰和WR1065扩增的细胞(已扩增+SW)。未扩增的一组细胞也包含在内作为对照。一旦细胞已经离体扩增,就将其引入免疫受损的NSG小鼠中。20周后,将这些小鼠处死,并且取得骨髓细胞样品并将其引入次要的一组小鼠中。在8周时对小鼠进行放血,并对存在于全血样品中的人CD45+细胞的频率进行分析。
图16示出了存在于来自施用了不同的细胞群的小鼠的全血样品中的CD45+细胞百分比。从外周血样品获得CD34+细胞,将这些细胞在以下条件下扩增:将细胞在标准培养基中培养(B,第3天)、将细胞在存在斯克瑞泰的情况下扩增(ScrA,第3天)、将细胞在存在斯克瑞泰和WR1065的情况下扩增(PL,第3天)。未扩增的一组细胞也被包含作为对照(第0天)。从扩增的细胞和对照中分选出HSC(CD34+、CD38-、CD90+、CD45RA-),并且每只小鼠(免疫受损的NSG小鼠)施用80,000个细胞。然后通过存在于在8和12周时取得的全血样品中的CD45+细胞百分比对移植的水平进行评估。
具体实施方式
如本文中所使用的,术语造血干细胞和祖细胞(HSPC)是指在骨髓、脐带血和外周血中发现的可以分化和/或增殖以形成血细胞的细胞,血细胞的实例包含但不限于单核细胞、巨噬细胞、嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、红细胞、树突状细胞、巨核细胞、血小板、T细胞、B细胞和自然杀伤细胞。
如本文中所使用的,术语“造血干细胞”或“HSC”是指具有分化成所有谱系的血细胞和在维持其多潜能特征的同时使自身再生的能力的多能或多潜能细胞。如本文中所使用的,术语“HSC”可以是指是以下的细胞:Lin-、CD38-、CD34+、CD133+、CD45RA-、CD90+和CD49f+。术语“HSC”也可以是指是CD38-、CD34+、CD45RA-、CD90+的细胞。在术语“CD34+”、“CD133+”、“CD90+”、“CD49f+”内,(+)标志指示特定分化簇(CD)由细胞表达并且存在于细胞表面上。在术语“CD38-”、“CD45RA-”内,(-)标志指示特定CD不由细胞表达或由所述细胞微弱表达。然而,人胚胎干细胞和由破坏人胚胎产生的任何细胞不在本发明的范围内。
如本文中所使用的,术语“分离的群”是指已经从来源获得的细胞的样品。其中所述细胞可以已经商购获得,或者其中所述细胞从受试者获得。分离的群的来源包含但不限于脐带血、骨髓和外周血。“分离的群”可以从新鲜或冷冻的来源获得,其中新鲜来源在使用前没有冷冻。如果样品被冷冻,则细胞将在用于方法中之前被解冻。
如本文中所使用的,术语“经过培养的群”是指已经在人工培养基中离体繁殖的分离的细胞群。对本领域技术人员而言显而易见的是,使用哪种类型的人工培养基,适合的培养基的实例是StemSpan ACF培养基(干细胞技术公司(Stem Cell Technologies))。人工培养基还可以补充有其它因子或细胞因子以改善细胞的生长,补充剂的实例包含但不限于干细胞因子(SCF)、fms相关酪氨酸激酶3-配体(FLT3LG)和促血小板生成素(TPO)。分离的群可以在数天内进行培养/繁殖以形成经过培养的群。在一些实施例中,培养时间为2到20天、更优选地3到20天、最优选地4到15天。例如,培养/繁殖可以在20天、15天、10天、9天、8天、7天、6天、5天或4天内进行。总培养时间涵盖进行步骤(ii)和(iii)所用的时间。
如本文中所使用的,术语组蛋白脱乙酰酶抑制剂(HDAC抑制剂)是指抑制酶组蛋白脱乙酰酶的活性的化合物。组蛋白脱乙酰酶有四个分类:I类、II类、III类和IV类。基于其序列同源性和结构域组织,II类抑制剂可进一步细分为IIa类和IIb类。如本文中所使用的,术语组蛋白脱乙酰酶是指可以抑制任何类型的组蛋白脱乙酰酶的活性的化合物。
HDAC抑制剂的实例包含但不限于斯克瑞泰、伏立诺他(Vorinostat)、泰克地那林(Tacedinaline)、RG2833、RGFP966、曲古抑菌素A、LMK235、妥巴斯汀A、奎诺司他、LBH589、PXD101、ITF2357、PCI-24781、FK228 MS-275、MGCD0103、苯丁酸钠、丙戊酸、AN-9、贝斯卡(Baceca)、萨维科尔(Savicol)。
本发明的一方面包含使用氨基硫醇化合物,所述氨基硫醇化合物具有式RNH(C
如本文中所使用的,“芳基”意指单环、双环或三环的单价或二价(视情况而定)的芳族自由基,如苯基、联苯基、萘基、蒽基,其可以任选地被优选地选自以下的组的至多五个取代基取代:C
如本文中所使用的,“烷基”意指可以为直链或支链的C
如本文中所使用的,酰基是包含羰基(C=O)的如上文所定义的烷基。
烷基和酰基中的每个烷基和酰基可以任选地被芳基、环烷基(优选地,C
如本文中所使用的,术语“脐带血”具有其在本领域中的常规用途;通常是产后残留在脐带和胎盘中的血液。人脐带血在本发明的范围内并且是在具有书面知情同意和伦理批准的情况下获得的。
如本文中所使用的,术语“外周血”具有其在本领域中的常规用途;通常是在整个循环系统中循环的血液。人外周血在本发明的范围内并且是在具有书面知情同意和伦理批准的情况下获得的。
如本文中所使用的,术语“骨髓”具有其在本领域中的常规用途;通常是存在于骨腔中的凝胶状组织。组织包括红色骨髓(具有造血干细胞群、祖细胞群和前体细胞群的骨髓的子集)。人骨髓在本发明的范围内并且是在具有书面知情同意和伦理批准的情况下获得的。
如本文中所使用的,术语“扩增的细胞”是指已经在适当的条件下离体培养并且经历细胞分裂以扩增细胞数量的细胞。如本文中所使用的,术语“细胞扩增”是指通过在适当的条件下离体培养细胞来扩增细胞数量,其中在培养结束时存在的细胞数量大于在培养开始时存在的细胞数量。
在细胞(其中细胞可以是分离的细胞群的一部分、经过培养的细胞群或扩增的细胞)内,存在细胞亚型。细胞亚型的实例是但不限于:造血干细胞、造血祖细胞和如由其表型标志物定义的细胞。表型标志物的非限制性实例是:Lin或CD38或CD34或CD133或CD45RA或CD90或CD49f,其中细胞也可以由这些表型标志物的组合定义。如本文中所使用的,术语“富集的”用于指含有高比例的特定细胞亚群/亚型的细胞组,其中所述细胞组可以含有2%、或5%、或10%、或15%、或20%、或25%、或30%、或35%、或40%、或45%、或50%、或55%、或60%、或65%、或70%、或75%、或80%、或85%、或90%的特定细胞亚群/亚型。在本发明内,术语“富集的”可以用于指其中细胞已经经历扩增并且其中特定细胞亚型的数量相较于群内的其它细胞成比例地增加的细胞群。富集的细胞群含有显著比例的特定细胞亚型,其中所述显著比例可以为总群的2%、或5%、或10%、或15%、或20%、或25%、或30%、或35%、或40%、或45%、或50%、或55%、或60%、或65%、或70%、或75%、或80%、或85%、或90%。
如本文中所使用的,术语“无血清组织培养系统”是指在尚未补充有源自动物的血清的培养基中培养细胞。
如本文中所使用的,术语“无饲养物组织培养系统”是指在没有利用结缔组织细胞层来支持生长的细胞和向生长的细胞提供代谢物的情况下培养细胞的方法。
如本文中所使用的,术语“总细胞扩增”是指总有核细胞的数量的增加。
如本文中所使用的,术语“总培养时间”是指进行步骤ii)和iii)的时间。其中步骤ii)包括在存在组蛋白脱乙酰酶抑制剂(HDAC抑制剂)的情况下培养所述分离的HSPC群,以形成经过培养的群;并且步骤iii)包括将以下添加到所述经过培养的HSPC群以形成扩增的细胞:具有式RNH(C
如本文中所使用的,术语“受试者”是指根据本发明的用途的疗法的接受者的任何动物(例如,哺乳动物),包含但不限于人、非人灵长类动物、犬科动物、猫科动物、啮齿动物等。具体地,设想了人类受试者。“患者”在本文中用于指人类受试者。
本发明的一方面是用于扩增造血干细胞和祖细胞(HSPC)的方法,其中所述方法包括:
i)获得分离的HSPC群
ii)在存在组蛋白脱乙酰酶抑制剂(HDAC抑制剂)的情况下培养所述分离的HSPC群,以形成经过培养的群
iii)将以下添加到所述经过培养的HSPC群以形成扩增的细胞:具有式RNH(C
在本发明的实施例中,步骤i)进一步包括选择是CD133+的细胞。在一些实施例中,分离的群包括是CD133+的细胞。在实施例中,步骤i)进一步包括选择是CD34+的细胞。如果分离的HSPC群是从已经冷冻的来源获得的,则选择是CD34+的细胞可能是优选的。如果分离的HSPC群是从新鲜来源获得的,则选择是CD133+的细胞可能是优选的。通过细胞表面标志物选择细胞的适合的方法是本领域已知的,例如使用磁性活化细胞分选(MACs)或荧光活化细胞分选(FACS)。优选地,分离的群包括是CD38-或CD34+或CD133+或CD45RA-或CD90+或CD49f+或其任何组合的细胞。
在本发明的一个实施例中,分离的细胞群从脐带血或骨髓或外周血获得。在优选实施例中,分离的细胞群从脐带血获得。在一些实施例中,细胞从哺乳动物(例如,小鼠、大鼠、狗或人)获得。优选实施例是其中细胞从人获得。
在本发明的一个实施例中,HDAC抑制剂选自广谱抑制剂或选择性I类、IIa类、IIb类、III类或IV类抑制剂。优选地,HDAC抑制剂选自广谱抑制剂或选择性I类、IIa类、III类或IV类抑制剂。更优选地,HDAC抑制剂是广谱抑制剂、I类或IIa类抑制剂。
在优选实施例中,HDAC抑制剂选自斯克瑞泰、RG2833、RGFP966、LMK235、妥巴斯汀A、奎诺司他、苯丁酸钠。在本发明的一些实施例中,HDAC抑制剂是斯克瑞泰或奎诺司他。在优选实施例中,HDAC抑制剂是斯克瑞泰,其具有以下结构:
本发明的氨基硫醇化合物具有式RNH(C
在优选实施例中,R是氢。
在一些实施例中,本发明的氨基硫醇化合物是氨磷汀:
或
WR1065:
最优选地,氨基硫醇化合物是WR1065。
在本发明的一个实施例中,HDAC抑制剂的使用浓度介于0.01μM到50μM、优选地介于0.1μM到10μM,更优选地,HDAC抑制剂的使用浓度为1μM。
在本发明的优选实施例中,氨基硫醇化合物(例如,WR1065)的使用浓度为50μM到500μM、优选地50μM到150μM,更优选地,浓度为100μM。
在本发明的优选实施例中,HDAC抑制剂的使用浓度为1μM,并且优选地,氨基硫醇化合物(例如,WR1065)的使用浓度为100μM。
在本发明的一些实施例中,在两天到十天内进行步骤ii)和iii)。在优选实施例中,在五天到10天内进行步骤ii)和iii)。在更优选实施例中,在约五天内进行步骤ii)和iii)。在本发明的实施例中,步骤iii)在总培养时间结束(即,步骤(iii)结束)前至多48小时开始。在本发明的一些实施例中,步骤iii)在总培养时间结束结束)前16小时到20小时开始。优选地,在五天内进行步骤ii)和iii),并且更优选地,在总培养时间结束前16小时到20小时进行步骤iii)。
优选地,在本发明中,在4天到10天内进行步骤ii)。在优选实施例中,在至少4天内进行步骤ii)。在一些实施例中,在已经用HDAC抑制剂(根据步骤ii))培养细胞至少4天到10天(优选地,至少4天)后进行步骤iii)。在一些实施例中,在如在步骤ii)中培养细胞至少4天到10天(优选地,至少4天)后进行步骤iii)。优选地,步骤iii)在总培养时间结束前48小时开始。
优选地,在无血清组织培养系统中培养细胞。在本发明的一些实施例中,在无饲养物组织培养系统中培养细胞。虽然培养系统无血清和/或饲养物,但是可以添加各种营养素以为细胞提供足够的生长和扩增条件。适合的培养基的实例包含但不限于StemSpan ACF培养基(干细胞技术公司)、StemPro34无血清培养基(英杰公司(Invitrogen))、Stemline II(赛默飞世尔公司(Thermo Fisher))、HPC扩增培养基DXF(普乐思尔公司(PromoCell))、QBSF-60(质量生物公司(Quality Biological))、StemMACS HSC扩展介质XF(美天旎生物技术公司(Miltenyi Biotec))。在本发明的优选实施例中,在StemSpan ACF培养基(干细胞技术公司)中培养细胞。适合的培养基还可以含有各种添加剂和组分,所述组分可以是化学或生物组分。这些组分可以单独地或组合地掺入适合的培养基中,并且技术人员将能够按照需要选择适合的组分。这些组分也可以按照需要在培养期间掺入。生物组分和化学组分两者的实例包含但不限于:氨基酸、维生素、细胞因子、生长因子、激素、抗生素、脂肪酸、糖、钠、钙、钾、镁、磷、琼脂、琼脂糖、甲基纤维素、胶原蛋白、胰岛素、转铁蛋白、乳铁蛋白、胆固醇、乙醇胺、丙酮酸钠、2-巯基乙醇、聚乙二醇、亚硒酸钠。
可以将各种细胞因子掺入培养基中和/或在培养期间掺入,适合的细胞因子的实例包含但不限于:白介素-1(IL-1)、白介素-2(IL-2)、白介素-3(IL-3)、白介素-4(IL-4)、白介素-5(IL-5)、白介素-6(IL-6)、白介素-7(IL-7)、白介素-8(IL-8)、白介素-9(IL-9)、白介素-10(IL-10)、白介素-11(IL-11)、白介素-12(IL-12)、白介素-13(IL-13)、白介素-14(IL-14)、白介素-15(IL-15)、白介素-18(IL-18)、白介素-21(IL-21)、干扰素-α(INF-α)、干扰素-β(INF-β)、干扰素-γ(INF-γ)、粒细胞巨噬细胞集落刺激因子(GM-CSF)、干细胞因子(SCF)、Wnt1、骨形态发生蛋白7(BMP7)、血管生成素样5(ANGPTL5)、胰岛素生长因子结合蛋白2(IGFBP2)、促红细胞生成素(EPO)、促血小板生成素(TPO)、Fms样酪氨酸激酶3-配体(FLT3LG)。在本发明的实施例中,培养基补充有SCF、TPO和FLT3LG。
可以将各种生长因子掺入培养基和/或在培养期间掺入。适合的生长因子的实例包含但不限于胰岛素样生长因子(IGF)、表皮生长因子(EGF)、人表皮生长因子(hEGF)、血小板源性生长因子(PDGF)、成纤维细胞生长因子1(FGF1)、神经生长因子(NGF)、巨噬细胞炎性蛋白1-α(MIP-1α)、白血病抑制因子(LIF)。
在本发明的实施例中,在介于32℃到39℃之间、优选地介于36℃到38℃之间的温度下培养分离的群。在本发明的实施例中,在具有介于约1%到约50%CO
在本发明的优选实施例中,总细胞扩增介于约2倍到约50倍、或约2倍到约25倍、或约2倍到约20倍。总细胞扩增通过在培养时间开始时测量总有核细胞的数量并与在培养时间结束时存在的总有核细胞的数量进行比较来测定。
在优选实施例中,Lin-、CD38-、CD34+、CD133+、CD45RA-、CD90+和CD49f+细胞扩增50到800倍、更优选地400到600倍、最优选地500倍。Lin-、CD38-、CD34+、CD133+、CD45RA-、CD90+和CD49f+细胞的扩增通过测量培养时间开始时存在的Lin-、CD38-、CD34+、CD133+、CD45RA-、CD90+和CD49f+细胞的数量并将其与培养时间结束时存在的Lin-、CD38-、CD34+、CD133+、CD45RA-、CD90+和CD49f+细胞的数量进行比较来测定。在一个实施方案中,CD38-、CD34+、CD45RA-和CD90+细胞扩增扩增50到800倍、更优选地400到600倍、最优选地500倍。CD38-、CD34+、CD45RA-和CD90+细胞的扩增通过测量培养时间开始时存在的CD38-、CD34+、CD45RA-和CD90+细胞的数量并将其与培养时间结束时存在的CD38-、CD34+、CD45RA-和CD90+细胞的数量进行比较来测定。用于测定细胞扩增的适合的方法是本领域已知的,并且包含例如与总细胞计数组合的多色流式细胞术分析、与流式细胞术分析组合使用绝对计数珠、使用手动或自动血细胞计数仪(Viacell、Countess、Nucleocounter、Nexcelome)基于细胞等分试样的成像分析进行细胞计数。
在一些实施例中,扩增的细胞富集HSC。在一个实施例中,扩增的细胞富集Lin-或CD38-或CD34+或CD133+或CD45RA-或CD90+或CD49f+或其任何组合,优选地,其中细胞富集CD34+、CD133+,更优选地,其中扩增的细胞富集CD38-、CD34+、CD133+,最优选地,其中扩增的细胞富集Lin-、CD38-、CD34+、CD133+、CD45RA-、CD90+、CD49f+。在实施例中,扩增的细胞富集CD38-或CD34+或CD45RA-或CD90+或其任何组合。
本发明的一方面是一种用于如本文所定义的HSPC的扩增的试剂盒,其中所述试剂盒包括:用于HSPC的扩增的无菌元件、HDAC抑制剂和氨基硫醇化合物,所述氨基硫醇化合物具有式RNH(C
通过本文所描述的方法产生的扩增的细胞群可以富集HSC,并且已经示出扩增的细胞具有长期移植能力和重新填充哺乳动物骨髓的能力。因此,本发明的一方面是一种用于疗法的扩增的细胞群,其中所述细胞已经根据以下方法扩增:
i)获得分离的HSPC群
ii)在存在组蛋白脱乙酰酶抑制剂(HDAC抑制剂)的情况下培养所述分离的HSPC群,以形成经过培养的群
iii)将以下添加到所述经过培养的HSPC群以形成扩增的细胞:具有式RNH(C
用于产生用于疗法的扩增的细胞的方法可以包括本文中所提供的另外的特征中的任何一个另外的特征。
本发明的一方面是一种治疗方法,其包括以下步骤:
i)获得分离的HSPC群
ii)在存在组蛋白脱乙酰酶抑制剂(HDAC抑制剂)的情况下培养所述分离的HSPC群,以形成经过培养的群
iii)将以下添加到所述经过培养的HSPC群以形成扩增的细胞:具有式RNH(C
iv)向受试者施用所述扩增的细胞。
所述治疗方法可以包括本文中所提供的另外的特征中的任何一个另外的特征。
本发明的另一方面是组合物的用途,其用于制造用于疗法的药剂,其中所述组合物包括以下步骤:
i)获得分离的HSPC群
ii)在存在组蛋白脱乙酰酶抑制剂(HDAC抑制剂)的情况下培养所述分离的HSPC群,以形成经过培养的群;以及
iii)将以下添加到所述经过培养的HSPC群以形成扩增的细胞:具有式RNH(C
如上文所描述的在制造药剂中的用途可以包括本文中所提供的另外的特征中的任何一个另外的特征。
通过本文所提出的方法扩增的细胞可以用作细胞移植物。通过本文所提出的方法扩增的细胞可以用于重新填充哺乳动物骨髓。因此,本发明的实施例是用于治疗血液学病症、免疫病症、代谢病症或神经退行性病症的扩增的细胞群。其中向受试者施用扩增的细胞群,所述细胞已经根据上文所描述的方法扩增。在特定实施例中,扩增的细胞群用于治疗血液学病症。
扩增的细胞群可以用作造血干细胞疗法的移植物而作为常规骨髓、脐带血或外周血移植的替代品。扩增的细胞群的移植可以以与常规骨髓、脐带血或外周血移植相同的方式进行。移植物可以包括扩增的细胞群以及以下组分中的任何组分:缓冲溶液、抗生素、药物化合物。
可以使用扩增的细胞群治疗的病症的实例包含急性骨髓性白血病、急性成淋巴细胞性白血病、慢性淋巴细胞性白血病、慢性骨髓性白血病、非霍奇金淋巴瘤(non-Hodgkinlymphoma)、重症再生障碍性贫血、重症综合性免疫缺陷、镰状细胞疾病、慢性肉芽肿病、重症综合性免疫缺陷综合征、腺苷脱氨酶(ADA)缺乏症、血中丙球蛋白贫乏、威斯科特-奥尔德里奇综合征(Wiskott-Aldrich syndrome)、薛迪克-东氏综合征(Chediak-Higashisyndrome)、免疫缺陷综合征(如获得性免疫缺陷综合征(AIDS))、C3缺乏、先天性贫血(如地中海贫血、由于酶缺乏引起的溶血性贫血和镰状细胞贫血症)、溶酶体贮积病(如高雪氏病(Gaucher's disease)和黏多糖病)、肾上腺脑白质营养不良、各种癌症和肿瘤(尤其是血癌,如急性或慢性白血病)、范科尼综合征(Fanconi syndrome)、再生障碍性贫血、粒细胞减少症、淋巴细胞减少症、血小板减少症、特发性血小板减少性紫癜、血栓性血小板减少性紫癜、卡沙巴梅综合征(Kasabach-Merritt syndrome)、恶性淋巴瘤、霍奇金病(Hodgkin'sdisease)、多发性骨髓瘤、慢性肝病、肾衰竭、库存血液或在手术期间的大量血液输注、乙型肝炎、丙型肝炎、重症感染、系统性红斑狼疮、关节风湿病、干皮性骨化症、全身性硬化症、多发性肌炎、皮肌炎、混合性结缔组织病、结节性多动脉炎、桥本氏病(Hashimoto'sdisease)、巴西多氏病(Basedow'sdisease)、重症肌无力、胰岛素依赖型糖尿病、自身免疫性溶血性贫血、蛇咬伤、溶血性尿毒综合征、脾机能亢进、出血、巨血小板综合征(Bernard-Soulier syndrome)、血小板无力症(Glanzmann's thrombasthenia)、尿毒症、骨髓增生异常综合征、真性红细胞增多症、红细胞增多、原发性血小板增多症、骨髓增生性疾病、创伤性脊髓损伤、神经损伤、神经断伤症、骨骼肌损伤、瘢痕形成、糖尿病、脑梗塞、心肌梗塞和阻塞性动脉硬化。
可以通过以下施用途径来施用扩增的细胞群:皮下、顶区内、肌肉内、静脉内、肿瘤内、眼内、视网膜内、玻璃体内或颅内。
扩增的细胞群可以与药学上可接受的赋形剂、稀释剂或载体组合以便改善和增强施用、稳定性、均匀性、生物利用度或其任何组合。在某些实施例中,本公开的细胞外囊泡或细胞悬浮于无菌溶液中施用。在某些实施例中,溶液包括0.9%NaCl。在某些实施例中,溶液进一步包括以下中的一种或多种:缓冲液,例如乙酸盐、柠檬酸盐、组氨酸、琥珀酸盐、磷酸盐、碳酸氢盐或羟基甲基氨基甲烷(Tris);表面活性剂,例如聚山梨醇酯80(吐温(Tween)80)、聚山梨醇酯20(吐温20)或泊洛沙姆(poloxamer)188;多元醇/二糖/多糖,例如葡萄糖、右旋糖、甘露糖、甘露醇、山梨糖醇、蔗糖、海藻糖或右旋糖酐40;氨基酸,例如甘氨酸或精氨酸;抗氧化剂,例如抗坏血酸或蛋氨酸;和螯合剂,例如EGTA或EGTA。
通过本发明方法产生的扩增的细胞群可以用于基因疗法。为了将治疗性基因引入到患者,应将所关注基因转染到分离的群的HSC中。可以使用病毒或非病毒方法引入治疗性基因。适合的病毒载体包含逆转录病毒、腺病毒、腺相关病毒和单纯疱疹病毒。包括所关注基因的细胞可以在被引入到患者之前根据本发明方法进行扩增。
以下实例展示本发明。
实例
实例1来自脐带血的细胞的扩增
材料与方法
细胞培养
在获得牛津和伯克希尔国家研究伦理委员会的书面知情同意和伦理批准后收集人UCB单位,并在NHSBT研究委员会的批准下进行研究。通过在淋巴细胞分离培养基1077(奥地利帕兴的PAA实验室(PAA Laboratories);密度<1.077g/ml)上进行密度梯度离心来分离UCB单核细胞(MNC)。使用免疫磁珠(德国的美天旎生物技术公司)从MNC分离CD133+细胞。分离后,将细胞冷冻保存在含10%DMSO的FCS(小牛血清)中,并以1×10
将来自2个或3个供体的小瓶解冻并汇集在含有100ng/mL SCF、100ng/mL FLT3LG和20ng/mL TPO(均来自美天旎生物技术公司)的StemSpan ACF培养基(干细胞技术公司)中。计数后,将细胞于上述培养基中以20,000个细胞/孔平板接种于96孔圆底悬浮板中。允许细胞在这些条件下在含有5%CO
第二天,从经过计数的板中收获细胞,并将其于含有HDAC抑制剂(对于大多数实验,斯克瑞泰的使用浓度为1μM)的1mL基础培养基(含有100ng/mL SCF、100ng/mL FLT3LG和20ng/mL TPO的StemSpan ACF)中以2500个细胞/孔接种到24孔Nanex板(罗盘生物医疗公司(Compass Biomedical))或经标准组织培养物处理的板中。使用一个等分试样的细胞进行CFU分析,并使用另一个等分试样进行流式细胞术分析。
培养3天后,用含有细胞因子(SCF、TPO和FLT3LG)和HDAC抑制剂(斯克瑞泰1μM)的新鲜培养基替代培养基,或者向培养基补充所述细胞因子和所述HDAC抑制剂。收获前十六小时到二十小时,以100μM的浓度添加WR1065。总共扩增5天后,收获细胞,对其进行计数,并通过流式细胞术对其进行分析。
CFU测定
使用MethoCult Classic试剂盒(干细胞技术公司)按照制造商的指导进行CFU测定。简而言之,将等分试样的细胞(已知数量或体积)与3mL的MethoCult培养基混合,并使用钝针和注射器将其平板接种到6孔悬浮板的一个孔中。在没有更换培养基的情况下,将板在37℃下在含有5%CO2的加湿温育箱中温育2周。2周后,在解剖显微镜下拍摄集落,并对其进行计数。然后对不同种类的集落的比例进行评分,并计算比例/样品。
流式细胞术测定
收获细胞,将其洗涤,并使用一组预先缀合的抗体在含3%FBS的PBS中对其进行染色。在使用BD Canto II流式细胞仪进行分析前,将细胞与抗体一起在冰上温育30分钟,然后在含3%FBS的PBS中洗涤两次,并重悬于250uL的上述缓冲液中。[抗体组如下:5Lin定制混合物(cocktail)(CD235a、CD4、CD10、CD11b和CD19)APC-Vio770、CD38-PE-Vio770、CD34-PerCP-Vio700、CD133-PE、CD45RA-VioBlue、CD49f-FITC、CD90-APC(均来自美天旎生物技术公司)。]
细胞计数
借助于计数珠(生命技术公司(Life Technologies)的CountBright珠)使用流式细胞术测量细胞数量。
结果
图1示出了跨所有处理组进行的总有核细胞的分析,其示出了在所有培养条件下,细胞的扩增之间的差异较小。在5天的培养期中,含有细胞因子的基础培养基中的细胞的扩增为20-40倍左右(在不同的供体和不同的生物重复序列之间看到差异),在具有或没有WR1065(100μM)的情况下在具有细胞因子的情况下在斯克瑞泰(1μM)上生长的细胞中的这种细胞的扩增略微减少,但是这种减少并不显著。[基础对斯克瑞泰p=0.191,基础对斯克瑞泰+WR1065 p=0.28]n=14。然而,在比较CD133+/CD34+细胞的扩增时(如图3中所示出的),与在单独的细胞因子上生长的细胞相比,已经用单独的斯克瑞泰和斯克瑞泰与WR1065的组合处理的细胞示出CD133+/CD34+细胞的比例有所增加。离体培养前对细胞进行的分析(图2)示出,起始群的纯度很高(介于90-98%之间的CD133+/CD34+)。在基础培养基+细胞因子(表示为基础)中培养5天后,比例下降到50%左右。在具有组合处理的情况下生长的细胞中,这个比例仍然高得多,为72%左右。这种差异具有统计学意义(分别为**p=0.003和***p=0.0001)。
特征在于表型Lin-、CD38-、CD34+、CD45RA-、CD133+、CD90+、CD49f+的特定的HSC富集群的扩增倍数在组合处理中比在单独的细胞因子中高20倍。可以将培养结束时存在的具有表型(Lin-、CD38-、CD34+、CD45RA-、CD133+、CD90+、CD49f+)的细胞数量的测量与在扩增开始时接种的细胞数量进行比较,并表示为“扩增倍数”。扩增倍数的比较示出,用斯克瑞泰处理的细胞具有比在含有细胞因子的基础培养基中生长的细胞高大约10倍的扩增。在斯克瑞泰和WR1065的组合中生长的细胞示出比在含有细胞因子的基础培养基中生长的细胞高20倍的扩增(图3)。这种差异具有统计学意义。药物组合的作用远不止每种单独化合物的累加效应。在细胞因子+WR1065上生长的细胞示出“HSC”区室的扩增比单独的细胞因子多3倍左右,在单独的斯克瑞泰上生长的细胞示出比基础高10倍的扩增,并且组合示出比基础高20倍的扩增(图3),因此这大于累加效应。与在单独的细胞因子上生长的细胞相比,用HDAC抑制剂和WR1065体外培养UCB源性CD133+细胞使集落形成单位粒细胞、红细胞、单核细胞、巨核细胞(CFU-GEMM)集落的数量有所增加。在组合处理上扩增并以有限稀释度平板接种在MethoCult中的细胞产生的GEMM集落比预先扩增的细胞多6到7倍并且比在单独的细胞因子上扩增的细胞多至少2.5倍,如图4中所示出的,这种差异具有统计学意义。
实例2来自骨髓的细胞的扩增
也在源自骨髓的细胞上进行如上文所定义的扩增方案。当在组合处理中培养时,骨髓细胞示出总有核细胞和CD34+细胞两者的5倍扩增。然而,与在含有细胞因子的基础培养基中生长的细胞的细胞扩增相比,对于斯克瑞泰和WR1065中生长的细胞,HSC(特征在于表型Lin-、CD38-、CD34+、CD45RA-、CD133+、CD90+、CD49f+)细胞扩增高17倍(图5)。
实例3来自外周血的细胞的扩增
也在源自外周血的细胞上进行如上文所定义的扩增方案。源自外周血的细胞的总体扩增倍数比源自脐带血的细胞的总体扩增倍数低。在所有生长条件下,外周血细胞示出总有核细胞和CD34+细胞两者的2-6倍扩增。然而,与在含有细胞因子的基础培养基中生长的细胞相比,对于斯克瑞泰和WR1065中生长的细胞,HSC(特征在于表型Lin-、CD38-、CD34+、CD45RA-、CD133+、CD90+、CD49f+)细胞扩增高300倍(图6)。
实例4使用I类HDAC抑制剂RG2833和RGFP966进行细胞扩增
使用I类HDAC抑制剂RG2833和RGFP966进行如上文所定义的扩增方案。RG2833对HDAC 1和3具有选择性并且RGFP966对HDAC 3具有选择性。将细胞在含有细胞因子的培养基(基础)、含有RG2833或RGFP966的基础培养基中和含有RG2833和WR1065或RGFP966和WR1065的基础培养基中扩增。图7示出了在基础培养基、含有RG2833的培养基、含有RG2833和WR1065的培养基中生长的细胞的TNC的扩增和HSC的扩增(也示出了用斯克瑞泰处理的培养基和含有斯克瑞泰和WR1065的培养基中生长的细胞的扩增数据作为比较)。示出了当与在基础培养基中生长的细胞比较时,TNC的扩增倍数在用RG2833或用RG2833和WR1065处理时有所增加。与在基础培养基中生长的细胞比较,对于用RG2833或用RG2833和WR1065处理的细胞,HSC的扩增倍数也加倍。还应注意,用RG2833和WR1065处理的细胞相较于仅用RG2833处理的细胞示出了HSC的增加的扩增倍数。
图8示出了在基础培养基、含有RGFP966的培养基、含有RGFP966和WR1065的培养基中生长的细胞的TNC的扩增和HSC的扩增(也示出了含有斯克瑞泰的培养基和含有斯克瑞泰和WR1065的培养基中生长的细胞的扩增数据作为比较)。示出了当与在基础培养基中生长的细胞比较时,TNC的扩增倍数在用RGFP966或用RGFP966和WR1065处理时有所增加。与在基础培养基中生长的细胞比较,对于用RGFP966或用RGFP966和WR1065处理的细胞,HSC的扩增倍数类似。然而,应注意,用RGFP966和WR1065处理的细胞相较于仅用RGFP966处理的细胞示出了HSC的增加的扩增倍数。
这些实例示出,与在基础培养基中生长的细胞相比,用I类HDAC抑制剂和WR1065处理的细胞示出TNC的扩增倍数有所增加。用I类HDAC抑制剂和WR1065处理的细胞还示出其HSC区室的扩增倍数比在基础培养基中生长或用单独的I类HDAC抑制剂处理的细胞中看到的所述扩增倍数高。
实例5使用IIa类HDAC抑制剂LMK235进行细胞扩增
使用IIa类HDAC抑制剂LMK235进行如上文所定义的扩增方案。LMK235对HDAC 4和5具有选择性。图9示出了在含有细胞因子的培养基(基础)、含有LMK235的基础培养基、含有LMK235和WR1065的基础培养基中扩增的细胞的TNC的扩增和HSC的扩增(也示出了含有斯克瑞泰的培养基和含有斯克瑞泰和WR1065的培养基中生长的细胞的扩增数据作为比较)。与在基础培养基中生长的细胞比较,TNC的扩增倍数在用LMK235或用LMK235和WR1065处理时略微降低。然而,与在基础培养基中生长的细胞比较,对于用LMK235或用LMK235和WR1065处理的细胞,HSC的扩增倍数略微增加。
实例6使用IIb类HDAC抑制剂妥巴斯汀A进行细胞扩增
使用IIb类HDAC抑制剂妥巴斯汀A进行如上文所定义的扩增方案。妥巴斯汀A对HDAC6具有选择性。图10示出了在含有细胞因子的培养基(基础)、含有妥巴斯汀A的基础培养基、含有妥巴斯汀A和WR1065的基础培养基中扩增的细胞的TNC的扩增和HSC的扩增(也示出了含有斯克瑞泰的培养基和含有斯克瑞泰和WR1065的培养基中生长的细胞的扩增数据作为比较)。与在基础培养基中生长的细胞比较,在用妥巴斯汀A或用妥巴斯汀A和WR1065处理时,TNC的扩增倍数类似。然而,与在基础培养基中生长的细胞比较,对于用妥巴斯汀A或用妥巴斯汀A和WR1065处理的细胞,HSC的扩增倍数略微增加。还应注意,用妥巴斯汀A和WR1065的组合处理的细胞相较于仅用妥巴斯汀A处理的细胞示出了HSC的扩增倍数的增加。
实例7使用广谱HDAC抑制剂苯丁酸钠和奎诺司他进行细胞扩增
使用广谱HDAC抑制剂苯丁酸钠和奎诺司他进行如上文所定义的扩增方案。苯丁酸钠当前用于治疗脲循环病症并且奎诺司他当前在用于癌症的临床试验中。将细胞在含有细胞因子的培养基(基础)、含有苯丁酸钠或奎诺司他的基础培养基中和含有苯丁酸钠和WR1065或奎诺司他和WR1065的基础培养基中扩增。图11示出了在基础培养基、含有苯丁酸钠的培养基、含有苯丁酸钠和WR1065的培养基中生长的细胞的TNC的扩增和HSC的扩增(也示出了含有斯克瑞泰的培养基和含有斯克瑞泰和WR1065的培养基中生长的细胞的扩增数据作为比较)。示出了当与在基础培养基中生长的细胞比较时,TNC的扩增倍数在用苯丁酸钠或用苯丁酸钠和WR1065处理时有所增加。与在基础培养基中生长的细胞比较,对于用苯丁酸钠或用苯丁酸钠和WR1065处理的细胞,HSC的扩增倍数也增加。
图12示出了在基础培养基、含有奎诺司他的培养基、含有奎诺司他和WR1065的培养基中生长的细胞的TNC的扩增和HSC的扩增(也示出了含有斯克瑞泰的培养基和含有斯克瑞泰和WR1065的培养基中生长的细胞的扩增数据作为比较)。当与在基础培养基中生长的细胞比较时,对于用奎诺司他或用奎诺司他和WR1065处理的细胞,TNC的扩增倍数略微降低。然而,与在基础培养基中生长的细胞比较,对于用奎诺司他或用奎诺司他和WR1065处理的细胞,HSC的扩增倍数略微增加。还应注意,用奎诺司他和WR1065处理的细胞相较于仅用奎诺司他处理的细胞示出了HSC的增加的扩增倍数。
实例8使用斯克瑞泰和WR1065进行来自单独供体的细胞的扩增
对来自三个单独供体的UCB细胞以及细胞的汇集样品进行如上文所定义的扩增方案。将细胞在补充有细胞因子的培养基(基础)、含有斯克瑞泰的培养基和含有斯克瑞泰加WR1065的培养基中扩增。图13示出了,在与在基础培养基上培养的细胞相比时,用斯克瑞泰处理的细胞的HSC扩增倍数平均高30倍(范围10-55)。无论单独的斯克瑞泰上的扩增倍数如何,用斯克瑞泰和WR1065的组合处理的细胞都示出了HSC扩增倍数的两倍增加。尽管存在供体变化,但是组合处理增强了所有所测试供体上的HSC扩增。
实例9使用各种组织培养板进行细胞扩增
无论用于使细胞生长的表面的类型如何,斯克瑞泰和WR1065的组合处理都增强了HSC细胞的扩增。已知在细胞培养中使用支架可以更好地模拟体内条件并且因此为细胞生长提供更好的生态位。所有先前的实例均是使用包括由用表面胺化处理的PES电纺丝纤维制成的薄支架材料的Nanex板进行的。进行实验示出,当使用经标准组织培养物处理的板以及Nanex板培养细胞时,用斯克瑞泰和WR1065处理增强HSC扩增。如上所描述的进行细胞扩增方案,并以相同的密度将细胞接种到3种类型的表面上:Nanex支架、经TC处理的康宁24孔板或悬浮液葛莱纳24孔板。对于在Nanex板中生长的细胞,在补充有细胞因子的培养基(基础)中培养的细胞的HSC扩增倍数显著较高。然而,与在基础培养基中生长的细胞比较,用斯克瑞泰或组合处理来处理的细胞的HSC的扩增倍数显著增加。在所有使用的表面上,这种效应是类似的,并且较小差异不具有统计学意义。
实例10免疫受损的NSG小鼠中的扩增的细胞的重新填充能力
对不同的离体扩增方案对细胞体内重新填充骨髓的能力的效应进行研究。从脐带血获得细胞并产生四个细胞制剂-1。未扩增的细胞,2。在存在媒剂的情况下扩增的细胞,3。在存在斯克瑞泰的情况下扩增的细胞(已扩增+SS-图15),4。在存在斯克瑞泰和WR1065的情况下扩增的细胞(已扩增+SW-图15)。然后,将这些细胞制剂注射到经辐照的成年(<8周)雄性NSG(NOD.Cg-Prkdc
对在第15周取得的血液样品进行流式细胞术分析(仅CD45
细胞施用后第20周,将主要动物处死。从股骨和胫骨中收货骨髓样品,并在计数之前对细胞进行洗涤。将50%的回收细胞注射到次要的经辐照的动物中。以这种方式,可以测定扩增的细胞的长期移植能力。
在第8周时对次要动物进行放血,并针对移植的证据通过FACs对全血样品进行分析。来自8周全血样品的流式细胞术的数据如图15中所示出。图15示出了小鼠全血样品中的人CD45+细胞的频率,以活单线态百分比为单位。接受在斯克瑞泰和WR1065中扩增的细胞的小鼠的全血中的人CD45+的平均频率(2.5%)高于接受在单独的斯克瑞泰中扩增的细胞的小鼠的平均频率(0.04%)。WR1065和斯克瑞泰的组合示出其CD45+的平均频率高于未扩增的细胞和用媒剂扩增的细胞。
实例11从外周血获得的扩增的细胞的移植能力
从健康供体的动员外周血分离出CD34+细胞。将这些细胞解冻并在补充有1%PennStrep、100ng/mL hFlt-3、100ng/mL SCF、20ng/mL TPO(来自派普泰克公司(Peprotech))的SCGM培养基(来自CellGenix公司)中以1×10
培养后,使用FACS对HSC CD34+、CD38-、CD90+、CD45RA-进行分选,并将其注射到经亚致死辐照的免疫受损的NSG小鼠中。每只小鼠施用80,000个细胞。对照样品(第0天-图16)包含新鲜解冻和分选的HSC CD34+、CD38-、CD90+、CD45RA-,这些细胞没有经历任何离体扩增。通过存在于在8和12周时来自动物的全血样品中的CD45+细胞百分比来对人细胞移植进行评价。
图16示出了存在于全血样品中的CD45+细胞百分比。在存在斯克瑞泰和WR1065两者的情况下扩增的细胞所实现的移植水平(由CD45+细胞百分比指示)高于未扩增的对照、在培养基中扩增的细胞以及在存在单独的斯克瑞泰的情况下扩增的细胞的移植水平。
- 源自多能干细胞的褐色脂肪细胞、源自多能干细胞的细胞凝聚物,其制造方法以及细胞疗法、内科疗法
- 基于IL-2的疗法和基于间充质干细胞的疗法的伴随方法和试剂盒
