靶向肝癌细胞的基因药物及其制备方法及应用
文献发布时间:2023-06-19 18:35:48
技术领域
本发明实施例基因治疗技术领域,具体涉及一种靶向肝癌细胞的基因药物及其制备方法及应用。
背景技术
癌症已逐渐成为世界范围内一种重大的疾病,全球范围内每年大约有70万人因肝癌去世,其中约55%发生在中国,仅次于肺癌。但通过手术、放化疗后容易再复发或不能取得理想的疗效以及传统抗癌药物普遍存在药效短、需要多次给药等问题使得肿瘤治疗遇到很多难题,而基因治疗的出现打破了这种局限性,为肝癌诊疗开拓了一种新的方法并有望提升肝癌患者的生存率。
然而,缺乏肿瘤靶向性和目的基因在体表达比较低是传统肿瘤基因治疗临床转化所面临的主要问题,所以寻找安全、可靠的高肿瘤靶向性载体是目前肿瘤基因治疗研究的重中之重。
发明内容
为了解决现有技术中存在的问题,本发明的目的是提供一种靶向肝癌细胞的基因药物及其制备方法及应用。
为了实现上述目的,本发明实施例提供如下技术方案:
根据本发明实施例的第一方面,提供了一种靶向肝癌细胞的基因药物,在载体上构建报告基因HSV1-TK和治疗基因Kallistatin。
进一步地,所述载体为自身互补重组腺相关病毒scrAAV3载体。
根据本发明实施例的第二方面,提供了如上所述的靶向肝癌细胞的基因药物的制备方法,包括如下步骤:
(1)以含CAG启动子的pdsAAV为载体质粒,将报告基因HSV1-TK和治疗基因Kallistatin插入多克隆位点,构建重组质粒pdsAAV-HSV1-TK-Kallistatin;
(2)以pdsAAV-HSV1-TK-Kallistatin作为重组穿梭质粒,与自身互补重组腺相关病毒骨架质粒共转染293T细胞,包装生成自身互补重组腺相关病毒重组体。
进一步地,所述自身互补重组腺相关病毒重组体为scrAAV3-HSV1-TK-Kallistatin。
根据本发明实施例的第三方面,提供了一种包含如上所述的基因药物的生物制剂。
根据本发明实施例的第四方面,提供了如上所述的基因药物、或如上所述的生物制剂在制备治疗抗肝癌药物中的应用。
本发明实施例具有如下优点:
本发明首次利用肝癌靶向载体scrAAV3连接报告基因和治疗基因用于非侵入性监测肝癌基因治疗。本发明的ATK基因药物能够有效转染HepG2细胞,并对其增殖产生抑制作用。肝癌HepG2细胞裸鼠移植瘤PET/CT成像表明scrAAV3载体具有明显的肝癌靶向性,ATK基因药物可用作靶向和非侵入性监测肝癌基因治疗。本发明的基因药物将为人们研究肝癌诊断治疗途径及致病机理和建立有效的靶向治疗监测体系提供新的方向,为临床诊疗一体化提供有力工具。
附图说明
为了更清楚地说明本发明的实施方式或现有技术中的技术方案,下面将对实施方式或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是示例性的,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图引伸获得其它的实施附图。
图1为scrAAV3-EGFP转染293T细胞后荧光照片及明场照片,A.荧光照片,B.明场照片;
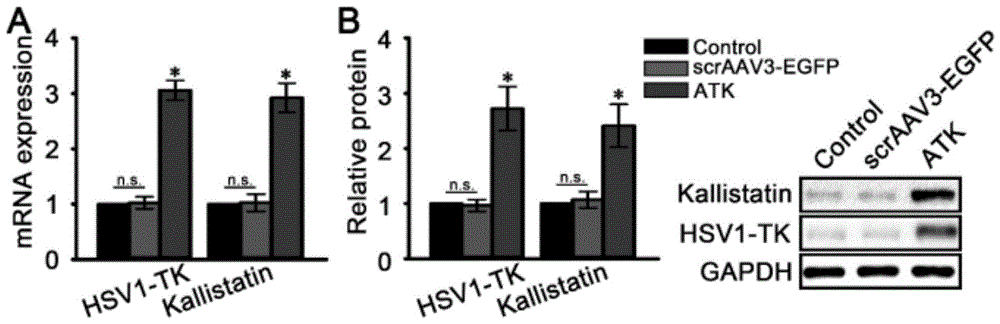
图2为ATK转染HepG2细胞后报告基因与治疗基因的表达水平,其中,A.RT-qPCR检测各组间HSV-1-TK和Kallistatin的mRNA表达情况,B.Western Blot检测各组间HSV-1-TK和Kallistatin的蛋白表达情况(*P<0.05;n.s.P>0.05);
图3为MTS检测细胞的增殖能力(*P<0.05);
图4为裸鼠肝癌皮下移植瘤PEC/CT显像;
图5为
图6为HepG2皮下移植瘤HE染色,其中,A.ATK组,B.对照组;
图7为HepG2皮下移植瘤免疫荧光染色;
图8为ATK组与对照组中HSV1-TK和Kallistatin的表达情况,其中,A.RT-qPCR检测ATK组与对照组中HSV1-TK和Kallistatin的mRNA表达情况,B.Western Blot检测ATK组与对照组中HSV1-TK和Kallistatin的蛋白表达情况。(*P<0.05)。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1重组体scrAAV3-HSV1-TK-Kallistatin(ATK)的制备和鉴定
重组体ATK的制备方法:含CAG启动子的pdsAAV为载体质粒,将报告基因HSV1-TK和治疗基因Kallistatin插入多克隆位点,构建重组质粒pdsAAV-HSV1-TK-Kallistatin,以pdsAAV-HSV1-TK-Kallistatin作为重组穿梭质粒,与自身互补重组腺相关病毒骨架质粒共转染293T细胞,包装生成自身互补重组腺相关病毒重组体scrAAV3-HSV1-TK-Kallistatin(ATK),以scrAAV3-EGFP为无效对照病毒。
重组体ATK的鉴定:将对照病毒scrAAV3-EGFP转染至293T细胞,显微镜下观察荧光表达及细胞形态。
最终得到ATK病毒重组体的病毒滴度为5.2×10
实施例2三组HepG2细胞报告基因与治疗基因的mRNA和蛋白表达水平
对三组HepG2细胞分别进行实时荧光定量PCR(RT-qPCR)和蛋白质印迹(WesternBlot)分析,检测ATK组、scrAAV3-EGFP组和对照组中HSV1-TK和Kallistatin两个指标的蛋白及mRNA表达情况。结果如图2所示,ATK组HSV1-TK和Kallistatin的蛋白及mRNA表达明显高于scrAAV3-EGFP组和对照组(P<0.05),而scrAAV3-EGFP组和对照组相比无明显差异(P>0.05)。
实施例3ATK对HepG2细胞增殖能力的影响
细胞增殖能力检测:(1)将处于对数生长期的HepG2细胞消化离心并计数,使用完全培养基重悬细胞并调整浓度。向96孔板中每孔加入100μL细胞悬液,使每孔包含4×10
(2)将scrAAV3-EGFP和ATK病毒转染(MOI=1×10
(3)转染6h后弃去孔板内的培养基,每孔加入100μL完全培养基继续培养。
(4)转染10h时向每孔滴加20μL CellTiter
(5)重复步骤(4),分别记录各组细胞在孵育24h、36h和72h时各孔的吸光度值。
结果见图3,结果显示,ATK组OD值在24h、48h、72h不同时间点要明显低于scrAAV3-EGFP组和对照组(P<0.05),而scrAAV3-EGFP组和对照组相比无明显差异(P>0.05)。
实施例4
实施例5皮下移植瘤裸鼠
通过PET成像对肠,脑,肾,内脏,肺,心脏,肝脏,脾脏,肌肉和肿瘤中
裸鼠
实施例6裸鼠移植瘤组织HE染色检测
成像后处死小鼠,取出移植瘤进行HE染色:
(1)脱蜡:将肿瘤组织切片放入60℃恒温箱中烤片20min。再依次放入二甲苯I、II中分别脱蜡10min。
(2)水化:将脱蜡后的组织切片依次放入无水乙醇、95%、90%、80%、70%乙醇溶液中各5min。再放入ddH
(3)染色:将水化后的肿瘤切片放入苏木素中染色约5min。后用自来水冲洗10min返蓝。
(4)分化:将返蓝后的肿瘤切片放入1%盐酸乙醇液中分化5s,当见到肿瘤切片变红,颜色变浅即可终止分化。
(5)复染:将分化后的肿瘤切片放入伊红溶液中染色3min。
(6)脱水:将复染后的肿瘤切片依次放入70%、80%、90%各浓度乙醇溶液中分别脱水3min,再依次放入95%乙醇溶液I、II和无水乙醇I、II中各脱水1min。
(7)透明:将脱水后的肿瘤切片依次放入二甲苯I、II中各5min。
(8)封片:选用合适的盖玻片,用中性树胶进行封片。
在显微镜下可看到大小不一,排列紧密,形态不规则的肝癌细胞,且细胞异型性明显,核质比例大。结果表明成功地建立了裸鼠HepG2肝癌模型,且ATK组与对照组无明显区别(图6)。
实施例7免疫荧光检测移植瘤中报告基因与治疗基因表达
对取出的皮下移植瘤进行免疫荧光染色:
(1)漂洗:将制备好的冰冻组织切片放入PBS缓冲液中轻柔洗涤3次,每次5min。
(2)封闭:用免疫组化笔在切片组织边缘画圈。切片上滴加适量1×驴血清室温条件下封闭10min。
(3)一抗孵育:向封闭后的冰冻切片上滴加抗单纯疱疹病毒TK的小鼠单克隆抗体(1:100)和抗Kalistatin/PI-4的兔多克隆抗体(1:100)于4℃冰箱过夜孵育。
(4)二抗孵育:将过夜孵育的冰冻切片拿出在室温复温20min,再放入PBS缓冲液中轻柔洗涤3次,每次5min。后分别滴加适量驴抗兔Alexa Fluor-568和驴抗小鼠AlexaFluor-488抗体(1:400)于37℃孵育40min。
(5)复染:将二抗孵育的冰冻切片放入PBS缓冲液中轻柔洗涤3次,每次5min。向每张切片滴加适量DAPI溶液进行细胞核染色。
(6)封片:向复染后的切片上滴加适量甘油,加盖合适的盖玻片,用指甲油涂刷盖玻片周围,固定盖玻片。于室温下晾干20min,后放入4℃冰箱保存。
(7)观察:将切片取出,放入荧光共聚焦显微镜下观察并采集图像。
免疫荧光染色结果如图7所示,显示了HSV1-TK和Kallistatin蛋白表达的免疫荧光图像。在注射了ATK基因药物的ATK组移植瘤冰冻切片荧光染色显示HSV1-TK和Kallistatin有明显的免疫荧光,而对照组表达较低。
实施例8裸鼠移植瘤中报告基因与治疗基因的mRNA和蛋白表达水平
对取出的皮下移植瘤分别进行RT-qPCR和Western Blot,检测ATK组和对照组中HSV1-TK和Kallistatin两个指标的蛋白及mRNA表达情况。结果如图8所示,ATK组HSV1-TK和Kallistatin的蛋白及mRNA表达明显高于对照组(P<0.05)。
以上结果表明,ATK基因药物可以准确靶向肝癌皮下移植瘤并成功转化为有活力的HSV1-TK酶。此外,免疫荧光结果证明HSV1-TK和Kallistatin均成功表达,RT-qPCR和蛋白质印迹数据显示HSV1-TK和Kallistatin均有过表达趋势。在本研究中,我们证明了scrAAV3载体介导的ATK基因药物在皮下移植瘤动物模型中可以明显靶向肝癌。此外,报告基因和治疗基因的成功表达也预示着连续非侵入性监测肝癌基因治疗的可能。
虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- H基因或其表达产物在制备抑制肝癌细胞或肝癌干细胞耐药能力的药物中的应用
- 人肝癌细胞Egfl8基因过表达慢病毒在制备治疗肝癌药物中的应用
