一种FAP靶向的探针及其制备方法和应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及医药技术领域,尤其涉及一种FAP靶向的探针及其制备方法和应用。
背景技术
基于成纤维细胞活化蛋白(fibroblast activation protein,FAP)靶点的小分子核素显像和治疗是近年来核医学剂放射性药物领域的热点,已成为继生长抑素受体(somatostatin receptor, SSTR)和前列腺特异性膜抗原(prostate specific membraneantigen,PSMA)后又一重大突破。它在未来可能应用于诊断及治疗多种肿瘤类型,代表了肿瘤学药物研发的下一个前沿领域。大量研究表明,FAP在肿瘤中的高表达与患者预后较差相关,并与肿瘤细胞的转移扩散联系紧密。因此,将其作为疾病核素成像及治疗的关键靶点是一种非常有前途策略。
68
发明内容
本发明的目的在于解决现有技术中的上述问题,提供一种FAP靶向的探针及其制备方法和应用,具有制备简单、稳定性好、肿瘤摄取高滞留久等优点,适于临床推广。
为达到上述目的,本发明采用如下技术方案:
一种FAP靶向的探针,该探针基于喹啉酸衍生的FAPI化合物,其结构如下式(I)和(II) 所示:
其中:R
核素包括
所述核素通过FAPI化合物中的核素标记基团R
所述核素标记基团R
所述核素标记基团R
所述核素标记基团R
所述R
其中,R
本发明中,当式(I)中n为0~3,R
/>
本发明中,当式(II)中,当n为0~3,R
/>
本发明中,当(II)中,当n为0~3,R
/>
本发明所述的一种FAP靶向的探针,其制备方法采用湿法或冻干法进行制备。
所述湿法步骤如下:将所述FAPI化合物溶于缓冲溶液或去离子水中,然后加入含放射性核素的溶液,室温至100℃反应10~30min,然后用生理盐水或注射用水稀释,进无菌滤膜过滤即生成放射性核素标记的配合物注射液。
所述冻干法步骤如下:将所述FAPI化合物溶于缓冲溶液或去离子水中,分装于冻干容器中,经冷冻干燥后密封成冻干药盒,可根据需要在冻干药盒加入相关赋形剂、抗氧化剂或酸碱调节剂;在冻干药盒中加入去离子水或缓冲液溶解,再加入含放射性核素的溶液,室温至 100℃反应10~30min,用生理盐水或注射用水稀释,进无菌滤膜过滤即生成放射性核素标记的配合物注射液。
本发明FAP靶向的探针应用于制备检测与成纤维细胞活化蛋白相关的疾病或病症的产品中的应用;所述FAP靶向的探针被制备成注射剂,通过静脉注射给药;所述的病症包括肿瘤或炎症;所述肿瘤包括乳腺癌、卵巢癌、肺癌、结直肠癌、前列腺癌、肺癌、纤维肉瘤、骨骼及结缔组织肉瘤、肾细胞癌、胃癌、胰腺癌或皮肤黑色素瘤;所述炎症包括骨关节炎、类风湿关节炎、肉芽组织、肝纤维化、肺纤维化或肝硬化;显像方式包括单光子发射计算机断层成像术(SPECT)和正电子发射断层成像术(PET)。
本发明提供一种基于喹啉酸衍生的成纤维细胞活化蛋白抑制剂(fibroblastactivation protein inhibitor,FAPI)化合物及其放射性核素标记的配合物,通过引入蛋白亲和配体并调节连接基团结构,最终延长FAPI探针的血液循环半衰期,提高靶部位摄取值。结果表明该系列标记化合物与现有的用于诊断或治疗的FAP靶向探针相比,具有增强的肿瘤摄取和保留时间,靶/非靶比值高,可以达到更好的诊断及治疗效果。
相对于现有技术,本发明技术方案取得的有益效果是:
1、药代动力学性质性质的优化:目前已报道的FAP靶向放射性探针的肿瘤摄取剂量和保留时间十分有限。本发明适当延长探针的循环半衰期,使其具有适宜的代谢动力学、较高的肿瘤摄取剂量和较长的肿瘤保留时间,满足核素治疗和显像需求。
2、制备方法优势:在配体制备过程中,核素螯合基团及疏水性蛋白亲和基团的引入分别基于胺基的酰胺化反应及基于巯基的迈克尔加成反应,该系列反应快速且条件温和。更为重要的是两个反应不会相互影响,避免基团保护及脱保护带来的步骤繁琐等造成的产物损失。此外,核素引入采用冻干药盒配方,简化标记程序,提高标记产率和降低成本。
3、多样的核素及药代动力学性质选择性:本发明开发的小分子前体化合物可适用于多种诊断及治疗核素的标记,可构建基于诊疗核素对的显像治疗平台。更为重要的是,通过亲水性肽段的增减,可对探针的脂水分布性质进行调控,从而影响探针在生物体内的分布特性。本发明可提供不同药代动力学性质的分子探针选项,具有更强的针对性和选择性。
4、相比于现有技术,本发明具有适宜的代谢动力学性质及较高的病灶摄取和滞留时间,靶/非靶比值高,可以达到更好的诊断及治疗效果,是目前其它FAPI探针所不具备的,更加有利于该类探针的商业化应用与临床推广。
附图说明
图1为本发明中化合物FGD
图2为本发明中化合物FGD
图3为本发明中化合物FGD
图4为本发明中化合物FGD
图5为本发明中化合物FGD
图6为本发明中化合物FSDD
图7为本发明中化合物FSDD
图8为本发明中化合物FSDD
图9为本发明中化合物FSDD
图10为本发明中化合物FSDD
图11为本发明中化合物FSDD
图12为本发明中化合物FSDD
图13为本发明中化合物
图14为本发明中化合物
图15为本发明中化合物
图16为本发明中化合物
图17为本发明中
图18为本发明中
图19为本发明中
图20为本发明中
图21为本发明中
具体实施方式
为了使本发明所要解决的技术问题、技术方案及有益效果更加清楚、明白,以下结合附图和实施例,对本发明做进一步详细说明。除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
本发明中FAPI化合物的结构式如下(I)及(II)所示:
其中:R
核素包括
所述核素通过FAPI化合物结构中的核素标记基团R
对于金属离子,所述放射性标记探针可以通过含放射性核素的化合物与式(I)、(II)化合物按照现有的多种标记方法制备得到;本发明优选的标记方法为湿法或冻干法。
所述湿法步骤如下:将所述FAPI化合物溶于缓冲溶液或去离子水中,然后加入含放射性核素的溶液,室温至100℃反应10~30min,然后用生理盐水或注射用水稀释,进无菌滤膜过滤即生成放射性核素标记的配合物注射液。
所述冻干法步骤如下:将所述FAPI化合物溶于缓冲溶液或去离子水中,分装于冻干容器中,经冷冻干燥后密封成冻干药盒,可根据需要在冻干药盒加入相关赋形剂、抗氧化剂或酸碱调节剂;在冻干药盒中加入去离子水或缓冲液溶解,再加入含放射性核素的溶液,室温至 100℃反应10~30min,用生理盐水或注射用水稀释,进无菌滤膜过滤即生成放射性核素标记的配合物注射液。
具体的,冻干法中分装用容器优选为冻存管或管制抗生素瓶,还可根据药盒冻干粉成型情况选择在药盒中增加赋形剂或抗氧化剂,比如甘露醇、抗坏血酸等,并通过调节FAPI化合物及赋形剂的用量,使药盒成型达到最佳。所述缓冲溶液为稳定反应液pH值的物质,可以为醋酸盐、乳酸盐、酒石酸盐、苹果酸盐、马来酸盐、琥珀酸盐、抗坏血酸盐、碳酸盐和磷酸盐,以及它们的混合物等。
如标记率及放射化学纯度较低,本发明提供一种优选纯化方式为:取一Sep-PakC18分离小柱,先后通过10mL无水乙醇及10mL水进行活化淋洗。加水稀释反应液后经Sep-Pak C18 色谱柱分离纯化,以缓冲液或水冲洗色谱柱以除去未反应的放射性离子,以乙醇溶液淋洗得到放射性核素标记的配合物,通过氮吹除去有机溶剂,再经生理盐水或注射用水稀释后无菌过滤,即得到放射化学纯度较高的放射性标记配合物的注射液。
实施例1:
下表直观地展示了制备例中以式(I)结构为基础的前体化合物信息:
其中,中间体2的合成路线如下所示:
FGD
以式(I)结构为基础的前体化合物FGD
其中化合物1可根据文献Journal of Nuclear Medicine(2020,61:1806-1813;2018;59:1415-1422) 所报道的制备方法制得。化合物1与丁二酸酐溶解于N,N-二甲基甲酰胺中,加入适量DIPEA 反应1小时,浓缩除去溶剂并通过柱纯化得化合物2。将化合物2与3溶于N,N-二甲基甲酰胺中,加入适量HATU及DIPEA反应2小时,浓缩除去溶剂。随后加入三氟乙酸(TFA)并于室温下反应30分钟,脱去保护基。反应结束后通过半制备高效液相色谱法分离,收集目标产物峰并冻干保存,得到4。将DOTA-NHS或HYNIC-NHS和化合物4溶解于N,N-二甲基甲酰胺中,随后滴加二异丙基乙基胺,室温搅拌3小时后,通用过半制备高效液相色谱法分离,收集目标产物峰并冻干保存,即可得产物FGD
其余(I)系列的化合物前体的制备方法均可参考以上合成过程,其区别在于将连接肽及核素标记基团进行相应替换,即可得到相应的前体化合物结构。FGD
实施例2:
下表直观地展示制备例中以式(II)结构为基础的前体化合物信息:
FSDD
以式(II)结构为基础的前体化合FSDD
将带保护基多肽化合物5与2溶于N,N-二甲基甲酰胺中,加入适量HATU及DIPEA反应2小时,浓缩除去溶剂。随后加入三氟乙酸(TFA)并于室温下反应30分钟,脱去保护基。反应结束后通过半制备高效液相色谱法分离,收集目标产物峰并冻干保存,得到化合物6。将DOTA-MAL和化合物4溶解于N,N-二甲基甲酰胺中,室温搅拌2小时后,通用过半制备高效液相色谱法分离,收集目标产物峰并冻干保存,可得产物化合物FSDD
其余(II)系列的化合物前体的制备方法均可参考以上合成过程,其区别在于将连接肽、蛋白亲和基团及核素标记基团进行相应替换,即可得到相应的前体化合物结构。FSDD
实施例3:
99m
湿法:将新鲜配制的SnCl
冻干法:将约37~3700兆贝可(MBq)新鲜的Na
如放射化学纯度低于95%,则需进行纯化,纯化步骤为:取一Sep-Pak C18分离小柱,先后通过10mL无水乙醇及10mL水进行活化淋洗。用10mL水将标记液稀释后,上样到分离柱上。用水冲洗分离柱除去未反应的
实施例4:
177
湿法:将约37~3700MBq
冻干法:将一定量的缓冲液及约37~3700MBq的
如放射化学纯度低于95%,则需进行纯化,纯化步骤为:取一Sep-Pak C18分离小柱,先后通过10mL无水乙醇及10mL水进行活化淋洗。用10mL水将标记液稀释后,上样到分离柱上。用水冲洗分离柱除去未反应的
如图14所示,对所标记化合物
实施例5:
68
湿法:将约37~3700MBq
冻干法:将一定量的缓冲液及约37~3700MBq的
如放射化学纯度低于95%,则需进行纯化,纯化步骤为:取一Sep-Pak C18分离小柱,先后通过10mL无水乙醇及10mL水进行活化淋洗。用10mL水将标记液稀释后,上样到分离柱上。用水冲洗分离柱除去未反应的
如图15所示,对所标记化合物
实施例6:
1、体外稳定性测试
将用生理盐水溶解的标记化合物在室温下放置不同时间,取样用HPLC进行分析。在所测试时间点,各探针依旧保持放射化学纯>95%,表明其在指定溶液中性质稳定,不易分解。
将标记化合物与血清在室温下共孵育不同时间,加入乙腈除蛋白,离心取上清溶液,取样用HPLC进行分析。在所测试时间点,各探针依旧保持放射化学纯>95%,表明其在指定溶液中性质稳定不易分解。
2.脂水分布系数(log P)测定
将100μL稀释后的放射性核素标记化合物加入到含有2.9mL PBS和3mL正辛醇混合液的离心管中,涡旋震荡3分钟之后,6000rpm离心5分钟,从水相及正辛醇相中各取100μL液体并通过γ-counter放射性计数。实验重复三次取平均值。log P的计算公式为:
P=I
其中I
表1
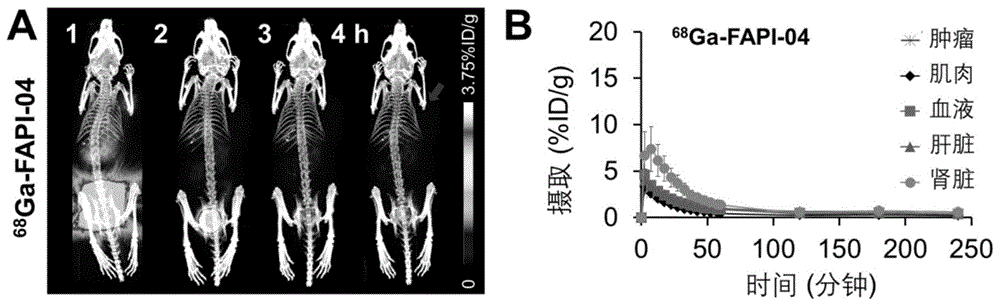
3.正常及肿瘤模型鼠MicroPET显像
按实施例4制备好放射化学纯度大于97%的
在人源HCC-PDX模型中验证
4.肿瘤模型鼠nanoSPECT显像
SPECT显像选用
5.肿瘤模型鼠生物分布实验
源HCC-PDX模型通过尾静脉注射约1.1MBq
综上,本发明提供的FAP靶向的放射性标记配合物能够显著延长其循环半衰期、增强肿瘤摄取及滞留时间,这种新颖性能是目前其它FAPI显像剂所不具备的,有望用于FAP高表达肿瘤的核素治疗和显像。
- 一种罗丹明类酰腙衍生物及其制备方法和应用以及一种荧光探针
- 一种双模成像光热发光探针及其制备方法及其应用
- 一种用于检测KIAA1549-BRAF融合基因的荧光原位杂交探针及其制备方法和应用
- 一种红色荧光铜纳米团簇探针的制备方法及其应用
- 一种检测外泌体中miRNA-1246的纳米金核酸探针及其制备方法和应用
- 一种糖基化靶向FAP化合物、靶向FAP标记配合物及其制备方法与应用
- 一种FAP抑制剂和靶向FAP的核素探针及应用
